Abstract
Le contexte récent du COVID-19 a renouvelé l’intérêt des pathologistes pour les maladies d’origine infectieuse. Cet intérêt est d’autant plus fort dans le tube digestif où les symptômes sont aspécifiques, souvent frustres avec un aspect endoscopique normal entraînant parfois une errance diagnostique. Dans ce contexte, les biopsies systématiques réalisées par le clinicien sont parfois le seul moyen de parvenir au diagnostic. Néanmoins, le diagnostic précis de ses pathologies nécessite une bonne connaissance à la fois du contexte de survenue de ces pathologies, de l’aspect histopathologique et d’une analyse rigoureuse utilisant des colorations spéciales et/ou des analyses immunohistochimiques. Certaines pathologies infectieuses du tube digestif sont bien connues par les pathologistes qui sont largement sollicités dans leurs diagnostics (gastrite à Helicobacter pylori, œsophagite à Candida albicans ou la colite à CMV), mais d’autres sont plus délicates à diagnostiquer. Dans cet article, nous présenterons, après avoir rappelé les différentes colorations spéciales utiles, des pathologies bactériennes ou parasitaires rares ou de diagnostic difficile « à ne pas manquer » dans le tube digestif.
Abstract
The recent context of COVID-19 has renewed the interest of pathologists in diseases of infectious origin. This interest is even stronger in the gastrointestinal tract where symptoms are aspecific, often frustrating with a normal endoscopic appearance sometimes leading to diagnostic erraticity. In this context, systematic biopsies performed by the clinician are sometimes the only way to reach a diagnosis. Nevertheless, the precise diagnosis of these pathologies requires a good knowledge of the context in which they occur, the histopathological aspect and a rigorous analysis using special stains and/or immunohistochemical analyses. Some infectious diseases of the gastrointestinal tract are well known to pathologists who are widely called upon to diagnose them (Helicobacter pylori gastritis, Candida albicans oesophagitis or CMV colitis), but others are more difficult to diagnose. In this article, we will present, after having recalled the various useful special stains, rare or difficult to diagnose bacterial or parasitic pathologies “not to be missed” in the digestive tract.
Introduction
Le diagnostic histologique des pathologies d’origine infectieuse fait partie de la pratique quotidienne des pathologistes. L’intérêt pour ce sujet a augmenté ces dernières années en raison, d’une part, de l’augmentation de l’incidence des infections opportunistes [1], notamment chez les patients transplantés ou immunodéprimés et, d’autre part, de l’émergence et/ou de la réémergence de maladies infectieuses, comme l’illustre la pandémie de COVID-19.
Cependant, les pathologistes sous-estiment souvent leur rôle diagnostique pour ces pathologies, notamment dans le tube digestif, alors que de nombreux diagnostics peuvent être établis en microscopie optique. Une analyse rigoureuse de ces prélèvements est nécessaire, car, d’une part, l’aspect endoscopique peut être non spécifique et, d’autre part, des prélèvements à l’état frais ne sont pas toujours envoyés en microbiologie et le pathologiste est donc parfois le seul à pouvoir évoquer ou affirmer le diagnostic. Par ailleurs, l’un des avantages de l’analyse tissulaire in situ par rapport à l’analyse en microbiologie est de pouvoir différencier l’infection tissulaire de la simple colonisation.
Dans cet article, les principales colorations spéciales utilisées en pathologie infectieuse seront présentées, puis une sélection d’agents pathogènes (AP) observables en histologie, « à ne pas manquer » sera discutée. Nous ne serons pas exhaustifs ; nous avons pris le parti d’illustrer des AP bactériens et parasitaires de type protozoaire, et de ne pas présenter d’infections virales souvent liées au CMV ou à l’herpès, bien connues avec des immunomarquages sensibles, ni d’infections mycotiques, lesquelles, plus rares dans le tube digestif en dehors de la candidose œsophagienne, sont bien mises en évidence par certaines colorations (nous les évoquerons cependant dans le diagnostic différentiel). Les infections bactériennes et parasitaires à protozoaires interviennent dans des contextes un peu différents, plus volontiers chez les patients immunodéprimés pour les parasites, rendant l’analyse attentive des prélèvements réalisés chez ces patients particulièrement importante : dans ce contexte, des AP à ne pas manquer !
Les différents AP bactériens et parasitaires seront présentés avec un bref rappel des principales manifestations cliniques, endoscopiques ou radiologiques permettant d’évoquer le diagnostic, puis les aspects histopathologiques caractéristiques seront illustrés.
Colorations spéciales utiles en pathologie infectieuse
La première approche dans l’évaluation des pathologies infectieuses est basée sur la coloration par hématoxyline-éosine-safran (HES) qui permet de définir le « pattern » inflammatoire et éliminer les diagnostics différentiels.
Cependant, l’identification des micro-organismes nécessite souvent des colorations spéciales :
-
•Gram :
-
∘elle permet la détection des bactéries, en les séparant en Gram positive et Gram négatives,
-
∘elle permet aussi d’identifier d’autres AP : Candida spp., Histoplasma capsulatum, Leishmania spp. et Microsporidium ;
-
∘
-
•PAS (Periodic acid-Schiff) :
-
∘cette coloration met en évidence la plupart des champignons, mais est moins sensible que le Grocott. Elle est également utilisée pour identifier les parasites comme Entamoeba histolytica, ou distinguer les mycoses intracellulaires de type Histoplasma capsulatum (PAS+) des Leishmania (PAS−). Elle permet d’identifier les granules intracytoplasmiques diastase résistants des macrophages spumeux liés à l’infection par Tropheryma Whipplei, sans être spécifique,
-
∘cette coloration peut être utilisée après traitement par diastase, dans le but d’éliminer le glycogène qui permet de diminuer la coloration tissulaire de fond ;
-
∘
-
•Ziehl Neelsen :
-
∘la coloration de Ziehl Neelsen est traditionnellement utilisée pour identifier les mycobactéries. Elle peut également servir à distinguer des bactéries filamenteuses telles que l’actinomycose (Ziehl−), alors que la nocardiose est Ziehl+ ;
-
∘
-
•Giemsa :
-
∘cette coloration aide notamment à mettre en évidence Giardia lamblia, Microsporidium et Leishmania spp. La coloration de Giemsa modifiée a une bonne sensibilité dans la détection d’Helicobacter. pylori ;
-
∘
-
•bleu Alcian :
-
∘la coloration des mucines par le bleu Alcian met en évidence la capsule de Cryptococcus neoformans et Blastomyces dermatitidis, et colore les corps de Michaelis-Gutmann de la malakoplakie.
-
∘
-
•Grocott :
-
∘cette coloration est largement utilisée dans la détection des levures ou des champignons dont Pneumocytis jirovecii, ou de certaines bactéries (elle colore les mycobactéries par exemple) ;
-
∘
-
•colorations argentiques :
-
∘elles incluent les colorations de Warthin-Starry, Steiner et Dieterle,
-
∘ces colorations permettent de détecter des bactéries Gram négatives ou faiblement positives, comme Legionella spp., Bartonella spp., les spirochètes et certains parasites tels que Microsporidium spp.
-
∘
Infections bactériennes à ne pas manquer dans le tube digestif
Actinomycose (Actinomyces israelii)
Définition et aspects cliniques
L’actinomycose est liée à une bactérie filamenteuse anaérobie, le plus souvent Actinomyces israe li i (90 % des cas) [2], [3]. Cette infection, fréquente en pathologie ORL et pulmonaire, est retrouvée le plus souvent dans le tube digestif lors de l’exploration d’une masse suspecte d’allure infiltrante à l’imagerie [2].
Cliniquement, elle peut être asymptomatique, mais se manifeste souvent par des douleurs chroniques en lien avec une masse qui peut être retrouvée à la palpation selon sa taille et sa localisation. Il peut également s’y associer de la fièvre ou une perte de poids. Les diagnostics différentiels souvent évoqués devant ce tableau clinique sont une maladie de Crohn, une tuberculose cæcale ou une pathologie tumorale [2].
L’actinomycose digestive survient le plus souvent dans les suites d’une pathologie digestive avec perforation, notamment une appendicite ou une pathologie diverticulaire ou après une chirurgie abdominale (bariatrique notamment). On la retrouve donc le plus souvent dans la région iléocolique [2].
Au scanner, elle se manifeste le plus souvent sous la forme d’une masse isolée dans le mésocôlon aux contours spiculés pouvant infiltrer la paroi abdominale, pouvant mimer une pathologie tumorale maligne [2].
Histopathologie
Actinomycose.
-
•
Localisation : péri-colique (iléo-cæcale+++).
-
•
Clinique : masse mésentrique suspecte d’allure infiltrante au scanner avec douleurs abdominales.
-
•
Macroscopie : masse rétractile du mésentère.
-
•
Histologie : masse inflammatoire pseudo-tumorale hétérogène associant des zones cicatricielles et des zones abcédées au contact d’amas de bactéries filamenteuses.
-
•
Techniques complémentaires : Gram+, PAS+, Grocott+, Zielh−.
À l’examen macroscopique, on peut observer une lésion indurée développée aux dépens de la sous-séreuse et associant des remaniements fibreux et nécrotiques, qui peut adhérer au tissu musculaire pariétal ou à des segments intestinaux.
À l’examen histologique (Fig. 1 ), la lésion apparaît hétérogène associant des zones de remaniements fibro-cicatriciels, avec un infiltrat inflammatoire subaigu riche en lymphocytes et en plasmocytes, des secteurs de nécrose suppurée, au sein de laquelle on retrouve des amas arrondis de bactéries filamenteuses basophiles avec en périphérie une zone éosinophile appelée phénomène de Splendore-Hoeppli. On peut parfois retrouver une réaction granulomateuse épithélioïde au contact de cette nécrose suppurée.
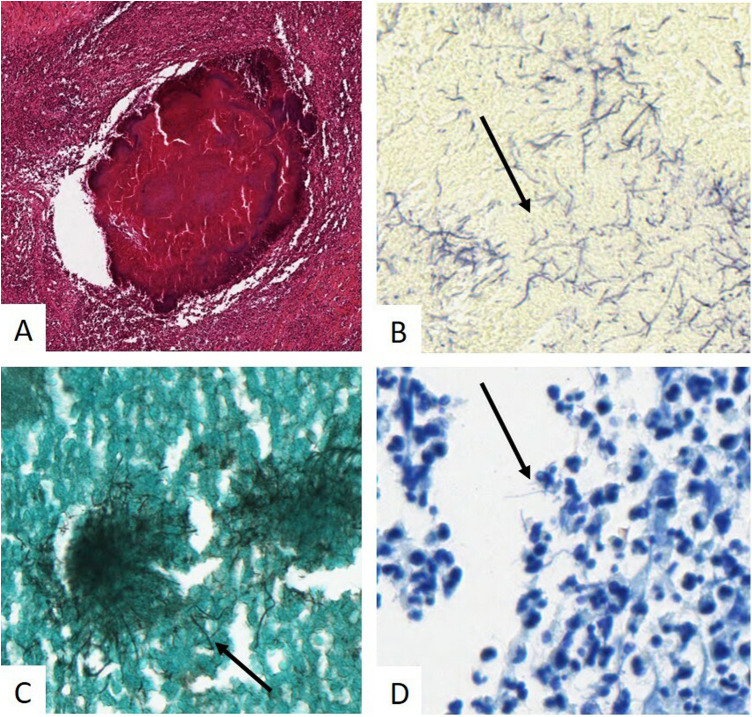
Figure 1.
Actinomycose colique, montrant un amas de bactéries filamenteuses au sein d’une intense réaction inflammatoire (HES × 100) (A), composé de bactéries filamenteuses (flèches) Gram+ (× 400) (B), Grocott+ (× 400) (C) Zielh− (× 400) (D).
Colonic actinomycosis, showing a cluster of filamentous bacteria within an intense inflammatory reaction (HES × 100) (A), composed of filamentous bacteria (arrow) Gram+ (× 400) (B), Grocott+ (× 400) (C) Zielh− (× 400) (D).
Sur les colorations spéciales, les bactéries filamenteuses sont Gram+, PAS+, Grocott+ et Ziehl− (Fig. 1) [2].
Nocardiose (Nocardia brasiliensis)
Définition et aspects cliniques
La nocardiose est liée à une bactérie filamenteuse. Il s’agit d’une maladie opportuniste survenant le plus souvent chez des patients immunodéprimés (environ 66 % des cas) [4]. Les atteintes digestives sont rares, la nocardiose se manifestant plus souvent par des abcès cérébraux ou une atteinte pulmonaire mimant une tuberculose ou une aspergillose [5].
Les rares cas de nocardiose digestives, rapportés dans la littérature, décrivaient des péritonites chez des patients avec hémodialyse péritonéale, des abcès profonds [5], [6] sous formes de masses pseudo-tumorales associés à une co-infection à Klebsiella pneumoniae ou des infections péri-anales avec infiltration pelvienne ou du tube digestif bas.
Histopathologie
Nocardiose.
-
•
Localisation : péritoine, péri-anale, tissus profonds.
-
•
Clinique : péritonite ou masse profonde.
-
•
Macroscopie : foyers indurés parfois suppurés.
-
•
Histologie : foyers de nécrose suppurée comportant des bactéries filamenteuses.
-
•
Technique complémentaires : Gram+, PAS+, Grocott+, Zielh+.
À l’examen macroscopique, on retrouve des foyers indurés parfois suppurés.
À l’examen histologique, on identifie des foyers suppurés avec nécrose dont les bactéries ne sont pas visibles sur l’HES. Sur les colorations spéciales, les bactéries filamenteuses sont Gram+, PAS+, Grocott+ et Ziehl+ (cette dernière coloration permettant de les distinguer de l’actinomycose) [7]. Il convient d’éliminer les autres AP Ziehl+, notamment les mycobactéries, mais leur aspect morphologique est différent. Dans ce contexte, la réalisation d’une PCR 16s afin de caractériser l’infection est importante.
Maladie de Whipple (Tropheryma whipplei)
Définition et aspects cliniques
La maladie de Whipple est causée par une bactérie T. Whipplei, de transmission oro-fécale, identifiée le plus souvent dans des stations d’épuration. Son atteinte la plus connue est digestive, touchant préférentiellement le duodénum, se manifestant le plus souvent par une diarrhée aqueuse, parfois accompagnée de méléna ou de stéatorrhée et pouvant se compliquer d’une perte de poids, voire d’œdèmes périphériques consécutifs à une hypoprotidémie [8].
Néanmoins, cette atteinte digestive apparaît après une période de latence pouvant durer plusieurs mois/années (moyenne 105 mois) après des symptômes prodromiques incluant des arthralgies. Cette atteinte digestive est associée à des adénopathies abdominales chez 45 % des patients. Après l’atteinte digestive, la maladie diffuse avec des atteintes cérébrales, cardiaques ou pulmonaires [8].
Histopathologie
Maladie de Whipple.
-
•
Localisation : prédominane duodénale.
-
•
Clinique : diarrhée aqueuse avec perte de poids, syndrome oedémateux ± ectasies vasculaires.
-
•
Endoscopie : plages jaunâtres ou blanchâtres ± ectasies vasculaires.
-
•
Microscopie : microphages spumeux du chorion, par ailleurs peu inflammatoire.
-
•
Techniques complémentaires : PAS− diastase+, Zielh− dans les microphages spumeux.
L’examen macroscopique visible en endoscopie peut retrouver des dépôts jaunâtres/blanchâtres au niveau de la muqueuse duodénale liée aux ectasies lymphatiques.
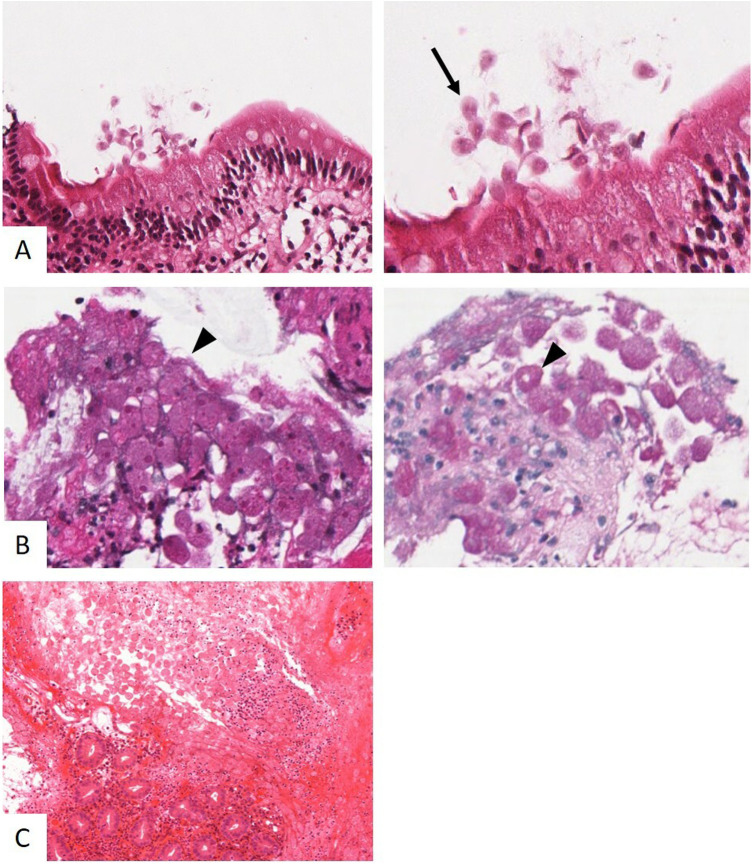
À l’examen microscopique (Fig. 2 ), on retrouve un chorion épaissi par un infiltrat inflammatoire fait de macrophages spumeux, parfois accompagnés de polynucléaires neutrophiles. Sur les colorations spéciales, ces macrophages renferment de grandes quantités de globules PAS-diastase+ (Fig. 2) [8]. Ces macrophages spumeux peuvent être observés en dehors de tout symptôme digestif et peuvent perdurer plusieurs années après le traitement. Leur persistance ne doit pas orienter d’emblée vers un échec du traitement antibiotique.
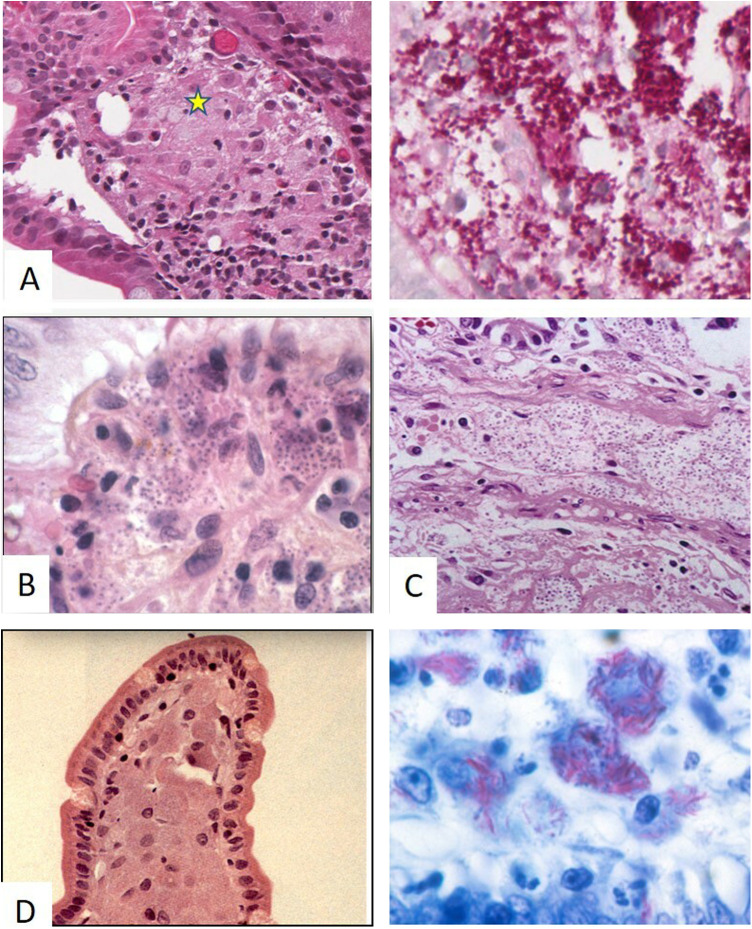
Figure 2.
Maladie de Whipple (A) montrant des macrophages spumeux ( ) dans le chorion (à gauche, HES × 200) comportant des granules PAS-diastase+ (à droite, × 400). Leishmaniose (B) montrant les AP intramacrophagiques (HES × 400). Histoplasmose (C) montrant les AP intramacrophagiques (HES × 200). Mycobacteriose atypique (D) montrant les macrophages spumeux dans le chorion (à gauche, HES × 200) avec la présence d’agents pathogènes Ziehl+ (à droite, × 800).
) dans le chorion (à gauche, HES × 200) comportant des granules PAS-diastase+ (à droite, × 400). Leishmaniose (B) montrant les AP intramacrophagiques (HES × 400). Histoplasmose (C) montrant les AP intramacrophagiques (HES × 200). Mycobacteriose atypique (D) montrant les macrophages spumeux dans le chorion (à gauche, HES × 200) avec la présence d’agents pathogènes Ziehl+ (à droite, × 800).
Whipple's disease (A) showing foamy macrophages ( ) in the chorion (left, HES × 200) with PAS-diastase+ granules (right, × 400). Leishmaniasis (B) showing intra-macrophagic pathogens (HES × 400). Histoplasmosis (C) showing intra-macrophagic pathogens (HES × 200). Atypical mycobacteriosis (D) showing foamy macrophages in the chorion (left, HES × 200) with Ziehl+ pathogens (right, × 800).
) in the chorion (left, HES × 200) with PAS-diastase+ granules (right, × 400). Leishmaniasis (B) showing intra-macrophagic pathogens (HES × 400). Histoplasmosis (C) showing intra-macrophagic pathogens (HES × 200). Atypical mycobacteriosis (D) showing foamy macrophages in the chorion (left, HES × 200) with Ziehl+ pathogens (right, × 800).
Le diagnostic doit être confirmé par un test PCR réalisé à partir du tissu inclus en paraffine [9].
Diagnostics différentiels
La présence de macrophages spumeux comportant des éléments PAS-diastase positifs dans le chorion du duodénum peut correspondre à d’autres pathologies infectieuses (bactérienne, mycotique ou parasitaire) infectant le système monocytes macrophages chez les patients immunodéprimés (Tableau 1 ), dont les 3 principales sont :
-
•
une mycobactériose atypique (Mycoba cte rium avium en majorité), pouvant également toucher le système respiratoire. Le rectum est la deuxième localisation digestive la plus fréquente après le duodénum. En histologie, les macrophages spumeux peuvent prendre une teinte bleutée liée à la présence des mycobactéries intracellulaires, parfois associés à des granulomes (Fig. 2). Sur les colorations spéciales, on retrouve des bacilles PAS-diastase+ et Ziehl+ souvent nombreux [8] ;
-
•
une mycose de type histoplasmose disséminée (Histoplasma caspulatum) pouvant intéresser tout le tube digestif avec une atteinte préférentielle de l’iléon terminal. En histologie (Fig. 2), l’AP se situe dans les macrophages, mais aussi en situation extracellulaire sous la forme de levures arrondies de 2–4 μm colorés par le PAS-Diastase et le Grocott++ sans être souligné par les colorations de Giemsa ou de Ziehl [8], [10] (Fig. 2) ;
-
•
une leishmaniose viscérale (Leishmania donoviani, Leishmania infamtum ou Leishmania chagasi), dont les principaux foyers sont répartis en Inde, Soudan, Brésil et Éthiopie [11]. Elle atteint préférentiellement les patients immunodéprimés ou les jeunes enfants. La leishmaniose viscérale se manifeste par une fièvre avec hépato-splénomégalie, micro-polyadénopathies, anémie et altération de l’état général.
Tableau 1.
Agents pathogènes infectant le système monocytes macrophages et leurs différentes caractéristiques.
Pathogens infecting the monocyte macrophage system and their different characteristics. From Panarelli et al., Histopathology 2021.
| Mycobactérie atypique | Tropheryma whipplei | Histoplasma capsulatum | Leishmania | |
|---|---|---|---|---|
| Morphologie du micro-organisme (HES) | Bacille, donnant un aspect bleuté au cytoplasme des macrophages | Bacille et amas de bactérie dégénéré intracytoplasmique | Levure de 2–5 μm avec aspect bourgeonneant et présence d’un halo clair autour de la levure | Organisme de 2–4 μm intramacrophagique et extracellulaire |
| Muqueuse digestive | ||||
| Infiltrat macrophagique | + | + | + | + |
| Autres cellules inflammatoires | – | PNN | – | + |
| Granulome | ± | – | ± | – |
| Élargissement des villosités | + | + | – | + |
| Lymphangiectasie | – | + | – | – |
| Goutelettes lipidiques dans lamina propria et vacuolisation entérocytes | – | + | – | – |
| Colorations spéciales | ||||
| Ziehl | Positif | Négatif | Négatif | Négatif |
| PAS-D | Positif | Positif | Positif | Positif |
| GMS | Positif | Négatif | Positif | Négatif |
D’après Panarelli et al., Histopathology 2021.
En histologie (Fig. 2), l’AP se présente sous forme d’organismes ronds ou ovalaires de 2–4 μm intra- ou extra-macrophagiques, colorés par le Giemsa et le PAS-diastase sans être coloré par le Grocott ou le Ziehl. L’immunohistochimie anti-CD1a peut également aider à repérer les AP [12].
Spirochétose (Brachyspira aalborgi ou pilosicoli)
Définition et aspects cliniques
La spirochétose comprend un groupe hétérogène d’organismes, dont les plus fréquents sont B. aalborgi et Brachyspira pilosicoli, appartenant aux familles des spirochètes (comportant également les tréponèmes responsables de la syphilis ou les Leptospira).
La spirochétose intestinale est plus fréquente chez les patients VIH et/ou homosexuels masculins, c’est pourquoi l’hypothèse d’une maladie sexuellement transmissible a été suggérée. Mais la spirochétose intestinale est également observée associée à diverses conditions (maladie diverticulaire, MICI, adénomes).
L’infection est habituellement asymptomatique. Les patients avec atteinte histologiquement prouvée peuvent manifester des symptômes peu spécifiques comme une diarrhée chronique et/ou des douleurs abdominales. Il n’est pas toujours bien établi que ces symptômes soient causés par la spirochétose.
La spirochétose intestinale peut intéresser tout le tube colorectal et l’iléon terminal, notamment l’appendice [13].
Histopathologie
Spirochétose.
-
•
Localisation : colorectale.
-
•
Clinique : asymptomatique ou diarrhée chronique ± douleur abdominales.
-
•
Endoscopie : normale ou lésions minimes (œdème, érosion focale).
-
•
Microscopie : ligne bleu frangée au pôle apical des cellules épithéliales. Absence d’inflammation le plus souvent.
-
•
Techniques complémentaires : Grocott+, PAS+. IHC anti-Treponema pallidum+.
À l’examen macroscopique, la muqueuse colique est typiquement normale, il s’agit d’une cause de diarrhée chronique à muqueuse endoscopiquement normale, mais des aspects polypoïdes ou des érosions focales ont rarement été rapportés.
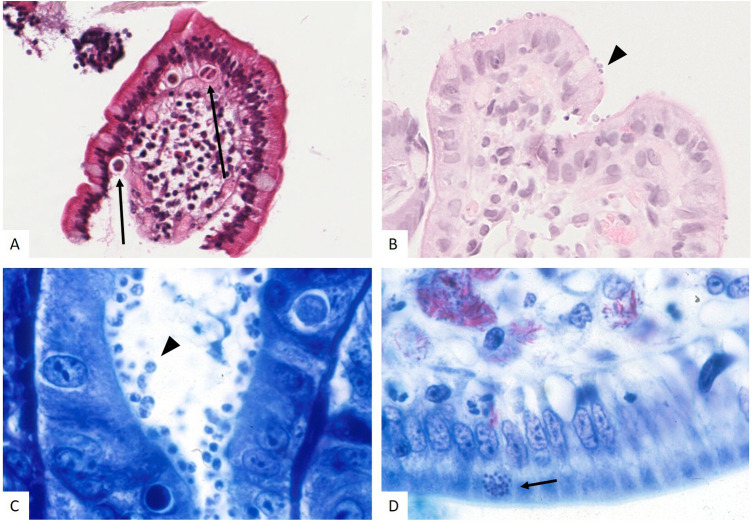
À l’examen microscopique (Fig. 3 ), il s’agit d’une colonisation du pôle apical des cellules épithéliales sans invasion de la muqueuse colique, ni infiltrat inflammatoire. Sur l’HES, les spirochètes apparaissent comme une ligne bleu flou et frangée, répartie de façon hétérogène et focale sur la bordure luminale du revêtement épithélial de surface.
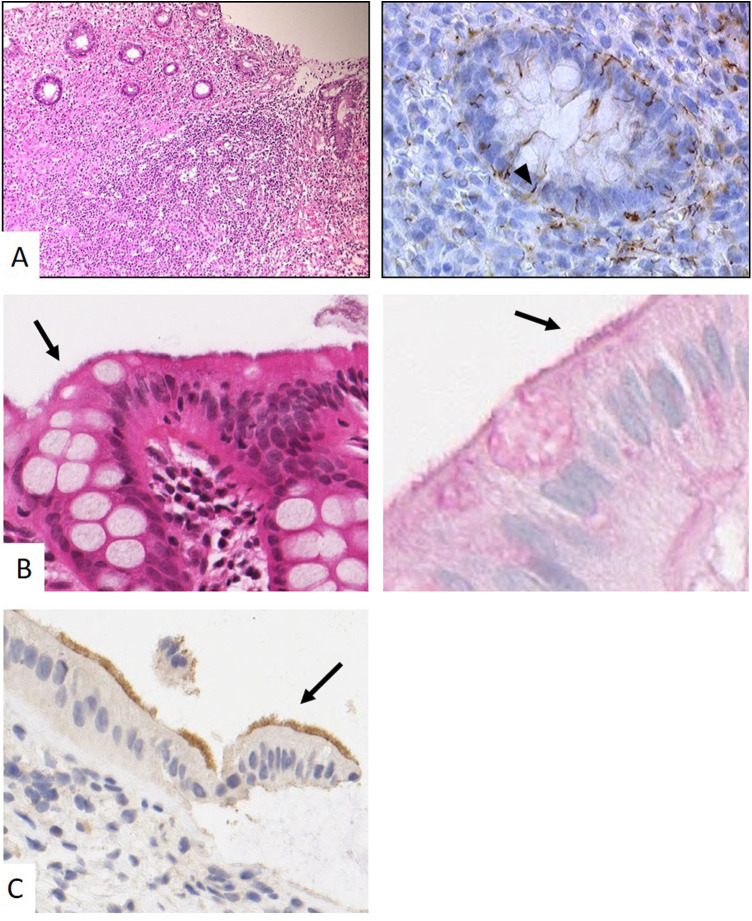
Figure 3.
Syphilis colique (A) montrant une ulcération de la muqueuse (à gauche, HES × 200) et la présence de Treponeme (flèches) en immunohistochimie avec l’anticorps anti-Treponema pallidum (à droite, × 800). Spirochétose colique (B) montrant le caractère « en frange » (flèches) du pôle apical des entérocytes en HES (à gauche, × 800), coloré par le PAS (à droite × 1200) ainsi que la positivité de ce pôle apical avec l’immunohistochimie par l’Ac anti-spirochète (C, × 800).
Colonic syphilis (A) showing ulceration of the mucosa (left, HES × 200) and the presence of Treponeme (arrows) on immunohistochemistry with anti-Treponema pallidum antibody (right, × 800). Colonic spirochetosis (B) showing the “fringed” character (arrows) of the apical pole of the enterocytes in HES (left, × 800), stained by PAS (right × 1200) as well as the positivity of this apical pole with immunohistochemistry by anti-spirochete Ac (C, × 800).
Les colorations argentiques colorent intensément les spirochètes, qui peuvent être également mis en évidence par la colorations du PAS.
L’étude immunohistochimique utilisant l’anticorps anti-Treponema pallidum (réaction croisée entre les deux bactéries) est fortement positive [13].
Syphilis (T. pallidum)
Définition et aspects cliniques
La syphilis est une maladie infectieuse sexuellement transmissible liée à T. pallidum, une bactérie Gram négative de la famille des spirochètes.
Les patients sont souvent asymptomatiques. Les manifestations cliniques digestives, lorsqu’elles sont présentes, sont peu spécifiques : nausée et vomissement dans l’atteinte gastrique, ténesme, constipation, saignement et décharge anale mucoïde ou sanglante dans l’atteinte anorectale [14].
Les atteintes digestives les plus fréquentes sont la cavité orale et la région anorectale, très rarement l’estomac (moins de 1 % des patients) [15].
Histopathologie
Syphilis.
-
•
Localisation : anorectale.
-
•
Clinique : douleur, constipation, rectorragie.
-
•
Macroscopie : chancres anaux, papules ou nodules, parfois lésion ulcérée pseudo-tumorale.
-
•
Microscopie : ulcération de la muqueuse avec inflammation plasmocytaire du chorion ± cryptite ou abcès cryptique.
-
•
Techniques complémentaires : immunohistochimie anti-T. pallidum.
À l’examen macroscopique, l’ulcération est l’aspect le plus commun de l’atteinte digestive. La syphilis anorectale primaire se manifeste par des chancres anaux (lésions circulaires indurées, unique ou multiple), des fissures ou des polypes, mimant une MICI ou un processus tumoral [16].
À l’examen microscopique [17] (Fig. 3), la muqueuse est souvent ulcérée, atrophique, hébergeant un infiltrat inflammatoire polymorphe typiquement riche en plasmocytes, détruisant les glandes. Les plasmocytes péri-nerveux sont fréquemment observés au niveau des filets nerveux dans la sous muqueuse [18]. Cet infiltrat inflammatoire dense peut s’accompagner d’une endartérite, de granulomes épithélioïdes mal formés ou d’une fibrose de la muqueuse. Dans certains cas, l’infiltrat inflammatoire peut être riche en histiocytes ou en lymphocytes activés, rendant le diagnostic difficile [17].
L’identification de T. pallidum dans la muqueuse gastro-intestinale peut être faite par plusieurs méthodes. L’étude immunohistochimique dirigée contre T. pallidum a montré une meilleure sensibilité (71 %) [19] dans les échantillons cutanéomuqueux que la coloration de Warthin Starry (41 %). Cependant, cet immunomarquage n’est pas spécifique de T. pallidum. Il peut marquer d’autres spirochètes comme B. aalborgi et B. pilosicoli, responsable de la spirochétose (voir chapitre précédent) [20]. L’immunomarquage est fréquemment négatif dans l’atteinte gastrique, et la PCR parait plus sensible [21].
Malakoplakie (liée à différentes bactéries, surtout Escherichia coli)
Définition et aspects cliniques
La malakoplakie est une maladie inflammatoire rare caractérisée par des macrophages altérés avec une incapacité à digérer et à tuer les bactéries [22]. Les bactéries les plus souvent impliquées sont E. coli, mais d’autres bactéries, comme Klebsiella pneumoniae, Mycobacterium tuberculosis, Staphylococcus aureus et Pseudomonas aeruginosa, ont également été isolées [22], [23]. Les AP partiellement digérés s’accumulent dans les phagolysosomes des macrophages et s’incrustent ensuite de sels de calcium et de fer.
Selon une étude récente [24], la découverte d’une malakoplakie est souvent fortuite, sous la forme de polypes colorectaux dans le cadre d’un dépistage. L’association d’une malakoplakie avec d’autres pathologies (néoplasie colique, transplantation d’organe, colites, polype gastrique hyperplasique, appendicite) a été décrite.
Le tractus gastro-intestinal est le deuxième site le plus touché après le tractus génito-urinaire, avec une atteinte préférentielle colorectale, plus rarement de l’iléon terminal et de l’appendice [25].
Histopathologie
L’aspect histologique (Fig. 4 ) est caractérisé au faible grandissement par des zones éosinophiles expansives composées d’histiocytes au cytoplasme pâle abondant, contenant des inclusions intracytoplasmiques en forme de cible (corps de Michaelis-Gutmann). Le processus inflammatoire implique essentiellement la muqueuse, avec une distorsion architecturale, due à une réponse inflammatoire faite de lymphocytes, plasmocytes avec une proportion variable de polynucléaires. L’agrégat lymphoïde peut être proéminent avec formation de centres germinatifs, masquant parfois la lésion histiocytaire, rendant le diagnostic histologique difficile [24], [25].
Malakoplakie.
-
•
Localisation : côlon.
-
•
Clinique : masse abdominale.
-
•
Endoscopie : polype colique, nodule, masse.
-
•
Microscopie : plages d’histiocytes spumeux renfermant des corps de Michaella-Gutmann. Distorsion architecturale de la muqueuse avec inflammation du chorion.
-
•
Techniques complémentaires : corps de Michaella-Gutmann Von Kossa+, PAS+, Perls+, bleu Alcian+.
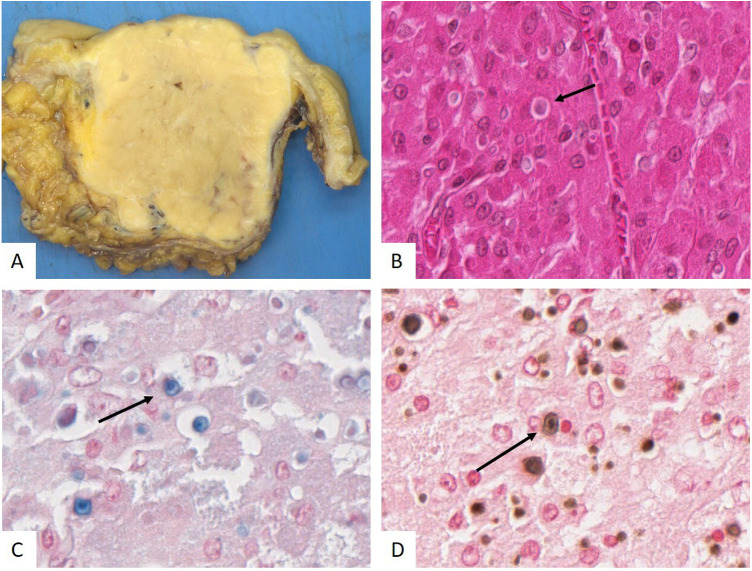
Figure 4.
Malakoplakie colique. A. Coupe transversale de la paroi colique montrant une lésion arrondie, mal limitée, jaunâtre dans la paroi colique, sans atteinte de la muqueuse. B. Histiocytes spumeux renfermant des corps de Michaelis-Gutmann (flèches) (HES, × 800) avec un aspect en cible. Ces corps de Michaelis-Gutmann sont colorés par le bleu alcian (C, × 800) et par la coloration de von Kossa (D, × 800).
Colonic malakoplakia. A. Cross section of the colonic wall showing a round, poorly bounded, yellowish lesion in the colonic wall, without mucosal involvement. B. Foamy histiocytes containing Michaelis-Gutmann bodies (arrows) (HES, × 800) with a target-like appearance. These Michaelis-Gutmann bodies are stained with Alcian blue (C, × 800) and with von Kossa stain (D, × 800).
Les corps de Michaelis-Gutmann sont soulignés par la coloration de Von Kossa, le bleu alcian, la coloration de Perls, plus rarement par le PAS diastase.
Les diagnostics différentiels de la malakoplakie incluent la maladie de Whipple, les mycobactéries atypiques (notamment M. avium), et l’histiocytose langerhansienne. Toutes ces entités sont cependant dépourvues des corps de Michaelis-Gutmann pathognomoniques.
Infections parasitaires à ne pas manquer dans le tube digestif
Les infections parasitaires difficiles à repérer et classer pour les pathologistes, et pouvant passer inaperçus, sont surtout les protozoaires, dont nous allons illustrer les quelques exemples les plus caractéristiques.
Giardiose (Giardia lamblia)
Définition et aspects cliniques
Giardiose.
-
•
Localisation : duodénale+++, iléocolique.
-
•
Clinique : souvent asymptomatique, diarrhée aiguë ou syndrome de malabsorption.
-
•
Endoscopie : sans anomalie.
-
•
Microscopie : trophozoïtes dans la lumière intestinale en forme de poire, binucléée. Muqueuse le plus souvent sans anomalie.
-
•
Techniques complémentaires : non nécessaires le plus souvent. IHC anti-CD117 possible en cas de doute.
La giardiose (aussi appelée Giardiase) est liée à un protozoaire flagellé, Giarda lamblia, faisant partie des parasites les plus fréquents chez l’homme avec une incidence estimée à 200–280 millions par an. Bien qu’il s’agisse d’un parasite ubiquitaire, sa prévalence est relativement faible dans les pays développés (2–7 %), contre 30 % et plus dans les pays en voie de développement [26].
La giardiose est le plus souvent asymptomatique avec une auto-éradication fréquente. Lorsqu’elle est symptomatique, la giardase aiguë se manifeste par une diarrhée aqueuse malodorante, associée à des douleurs abdominales, plus rarement une perte de poids et un syndrome de malabsorption [26]. Ces symptômes peuvent durer jusqu’à 4 semaines, puis se chroniciser avec persistance du syndrome de malabsorption pouvant mener à une perte de poids.
G. lamblia est trouvé le plus souvent dans le duodénum bien que des localisations iléale, gastrique ou colique aient également été rapportées [27].
Histopathologie
L’examen endoscopique est classiquement normal.
À l’examen microscopique (Fig. 5 ), la giardiose est le plus souvent non invasive et l’on observe les trophozoïtes attachés aux entérocytes sans pénétrer au sein de l’épithélium. Dans de rares cas, on peut observer une lymphocytose intra-épithéliale, une augmentation de l’infiltrat inflammatoire du chorion, voire une atrophie villositaire, associée à une hyperplasie des cryptes, mimant une maladie cœliaque.
Figure 5.
Giardiose duodénale (A) montrant une muqueuse duodénale sans anomalie (à gauche, HES × 200) et la présence de Giarda (flèches) dans la lumière (à droite, HES × 400). Amibiase colique (B) montrant les amibes (flèches) au cytoplasme spumeux à l’HES (à gauche × 400) avec des granulations PAS+ (à droite, × 400) avec une ulcération de la muqueuse colique (C) (HES, 1200).
Duodenal giardiasis (A) showing duodenal mucosa without abnormality (left, HES × 200) and the presence of Giarda (arrows) in the lumen (right, HES × 400). Colonic amoebiasis (B) showing amoebae (arrow) with foamy cytoplasm on HES (left × 400) with PAS + granulations (right, × 400) with ulceration of the colonic mucosa (C) (HES, 1200).
Les trophozoïtes de Giardia ont une forme de poire et sont binucléés, mais apparaissent elliptiques lorsqu’ils sont vus de profil (aspect typique de coupe-ongle), et mesurent 10–20 μm de long (Fig. 3B) [26], [27]. En cas de doute, CD117 est rapporté comme étant positif sur les parasite, ce qui peut aider en cas de faible infestation [28].
Amibiase (Entamoeba histolytica)
Définition et aspects cliniques
Amibiase.
-
•
Localisation : côlon, foie ou poumon.
-
•
Clinique : diarrhée aqueuse ou glairosanglante, perte de poids, parfois forme fulminante avec nécrose intestinale et péritonite.
-
•
Endoscopie : ulcères coliques.
-
•
Microscopie : ulcérations de la muqueuse colique avec inflammation chronique du chorion. Trophozoïtes dans la lumière de 6–40 μm au cytoplasme spumeux avec granulations et érythtocytes ingérés.
-
•
Techniques complémentaires : granulations PAS+.
L’amibiase causée par E. histolytica (être unicellulaire) est l’une des principales causes de mortalité parasitaire dans le monde avec 50 000 morts annuels et environ 50 millions de cas [27].
Elle est endémique en Amérique centrale et du Sud, en Afrique et en Asie du Sud, surtout dans les zones pauvres avec de mauvaises conditions sanitaires, alors qu’elle est rare dans les pays occidentaux, à l’exception des personnes migrantes ou revenant de zones endémiques (5,1–61/cas/1 000 000 habitants au Canada) [29].
L’amibiase est rarement symptomatique (10 % des cas) et se manifeste alors le plus souvent par une diarrhée aqueuse ou glairosanglante associée à des douleurs abdominales et un syndrome dysentérique. Rarement, l’amibiase peut se manifester par une colite fulminante avec fièvre, diarrhée profuse glairosanglante et péritonite, pouvant se compliquer d’une nécrose avec perforation à haut risque de mortalité (60 %) [27], [29].
L’atteinte digestive intéresse le plus souvent le côlon proximal, mais peut aller de l’iléon au canal anal.
Le cycle parasitaire commence par l’ingestion des kystes (présent dans l’eau ou la nourriture contaminées) survivant à l’acide de l’estomac grâce à leur coque. Les kystes se détruisent dans l’intestin grêle avec libération de trophozoïtes qui migrent dans le côlon. Les trophozoïtes forment de nouveaux kystes qui se retrouveront dans les selles.
Histopathologie
L’examen macroscopique montre le plus souvent des ulcérations non spécifiques (typiquement « coup d’ongle »), associée à des remaniements œdémateux de la muqueuse.
À l’examen microscopique (Fig. 5), la paroi colique peut être le siège de multiples ulcères de petite taille entrecoupés de muqueuse saine. La muqueuse peut également présenter une inflammation chronique active avec une nécrose épithéliale et une baisse de mucosécrétion. Plus rarement, chez des patients non traités ou sous traités, peuvent se développer des amoebomes correspondant à des masses exophytiques liées à une réponse inflammatoire granulomateuse et une prolifération fibroblastique pouvant aboutir à une obstruction colique [27].
Les trophozoïtes mesurent de 6 à 40 μm, de forme arrondie avec un cytoplasme spumeux renfermant des granulations PAS+ et des érythrocytes ingérés. Leur chromatine est dispersée avec peu d’amas permettant de les distinguer des macrophages [27].
Conoidasida (Cryptosporidium, Cystoisospora, Cyclospora)
Définition et aspects cliniques
Les cryptosporidiose, cystoisosporose et la cyclosporose sont liés à des protozoaires cocciformes de la classe Conoidasida. Il en existe 2 sous-classes, les grégarines comportant les AP de la cryptosporidiose [30] (Cryptosporidium parvum, Cryptosporidium hominis et Cryptosporidium meleagridis) et les coccidioses comportant Cystoisospora belli (anciennement appelé Isospora belli) et Cyclospora cayetanensis. Ce sont des AP intracellulaires obligatoires.
L’infection par ces AP est mondiale, mais fortement endémique dans les régions tropicales et subtropicales.
L’infection des Conoidasida se manifeste par une diarrhée aqueuse, pouvant se compliquer d’une déshydratation ou d’une malabsorption surtout chez les patients immunodéprimés [31], [32], [33].
L’intestin grêle est le site primaire de l’infection des Conoidasida. La cyclosporose atteint préférentiellement le duodénum et le jéjunum [34]. La cryptosporidiose peut s’observer dans l’estomac et dans le côlon [33].
L’infection humaine à Conoidasida se fait par contamination oro-fécale, après ingestion d’aliments ou d’eau contaminés par les oocystes. Après ingestion, les oocystes s’enkystent dans l’intestin grêle et libèrent des sporozoïtes qui envahissent les cellules épithéliales de l’hôte.
Les sporozoïtes de Cryptosporidia s’attachent à la membrane apicale des cellules épithéliales par un processus ligand (sporozoïte)-récepteur (cellule hôte) spécifique, induisant une réorganisation du cytosquelette de la cellule hôte formant une protrusion de la membrane de la cellule hôte autour du sporozoïte correspondant à une vacuole dans laquelle l’organisme reste intracellulaire mais extracytoplasmique.
Les sporozoïtes de C. belli et C. cayetanensis se multiplient à travers plusieurs étapes du cycle de vie comprenant à la fois la reproduction asexuée (formation de mérontes contenant des mérozoïtes) et la reproduction sexuée (formation de microgamonts qui sont des gamètes mâles et des macrogamonts qui sont des gamètes femelles). Après fécondation, les oocystes se forment et sont excrétés dans les selles [35].
Histopathologie
Conoidasidiose.
-
•
Localisation : principalement intestin grêle. Estomac ou côlon possible.
-
•
Clinique : diarrhée aqueuse.
-
•
Endoscopie : sans anomalie.
-
•Microscopie : atrophie villositaire modérée avec lymphocytose intra-épithéliale :
-
∘Cryptosporidium : situé à la surface des villosités, arrondis, 2–5 μm,
-
∘C. belli : dans des vacuoles parasitophores dans le cytoplasme des cellules épithéliales, 15–20 μm à différents stades de division,
-
∘C. cayetanensis : dans des vacuoles parasitophores dans le cytoplasme des cellules épithéliales, 5–6 μm.
-
∘
-
•Technique complémentaire :
-
∘Cryptosporidium : Giemsa+, Gram+,
-
∘C. belli : Giemsa+, PAS+, Grocott+,
-
∘C. cayetanensis : Giemsa+.
-
∘
L’aspect endoscopique est souvent normal ou non spécifique avec un érythème de la muqueuse pouvant s’accompagner d’érosions.
À l’examen microscopique (Fig. 6 ), la muqueuse intestinale peut montrer une atrophie villositaire modérée, revêtue par des cellules épithéliales régénératives, par places apoptotiques, avec une discrète lymphocytose intra-épithéliale.
Figure 6.
Cystoisospora (A) montrant une muqueuse duodénale peu remaniée, renfermant les vacuoles avec les Cystoisospora belli au sein de la muqueuse (flèches) (HES × 200). Cryptosporidiose (B et C) montrant les cryptosporidies (flèches) au pôle luminal des cellule épithéliales à l’HES (B, × 400) et au Giemsa (C, × 1000). Microsporidiose (D) montrant les parasites de petite taille en amas (flèches) dans le cytoplasme des entérocytes (Ziehl, × 800) ici associé à une mycobacteriose atypique avec des mycobacteries Ziehl's+ mycobacteria.
Cystoisospora (A) showing minimally reshaped duodenal mucosa with vacuoles containing Cystoisospora belli within the mucosa (arrows) (HES × 200). Cryptosporidiosis (B and C) showing cryptosporidia (arrow) at the luminal pole of epithelial cells on HES (B, × 400) and Giemsa (C, × 1000). Microsporidiosis (D) showing small parasites in clusters (arrows) in the cytoplasm of enterocytes (Ziehl's, × 800) here associated with atypical mycobacteriosis with Ziehl's+ mycobacteria.
Ces micro-organismes sont identifiés dans les cellules épithéliales luminales avec différentes morphologies (Fig. 6).
Cryptosporidium
Les cryptosporidies sont des AP intracellulaires, mais extracytoplasmiques de petite taille (2–5 μm), se disposant à la surface des villosités et dans la lumière des cryptes sous forme de petits corps ronds bleu-violacé Giemsa + Gram+, Ziehl Neelsen modifié+ (Fig. 6A) [36]. Ils sont bien visibles sur la coloration HES, car ils font protrusion dans la lumière sous la forme de petites structures arrondies éosionophiles à bien rechercher chez les patients greffés (ils peuvent être peu nombreux).
C. belli (anciennement appelé Isospora belli)
C. belli diffère des autres protozoaires par sa grande taille (15–20 mm) selon les stades de division (Fig. 6B) [35]. Toutes les formes sont situées dans une vacuole parasitophore dans le cytoplasme basal de la cellule épithéliale infectée, sous le noyau, qui a tendance à adopter une position transversale par rapport au parasite allongé, entraînant ainsi le soi-disant « signe T ».
L’AP est visible lors de l’examen attentif en HES. Les colorations de PAS, GMS et Grocott mettent en évidence des granules au sein des mérozoïtes.
C. cayetanensis
Dans les coupes histologiques, C. cayetanensis est observé dans des vacuoles parasitophores cytoplasmiques à la partie apicale des cellules épithéliales intestinales, au-dessus du noyau, généralement en grand nombre à l’extrémité des villosités. Les gamonts sont ronds, avec un ou plusieurs noyaux proéminents de 2–3 μm et les mérozoïtes mesurent 5–6 μm, et ont un seul noyau à une extrémité. Ces microorganismes sont mal visibles sur la coloration de l’HES et sont bien soulignés par la coloration de Giemsa [34].
Microsporidiose (Enterocytozoon bieneusi et Encephalitozoon intestinalis)
Définition et aspects cliniques
Les microsporidies sont des « parasites » intracellulaires obligatoires, visibles sous la forme de spore de 1–4 μm. Par analyse phylogénétique moléculaire, ils sont depuis peu classés comme des mycoses avec lesquelles ils partagent un ancêtre commun, mais ils se comportent de la même manière que les protozoaires intestinaux [37] et font partie des diagnostics différentiels des protozoaires pour les pathologistes, raison pour laquelle nous les présentons dans cette catégorie des parasites protozoaires.
Microsporidiose.
-
•
Localisation : duodénum+++, iléon terminal.
-
•
Clinique : diarrhée liquide transitoire chez les patients immunocompétents. Syndrome de malabsorption plus fréquent chez les patients immunodéprimés.
-
•
Endoscopie : sans anomalie.
-
•
Microscopie : atrophie villositaire ± lymphocytose, inflammation polymorphe du chorion, spores situés dans la portion supérieure du cytoplasme des entérocytes.
-
•
Coloration : Warthin-Starry+, Giemsa+, Trichrome+.
Il s’agit d’une infection opportuniste liée à E. bieneusi ou E. intestinalis survenant chez les patients transplantés d’organe ou les patients VIH avec un nombre de CD4 inférieur à 100/μL. Il peut s’agir parfois d’une « diarrhée du voyageur » transitoire spontanément résolutive chez les patients immunocompétents.
Les manifestations digestives sont, au premier plan, sous la forme d’une diarrhée aqueuse avec malabsorption.
L’intestin grêle est le site primaire de l’infection, plus fréquemment le duodénum, mais également l’iléon terminal.
Histopathologie
L’aspect macroscopique est souvent normal ou avec de minimes modifications (érythème, érosions superficielles).
À l’examen microscopique (Fig. 6), la muqueuse intestinale peut montrer une atrophie villositaire partielle. Les villosités raccourcies sont associées à une discrète augmentation de macrophages, lymphocytes, plasmocytes et polynucléaires éosinophiles dans le chorion, revêtues par des entérocytes régénératifs, en particulier sur les pointes des villosités mais pas dans les cryptes. Les cellules épithéliales superficielles contiennent de multiples spores sous la forme d’amas dans le cytoplasme supranucléaire. Des spores peuvent également être retrouvées dans les macrophages [37].
Les spores de microsporidie passent facilement inaperçus sur l’HES. Elles peuvent être mises en évidence en foncé à noir dans le pôle apical des entérocytes sur la coloration Warthin-Starry, mais également avec les colorations de Giemsa et Trichome. Les colorations de Grocott, PAS diastase, Gram sont négatives.
La PCR dans les selles peut être utile dans la confirmation diagnostique.
Conclusion
Le pathologiste examinant une biopsie ou une pièce opératoire du tube digestif peut être amené à porter le diagnostic d’une infection et doit, aidé par le contexte clinique, rechercher les AP en s’aidant au moindre doute de colorations spéciales et d’immunomarquages.
À l’aide de ces outils relativement simples, une identification assez précise et rapide de nombreux AP peut être réalisée à partir de prélèvements fixés en formol et inclus en paraffine (Tableau 2 ). Dans certains cas, ce diagnostic sera confirmé dans un second temps par PCR. Nous l’avons vu, certaines pathologies parasitaires ou bactériennes présentent des aspects spécifiques « à ne pas manquer » permettant de porter un diagnostic précis ou, tout du moins, d’apporter des éléments d’orientations pour le clinicien. Une bonne connaissance de ces lésions est d’autant plus précieuse que dans bien des cas, le patient se présente pour des symptômes non spécifiques avec un examen endoscopique pouvant être normal.
Tableau 2.
Colorations utiles pour l’identification des agents pathogènes affectant le tube digestif.
Useful stains for the identification of pathogens affecting the digestive tract (NU: not useful).
| Actinomycose | Nocardiose | Whipple | Spirochète | Syphilis | Malakoplakie | Giardiose | Amibiase | Conoidasida | Microsporidiose | |
|---|---|---|---|---|---|---|---|---|---|---|
| GRAM | + | + | + | – | – | – | NU | NU | NU | + |
| Grocott | + | + | – | + | – | – | NU | + | + | – |
| PAS | + | + | + (confirmer par PAS-Diastase) | + | – | + | NU | + | + | – |
| Warthin Starry | + | + | – | + | ± | – | NU | + | NU | + |
| Von Kossa | – | – | – | – | – | + | NU | NU | NU | – |
| Bleu alcian | – | – | – | – | – | + | NU | – | NU | – |
| Giemsa | + | + | – | + | + | ± | + | + | + | + |
| Ziehl | – | + | – | – | – | – | NU | – | + (cryptosporidium) | + |
NU : non utile.
Une attention particulière doit être portée aux prélèvements issus de patients immunodéprimés, par exemple greffés, présentant des symptômes à type de diarrhée. Chez ces patients, l’analyse attentive des biopsies digestives doit systématiquement éliminer une infection parasitaire, l’examen parasitologique n’étant pas toujours systématiquement réalisé. Même en cas de biopsies normales sur l’HE, les colorations complémentaires peuvent s’avérer utiles dans ce contexte, pour trouver des AP en faible nombre. La découverte de l’AP permettra d’entreprendre une confirmation parasitologique qui n’aurait pas été réalisée d’emblée, et de débuter un traitement en urgence chez ces patients fragiles.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Références
- 1.Hofman P., Lucas S., Jouvion G., Tauziède-Espariat A., Chrétien F., Cathomas G. Pathology of infectious diseases: what does the future hold? Virchows Arch Int J Pathol. 2017;470:483–492. doi: 10.1007/s00428-017-2082-6. [DOI] [PubMed] [Google Scholar]
- 2.Jabi R., Ramdani H., Elmir S., Elmejjati F., Serji B., El Harroudi T., et al. Pseudotumoral actinomycosis mimicking malignant colic disease: a case report and literature review. Visc Med. 2020;36:333–337. doi: 10.1159/000502895. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Sia G.B., Soares P.F.C., Benedetti L., Moreira L.R., Cazzo E. Abdominal actinomycosis after bariatric surgery. Obes Surg. 2021;31:405–408. doi: 10.1007/s11695-020-04784-x. [DOI] [PubMed] [Google Scholar]
- 4.Hofman P., Benzaquen J., Lassalle S., Diascorn Y., Cohen C. Pseudo-tumor lesions induced by infectious agents. Case No. 8. Ann Pathol. 2019;39:277–279. doi: 10.1016/j.annpat.2019.04.005. [DOI] [PubMed] [Google Scholar]
- 5.Tramèr L., Mertz K.D., Huegli R., Hinic V., Jost L., Burkhalter F., et al. Intra-abdominal nocardiosis-case report and review of the literature. J Clin Med. 2020;9(7):E2141. doi: 10.3390/jcm9072141. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Naha K., Dasari S., Vivek G., Prabhu M. Primary abdominal nocardiosis masquerading as tubercular pelvic inflammatory disease in an immunocompetent individual. BMJ Case Rep. 2013;2013 doi: 10.1136/bcr-2012-008076. [bcr2012008076] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.McHugh K.E., Sturgis C.D., Procop G.W., Rhoads D.D. The cytopathology of actinomyces, nocardia, and their mimickers. Diagn Cytopathol. 2017;45:1105–1115. doi: 10.1002/dc.23816. [DOI] [PubMed] [Google Scholar]
- 8.Panarelli N.C. Infectious diseases of the upper gastrointestinal tract. Histopathology. 2021;78:70–87. doi: 10.1111/his.14243. [DOI] [PubMed] [Google Scholar]
- 9.Ferrieres L., Laroche M., Bonnet D., Alric L. Whipple's disease: diagnosis and predictive factors of relapse. Eur J Gastroenterol Hepatol. 2020;32:325–328. doi: 10.1097/MEG.0000000000001611. [DOI] [PubMed] [Google Scholar]
- 10.Zhu L.L., Wang J., Wang Z.J., Wang Y.P., Yang J.L. Intestinal histoplasmosis in immunocompetent adults. World J Gastroenterol. 2016;22:4027–4033. doi: 10.3748/wjg.v22.i15.4027. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Pace D. Leishmaniasis. J Infect. 2014;69:S10–S18. doi: 10.1016/j.jinf.2014.07.016. [DOI] [PubMed] [Google Scholar]
- 12.Fernandez-Flores A., Rodriguez-Peralto J.L. Morphological and immunohistochemical clues for the diagnosis of cutaneous leishmaniasis and the interpretation of CD1a status. J Am Acad Dermatol. 2016;74:536–543. doi: 10.1016/j.jaad.2015.09.038. [DOI] [PubMed] [Google Scholar]
- 13.Ogata S., Shimizu K., Tominaga S., Nakanishi K. Histologic characteristics of human intestinal spirochetosis in operatively resected specimens. Virchows Arch. 2020;477 doi: 10.1007/s00428-020-02785-w. [DOI] [PubMed] [Google Scholar]
- 14.Arnold C.A., Roth R., Arsenescu R., Harzman A., Lam-Himlin D.M., Limketkai B.N., et al. Sexually transmitted infectious colitis vs. inflammatory bowel disease: distinguishing features from a case-controlled study. Am J Clin Pathol. 2015;144:771–781. doi: 10.1309/AJCPOID4JIJ6PISC. [DOI] [PubMed] [Google Scholar]
- 15.Yu H.J., Kim S.J., Oh H.H., Im C.M., Han B., Myung E., et al. Case report of gastric syphilis in Korea: clinical features, pathology, management, and prognosis. Medicine (Baltimore) 2021;100:e28212. doi: 10.1097/MD.0000000000028212. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Yilmaz M., Memisoglu R., Aydin S., Tabak O., Mete B., Memisoglu N., et al. Anorectal syphilis mimicking Crohn's disease. J Infect Chemother. 2011;17:713–715. doi: 10.1007/s10156-011-0234-1. [DOI] [PubMed] [Google Scholar]
- 17.Tse J.Y., Chan M.P., Ferry J.A., Deshpande V., Sohani A.R., Nardi V., et al. Syphilis of the aerodigestive tract. Am J Surg Pathol. 2018;42:472–478. doi: 10.1097/PAS.0000000000000987. [DOI] [PubMed] [Google Scholar]
- 18.Choi W.T., Lauwers G.Y. Patterns of gastric injury: beyond Helicobacter Pylori. Surg Pathol Clin. 2017;10:801–822. doi: 10.1016/j.path.2017.07.003. [DOI] [PubMed] [Google Scholar]
- 19.Hoang M.P., High W.A., Molberg K.H. Secondary syphilis: a histologic and immunohistochemical evaluation. J Cutan Pathol. 2004;31:595–599. doi: 10.1111/j.0303-6987.2004.00236.x. [DOI] [PubMed] [Google Scholar]
- 20.Ruiz S.J., Procop G.W. Cross-reactivity of anti-treponema immunohistochemistry with non-treponema spirochetes: a simple call for caution. Arch Pathol Lab Med. 2016;140:1021–1022. doi: 10.5858/arpa.2016-0004-LE. [DOI] [PubMed] [Google Scholar]
- 21.Buffet M., Grange P.A., Gerhardt P., Carlotti A., Calvez V., Bianchi A., et al. Diagnosing Treponema pallidum in secondary syphilis by PCR and immunohistochemistry. J Invest Dermatol. 2007;127:2345–2350. doi: 10.1038/sj.jid.5700888. [DOI] [PubMed] [Google Scholar]
- 22.Yousef G.M., Naghibi B., Hamodat M.M. Malakoplakia outside the urinary tract. 2007;131(2):297–300. doi: 10.5858/2007-131-297-MOTUT. [DOI] [PubMed] [Google Scholar]
- 23.Rickert C.H., August C., Brandt M., Wagner V., Paulus W. Cerebral malakoplakia associated with Escherichia coli infection. Acta Neuropathol (Berl). 2000;99(5):595–598. doi: 10.1007/s004010051167. [DOI] [PubMed] [Google Scholar]
- 24.Zhang Y., Byrnes K., Lam-Himlin D., Pittman M., Pezhouh M., Gonzalez R.S., et al. Gastrointestinal malakoplakia: clinicopathologic analysis of 26 cases. Am J Surg Pathol. 2020;44:1251–1258. doi: 10.1097/PAS.0000000000001491. [DOI] [PubMed] [Google Scholar]
- 25.Lee M., Ko H.M., Rubino A., Lee H., Gill R., Lagana S.M. Malakoplakia of the gastrointestinal tract: clinicopathologic analysis of 23 cases. Diagn Pathol. 2020;15:97. doi: 10.1186/s13000-020-01013-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Groudan K., Gupta K., Chalhoub J., Singhania R. Giardia lamblia diagnosed incidentally by duodenal biopsy. J Investig Med High Impact Case Rep. 2021;9 doi: 10.1177/23247096211001649. [23247096211001650] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Grillo F., Campora M., Carlin L., Cornara L., Parente P., Vanoli A., et al. « Stranger things » in the gut: uncommon items in gastrointestinal specimens. Virchows Arch Int J Pathol. 2022;480:231–245. doi: 10.1007/s00428-021-03188-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Sinelnikov I., Sion-Vardy N., Shaco-Levy R. C-kit (CD117) immunostain is useful for the diagnosis of Giardia lamblia in duodenal biopsies. Hum Pathol. 2009;40:323–325. doi: 10.1016/j.humpath.2008.07.015. [DOI] [PubMed] [Google Scholar]
- 29.Kantor M., Abrantes A., Estevez A., Schiller A., Torrent J., Gascon J., et al. Entamoeba Histolytica: updates in clinical manifestation, pathogenesis, and vaccine development. Can J Gastroenterol Hepatol. 2018;2018:4601420. doi: 10.1155/2018/4601420. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Ryan U., Paparini A., Monis P., Hijjawi N. It's official – Cryptosporidium is a gregarine: what are the implications for the water industry? Water Res. 2016;105:305–313. doi: 10.1016/j.watres.2016.09.013. [DOI] [PubMed] [Google Scholar]
- 31.Lai K.K., Goyne H.E., Hernandez-Gonzalo D., Miller K.A., Tuohy M., Procop G.W., et al. Cystoisospora belli Infection of the Gallbladder in immunocompetent patients: a clinicopathologic review of 18 cases. Am J Surg Pathol. 2016;40:1070–1074. doi: 10.1097/PAS.0000000000000660. [DOI] [PubMed] [Google Scholar]
- 32.Gupta S., Narang S., Nunavath V., Singh S. Chronic diarrhoea in HIV patients: prevalence of coccidian parasites. Indian J Med Microbiol. 2008;26:172–175. doi: 10.4103/0255-0857.40536. [DOI] [PubMed] [Google Scholar]
- 33.Field A.S. Light microscopic and electron microscopic diagnosis of gastrointestinal opportunistic infections in HIV-positive patients. Pathology (Phila) 2002;34:21–35. doi: 10.1080/00313020120111230. [DOI] [PubMed] [Google Scholar]
- 34.Mathison B.A., Pritt B.S. Cyclosporiasis-updates on clinical presentation, pathology, clinical diagnosis, and treatment. Microorganisms. 2021;9:1863. doi: 10.3390/microorganisms9091863. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Rowan D.J., Said S., Schuetz A.N., Pritt B.S. A case of Cystoisospora (Isospora) belli infection with multiple life stages identified on endoscopic small Bowel biopsies. Int J Surg Pathol. 2020;28:884–886. doi: 10.1177/1066896920901589. [DOI] [PubMed] [Google Scholar]
- 36.Hemphill A., Müller N., Müller J. Comparative pathobiology of the intestinal protozoan parasites giardia lamblia, Entamoeba histolytica, and Cryptosporidium parvum. Pathog Basel Switz. 2019;8:E116. doi: 10.3390/pathogens8030116. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Field A.S., Milner D.A. Intestinal microsporidiosis. Clin Lab Med. 2015;35(2):445–459. doi: 10.1016/j.cll.2015.02.011. [DOI] [PubMed] [Google Scholar]