Résumé
Une chienne de 3 ans est référée pour l’exploration d’un souffle concomitant à une léthargie. Une échocardiographie révèle une inversion de la position des chambres cardiaques et la présence d’une communication interventriculaire. Un examen tomodensitométrique du thorax et de l’abdomen met en évidence les anomalies cardiaques connues ainsi que l’association d’un situs inversus complet. L’examen clinique révèle également des malformations oculaires (déviation des globes oculaires et asymétrie des fonds d’œil). Cet article souligne la variété des anomalies pouvant s’associer à l’inversion complète des organes et démontre qu’il peut y avoir des variantes au tableau plus classique rencontré habituellement chez l’homme (manifestations respiratoires liées au syndrome de Kartagener).
Abstract
A case of complete situs inversus associated with an interventricular communication and ocular abnormalities in a 3-year-old mixed-breed female dog. A 3-year-old female dog was referred for exploration of a murmur concomitant with lethargy. An echocardiogram reveals an inversion of the position of the cardiac chambers and the presence of an interventricular communication. A computed tomography examination of the thorax and abdomen highlights the known cardiac abnormalities as well as the association of a complete situs inversus. The clinical examination also reveals ocular malformations (deviation of the eyeballs and asymmetry of the fundus). This article highlights the variety of abnormalities that can be associated with the complete inversion of the organs and demonstrates that there may be variants to the more classic picture usually encountered in humans (respiratory manifestations related to Kartagener syndrome).
(Translated by Dr Serge Messier)
Le situs inversus complet est une pathologie rare chez l’Homme décrite également en médecine vétérinaire chez le chien dans moins d’une vingtaine de rapports de cas. Dans la majorité des cas, cette inversion des organes n’est pas associée à des anomalies cardiaques à l’exception de la dextrocardie. Ce rapport présente l’un des rares cas de situs inversus complet avec une communication interventriculaire concomitante, accompagné d’une léthargie et d’anomalies oculaires.
Description
Une chienne croisée Epagneul femelle entière de 3 ans pesant 18 kg est référée au service de Cardiologie de l’École Nationale Vétérinaire de Maisons-Alfort par son vétérinaire traitant pour suspicion d’une communication interventriculaire membraneuse et pour investiguer l’évolution de la cardiopathie. La propriétaire rapporte depuis l’adoption une fatigabilité et une léthargie importantes. Par ailleurs, la chienne présente un bon appétit. Aucune toux ou autre difficulté respiratoire ne sont rapportées. En ce qui concerne son historique, la chienne a été importée de la Réunion à son jeune âge; trois des cinq chiots appartenant à sa portée sont mort-nés. Elle ne présente pas d’antécédant majeur à l’exception d’une démodécie prise en charge chez son vétérinaire traitant. Actuellement, elle est nourrie avec un aliment industriel de grande surface contenant un faible pourcentage de céréales (16 % de légumineuses et 10 % de céréales) et reçoit comme traitement quotidien du pimobendane à 0,14 mg/kg deux fois par jour depuis 4 mois.
A son examen clinique d’admission, la chienne présente à l’auscultation cardiaque une fréquence de 84 battements par minute et un souffle médiothoracique gauche de grade 5/6. L’auscultation respiratoire est sans anomalie, les muqueuses buccales et génitales sont roses. L’examen ophtalmologique met en évidence un strabisme bilatéral caractérisé par une déviation dorsale des globes oculaires (Figure 1), plus marquée à gauche, avec une motricité conservée et une absence de nystagmus. Une asymétrie de l’aspect des fonds d’œil est constatée avec un tapis de plus petite taille à gauche (Figure S1, disponible en ligne à partir de : www.canadianveterinarians.net). Aucune autre anomalie oculaire n’est observée.
Figure 1.
Déviation bilatérale des globes oculaires à l’examen clinique général. La motricité oculaire est conservée bilatéralement. Crédit photo : Service d’Ophtalmologie de l’École Nationale Vétérinaire de Maisons-Alfort.
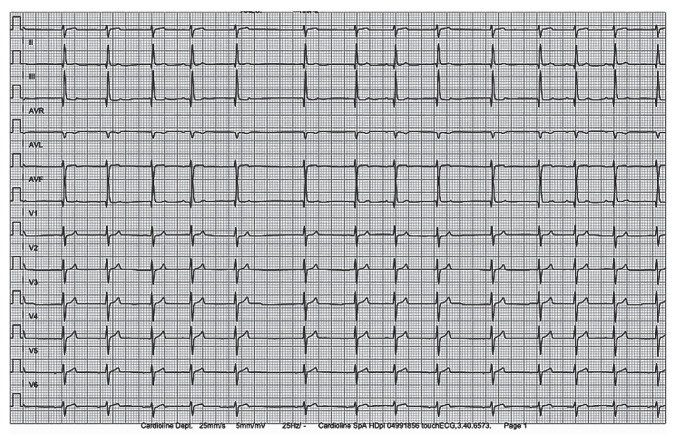
Afin d’explorer le souffle cardiaque, un bilan cardiologique incluant électrocardiogramme (ECG) et échocardiographie est proposé au propriétaire. L’ECG (12 dérivations, 25 mm/s, 5 mm/mV) révèle une arythmie sinusale respiratoire avec une onde P positive en DIII et une discrète déviation axiale droite à 110° (Figure 2). Les dérivations précordiales montrent une onde S dominante et une diminution de l’onde R de V1 à V6, ainsi que des complexes QRS-T similaires en DI et en V6 (1). A l’examen échocardiographique, l’ensemble des coupes obtenues habituellement à gauche sont obtenues à droite et inversement, laissant suspecter un positionnement du cœur dans l’hémithorax droit. L’échocardiographie révèle de plus une communication interventriculaire (CIV) membraneuse (type II) de petit diamètre (CIV/Ao = 0,13; limite de référence < 0,4) (2), modérément restrictive (Qp/Qs = 1,79; Qp/Qs ≥ 1,5 et < 2,2) (2) avec un shunt gauche-droit de haute vélocité en systole (5 m/sec) et un gradient interventriculaire physiologique (100 mmHg). Cette CIV s’associe à une discrète dilatation du ventricule droit (aire ventriculaire droite diastolique, obtenue à partir de la coupe apicale = 7,13 cm2; médiane de référence = 6,77 cm2) (3). Une dilatation ventriculaire gauche est également mise en évidence en diastole (VGdN = 1,9) (4) ainsi que des parois myocardiques (paroi libre et septum interventriculaire, respectivement) d’épaisseur dans les limites inférieures de la norme en systole (9,8 et 9,5 mm; intervalle de référence : 9–17 mm et 9–16 mm) (4) et en diastole (6,1 et 7,2 mm; intervalle de référence : 6–12 mm et 6–12 mm) (4), sans aucun signe d’hypokinésie (FR = 33 %). Aucune dilatation atriale n’est mise en évidence (rapport atrium gauche/aorte = 0,80; rapport atrium droit/atrium gauche = 0,7).
Figure 2.
ECG obtenu chez une chienne croisée de 3 ans présentant un situs inversus et une communication interventriculaire, 12 dérivations (I, II, III, aVR, aVL, aVF, V1, V2, V3, V4, V5, V6) – 25 mm/s – 5 mm/mV – Axe électrique moyen : +110°. Noter l’onde P positive en DIII.
En raison des images et mesures échocardiographiques et du tracé ECG obtenus ainsi que de la palpation du choc précordial à droite, l’hypothèse d’une dextrocardie associée ou non à un situs inversus complet, est suspectée. Le diagnostic différentiel des lésions oculaires, inclut une anomalie du développement embryonnaire prioritairement, une fibrose secondaire à une myosite des muscles extra-oculaires ou une autre atteinte neuromusculaire atypique.
En raison de la dilatation ventriculaire gauche constatée, le traitement au pimobendane est adapté (0,28 mg/kg deux fois par jour) tout en ajoutant du bénazépril (0,12 mg/kg une fois par jour) pour d’une part prévenir l’apparition d’insuffisance cardiaque et d’une autre contraster l’éventuelle activation du système rénine-angiotensine-aldostérone – la dilatation ventriculaire gauche pouvant dépendre en effet, de la surcharge volumique pulmonaire liée au shunt gauche-droit (5), tout comme du régime alimentaire non traditionnel (6). Un examen tomodensitométrique du thorax et de l’abdomen est programmé afin d’investiguer la présence d’une dextrocardie associée ou non à un situs inversus et mettre en évidence les éventuelles malformations extra-cardiaques associées. Enfin, un dosage des acides biliaires pré- et post-prandiaux est réalisé afin d’exclure le shunt porto-systémique comme possible cause de la léthargie, ce test s’avérant ensuite négatif.
Un suivi échocardiographique à 5 mois est planifié et ne montre pas d’évolution des anomalies cardiaques précédemment mentionnées. Afin de mieux décrire la topographie des organes et de leur vascularisation dans le contexte d’un probable situs inversus complet, un examen tomodensitométrique du thorax et de l’abdomen est réalisé le même jour, avec l’animal placé en décubitus sternal et sous anesthésie générale. Un scanner à 80 rangées (Aquilion lightning SP; Canon Medical System) est utilisé. Les paramètres d’acquisition consistent en un pas de 0,8, 123 mA et 120 kVp. Des acquisitions avant et après injection intraveineuse de produit de contraste iodé non ionique (2 mL/kg d’iohexol à 300 mgI/mL; Omnipaque, GE Healthcare) sont obtenues en utilisant des algorithmes de reconstruction tissu mous (1 mm d’épaisseur de coupe) et pulmonaire (1 mm d’épaisseur de coupe). Le protocole d’anesthésie est choisi à la discrétion des anesthésistes avec une prémédication réalisée par l’injection intraveineuse de 0,2 mg/kg de butorphanol, suivie d’une induction par l’administration intraveineuse de 0,2 mg/kg de midazolam et 1,5 mg/kg d’alfaxalone, puis maintenue par l’inhalation d’isoflurane (1–2 %). L’examen met en évidence un situs inversus complet caractérisé par une inversion de la latéralisation de l’ensemble des organes et de la vascularisation thoraciques et abdominaux (Figure 3 A, B). Aucune autre anomalie/malformation vasculaire n’est mise en évidence, excluant la présence d’un shunt porto-systémique. Une dilatation ventriculaire gauche sans dilatation atriale ainsi qu’une dilatation du tronc pulmonaire (TP) (ratio TP/Aorte = 1,4) sont également observées, associées à une visualisation limitée de la communication interventriculaire précédemment diagnostiquée. Enfin, une légère congestion veineuse est visible, sans évidence d’œdème pulmonaire compte tenu de l’apparence uniformément usuelle du parenchyme pulmonaire, et donc sans insuffisance cardiaque congestive gauche associée; la congestion est attribuée en priorité à une augmentation du flux dans les vaisseaux pulmonaires secondaire au shunt gauche-droit. Aucune autre anomalie n’est visualisée.
Figure 3.
Reconstructions multiplanaires dans un plan dorsal et transversal de l’examen tomodensitométrique du corps entier, en fenêtre tissulaire après injection de produit de contraste iodé. A – Corps entier. Noter l’apex du cœur pointant vers la droite du corps ainsi que l’inversion des organes abdominaux. B – Abdomen. Noter le positionnement de la rate à droite. Légendes : c – cœur; co – côlon; e – estomac; f – foie; r – rate; rei – rein gauche.
Au suivi à un an, la propriétaire rapporte une persistance de la fatigabilité ainsi que l’apparition de régurgitation depuis près d’un mois; l’examen clinique de la chienne est par ailleurs stable. L’ECG ne révèle toujours pas d’arythmie mais met en évidence une déviation axiale droite plus marquée (+120°) qu’à la première présentation. L’échocardiographie montre une dilatation ventriculaire gauche stable en systole (30,8 mm; 30,15 mm au précédent contrôle) mais discrètement augmentée en diastole par rapport au précédent contrôle (47,2 mm; 45,34 mm au précédent contrôle), motivant le rajout de spironolactone à la dose de 0,5 mg/kg une fois par jour pour contraster l’hypertrophie excentrique et la fibrose associée (7).
Discussion
Le situs inversus complet est une malformation congénitale rare qui correspond à l’inversion complète des organes thoraciques et abdominaux, produisant une image miroir anatomique de l’emplacement normal. Elle est notamment à différencier de la dextrocardie isolée avec estomac à gauche et foie à droite (8). Rapportée chez les humains à une fréquence de 0,01–0,02 % (9), elle est également mentionnée en médecine vétérinaire chez de nombreuses espèces. Sa prévalence dans l’espèce canine s’élève à 0,2 % d’après une large étude rétrospective (10). Elle est rapportée de manière anecdotique chez le chat, le rat, les chevaux, les bovins et les porcs (11–14). Aucune prédisposition raciale n’est mise en évidence dans l’espèce canine, le situs inversus étant décrit dans la littérature chez les races suivantes : cocker, golden retriever, shih tzu, Berger Allemand, Cavalier King Charles, teckel, chow chow, border collie et Doberman pinscher (9, 15–20). À la connaissance des auteurs, le nombre total de cas rapportés dans la littérature actuellement est de 18.
Fréquemment, cette entité est associée chez l’humain au syndrome de Kartagener (SK), une dyskinésie ciliaire primitive caractérisée par la triade clinique « sinusite, bronchectasie et situs inversus complet ou incomplet » (16). Une telle association est également décrite chez l’espèce canine, dans un certain nombre de cas cliniques (7 parmi les 18 mentionnés), tous présentant des signes cliniques compatibles avec une rhinite et/ou bronchite, notamment de la toux et du jetage nasal (9, 16–21). Dans le cas présent, l’absence de signe respiratoire et d’images en faveur d’une bronchopneumonie au scanner a exclu cette possibilité. En général, le diagnostic de SK associé au situs inversus se réalise au jeune âge (< 1 an) (15, 17–20) et plus rarement à l’âge adulte (9–16). Par exemple, dans l’article de Celona (9), cette association a été mise en évidence chez un cocker de 4 ans présenté dans un contexte de polyurie/polydipsie. De même, il est décrit un teckel de 4 ans diagnostiqué d’un situs inversus avec SK présentant des antécédents de troubles respiratoires chroniques (16).
Le situs inversus peut également être associé à des anomalies cardiaques congénitales, parfois complexes. Chez le chien, les anomalies cardiaques décrites sont : dysplasie tricuspidienne et sténose sous-aortique chez un golden retriever (17); sténose sous-aortique, dysplasie tricuspidienne et communication interventriculaire chez un chien croisé (22); sténose sous-aortique chez un chien de race non renseignée (10).
Quelques cas de situs inversus sans association avec le SK ou avec des malformations cardiaques sont également décrits chez le chien. Prédominent notamment des signes urinaires avec de l’incontinence urinaire et de la strangurie chez un dalmatien présentant une cystite (13) ou encore de la polyurie-polydipsie chez une shih tzu avec une pyélonéphrite et des lithiases vésicales (23). Des signes respiratoires non liés au SK sont également rapportés chez une chienne Dobermann ayant une hernie diaphragmatique congénitale et une polyarthrite (24). D’autres signes sont décrits en association avec un situs inversus : digestifs dans un cas d’intussusception (25) et de shunt portosystémique (26); signes neurologiques lors d’encéphalopathie (27). Enfin, le situs inversus a été décrit chez un chien de 3 ans asymptomatique en tant que découverte fortuite (13). Aucun signe oculaire n’est mentionné en association avec cette pathologie dans la littérature.
La clinique est assez peu évocatrice à des fins de diagnostic, souvent dominée par les signes de bronchite et rhinite liées au SK; ainsi, dans la majorité des cas décrits, la découverte d’un situs inversus a lieu dans le cadre de l’exploration de ces signes. En ce qui concerne la sémiologie, il est décrit dans la littérature une déviation droite du choc précordial (9, 22) comme observée dans le cas présent. Un souffle peut également être présent à l’examen clinique en cas de concomitance d’autre anomalie cardiaque congénitale (telle que la sténose sous-aortique ou la CIV), restant peu spécifique du situs inversus (22). A l’examen clinique de notre animal, il s’agissait d’un souffle médiothoracique de plus forte intensité à gauche, peu cohérent avec une première hypothèse de CIV isolée (normalement associée à un souffle médiothoracique de plus forte intensité à droite).
A l’examen radiographique du thorax, une inversion en miroir des organes thoraciques, avec l’apex du cœur pointant vers la droite de la ligne médiane (8, 9, 13, 16, 22, 24) et une position à gauche de la veine cave caudale ont été rapportées (17, 19). La silhouette cardiaque peut être élargie et arrondie (9, 17, 22) ou au contraire, préservée (13).
Cette inversion de latéralisation des organes est également retrouvée dans l’abdomen, avec notamment une position à droite du fundus et de la tête de la rate, visibles sur des radiographies abdominales (9, 16, 17, 19, 22, 23), comme à l’échographie abdominale (8, 13).
L’échocardiographie peut montrer une rotation partielle du cœur avec une position inversée des artères pulmonaires et de l’aorte (9); les coupes sont obtenues par l’abord thoracique opposé (par exemple, la coupe apicale grand axe est obtenue par abord droit alors que la coupe transventriculaire petit axe par abord gauche), suggérant une position en miroir du cœur dans le thorax (22). L’électrocardiogramme est également un examen très informatif dans la détection des situs inversus : il est décrit une onde P négative en DI, indiquant un nœud sinusal situé sur le côté gauche du cœur et une déviation vers la droite de l’axe électrique (8, 13, 22).
La description de l’usage du scanner dans la démarche diagnostique du situs inversus est relativement récente. En effet, Cavrenne et al. (19) décrit pour la première fois une position inversée de la veine azygos, de la veine cave crâniale, du tronc brachio-céphalique, des deux artères sous-clavières et de l’œsophage au scanner. Quelques années plus tard, l’étude de Piantedosi et al. (22) fait également mention de cet examen avec la mise en évidence d’une dextrocardie et d’une inversion complète des lobes pulmonaires et grands vaisseaux. Le scanner abdominal montre une inversion totale des organes et des vaisseaux abdominaux. Une des complications majeures de cette pathologie étant la bronchite due au SK, une endoscopie couplée à des biopsies ou un lavage broncho-alvéolaire sont fréquemment réalisés (17, 19, 20, 22).
En ce qui concerne le traitement des anomalies cardiaques associées au situs inversus, il est influencé par les malformations cliniques et altération échocardiographiques observées mais aucun consensus n’est établi. Dans notre cas, il a été décidé de mettre en place une polythérapie palliative, visant à prévenir l’insuffisance cardiaque à l’aide du pimobendane et benazépril tout en ajoutant la spironolactone notamment pour son effet anti-remodelage cardiaque (7).
Ce cas est le premier chez un chien mentionnant un situs inversus complet associé à une communication interventriculaire et des malformations oculaires concomitantes (une déviation dorsale bilatérale des globes oculaires et une asymétrie de l’aspect des fonds d’œil) ainsi qu’une léthargie dont la cause reste inconnue au moment de l’écriture de cet article.
Remerciements
Les auteurs souhaitent remercier chaleureusement le Dr Hahn du service d’imagerie de l’École Nationale Vétérinaire de Maisons-Alfort pour sa contribution lors de la démarche diagnostique et les images de tomodensitométrie. RVC
Footnotes
Du matériel supplémentaire non publié (Figure S1) est disponible en ligne à partir de : www.canadianveterinarians.net
L’usage du présent article se limite à un seul exemplaire pour étude personnelle. Les personnes intéressées à se procurer des réimpressions devraient communiquer avec le bureau de l’ACMV (hbroughton@cvma-acmv.org) pour obtenir des exemplaires additionnels ou la permission d’utiliser cet article ailleurs.
Références
- 1.Taboulet P. Situs inversus (monographie sur internet) e-cardiogram. 2020. [Dernier accès le 22/09/22]. Accessible sur https://www.e-cardiogram.com/situs-inversus/ 2019.
- 2.Bomassi E, Misbach C, Tissier R, et al. Signalment, clinical features, echocardiographic findings, and outcome of dogs and cats with ventricular septal defects: 109 cases (1992–2013) J Am Vet Med Assoc. 2015;247:166–175. doi: 10.2460/javma.247.2.166. [DOI] [PubMed] [Google Scholar]
- 3.Feldhütter E, Domenech O, Vezzosi T, et al. Echocardiographic reference intervals for right ventricular indices, including 3-dimensional volume and 2-dimensional strain measurements in healthy dogs. J Vet Intern Med. 2022;36:8–19. doi: 10.1111/jvim.16331. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Cornell C, Kittleson M, Della Torre P, et al. Allometric scaling of M-mode cardiac measurements in normal adult dogs. J Vet Intern Med. 2004;18:311–321. doi: 10.1892/0891-6640(2004)18<311:asomcm>2.0.co;2. [DOI] [PubMed] [Google Scholar]
- 5.Buchanan JW. Prevalence of cardiovascular disorders. In: Fox P, Sisson D, Moise S, editors. Textbook of canine and feline cardiology Principles and clinical practice. 2nd ed. Philadelphia, Pennsylvania: WB Saunders Company; 1999. p. 542. [Google Scholar]
- 6.Freeman L, Rush J, Adin D, et al. Prospective study of dilated cardiomyopathy in dogs eating nontraditional or traditional diets and in dogs with subclinical cardiac abnormalities. J Vet Intern Med. 2022;36:451–463. doi: 10.1111/jvim.16397. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Borgarelli M, Ferasin L, Lamb K. Delay of appearance of symptoms of canine degenerative mitral valve disease treated with spironolactone and benazepril: The DELAY Study. J Vet Cardiol. 2020;27:34–53. doi: 10.1016/j.jvc.2019.12.002. [DOI] [PubMed] [Google Scholar]
- 8.Almeida G, Freitas L, Santos A, Mattos A. Dextrocardia and situs inversus in a dog. Vet World. 2012;5:369–372. [Google Scholar]
- 9.Celona B, Crinò C, Bruno C, Di Pietro S, Giudice E. Renal amyloidosis associated with Kartagener syndrome in a dog. Top Companion Anim Med. 2017;32:61–65. doi: 10.1053/j.tcam.2017.03.001. [DOI] [PubMed] [Google Scholar]
- 10.Oliveira P, Domenech O, Silva J, Vannini S, Bussadori R, Bussadori C. Retrospective review of congenital heart disease in 976 dogs. J Vet Intern Med. 2011;25:477–483. doi: 10.1111/j.1939-1676.2011.0711.x. [DOI] [PubMed] [Google Scholar]
- 11.Shiraiwa K, Watanabe A, Sato N, Nito M, Kobayashi Y. Case report on situs inversus totalis in two Sprague-Dawley rats. Exp Anim. 1995;44:341–345. doi: 10.1538/expanim.44.341. [DOI] [PubMed] [Google Scholar]
- 12.Jerram R, Warman C, Wu C. Echocardiographic and radiographic diagnosis: Complete situs inversus in a cat. Vet Radiol Ultrasound. 2006;47:313–315. doi: 10.1111/j.1740-8261.2006.00146.x. [DOI] [PubMed] [Google Scholar]
- 13.Cahua J, Dias D, Gonzales-Viera O. Complete situs inversus in 2 asymptomatic dogs. Top Companion Anim Med. 2015;30:68–71. doi: 10.1053/j.tcam.2015.07.004. [DOI] [PubMed] [Google Scholar]
- 14.Buhl R, Koch J, Søland T, Eriksen L, Agerholm J, Maddox-Hyttel P. Complete situs inversus in a two-year old standardbred horse. Vet Rec. 2004;154:600–602. doi: 10.1136/vr.154.19.600. [DOI] [PubMed] [Google Scholar]
- 15.Afzelius B. Situs inversus and ciliary abnormalities. What is the connection? Int J Dev Biol. 1995;39:839–844. [PubMed] [Google Scholar]
- 16.Neil J, Canapp S, Cook C, Lattimer J. Kartagener’s syndrome in a Dachshund dog. J Am Anim Hosp Assoc. 2002;38:45–49. doi: 10.5326/0380045. [DOI] [PubMed] [Google Scholar]
- 17.Reichler I, Hoerauf A, Guscetti F, et al. Primary ciliary dyskinesia with situs inversus totalis, hydrocephalus internus and cardiac malformations in a dog. J Small Anim Pract. 2001;42:345–348. doi: 10.1111/j.1748-5827.2001.tb02471.x. [DOI] [PubMed] [Google Scholar]
- 18.Carrig C, Suter P, Ewing G, Dungworth D. Primary dextrocardia with situs inversus, associated with sinusitis and bronchitis in a dog. J Am Vet Med Assoc. 1974;164:1127–1134. [PubMed] [Google Scholar]
- 19.Cavrenne R, De Busscher V, Bolen G, Billen F, Clercx C, Snaps F. Primary ciliary dyskinesia and situs inversus in a young dog. Vet Rec. 2008;163:54–55. doi: 10.1136/vr.163.2.54. [DOI] [PubMed] [Google Scholar]
- 20.Durant A. What is your diagnosis? Thoracic and abdominal situs inversus totalis. J Am Vet Med Assoc. 2008;232:197–198. doi: 10.2460/javma.232.2.197. [DOI] [PubMed] [Google Scholar]
- 21.Afzelius B, Carlsten J, Karlsson S. Clinical, pathologic, and ultrastructural features of situs inversus and immotile-cilia syndrome in a dog. J Am Vet Med Assoc. 1984;184:560–563. [PubMed] [Google Scholar]
- 22.Piantedosi D, Cortese L, Meomartino L, Di Loria A, Ciaramella P. Situs inversus totalis associated with subaortic stenosis, restrictive ventricular septal defect, and tricuspid dysplasia in an adult dog. Can Vet J. 2011;52:1237–1242. [PMC free article] [PubMed] [Google Scholar]
- 23.Choi M, Hwang G, Yoo H, et al. Radiographic diagnosis-situs inversus of abdominal organs in a dog. Vet Radiol Ultrasound. 2001;42:423–425. doi: 10.1111/j.1740-8261.2001.tb00963.x. [DOI] [PubMed] [Google Scholar]
- 24.Witsberger T, Dismukes D, Kelmer E. Situs inversus totalis in a dog with a chronic diaphragmatic hernia. J Am Anim Hosp Assoc. 2009;45:245–248. doi: 10.5326/0450245. [DOI] [PubMed] [Google Scholar]
- 25.Hough J, Carlson B, Weitkamp R, McLean R. Situs inversus and intussusception in a dog. J Am Anim Hosp Assoc. 1979;15:335–337. [Google Scholar]
- 26.Oui H, Kim J, Bae Y, et al. Computed tomography angiography of situs inversus, portosystemic shunt and multiple vena cava anomalies in a dog. J Vet Med Sci. 2013;75:1525–1528. doi: 10.1292/jvms.13-0212. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Lohse C, Selcer R, Suter P. Hepatoencephalopathy associated with situs inversus of abdominal organs and vascular anomalies in a dog. J Am Vet Med Assoc. 1976;168:681–688. [PubMed] [Google Scholar]