Abstract
目的
探讨肉豆蔻木脂素(myrislignan, MYR)对胃癌细胞凋亡的影响及与磷脂酰肌醇-3-激酶(phosphatidylinositol 3 kinase, PI3K)/蛋白激酶B(protein kinase B, AKT)信号通路的关系。
方法
采用不同浓度的MYR(即0、25、50、100和200 μmol/L)作用胃癌细胞(SGC-7901)48 h和72 h,CCK8法检测细胞活性。选择MYR(50、100和200 μmol/L)作用胃癌细胞(SGC-7901)48 h,同时设置正常对照(Control)组和溶剂对照(0.1%DMSO)组,采用流式细胞仪检测凋亡率,蛋白质印迹法检测PI3K、AKT、Bcl2关联X蛋白(Bcl-2 associated X protein, BAX)、半胱天冬酶(cysteine-dependent aspartate-specifc protease, Caspase)-3和Caspase-9蛋白的表达水平。特异性PI3K激活剂(20 μmol/mL)作用胃癌细胞(SGC-7901)48 h(分组为:Control组、0.1%DMSO组、MYR组和MYR+PI3K激活剂组),观察其对MYR诱导胃癌细胞凋亡和调控PI3K、AKT、BAX、Caspase-3和Caspase-9蛋白表达的影响。
结果
与对照组比较,MYR在50、100和200 μmol/L时以剂量依赖关系抑制胃癌细胞增殖,诱导胃癌细胞凋亡,下调PI3K和AKT蛋白表达水平,上调BAX、Caspase-3和Caspase-9蛋白表达水平(P<0.05)。PI3K激活剂减弱了MYR诱导胃癌细胞凋亡和对PI3K、AKT、BAX、Caspase-3和Caspase-9蛋白表达的调控作用(P<0.05)。
结论
肉豆蔻木脂素通过抑制PI3K/AKT信号通路诱导BAX、Caspase-3和Caspase-9蛋白表达,促进胃癌细胞凋亡。
Keywords: 肉豆蔻木脂素, PI3K/AKT信号通路, 胃肿瘤, 细胞凋亡
Abstract
Objective
To investigate the effect of myrislignan (MYR) on the apoptosis of gastric cancer cell line and its relationship with phosphatidylinositol 3-kinase (PI3K)/protein kinase B (AKT) signaling pathway.
Methods
The gastric cells (SGC-7901) were treated with MYR at different concentrations, i.e., 0, 25, 50, 100, and 200 μmol/L, for 48 h and 72 h and the effect of MYR on the proliferation of SGC-7901 cells was measured by CCK-8 assay. Then, SGC-7901 cells were treated with different concentrations of MYR at 50, 100, and 200 μmol/L for 48 h. Meanwhile, a normal control group and a dimethyl sulfoxide (DMSO) solvent control group (0.1% DMSO) were established. Flow cytometry was used to determine the apoptosis rate of SGC-7901 cells. The protein expression levels of PI3K, AKT, Bcl-2-associated X protein (BAX), cysteine-dependent aspartate-specifc protease-3 (Caspase-3), and Caspase-9 were determined by Western blot. Then, PI3K activator (20 μmol/mL) was used to treat SGC-7901 cells for 48 h in 4 groups, the control group, 0.1% DMSO group, MYR group, and MYR+PI3K activator group, and the effect on MYR’s induction of apoptosis and regulation of the protein expression levels of PI3K, AKT, BAX, Caspase-3, and Caspase-9 in SGC-7901 cells.
Results
Compared with the control group, MYR at 50, 100 and 200 μmol/L inhibited the proliferation of gastric cancer cells, increased the apoptosis rate, down-regulated the protein expression levels of PI3K and AKT, and up-regulated the protein expression levels of BAX, Caspase-3, and Caspase-9 in a dose-dependent manner (P<0.05). However, PI3K activator attenuated MYR-induced apoptosis in gastric cancer cells and MYR’s regulation of PI3K, AKT, BAX, Caspase-3, and Caspase-9 protein expression (P<0.05).
Conclusion
MYR induces the expression of BAX, Caspase-3, and Caspase-9 proteins by inhibiting the PI3K/AKT signaling pathway, thereby promoting the apoptosis of gastric cancer cells.
Keywords: Myrislignan, PI3K/AKT signaling pathway, Stomach neoplasms, Apoptosis
胃癌(gastric cancer, GC)是一种恶性消化道肿瘤,具有发病率高、隐匿性强、进展快、预后差等特点,其发病率和死亡率分别排在肿瘤的第五位和第三位,严重威胁人类身体健康[1-2]。针对GC,现阶段临床上主要采用手术、手术联合放化疗和靶向药物等策略进行治疗,虽然这些治疗策略在一定程度上延长了GC患者的生存时间,但GC总体5年生存率仍不足10%[3-5]。因此急需探索新的治疗策略和药物。
近年来,随着植物天然化合物成为临床用药的重要来源,越来越多的天然化合物也被用于抗肿瘤的研究[6-7]。肉豆蔻木脂素(myrislignan, MYR)是从肉豆蔻科肉豆蔻属常绿乔木植物果实中提取的单体化合物[7]。研究显示MYR具有抗炎[8]、抗寄生虫[9]和保肝[10]等多种生物活性。此外,LU等[7]研究发现MYR可诱导肺癌细胞凋亡,初步证实MYR具有抗肿瘤活性。但MYR能否诱导胃癌细胞凋亡及相关机制,现阶段还未见报道。磷脂酰肌醇-3-激酶(phosphatidylinositol 3 kinase, PI3K)/蛋白激酶B(protein kinase B, AKT)信号通路是一条经典且重要的肿瘤细胞抗凋亡信号通路,在胃癌细胞中PI3K/ATK信号通路可通过调控B细胞淋巴瘤2家族蛋白和半胱天冬酶(cysteine-dependent aspartate-specifc protease, Caspase)家族蛋白的表达,进而增强胃癌细胞抗凋亡能力[11]。但MYR能否通过PI3K/AKT信号通路调控胃癌细胞凋亡还未阐明。因此本研究以胃癌细胞(SGC-7901)为研究模型,探讨MYR调控胃癌细胞凋亡的作用和机制,为MYR的进一步研究和临床转化提供实验基础。
1. 材料与方法
1.1. 实验材料
1.1.1. 细胞系
胃癌细胞(SGC-7901)购自武汉普诺赛生命科技有限公司。
1.1.2. 主要试剂
肉豆蔻木脂素(粉末)购自成都植标化纯生物技术有限公司,纯度98%;DMEM高糖培养基购自武汉赛维尔生物科技有限公司;胎牛血清购自Cellmax公司;青链霉素购自hyclone公司;CCK8试剂盒购自biosharp公司;PI3K激活剂购自MCE公司;兔抗PI3K抗体和兔抗AKT抗体购自CST公司,兔抗BAX抗体、兔抗Caspase-3抗体和兔抗Caspase-9抗体购自武汉爱博泰克生物科技有限公司;Easy PAGE彩色快速凝胶配制试剂盒购自赛文创新(北京)生物科技有限公司;一抗稀释液、二抗稀释液、封闭液、SDS-PAGE电泳液和SDS-PAGE转膜缓冲液购自武汉赛维尔生物科技有限公司;HPR-羊抗兔IgG购自北京中杉金桥生物技术有限公司;ECL发光液和PVDF膜购自美国BIO-RAD公司;AnnexinⅤ-APC/PI凋亡试剂盒购自杭州联科生物技术股份有限公司。
1.1.3. 主要设备
流式细胞仪购自Beckman公司;凝胶成像系统购自美国BIO-RAD公司;蛋白电泳仪购自北京八一实验仪器厂;酶标仪购自TECAN公司;细胞培养箱购自上海一恒仪器有限公司公司;生物安全柜购自北京东联哈尔仪器制造有限公司。
1.2. 实验方法
1.2.1. MYR对SGC-7901活性的影响
将SGC-7901按1×105 mL−1接种至96孔板中,0.1 mL/孔,培养24 h分组。实验分为6组:正常对照(Control)组、二甲基亚砜(dimethyl sulfoxide, DMSO)溶剂对照(0.1%DMSO)组和MYR(200、100、50和25 μmol/L)组;MYR溶液配制:MYR粉末溶于含0.1%DMSO的细胞培养基中备用。根据实验分组加入相应浓度DMSO和MYR溶液,分别作用48 h和72 h,加入CCK8试剂作用1 h后,在酶标仪450 nm处读取光密度(OD)值,并计算细胞活性。细胞活性=(实验组OD值−空白孔OD值)/(正常对照组OD值−空白孔OD值)。
1.2.2. 流式细胞仪检测SGC-7901的凋亡
将SGC-7901按5×105 mL−1接种至6孔板中,2 mL/孔,培养24 h分为5组:正常对照(Control)组、溶剂对照(0.1%DMSO)组、MYR(200 μmol/L)组、MYR(100 μmol/L)组和MYR(50 μmol/L)组;根据实验分组加入相应浓度DMSO和MYR溶液,作用48 h。将MYR处理的细胞常规消化后,制备成细胞悬液;细胞悬液样本经250×g离心5 min,弃上清液,然后用1×PBS洗涤2次,250×g离心5 min,弃上清液,获得细胞沉淀。细胞沉淀用100 μL 1×Binding Buffer重悬后,加入5 μL AnnexinⅤ-APC轻轻吹匀,再加入5 μL PI混匀,室温避光孵育10 min,加入400 μL 1×Binding Buffer轻轻混匀,上机检测,检测结果经CytExpert软件分析细胞早期和晚期凋亡的百分比。
1.2.3. Western blot检测PI3K、AKT、BAX、Caspase-3和Caspase-9的表达
实验分组同1.2.2。将MYR处理的细胞用预冷的RIPA裂解液裂解并制备成Western blot上样样品。样品经SDS-PAGE凝胶电泳后,转至聚偏二氟乙烯膜(PVDF)上;PVDF膜经TBST洗涤及封闭液封闭,然后对应加入1∶1000稀释的PI3K、AKT、BAX、Caspase-3和Caspase-9抗体,4 ℃孵育过夜;PVDF膜经TBST漂洗后加入HRP-羊抗兔IgG(1∶8000),室温孵育60 min;PVDF膜经TBST漂洗后,加入ECL发光液于凝胶成像系统中采集图像;使用Image J软件分析蛋白条带灰度值,以目的蛋白条带灰度值与内参蛋白(β-actin)条带灰度值的比值作为目的蛋白的相对表达量。
1.2.4. PI3K激活剂对MYR诱导SGC-7901凋亡的影响
将SGC-7901按5×105 mL−1接种至6孔板中,2 mL/孔,培养24 h分为4组:正常对照(Control)组、溶剂对照(0.1%DMSO)组、MYR(200 μmol/L)组和MYR(200 μmol/L)+PI3K激活剂(20 μmol/L)组;根据实验分组加入相应浓度DMSO、MYR和PI3K激活剂,作用48 h。采用流式细胞仪检测各组SGC-7901的凋亡,方法同1.2.2;采用Western blot检测PI3K、AKT、BAX、Caspase-3和Caspase-9蛋白的表达(方法同1.2.3)。
1.3. 统计学方法
计量数据以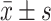 表示。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
表示。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2. 结果
2.1. MYR对SGC-7901活性的影响
如图1所示,与对照组比较,在48 h和72 h时,MYR浓度在50、100和200 μmol/L时可显著抑制SGC-7901的活性,且MYR浓度越高抑制效果越明显(P<0.05);溶剂对照组和MYR (25 μmol/L)组与对照组比较无明显差异(P>0.05);表明MYR浓度在50 μmol/L及以上时可抑制胃癌细胞的活性。
图 1.
The effect of MYR on the viability of gastric cancer cell line (SGC-7901)
MYR对SGC-7901活性的影响
* P<0.05, vs. control group; # P<0.05, vs. lower MYR dosage group. n=3.
2.2. MYR对SGC-7901凋亡的影响
细胞凋亡检测结果显示,与对照组比较,溶剂对照组SGC-7901凋亡率未见明显变化(P>0.05);MYR(50、100和200 μmol/L)组SGC-7901凋亡率升高,MYR(200 μmol/L)组与MYR(100 μmol/L)组比较差异有统计学意义(P<0.05)。见图2。
图 2.
The effect of MYR on the apoptosis of gastric cancer cell line (SGC-7901)
MYR对SGC-7901凋亡的影响
A: Control group; B: 0.1% DMSO group; C: MYR (200 μmol/L) group; D: MYR (100 μmol/L) group; E: MYR (50 μmol/L) group; F: the bar chart of apoptosis rate. * P<0.05, vs. control group; # P<0.05, vs. MYR (100 μmol/L) group. n=3.
2.3. MYR对SGC-7901中PI3K、AKT、BAX、Caspase-3和Caspase-9蛋白表达的影响
Western blot检测结果(图3)显示,与对照组比较,溶剂对照组SGC-7901中PI3K、AKT、BAX、Caspase-3和Caspase-9蛋白表达水平无明显变化(P>0.05);MYR(50、100和200 μmol/L)组SGC-7901中PI3K和AKT蛋白表达水平下调(P<0.05),BAX、Caspase-3和Caspase-9蛋白表达水平上调(P<0.05);且随MYR浓度升高上述变化越明显(P<0.05)。表明MYR可抑制SGC-7901中PI3K和AKT蛋白表达,促进BAX、Caspase-3和Caspase-9蛋白表达。
图 3.

The protein expression levels of PI3K, AKT, BAX, Caspase-3, and Caspase-9
PI3K、AKT、BAX、Caspase-3和Caspase-9蛋白表达水平
* P<0.05, vs. control group; # P<0.05, vs. lower MYR dosage group. n=3.
2.4. PI3K激活剂对MYR诱导SGC-7901凋亡的影响
细胞凋亡检测结果显示,与对照组比较,溶剂对照组SGC-7901凋亡率未见明显变化(P>0.05);MYR(200 μmol/L)和MYR(200 μmol/L)+PI3K激活剂组SGC-7901凋亡率升高(P<0.05);MYR(200 μmol/L)组SGC-7901凋亡率高于MYR(200 μmol/L)+PI3K激活剂组(P<0.05)。表明PI3K激活剂逆转了MYR诱导胃癌细胞凋亡。见图4。
图 4.

The effect of PI3K activator on MYR-induced apoptosis of gastric cancer cell line (SGC-7901)
PI3K激活剂对MYR诱导SGC-7901凋亡的影响
A: Control group; B: 0.1% DMSO group; C: MYR (200 μmol/L) group; D: MYR (200 μmol/L)+PI3K activator group; E: the bar chart of apoptosis rate. * P<0.05, vs. control group; # P<0.05, vs. MYR (200 μmol/L) group. n=3.
2.5. PI3K激活剂对MYR调控SGC-7901中PI3K、AKT、BAX、Caspase-3和Caspase-9蛋白表达的影响
Western blot检测结果显示,与对照组比较,溶剂对照组SGC-7901中PI3K、AKT、BAX、Caspase-3和Caspase-9蛋白表达水平未见明显变化(P>0.05);MYR(200 μmol/L)和MYR(200 μmol/L)+PI3K激活剂组SGC-7901中PI3K和AKT蛋白表达下调,BAX、Caspase-3和Caspase-9蛋白表达上调(P<0.05);MYR(200 μmol/L)组SGC-7901中PI3K和AKT蛋白表达水平低于MYR(200 μmol/L)+PI3K激活剂组,BAX、Caspase-3和Caspase-9蛋白表达水平高于MYR(200 μmol/L)+PI3K激活剂组。表明PI3K激活剂减弱了MYR对SGC-7901中PI3K、AKT、BAX、Caspase-3和Caspase-9蛋白的调控作用。见图5。
图 5.

The effect of PI3K activator on MYR's regulation of the protein expression of PI3K, AKT, BAX, Caspase-3, and Caspase-9
PI3K激活剂对MYR调控PI3K、AKT、BAX、Caspase-3和Caspase-9蛋白表达的影响
* P<0.05, vs. control group; # P<0.05, vs. MYR (200 μmol/L) group. n=3.
3. 讨论
胃癌是一种常见恶性肿瘤,由于早期诊断率低和晚期治疗策略有限,进展期患者5年生存率不足10%,因此急需探索新的治疗药物和策略[7]。随着传统医学的发展,越来越多的药用植物成分被用于抗肿瘤研究,并被证实具有抗肿瘤效果,且毒副作用小[12]。MYR是肉豆蔻的主要活性成分之一,具有多种药理活性,近年来研究发现MYR具有诱导肺癌细胞凋亡的作用[8-10]。本研究发现MYR可以抑制胃癌细胞的增殖活性,进一步研究表明MYR是通过抑制PI3K/AKT通路调控BAX、Caspase-3和Caspase-9等蛋白表达,进而促进胃癌细胞凋亡,发挥抑癌效果。
凋亡是基因控制的细胞程序性死亡,由于肿瘤细胞凋亡基因及其上游信号通路蛋白异常表达,导致肿瘤细胞出现抗凋亡能力,进而无限增殖[13]。PI3K/AKT信号通路是调控细胞增殖和凋亡的重要信号通路之一,当PI3K/AKT信号通路活化后会抑制BAX、Caspase-3和Caspase-9等促凋亡蛋白的表达和活化,进而增强肿瘤细胞的抗凋亡能力,促进肿瘤的发生发展[14-16]。近年来,诸多文献报道显示,在胃癌细胞和组织中PI3K/AKT会异常高表达和活化,而通过抑制PI3K/AKT的表达水平可诱导胃癌细胞的凋亡和抑制胃癌细胞增殖[17-19]。YU等[20]研究显示滋阴化痰复方通过抑制PI3K蛋白的表达,抑制PI3K/AKT通路活化,上调BAX蛋白诱导胃癌细胞凋亡。此外,ZHOU等[21]的研究也发现凋亡素衍生肽可诱导胃癌细胞凋亡,其作用机制也与抑制PI3K和AKT蛋白表达有关。本研究中通过CCK8实验检测发现50 μmol/L及以上的MYR以剂量依赖关系抑制胃癌细胞(SGC-7901)的增殖,通过流式细胞仪检测发现MYR可以诱导胃癌细胞(SGC-7901)凋亡,表明MYR可通过诱导胃癌细胞凋亡,发挥抗胃癌的作用;进一步研究显示MYR通过抑制PI3K和AKT蛋白的表达,上调促凋亡蛋白BAX、Caspase-3和Caspase-9等,诱导胃癌细胞凋亡;而介入PI3K激活剂后,MYR抑制PI3K和AKT蛋白表达以及上调促凋亡蛋白BAX、Caspase-3和Caspase-9的能力被部分抑制。
综上所述,本研究表明MYR可抑制PI3K和AKT蛋白的表达,促进BAX、Caspase-3和Caspase-9等蛋白表达,诱导胃癌细胞(SGC-7901)凋亡;PI3K激活剂反证实验进一步证实MYR的促凋亡作用是通过抑制PI3K/AKT通路实现的。虽然本研究揭示了MYR诱导胃癌细胞凋亡的部分机制,但存在以下不足:①只观察了MYR对胃癌细胞增殖和凋亡的作用,未观察对胃癌细胞能量代谢异常、上皮间充质转换等恶性行为的影响;②相对于体外环境,体内环境更复杂,MYR能否发挥同样的效果,仍需进一步研究;③仅观察了MYR对PI3K、AKT、BAX、Caspase-3和Caspase-9蛋白的调控,MYR调控其它分子蛋白需进一步探索。因此接下来本课题组将通过蛋白组学全面研究MYR对胃癌转移、增殖、抗凋亡和能量代谢相关分子的影响,同时进行体内实验研究,深入阐明MYR的效应和机制,为胃癌的防治提供更多的策略和更多的分子靶点。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
西藏自治区自然科学基金(No. 2016ZR-15-2)资助
Contributor Information
永君 周 (Yong-jun ZHOU), Email: 821079676@qq.com.
明江 别 (Ming-jiang BIE), Email: 13941057@qq.com.
References
- 1.SMYTH E C, NILSSON M, GRABSCH H I, et al Gastric cancer. Lancet. 2020;396(10251):635–648. doi: 10.1016/S0140-6736(20)31288-5. [DOI] [PubMed] [Google Scholar]
- 2.JOSHI S S, BADGWELL B D Current treatment and recent progress in gastric cancer. CA Cancer J Clin. 2021;71(3):264–279. doi: 10.3322/caac.21657. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.ALSHEHRI A, ALANEZI H, KIM B S Prognosis factors of advanced gastric cancer according to sex and age. World J Clin Cases. 2020;8(9):1608–1619. doi: 10.12998/wjcc.v8.i9.1608. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.SEENEEVSSEN L, BESSEDE E, MEGRAUD F, et al Gastric Cancer: Advancesin Carcinogenesis Research and New Therapeutic Strategies. Int J Mol Sci. 2021;22(7):3418–3442. doi: 10.3390/ijms22073418. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.HACKER U, HOFFMEISTER A, LORDICK F Gastric cancer: diagnosis and current treatment strategies. Dtsch Med Wochenschr. 2021;146(23):1533–1537. doi: 10.1055/a-1169-0440. [DOI] [PubMed] [Google Scholar]
- 6.SHI C, YANG E J, TAO S, et al Natural products targeting cancer cell dependency. J Antibiot. 2021;74(10):677–686. doi: 10.1038/s41429-021-00438-x. [DOI] [PubMed] [Google Scholar]
- 7.LU X, YANG L, CHEN J, et al The action and mechanism of myrislignan on A549 cells in vitro and in vivo. J Nat Med. 2017;71(1):76–85. doi: 10.1007/s11418-016-1029-6. [DOI] [PubMed] [Google Scholar]
- 8.JIN H, ZHU Z G, YU P J, et al Myrislignan attenuates lipopolysaccharide-induced inflammation reaction in murine macrophage cells through inhibition of NF-κB signalling pathway activation. Phytother Res. 2012;26(9):1320–1326. doi: 10.1002/ptr.3707. [DOI] [PubMed] [Google Scholar]
- 9.ZHANG J, CHEN J, LV K, et al Myrislignan induces redox imbalance and activates autophagy in Toxoplasma gondii. Front Cell Infect Microbiol. 2021;11:730222. doi: 10.3389/fcimb.2021.730222. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.YANG X N, LIU X M, FANG J H, et al PPARα mediates the hepatoprotective effects of nutmeg. J Proteome Res. 2018;17(5):1887–1897. doi: 10.1021/acs.jproteome.7b00901. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.ZHANG L, JIA B, VELU P, et al Corilagin induces apoptosis and inhibits HMBG1/PI3K/AKT signaling pathways in a rat model of gastric carcinogenesis induced by methylnitronitrosoguanidine. Environ Toxicol. 2022;37(5):1222–1230. doi: 10.1002/tox.23478. [DOI] [PubMed] [Google Scholar]
- 12.TAN W, LU J, HUANG M, et al Anti-cancer natural products isolated from chinese medicinal herbs. Chin Med. 2011;6(1):27–36. doi: 10.1186/1749-8546-6-27. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.CARNEIRO B A, El-DEIRY W S Targeting apoptosis in cancer therapy. Nat Rev Clin Oncol. 2020;17(7):395–417. doi: 10.1038/s41571-020-0341-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.LIU R, CHEN Y, LIU G, et al PI3K/AKT pathway as a key link modulates the multidrug resistance of cancers. Cell Death Dis. 2020;11(9):797–808. doi: 10.1038/s41419-020-02998-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.方正月, 杨凯, 赵丹, 等 LncRNA CASC9高表达激活PI3K/AKT信号通路促进口腔鳞癌细胞增殖转移. 重庆医科大学学报. 2019;44(7):898–904. doi: 10.13406/j.cnki.cyxb.002169. [DOI] [Google Scholar]
- 16.姚红兵, 肖芳, 郭威, 等 FAK抑制剂对肝癌HCC-LM3细胞骨架重排和侵袭的作用机制. 中山大学学报(医学科学版). 2021;42(3):364–372. doi: 10.13471/j.cnki.j.sun.yat-sen.univ(med.sci).2021.0106. [DOI] [Google Scholar]
- 17.JIA X, WEN Z, SUN Q, et al Apatinib suppresses the proliferation and apoptosis of gastric cancer cells via the PI3K/Akt signaling pathway. J BUON. 2019;24(5):1985–1991. [PubMed] [Google Scholar]
- 18.SONG M, BODE A M, DONG Z, et al AKT as a therapeutic target for cancer. Cancer Res. 2019;9(6):1019–1031. doi: 10.1158/0008-5472.CAN-18-2738. [DOI] [PubMed] [Google Scholar]
- 19.CHEN W, ZHANG Y, GU X, et al Qi Ling decoction reduces gastric cancer cell metastasis by inhibiting MMP-9 through the PI3K/Akt signaling pathway. Am J Transl Res. 2021;13(5):4591–4602. [PMC free article] [PubMed] [Google Scholar]
- 20.YU J, SONG S, JIAO J, et al ZiYinHuaTan recipe inhibits cell proliferation and promotes apoptosis in gastric cancer by suppressing PI3K/AKT pathway. Biomed Res Int. 2020;2020:2018162. doi: 10.1155/2020/2018162. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.ZHOU D, LIU W, LIANG S, et al Apoptin-derived peptide reverses cisplatin resistance in gastric cancer through the PI3K-AKT signaling pathway. Cancer Med. 2018;7(4):1369–1383. doi: 10.1002/cam4.1380. [DOI] [PMC free article] [PubMed] [Google Scholar]




