Abstract
目的
探讨鞘氨醇激酶-1(SPHK1)在胃癌(GC)组织中的表达及其靶向核因子-κB(NF-κB)调控GC细胞迁移和侵袭能力的分子机制。
方法
基于TIMER2.0、GEPIA与HPA数据库分析SPHK1在GC组织中的表达。使用Kaplan-Meier Plotter数据库预测SPHK1与GC患者预后的关联。利用IHC检测GC及癌旁组织中SPHK1和MKI67的表达并分析两者相关性。运用Western blotting与qRT-PCR检测GC各细胞系中SPHK1蛋白及mRNA水平。基因富集通路数据库检索SPHK1对GC进展的生物学功能。使用慢病毒敲低HGC-27/过表达MGC-803细胞中SPHK1的表达;采用细胞划痕实验探究SPHK1对GC细胞迁移能力的影响;Transwell实验探究SPHK1对GC细胞迁移和侵袭能力的作用;通过Western blotting检测各蛋白表达情况。体内成瘤实验中,将裸鼠随机分为shNC组、shSPHK1组、oeNC组与oeSPHK1组,利用稳转株验证SPHK1的促癌作用。
结果
生物信息学表明SPHK1在GC组织中显著高表达(P<0.001);同时高表达的SPHK1预示着较差的总生存期(P<0.001)和进展后总生存期(P<0.001)以及更差的无复发生存期(P<0.001)。IHC结果表明GC组织中SPHK1与MKI67表达明显上调(P<0.001)且呈正相关(P<0.001)。基因富集通路数据库提示,SPHK1参与GC中的细胞黏附、迁移及血管生成等,且NF-κB参与GC进展(P<0.05)。细胞实验数据显示,抑制SPHK1减弱GC细胞的迁移和侵袭能力,而过表达SPHK1会产生相反的结果(P<0.01);SPHK1正向调节磷酸化P65 (p-P65)、血管内皮生长因子(VEGFA)和白细胞介素(IL-17)蛋白表达(P<0.05);利用PDTC阻断NF-κB信号通路可削弱SPHK1促进的GC细胞迁移与侵袭能力以及各蛋白表达水平(P<0.01);动物实验表明,与NC组相比,shSPHK1组肿瘤大小和质量明显减小,而oeSPHK1组显著增加(P<0.001)。
结论
SPHK1可靶向NF-κB信号通路表达进而调控GC细胞的迁移与侵袭,提示SPHK1可能是GC进展的潜在诊断分子标志物。
Keywords: 胃癌, 鞘氨醇激酶-1, NF-κB, 迁移, 侵袭
Abstract
Objective
To investigate the role of sphingosine kinase-1 (SPHK1) in regulating migration and invasion of gastric cancer (GC) cells.
Methods
TIMER2.0, GEPIA and HPA databases were used to investigate SPHK1 expression in GC, and its association with prognosis of the patients was analyzed using Kaplan-Meier Plotter database. In 40 clinical GC and adjacent tissue samples, SPHK1 and MKI67 expressions were detected with immunohistochemistry, Western blotting, and RT-qPCR. Gene enrichment pathway analysis was conducted to explore the biological functions of SPHK1. In HGC-27 and MGC-803 cells, the effects of lentivirus-mediated SPHK1 knockdown or overexpression on cell migration and invasion and expressions of key proteins in the nuclear factor-κB (NF-κB) signaling were evaluated using cell scratch test, Transwell assays and Western blotting. The changes in tumorigenic capacity of the transfected GC cells were evaluated in nude mice.
Results
SPHK1 was highly expressed in GC tissues in negative correlation with overall survival, overall survival after progression, and relapse-free survival of the patients (all P<0.001). In clinical GC samples, SPHK1 and MKI67 expressions showed a positive correlation (P=0.00049) and were both significantly up-regulated (P<0.001). Gene enrichment pathway analysis suggested the involvement of SPHK1 in cell adhesion, migration, angiogenesis and the NF-κB pathway (P<0.05). In the cell experiment, SPHK1 knockdown significantly decreased while SPHK1 overexpression enhanced migration and invasion abilities of the GC cells. SPHK1 positively regulated the expressions of phosphorylated P65 (P-P65), VEGFA and IL-17, and blocking the NF-κB pathway by PDTC significantly lowered migration and invasion ability of the cells. In nude mice, the GC cells with SPHK1 knockdown resulted in significantly reduced tumor size and mass, while the SPHK1-overexpressing cells showed enhanced tumorigenicity.
Conclusion
SPHK1 regulates migration and invasion of GC cells via the NF-κB signaling pathway and may serve as a potential diagnostic marker for GC progression.
Keywords: gastric cancer, sphingosine kinase-1, NF-κB, migration, invasion
胃癌(GC)是消化系统中最常见的恶性肿瘤之一[1]。据调查,GC在全球发病率呈逐年递增趋势[2]。其发病率和死亡率在中国所有癌症类型中排名第3,占全球GC新发病例和相关死亡病例的44.0%和48.6%[3]。GC患者多采用手术治疗、放化疗以及免疫治疗,但临床疗效及预后不佳[4,5]。高侵袭与转移性能力是肿瘤保持恶性的重要特征。然而到目前为止,导致癌症转移的复杂机制还远远没有被完全理解。因此,为明确GC转移机制急需寻找潜在的治疗靶点。
鞘氨醇激酶1(SPHK1)是一种保守的脂质激酶,可将鞘氨醇磷酸化进而生成鞘氨醇-1-磷酸,已被发现在肿瘤进展不同阶段中发挥着各种功能[6]。SPHK1是SPHK家族蛋白中的一员,是介导细胞各个方面的关键信号分子,并在多种致癌过程中发挥核心作用,包括细胞增殖、迁移与侵袭[7, 8]。据研究,SPHK1是结直肠癌细胞中的激活因子,通过调控特定信号通路表达来促进癌症发生发展[9-11]。在胰腺癌组织中,SPHK1表达上升,并通过分析患者ROC曲线表明低生存率与高表达的SPHK1密切相关[12]。SPHK1在非小细胞肺癌组织和细胞系中表达上调。过表达SPHK1增加了癌细胞的增殖和迁移能力[13]。核因子-κB(NF-κB)是转录因子家族中的一员,是免疫、炎症和癌症的关键调节因子[14]。抑制鼻咽癌细胞中NF-κB信号转导作用,可大大降低靶基因对癌细胞的增殖、侵袭能力[15]。同时,NF-κB通路的激活增加了卵巢癌中TRIM52对肿瘤介导的恶性行为[16]。然而,尚不清楚SPHK1是否与GC恶性进展过程中的NF-κB信号通路有关,因而需要对SPHK1进行深入探究。本研究旨在利用生物数据库与体内外实验分析SPHK1在GC发生发展中的作用及其潜在的通路分子机制,从而为GC治疗带来新方向。
1. 材料和方法
1.1. 材料
1.1.1. 患者样本
选取2023年6月~12月在蚌埠医科大学第一附属医院胃肠外科行手术切除的GC患者40例(男28例,女12例,年龄35~75岁),经患者术前书面知情同意后获得该40例患者的非癌性胃组织样本(术中病理切片结果证实为正常组织)纳入本研究。从医疗记录中检索患者临床特征,包括性别、年龄、肿瘤大小和肿瘤分期等(表1)。本研究经蚌埠医科大学伦理委员会批准[伦理批号: 第(2023)311,(2023)405号]。
表1.
SPHK1在GC中的表达与临床病理特征的关系
Tab.1 Clinicopathological characteristics of GC patients (n=40)
| Characteristic | Clinicopathological characteristics | |
|---|---|---|
| n | Percentage (%) | |
| Gender | ||
| Male | 28 | 70 |
| Female | 12 | 30 |
| Age (year) | ||
| ≥60 | 24 | 60 |
| <60 | 16 | 40 |
| Tumor size (cm) | ||
| ≥5.0 | 22 | 55 |
| <5.0 | 18 | 45 |
| Clinical stage | ||
| I+II | 14 | 35 |
| III+IV | 26 | 65 |
| N stage | ||
| N0 | 10 | 25 |
| N1+N2+N3 | 30 | 75 |
1.1.2. 主要试剂
PDTC(MCE);RPMI 1640培养基、胰酶、胎牛血清(Gibco);小鼠多克隆抗体SPHK1、P65、p-P65、p-PI3K、MKI67以及单克隆抗体GAPDH、PI3K、VEGFA、IL-17 (Proteintech);总RNA提取试剂盒、逆转录、定量PCR试剂盒(Novoprotein)。引物合成于生工生物工程(上海)股份有限公司。慢病毒合成于上海吉玛制药技术有限公司。
1.2. 方法
1.2.1. 公共数据库检索
TIMER2.0 (http://timer.cistrome.org)数据库分析SPHK1在泛癌中的表达。GEPIA(http://gepia. cancer-pku.cn)数据库搜索SPHK1相关基因表达及关联。HPA(https://www.proteinatlas.org)数据库检索SPHK1与MKI67的IHC结果。Kaplan-Meier plotter(https://kmplot.com)数据库预测GC患者预后。cBioportal(https://www.cbioportal.org)数据库下载与SPHK1在GC中共表达的前500个潜在靶基因。DAVID(https://david.ncifcrf.gov)数据库分析检索生物富集通路。微生信(http://www.bioinformatics.com.cn)网站在线编辑处理下载数据并产生气泡图。KEGG (https://www. kegg.jp)数据库检索相关信号通路。
1.2.2. 免疫组织化学(IHC)
IHC检测组织中SPHK1与MKI67的表达。临床40例GC组织和40例匹配的非癌性组织按照标准程序进行操作。具体步骤如固定、脱水、包埋、制片、染色等,经一抗(SPHK1/1∶200,MKI67/1∶2000)、二抗(山羊抗兔ZSGB-BIO/1∶3000)孵育后进行DAB染色,然后显色并采集图片评分。所有切片由2名病理科医师独立进行盲审评分。同样染色操作评分可参考张浩等[17]的研究。
1.2.3. 细胞培养
人GC细胞株MGC-803、AGS、MKN-1、HGC-27与正常胃上皮细胞GES-1均购自中国科学院上海生命科学研究院,均在RPMI 1640完全培养液中于37 ℃、5%CO2的恒温细胞培养箱中培养,待细胞生长至合适密度时消化传代。
1.2.4. Western blotting
提取细胞蛋白并进行浓度测定。取等量的蛋白样品进行电泳,电泳完成后将蛋白凝胶转移至0.45 μm的PVDF膜上进行转膜。结束后将其浸入封闭液中封闭60 min。3次洗膜后,加入稀释相应一抗并在4℃冰箱中过夜孵育。次日洗膜,与二抗稀释室温摇床孵育90 min。洗膜后检测PVDF膜上的蛋白印迹信号。
1.2.5. qRT-PCR
提取细胞RNA并测定浓度和纯度,将其逆转录为cDNA。将得到的cDNA以GAPDH为内参,按照试剂盒操作方法进行qRT-PCR,检测目的基因表达情况。采用相对定量的方法(2-ΔΔCT) 计算基因的mRNA表达水平。相应引物序列如下:SPHK1引物上游:5'-TGGCATCTGCTGAACTCATTT-3';下游:5'-TGC AGCGAGGTCTAATTGTTT-3';GAPDH引物上游:5'-GAGAAGTATGACA CAGCCTCAA-3';下游:5'-GC CATCACGCCTG ACA GTTT-3'。
1.2.6. SPHK1的RNA干扰和过表达
将人GC细胞系HGC-27与MGC-803进行铺板,当培养密度达到70%~80%,然后分别采用SPHK1干扰(载体:GV382)、过表达(载体:GV492)和对照慢病毒载体对上述细胞进行敲低与过表达转染,6 h后更换含培养基,3 d后用含1 μg/mL嘌呤霉素的培养基筛选稳定表达细胞株。针对SPHK1慢病毒转染序列如表2。
表2.
RNA干扰和过表达序列
Tab.2 Sequences for RNA interference or gene overexpression
| Item | Sequences (5'-3') |
|---|---|
| shNC | GAGTCTATGACATTGCCTCA |
| shSPHK1#1 | CTTCGTGTCAGATGTTGGATAT |
| shSPHK1#2 | GCTTTGCCCTCACCCTTACAT |
| shSPHK1#3 | GCTTTGCCCTCACCCTTACAT |
| oeNC | CGCATCTAGCCTGTCAGTCC |
| oeSPHK1#1 | CTCGTGTCAGATATTGGTTAT |
| oeSPHK1#2 | ATTGTGTGAGACATCCGTAAG |
| oeSPHK1#3 | TTGAGTCCTGCTTCTTCATTG |
1.2.7. 细胞划痕实验
调整细胞密度为2.0×106/孔后铺板于6孔板中,待显微镜下观察细胞融合成单层状态时,用无菌200 μL枪头在孔内垂直均匀划线,继续置于培养箱中培养。在0、24 h时通过倒置显微镜(放大倍数×40)观察并随机分5个区域拍照,得到的图片通过Image J 软件进行处理并计算划痕迁移率。
1.2.8. Transwell 迁移和侵袭实验
将悬浮于0.2 mL的无血清培养基中的稳转株细胞置于Transwell板的上孔(1×104/孔),将含有0.6 mL的完全培养基装入下孔。37 ℃培养24 h后,用棉签将上腔的细胞完全去除,将下腔的细胞用4%多聚甲醛固定,并用0.1%结晶紫染色。然后在倒置显微镜(放大倍数×200)上随机分5个区域拍照计数,取平均值。对于侵袭试验,实验过程与迁移试验相似,只是在细胞装载之前,Transwell上孔加入50 μL的基质胶并孵育1 h。
1.2.9. 裸鼠背部成瘤模型
4~5周龄雌性裸鼠12只购自杭州子源实验动物科技有限公司,在SPF环境下饲养。将裸鼠随机分为4组(n=3):shNC组、shSPHK1组、oeNC组和oeSPHK1组。将构建稳转株或GC细胞200 μL(2×107/只)皮下注射于裸鼠背部。2周后,在麻醉(0.7%戊巴比妥钠)下,采用颈椎脱臼法处死小鼠。然后,切除异种移植肿瘤,拍照并称重。本研究经蚌埠医科大学动物伦理委员会批准(伦理批号:第[(2023)574]号)。
1.3. 统计学处理
所有统计数据采用Prism 9.0(Graphpad Software)、ImageJ软件进行分析。数据以均数±标准差表示。采用单因素方差分析检验、两样本t检验。P<0.05为差异有统计学意义。所有实验均重复3次。
2. 结果
2.1. SPHK1在GC组织中的表达
基于TIMER2.0数据库,SPHK1表达水平在15种癌症类型中上调,在2种癌症类型中下调,其中在GC组织中表达(P<0.001,图1A)。利用GEPIA数据库,SPHK1与MKI67在GC组织(n=408)中的表达水平均高于正常组织(n=211)(P<0.05,图1B)。此外,两者表达水平呈正相关(P<0.001,图1C)。HPA数据库显示,GC组织中SPHK1与MKI67的染色程度上调(图1D、E)。
图1.
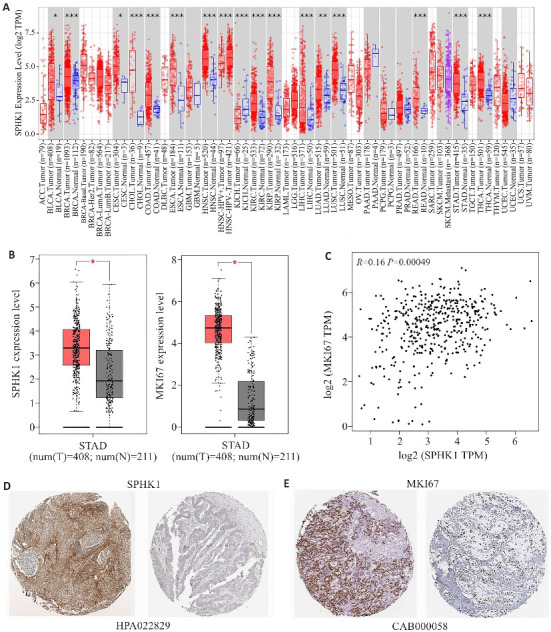
SPHK1在GC组织中的表达
Fig.1 Expression of SPHK1 in GC tissues. A: Expression of SPHK1 in pan-cancer based on data retrieved from TIMER2.0 database. B: Expression of SPHK1 and MKI67 in GC tissues based on data retrieved from GEPIA database. C: GEPIA database analysis of the correlation between SPHK1 and MKI67. D, E: Immunohistochemical staining for SPHK1 and MKI67 in GC tissues from HPA database. *P<0.05, **P<0.01, ***P<0.001 vs Tumor group.
2.2. SPHK1表达与GC患者预后的关联
GC患者中高表达的SPHK1预示着较差的总生存期(OS,P<0.001,图2A)和进展后总生存期(PPS,P<0.001,图2B)以及更差的无复发生存期(RFS,P<0.001,图2C)。
图2.
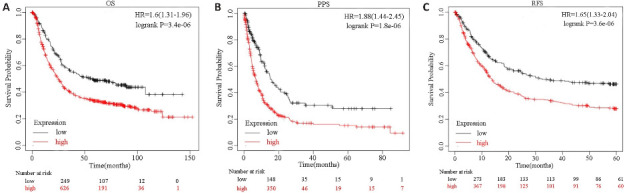
SPHK1表达与GC患者预后的关联
Fig.2 Association of SPHK1 expression with overall survival (OS; A), post-progression survival (PPS; B) and recurrence-free survival (RFS; C) of GC patients predicted using Kaplan-Meier Plotter database.
2.3. GC组织中SPHK1表达的上调
IHC结果显示,SPHK1与MKI67在GC组织的阳性染色强度均高于非癌性胃组织(图3A)。GC组织切片中SPHK1与MKI67蛋白的综合染色评分也高于正常组织切片(P<0.001,图3B)。同时,两种蛋白相对表达量呈的正相关(P<0.0001,图3C)。此外,Western blotting与qRT-PCR结果显示,SPHK1在HGC-27细胞系中高表达,在MGC-803细胞系中低表达,差异有统计学意义(P<0.05,图3D、E)。
图3.
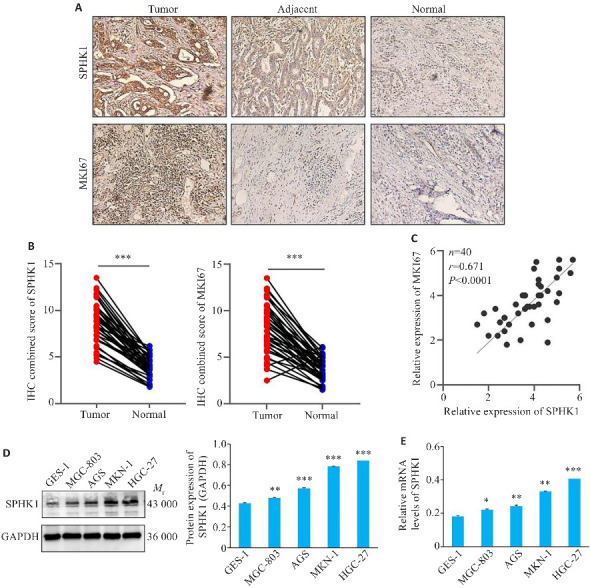
GC组织中SPHK1表达的上调
Fig.3 SPHK1 expression is upregulated in GC tissue. A: Immunohistochemical staining for detecting SPHK1 and MKI67 in clinical tissue samples (Original magnification:×200). B: Immunohistochemical score of SPHK1 and MKI67. ***P<0.001. C: Correlation between SPHK1 and MKI67 expressions. D: Western blotting for detecting the expression of SPHK1 protein. E: qRT-PCR for detecting the level of SPHK1 mRNA. *P<0.05, **P<0.01, ***P<0.001 vs GES-1 group.
2.4. SPHK1对GC细胞迁移与侵袭的影响
Western blotting结果显示,shSPHK1组SPHK1的表达下调(P<0.001),而oeSPHK1组SPHK1的表达上调(P<0.01,图4A)。shSPHK1组MKI67蛋白表达受到抑制(P<0.01),而oeSPHK1组的MKI67 蛋白表达上调(P<0.05,图4B)。此外,细胞划痕实验表明,与NC组相比,转染shSPHK1的HGC-27细胞在24 h时,细胞的迁移率降低,转染oeSPHK1的MGC-803细胞在24 h时,细胞的迁移率增加,差异有统计学意义(P<0.01,图4C、E)。Transwell侵袭实验显示,与NC组相比,shSPHK1组HGC-27细胞的侵袭能力减弱,oeSPHK1组MGC-803细胞的侵袭能力上调,差异有统计学意义(P<0.01,图4D、F)。此外,裸鼠成瘤实验显示,与NC组相比,shSPHK1组肿瘤大小和质量减小,而oeSPHK1组增加,差异有统计学意义(P<0.001,图4G、H)。
图4.
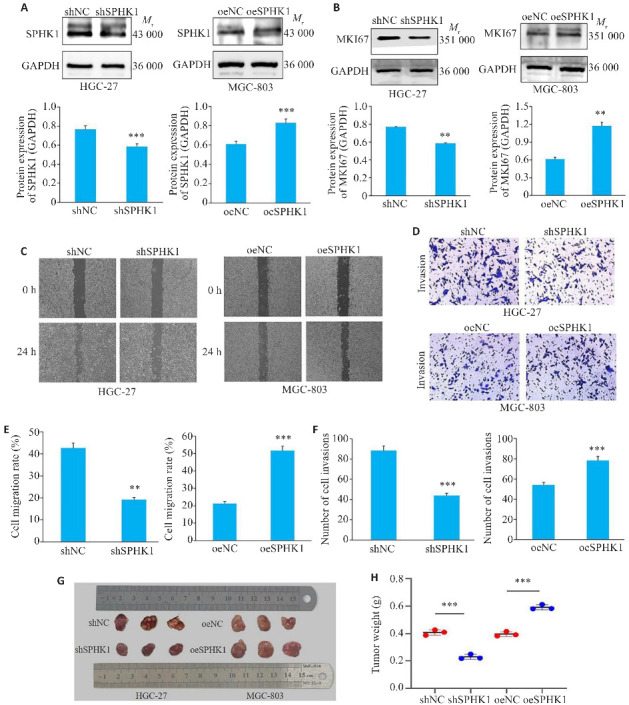
SPHK1对GC细胞迁移与侵袭的影响
Fig.4 Effect of SPHK1 knockdown or overexpression on GC cell migration and invasion. A: Western blotting for assessing efficiency of lentivirus-mediated SPHK1 knockdown and overexpression. B: Western blotting for detecting MKI67 protein levels. C, E: Cell scratch assay for assessing migration ability of the cells (×40). D, F: Transwell assays for assessing invasion ability of the cells (×200). G: Size of the subcutaneous tumors in nude mice. F: Weight of the subcutaneous tumors. *P<0.05, **P<0.01, ***P<0.001 vs NC group.
2.5. SPHK1靶向NF-κB信号通路
基于cBioportal数据库下载与SPHK1在GC中共表达的前500个潜在靶基因,DAVID数据库分析潜在靶基因并下载SPHK1mRNA富集相关数据,利用微生信网站处理并得出SPHK1相关潜在靶基因参与GC生物过程、细胞组成与分子功能中的细胞黏附、迁移及血管生成等(P<0.05,图5A)。KEGG通路显示NF-κB、PI3K富集其中(P<0.05,图5B)。与NC组相比,shSPHK1组抑制了磷酸化P65(p-P65)与PI3K(p-PI3K)水平,而总蛋白P65、PI3K无明显变化。VEGFA与IL-17表达水平也受到抑制(P<0.05,图5C、E)。相反,SPHK1过表达则增强了这一表现(P<0.05,图5D、F)。
图5.
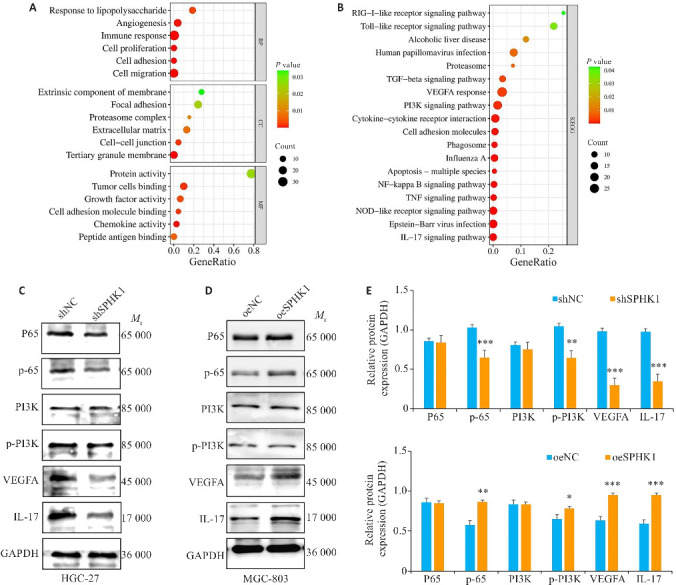
SPHK1靶向NF-κB信号通路
Fig.5 SPHK1 targets the NF-κB signaling pathway. A: Results of GO enrichment analysis. B: Results of KEGG pathway enrichment analysis. C, E: Expression levels of NF-κB signaling pathway proteins after SPHK1 knockdown. D, F: Expression levels of the proteins after SPHK1 overexpression. *P<0.05, **P<0.01, ***P<0.001 vs NC group.
2.6. 阻断NF-κB信号通路,SPHK1对GC细胞的迁移与侵袭能力的影响
利用PDTC(NF-κB信号通路抑制剂)处理前期已构建的病毒稳转株细胞24 h。Transwell迁移与侵袭实验结果显示,与shSPHK1+DMSO组相比,shSPHK1+PDTC组的细胞迁移与侵袭能力下调(P<0.05,图6A)。与oeSPHK1+DMSO组相比,oeSPHK1+PDTC组的细胞迁移与侵袭能力也下调(P<0.05,图6B)。同样,p-P65、VEGFA和IL-17蛋白水平变化中,shSPHK1+PDTC组、oeSPHK1+PDTC组与对照组相比,其表达量下降,差异有统计学意义(P<0.05,图6C~F)。
图6.
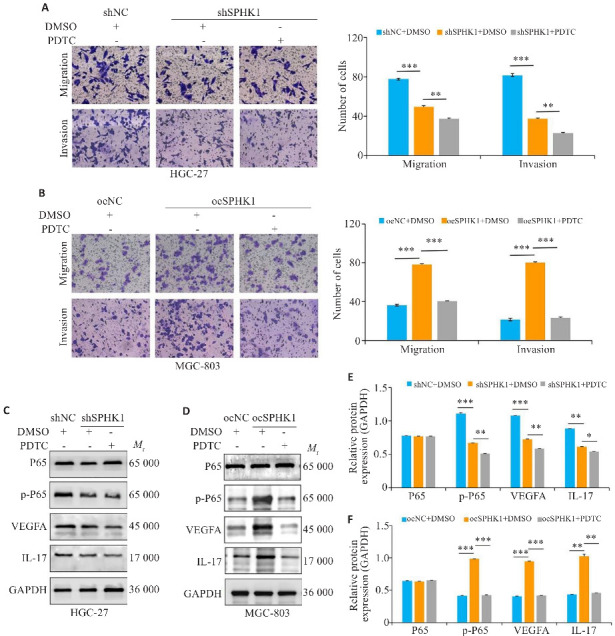
阻断NF-κB信号通路, SPHK1对GC细胞的迁移与侵袭能力的影响
Fig.6 Effect of blocking the NF-κB signaling pathway on migration and invasion ability of GC cells with SPHK1 knockdown or overexpression. A, B: Transwell assay for assessing migration and invasion of GC cells treated with 100 nmol/L PDTC (a NF-κB pathway inhibitor) or DMSO for 24 h (×200). C-F: Western blotting for detecting the levels of P65, p-P65, VEGFA and IL-17 proteins.*P<0.05, **P<0.01, ***P<0.001.
3. 讨论
鞘氨醇激酶家族蛋白参与多种癌症进展过程[18],如S1PR1信号通过增强肿瘤细胞中趋化因子的表达来促进GC转移[19]。SPHK1通过刺激Akt/FoxO3a 信号传导下调凋亡蛋白表达来抵抗GC细胞凋亡[20]。SPHK2在GC组织中表达上调,对GC发挥致癌作用[21, 22]。基于生物信息学分析,SPHK1在GC组织中的表达高于正常胃组织以及高表达的SPHK1预测更差的生存期。这与我们的研究结果一致,IHC结果显示SPHK1与MKI67在GC组织中表达上调且两者呈正相关。MKI67是肿瘤细胞恶性增殖因子。随着MKI67指标的建立,MKI67已发展成为癌症患者诊断和预后评估的标准[23]。以上数据提示SPHK1可能是GC进展中的恶性因子。
远处转移是GC患者高死亡率的原因之一[24]。肿瘤转移是一个多阶段的过程。肿瘤细胞的迁移和侵袭是转移过程中的关键环节[25]。SPHK1在乳腺癌[26]和前列腺癌[27]中已经证明了肿瘤细胞的迁移和侵袭功能。与上述研究结果类似,我们的数据显示敲低SPHK1抑制GC细胞的迁移和侵袭,而过表达SPHK1则相反。此外,裸鼠背部成瘤实验结果显示敲低SPHK1可抑制肿瘤的生长,而过表达SPHK1则会加速肿瘤生长。据此,我们的研究数据进一步证实了SPHK1在肿瘤进展中的重要作用。据报道,SPHK1可激活多种癌症相关信号通路,如结直肠癌中的TRAF6/ULK1通路[28]、膀胱癌中的NONO/STAT3通路[6]以及非小细胞肺癌的JAK/mTOR通路[13]。本课题主要研究集中在NF-κB通路,SPHK1对其它通路的影响将在我们未来的研究中深入挖掘。NF-κB信号通路在肿瘤相关活动中发挥重要作用,如细胞增殖、迁移与侵袭[29,30]。靶向调控SPHK1转录激活NF-κB/p65磷酸化可促进结直癌进展[31]。基因代谢组学分析显示SPHK1通过NF-κB激活促进口腔鳞状细胞癌的生长与转移[32]。有研究发现,NF-κB/P65与GC恶性转移可能存在关联[33]。在本研究中,SPHK1激活了GC细胞中磷酸化NF-κB信号通路。利用PDTC(NF-κB通路抑制剂)[34, 35]干预SPHK1敲低和过表达细胞株,结果显示,抑制NF-κB信号通路后,SPHK1减弱了对GC细胞迁移与侵袭的作用,表明NF-κB参与了SPHK1介导的GC细胞的迁移、侵袭,继而提示SPHK1可能调控NF-κB促进GC的转移。VEGFA是重要的血管生成因子,与GC侵袭、转移有关[36, 37]。IL-17与免疫细胞共同作用,促进肿瘤转移[38]。VEGFA、IL-17可能是NF-κB信号通路的转录靶点[39]。本研究显示,敲低SPHK1下调了p-P65、VEGFA和IL-17,而过表达SPHK1结果则相反。据此,我们推测SPHK1靶向NF-κB信号通路调节VEGFA/IL-17表达进而调控GC进展。然而本研究还存在一些不足之处:SPHK1激活NF-κB通路与其他相互作用蛋白共同调控促进GC转移的机制还亟需进一步探索。在裸鼠成瘤模型中亦未进行深入验证SPHK1调控NF-κB通路的促癌作用。
综上所述,本研究表明SPHK1在GC中表达上调,同时靶向NF-κB信号通路促进GC细胞的增殖、迁移与侵袭,继而促进肿瘤的发生发展。因此,SPHK1可作为GC患者治疗过潜在新靶点。
基金资助
安徽省高校科学研究重大项目(KJ2021ZD0090);蚌埠医学院研究生科研创新项目(Byycx22090);安徽省2023年度新时代育人质量工程(研究生教育)项目(2023xscx125)
参考文献
- 1. 冯金华, 刘亚江, 颜慧玲, 等. 四君子汤对胃癌肿瘤干细胞标志物活性及TFAP4蛋白的作用机制[J]. 中国老年学杂志, 2024, 44(7): 1739-44. [Google Scholar]
- 2. Wang X, Wu WKK, Gao J, et al. Autophagy inhibition enhances PD-L1 expression in gastric cancer[J]. J Exp Clin Cancer Res, 2019, 38(1): 140. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. Yang WJ, Zhao HP, Yu Y, et al. Updates on global epidemiology, risk and prognostic factors of gastric cancer[J]. World J Gastroenterol, 2023, 29(16): 2452-68. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4. Yeong J, Teo CB, Tay RYK, et al. Reply to: letter to editor on the article "Choice of PD-L1 immunohistochemistry assay influences clinical eligibility for gastric cancer immunotherapy"[J]. Gastric Cancer, 2022, 25(6): 1133-5. [DOI] [PubMed] [Google Scholar]
- 5. Tang L, Guo CM, Li X, et al. TAF15 promotes cell proliferation, migration and invasion of gastric cancer via activation of the RAF1/MEK/ERK signalling pathway[J]. Sci Rep, 2023, 13(1): 5846. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Qin ZJ, Tong H, Li TH, et al. SPHK1 contributes to cisplatin resistance in bladder cancer cells via the NONO/STAT3 axis[J]. Int J Mol Med, 2021, 48(5): 204. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Bernacchioni C, Squecco R, Gamberi T, et al. S1P signalling axis is necessary for adiponectin-directed regulation of electrophysio-logical properties and oxidative metabolism in C2C12 myotubes[J]. Cells, 2022, 11(4): 713. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. 张文路, 徐春燕. SphK1/S1P在肿瘤恶性生物学行为中的研究进展[J]. 实用医学杂志, 2023, 39(19): 2551-5, 2560. DOI: 10.3969/j.issn.1006-5725.2023.19.024 [DOI] [Google Scholar]
- 9. Long JT, Yao ZJ, Sui Y, et al. SphK1 promotes cancer progression through activating JAK/STAT pathway and up-regulating S1PR1 expression in colon cancer cells[J]. Anticancer Agents Med Chem, 2022, 22(2): 254-60. [DOI] [PubMed] [Google Scholar]
- 10. Wu JN, Lin L, Luo SB, et al. SphK1-driven autophagy potentiates focal adhesion paxillin-mediated metastasis in colorectal cancer[J]. Cancer Med, 2021, 10(17): 6010-21. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Liu SQ, Xu CY, Wu WH, et al. Sphingosine kinase1 promotes the metastasis of colorectal cancer by inducing the epithelial-mesenchymal transition mediated by the FAK/AKT/MMPs axis[J]. Int J Oncol, 2019, 54(1): 41-52. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Yu MS, Zhang KN, Wang S, et al. Increased SPHK1 and HAS2 expressions correlate to poor prognosis in pancreatic cancer[J]. Biomed Res Int, 2021, 2021: 8861766. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Ma Y, Xing X, Kong R, et al. SphK1 promotes development of non-small cell lung cancer through activation of STAT3[J]. Int J Mol Med, 2021, 47(1): 374-86. [DOI] [PubMed] [Google Scholar]
- 14. 卢 芳, 蒋 鑫, 徐晓敏, 等. 分子对接与体内验证联合探讨穿山龙复方对痛风模型大鼠TLR4/MyD88/NF-kB信号通路的影响[J]. 中药药理与临床, 2023, 39(08): 25-31. [Google Scholar]
- 15. Wang MD, Li HT, Peng LX, et al. TSPAN1 inhibits metastasis of nasopharyngeal carcinoma via suppressing NF-kB signaling[J]. Cancer Gene Ther, 2024, 31(3): 454-63. [DOI] [PubMed] [Google Scholar]
- 16. Yang WH, Liu L, Li CX, et al. TRIM52 plays an oncogenic role in ovarian cancer associated with NF-kB pathway[J]. Cell Death Dis, 2018, 9(9): 908. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. 张 浩, 张 震, 王秋生, 等. FJX1在胃癌组织中高表达并与不良预后相关[J]. 南方医科大学学报, 2023, 43(6): 975-84. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18. Sukocheva OA, Furuya H, Ng ML, et al. Sphingosine kinase and sphingosine-1-phosphate receptor signaling pathway in inflammatory gastrointestinal disease and cancers: a novel therapeutic target[J]. Pharmacol Ther, 2020, 207: 107464. [DOI] [PubMed] [Google Scholar]
- 19. 刘加蒙, 李 明. S1PR1在胃癌组织中的表达及其临床意义[J]. 现代肿瘤医学, 2024, 32(1): 93-5. [Google Scholar]
- 20. Xiong HP, Wang JC, Guan HY, et al. SphK1 confers resistance to apoptosis in gastric cancer cells by downregulating Bim via stim-ulating Akt/FoxO3a signaling[J]. Oncol Rep, 2014, 32(4): 1369-73. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Jia ZW, Tang XF, Zhang XC, et al. MiR-153-3p attenuates the development of gastric cancer by suppressing SphK2[J]. Biochem Genet, 2022, 60(5): 1748-61. [DOI] [PubMed] [Google Scholar]
- 22. Huo FC, Zhu ZM, Zhu WT, et al. METTL3-mediated m6A methylation of SPHK2 promotes gastric cancer progression by targeting KLF2[J]. Oncogene, 2021, 40(16): 2968-81. [DOI] [PubMed] [Google Scholar]
- 23. Uxa S, Castillo-Binder P, Kohler R, et al. Ki-67 gene expression[J]. Cell Death Differ, 2021, 28(12): 3357-70. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24. Leibold J, Tsanov KM, Amor C, et al. Somatic mouse models of gastric cancer reveal genotype-specific features of metastatic disease[J]. Nat Cancer, 2024, 5(2): 315-29. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25. Ruan Q, Wang CJ, Wu YT, et al. Exosome microRNA-22 inhibiting proliferation, migration and invasion through regulating Twist1/CADM1 axis in osteosarcoma[J]. Sci Rep, 2024, 14(1): 761. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. Bhadwal P, Randhawa V, Vaiphei K, et al. Clinical relevance of CERK and SPHK1 in breast cancer and their association with metastasis and drug resistance[J]. Sci Rep, 2022, 12(1): 18239. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27. Jin L, Zhu J, Yao LY, et al. Targeting SphK1/2 by SKI-178 inhibits prostate cancer cell growth[J]. Cell Death Dis, 2023, 14(8): 537. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28. Chen D, Wu JN, Qiu XZ, et al. SPHK1 potentiates colorectal cancer progression and metastasis via regulating autophagy mediated by TRAF6-induced ULK1 ubiquitination[J]. Cancer Gene Ther, 2024, 31(3): 410-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29. Long XL, Hu YK, Duan SY, et al. MRGBP promotes colorectal cancer metastasis via DKK1/Wnt/β-catenin and NF-kB/p65 pathways mediated EMT[J]. Exp Cell Res, 2022, 421(1): 113375. [DOI] [PubMed] [Google Scholar]
- 30. Mirzaei S, Saghari S, Bassiri F, et al. NF-κB as a regulator of cancer metastasis and therapy response: a focus on epithelial-mesenchymal transition[J]. J Cell Physiol, 2022, 237(7): 2770-95. [DOI] [PubMed] [Google Scholar]
- 31. 冯晓创. POTEE通过调控SPHK1转录激活p65磷酸化促进结直肠癌进展的机制研究[D]. 广州: 南方医科大学, 2020. [Google Scholar]
- 32. Hou CX, Mao GY, Sun QW, et al. Metabolomic analysis reveals that SPHK1 promotes oral squamous cell carcinoma progression through NF-κB activation[J]. Ann Surg Oncol, 2022, 29(12): 7386-99. [DOI] [PubMed] [Google Scholar]
- 33. Zhang JX, Chen ZH, Chen DL, et al. Retraction Note: LINC01410-miR-532-NCF2-NF-kB feedback loop promotes gastric cancer angiogenesis and metastasis[J]. Oncogene, 2023, 42(14): 1158. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34. Li YF, Qiao YQ, Wang HH, et al. Intraperitoneal injection of PDTC on the NF-kB signaling pathway and osteogenesis indexes of young adult rats with anterior palatal suture expansion model[J]. PLoS One, 2021, 16(7): e0243108. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35. Mei L, Zheng YM, Song TY, et al. Rieske iron-sulfur protein induces FKBP12.6/RyR2 complex remodeling and subsequent pulmonary hypertension through NF‑κB/cyclin D1 pathway[J]. Nat Commun, 2020, 11(1): 3527. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36. Yang KX, Li JT, Zhu JH, et al. HOOK3 suppresses proliferation and metastasis in gastric cancer via the SP1/VEGFA axis[J]. Cell Death Discov, 2024, 10(1): 33. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37. Zeng K, Xie WW, Wang CY, et al. USP22 upregulates ZEB1-mediated VEGFA transcription in hepatocellular carcinoma[J]. Cell Death Dis, 2023, 14(3): 194. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38. 李 燕, 王 琦, 郑 路, 等. 白细胞介素-17基因多态性与山西东南地区汉族人群2型糖尿病的相关性[J]. 实用医学杂志, 2024, 40(05): 695-701. [Google Scholar]
- 39. Korbecki J, Simińska D, Gąssowska-Dobrowolska M, et al. Chronic and cycling hypoxia: drivers of cancer chronic inflammation through HIF-1 and NF‑κB activation: a review of the molecular mechanisms[J]. Int J Mol Sci, 2021, 22(19): 10701. [DOI] [PMC free article] [PubMed] [Google Scholar]


