Abstract
目的
研究核蛋白(Nupr)1调控软骨细胞铁死亡在骨关节炎进展中的作用及机制。
方法
将小鼠膝关节软骨细胞分为小干扰RNA(siRNA)对照组、靶向Nupr1的siRNA(siNupr1)组、siRNA对照+IL-1β组(siRNA对照干扰24 h后再加入10 ng/mL IL-1β)和siNupr1+IL-1β组(siNupr1干扰24 h后再加入10 ng/mL IL-1β)。采用蛋白质印迹法和定量逆转录聚合酶链反应法分别检测Nupr1蛋白及其信使RNA(mRNA)表达。采用细胞计数试剂盒(CCK)8法检测细胞活性,FerroOrange染色法检测亚铁离子水平,C11-BODIPY-591荧光显影法检测脂质过氧化水平,酶联免疫吸附试验检测丙二醛和谷胱甘肽含量。蛋白质印迹法检测酰基辅酶A合成酶长链家族(ACSL)4、P53、谷胱甘肽过氧化物酶(GPX)4、溶质载体家族7成员11(SLC7A11)表达。通过膝关节内侧半月板失稳术(DMM)造模构建骨关节炎小鼠模型,将7周龄C57BL/6J雄性小鼠随机分为假手术+腺相关病毒5型(AAV5)-短发夹RNA(shRNA)对照组、假手术+AAV5-靶向Nupr1的shRNA(shNupr1)组、DMM+AAV5-shRNA对照组和DMM+AAV5-shNupr1组,每组各10只,采用苏木精-伊红染色和番红O-固绿染色观察软骨组织病理形态学变化并通过国际骨关节炎研究协会(OARSI)骨关节炎软骨组织病理学评分评价小鼠软骨退变程度。定量逆转录聚合酶链反应法检测基质金属蛋白酶(MMP)13、一种具有血小板反应蛋白基序的去整合素和金属蛋白酶(ADAMTS)5、环氧合酶(COX)2、GPX4的mRNA表达。
结果
体外实验结果显示,敲低Nupr1可缓解IL-1β诱导的软骨细胞增殖活性下降,减少小鼠软骨细胞中铁蓄积,降低脂质过氧化水平,下调ACSL4、P53蛋白表达,上调GPX4、SLC7A11蛋白表达(均P<0.01),抑制小鼠软骨细胞铁死亡。动物实验结果显示,敲低Nupr1可延缓骨关节炎小鼠关节软骨退变,改善OARSI评分,减缓骨关节炎软骨细胞外基质降解,减少铁死亡主要调节因子GPX4的表达(均P<0.01)。
结论
敲低Nupr1可通过抑制小鼠软骨细胞铁死亡延缓骨关节炎病理进展。
Keywords: 骨关节炎, 铁死亡, 核蛋白1, 软骨细胞, 小鼠
Abstract
Objective
To investigate the effect of nuclear protein (Nupr) 1 on the pathological progression of osteoarthritis and its relationship with ferroptosis of chondrocytes.
Methods
Chondrocytes from mouse knees were divided into small interfering RNA (siRNA) control group, small interfering RNA targeting Nupr1 (siNupr1) group, siRNA control+IL-1β group (siRNA control interference for 24 h followed by 10 ng/mL IL-1β) and siNupr1+IL-1β group (siNupr1 interference for 24 h followed by 10 ng/mL IL-1β). The protein and mRNA expressions of Nupr1 were detected by Western blotting and quantitative reverse transcription polymerase chain reaction (qRT-PCR). Cell proliferation viabilities were measured using the cell counting kit-8 method. The levels of ferrous ions were detected by FerroOrange staining. Lipid peroxidation levels were detected by C11-BODIPY-591 fluorescence imaging. The contents of malondialdehyde (MDA) and glutathione (GSH) were detected by enzyme-linked immunosorbent assay. The protein expressions of acyl-CoA synthetase long-chain family (ACSL) 4, P53, glutathione peroxidase (GPX) 4 and solute carrier family 7 member 11 gene (SLC7A11) were detected by Western blotting. The osteoarthritis model was constructed by destabilization of the medial meniscus (DMM) surgery in 7-week-old male C57BL/6J mice. The mice were randomly divided into four groups with 10 animals in each group: sham surgery (Sham)+adeno-associated virus serotype 5 (AAV5)-short hairpin RNA (shRNA) control group, Sham+AAV5-shRNA control targeting Nupr1 (shNupr1) group, DMM+AAV5-shRNA control group, and DMM+AAV5-shNupr1 group. Hematoxylin and eosin staining and Safranin O-Fast Green staining were used to observe the morphological changes in cartilage tissue. The Osteoarthritis Research Society International (OARSI) osteoarthritis cartilage histopathology assessment system was used to evaluate the degree of cartilage degeneration in mice. The mRNA expressions of matrix metallopeptidase (MMP) 13, a disintegrin and metalloproteinase with thrombospondin motifs (ADAMTS) 5, cyclooxy-genase (COX) 2, and GPX4 were detected by qRT-PCR.
Results
In vitro experiments showed that knocking down Nupr1 alleviated the decrease of chondrocyte proliferation activity induced by IL-1β, reduced iron accumulation in mouse chondrocytes, lowered lipid peroxidation, downregulated ACSL4 and P53 protein expression and upregulated GPX4 and SLC7A11 protein expression (all P<0.01), thereby inhibiting ferroptosis in mouse chondrocytes. Meanwhile, in vivo animal experiments demonstrated that knocking down Nupr1 delayed the degeneration of articular cartilage in osteoarthritis mice, improved the OARSI score, slowed down the degradation of the extracellular matrix in osteoarthritis cartilage, and reduced the expression of the key ferroptosis regulator GPX4 (all P<0.01).
Conclusion
Knockdown of Nupr1 can delay the pathological progression of osteoarthritis through inhibiting ferroptosis in mouse chondrocytes.
Keywords: Osteoarthritis, Ferroptosis, Nuclear protein 1, Chondrocyte, Mice
骨关节炎通常表现为关节软骨的损伤以及由此产生的炎症持续存在,可能带来关节功能障碍、畸形、心血管和死亡风险增高等一系列问题[1]。骨关节炎的患病率较高,患者基数庞大,疾病负担较重。1990—2019年中国膝骨关节炎新发病人数从368.39万例增加至842.58万例,患病人数从4257.08万例增加至10 812.01万例[2-3]。目前,骨关节炎的致病机制尚未完全明确,其治疗手段较为有限,且保守治疗效果一般,急需发掘新的治疗靶点。由于骨关节炎病因复杂,又以膝关节软骨退变为核心病理特征[4],因此深入研究骨关节炎软骨退变的病理机制和关键靶点尤为重要。
有研究表明,抑制软骨细胞铁死亡是一种有效延缓骨关节炎软骨退变的方法[5-6]。铁死亡是一种铁离子依赖的由过量脂质过氧化积累导致细胞膜破裂的程序性细胞死亡[7]。Nupr1是一种高碱性、多功能的应激诱导蛋白,广泛分布于生物体内,具有很强的转录活性,可通过触发多种细胞信号途径平衡细胞生长发育过程中的各种应激反应,维持细胞稳态[8]。胰腺癌体内外模型均显示Nupr1与铁死亡关系密切,是铁死亡的关键抑制剂[9]。但Nupr1与骨关节炎软骨退变之间的具体作用机制尚不清楚。本研究拟通过体内外实验探讨Nupr1是否通过调控软骨细胞铁死亡延缓骨关节炎病理进展,以期为深入理解骨关节炎的病理机制及发现新的治疗靶点提供依据。
1. 材料与方法
1.1. 动物、药物、试剂与仪器
7周龄SPF级C57BL/6J雄性小鼠购自江苏集萃药康生物科技股份有限公司[许可证号SCXK(苏)2018-0008],饲养于12 h光照/12 h无光照、24~26 ℃环境,可自由进食及饮水。
IL-1β为苏州近岸蛋白质科技股份有限公司产品;亚铁离子检测FerroOrange荧光探针为日本Dojindo公司产品;C11-BODIPY-591脂质过氧化检测荧光探针、Ⅱ型胶原酶、胎牛血清、脂质体2000、裂解液、BCA试剂盒、TRIzol为美国ThermoFisher Scientific公司产品;兔Nupr1多克隆抗体为北京博奥森生物技术有限公司产品;兔GPX4单克隆抗体、兔SLC7A11单克隆抗体、兔ACSL4单克隆抗体、兔P53单克隆抗体、HRP标记羊抗兔二抗为美国Abcam公司产品;β-actin抗体为武汉三鹰生物技术有限公司产品;CCK-8为美国APExBIO公司产品;MDA检测试剂盒、GSH和氧化型GSH检测试剂盒为上海碧云天生物技术股份有限公司产品;逆转录试剂盒、荧光定量PCR试剂盒为上海翌圣生物科技股份有限公司产品;siRNA序列和引物为上海捷瑞生物工程有限公司产品;AAV5为上海汉恒生物科技有限公司产品;软骨HE染色试剂盒、番红O-固绿染色试剂盒为武汉皮诺飞生物科技有限公司产品。
蛋白电泳仪及转膜仪系统为美国Bio-Rad公司产品;凝胶成像系统为美国GE公司产品;组织切片、脱水、包埋机及倒置显微镜为德国Leica公司产品;多功能酶标仪为美国PerkinElmer公司产品;逆转录仪为德国Eppendorf公司产品;实时PCR仪为美国Applied Biosystems公司产品。
1.2. 小鼠原代软骨细胞的分离、分组及干预
参考前期研究方法,每次取5只SPF级C57BL/6J小鼠脱颈处死,迅速取双膝关节置于无菌超净台中,打开膝关节腔并用刀片削取胫骨平台与股骨远端透明软骨,0.25% Ⅱ型胶原酶消化6 h,收集上清液,500×g离心5 min,弃上清液,用含10%胎牛血清、100 U/mL青-链霉素的DMEM培养液(以下简称“完全培养液”)重悬细胞沉淀,置于37 ℃、5%二氧化碳的培养箱中培养,在小鼠软骨细胞汇合达80%后按照1∶2传代[10]。
将第三代生长状态良好的细胞分为siRNA对照组、siNupr1组、siRNA对照+IL-1β组和siNupr1+IL-1β组。siRNA序列:siNupr1正向5 -AGAGGAAGCUGCUGACCAATT-3 ,反向5 -UUGGUCAGCAGCUUCCUCUTT-3 ;siRNA对照正向5 -UUCUCCGAACGUGUCACGUTT-3 ,反向5 -ACGUGACACGUUCGGAGAATT-3 。各取50 μL不含血清的无双抗DMEM培养液加入100 nmol siRNA 和5 μL 脂质体2000混匀。将上述溶液加入细胞培养板中,用不含血清的无双抗DMEM培养液培养,12 h后换为不含siRNA的完全培养液继续培养。siRNA对照+IL-1β组和siNupr1+IL-1β组分别在siRNA对照或siNupr1干扰24 h后加入10 ng/mL IL-1β孵育24 h[10-11]。
1.3. 蛋白质印迹法检测软骨细胞中Nupr1及铁死亡相关蛋白表达
配置含1%蛋白酶抑制剂的裂解液,加入细胞培养板中,冰盒上将细胞从细胞培养板刮下并经超声波粉碎仪裂解,4 ℃下10 000×g离心10 min,保留上清液并经BCA法测定蛋白质浓度。取25 μg软骨细胞蛋白质上样,经6%~8% SDS聚丙烯酰胺凝胶电泳分离蛋白、转膜、封闭;分别以Nupr1抗体(1∶1000)、ACSL4抗体(1∶25 000)、P53抗体(1∶2000)、GPX4抗体(1∶5000)、SLC7A11抗体(1∶5000)、β-actin抗体(1∶50 000)4 ℃孵育过夜,TBST清洗三次;以HRP二抗(1∶20 000)室温孵育2 h,TBST清洗三次;采用增强化学发光法显色,凝胶成像分析仪显影。采用Image Lab软件进行灰度值分析。
1.4. 定量逆转录PCR法检测软骨细胞中Nupr1、细胞外基质及铁死亡调节因子mRNA表达
TRIzol法提取小鼠软骨细胞总RNA,按照逆转录试剂盒说明将总RNA逆转录合成模板互补DNA,采用实时PCR仪进行PCR扩增检测。均以β-actin基因作为内参,以2-ΔΔCt法进行半定量分析。引物序列见表1。
表1.
引物序列一览
| 基因名称 | 引物序列(5 →3 ) |
|---|---|
| Nupr1 | 正向:CTGGAGATAAGGCCAGACCAC |
| 反向:GCTTCTTGCTCCCATCTTGC | |
| MMP13 | 正向:TACCATCCTGCGACTCTTGC |
| 反向:TTCACCCACATCAGGCACTC | |
| ADAMTS5 | 正向:CCAAGGCCAAATGGTGTGTC |
| 反向:CAATGGCGGTAGGCAAACTG | |
| COX2 | 正向:CAGGACTCTGCTCACGAAGG |
| 反向:ATCCAGTCCGGGTACAGTCA | |
| GPX4 | 正向:GCCTCGCAATGAGGCAAAAC |
| 反向:CAAACTGGTTGCAGGGGAAG | |
| β-actin | 正向:GTGACGTTGACATCCGTAAAGA |
| 反向:GCCGGACTCATCGTACTCC |
Nupr:核蛋白;MMP:基质金属蛋白酶;ADAMTS:一种具有血小板反应蛋白基序的去整合素和金属蛋白酶;COX:环氧合酶;GPX:谷胱甘肽过氧化物酶;β-actin:β肌动蛋白.
1.5. CCK-8法检测软骨细胞增殖情况
将小鼠软骨细胞(5×103个/孔)接种于96孔板中培养24 h,细胞干预时间到达后更换新鲜完全培养液,加入10 μL CCK-8溶液,培养箱避光孵育2 h,设置酶标仪450 nm波长,测定吸光度并计算细胞存活率。细胞存活率(%)=[(实验孔吸光度值-空白孔吸光度值)/(对照孔吸光度值-空白孔吸光度值)]×100%。
1.6. 亚铁离子荧光探针FerroOrange染色法检测软骨细胞亚铁离子水平
各组小鼠软骨细胞给药处理结束后,弃去培养液,用HBSS平衡盐溶液洗涤细胞两次,加入1 μmol/L的FerroOrange工作液,在37 ℃、5%二氧化碳的培养箱中培养30 min,荧光显微镜下观察,记录平均荧光强度。
1.7. C11-BODIPY-591荧光显影检测软骨细胞中脂质活性氧水平
各组小鼠软骨细胞给药处理结束后,弃去培养液,用HBSS平衡盐溶液洗涤细胞两次,加入5 μmol/L的C11-BODIPY-591工作液,在37 ℃、5%二氧化碳的培养箱中培养30 min,荧光显微镜下观察并分析各组软骨细胞绿色荧光强度。
1.8. 比色法检测软骨细胞中MDA含量
收集小鼠软骨细胞并用裂解液超声裂解,4 ℃下10 000×g离心10 min,收集上清液,BCA法测定蛋白浓度,取适量标准品按照1、2、5、10、20、50 μmol/L制作标准曲线,根据MDA检测试剂盒说明书操作依次配置硫代巴比妥酸储存液、MDA检测工作液及设置样品测定检测反应体系,设置酶标仪波长532 nm,测定吸光度,根据系列浓度标准品测定拟合标准曲线方程,基于样品吸光度计算MDA含量。
1.9. GSH和氧化型GSH检测试剂盒检测软骨细胞中GSH含量
收集各组小鼠软骨细胞沉淀,加入蛋白质去除试剂M混匀,交替使用液氮和37 ℃水浴对样品冻融两次,冰上放置5 min 后4 ℃下10 000×g离心10 min,收集上清液。严格按照说明书操作,取15.0、10.0、5.0、2.0、1.0、0.5 μmol/L氧化型GSH溶液制作标准曲线,并取部分样品依次加入6×GSH清除辅助液、GSH清除工作液、总GSH检测工作液及NADPH溶液,设置酶标仪波长411 nm,测定吸光度并对照标准曲线计算样品中总GSH和氧化型GSH含量,GSH含量=(总GSH含量-氧化型GSH含量)×2。
1.10. 实验动物建模、分组及干预
建立小鼠膝关节内侧半月板失稳术造模骨关节炎模型[12]:小鼠采用0.3%戊巴比妥钠(30 mg/kg,0.1 mL/10g)腹腔注射麻醉后,置于37 ℃恒温垫上,膝关节局部备皮、消毒,小鼠选取仰卧位固定后屈曲膝90°充分暴露视野,用11号手术尖刀沿着髌韧带内侧缘打开关节囊,钝性分离视野中的皮下组织和筋膜,内侧半月板通过内侧半月板胫副韧带与胫骨平台相连接,离断半月板胫副韧带。小鼠随机分为假手术+AAV5-shRNA对照组、假手术+AAV5-shNupr1组、DMM+AAV5-shRNA对照组和DMM+AAV5-shNupr1组,每组各10只。假手术指不做半月板胫副韧带离断处理,其余处理其他组均相同。DMM术前两周,各组小鼠膝关节腔注射一次AAV5-shRNA对照或AAV5-shNupr1病毒(10 μL,病毒滴度为1×1010 vg/mL),8周后收集小鼠膝关节标本。AAV5-shNupr1和AAV5-shRNA对照序列见表2。
表2.
shNupr1序列及其对照序列
| shRNA | 序 列(5 →3 ) |
|---|---|
| shNupr1 | 正向:AATTCGAGATGGAATCCTGGATGAATACTCGAGTATTCATCCAGGATTCCATCTTTTTTTG |
| 反向:GATCCAAAAAAAGATGGAATCCTGGATGAATACTCGAGTATTCATCCAGGATTCCATCTCG | |
| shRNA对照 | 正向:GATCCGTTCTCCGAACGTGTCACGTAATTCAAGAGATTACGTGACACGTTCGGAGAATTTTTTC |
| 反向:AATTGAAAAAATTCTCCGAACGTGTCACGTAATCTCTTGAATTACGTGACACGTTCGGAGAACG |
Nupr:核蛋白;shRNA:短发夹RNA;shNupr1:靶向Nupr1的shRNA.
1.11. HE染色和番红O-固绿染色观察模型鼠软骨组织病理形态并进行OARSI评分
小鼠膝关节经固定、脱钙、脱水、透明、浸蜡和包埋处理后沿矢状面制成厚度为5 μm的石蜡切片,HE染色及番红O-固绿染色后于显微镜下观察并采集图像,采用OARSI骨关节炎软骨组织病理学评分系统[13]评价小鼠软骨退变程度,计算5只小鼠平均OARSI评分。
1.12. 统计学方法
采用GraphPad Prism 9.5软件进行统计分析。正态分布的计量数据以均数±标准差( ±s)表示,多组间比较采用单因素方差分析,组间两两比较采用t检验,P<0.05为差异具有统计学意义。
2. 结果
2.1. 小鼠软骨细胞Nupr1敲低模型构建成功
蛋白质印迹法结果显示,与siRNA对照组比较,siNupr1组小鼠软骨细胞Nupr1蛋白表达减少(分别为0.68±0.04和0.28±0.03,t=17.96,P<0.01);定量逆转录PCR法结果显示,与siRNA对照组比较,siNupr1组小鼠软骨细胞Nupr1 mRNA表达减少(分别为1.00±0.00和0.37±0.04,t=34.57,P<0.01)。见图1。结果提示,siNupr1对Nupr1的表达具有显著抑制效果,可见小鼠软骨细胞Nupr1敲低模型构建成功。
图1. siNupr1及其对照干扰后小鼠软骨细胞中Nupr1蛋白电泳图.

Nupr:核蛋白;siRNA:小干扰RNA;siNupr1:靶向Nupr1的siRNA;β-actin:β肌动蛋白.
2.2. 敲低Nupr1可缓解IL-1β诱导的软骨细胞活性下降
siRNA对照组、siNupr1组、siRNA对照+IL-1β组和siNupr1+IL-1β组细胞存活率分别为(100.00±0.00)%、(99.00±0.04)%、(71.00±0.03)%和(87.00±0.05)%。与siRNA对照组比较,siRNA对照+IL-1β组小鼠软骨细胞活性降低(t=25.68,P<0.01);与siRNA对照+IL-1β组比较,siNupr1+IL-1β组小鼠软骨细胞活性降低减少(t=6.649,P<0.01)。结果提示,敲低Nupr1可缓解IL-1β诱导的软骨细胞增殖活性下降。
2.3. 敲低Nupr1可缓解IL-1β诱导的软骨细胞铁蓄积
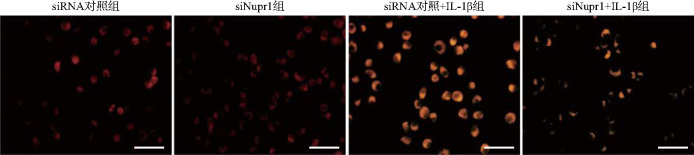
与siRNA对照组比较,siRNA对照+IL-1β组小鼠软骨细胞亚铁离子荧光强度明显增强(分别为9.71±0.84和40.29±1.89,t=33.11,P<0.01);siNupr1+IL-1β组小鼠软骨细胞亚铁离子荧光强度为18.98±1.58,较siRNA对照+IL-1β组明显减弱(t=19.38,P<0.01),见图2。结果提示,敲低Nupr1可缓解IL-1β诱导的软骨细胞中铁蓄积。
图2. 各组软骨细胞中亚铁离子检测荧光图(FerroOrange染色法).
与siRNA对照组比较,siRNA对照+IL-1β组小鼠软骨细胞亚铁离子荧光强度增强;与siRNA对照+IL-1β组比较,siNupr1+IL-1β组小鼠软骨细胞亚铁离子荧光强度减弱. siRNA:小干扰RNA;siNupr1:靶向核蛋白1的siRNA. 标尺=50 μm.
2.4. 敲低Nupr1可缓解IL-1β诱导的软骨细胞脂质过氧化
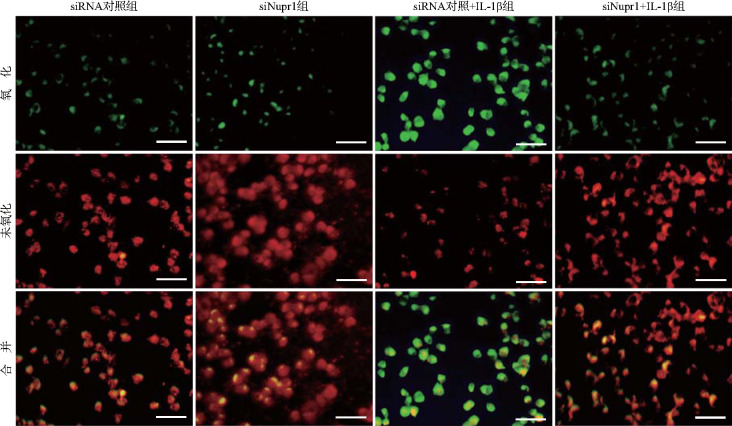
与siRNA对照组比较,siRNA对照+IL-1β组小鼠软骨细胞中绿色荧光强度明显增强,表明脂质活性氧水平升高(t=19.23,P<0.01);与siRNA对照+IL-1β组比较,siNupr1+IL-1β组小鼠软骨细胞中绿色荧光强度明显减弱,表明脂质活性氧水平降低(t=13.70,P<0.01),见图3和表3。
图3. 各组软骨细胞中脂质活性氧检测荧光图(C11-BODIPY-591荧光显影法).
与siRNA对照组比较,siRNA对照+IL-1β组小鼠软骨细胞绿色荧光(氧化)强度增强,红色荧光(未氧化)强度减弱;与siRNA对照+IL-1β组比较,siNupr1+IL-1β组小鼠软骨细胞绿光荧光强度减弱,红光荧光强度增强. siRNA:小干扰RNA;siNupr1:靶向核蛋白1的siRNA. 标尺=50 μm.
表3.
各组软骨细胞脂质过氧化相关标志物表达水平比较
| 组 别 | n |
脂质 活性氧(%) |
丙二醛 (nmol/mg蛋白) |
谷胱甘肽 (nmol/mg蛋白) |
|---|---|---|---|---|
| siRNA对照组 | 5 | 9.33±0.87 | 1.03±0.13 | 0.13±0.04 |
| siNupr1组 | 5 | 7.62±0.92 | 0.99±0.21 | 0.14±0.03 |
| siRNA对照+IL-1β组 | 5 | 29.18±2.14** | 2.09±0.18** | 0.07±0.01** |
| siNupr1+IL-1β组 | 5 | 13.31±1.46## | 1.41±0.11## | 0.22±0.03## |
与siRNA对照组比较,** P<0.01;与siRNA对照+IL-1β组比较,## P<0.01. 脂质活性氧水平用绿色荧光强度表示. siRNA:小干扰RNA;siNupr1:靶向核蛋白1的siRNA.
±s
与siRNA对照组比较,siRNA对照+IL-1β组小鼠软骨细胞MDA含量增加(t=10.94,P<0.01),GSH含量减少(t=3.00,P<0.01);与siRNA对照+IL-1β组比较,siNupr1+IL-1β组小鼠软骨细胞MDA含量减少(t=7.30,P<0.01),GSH含量增加(t=10.50,P<0.01),见表3。
上述结果提示,敲低Nupr1可缓解IL-1β诱导的小鼠软骨细胞内脂质过氧化水平。
2.5. 敲低Nupr1影响IL-1β诱导的软骨细胞中铁死亡相关蛋白表达
蛋白质印迹法检测结果显示,与siRNA对照组比较,siRNA对照+IL-1β组小鼠软骨细胞中ACSL4、P53蛋白表达增加(t=45.17和17.30,均P<0.01),GPX4、SLC7A11蛋白表达减少(t=10.5和8.05,均P<0.01);与siRNA对照+IL-1β组比较,siNupr1+IL-1β组小鼠软骨细胞中ACSL4、P53蛋白表达减少(t=12.8和10.34,均P<0.01),GPX4、SLC7A11蛋白表达增加(t=34.23和22.26,均P<0.01),见图4和表4。结果提示,敲低Nupr1可通过调节铁死亡相关蛋白表达,抑制小鼠软骨细胞铁死亡。
图4. 各组软骨细胞中铁死亡相关蛋白电泳图.
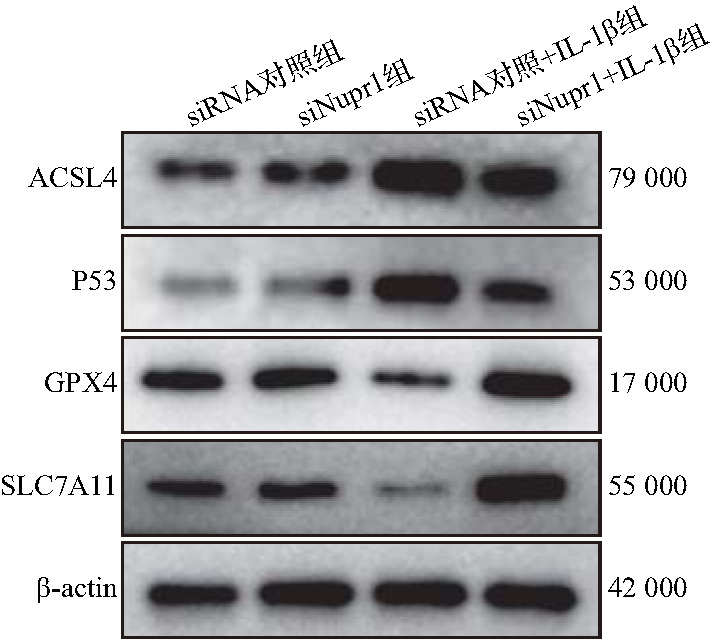
siRNA:小干扰RNA;siNupr1:靶向核蛋白1的小干扰RNA;ACSL:酰基辅酶A合成酶长链家族; GPX:谷胱甘肽过氧化物酶;SLC7A11:溶质载体家族7成员11;β-actin:β肌动蛋白.
表4.
各组软骨细胞中铁死亡相关蛋白表达量比较
| 组 别 | n | ACSL4 | P53 | GPX4 | SLC7A11 |
|---|---|---|---|---|---|
| siRNA对照组 | 5 | 0.39±0.02 | 0.23±0.02 | 0.49±0.06 | 0.31±0.03 |
| siNupr1组 | 5 | 0.37±0.04 | 0.29±0.03 | 0.51±0.08 | 0.29±0.08 |
| siRNA对照+IL-1β组 | 5 | 1.63±0.06** | 0.91±0.09** | 0.21±0.05** | 0.15±0.03** |
| siNupr1+IL-1β组 | 5 | 1.06±0.08## | 0.47±0.04## | 0.91±0.03## | 1.16±0.09## |
与siRNA对照组比较,** P<0.01;与siRNA对照+IL-1β组比较,## P<0.01. siRNA:小干扰RNA;siNupr1:靶向核蛋白1的siRNA;ACSL:酰基辅酶A合成酶长链家族;GPX:谷胱甘肽过氧化物酶;SLC7A11:溶质载体家族7成员11.
±s
2.6. 关节软骨Nupr1敲低模型鼠构建成功
空白对照组未见绿色荧光,AAV5-shRNA对照组和AAV5-shNupr1组所有细胞均成功表达绿色荧光蛋白,两组病毒转染率分别为(53.71±2.03)%和(56.67±2.96)%,差异无统计学意义(t=1.837,P>0.05),见图5。定量逆转录PCR结果显示,与AAV5-shRNA对照组比较,AAV5-shNupr1组Nupr1 mRNA表达水平降低(分别为1.00±0.00和0.51±0.06,t=17.050,P<0.01)。结果提示,AAV5-shNupr1组对Nupr1的表达具有显著抑制效果,证明小鼠关节软骨Nupr1敲低模型构建成功。
图5. AAV5-shNupr1序列及其对照序列转染结果.
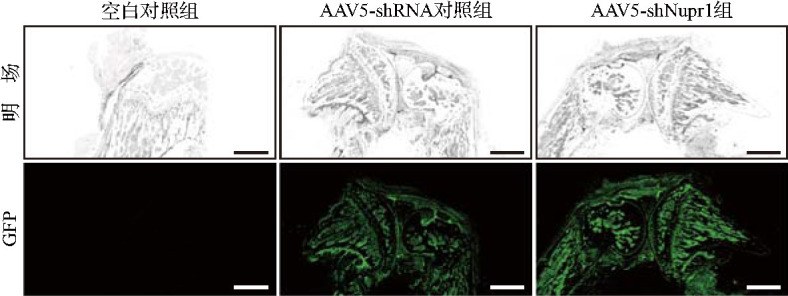
空白对照组未见绿色荧光,AAV5-shRNA对照组和AAV5-shNupr1组可见所有细胞均成功表达GFP. 标尺=500 μm. AAV:腺相关病毒;shRNA:短发夹RNA;shNupr1:靶向核蛋白1的shRNA;GFP:绿色荧光蛋白.
2.7. 敲低Nupr1减轻DMM诱导的骨关节炎模型鼠关节软骨退变
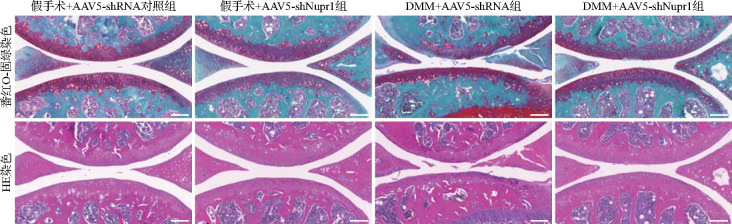
HE染色和番红O-固绿染色结果显示,假手术+AAV5-shRNA对照组和假手术+AAV5-shNupr1组软骨病理形态完整,细胞排列整齐,OARSI评分均为0分;与假手术+AAV5-shRNA对照组比较,DMM+AAV5-shRNA对照组小鼠透明软骨部分缺损,软骨厚度变薄,基质染色变浅,软骨表面纤维化,OARSI评分升高至5.80±0.84(t=15.5,P<0.01);与DMM+AAV5-shRNA对照组比较,DMM+AAV5-shNupr1组小鼠膝关节软骨完整性、软骨厚度、基质染色和软骨表面纤维化均明显得到改善,OARSI评分为2.60±0.55(t=7.155,P<0.01),见图6。结果提示,敲低Nupr1可改善骨关节炎模型鼠关节软骨退变。
图6. 各组小鼠软骨病理形态(番红O-固绿染色和HE染色).
两组假手术组软骨病理形态完整,细胞排列整齐;与假手术+AAV5-shRNA对照组比较,DMM+AAV5-shRNA对照组小鼠透明软骨部分缺损,软骨厚度变薄,基质染色变浅,软骨表面纤维化;与DMM+AAV5-shRNA对照组比较,DMM+AAV5-shNupr1组小鼠膝关节软骨完整性、软骨厚度、基质染色和软骨表面纤维化均明显改善. 标尺=50 μm. HE染色:苏木精-伊红染色;AAV:腺相关病毒;shRNA:短发夹RNA;shNupr1:靶向核蛋白1的shRNA;DMM:内侧半月板失稳术.
2.8. 敲低Nupr1影响DMM诱导的骨关节炎模型鼠关节软骨细胞外基质和铁死亡调节因子mRNA表达
定量逆转录PCR检测结果显示,与假手术+AAV5-shRNA对照组比较,DMM+AAV5-shRNA对照组小鼠软骨MMP13、ADAMTS5、COX2和GPX4 mRNA表达水平明显升高(t=47.48、49.65、12.34和30.03,均P<0.01);与DMM+AAV5-shRNA组比较,DMM+AAV5-shNupr1组MMP13、ADAMTS5、COX2和GPX4 mRNA表达水平明显降低(t=28.7、20.92、6.461和8.692,均P<0.01),见表5。结果提示,敲低Nupr1能够减缓骨关节炎软骨细胞外基质降解,减少铁死亡主要调节因子GPX4的表达。
表5.
各组模型鼠软骨中细胞外基质和铁死亡调节因子 mRNA比较
| 组 别 | n | MMP13 | ADAMTS5 | COX2 | GPX4 |
|---|---|---|---|---|---|
| 假手术+AAV5-shRNA对照组 | 5 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 |
| 假手术+AAV5-shNupr1组 | 5 | 1.09±0.08 | 1.05±0.11 | 1.04±0.14 | 1.09±0.06 |
| DMM+AAV5-shRNA组 | 5 | 3.89±0.14** | 5.07±0.18** | 2.37±0.25** | 0.28±0.05** |
| DMM+AAV5-shNupr1组 | 5 | 1.68±0.11## | 2.81±0.16## | 1.47±0.19## | 0.69±0.09## |
与假手术+AAV5-shRNA对照组比较,** P<0.01;与DMM+AAV5-shRNA组比较,## P<0.01. AAV:腺相关病毒;shRNA:短发夹RNA;shNupr1:靶向核蛋白1的shRNA;DMM:内侧半月板失稳术;MMP:基质金属蛋白酶;ADAMTS:一种具有血小板反应蛋白基序的去整合素和金属蛋白酶;COX:环氧合酶;GPX:谷胱甘肽过氧化物酶.
±s
3. 讨论
骨关节炎是一种临床常见病和多发病,严重影响患者生活质量的关节退行性疾病。随着社会人口老龄化进度的加快,越来越多的中老年人被骨关节炎所困扰[1]。骨关节炎发病主要由软骨磨损、继发骨赘、滑膜炎、关节畸形等导致,是老年人残疾或进行膝关节置换术的主要原因[2-3]。研究发现,骨关节炎患者膝关节液中铁水平明显升高,且骨关节炎患者血清中铁蛋白水平与软骨损伤程度呈正相关,全身性铁过载更可引起豚鼠关节铁积累,并导致关节退行性改变[14-15]。在DMM诱导的小鼠模型中,软骨细胞铁死亡相关蛋白表达异常,而抑制铁死亡能够显著改善骨关节炎[5-6],表明靶向调控软骨细胞铁死亡可能是骨关节炎治疗的关键。从铁死亡这一新的程序性细胞死亡方式探究治疗骨关节炎的新靶点、新机制已成为目前的研究热点[16]。
大量研究证实,IL-1β和肿瘤坏死因子-α等促炎性细胞因子驱动的炎症反应是骨关节炎病理进展的关键[17]。由于IL-1β在骨关节炎中的促炎特性,目前较多研究使用10 ng/mL浓度的IL-1β诱导软骨细胞铁死亡[18-19]。亚铁离子是铁死亡的典型标志之一[20]。本研究观察到10 ng/mL浓度IL-1β可促进软骨细胞中亚铁离子水平升高,因此使用10 ng/mL浓度的IL-1β来建立骨关节炎软骨细胞铁死亡模型。
铁死亡的发生机制主要涉及细胞脂质的过氧化作用和抗氧化系统的失效[7]。在细胞脂质过氧化中,亚铁离子是铁死亡最为直接的促进因素[20],亚铁离子蓄积会触发胞膜脂质过氧化反应,甚至诱导氧化应激,促进活性氧和MDA大量积聚,导致细胞氧化损伤并走向死亡[21]。抗氧化系统受损是导致脂质过氧化累积的关键[22]。抗氧化酶GSH作为细胞内的主要抗氧化剂,是GPX4的优先选择底物;通过GPX4的作用,GSH可以有效降低细胞内活性氧累积,进而抑制铁死亡[23]。相反,抑制GSH和GPX4活性可导致脂质过氧化物积累,同时,ACSL4能够激活多不饱和脂肪酸,通过改变脂质组成协同促进脂质过氧化反应,促进铁死亡的发生[24]。SLC7A11是控制铁死亡的关键调控因子,而P53作为防癌基因,能够抑制SLC7A11的活性和表达,调控GPX4表达,促进细胞铁死亡[25]。
转录调节因子Nupr1亦称为p8或Com1,是一种小分子调节蛋白,涉及多个细胞生理和信号传导过程[8]。正常生理条件下,Nupr1表达水平非常低,但在内质网应激、DNA损伤、活性氧增加等应激条件下,Nupr1可被诱导并启动下游基因转录,发挥相应作用[26]。研究显示,Nupr1可在人骨关节炎关节软骨和老年猴关节软骨中表达升高,并通过内质网应激调节软骨细胞凋亡保护骨关节炎软骨[27-28]。在胰腺癌中,Nupr1表达与铁死亡关系密切,被认为是铁死亡的关键抑制剂[9],但Nupr1在骨关节炎软骨中的具体作用机制尚未完全明确。为更加全面阐释Nupr1在骨关节炎软骨中的作用,本研究利用siRNA靶向敲低Nupr1观察其对软骨细胞铁死亡的影响,结果显示siNupr1能够降低Nupr1蛋白和mRNA表达水平。敲低Nupr1后,软骨细胞中亚铁离子、脂质活性氧、MDA含量明显减少,GSH含量增加,铁死亡相关蛋白ACSL4、P53蛋白表达下降,GPX4、SLC7A11蛋白表达升高。由此可见,敲低Nupr1对IL-1β诱导的软骨细胞铁死亡有抑制作用。为进一步探明敲低Nupr1对骨关节炎软骨的影响,本研究利用AAV干扰技术敲低Nupr1后发现小鼠软骨退变得到明显改善。另外,MMP13、ADAMTS5、COX2和GPX4 mRNA表达减少提示敲低Nupr1能够减缓骨关节炎软骨细胞外基质降解,减少GPX4表达,发挥保护骨关节炎软骨延缓骨关节炎病理进展的作用。
探究软骨细胞铁死亡过程中关键分子靶点的病理机制,对于骨关节炎关节软骨保护具有重要的研究价值。本研究阐明了IL-1β诱导软骨细胞铁死亡后,敲低Nupr1可以抑制P53/SLC7A11/GPX4信号轴改善小鼠软骨细胞的铁死亡表型;且体内实验表明Nupr1可能是骨关节炎发挥治疗作用的潜在靶点。总之,Nupr1可能通过调控软骨细胞的铁死亡来调控小鼠骨关节炎的病理进展。这项研究结果为骨关节炎治疗药物的开发开辟了新的研究路径。
医学伦理 本研究遵循本机构和国家有关实验动物管理和使用的规定,并通过南京中医药大学伦理委员会审查(202302A016)
Acknowledgments
研究得到国家自然科学基金(82274545)、江苏省医学重点学科/实验室建设单位(JSDW202252)、江苏省中医院第三批高峰学术人才(y2021rc02)、江苏省中医院中医膝骨关节炎临床医学创新中心(Y2023zx05)支持
Acknowledgments
This work was supported by the National Natural Science Foundation of China (82274545), Medical Key Discipline/Laboratory Cultivation Unit of Jiangsu Province (JSDW202252), Peak Academic Talent Project of Jiangsu Province Hospital of Chinese Medicine (y2021rc02), and Clinical Medical Innovation Center for Knee Osteoarthritis in Jiangsu Province Hospital of Chinese Medicine (Y2023zx05)
[缩略语]
核蛋白(nuclear protein,Nupr);无特定病原体(specific pathogen free,SPF);谷胱甘肽过氧化物酶(glutathione peroxidase,GPX);溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11);酰基辅酶A合成酶长链家族(acyl-CoA synthetase long-chain family,ACSL);辣根过氧化物酶(horseradish peroxidase,HRP);细胞计数试剂盒(cell counting kit,CCK);丙二醛(malondialdehyde,MDA);谷胱甘肽(glutathione,GSH);聚合酶链反应(polymerase chain reaction,PCR);小干扰RNA(small interfering RNA,siRNA);腺相关病毒(adeno-associated virus,AAV);苏木精-伊红染色(hematoxylin and eosin staining,HE染色);靶向Nupr1的siRNA(siRNA targeting Nupr1,siNupr1);含吐温-20的Tris缓冲液(Tris buffered saline with Tween-20,TBST);Hanks’平衡盐溶液(Hank’s Balanced Salt Solution,HBSS);还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphat,NADPH);短发夹RNA(short hairpin RNA,shRNA);靶向Nupr1的shRNA(shRNA targeting Nupr1,shNupr1);内侧半月板失稳(destabilization of the medial meniscus,DMM);国际骨关节炎研究协会(Osteoarthritis Research Society International,OARSI);基质金属蛋白酶(matrix metalloproteinase,MMP);一种具有血小板反应蛋白基序的去整合素和金属蛋白酶(a disintegrin and metalloproteinase with thrombospondin motifs,ADAMTS);环氧合酶(cyclooxygenase,COX)
利益冲突声明
所有作者均声明不存在利益冲突
Conflict of Interests
The authors declare that there is no conflict of interests
Ethical Approval
All applicable institutional and/or national guidelines for the care and use of animals were followed, and the research protocol of animal experiments was approved by the Ethics Committee of Nanjing University of Chinese Medicine (202302A016)
参考文献(References)
- 1.ALLEN K D, THOMA L M, GOLIGHTLY Y M. Epi-demiology of osteoarthritis[J]. Osteoarthritis Cartilage, 2022, 30(2): 184-195. 10.1016/j.joca.2021.04.020 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.SAFIRI S, KOLAHI A A, SMITH E, et al. Global, regional and national burden of osteoarthritis 1990—2017: a systematic analysis of the Global Burden of Disease Study 2017[J]. Ann Rheum Dis, 2020, 79(6): 819-828. 10.1136/annrheumdis-2019-216515 [DOI] [PubMed] [Google Scholar]
- 3.冯晓晴, 蔡道章, 余星磊, 等. 基于GBD大数据中国膝骨关节炎疾病负担现状与趋势分析[J]. 现代预防医学, 2022, 49(10): 1753-1760. [Google Scholar]; FENG Xiaoqing, CAI Daozhang, YU Xinglei, et al. Analysis of current status and trends of disease burden of knee osteoarthritis in China based on GBD big data[J]. Modern Preventive Medicine, 2022, 49(10): 1753-1760. (in Chinese) [Google Scholar]
- 4.HUNTER D J, MARCH L, CHEW M. Osteoarthritis in 2020 and beyond: a Lancet commission[J]. Lancet, 2020, 396(10264): 1711-1712. 10.1016/s0140-6736(20)32230-3 [DOI] [PubMed] [Google Scholar]
- 5.MIAO Y, CHEN Y, XUE F, et al. Contribution of fer-roptosis and GPX4’s dual functions to osteoarthritis progression[J]. EBioMedicine, 2022, 76: 103847. 10.1016/j.ebiom.2022.103847 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.ZHOU R, CHEN Y, LI S, et al. TRPM7 channel inhibi-tion attenuates rheumatoid arthritis articular chondro-cyte ferroptosis by suppression of the PKCα-NOX4 axis[J]. Redox Biol, 2022, 55: 102411. 10.1016/j.redox.2022.102411 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.LIANG D, MINIKES A M, JIANG X. Ferroptosis at the intersection of lipid metabolism and cellular signaling[J]. Mol Cell, 2022, 82(12): 2215-2227. 10.1016/j.molcel.2022.03.022 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.WANG C, WANG T, LI K J, et al. SETD4 inhibits prostate cancer development by promoting H3K27me3-mediated NUPR1 transcriptional repression and cell cycle arrest[J]. Cancer Lett, 2023, 579: 216464. 10.1016/j.canlet.2023.216464 [DOI] [PubMed] [Google Scholar]
- 9.LIU J, SONG X, KUANG F, et al. NUPR1 is a critical repressor of ferroptosis[J]. Nat Commun, 2021, 12(1): 647. 10.1038/s41467-021-20904-2 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.廖太阳, 李晓辰, 杨楠, 等. 白芍总苷经活性氧-线粒体途径改善骨关节炎软骨细胞自噬性死亡[J]. 医学研究与战创伤救治, 2023, 36(4): 337-342. 10.16571/j.cnki.2097-2768.2023.04.001 [DOI] [Google Scholar]; LIAO Taiyang, LI Xiaochen, YANG Nan, et al. Total glucosides of paeony ameliorated autophagic death of osteoarthritis chondrocytes by reactive oxygen species-mitochondria pathway[J]. Journal of Medical Research & Combat Trauma Care, 2023, 36(4): 337-342. (in Chinese) . [Google Scholar]
- 11.WAN Y, SHEN K, YU H, et al. Baicalein limits osteo-arthritis development by inhibiting chondrocyte ferroptosis[J]. Free Radic Biol Med, 2023, 196: 108-120. 10.1016/j.freeradbiomed.2023.01.006 [DOI] [PubMed] [Google Scholar]
- 12.GLASSON S S, BLANCHET T J, MORRIS E A. The surgical destabilization of the medial meniscus (DMM) model of osteoarthritis in the 129/SvEv mouse[J]. Osteo-arthritis Cartilage, 2007, 15(9): 1061-1069. 10.1016/j.joca.2007.03.006 [DOI] [PubMed] [Google Scholar]
- 13.PRITZKER K P, GAY S, JIMENEZ S A, et al. Osteo-arthritis cartilage histopathology: grading and staging[J]. Osteoarthritis Cartilage, 2006, 14(1): 13-29. 10.1016/j.joca.2005.07.014 [DOI] [PubMed] [Google Scholar]
- 14.VINCHI F, PORTO G, SIMMELBAUER A, et al. Ath-erosclerosis is aggravated by iron overload and amelio-rated by dietary and pharmacological iron restriction[J]. Eur Heart J, 2020, 41(28): 2681-2695. 10.1093/eurheartj/ehz112 [DOI] [PubMed] [Google Scholar]
- 15.WARD R J, ZUCCA F A, DUYN J H, et al. The role of iron in brain ageing and neurodegenerative disorders[J]. Lancet Neurol, 2014, 13(10): 1045-1060. 10.1016/s1474-4422(14)70117-6 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.李浩, 吴勉华, 马艳霞, 等. 中药调控铁死亡抑制肝纤维化的研究进展[J]. 南京中医药大学学报, 2023, 39(6): 587-593. [Google Scholar]; LI Hao, WU Mianhua, MA Yanxia, et al. Research progress of traditional chinese medicine regulating ferroptosis to inhibit hepatic fibrosis[J]. Journal of Nanjing University of Traditional Chinese Medicine, 2023, 39(6): 587-593. (in Chinese) [Google Scholar]
- 17.LIAO T, SHI L, HE C, et al. Suppression of NUPR1 in fibroblast-like synoviocytes reduces synovial fibrosis via the Smad3 pathway[J]. J Transl Med, 2024, 22(1): 715. 10.1186/s12967-024-05540-w [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.ZHAO C, SUN G, LI Y, et al. Forkhead box O3 atten-uates osteoarthritis by suppressing ferroptosis through inactivation of NF-κB/MAPK signaling[J]. J Orthop Translat, 2023, 39: 147-162. 10.1016/j.jot.2023.02.005 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.SUN J, ZHANG Y, WANG C, et al. Kukoamine A pro-tects mice against osteoarthritis by inhibiting chondro-cyte inflammation and ferroptosis via SIRT1/GPX4 signaling pathway[J]. Life Sci, 2023, 332: 122117. 10.1016/j.lfs.2023.122117 [DOI] [PubMed] [Google Scholar]
- 20.CHEN G H, SONG C C, PANTOPOULOS K, et al. Mitochondrial oxidative stress mediated Fe-induced ferroptosis via the NRF2-ARE pathway[J]. Free Radic Biol Med, 2022, 180: 95-107. 10.1016/j.freeradbiomed.2022.01.012 [DOI] [PubMed] [Google Scholar]
- 21.TONG J, LAN X T, ZHANG Z, et al. Ferroptosis inhi-bitor liproxstatin-1 alleviates metabolic dysfunction-associated fatty liver disease in mice: potential involve-ment of PANoptosis[J]. Acta Pharmacol Sin, 2023, 44(5): 1014-1028. 10.1038/s41401-022-01010-5 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.RUAN Q, WANG C, ZHANG Y, et al. Brevilin A attenu-ates cartilage destruction in osteoarthritis mouse model by inhibiting inflammation and ferroptosis via SIRT1/Nrf2/GPX4 signaling pathway[J]. Int Immunophar-macol, 2023, 124(Pt B): 110924. 10.1016/j.intimp.2023.110924 [DOI] [PubMed] [Google Scholar]
- 23.FU C, WU Y, LIU S, et al. Rehmannioside A improves cognitive impairment and alleviates ferroptosis via activating PI3K/AKT/Nrf2 and SLC7A11/GPX4 sig-naling pathway after ischemia[J]. J Ethnopharmacol, 2022, 289: 115021. 10.1016/j.jep.2022.115021 [DOI] [PubMed] [Google Scholar]
- 24.BI X, WU X, CHEN J, et al. Characterization of ferroptosis-triggered pyroptotic signaling in heart failure[J]. Signal Transduct Target Ther, 2024, 9(1): 257. 10.1038/s41392-024-01962-6 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.YANG Y, MA Y, LI Q, et al. STAT6 inhibits ferroptosis and alleviates acute lung injury via regulating P53/SLC7A11 pathway[J]. Cell Death Dis, 2022, 13(6): 530. 10.1038/s41419-022-04971-x [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.LIU S, COSTA M. The role of NUPR1 in response to stress and cancer development[J]. Toxicol Appl Phar-macol, 2022, 454: 116244. 10.1016/j.taap.2022.116244 [DOI] [PubMed] [Google Scholar]
- 27.YAMMANI R R, LOESER R F. Brief report: stress-inducible nuclear protein 1 regulates matrix metallo-proteinase 13 expression in human articular chondrocytes[J]. Arthritis Rheumatol, 2014, 66(5): 1266-1271. 10.1002/art.38391 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.TAN L, REGISTER T C, YAMMANI R R. Age-related decline in expression of molecular chaperones induces endoplasmic reticulum stress and chondrocyte apoptosis in articular cartilage[J]. Aging Dis, 2020, 11(5): 1091-1102. 10.14336/ad.2019.1130 [DOI] [PMC free article] [PubMed] [Google Scholar]