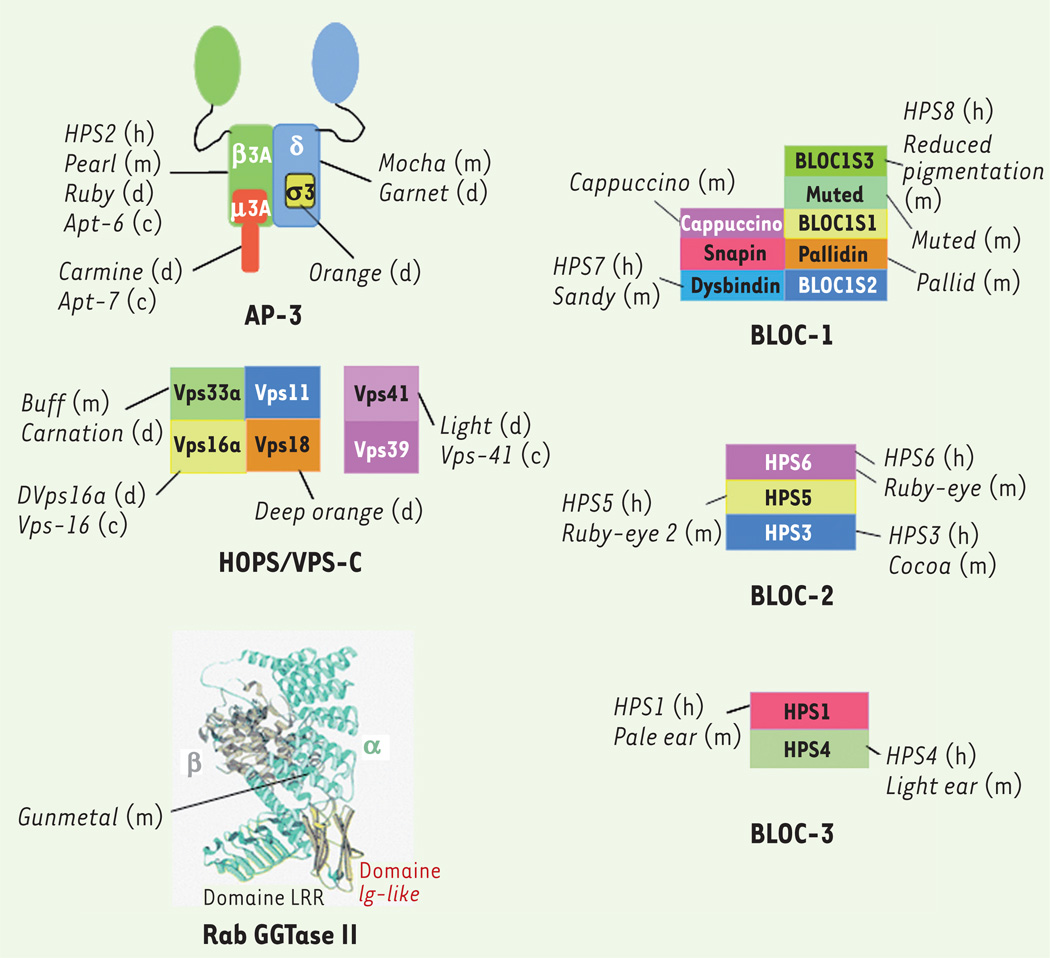
Figure 5. Protéines mutées dans le syndrome d’Hermansky-Pudlak (HPS).
Le HPS résulte de la mutation d’au moins un gène parmi huit gènes candidats chez l’homme et huit supplémentaires chez la souris. De plus, les mutations de gènes homologues chez Drosophila melanogaster et Caenorhabditis elegans causent respectivement une malformation des granules pigmentaires de l’œil ou des granules de l’intestin. La quasi-totalité de ces gènes codent pour des sous-unités de complexes protéiques ubiquitaires impliquées dans la biogenèse des LRO. Certains d’entre eux ont une fonction connue dans le trafic intra cellulaire. Le complexe AP-3 interagit avec des séquences d’acides aminés présentes dans le domaine cytosolique de protéines transmembranaires. Il est impliqué dans leur transport des endosomes vers les lysosomes ou les organites apparentés aux lysosomes. Le complexe HOPS (homotypic protein sorting) interagit avec les protéines SNARE (soluble N-ethylmaleimide sensitive factor [NSF] attachment protein receptors) impliquées dans la fusion membranaire. La géranyl géranyl Rab transférase II (RabGGTase II) catalyse la prénylation de petites GTPases de la famille Rab, une modification nécessaire à leur association aux membranes. Par exemple, une diminution de son activité dans les souris Gunmetal entraîne la localisation cytosolique de certaines Rab et bloquent ainsi des étapes de trafic membranaire. En revanche, les sous-unités des complexes BLOC (biogenesis of lysosome related organelles) BLOC-1, BLOC-2, BLOC-3 ne présentent ni motifs structuraux, ni homologies significatives avec des protéines connues et leurs fonctions restent mal comprises. Cette figure illustre les sous-unités des différents complexes connus chez l’homme (h), la souris (m), la drosophile (d) ou C. elegans (c). Structure de Rab GGTase II : vert, domaine hélical de la sous-unité α ; jaune : domaine Ig-like ; vert en feuillets : domaine LRR (leucine rich repeat) ; gris : sous-unité β (d’après [4]).