Résumé
Objectif
Présenter aux cliniciens une mise à jour sur le diagnostic de la maladie cœliaque (MC), ainsi que des recommandations sur les indications de procéder au dépistage de la MC chez les patients présentant une faible densité minérale osseuse (DMO) ou des fractures de fragilité.
Qualité des données
Un groupe de travail multidisciplinaire a élaboré des questions cliniquement pertinentes relativement au diagnostic de la MC servant de fondement à une recherche documentaire dans les bases de données MEDLINE, EMBASE et CENTRAL (de janvier 2000 à janvier 2009) à l’aide des mots clés en anglais celiac disease, osteoporosis, osteopenia, low bone mass et fracture. Les ouvrages scientifiques existants comportent des études de niveaux I et II.
Message principal
La prévalence estimée de la MC asymptomatique est de 2 % à 3 % chez les personnes qui ont une faible DMO. Par ailleurs, un dépistage ciblé est recommandé pour les patients qui ont des T-scores de −1,0 ou moins à la colonne vertébrale ou aux hanches ou des antécédents de fractures de fragilité associées à des symptômes ou à des problèmes reliés à la MC, des antécédents familiaux de MC ou de bas niveaux de calcium urinaire, une insuffisance en vitamine D et des niveaux à la hausse d’hormones parathyroïdiennes en dépit d’un apport suffisant en calcium et en vitamine D. Le dépistage de la MC devrait se faire pendant que le sujet consomme un régime alimentaire contenant du gluten. On procède au dépistage initial par le dosage d’immunoglobuline (Ig) A antitransglutaminase en utilisant la transglutaminase tissulaire humaine recombinante ou une autre transglutaminase tissulaire, en association avec l’immunofluorescence des IgA anti-endomysium. Une biopsie du duodénum est nécessaire pour confirmer le diagnostic de la MC. Le typage des antigènes des leucocytes humains peut aider à confirmer ou à exclure le diagnostic de la MC dans les cas où la sérologie et l’histologie ne concordent pas. Le diagnostic définitif se fonde sur les caractéristiques cliniques, sérologiques et histologiques combinées à une réponse positive à une alimentation sans gluten.
La maladie cœliaque (MC) est une entéropathie auto-immune génétique causée par une réaction immunitaire au gluten. Habituellement, la MC se présente sous forme de diarrhée chronique, de douleurs abdominales et de malabsorption. L’intestin grêle subit une atrophie et une inflammation de la muqueuse, qui s’améliorent lorsque la personne adopte un régime sans gluten (RSG)1–4. Le spectre clinique de la MC est vaste, comportant notamment des différences marquées dans la gravité des symptômes et l’histologie1–6. Selon une récente synthèse systématique, la prévalence de la MC est de près de 1 % à l’échelle mondiale7–12. Les enfants présentent souvent de la diarrhée, une distension abdominale et une insuffisance de développement; chez les adolescents et les adultes, on observe plus communément de légers symptômes gastro-intestinaux qui durent depuis des années13,14. La maladie cœliaque peut aussi être complètement asymptomatique (forme silencieuse) et n’est détectée que par dépistage sérologique ou par pur hasard durant une endoscopie supérieure.
Les patients atteints d’une ostéoporose, qui se manifeste sous forme de faible densité minérale osseuse (DMO) observée par absorptiométrie biphotonique à rayons X ou encore de fractures de fragilité, devraient être évalués pour en trouver les causes secondaires, y compris la MC15–17. La maladie cœliaque cause une hyperparathyroïdie et de l’ostéomalacie dues à une malabsorption du calcium et de la vitamine D18–20. Les marqueurs de la résorption osseuse augmentent et ne sont pas contrebalancés par les marqueurs de la formation osseuse, résultant en une perte nette de masse osseuse21. L’inflammation chronique due à des niveaux accrus de cytokines pro-inflammatoires et des niveaux diminués de cytokines inhibitrices cause la perte osseuse en raison d’effets directs sur l’ostéoclastogenèse et l’activité des ostéoblastes22–27. Un ratio plus élevé du ligand de l’activateur du récepteur NFκB par rapport à l’ostéoprotégérine a aussi été impliqué21,28. L’hypogonadisme associé avec la MC pourrait aussi contribuer à la perte osseuse29.
Les patients atteints de la MC sont à risque accru de fractures, en particulier au squelette périphérique30,31. Une récente méta-analyse a démontré que les rapports de cotes regroupés pour toutes les fractures chez des patients atteints de MC se situaient à 1,43 par rapport aux groupes témoins32. De nombreuses études font valoir des améliorations considérables à la DMO après l’adoption d’un RSG33–36. Il est plausible qu’un diagnostic précoce de la MC chez des patients ayant une faible DMO pourrait aider à prévenir les fractures. Par ailleurs, aucune donnée n’indique une augmentation du risque de fractures chez les patients atteints de la MC identifiés par dépistage37 et il n’existe pas d’études directes sur les effets d’un RSG sur le risque de fractures. Par conséquent, il n’y a actuellement pas de consensus sur la question de savoir s’il faut dépister la MC chez des patients ayant une faible DMO. La reconnaissance de la nécessité d’établir des approches fondées sur des données probantes dans ce domaine a motivé la formation d’un groupe de travail canadien chargé d’examiner les ouvrages scientifiques pertinents et de présenter des conseils cliniques pour le diagnostic de la MC chez les personnes ayant une faible DMO ou des fractures de fragilité. La clinique des troubles du calcium du St Joseph’s Healthcare Hamilton de la McMaster University en Ontario, en coopération avec des membres de sociétés nationales des domaines connexes, a dirigé et soutenu cette initiative. La présente révision insiste principalement sur la population adulte.
Qualité des données
Nous avons fait une recherche documentaire dans les bases de données MEDLINE, EMBASE et CENTRAL de janvier 2000 à janvier 2009 à l’aide des mots clés en anglais celiac disease, osteoporosis, osteopenia, low bone mass et fracture. Tous les articles pertinents portant sur la relation entre l’ostéoporose et la MC et sur la prévalence et le diagnostic de la MC ont été examinés aux fins de leur inclusion. Les lignes directrices internationales sur la MC publiées après 2000 ont aussi fait l’objet d’un examen. La qualité des données probantes a été classifiée selon les critères du Groupe d’étude canadien sur les soins de santé préventifs (Encadré 1)38. La qualité des données est jugée bonne pour certaines des questions et passable ou absente pour d’autres.
Encadré 1. Niveaux des données probantes adaptés de ceux du Groupe d’étude canadien sur les soins de santé préventifs.
| Niveau I: Au moins une étude randomisée contrôlée, une synthèse systématique ou une méta-analyse |
| Niveau II: Autres études comparatives, non randomisées, de cohorte, cas-témoins ou épidémiologiques et préférablement plusieurs |
| Niveau III: Opinion d’experts ou déclaration consensuelle |
Adaptation des niveaux du Groupe d’étude canadien sur les soins de santé préventifs38
Comment diagnostique-t-on la MC?
Il n’existe pas de test universel unique pour diagnostiquer la MC; le diagnostic définitif exige une évaluation clinique, des analyses sérologiques et une biopsie du duodénum, souvent complétées par une réponse clinique ou histologique à un RSG. Les constatations sérologiques, cliniques et histologiques ne concordent pas dans environ 10 % des cas2. Les tests initiaux devraient être effectués pendant que le patient consomme un régime avec gluten, parce que l’exclusion du gluten dans l’alimentation pourrait produire des résultats faux-négatifs.
Analyses sérologiques
À l’heure actuelle, les meilleures analyses disponibles sont le dosage des immunoglobulines (Ig) A contre l’antigène antitransglutaminase tissulaire (tTG) et l’immunofluorescence des IgA anti-endomysium (EMA). Les 2 ont une exactitude diagnostique comparable, leur spécificité se situant à près de 100 % et leur sensibilité entre 90 % et 98 %39. L’épreuve de l’immunoglobuline A tTG est privilégiée parce qu’elle est automatisée, moins coûteuse et plus rapide. L’épreuve de l’immunoglobuline A tTG a été validée en pratique clinique et c’est un excellent outil pour exclure un diagnostic de MC dans les populations à risque faible ou intermédiaire40.
Le dosage des IgG EMA et tTG a généralement une plus faible sensibilité6,39 et il sert davantage à détecter la MC chez les patients ayant une déficience en IgA41,42.
Le dosage des anticorps antigliadine n’est plus recommandé systématiquement en raison de sa faible sensibilité (moins de 80 %) et de sa moins grande spécificité (de 80 % à 90 %)6,39.
Analyses histologiques
Le critère standard pour le diagnostic de la MC est l’atrophie villositaire observée lors d’une biopsie duodénale. On recommande un rapport histologique standardisé en fonction des critères de Marsh modifiés (Tableau 1)43–45. Étant donné que les changements à la muqueuse peuvent être épars, on devrait prélever au moins 4 à 6 spécimens de biopsie pour assurer une sensibilité optimale du test46,47. Des résultats faux-négatifs peuvent aussi se produire si les patients prennent des immunosuppresseurs, des corticostéroïdes ou s’ils suivent un RSG. Les constatations histologiques sont caractéristiques d’une MC mais n’y sont pas spécifiques, car des résultats semblables sont aussi présents dans la sprue tropicale l’entéropathie due au VIH, une infestation de Giardia lamblia et l’immunodéficience variable courante. Si les résultats sérologiques et histologiques ne concordent pas, le typage des antigènes des leucocytes humains (HLA) pourrait être utile au diagnostic, car les HLA-DQ2 et les HLA-DQ8 sont présents chez presque toutes les personnes atteintes de la MC, mais chez seulement de 30 % à 40 % dans la population en général. Par conséquent, l’absence de ces allèles a une valeur prédictive négative élevée et peut presque exclure complètement un diagnostic de MC48. Le typage des antigènes des leucocytes humains est aussi utile pour identifier les proches parents à risque d’une MC qui pourraient bénéficier d’un dépistage longitudinal de la MC par sérologie2.
Tableau 1.
Classement histologique des changements à la muqueuse du duodénum selon les critères de Marsh modifiés
| STADE | CHANGEMENTS À LA MUQUEUSE | DESCRIPTION |
|---|---|---|
| 0 | Normal | Architecture normale de la muqueuse |
| I | Infiltration | Architecture normale de la muqueuse L’épithélium des villosités est infiltré par des lymphocytes (> 30 par 100 entérocytes) |
| II | Hyperplasique | Hyperplasie des cryptes avec infiltration de cellules inflammatoires |
| III | Atrophie villositaire | |
| IIIa | • Partielle | Villosités raccourcies et arrondies associées à une légère infiltration de lymphocytes et à une hyperplasie des cryptes |
| IIIb | • Sous-totale | Villosités clairement atrophiques mais encore reconnaissables Signes d’hyperplasie des cryptes et infiltration des cellules inflammatoires à la hausse |
| IIIc | • Totale | Absence presque totale de villosités Lésions atrophiques, hyperplasiques et infiltrantes sévères |
| IV | Hypoplasique | Atrophie villositaire totale Hypoplasie des cryptes Numération normale des lymphocytes intra épithélium |
Adaptation de Buchman45
Chez qui devrait-on faire un dépistage de la MC?
Le rôle d’un dépistage de masse de la MC demeure controversé45,49,50 ; ses adeptes insistent sur la forte prévalence de la MC et les cancers et fractures de fragilité qui lui sont associés. Réciproquement, ses opposants mentionnent le manque de connaissances à propos de la progression de la MC asymptomatique, le manque d’observance d’un régime par les personnes chez qui la MC est détectée par dépistage et la moins bonne qualité de vie qu’entraine un RSG permanent chez des personnes autrement asymptomatiques. Il a donc été proposé que le dépistage soit limité aux personnes à plus haut risque d’une MC51.
Les patients ayant une faible DMO ont-ils un risque accru de MC?
Nous avons mis à jour les données tirées d’une synthèse systématique antérieure sur la prévalence de la MC diagnostiquée par dépistage chez des patients ayant une faible DMO7 à l’aide de la même stratégie de recherche et des mêmes critères d’inclusion pour les études allant jusqu’en juin 2008. Nous avons inclus 8 études et la prévalence de la MC variait entre 0 % et 3,4 % (Tableau 2)52–59. Seulement 4 études appliquaient le même algorithme de dépistage aux patients ayant une faible DMO et aux groupes témoins. Elles démontraient généralement une plus grande prévalence de la MC chez les patients ayant une faible DMO (Tableau 3)52,53,57,58. En se fondant sur ces résultats, on peut raisonnablement estimer la prévalence de la MC entre 2 % et 3 % dans les populations à faible DMO, par rapport à 1 % ou moins dans l’ensemble de la population.
Tableau 2.
Prévalence de la MC détectée par dépistage chez des patients présentant une faible densité minérale osseuse.
| AUTEUR, ANNÉE, PAYS | T-SCORE | ÉCHANTILLON | SEXE FÉMININ, % | ÂGE, ANS | ALGORITHME DE DÉPISTAGE | CRITÈRES DE LA BIOPSIE | PRÉVALENCE DE LA MC (IC À 95), % |
|---|---|---|---|---|---|---|---|
| Drummond et collab.52, 2003, Irlande | ≤ −1.0 | 366 | 100 | Moyenne de 56 (DS 11,5; de 28 à 96) | IgA EMA et IgA tTG | ND | 2,2 (1,1–4,2) |
| González et collab.53, 2002, Argentine | < −2,5 | 127 | 100 | Moyenne de 68 (de 50 à 82) | 1. IgA AGA 2. IgA EMA |
Marsh III | 0,8 (0,02–4,31) |
| Lindh et collab.54, 1992, Suède | ND | 92 | 91 | Moyenne de 66 (DS 12) | IgA AGA | ND | 3,3 (1,1–9,1) |
| Mather et collab.55, 2001, Canada | ≤ −1,0 | 96 | 81 | Moyenne de 57 (de 18 à 86) | IgA EMA | ND | 0 (0–3,8) |
| Nuti et collab.56, 2001, Italie | ≤ −2,5 | 255 | 100 | Moyenne de 66 (DS 8,5) | 1. IgA AGA 2. IgA tTG |
ND | 2,3 (1,1–5,0) |
| Sanders et collab.57, 2005, Royaume-Uni | ≤ −1,0 | 674 | 95 | Moyenne de 53 (de 21 à 69) | IgA AGA et IgA EMA | ESPGHAN | 1,5 (0,8–2,7) |
| Stenson et collab.58, 2005, États-Unis | ≤ −2,5 | 266 | 90 | Moyenne de 57 (DS 12) | IgA EMA et IgA tTG | Marsh III | 3,4 (1,8–6,3) |
| Karakan et collab.59, 2007, Turquie | ≤ −1,0 | 135 | 90 | Moyenne de 57,2 (de 24 à 81) | IgA EMA | ND | 0 (0–2,7) |
AGA—anticorps antigliadine, MC—maladie cœliaque, EMA—anticorps anti-endomysium, ESPGHAN—European Society of Paediatric Gastroenterology, Hepatology and Nutrition, Ig—immunoglobuline, ND—non disponible, tTG—transglutaminase tissulaire, DS—déviation standard.
Tableau 3.
Risque d’une MC chez des patients ayant une faible DMO par rapport aux groupes témoins évalués selon les mêmes algorithmes de dépistage
| AUTEUR, ANNÉE, PAYS | CARACTÉRISTIQUES DES PATIENTS AYANT UNE FAIBLE DMO | CARACTÉRISTIQUES DU GROUPE TÉMOIN | PRÉVALENCE DE LA MC CHEZ LES PATIENTS AYANT UNE FAIBLE DMO, % (CAS/N) | PRÉVALENCE DE LA MC DANS LE GROUPE TÉMOIN, % (CAS/N) | VALEUR P |
|---|---|---|---|---|---|
| Drummond et collab.52, 2003, Irlande | 366 femmes (82 % post-ménopause) fréquentant une unité de densitométrie osseuse Âge moyen de 56 ans (de 28 à 96) T-score ≤ −1,0 |
89 femmes (45 % post-ménopause) fréquentant la même unité de densitométrie osseuse T-score > −1,0 |
2,2 (8/366) | 0 (0/89) | ,364 |
| González et collab.53, 2002, Argentine | 127 femmes post-ménopause Âge moyen de 68 ans (de 50 à 82 ans) T-score < −2,5 |
747 femmes, âge moyen de 29 ans (de 16 à 79 ans) devant subir l’examen prénuptial obligatoire dans la même région | 0,8 (1/127) | 0,8 (6/747) | > ,99 |
|
|
|||||
| Sanders et collab.57, 2005, Royaume-Uni | 674 personnes (95 % de femmes) qui ont passé un examen DEXA en soins primaires ou secondaires Âge moyen de 53 ans (de 21 à 69 ans) Groupe total : T-score ≤ −1,0 |
304 personnes de la même population T-score > −1,0 |
1,5 (10/674) | 0,7 (2/304) | ,360 |
| Ostéopénie: T-score −2,5 ≤ −1,0 | 1,2 (5/431) | 0,7 (2/304) | ,7058 | ||
| Ostéoporose: T-score ≤ −2,5 | 2,1 (5/243) | 0,7 (2/304) | ,2505 | ||
| Stenson et collab.58, 2005, États-Unis | 266 personnes (90 % de femmes, la plupart post-ménopause) fréquentant une clinique universitaire de la santé des os Âge moyen de 57 ans T-score ≤ −2,5 |
574 personnes (90 % de femmes, la plupart post-ménopause) fréquentant la même clinique Âge moyen de 63,2 ans T-score > −2,5 |
3,4 (9/266) | 0,2 (1/574) | < ,001 |
DMO—densité minérale osseuse, MC—maladie cœliaque, DEXA—absorptiométrie biphotonique à rayons X.
Des groupes spécifiques de patients ayant une faible DMO ont-ils un risque plus élevé de MC?
Diverses études ont établi une corrélation entre la gravité de la MC et la gravité de la perte osseuse. Il semble que la MC est plus susceptible d’être diagnostiquée chez les patients ayant une faible DMO s’ils ont des T-scores de −2.5 ou moins, des niveaux élevés d’hormones parathyroïdiennes ou une insuffisance en vitamine D56–58 et des symptômes gastro-intestinaux non expliqués57,58. Il faudrait toutefois plus de recherche pour confirmer ces facteurs de prédiction.
Devrait-on faire le dépistage de la MC chez tous les patients ayant une faible DMO?
Jusqu’à présent, il n’y a pas d’étude sur la rentabilité d’un dépistage systématique de la MC chez tous les patients ayant une faible DMO. Les données actuelles font valoir que le dépistage sérologique ne serait pas rentable dans cette population dans laquelle la prévalence de la MC est faible, car il entrainerait de nombreux résultats faux-positifs, ce qui exigerait des tests additionnels inutiles. L’ajout du typage des HLA pour les patients ayant des résultats sérologiques positifs réduirait les cas de faux-positifs48. Cependant, la rentabilité d’une telle approche est inconnue. Les données probantes actuelles ne corroborent pas la nécessité d’un dépistage systématique de la MC chez tous les patients ayant une faible DMO, quoique cela n’empêche pas l’adoption d’une approche ciblée de recherche de cas, comme on la décrit ci-après.
Dépistage de la MC : approche ciblée de recherche de cas
La suspicion clinique d’une MC augmente avec des symptômes associés à la MC, des antécédents familiaux et des troubles connexes de cette maladie1,3,7. Le Tableau 4 décrit la prévalence de la MC chez les personnes ayant ces caractéristiques3,7,60–66.
Tableau 4.
Problèmes associés à un risque accru de MC
| PROBLÈME | PRÉVALENCE DE LA MC, % | RÉFÉRENCES |
|---|---|---|
| Dermatite herpétiforme* | 69,0–89,0 | Hopper et collab.3 |
| Parents du premier degré de personnes ayant une MC connue | 4,0–12,0 | Dubé et collab.7 |
| Anémie ferriprive | 2,3–8,7 | Dubé et collab.7 |
| Infertilité inexpliquée | 2,1–4,1 | Dubé et collab.7 |
| Hausse inexpliquée des taux de transaminase | 1,5–9,0 | Dubé et collab.7 |
| Diabète de type 1 | 1–11 | Dubé et collab.7 |
| Maladie hépatique auto-immune | 0,0–6,4 | Dubé et collab.7 |
| Thyroïdite auto-immune | 1,5–6,7 | Dubé et collab.7 |
| Maladie d’Addison | 1,2–11,0 | Betterle et collab.60,61 Myhre et collab.62 |
| Ataxie de cause inconnue | 1,9–16,0 | Bushara63 |
| Syndrome de Down | 3,0–12,0 | Dubé et collab.7 |
| Syndrome de Turner | 2,0–10,0 | Dubé et collab.7 |
| Ulcères aphteux récurrents idiopathiques | 5,0 | Jokinen et collab.64 |
| Alopécie en aires | 1,0–2,0 | Corazza et collab.65 Fessatou et collab.66 |
| Faible densité minérale osseuse | 0,0–3,4 | Discuté dans le texte |
MC—maladie cœliaque
Les patients souffrant de ce problème devraient subir une biopsie du duodénum qu’importe si une épreuve sérologique de dépistage de la MC est effectuée ou non.
L’Encadré 2 donne la liste des cas où il est indiqué de faire un dépistage de la MC chez les patients ayant une faible DMO ou des fractures de fragilité15. Nous croyons qu’il est raisonnable de procéder à un dépistage chez les patients qui présentent de faibles taux de calcium urinaire, de l’hyperparathyroïdie secondaire ou une insuffisance en vitamine D malgré un apport quotidien suffisant de calcium et de vitamine D15. Nous établissons le seuil de dépistage à des T-scores de −1,0 ou moins, au lieu de −2,5 ou moins, en raison de la rareté de données probantes convaincantes justifiant d’exclure du dépistage les patients atteints d’ostéopénie. Parce qu’il peut se produire une malabsorption des bisphosphonates dans la MC, il semble raisonnable de tenir compte aussi dans le dépistage de la MC des personnes qui ne répondent pas bien à une thérapie aux bisphosphonates.
Encadré 2. Indications d’un dépistage sérologique de la MC chez les patients ayant une faible DMO (T-score de moins de −1,0) ou des antécédents de fractures de fragilité.
|
DMO—densité minérale osseuse, MC—maladie cœliaque
Apport quotidien suffisant en calcium et en vitamine D tel que défini par Ostéoporose Canada (au moins 800 UI et 400 UI de vitamine D3 respectivement pour les plus et les moins de 50 ans et ≥ 1 000 mg de calcium élémentaire)15
Les patients qui présentent ces symptômes devraient subir une biopsie duodénale qu’ils fassent l’objet ou non d’une épreuve sérologique.
Algorithme d’étude
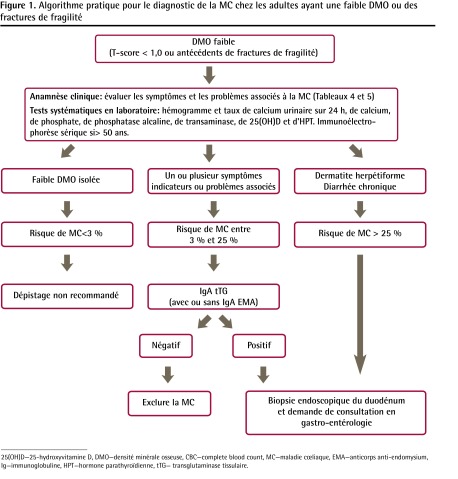
La Figure 1 montre un algorithme d’étude proposé pour le diagnostic de la MC chez les patients ayant une faible DMO (T-score de −1.0 ou moins) ou des fractures de fragilité.
Figure 1.
Algorithme pratique pour le diagnostic de la MC chez les adultes ayant une faible DMO ou des fractures de fragilité
25(OH)D—25-hydroxyvitamine D, DMO—densité minérale osseuse, CBC—complete blood count, MC—maladie cœliaque, EMA—anticorps anti-endomysium, Ig—immunoglobuline, HPT—hormone parathyroïdienne, tTG— transglutaminase tissulaire.
Nous avons proposé une valeur de 25 % comme seuil de classification du risque faible ou élevé de MC chez les patients. Le lecteur peut estimer le risque (probabilité avant test) de MC pour un cas en particulier en se fondant sur les données sur la prévalence associée aux différents symptômes et problèmes (Tableau 4)3,7,60–66.
Dans le groupe à risque élevé (risque de MC de plus de 25 %), les personnes qui ont une dermatite herpétiforme, de la diarrhée chronique ou une perte de poids inexpliquée ont une prévalence de MC variant de 25 % à 89 % 2,3,7.
Lorsque la prévalence de la maladie (probabilité avant test) est élevée, la valeur prédictive négative du test diminue (p. ex. un test négatif ne peut pas exclure le diagnostic). Étant donné que jusqu’à 9 % de ces patients peuvent être séronégatifs aux tTG et aux EMA, ils devraient subir une biopsie intestinale indépendamment des résultats sérologiques44,67–69.
La plupart des cas se classent dans le groupe à faible risque (risque de MC de moins de 25 %). De tels patients ont au moins 1 symptôme ou problème associé à la MC (Tableau 4 et Encadré 2)3,7,15,60–66. Il faudrait mesurer l’IgA EMA et l’IgA tTG recombinante humaine. Si les résultats de tests sérologiques sont positifs, il faudrait alors procéder à une biopsie70.
Quels tests sérologiques devrait-on utiliser?
On trouve dans CFPlus* des exemples cliniques du rendement des tests sérologiques et de la façon d’utiliser le monogramme du rapport de vraisemblance (RV). Les tests de l’immunoglobuline A tTG et de l’IgA EMA ont une excellente précision, le RV+ étant supérieur à 40 et le RV− se situant à de près de 0,02. Par ailleurs, leur rendement varie selon le test spécifique utilisé. L’IgA tTG recombinante humaine est la meilleure épreuve à elle seule pour dépister les personnes asymptomatiques et pour exclure une MC chez des personnes symptomatiques ayant une faible probabilité avant test d’être atteintes de la MC (p. ex. <25 %) 6,70–72. Si cette épreuve biologique n’est pas disponible, une combinaison de l’IgA tTG (ou tout autre test biologique) et l’épreuve de l’IgA EMA conviendraient aussi40,73.
Une biopsie de confirmation est-elle toujours nécessaire?
Nous recommandons que les patients qui ont des résultats sérologiques positifs subissent une biopsie de confirmation. Quoique l’épreuve sérologique ait une excellente spécificité, ces résultats à eux seuls ne suffisent pas, car la plupart des cas en milieu de soins primaires ont de faibles probabilités avant test (la probabilité avant test de MC doit être de plus de 35 % pour que la probabilité après test soit de plus de 95 %)6. De plus, un diagnostic de MC aura des conséquences permanentes sur le plan des coûts et des inconvénients d’un RSG.
Conclusion
La prévalence de la MC chez les patients ayant une faible DMO est probablement plus élevée que dans la population en général (données probantes de niveau I). Le dépistage systématique de la MC chez les patients ayant une faible DMO n’est pas justifié (données probantes de niveau III). Pour les adultes ayant une faible DMO (T-score de moins de −1,0 à la colonne vertébrale ou aux hanches), il est recommandé de suivre une approche de recherche de cas ciblée. Un T-score de −2,5 ou moins devrait susciter une forte suspicion de la présence d’une MC, car la MC est souvent silencieuse ou atypique chez les adultes. Des antécédents familiaux de MC ou des symptômes ou problèmes associés à cette maladie justifieraient un dépistage (données probantes de niveau III).
Il est indiqué de procéder au dépistage de la MC dans les cas d’un faible niveau de calcium urinaire, d’une insuffisance en vitamine D ou d’un niveau élevé d’hormones parathyroïdiennes en dépit d’un apport suffisant de calcium et de vitamine D (données probantes de niveau II).
Les épreuves de dépistage de la MC doivent être effectuées pendant que le patient suit un régime avec gluten (données probantes de niveau II). Le dépistage initial de la MC devrait se faire par une analyse de l’ IgA tTG humaine recombinante ou un autre test de l’IgA tTG en association avec une analyse de l’IgA EMA (données probantes de niveau II).
Une biopsie par endoscopie avec 4 à 6 spécimens est nécessaire comme épreuve de confirmation dans la plupart des cas (données probantes de niveau I). Un diagnostic définitif de la MC exige de tenir compte des caractéristiques cliniques, sérologiques et histologiques, complétées au besoin par la documentation d’une réponse positive à un RSG (données probantes de niveau III).
POINTS DE REPÈRE DU RÉDACTEUR
Les patients qui présentent de l’ostéoporose, manifestée par une faible densité minérale osseuse observée par absorptiométrie biphotonique par rayons X ou par des fractures de fragilité, devraient faire l’objet d’une évaluation pour en trouver les causes secondaires, y compris la maladie cœliaque (MC).
Les meilleures épreuves disponibles sont celle de l’immunoglobuline A contre l’antigène transglutaminase tissulaire et l’immunofluorescence des immunoglobulines A anti-endomysium. Le critère de test standard pour le diagnostic de la MC est une atrophie villositaire observée lors d’une biopsie du duodénum. Si les résultats sérologiques et histologiques ne concordent pas, le typage des antigènes des leucocytes humains pourrait être utile dans le diagnostic.
On devrait soupçonner fortement une MC si le T-score se situe à −2,5 ou moins, car la MC est souvent silencieuse ou atypique chez les adultes. Il faudrait procéder à un dépistage dans les cas d’antécédents familiaux de MC ou de symptômes ou problèmes associés à la MC.
Footnotes
Cet article donne droit à des crédits Mainpro-M1. Pour obtenir des crédits, allez à www.cfp.ca et cliquez sur le lien vers Mainpro.
Cet article a fait l’objet d’une révision par des pairs.
The English version of this article is available at www.cfp.ca on the table of contents for the october 2013 issue on page 1055.
Des exemples cliniques en anglais du rendement des tests sérologiques et de la façon d’utiliser le monogramme du rapport de vraisemblance se trouvent à www.cfp.ca. Allez au texte intégral de l’article et cliquez sur CFPlus dans le menu dans le coin supérieur droit de la page.
Collaborateurs
Tous les auteurs ont contribué à la recherche documentaire et à l’interprétation des ouvrages, ainsi qu’à la préparation du manuscrit aux fins de présentation.
Intérêts concurrents
Aucun déclaré
Références
- 1.Green PH, Jabri B. Celiac disease. Annu Rev Med. 2006;57:207–21. doi: 10.1146/annurev.med.57.051804.122404. [DOI] [PubMed] [Google Scholar]
- 2.Green PH, Cellier C. Celiac disease. N Engl J Med. 2007;357(17):1731–43. doi: 10.1056/NEJMra071600. [DOI] [PubMed] [Google Scholar]
- 3.Hopper AD, Hadjivassiliou M, Butt S, Sanders DS. Adult coeliac disease. BMJ. 2007;335(7619):558–62. doi: 10.1136/bmj.39316.442338.AD. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Van Heel DA, West J. Recent advances in coeliac disease. Gut. 2006;55(7):1037–46. doi: 10.1136/gut.2005.075119. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Lo W, Sano K, Lebwohl B, Diamond B, Green PH. Changing presentation of adult celiac disease. Dig Dis Sci. 2003;48(2):395–8. doi: 10.1023/a:1021956200382. [DOI] [PubMed] [Google Scholar]
- 6.Rostom A, Murray JA, Kagnoff MF. American Gastroenterological Association (AGA) Institute technical review on the diagnosis and management of celiac disease. Gastroenterology. 2006;131(6):1981–2002. doi: 10.1053/j.gastro.2006.10.004. [DOI] [PubMed] [Google Scholar]
- 7.Dubé C, Rostom A, Sy R, Cranney A, Saloojee N, Garritty C, et al. The prevalence of celiac disease in average-risk and at-risk Western European populations: a systematic review. Gastroenterology. 2005;128(4 Suppl 1):S57–67. doi: 10.1053/j.gastro.2005.02.014. [DOI] [PubMed] [Google Scholar]
- 8.Shahbazkhani B, Malekzadeh R, Sotoudeh M, Moghadam KF, Farhadi M, Ansari R, et al. High prevalence of coeliac disease in apparently healthy Iranian blood donors. Eur J Gastroenterol Hepatol. 2003;15(5):475–8. doi: 10.1097/01.meg.0000059118.41030.96. [DOI] [PubMed] [Google Scholar]
- 9.Tatar G, Elsurer R, Simsek H, Balaban YH, Hascelik G, Ozcebe OI, et al. Screening of tissue transglutaminase antibody in healthy blood donors for celiac disease screening in the Turkish population. Dig Dis Sci. 2004;49(9):1479–84. doi: 10.1023/b:ddas.0000042250.59327.91. [DOI] [PubMed] [Google Scholar]
- 10.Sood A, Midha V, Sood N, Malhotra V. Adult celiac disease in northern India. Indian J Gastroenterol. 2003;22(4):124–6. [PubMed] [Google Scholar]
- 11.Catassi C, Rätsch IM, Gandolfi L, Pratesi R, Fabiani E, El Asmar R, et al. Why is coeliac disease endemic in the people of the Sahara? Lancet. 1999;354(9179):647–8. doi: 10.1016/s0140-6736(99)02609-4. [DOI] [PubMed] [Google Scholar]
- 12.Gomez JC, Selvaggio GS, Viola M, Pizarro B, la Motta G, de Barrio S, et al. Prevalence of celiac disease in Argentina: screening of an adult population in the La Plata area. Am J Gastroenterol. 2001;96(9):2700–4. doi: 10.1111/j.1572-0241.2001.04124.x. [DOI] [PubMed] [Google Scholar]
- 13.Cranney A, Zarkadas M, Graham ID, Butzner JD, Rashid M, Warren R, et al. The Canadian Celiac Health Survey. Dig Dis Sci. 2007;52(4):1087–95. doi: 10.1007/s10620-006-9258-2. Cyberpub. du 22 février 2007. [DOI] [PubMed] [Google Scholar]
- 14.Green PHR, Stavropoulos SN, Panagi SG, Goldstein SL, McMahon DJ, Absan H, et al. Characteristics of adult celiac disease in the USA: results of a national survey. Am J Gastroenterol. 2001;96(1):126–31. doi: 10.1111/j.1572-0241.2001.03462.x. [DOI] [PubMed] [Google Scholar]
- 15.Papaioannou A, Morin S, Cheung AM, Atkinson S, Brown JP, Feldman S, et al. 2010 clinical practice guidelines for the diagnosis and management of osteoporosis in Canada: summary. CMAJ. 2010;182(17):1864–73. doi: 10.1503/cmaj.100771. Cyberpub. du 12 octobre 2010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Catassi C, Rätsch IM, Fabiani E, Rossini M, Bordicchia F, Candela F, et al. Coeliac disease in the year 2000: exploring the iceberg. Lancet. 1994;343(8891):200–3. doi: 10.1016/s0140-6736(94)90989-x. [DOI] [PubMed] [Google Scholar]
- 17.Fasano A, Catassi C. Current approaches to diagnosis and treatment of celiac disease: an evolving spectrum. Gastroenterology. 2001;120(3):636–51. doi: 10.1053/gast.2001.22123. [DOI] [PubMed] [Google Scholar]
- 18.Fiore CE, Pennisi P, Ferro G, Ximenes B, Privitelli L, Mangiafico RA, et al. Altered osteoprotegerin/RANKL ratio and low bone mineral density in celiac patients on long-term treatment with gluten-free diet. Horm Metab Res. 2006;38(6):417–22. doi: 10.1055/s-2006-944548. [DOI] [PubMed] [Google Scholar]
- 19.Kemppainen T, Kröger H, Janatuinen E, Arnala I, Kosma VM, Pikkarainen P, et al. Osteoporosis in adult patients with celiac disease. Bone. 1999;24(3):249–55. doi: 10.1016/s8756-3282(98)00178-1. [DOI] [PubMed] [Google Scholar]
- 20.Valdimarsson T, Toss G, Löfman O, Ström M. Three years’ follow-up of bone density in adult coeliac disease: significance of secondary hyperparathyroidism. Scand J Gastroenterol. 2000;35(3):274–80. doi: 10.1080/003655200750024146. [DOI] [PubMed] [Google Scholar]
- 21.Keaveny AP, Freaney R, McKenna MJ, Masterson J, O’Donoghue DP. Bone remodeling indices and secondary hyperparathyroidism in celiac disease. Am J Gastroenterol. 1996;91(6):1226–31. [PubMed] [Google Scholar]
- 22.Fornari MC, Pedreira S, Niveloni S, González D, Diez RA, Vánquez H, et al. Pre- and post-treatment serum levels of cytokines, IL-1beta, IL-6, and IL-1 receptor antagonist in celiac disease. Are they related to the associated osteopenia? Am J Gastroenterol. 1998;93(3):413–8. doi: 10.1111/j.1572-0241.1998.00413.x. [DOI] [PubMed] [Google Scholar]
- 23.Di Stefano M, Sciarra G, Jorizzo RA, Grillo RL, Cecchetti L, Speziale D, et al. Local and male gonadal factors in the pathogenesis of coeliac bone loss. Ital J Gastroenterol Hepatol. 1997;29(Suppl 2):31. [Google Scholar]
- 24.Taranta A, Fortunati D, Longo M, Rucci N, lacomino E, Aliberti F, et al. Imbalance of osteoclastogenesis-regulating factors in patients with celiac disease. J Bone Miner Res. 2004;19(7):1112–21. doi: 10.1359/JBMR.040319. Cyberpub. du 22 mars 2004. [DOI] [PubMed] [Google Scholar]
- 25.Horwood NJ, Elliott J, Martin TJ, Gillespie MT. IL-12 alone and in synergy with IL-18 inhibits osteoclast formation in vitro. J Immunol. 2001;166(8):4915–21. doi: 10.4049/jimmunol.166.8.4915. [DOI] [PubMed] [Google Scholar]
- 26.Yamada N, Niwa S, Tsujimura T, Iwasaki T, Sugihara A, Futani H, et al. Interleukin-18 and interleukin-12 synergistically inhibit osteoclastic bone-resorbing activity. Bone. 2002;30(6):901–8. doi: 10.1016/s8756-3282(02)00722-6. [DOI] [PubMed] [Google Scholar]
- 27.Moreno ML, Crusius JB, Cherñavsky A, Sugai E, Sambuelli A, Vazquez H, et al. The IL-1 gene family and bone involvement in celiac disease. Immunogenetics. 2005;57(8):618–20. doi: 10.1007/s00251-005-0033-x. Cyberpub. du 29 septembre 2005. [DOI] [PubMed] [Google Scholar]
- 28.Taranta A, Fortunati D, Longo M, Rucci N, Iacomino E, Aliberti F, et al. Imbalance of osteoclastogenesis-regulating factors in patients with celiac disease. J Bone Miner Res. 2004;19(7):1112–21. doi: 10.1359/JBMR.040319. Cyberpub. du 22 mars 2004. [DOI] [PubMed] [Google Scholar]
- 29.Smecuol E, Mauriño E, Vazquez H, Pedreira S, Niveloni S, Mazure R, et al. Gynaecological and obstetric disorders in coeliac disease: frequent clinical onset during pregnancy or the puerperium. Eur J Gastroenterol Hepatol. 1996;8(1):63–89. doi: 10.1097/00042737-199601000-00012. [DOI] [PubMed] [Google Scholar]
- 30.Ludvigsson JF, Michaelsson K, Ekbom A, Montgomery SM. Coeliac disease and the risk of fractures—a general population-based cohort study. Aliment Pharmacol Ther. 2007;25(3):273–85. doi: 10.1111/j.1365-2036.2006.03203.x. [DOI] [PubMed] [Google Scholar]
- 31.West J, Logan RF, Card TR, Smith C, Hubbard R. Fracture risk in people with celiac disease: a population-based cohort study. Gastroenterology. 2003;125(2):429–36. doi: 10.1016/s0016-5085(03)00891-6. [DOI] [PubMed] [Google Scholar]
- 32.Olmos M, Antelo M, Vazquez H, Smecuol E, Mauriño E, Bai JC. Systematic review and meta-analysis of observational studies on the prevalence of fractures in coeliac disease. Dig Liver Dis. 2008;40(1):46–53. doi: 10.1016/j.dld.2007.09.006. Cyberpub. du 19 novembre 2007. [DOI] [PubMed] [Google Scholar]
- 33.Bai JC, Gonzalez D, Mautalen C, Mazure R, Pedreira S, Vazquez H, et al. Long-term effect of gluten restriction on bone mineral density of patients with coeliac disease. Aliment Pharmacol Ther. 1997;11(1):157–64. doi: 10.1046/j.1365-2036.1997.112283000.x. [DOI] [PubMed] [Google Scholar]
- 34.McFarlane XA, Bhalla AK, Robertson DA. Effect of a gluten free diet on osteopenia in adults with newly diagnosed coeliac disease. Gut. 1996;39(2):180–4. doi: 10.1136/gut.39.2.180. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Sategna-Guidetti C, Grosso SB, Grosso S, Mengozzi G, Aimo G, Zaccaria T, et al. The effects of 1-year gluten withdrawal on bone mass, bone metabolism and nutritional status in newly-diagnosed adult coeliac disease patients. Aliment Pharmacol Ther. 2000;14(1):35–43. doi: 10.1046/j.1365-2036.2000.00671.x. [DOI] [PubMed] [Google Scholar]
- 36.Valdimarsson T, Löfman O, Toss G, Ström M. Reversal of osteopenia with diet in adult coeliac disease. Gut. 1996;38(3):322–7. doi: 10.1136/gut.38.3.322. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Moreno ML, Vazquez H, Mazure R, Smecuol E, Niveloni S, Pedreira S, et al. Stratification of bone fracture risk in patients with celiac disease. Clin Gastroenterol Hepatol. 2004;2(2):127–34. doi: 10.1016/s1542-3565(03)00320-3. [DOI] [PubMed] [Google Scholar]
- 38.Groupe d’étude canadien sur les soins de santé préventifs The periodic health examination [Bibliography] CMAJ. 1979;121(9):1193–254. [PMC free article] [PubMed] [Google Scholar]
- 39.Rostom A, Dubé C, Cranney A, Saloojee N, Sy R, Garritty C, et al. The diagnostic accuracy of serologic tests for celiac disease: a systematic review. Gastroenterology. 2005;128(4 Suppl 1):S38–46. doi: 10.1053/j.gastro.2005.02.028. [DOI] [PubMed] [Google Scholar]
- 40.Hopper AD, Cross SS, Hurlstone DP, McAlindon ME, Lobo AJ, Hadjivassiliou M, et al. Pre-endoscopy serological testing for coeliac disease: evaluation of a clinical decision tool. BMJ. 2007;334(7598):729. doi: 10.1136/bmj.39133.668681.BE. Cyberpub. du 23 mars 2007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Villalta D, Alessio MG, Tampoia M, Tonutti E, Brusca I, Bagnasco M, et al. Diagnostic accuracy of IgA anti-tissue transglutaminase antibody assays in celiac disease patients with selective IgA deficiency. Ann N Y Acad Sci. 2007;1109:212–20. doi: 10.1196/annals.1398.025. [DOI] [PubMed] [Google Scholar]
- 42.Villalta D, Alessio MG, Tampoia M, Tonutti E, Brusca I, Bagnasco M, et al. Testing for IgG class antibodies in celiac disease patients with selective IgA deficiency. A comparison of the diagnostic accuracy of 9 IgG anti-tissue transglutaminase, 1 IgG anti-gliadin and 1 IgG anti-deaminated gliadin peptide antibody assays. Clin Chim Acta. 2007;382(1–2):95–9. doi: 10.1016/j.cca.2007.03.028. Cyberpub. du 13 avril 2007. [DOI] [PubMed] [Google Scholar]
- 43.James SP. National Institutes of Health Consensus Development Conference Statement on Celiac Disease, June 28–30, 2004. Gastroenterology. 2005;128(4 Suppl 1):S1–S9. doi: 10.1053/j.gastro.2005.02.007. [DOI] [PubMed] [Google Scholar]
- 44.Rostami K, Kerckhaert J, Tiemessen R, von Blomberg BM, Meijer JW, Mulder CJ. Sensitivity of antiendomysium and antigliadin antibodies in untreated celiac disease: disappointing in clinical practice. Am J Gastroenterol. 1999;94(4):888–94. doi: 10.1111/j.1572-0241.1999.983_f.x. [DOI] [PubMed] [Google Scholar]
- 45.Buchman AL. Population-based screening for celiac disease: improvement in morbidity and mortality from osteoporosis? Arch Intern Med. 2005;165(4):370–2. doi: 10.1001/archinte.165.4.370. [DOI] [PubMed] [Google Scholar]
- 46.Bonamico M, Mariani P, Thanasi E, Ferri M, Nenna R, Tiberti C, et al. Patchy villous atrophy of the duodenum in childhood celiac disease. J Pediatr Gastroenterol Nutr. 2004;38(2):204–7. doi: 10.1097/00005176-200402000-00019. [DOI] [PubMed] [Google Scholar]
- 47.Ravelli A, Bolognini S, Gambarotti M, Villanacci V. Variability of histologic lesions in relation to biopsy site in gluten-sensitive enteropathy. Am J Gastroenterol. 2005;100(1):177–85. doi: 10.1111/j.1572-0241.2005.40669.x. [DOI] [PubMed] [Google Scholar]
- 48.Kaukinen K, Partanen J, Mäki M, Collin P. HLA-DQ typing in the diagnosis of celiac disease. Am J Gastroenterol. 2002;97(3):695–9. doi: 10.1111/j.1572-0241.2002.05471.x. [DOI] [PubMed] [Google Scholar]
- 49.Collin P. Should adults be screened for celiac disease? What are the benefits and harms of screening? Gastroenterology. 2005;128(4 Suppl 1):S104–8. doi: 10.1053/j.gastro.2005.02.021. [DOI] [PubMed] [Google Scholar]
- 50.Mearin ML, Ivarsson A, Dickey W. Coeliac disease: is it time for mass screening? Best Pract Res Clin Gastroenterol. 2005;19(3):441–52. doi: 10.1016/j.bpg.2005.02.004. [DOI] [PubMed] [Google Scholar]
- 51.Catassi C, Kryszak D, Louis-Jacques O, Duerksen DR, Hill I, Crowe SE, et al. Detection of celiac disease in primary care: a multicenter case-finding study in North America. Am J Gastroenterol. 2007;102(7):1454–60. doi: 10.1111/j.1572-0241.2007.01173.x. Cyberpub. du 13 mars 2007. [DOI] [PubMed] [Google Scholar]
- 52.Drummond FJ, Annis P, O’Sullivan K, Wynne F, Daly M, Shanahan F, et al. Screening for asymptomatic celiac disease among patients referred for bone densitometry measurement. Bone. 2003;33(6):970–4. doi: 10.1016/j.bone.2003.07.002. [DOI] [PubMed] [Google Scholar]
- 53.González D, Sugai E, Gomez JC, Oliveri MB, Gomez Acotto C, Vega E, et al. Is it necessary to screen for celiac disease in postmenopausal osteoporotic women? Calcif Tissue Int. 2002;71(2):141–4. doi: 10.1007/s00223-001-1027-9. Cyberpub. du 24 juillet 2002. [DOI] [PubMed] [Google Scholar]
- 54.Lindh E, Ljunghall S, Larsson K, Lavö B. Screening for antibodies against gliadin in patients with osteoporosis. J Intern Med. 1992;231(4):403–6. doi: 10.1111/j.1365-2796.1992.tb00951.x. [DOI] [PubMed] [Google Scholar]
- 55.Mather KJ, Meddings JB, Beck PL, Scott RB, Hanley DA. Prevalence of IgA-antiendomysial antibody in asymptomatic low bone mineral density. Am J Gastroenterol. 2001;96(1):120–5. doi: 10.1111/j.1572-0241.2001.03461.x. [DOI] [PubMed] [Google Scholar]
- 56.Nuti R, Martini G, Valenti R, Giovani S, Salvadori S, Avanzati A. Prevalence of undiagnosed coeliac syndrome in osteoporotic women. J Intern Med. 2001;250(4):361–6. doi: 10.1046/j.1365-2796.2001.00895.x. [DOI] [PubMed] [Google Scholar]
- 57.Sanders DS, Patel D, Khan FB, Westbrook RH, Webber CV, Milford-Ward A, et al. Case-finding for adult celiac disease in patients with reduced bone mineral density. Dig Dis Sci. 2005;50(3):587–92. doi: 10.1007/s10620-005-2479-y. [DOI] [PubMed] [Google Scholar]
- 58.Stenson WF, Newberry R, Lorenz R, Baldus C, Civitelli R. Increased prevalence of celiac disease and need for routine screening among patients with osteoporosis. Arch Intern Med. 2005;165(4):393–9. doi: 10.1001/archinte.165.4.393. [DOI] [PubMed] [Google Scholar]
- 59.Karakan T, Ozyemisci-Taskiran O, Gunendi Z, Atalay F, Tuncer C. Prevalence of IgA-antiendomysial antibody in a patient cohort with idiopathic low bone mineral density. World J Gastroenterol. 2007;13(21):2978–82. doi: 10.3748/wjg.v13.i21.2978. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Betterle C, Dal Pra C, Mantero F, Zanchetta R. Autoimmune adrenal insufficiency and autoimmune polyendocrine syndromes: autoantibodies, autoantigens, and their applicability in diagnosis and disease prediction. Endocr Rev. 2002;23(3):327–64. doi: 10.1210/edrv.23.3.0466. [DOI] [PubMed] [Google Scholar]
- 61.Betterle C, Lazzarotto F, Spadaccino AC, Basso D, Plebani M, Pedini B, et al. Celiac disease in North Italian patients with autoimmune Addison’s disease. Eur J Endocrinol. 2006;154(2):275–9. doi: 10.1530/eje.1.02089. [DOI] [PubMed] [Google Scholar]
- 62.Myhre AG, Aarsetøy H, Undlien DE, Hovdenak N, Aksnes L, Husebye ES. High frequency of coeliac disease among patients with autoimmune adrenocortical failure. Scand J Gastroenterol. 2003;38(5):511–5. doi: 10.1080/00365520310002544. [DOI] [PubMed] [Google Scholar]
- 63.Bushara KO. Neurologic presentation of celiac disease. Gastroenterology. 2005;128(4 Suppl 1):S92–7. doi: 10.1053/j.gastro.2005.02.018. [DOI] [PubMed] [Google Scholar]
- 64.Jokinen J, Peters U, Mäki M, Miettinen A, Collin P. Celiac sprue in patients with chronic oral mucosal symptoms. J Clin Gastroenterol. 1998;26(1):23–6. doi: 10.1097/00004836-199801000-00007. [DOI] [PubMed] [Google Scholar]
- 65.Corazza GR, Andreani ML, Venturo N, Bernardi M, Tosti A, Gasbarrini G. Celiac disease and alopecia areata: report of a new association. Gastroenterology. 1995;109(4):1333–7. doi: 10.1016/0016-5085(95)90597-9. [DOI] [PubMed] [Google Scholar]
- 66.Fessatou S, Kostaki M, Karpathios T. Coeliac disease and alopecia areata in childhood. J Paediatr Child Health. 2003;39(2):152–4. doi: 10.1046/j.1440-1754.2003.00116.x. [DOI] [PubMed] [Google Scholar]
- 67.Rostami K, Kerckhaert J, Tiemessen R, Meijer JW, Mulder CJ. The relationship between anti-endomysium antibodies and villous atrophy in coeliac disease using both monkey and human substrate. Eur J Gastroenterol Hepatol. 1999;11(4):439–42. doi: 10.1097/00042737-199904000-00013. [DOI] [PubMed] [Google Scholar]
- 68.Tursi A, Brandimarte G, Giorgetti GM. Sorbitol H2-breath test versus anti-endomysium antibodies for the diagnosis of subclinical/silent coeliac disease. Scand J Gastroenterol. 2001;36(11):1170–2. doi: 10.1080/00365520152584798. [DOI] [PubMed] [Google Scholar]
- 69.Tursi A, Brandimarte G, Giorgetti GM. Prevalence of antitissue transglutaminase antibodies in different degrees of intestinal damage in celiac disease. J Clin Gastroenterol. 2003;36(3):219–21. doi: 10.1097/00004836-200303000-00007. [DOI] [PubMed] [Google Scholar]
- 70.AGA Institute AGA Institute Medical Position Statement on the Diagnosis and Management of Celiac Disease. Gastroenterology. 2006;131(6):1977–80. doi: 10.1053/j.gastro.2006.10.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71.Hill PG, Forsyth JM, Semeraro D, Holmes GK. IgA antibodies to human tissue transglutaminase: audit of routine practice confirms high diagnostic accuracy. Scand J Gastroenterol. 2004;39(11):1078–82. doi: 10.1080/00365520410008051. [DOI] [PubMed] [Google Scholar]
- 72.Armstrong D, Don-Wauchope AC, Verdu EF. Testing for gluten-related disorders in clinical practice: the role of serology in managing the spectrum of gluten sensitivity. Can J Gastroenterol. 2011;25(4):193–7. doi: 10.1155/2011/642452. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.Dickey W, Kearney N. Overweight in celiac disease: prevalence, clinical characteristics, and effects of a gluten-free diet. Am J Gastroenterol. 2006;101(10):2356–9. doi: 10.1111/j.1572-0241.2006.00750.x. [DOI] [PubMed] [Google Scholar]