Abstract
But de l'étude
L'objectif de cette étude est de décrire l'épidémiologie des infections à Mycoplasma pneumoniae (Mpn) en Basse-Normandie par une analyse rétrospective des résultats sérologiques et PCR, et de valider ces deux outils pour un diagnostic précoce de ces infections.
Patients et méthodes
De 1997 à août 2005, 6156 sérums et 6123 prélèvements respiratoires ont été réalisés chez des patients hospitalisés et analysés pour une recherche d'infection à Mpn, soit par PCR, soit par sérologie Elisa, soit par les deux. Pendant la période épidémique (2004–2005), les résultats de 1489 patients ont été analysés.
Résultats
Sur les neuf années, la séroprévalence moyenne se chiffre à 40,4 % et 525 cas d'infection ont été diagnostiqués par PCR et/ou sérologie, se profilant nettement sous l'aspect de deux pics épidémiques espacés de sept ans. Pendant la période épidémique, la séroprévalence augmente (50,2 %) et l'incidence est de 8,3 %. L'analyse des caractéristiques épidémiologiques des 124 cas diagnostiqués montre : une prédominance chez l'enfant et l'adulte jeune, une fréquence saisonnière estivohivernale, l'existence de co-infection virale. L'analyse des résultats chez 36 patients ayant bénéficié des deux tests diagnostiques, PCR et sérologie, montre une concordance dans seulement 41,7 % des cas.
Conclusion
Les infections à Mpn surviennent sur un mode endémo-épidémique, avec une incidence élevée lors des pics épidémiques, particulièrement chez l'enfant. Nous disposons actuellement d'outils bactériologiques performants permettant de réaliser un diagnostic précoce et fiable. Chez l'enfant, il convient d'associer une sérologie (IgM) et une PCR sur un prélèvement nasopharyngé ; chez l'adulte il faudra privilégier la PCR.
Mots clés: Mycoplasma pneumoniae, Epidémie, Séroprévalence, Incidence, PCR, Sérologie
Abstract
Objectives
The objective of this study was to evaluate the epidemiology of Mycoplasma pneumoniae (Mpn) infections in Basse-Normandie by a retrospective analysis of serological and PCR data, and to confirm the diagnostic utility of PCR and serology.
Methods
From 1997 to August 2005, 6156 serum samples and 6123 respiratory tract samples were collected from hospitalised patients and evaluated for the diagnosis of Mpn infection by PCR, serological assays, or by the two tests. During the epidemic period (2004-2005), the results of 1489 patients were analysed.
Results
Over the 9-y period, the seroprevalence was 40,4% and we reported on 525 cases with serologically or/and PCR proven Mpn infection, according a cyclic pattern spaced out 7 years. During the epidemic period, the seroprevalence increased to 50,2% and the rate of infections was 8.3%. The analysis of the 124 cases of Mpn infection showed typical epidemiological characteristics: a peak of incidence among the children and young adults, a summer-winter pattern and some coinfections with viral strains. For diagnosis of Mpn infection, the comparison of PCR and serological assays among 36 patients showed a concordance of only 41.7%.
Conclusion
Mpn infections were endemic and outbreaks were observed according cyclic pattern with a high incidence specially in the children. Sensitive and specific tests were now available for early and reliable diagnosis. In children, the combination of the PCR on nasopharyngeal samples and the IgM EIA serology test were recommended. In adults, the PCR was privilegiated.
Keywords: Mycoplasma pneumoniae, Outbreak, Seroprevalence, Incidence, PCR, Serology
1. Introduction
Mycoplasma pneumoniae (Mpn) est une bactérie impliquée dans de nombreuses pathologies respiratoires hautes (rhinopharyngite, sinusite, otite…) et basses (pneumopathie, trachéobronchite…) [1], [2]. Mpn est la première cause de pneumopathies communautaires chez l'enfant de plus de cinq ans. L'infection à Mpn peut aussi provoquer l'apparition et l'exacerbation de crise d'asthme [3]. Chez l'adulte, Mpn serait impliqué dans environ 20 % des pneumopathies infectieuses, venant juste après Streptococcus pneumoniae [4], [5]. Les pneumopathies à Mpn surviennent sur un mode endémo-épidémique et leur évolution est en général favorable, mais des observations de pneumopathies sévères avec détresse respiratoire pouvant mettre en jeu le pronostic vital ont été rapportées, particulièrement chez l'adulte jeune [6], [7]. Des formes extrapulmonaires, diverses et parfois atypiques (atteintes neuroméningées, cutanées, myopéricardiques, hématologiques…) peuvent survenir de façon isolée ou être observées avant, pendant ou après les manifestations respiratoires [8]. Les complications neurologiques, bien que relativement rares, sont celles le plus fréquemment observées et tous les types d'atteintes ont été décrits [9], [10].
L'existence de réinfections et de co-infections bactériennes et virales, l'existence de nombreuses formes asymptomatiques ou paucisymptomatiques font que l'incidence des infections à Mpn est relativement élevée [1], [11] et probablement sous-estimée [12], [13]. Une enquête chez les sujets contacts de patients ayant une infection respiratoire aiguë à Mpn a ainsi démontré la présence de Mpn chez 15 % d'entre eux. Quatre-vingts pour cent étaient des enfants, ce qui confirme leur rôle de réservoir et leur rôle dans la transmission de l'infection [12]. Le diagnostic des infections communautaires à Mpn repose encore fréquemment sur les signes cliniques et radiologiques. Toutefois, l'importance de Mpn en pathologie respiratoire va croissant et le diagnostic différentiel avec les viroses respiratoires est de plus en plus souvent établi grâce à la mise à disposition d'outils diagnostiques spécifiques et rapides. Transmises par voie aérienne, les infections à Mpn évoluent selon un mode endémique avec des poussées épidémiques d'une durée d'un à deux ans, tous les trois à huit ans [13], [14], [15].
Le but de notre étude est d'analyser rétrospectivement les résultats de la sérologie et de la PCR Mpn au cours des neuf dernières années (1997–2005) et de décrire les caractéristiques épidémiologiques en termes de séroprévalence, incidence, distribution saisonnière et par âge. Sur le plan bactériologique, l'objectif de ce travail est de comparer les outils diagnostiques de l'infection à Mpn : diagnostic sérologique et diagnostic direct par amplification génique (PCR), et définir le meilleur site de prélèvement.
2. Patients et méthodes
2.1. Population étudiée
Entre les mois de mars 1997 et août 2005, 6156 sérums et 6123 prélèvements respiratoires ont été réalisés chez des adultes et des enfants hospitalisés pour une recherche d'infection à Mpn. Ces prélèvements proviennent majoritairement des services de pédiatrie, infectiologie et pneumologie du CHU de Caen et des CHR des trois départements bas-normands (Flers61, Avranches50, et Bayeux14). Les prélèvements ont été analysés au laboratoire de virologie du CHU de Caen soit par une recherche directe (PCR), soit par un test sérologique, soit par les deux. La Fig. 1 représente la pratique diagnostique des services demandeurs les plus courants : on note une pratique exclusivement sérologique au CH d'Avranches (24 % de nos sérologies, 61 % d'enfants), une pratique privilégiant la PCR pour les services de médecine adulte (maladies infectieuses, médecine interne et pneumologie) et une pratique à la fois sérologique et de diagnostic direct pour le service de pédiatrie du CHU de Caen.
Fig. 1.

Type et pourcentage des demandes d'examens pour la recherche de Mpn selon les principaux services hospitaliers bas-normands prescripteurs. Épidémie (septembre 2004–août 2005).
Pendant la période épidémique survenue entre septembre 2004 et fin août 2005, une analyse rétrospective des résultats de 1489 patients (1050 adultes et 439 enfants) prélevés soit pour une recherche directe, soit pour une sérologie Mpn, soit pour les deux, a permis d'établir les caractéristiques de cette épidémie et d'évaluer les performances des outils diagnostiques.
2.2. Recherche directe par PCR
Divers prélèvements sont collectés pour la recherche de Mpn par PCR : aspirations nasales, gorges, nasopharynx, lavages bronchoalvéolaires, crachats…
L'ADN bactérien est extrait par la procédure Chelex. Deux cent cinquante microlitres de prélèvements recueillis sont vortexés avec 150 μl d'une suspension de résine Chelex 100 (Biorad, Marnes-la-Coquette, France) en milieu détergent (0,1 % SDS, 0,1 % Noninet P-40 et 1 % Tween 20), puis chauffés 15 minutes à 100 °C et centrifugés dix minutes à 12 000g. Le surnageant est directement utilisé pour réaliser une réaction PCR à l'aide des amorces spécifiques MP-P11 et MP-P12 situées dans le gène P1 de Mpn [16]. Les produits d'amplification sont détectés par hybridation en milieu liquide (GEN-ETI-K DEIA, Sorin) au moyen d'une sonde spécifique biotinylée MP-I [16]. Le signal d'hybridation est considéré comme positif quand l'index est supérieur ou égal à 2 ; le résultat est « équivoque » lorsque l'index est compris entre 1 et 2 (index = DO échantillon/DO seuil). Lors de chaque manipulation, l'introduction de différents contrôles permet de valider les résultats de la PCR Mpn : contrôle positif, contrôles négatifs (introduits à chaque étape de traitement de l'échantillon). Enfin, la circulation dans trois secteurs séparés de manipulation est respectée afin de pallier tout risque de contamination.
2.3. Diagnostic sérologique
Deux trousses Elisa format microplaque ont été utilisées au cours de cette période pour la détection des anticorps spécifiques de type IgG et IgM : EIA-Platelia (Platelia® EIA Sanofi Diagnostica Pasteur) de mars 1997 à mi-avril 2001 et EIA-Bmd (ImmunoWell® Bmd S.A.) de mi-avril 2001 à août 2005. Ces deux techniques sont des tests Elisa indirects utilisant comme antigène soit un ultrasonicat purifié riche en protéine membranaire P1 (EIA-Platelia), EIA-Sorin, EIA-Biotest, soit un glycolipide purifié d'une souche FH de Mpn (EIA-Bmd).
Afin d'éviter toute interférence par le facteur rhumatoïde (FR) ou la présence d'IgG résiduelles au cours du dosage des IgM, la technique EIA-Platelia utilise une méthode d'immunocapture et la technique EIA-Bmd une absorption préalable des sérums avec une solution anti-IgG humaines. Pour les deux trousses, nous avons appliqué les protocoles opératoires, les critères de validation et les critères d'interprétation des résultats fournis par le fabricant. Toutefois, devant les difficultés d'interprétation d'un seuil de positivité, fixé de façon arbitraire, une zone « équivoque » a été définie pour l'interprétation des IgM : 750 à 1100 UA/ml pour Bmd et index 0,9 à 1,1 pour Platelia. Les critères sérologiques d'« infection actuelle » à Mpn ont été définis comme suit : séroconversion ou augmentation significative du titre des IgG sur deux sérums prélevés à 15–21 jours et manipulés en parallèle ; sur un sérum isolé : chez l'adulte, IgG supérieures à 2000 UA/ml ; chez l'enfant, IgM positives associées ou non à des IgG.
3. Résultats
3.1. Séroprévalence
Sur les 6156 sérologies Mpn réalisées pendant neuf années, la séroprévalence chez les patients hospitalisés se chiffre globalement à 40,4 % (adultes 44,4 %, enfants 31,5 %). Connaissant la variabilité de sensibilité des trousses sérologiques Elisa, nous avons calculé la séroprévalence pour chacune des périodes utilisant successivement la trousse EIA-Platelia et la trousse EIA-Bmd. De mars 1997 à avril 2001 (trousse EIA-Platelia), nous trouvons une séroprévalence moyenne stable de 33,3 % (adultes 36,3 %, enfants 25,3 %) sur les quatre années. En 2001, la séroprévalence atteint 47,5 % (adultes 51 %, enfants 33,3 %) ; cette augmentation est significative et correspond à l'utilisation d'une nouvelle trousse sérologique (trousse EIA-Bmd). D'avril 2001 à août 2005 (trousse EIA-Bmd), nous trouvons une séroprévalence moyenne de 47,6 % (adultes 51,9 %, enfants 37,7 %), mais fluctuante au cours de ces quatre années : 53,4 % en 2002, chute à 42,2 % (2003) et 40 % (2004), et augmentation à 53,5 % en 2005 (Fig. 2 ). Parallèlement, nous observons une diminution du titre moyen des IgG en 2003 (414 UA/ml) et en 2004 (388 UA/ml) et une augmentation du titre en 2005 (545 UA/ml) [Tableau 1 ].
Fig. 2.
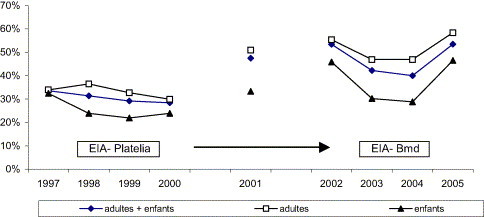
Distribution des séroprévalences à Mpn obtenues par les deux tests sérologiques Elisa : EIA-Platelia (1997–avril 2001) et EIA-Bmd (avril 2001–2005).
Tableau 1.
Distribution du titre des IgG anti-Mpn chez la « population malade » hospitalisée de 2002 à 2005, chez la « population malade » hospitalisée pendant la période épidémique et chez la « population témoin »
| Population étudiée | Nombre de patients | IgG titre moyen UA/ml (EIA-Bmd) | Test de Mann-Whitney degré de signification p | |
|---|---|---|---|---|
| Témoin | 2003–2004 | 395 | 343 | |
| Hospitalisés | ||||
| 2002 | 554 | 486 | < 0,001 | |
| 2003 | 631 | 414 | 0,016 | |
| 2004 | 641 | 388 | 0,662 | |
| 2005 | 783 | 545 | < 0,001 | |
| Hospitalisés | ||||
| 9-2004 à 8-2005 | 705 | 524 | < 0,001 | |
Durant la période épidémique (septembre 2004–août 2005), 664 sérologies ont été réalisées chiffrant une séroprévalence globale à 50,2 % (adultes 54,7 %, enfants 43,5 %), avec un titre moyen d'IgG à 524 UA/ml.
Ces séroprévalences sont calculées sur une population de patients « malades » hospitalisés le plus souvent pour une pathologie respiratoire. Nous les avons donc comparées à la séroprévalence d'une population « témoin ». Les sérums de 291 adultes et 104 enfants, indemnes de toute pathologie respiratoire, ont été sélectionnés au cours de l'année 2003 (bilans préopératoires, consultations en médecine du travail) et titrés en IgG et IgM avec le kit EIA-Bmd. La séroprévalence est de 36,2 %, avec un titre moyen d'IgG à 343 UA/ml.
Le Tableau 2 résume les résultats des séroprévalences obtenues chez la population « malade » et la population « témoin » au cours des différentes périodes avec la trousse EIA-Bmd.
Tableau 2.
Comparaison de la séroprévalence Mpn au sein des populations hospitalisées et témoin
| Population étudiée | Séroprévalence (EIA-Bmd) |
||
|---|---|---|---|
| Hospitalisés | Hospitalisés | Témoin | |
| (4-2001 à 8-2005) | (9-2004 à 8-2005) | (2003–2004) | |
| 1796 adultes | 431 adultes | 291 adultes | |
| 789 enfants | 279 enfants | 104 enfants | |
| Adultes + enfants (%) | 47,6 | 50,2 | 36,2 |
| Adultes (%) | 51,9 | 54,7 | 39,5 |
| Enfants (%) | 37,7 | 43,5 | 26,9 |
Les résultats de comparaison de séroprévalence et de titre moyen en IgG entre les « populations malades » et « population témoin » ont été évalués respectivement avec le test du χ2 (p < 0,00001) et de Mann-Whitney (p < 0,001).
3.2. Incidence de l'infection à Mpn
Au cours des neuf années étudiées, 525 cas d'infection à Mpn ont été diagnostiqués par sérologie, PCR ou les deux tests selon les critères de positivité définis. La population infectée est jeune (78 % ont moins de 15 ans), d'âge moyen 6,5 ans pour les enfants et 46,6 ans pour les adultes, 22 % des adultes ayant plus de 65 ans (Fig. 3 ). En utilisant la sérologie comme seul test diagnostic, parmi les 6156 sérologies effectuées, 433 (7 %) signaient une infection active à Mpn : 77 adultes (1,8 %) et 356 enfants (18,6 %) ; la moyenne d'âge des adultes était 43,7 ans, celle des enfants 6,7 ans. En utilisant la PCR comme seul test diagnostic, parmi les 6123 prélèvements respiratoires, 154 (2,5 %) étaient positifs par PCR ; la moyenne d'âge des adultes était 50 ans, celle des enfants six ans. Le nombre de prélèvements respiratoires analysés par PCR a augmenté régulièrement chaque année depuis 1997 (267 prélèvements) pour atteindre sur les trois dernières années environ 1000 prélèvements par an, composés à 90 % d'aspirations nasales et de prélèvements de gorge. Alors que le pourcentage de prélèvements respiratoires PCR positive diminue très nettement à partir de 1999–2000 pour n'atteindre que 1 % de positif en 2002, une augmentation significative est observée en 2004 pour atteindre 3,3 % en 2005 (Fig. 4a ). La Fig. 4b représente le pourcentage de PCR positive pour chaque type de prélèvement.
Fig. 3.

Distribution des âges des patients présentant une infection à Mpn en Basse-Normandie, 1997–2005.
Fig. 4a.

Évolution entre 1997 et 2005 du nombre de prélèvements respiratoires analysés par PCR Mpn et du pourcentage de prélèvements positifs.
Fig. 4b.

Évolution entre 1997 et 2005 du nombre de chacun des types de prélèvements analysés par PCR et pourcentage de PCR Mpn positive pour chaque type de prélèvement.
L'examen du nombre de cas diagnostiqués, que ce soit par sérologie, PCR ou les deux associés, montre une fluctuation tout au long des neuf années étudiées. Nous observons très nettement deux pics épidémiques : un pic fin 1997–début 1998 et un second pic en septembre 2004, se prolongeant jusqu'à fin 2005 (Fig. 5 ). Concernant la distribution saisonnière, chaque année la fréquence des infections apparaît plus importante en été et en hiver, fréquence particulièrement nette lors des deux pics épidémiques (Fig. 6 ).
Fig. 5.

Incidence mensuelle des infections à Mpn en Basse-Normandie. 1997–2005.
Fig. 6.
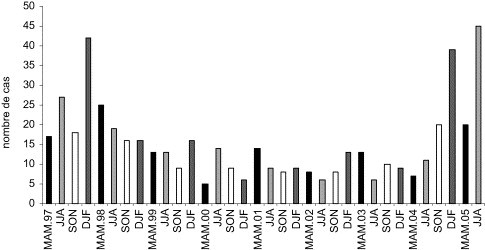
Répartition saisonnière des infections à Mpn en Basse-Normandie. 1997–2005.
MAM : mars–avril mai ; JJA : juin-juillet-août ; SON : septembre-octobre-novembre ; DJF : décembre–janvier–février.
Au cours de la période épidémique (septembre 2004–août 2005), parmi les 1489 patients ayant eu une sérologie (664 patients –– 395 adultes, 269 enfants ––), une PCR (1179 patients –– 908 adultes, 271 enfants ––) ou les deux tests (204 patients –– 125 adultes, 79 enfants ––), ont été répertoriés 124 cas (26 adultes, 98 enfants) d'infections à Mpn, soit une incidence de 8,3 %. Soixante-dix-neuf pour cent des cas étaient des enfants d'âge moyen 6,2 ans. L'âge moyen des adultes se situe à 45,2 ans. Parmi les 664 sérologies, 94 (14,1 %) signaient une infection active à Mpn : 13 adultes (3,3 %) et 81 enfants (30 %). Cent soixante et onze sérologies (25,7 %) ont été réalisées à l'hôpital d'Avranches et 26 (15,2 %) signaient une infection active. Parmi les 1185 prélèvements respiratoires, 43 (3,6 %) étaient PCR positive ou « équivoque » : 14 adultes (1,5 %) et 29 enfants (10,7 %). Cinq des 29 enfants PCR positive (17,2 %) présentaient une infection virale associée : quatre VRS, un rhinovirus et un entérovirus.
La nature des prélèvements respiratoires se distribue ainsi : 103 LBA/aspirations bronchiques/crachats, 684 prélèvements de gorge et 398 aspirations nasales. Sept LBA/aspiration bronchiques/crachats (6,8 %) sont PCR positive (un crachat et un LBA PCR « équivoque »), six gorges (0,9 %) et 32 aspirations nasales (8 %) dont une « équivoque » ; un enfant et un adulte ont eu deux prélèvements positifs (aspiration et gorge pour l'enfant, gorge et LBA pour l'adulte) [Fig. 7 ].
Fig. 7.

Pourcentage de PCR Mpn positive par type de prélèvements respiratoires prélevés pendant la période épidémique –– septembre 2004 à août 2005.
LBA : lavage bronchoalvéolaire ; Asp B : aspiration bronchique ; Asp N : aspiration nasale ; Asp T : aspiration trachéale.
Une étude des virus isolés chez les enfants hospitalisés pendant cette même période montre, sur un total de 2377 aspirations nasales, une fréquence de 14,9 % pour la famille des picornaviridae (rhinovirus 77 %, entérovirus 23 %), 12 % pour le VRS, 5 % pour les virus influenza A, B et C, 4 % pour les coronavirus et 3,9 % pour les para-influenza virus. Avec une incidence de 10,7 %, Mpn vient donc en troisième position des agents responsables de pathologie respiratoire durant cette période.
3.3. Comparaison des résultats des tests PCR et sérologiques
Parmi les 124 cas d'infection active, 36 patients (32 enfants et quatre adultes) ayant bénéficié à la fois d'une recherche directe (PCR) et d'une sérologie, nous avons pu comparer les résultats des deux tests (Tableau 3 ). Quinze patients ont les deux tests positifs (12 enfants, trois adultes), cinq sont PCR positive/sérologie négative (quatre enfants, un adulte) et 16 enfants sont PCR négative/sérologie positive.
Tableau 3.
Comparaison des résultats de la PCR et de la sérologie Mpn chez 36 patients présentant une infection
| Sérologie | PCR Mpn |
|
|---|---|---|
| Elisa Mpn | Positive | Négative |
| Positive | 15 | 16 |
| Négative | 5 | 0 |
Une étude des 21 discordances PCR–sérologie a montré que :
-
●
pour les 16 enfants –– PCR négative/sérologie positive –– : quatre présentaient des IgM isolées et cinq présentaient une co-infection virale (deux VRS, un influenza A, un para-influenza 4, un coronavirus NL63) ;
-
●
pour les cinq patients –– PCR positive/sérologie négative –– : quatre n'ont pas eu de deuxième sérum à 15–21 jours ; chez le cinquième patient, les IgM apparaissent de façon fugace sans séroconversion des IgG à un mois et le résultat de la PCR donne un index d'hybridation faible (2,6).
4. Discussion
Au cours de cette étude rétrospective bas-normande, nous avons démontré en septembre 2004 l'apparition, après sept années, d'une nouvelle vague épidémique d'infections à Mpn persistant jusqu'à fin 2005. En combinant les résultats de la technique PCR et le diagnostic sérologique, l'incidence est chiffrée à 8,3 % et prédomine largement chez les enfants de cinq à neuf ans. D'autres études rétrospectives fondées sur des résultats sérologiques, PCR ou combinés PCR–sérologie montrent des caractéristiques épidémiologiques similaires concernant la distribution des âges avec un pic d'incidence à sept ans et chez l'adulte jeune [12], [13], [14], [15], la périodicité épidémique entre trois et sept ans [13], [14], [15], [17], la distribution saisonnière avec un pic en hiver et été [11], [12], [13], [14], [17], des co-infections virales [11], [12].
L'observation d'un pic d'incidence très net dans la tranche des quatre à neuf ans reflète la fréquence des infections respiratoires basses chez l'enfant. La plupart des données épidémiologiques proviennent d'études réalisées chez des enfants hospitalisés [14], [15], [18], plus rarement en ambulatoire [11], [12]. Alors que les infections virales sont largement majoritaires avant l'âge de trois ans [19], les pneumopathies à mycoplasmes constituent, entre 5 et 15 ans, la première cause de pneumopathies communautaires. Fréquentes chez l'adulte jeune, le nombre de ces pneumopathies diminue fortement après 50 ans [20]. Dans notre recrutement uniquement hospitalier, leur fréquence est probablement sous-estimée : moins sévère que les pneumonies à pneumocoques, les pneumopathies à Mpn nécessitent rarement une hospitalisation et sont le plus souvent traitées en ambulatoire [20].
La périodicité des épidémies n'est pas très bien connue mais peut s'expliquer par une variation de l'immunité protectrice dans la population générale [15]. L'immunité acquise après une infection à Mpn n'est pas durable, elle s'étend de deux à dix ans avec une moyenne à quatre ans [21], [22] ; la balance entre la population protégée et la population exposée est alors rompue et l'épidémie suivante pourra se développer. Ainsi, juste avant le pic épidémique, nous observons une chute significative de la prévalence et du titre moyen des IgG, reflet probable d'une baisse de l'immunité de la population générale.
À l'image d'autres études, la séroprévalence calculée au sein de notre population témoin est relativement élevée (36,2 %), avec un titre moyen d'IgG à 343 UA/ml. Ces chiffres sont significativement plus bas que ceux de la « population malade » hospitalisée pendant la période épidémique (séroprévalence 50,2 % –– χ2 p < 0,00001 ; titre IgG 524 UA/ml –– Mann-Whitney p < 0,001). Toutefois, la différence non significative du titre moyen des IgG au sein de la population « malade » hospitalisée, en dehors de la période épidémique, ne fait qu'appuyer la nécessité de titrer les IgG sur une paire de sérums pour l'identification d'une infection active à Mpn (Tableau 1 et Tableau 2) [23], [24], [25]. Le titrage des IgG et IgM, très dépendant de la sensibilité de la trousse Elisa et du choix du seuil, impose un titrage en parallèle des deux sérums avec la même trousse sérologique.
Les co-infections virus–bactéries sont en général trouvées dans 15 à 25 % des infections à Mpn [11], [12]. Avec 17 % de co-infections chez l'enfant, les infections à VRS prédominent pendant la période épidémique puisque nous les retrouvons chez quatre des cinq enfants PCR positive et deux des six enfants ayant une sérologie positive–PCR négative ; les autres virus en cause sont deux virus influenza A, un rhinovirus, un entérovirus, un para-influenza 4 et un coronavirus NL63.
Plusieurs auteurs ont montré que l'incidence de Mpn en pathologie respiratoire varie grandement d'une étude à l'autre (2 à 30 %), dépendant de la population étudiée (ambulatoire, hospitalière) et des techniques de diagnostic utilisées (sérologie RFC ou sérologie Elisa, PCR) [18], [25], [26], [27], [28]. Le diagnostic des infections à Mpn gagne donc à être amélioré par l'utilisation de techniques standardisées, rapides, sensibles et spécifiques.
Le diagnostic spécifique des infections à Mpn repose sur le diagnostic bactériologique. Il utilise classiquement la mise en évidence de l'agent infectieux à partir de prélèvements de la sphère ORL et le diagnostic sérologique avec la recherche d'anticorps anti-Mpn. La culture, lente et difficile, reste la technique de référence réservée aux laboratoires spécialisés mais n'est plus utilisée en routine ; elle fait place aux techniques d'amplification génique (PCR), très sensibles et spécifiques, permettant la détection précoce de faibles charges bactériennes (0,1 à 1 UCC/ml) directement à partir de prélèvements [26], [27]. La technique sérologique classique de réaction de fixation du complément, peu sensible et peu spécifique, est abandonnée au profit de techniques Elisa utilisant des antigènes purifiés. Ces techniques très sensibles et spécifiques mesurent séparément les immunoglobulines G (IgG) et IgM [29]. De nombreuses trousses existent actuellement sur le marché mais leurs performances en termes de sensibilité et spécificité sont très variables, rendant parfois l'interprétation difficile [30].
Chez l'enfant, la détection des IgM anti-Mpn est un bon marqueur d'infection récente et le plus souvent, dès le premier prélèvement, on observe des titres élevés d'IgM et IgG [18], [29], [31]. Chez l'adulte, les IgM peuvent être absentes (réinfection) et leur présence est toujours difficile à interpréter : infection active primaire ou secondaire, activation polyclonale non spécifique, croisement antigénique, interférence du FR. Quant aux IgG, elles peuvent augmenter lentement [2]. L'infection ne sera donc affirmée que sur une séroconversion ou une augmentation significative du titre des IgG [22], [25], [29]. Le résultat des examens sérologiques étant long à obtenir et le second sérum étant très rarement prélevé, l'examen direct devra donc être privilégié chez l'adulte.
Dans notre population hospitalière, le pourcentage de prélèvements positifs varie de 1 à 4,7 % entre 1997 et 2005 avec une moyenne de 2,5 %. Cette fréquence est faible, comparée à plusieurs autres études plus ciblées [11], [18], [25], [27]. Lors du pic épidémique, la recherche ciblée de Mpn chez les enfants montre une fréquence de 10,7 %, se rapprochant des chiffres de la littérature. Cette fréquence apparaît relativement élevée au vu des étiologies virales recherchées de façon systématique pendant la même période chez les enfants hospitalisés pour une pathologie respiratoire (14,9 % rhinovirus–entérovirus, 12 % VRS, 5 % virus influenza et 4 % coronavirus, 3,9 % virus para-influenza). Les co-infections Mpn–virus sont relativement fréquentes chez les enfants : 5 des 29 enfants PCR Mpn positive (17 %) hébergent un virus : quatre VRS, un rhinovirus et un entérovirus, résultats tout à fait concordant avec d'autres études [11], [12].
La mise en évidence de la bactérie par les méthodes sensibles et spécifiques de PCR a amélioré les performances diagnostiques en termes de rapidité (délai de réponse 24 heures) et de précocité (dès le début des signes cliniques) [27], [32], [33]. Cependant, l'existence de portage sain au niveau du tractus respiratoire [24], la présence d'inhibiteurs d'amplification dans certains prélèvements, la variabilité de la richesse cellulaire du prélèvement peuvent influencer fortement l'interprétation des résultats PCR. Mpn est une bactérie qui adhère aux cellules de l'épithélium respiratoire, le résultat de la recherche directe est par conséquent très dépendant de la nature et de la qualité du prélèvement. Différentes études ont essayé d'établir le site optimal de prélèvement pour la détection de Mpn par PCR [25], [32], [34], [35], [36]. Gnarpe et Michelow obtiennent une sensibilité identique avec les prélèvements nasopharyngés et oropharyngés mais préconisent une combinaison des deux pour une sensibilité optimale [35], [36]. Reznikov et al. privilégient les prélèvements de gorge aux prélèvements d'aspirations du fait d'un matériel plus riche en cellules et d'une présence moindre d'inhibiteurs [34]. Ces résultats vont à l'encontre de ceux de Tjhie et Dorigo-Zetsman, qui trouvent une fréquence non négligeable d'inhibiteurs dans les prélèvements de gorge [18], [32]. Dans notre pratique, les prélèvements de gorge prédominent. Ils sont majoritaires chez l'adulte et sont préconisés chez l'enfant en dehors du classique prélèvement d'aspiration nasale pour recherche virale. Cependant, les performances de la PCR apparaissent supérieures sur les aspirations nasales, comparées aux prélèvements de gorge (8 % d'aspiration nasale PCR positive versus 0,9 % de gorge). Ces résultats concordent avec les résultats de Dorigo-Zetsma et al. qui démontrent par ailleurs une amélioration des performances en réalisant un lavage des prélèvements de gorge avec 10 ml de PBS et une excellente performance de la PCR à partir de crachats [25]. De tous ces résultats, ne se dessine donc aucun site privilégié de prélèvement, si ce n'est que l'on peut améliorer le rendement PCR en combinant les deux sites (gorge + aspiration nasale) ou, à défaut, privilégier le prélèvement nasopharyngé à condition d'y associer la recherche d'inhibiteurs. En fait, la purification de l'extrait d'ADN est primordiale pour résoudre ce problème d'inhibition d'amplification [32], [34]. Les nouveaux automates d'extraction (Biorobot-Qiagen ou Magnapure-Roche diagnostic) permettent d'obtenir des ADN très purs et améliorent la sensibilité et la spécificité de la PCR [37].
Plusieurs études font état de l'existence de portage sain de Mpn au niveau du tractus respiratoire. Il apparaît donc difficile de le différencier d'une infection active par une PCR conventionnelle [12], [18], [32], [33]. Dorigo-Zetsma et al., en utilisant une technique PCR semi-quantitative, montrent une relation significative entre la charge bactérienne et la sévérité de l'infection chez des patients hospitalisés, non hospitalisés et contacts asymptomatiques [38]. Aussi, peut-on espérer que les nouvelles techniques de PCR en temps réel permettront d'améliorer la différentiation entre portage sain et infection active par quantification de la charge bactérienne [39], [40].
Parmi les 124 infections actives à Mpn répertoriées pendant la période épidémique 2004–2005, 36 patients ont bénéficié d'une double recherche, PCR et sérologie. Seuls ont été retenus les adultes ayant eu deux sérums avec une séroconversion ou une augmentation significative du titre des IgG. Vingt des 36 patients (55,5 %) présentaient une PCR positive, 31 une sérologie positive (86 %) et seulement 15 patients (41,7 %) avaient des résultats concordants. Cette discordance sérologie–PCR, avec une performance relativement faible de la PCR, est retrouvée également dans d'autres études qui préconisent une combinaison de la sérologie et de la PCR pour l'obtention d'un diagnostic rapide et fiable des infections à Mpn [18], [25], [27], [29], [31], [33], [35]. Les discordances –– sérologie positive/PCR négative –– peuvent s'expliquer par l'existence d'une charge bactérienne faible, en dessous du seuil de détection, du fait d'un prélèvement retardé ou plus probablement d'un prélèvement défectueux. L'absence de contrôle interne dans notre PCR ne permet pas d'éliminer la présence d'inhibiteurs de la réaction PCR [27], [33]. On ne peut également exclure un prélèvement pauvre en cellules (environ 8 à 10 % des aspirations nasales observées quotidiennement en immunofluorescence sont ininterprétables par absence de cellules nasales). Inversement, la PCR était positive chez cinq patients (quatre enfants, un adulte) ayant une sérologie négative. Dans quatre cas, l'absence de réponse immune peut s'expliquer par l'existence d'un seul prélèvement sérologique à un stade précoce de l'infection. Pour le cinquième cas, l'apparition fugace des IgM sans apparition des IgG à un mois permet d'envisager une réponse immune retardée ou déficiente [33]. Toutefois, l'index PCR faible observé chez cet adulte –– PCR positive/sérologie négative –– ne permet pas d'exclure un faux positif de la PCR ou une faible charge bactérienne témoin d'un portage sain, bien qu'aucune autre étiologie bactérienne et virale n'ait été retrouvée pour ce patient [12], [35], [41].
5. Conclusion
Les épidémies à Mpn surviennent de façon cyclique préférentiellement chez l'enfant et l'adulte jeune, avec un pic hivernal notable et une incidence élevée, les situant dans notre étude au troisième rang des infections respiratoires de l'enfant hospitalisé. La difficulté d'une discrimination purement clinique entre les infections à Mpn et les autres infections respiratoires virales appuie sur la nécessité d'une confirmation bactériologique à un stade précoce de la maladie pour une prise en charge thérapeutique optimale. La recherche directe par PCR et la sérologie chez l'enfant (IgM) apparaissent être deux outils complémentaires dont les performances dépendent du stade de l'infection et qu'il est conseillé d'associer pour améliorer la sensibilité de détection. Chez l'enfant, la sérologie présente une très bonne sensibilité, avec des IgM présentes plus souvent dès le premier prélèvement et des titres très élevés d'IgM et IgG. Chez l'adulte, il faudra privilégier la recherche directe par PCR dès le début des symptômes, de préférence sur un prélèvement nasopharyngé correctement réalisé.
Références
- 1.Clyde W.A. Clinical overview of typical Mycoplasma pneumoniae infections. Clin. Infect. Dis. 1993;17(Suppl 1):32–36. [PubMed] [Google Scholar]
- 2.Garo B., Garré M., Quiot J.J., Boles J.M., Becq-Giraudon B., Chennebault J.M. Les aspects des infections à Mycoplasma pneumoniae. Étude multicentrique rétrospective de 182 cas. Presse Med. 1988;17:1475–1478. [PubMed] [Google Scholar]
- 3.Gendrel D., Biscardi S., Marc E., Moulin F., Iniguez J.L., Raymond J. Mycoplasma pneumoniae, pneumonies et asthme. Arch. Pediatr. 2005;12:S7–S11. doi: 10.1016/s0929-693x(05)80003-x. [DOI] [PubMed] [Google Scholar]
- 4.Research Communittee of the British Thoracic Society and the Public Health Laboratory Service Community-acquired pneumonia in adults in British hospitals in 1982–1983: a survey of aetiology, mortality, prognostic factors and outcome. Q. J. Med. 1987;62:195–220. [PubMed] [Google Scholar]
- 5.Apfalter P., Stoiser B., Barousch W., Nehr M., Kramer L., Burgmann H. Community-acquired bacteria frequently detected by means of quantitative polymerase chain reaction in nosocomial early-onset ventilator-associated pneumoniae. Crit. Care Med. 2005;33:1492–1498. doi: 10.1097/01.ccm.0000169879.97129.7b. [DOI] [PubMed] [Google Scholar]
- 6.Lieberman D., Schlaeffer F., Lieberman D., Horowitz S., Horowitz O., Porath A. Mycoplasma pneumoniae community-acquired pneumonia: a review of 101 hospitalized adult patients. Respiration (Herrlisheim) 1996;63:261–266. doi: 10.1159/000196557. [DOI] [PubMed] [Google Scholar]
- 7.Baum H., Strubel A., Nollert J., Layh-Schmitt G. Two cases of fulminant Mycoplasma pneumoniae pneumonia within 4 months. Infection. 2000;28:180–183. doi: 10.1007/s150100050077. [DOI] [PubMed] [Google Scholar]
- 8.Garnier J.M., Noël G., Retornaz K., Blanc P., Minodier P. L’infection extrapulmonaire à Mycoplasma pneumoniae. Arch. Pediatr. 2005;12:S2–S6. doi: 10.1016/s0929-693x(05)80002-8. [DOI] [PubMed] [Google Scholar]
- 9.Smith R., Eviatar L. Neurologic manifestations of Mycoplasma pneumoniae infections: diverse spectrum of diseases. A report of six cases and review of the literature. Clin. Pediatr. (Phila.) 2000;39:195–201. doi: 10.1177/000992280003900401. [DOI] [PubMed] [Google Scholar]
- 10.Guleria R., Nisar N., Chawla T.C., Biswas N.R. Mycoplasma pneumoniae and central nervous system complications: a review. J. Lab. Clin. Med. 2005;146:55–63. doi: 10.1016/j.lab.2005.04.006. [DOI] [PubMed] [Google Scholar]
- 11.Layani-Milon M.P., Gras I., Valette M., Luciani J., Stagnara J., Aymard M. Incidence of upper respiratory tract Mycoplasma pneumoniae infections among outpatients in Rhône-Alpes, France, during five successive winter periods. J. Clin. Microbiol. 1999;36:1721–1726. doi: 10.1128/jcm.37.6.1721-1726.1999. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Dorigo-Zetsma J.W., Wilbrink B., van der Nat H., Bartelds A.I., Heijnen M.L., Dankert J. Results of molecular detection of Mycoplasma pneumoniae among patients with acute respiratory infection and in their household contacts reveals children as human reservoirs. J. Infect. Dis. 2001;183:675–678. doi: 10.1086/318529. [DOI] [PubMed] [Google Scholar]
- 13.Ghosh K., Clements G.B. Surveillance of Mycoplasma pneumoniae infections in Scotland 1986-1991. J. Infect. 1992;25:221–227. doi: 10.1016/0163-4453(92)94196-5. [DOI] [PubMed] [Google Scholar]
- 14.Hauksdottir G.S., Jonsson T., Sigurdardottir V., Löve A. Seroepidemiology of Mycoplasma pneumoniae infections in Iceland 1987–1996. Scand. J. Infect. Dis. 1998;30:177–180. doi: 10.1080/003655498750003591. [DOI] [PubMed] [Google Scholar]
- 15.Yu J., Yoo Y., Kim D.K., Kang H., Koh Y.Y. Distributions of antibody titers to Mycoplasma pneumoniae in Korean children in 2000–2003. J. Korean Med. Sci. 2005;20:542–547. doi: 10.3346/jkms.2005.20.4.542. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.De Barbeyrac B., Bernet-Poggi C., Fébrer F., Renaudin H., Dupont M., Bebear C. Detection of Mycoplasma pneumoniae and Mycoplasma genitalium in clinical samples by polymerase chain reaction. Clin. Infect. Dis. 1993;17:S83–S89. doi: 10.1093/clinids/17.supplement_1.s83. [DOI] [PubMed] [Google Scholar]
- 17.Foy H.M., Kenny G.E., Cooney M.K., Allan I.D. Long term epidemiology of infections with Mycoplasma pneumoniae. J. Infect. Dis. 1979;139:681–687. doi: 10.1093/infdis/139.6.681. [DOI] [PubMed] [Google Scholar]
- 18.Dorigo-Zetsma J.W., Zaat S.A., Wertheim-van Dillen P.M., Spanjaard L., Rijntjes J., van Waveren G. Comparaison of PCR, culture and serological tests for diagnosis of Mycoplasma pneumoniae respiratory tract infection in children. J. Clin. Microbiol. 1999;37:14–17. doi: 10.1128/jcm.37.1.14-17.1999. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Brouard J., Freymuth F. Bronchiolites et pneumopathies virales du nourrisson. Rev. Prat. 1996;46:2071–2076. [PubMed] [Google Scholar]
- 20.Gendrel D. Pneumonies communautaires de l’enfant : étiologie et traitement. Arch. Pediatr. 2002;9:278–288. doi: 10.1016/s0929-693x(01)00766-7. [DOI] [PubMed] [Google Scholar]
- 21.Foy H.M., Kenny G.E., Sefi R., Ochs H.D., Allan I.D. Second attacks of pneumonia due to Mycoplasma pneumoniae. J. Infect. Dis. 1977;135:673–677. doi: 10.1093/infdis/135.4.673. [DOI] [PubMed] [Google Scholar]
- 22.Nakamura S., Ebisawa I., Kitamoto O., Sato T. Persistence of serum antibody following Mycoplasma pneumoniae infection. Am. Rev. Respir. Dis. 1970;101:620–622. doi: 10.1164/arrd.1970.101.4.620. [DOI] [PubMed] [Google Scholar]
- 23.Tuuminen T., Varjo S., Ingman H., Weber T., Oksi J., Viljanen M. Prevalence of Chlamydia pneumoniae and Mycoplasma pneumoniae Immunoglobulin G and A antibodies in a healthy finnish population as analysed by quantitative enzyme immunoassays. Clin. Diagn. Lab. Immunol. 2000;7:734–738. doi: 10.1128/cdli.7.5.734-738.2000. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Gnarpe J., Lundbäck A., Sundelöf B., Gnarpe H. Prevalence of Mycoplasma pneumoniae in subjectively healthy individuals. Scand. J. Infect. Dis. 1992;24:161–164. doi: 10.3109/00365549209052607. [DOI] [PubMed] [Google Scholar]
- 25.Dorigo-Zetsma J.W., Verkooyen R.P., van Helden H.P., van der Nat H., van den Bosch J.M. Molecular detection of Mycoplasma pneumoniae in adults with community-acquired pneumonia requiring hospitalization. J. Clin. Microbiol. 2001;39:1184–1186. doi: 10.1128/JCM.39.3.1184-1186.2001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Leng Z., Kenny G.E., Roberts M.C. Evaluation of the detection limits of PCR for identification of Mycoplasma pneumoniae in clinical samples. Mol. Cell. Probes. 1994;8:125–130. doi: 10.1006/mcpr.1994.1017. [DOI] [PubMed] [Google Scholar]
- 27.Abele-Horn M., Busch U., Nitschko H., Jacobs E., Bax R., Pfaff F. Molecular approaches to diagnosis of pulmonary diseases due to Mycoplasma pneumoniae. J. Clin. Microbiol. 1998;36:548–551. doi: 10.1128/jcm.36.2.548-551.1998. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Hammerschlag M.R. Mycoplasma pneumoniae infections. Curr. Opin. Infect. Dis. 2001;14:181–186. doi: 10.1097/00001432-200104000-00012. [DOI] [PubMed] [Google Scholar]
- 29.Petitjean J., Vabret A., Gouarin S., Freymuth F. Evaluation of four commercial immunoglobulin G (IgG)-and IgM specific enzyme immunoassays for diagnosis of Mycoplasma pneumoniae infections. J. Clin. Microbiol. 2002;40:165–171. doi: 10.1128/JCM.40.1.165-171.2002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Beersma M.F.C., Dirven K., Van Dam A.P., Templeton K.E., Claas E.C.J., Goosens H. Evaluation of 12 commercial tests and the complement fixation test for Mycoplasma pneumoniae––specific Immunoglobulin G (IgG) and IgM antibodies with PCR used as the “gold standard”. J. Clin. Microbiol. 2005;43:2277–2285. doi: 10.1128/JCM.43.5.2277-2285.2005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Waris M.E., Toikka P., Saarinen T., Nikkari S., Meurman O., Vainionpaa R. Diagnosis of Mycoplasma pneumoniae pneumonia in children. J. Clin. Microbiol. 1998;36:3155–3159. doi: 10.1128/jcm.36.11.3155-3159.1998. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Tjhie J.H.T., van Kuppeveld F.J.M., Roosendaal R., Melchers W.J.G., Gordijn R., MacLaren D.M. Direct PCR enables detection of Mycoplasma pneumoniae in patients with respiratory tract infections. J. Clin. Microbiol. 1994;32:11–16. doi: 10.1128/jcm.32.1.11-16.1994. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Skakni L., Sardet A., Just J., Landman-Parker J., Costil J., Moniot-Ville N. A. Detection of Mycoplasma pneumoniae in clinical samples from pediatric patients by polymerase chain reaction. J. Clin. Microbiol. 1992;30:2638–2643. doi: 10.1128/jcm.30.10.2638-2643.1992. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Reznikov M., Blackmore T.K., Finlay-Jones J.J., Gordon D.L. Comparaison of nasopharyngeal aspirates and throat swab specimens in a polymerase chain reaction-based test for Mycoplasma pneumoniae. Eur. J. Clin. Microbiol. Infect. Dis. 1995;14:58–61. doi: 10.1007/BF02112622. [DOI] [PubMed] [Google Scholar]
- 35.Michelow I.C., Olsen K., Lozano J., Duffy L.B., McCracken G.H., Hardy R.D. Diagnostic utility and clinical significance of naso- and oropharyngeal samples used in a PCR assay to diagnose Mycoplasma pneumoniae infection in children with community-acquired pneumonia. J. Clin. Microbiol. 2004;42:3339–3341. doi: 10.1128/JCM.42.7.3339-3341.2004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Gnarpe J., Lundback A., Gnarpe H., Sundelof B. Comparison of nasopharyngeal and throat sawbs for the detection of Chlamydia pneumoniae and Mycoplasma pneumoniae by polymerase chain reaction. Scand. J. Infect. Dis. 1997;(Suppl. 104):11–12. [PubMed] [Google Scholar]
- 37.Dalesio N., Marsiglia V., Quinn A., Quinn T.C., Gaydos C.A. Performance of the MagNA pure LC robot for extraction of Chlamydia trachomatis and Neisseria gonorrhoeae DNA from urine and swab specimens. J. Clin. Microbiol. 2004;42:3300–3302. doi: 10.1128/JCM.42.7.3300-3302.2004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Dorigo-Zetsma J.W., Zaat S.A.J., Vriesema A.J.M., Dankert J. Demonstration by a nested PCR for Mycoplasma pneumoniae that M. pneumoniae load in the throat is higher in patients hospitalised for M. pneumoniae infection than in non-hospitalised subjects. J. Med. Microbiol. 1999;48:1115–1122. doi: 10.1099/00222615-48-12-1115. [DOI] [PubMed] [Google Scholar]
- 39.Khanna M., Fan J., Pehler-Harrington K., Waters C., Douglass P., Stallock J. The pneumoplex assays, a multiplex PCR-enzyme hybridation assay that allows simultaneous detection of five organisms, Mycoplasma pneumoniae, Chlamydia (Chlamydophila) pneumoniae, Legionella pneumophila, Legionella micdadei, and Bordetella pertussis, and its real-time counterpart. J. Clin. Microbiol. 2005;43:565–571. doi: 10.1128/JCM.43.2.565-571.2005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Welti M., Jaton K., Altwegg M., Sahli R., Wenger A., Bille J. Development of a multiplex real-time quantitative PCR assay to detect Chlamydia pneumoniae, Legionella pneumophila and Mycoplasma pneumoniae in respiratory tract secretions. Diagn. Microbiol. Infect. Dis. 2003;45:85–95. doi: 10.1016/s0732-8893(02)00484-4. [DOI] [PubMed] [Google Scholar]
- 41.Foy H.M. Infections caused by Mycoplasma pneumoniae and possible carrier state in different populations of patients. Clin. Infect. Dis. 1993;17:S37–S46. doi: 10.1093/clinids/17.supplement_1.s37. [DOI] [PubMed] [Google Scholar]


