Abstract
目的
探讨监测WT1基因在急性T淋巴细胞白血病(T-ALL)患者异基因造血干细胞移植(allo-HSCT)后预后的意义。
方法
回顾性分析2009年1月至2012年3月在我单位行allo-HSCT,且移植后连续监测WT1基因表达水平的68例T-ALL患者。留取初治,移植前,+30、+60、+90、+180、+270、+360 d骨髓标本,用实时定量聚合酶链反应(RQ-PCR)方法监测WT1基因表达水平,同时经流式细胞术(FCM)监测微小残留病(MRD)。
结果
①移植后WT1基因低水平表达与较低复发风险相关;②+60、+90 d WT1基因升高与较高累计复发率相关(P<0.001、P=0.003),与较低的无病生存率(P=0.004、P=0.006)和总生存率相关(P=0.004、P=0.007);③移植后微小残留病(MRD)阳性是T-ALL移植后复发的独立危险因素;④联合WT1基因和FCM可用于移植后复发的监测。
结论
+60、+90 d WT1基因升高与T-ALL预后显著相关,应尽早予以干预,减少复发甚至死亡风险。T-ALL移植后WT1基因表达低于0.6%,复发风险较低;WT1基因表达超过0.6%需密切随访,并结合FCM监测,达到MRD阳性标准需临床干预,降低复发率。
Keywords: WT1基因, 白血病,T淋巴细胞,急性, 造血干细胞移植, 复发
Abstract
Objective
To probe monitoring Wilms tumor-1 (WT1) gene expression level in acute T lymphoblastic leukemia (T-ALL) following allogeneic hematopoietic stem cell transplantation (allo-HSCT) with prognostic significance.
Methods
This retrospective study analyzed 68 T-ALL cases from January 2009 to March 2012, that monitoring WT1 gene expression level after allo-HSCT. WT1 expression level was measured with real-time quantitative reverse transcription polymerase chain reaction (RQ-PCR) method at +30, +60, +90, +180, +270, +360 days after allo-HSCT, simultaneously monitoring residual leukemia using flow cytometry (FCM).
Results
Low WT1 gene expression level associated with a low risk of recurrence after allo-HSCT in T-ALL. Increased WT1 gene expression levels at +60 and +90 days after allo-HSCT associated with higher cumulative incidences of relapse (P<0.001, P=0.003), and low disease-free survival rates (P=0.004, P=0.006), and low overall survival rates (P=0.004, P=0.007). The presence of MRD after allo-HSCT was an independent prognostic factor for relapse in T-ALL. Combining WT1 gene and FCM could be used to monitor recurrence after allo-HSCT.
Conclusion
Increased WT1 gene expression level at +60 and +90 days after allo-HSCT significantly associated with worse prognosis, that should be intervened as early as possible to reduce the risk of recurrence or death. WT1 gene expression level that was less than 0.6% associated with lower risk of recurrence. WT1 gene expression more than 0.6% that needed close follow-up, combined with FCM monitoring MRD, which required intervention to reduce the relapse.
Keywords: WT1 gene; Leukemia, T lymphoblastic, acute; Hematopoietic stem cell transplantation; Relapse
Wilms tumer-1(WT1)基因是一种“泛白血病基因”,对异基因造血干细胞移植(allo-HSCT)患者移植后微小残留病(MRD)的监测及预后评价均具有重要意义。目前,WT1基因在急性髓系白血病(AML)患者巩固化疗后[1]、allo-HSCT后[2]升高的意义已较为明确,常用于AML的MRD监测。急性淋巴细胞白血病(ALL)MRD监测则常用流式细胞技术(FCM),部分病例可监测特异性标志基因。在ALL亚型中,急性T淋巴细胞白血病(T-ALL)相对于急性B淋巴细胞白血病(B-ALL)FCM特异性较差、特异性标志基因较少。对无特异性标志基因的T-ALL,WT1基因是否与其预后相关引起关注。有报道称T-ALL患者WT1基因表达的增加与较差的预后相关[3],但目前尚无关于移植后WT1基因与T-ALL复发的相关研究,我们回顾性分析了2009至2012年在我单位行allo-HSCT的T-ALL患者,旨在探讨监测WT1基因在T-ALL患者allo-HSCT后预后的意义。
病例和方法
1.病例:2009年1月至2012年3月在我单位行allo-HSCT且移植后连续监测WT1基因表达水平的68例T-ALL患者,其中男57例,女11例,中位年龄24.5(3~57)岁。T-ALL患者的诊断根据国际MICM分型标准[4]。T-ALL 61例,双表型5例,T淋巴母细胞淋巴瘤白血病3例,T淋巴母细胞淋巴瘤、前体T淋巴母细胞淋巴瘤、非霍奇金T细胞淋巴瘤、T淋巴母细胞霍奇金淋巴瘤各1例。移植前首次完全缓解(CR1)55例,CR2 7例,无效6例。同胞全合19例,单倍体49例。发生急性移植物抗宿主病(aGVHD) 33例。中位随访时间833 d,复发15例(22%),死亡22例(32.3%)。分别于初治,移植前,+30、+60、+90、+180、+270、+360 d行骨髓穿刺,检测WT1基因表达水平。
2.移植前预处理:采用本所常规方案[5],全合移植采用改良白消安加环磷酰胺或环磷酰胺加全身照射方案,半合移植在常规方案基础上加用抗胸腺细胞球蛋白。
3.WT1检测:骨髓标本经Na2EDTA抗凝,用相对密度为1.077 g/L的淋巴细胞分离液分离单个核细胞。经TRIzol试剂(美国Invitrogen公司产品)提取总RNA。逆转录cDNA及RQ-PCR均采用本单位常用方法[6]–[7]。内参照基因选用ABL基因。albU上游引物Ia:5′-TCCTCGTCCTCCAGCTGTTATC-3′,Ib:5′-TTATCAAAGGAGCAGGGAAGAAG-3′;ablU下游引物a2:5′-CTCAGACCCTGAGGCTCAAAGT-3′,探针:FAM-AGCCCTTCAGCGGCCAGTAGCATCT-TAMRA。WT1基因序列源自Tamaki等[8]的报道,上游引物:5′-GATAACCACACAACGCCCATC-3′,下游引物:5′-CACACGTCGCACATCCTGAAT-3′,探针:FAM-ACACCGTGCGTGTGTATTCTGTATTGG-TAMRA。WT1表达水平由以下公式计算:WT1基因表达水平(%)=(WT1拷贝数/ABL拷贝数)×100%,<0.6%为阴性。
4.定义:复发包括血液学复发、髓外复发,均通过骨髓形态学检查或组织病理学检查确诊。FCM阳性指流式细胞术检测到表型异常T淋巴细胞,比例高于0.1%。MRD阳性:连续2次WT1≥0.6%,或连续2次FCM阳性,2次间隔时间2周;或同一标本WT1≥0.6%且FCM阳性。干预:对MRD阳性患者进行的措施,包括停用环孢素、使用IL-2、化疗+供者淋巴细胞输注(DLI)等。
5.统计学处理:采用SPSS 19.0统计学软件,非连续变量用独立样本χ2检验。生存率的估计采用Kaplan-Meier法,两组生存曲线比较采用Log-rank检验,多因素分析采用COX回归模型。随访截至2014年1月1日,中位随访时间833(61~1 680) d。
结果
一、基本信息
68例患者中粒细胞及血小板均未植活2例,仅血小板植入不良1例,余63例粒细胞及血小板均植活,植活中位时间分别为+13(+10~+22)和+15(+8~+71) d。共35例发生aGVHD,中位发生时间为+20(+11~+77) d。随访期间,共15例发生慢性移植物抗宿主病(cGVHD),中位发生时间+177(+72~+660) d。68例患者中共复发15例,复发中位时间为+765(+60~+1 680) d。共死亡22例,死亡中位时间为+243(+61~+1 518) d,其中死于复发12例,呼吸衰竭6例,病毒性脑炎1例,消化道出血1例,cGVHD 1例。
二、组间比较移植后WT1表达水平
1.移植后WT1基因表达水平未升高(组1):68例患者中26例在移植后随访期间WT1基因表达水平始终未超过0.6%。该组患者中位随访时间为+ 819 (+ 72~+ 1 644)d,随访期间均未复发,+ 30、+60、+90、+180、+270、+360 d WT1基因表达中位值分别为0.13% (0.02%~0.55%)、0.12%(0~0.04%)、0.11% (0~0.04%)、0.18% (0~0.43%)、0.11% (0~0.54%)、0.22%(0.05%~0.50%)。
2.移植后WT1基因表达水平升高未干预(组2):24例患者中16例于移植后WT1基因仅升高1次,无FCM阳性,监测到移植后WT1基因升高最高值的中位数为0.95%(0.60%~2.77%)。这16例患者中复发1例,复发时间为+60 d,复发时WT1基因为2.77%,发现WT1基因高于0.6%,同时发现复发,家属放弃进一步治疗,故未干预;15例患者WT1基因升高1次后复查即下降至正常,未干预,随访期间未复发。移植后WT1基因达至我单位定义的MRD阳性标准共8例,移植后WT1基因表达最高值的中位数为9.65%(1.00%~51.80%)。这8例患者中复发7例,其中6例因发现WT1基因升高同时血液学复发、髓外复发,此时WT1基因分别为51.8%、20.5%、10.2%、9.1%、3.16%、1.3%,家属放弃治疗,未干预;1例WT1基因升高至23.1%,因cGVHD未干预,于+282 d血液学复发,并死于复发。余1例未复发患者于+300 d MRD阳性,拟行化疗联合DLI,但因cGVHD未干预,后复查WT1基因下降至0.38%,故未干预。
3.移植后WT1基因表达水平升高并干预(组3):18例患者分别因MRD或血液学复发干预,干预措施包括减量免疫抑制剂、化疗、DLI等治疗。本组WT1基因表达的中位值为3.00% (0.67%~23.80%)。8例患者出现WT1基因升高同时血液学复发,其中3例因复发行DLI,继续监测WT1基因表达水平均下降至0.6%以下,随访期间均达CR;另5例行化疗或DLI等干预,复发时WT1基因分别为2.1%、10.1%、11.7%、11.3%、13.7%,均因复发分别于+120、+154、+365、+703、+846 d死亡。余10例干预后WT1基因不同程度下降,均低于0.6%,随访期间均未复发。
三、移植后WT1基因表达水平与T-ALL复发、无病生存(DFS)率、总体生存(OS)率的关系
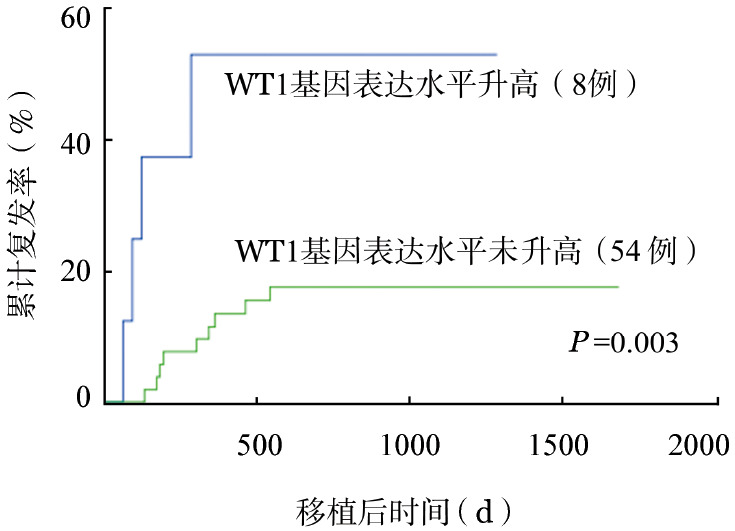
对68例T-ALL患者的初治,移植前,+ 30、+60、+90、+180、+270、+360 d WT1基因表达水平升高与复发的关系进行分析,结果见表1。若以WT1>0.6%为界值,+60 d W1基因升高对复发有意义(P<0.01),其他时间点WT1升高与复发无统计学相关性。若以WT1>1%为界值,+60、+90 d WT1基因高表达均与复发显著相关(P=0.006、0.003)。通过受试者工作曲线分析可知,WT1基因升高至2.05%对复发敏感性、特异性最高,曲线下面积为0.966。+60 d WT1基因表达水平升高与较高的累计复发率(CIR)相关(P<0.001),+90 d WT1基因表达水平升高亦与较高的CIR相关(P=0.003,图1),而+ 30、+180、+270、+360 d WT1基因表达水平升高与CIR均无显著相关性(P=0.275、0.102、0.046、0.079)。
表1. 68例急性T淋巴细胞白血病患者WT1基因表达水平升高与复发关系.
| 时间 | 例数 | WT1基因表达 | 复发 | 未复发 | P值 |
| 初治 | 34 | 高表达 | 6 | 22 | 0.533 |
| 正常 | 2 | 4 | |||
| 移植前 | 61 | 高表达 | 3 | 10 | 0.886 |
| 正常 | 12 | 36 | |||
| +30 d | 65 | 高表达 | 1 | 1 | 0.320 |
| 正常 | 13 | 50 | |||
| +60 d | 64例 | 高表达 | 5 | 2 | <0.001 |
| 正常 | 8 | 49 | |||
| +90 d | 62例 | 高表达 | 4 | 4 | 0.031 |
| 正常 | 9 | 45 | |||
| +180 d | 55例 | 高表达 | 4 | 7 | 0.129 |
| 正常 | 7 | 37 | |||
| +270 d | 49例 | 高表达 | 2 | 3 | 0.083 |
| 正常 | 5 | 39 | |||
| +360 d | 47例 | 高表达 | 4 | 8 | 0.038 |
| 正常 | 3 | 32 | |||
| 未干预 | 50例 | MRD阳性 | 6 | 2 | <0.001 |
| MRD阴性 | 1 | 41 |
注:MRD:微小残留病
图1. 急性T淋巴细胞白血病患者+90 d WT1基因表达升高与累计复发率关系.
结合组1、组2分析WT1基因表达增加与复发关系,可去除达到MRD阳性临床干预对结果的影响。比较发现,MRD阳性与复发增加显著相关(P<0.001,表1)。分析患者性别,移植前疾病状态,移植前有无中枢系统白血病,CMV血症,EBV血症,移植后MRD,+30、+60、+90、+180、+270、+360 d WT1基因表达升高与复发的关系,仅移植后MRD阳性与复发显著相关(P<0.001),是复发的独立预后因素(HR=36.85,95% CI 4.826~281.351)。
本研究结果显示,+60、+90 d WT1基因高表达与较低DFS率有关(P=0.004、P=0.006)。+30、+180、+270、+360 d WT1基因高表达与DFS均无显著相关性(P=0.629、0.329、0.113、0.140)。
+60、+90 d WT1基因升高与较差的整体生存(OS)率有关(P=0.004、P=0.007)。+30、+180、+270、+360 d WT1基因高表达与OS均无显著相关性(P=0.552、0.118、0.027、0.163)。死亡的22例患者中因复发死亡12例,复发时WT1基因表达均升高,分别为1.3%、1.5%、1.5%、6.6%、10.1%、10.2%、11.7%、13.7%、20.5%、23.1%、51.8%。
四、比较移植后WT1基因与其他监测指标
移植后WT1基因仅1次升高对预测白血病复发的敏感性100.0%,特异性56.5%;移植后WT1基因连续2次升高(2次监测间隔2周)对白血病复发的敏感性53.3%,特异性83.0%;移植后仅FCM阳性对白血病复发的敏感性0,特异性95.7%。MRD阳性对白血病复发敏感性93.3%,特异性79.2% (表2)。
表2. WT1基因与流式细胞术(FCM)敏感性特异性比较.
| 基因表达 | 复发 | 未复发 | 敏感性(%) | 特异性(%) | Youden指数 |
| WT1仅1次升高 | 9 | 20 | 100 | 56.5 | 0.565 |
| WT1阴性 | 0 | 26 | |||
| WT1连续2次升高 | 8 | 9 | 53.3 | 83.0 | 0.363 |
| WT1未连续2次升高 | 7 | 44 | |||
| 仅FCM阳性 | 0 | 2 | 0 | 95.7 | −0.043 |
| FCM阴性 | 15 | 45 | |||
| MRD阳性 | 14 | 11 | 93.3 | 79.2 | 0.725 |
| MRD阴性 | 1 | 42 |
注:MRD:微小残留病
讨论
WT1基因作为“泛白血病基因”,在急性白血病移植后MRD监测的作用已逐渐被认可,Ogawa等[9]的研究已证实WT1基因可作为一项急性白血病移植后早期复发的危险度分层参数,Candoni等[10]亦报道了相似结论。
本研究组1揭示了移植后WT1基因低水平表达与T-ALL较低的复发风险相关,这26例未复发患者移植后连续监测骨髓WT1基因,其表达水平始终未超过0.6%。这与Candoni等[11]报道的急性白血病获完全缓解后WT1基因表达水平较低的结论相似,也与Zhao等[2]在急性白血病中的研究结论一致。
目前有部分研究在AML中证实移植后WT1基因表达水平升高与较差预后相关[12]–[13],本研究首次报道WT1基因表达水平与T-ALL移植后预后的关系。组2与组1差异证实WT1基因升高与移植后复发率升高有关。并发现移植后WT1基因达2.05%,预测复发的敏感性及特异性均较高。这与我们发现的WT1基因在急性白血病中预测复发的临界值不同,可能与WT1基因表达水平在T-ALL中比AML中波动范围大有关[14]。组2中WT1基因仅升高1次患者的复发率明显低于MRD阳性患者,可继续监测。这与之前的研究结论[15]相似。
本研究结果证实MRD阳性是复发的独立预后因素,MRD阳性患者复发率是MRD阴性患者复发率的36.85倍,应积极干预,预防复发,这与Chiusa等[16]的研究结论相似。组3与组2比较证实,对MRD阳性患者及时干预,可降低复发率;对已复发者,可一定程度达到完全缓解,并延长存活时间。这与我们发现的免疫抑制剂减量可增强移植后残留的移植物抗白血病(GVL)效应从而减慢复发速度的结论[2]相似。
通过生存分析发现,+60、+90 d WT1基因高表达均与较高的CIR及较低的DFS、OS率相关,这与2010年Heesch等[3]发现T-ALL患者WT1基因表达的增加与较差的预后相关的结论一致,也与我们之前在急性白血病中研究结论[2]相同。+30 d WT1基因升高与预后关系并不显著,可能与移植后最初阶段免疫重建尚不完整有关[17]。移植后早期GVL效应未充分发挥,白血病细胞清除延迟,这也是造成移植后患者WT1基因倍增时间不同的原因之一[9]。
目前常用监测MRD的手段为FCM及分子生物学技术。本研究我们比较了WT1基因与FCM对T-ALL复发的敏感性及特异性,发现移植后WT1基因仅1次升高对T-ALL复发的敏感性最高,但特异性很低,假阳性率较高,若以此为依据干预会出现过度干预。仅FCM阳性对T-ALL复发的特异性较高而敏感性不足,假阴性率较高,易漏诊。有文献报道[18],由于免疫球蛋白及T细胞受体重排受克隆演变的影响,FCM联合分子生物学指标不降低假阴性结果。之前我们的研究亦显示,在急性白血病中联合FCM及WT1基因可提高对复发的预测[19]。本研究我们通过比较发现,联合FCM和WT1基因可在临床获得较高的敏感性和特异性,适于移植后对T-ALL复发的监测。
+60、+90 d WT1基因升高与T-ALL预后显著相关,应尽早予以干预,减少复发甚至死亡风险。T-ALL移植后WT1基因表达低于0.6%,复发风险较低;WT1基因超过0.6%需密切随访,同时结合FCM监测,达到MRD阳性标准需临床干预,降低复发率。
Funding Statement
基金项目:首都临床特色应用研究项目(Z121107001012085);北京市自然科学基金面上项目(7132181);国家自然科学基金青年基金(81300440)
References
- 1.Cilloni D, Gottardi E, Fava M, et al. Usefulness of quantitative assessment of the WT1 gene transcript as a marker for minimal residual disease detection[J] Blood. 2003;102(2):773–774; author reply 774. doi: 10.1182/blood-2003-03-0980. [DOI] [PubMed] [Google Scholar]
- 2.Zhao XS, Jin S, Zhu HH, et al. Wilms' tumor gene 1 expression: an independent acute leukemia prognostic indicator following allogeneic hematopoietic SCT[J] Bone Marrow Transplant. 2012;47(4):499–507. doi: 10.1038/bmt.2011.121. [DOI] [PubMed] [Google Scholar]
- 3.Heesch S, Goekbuget N, Stroux A, et al. Prognostic implications of mutations and expression of the Wilms tumor 1 (WT1) gene in adult acute T-lymphoblastic leukemia[J] Haematologica. 2010;95(6):942–949. doi: 10.3324/haematol.2009.016386. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Alvarnas JC, Brown PA, Aoun P, et al. Acute lymphoblastic leukemia[J] J Natl Compr Canc Netw. 2012;10(7):858–914. doi: 10.6004/jnccn.2012.0089. [DOI] [PubMed] [Google Scholar]
- 5.陈 欢, 刘 开彦, 许 兰平, et al. 异基因造血干细胞移植后实时定量聚合酶链反应在巨细胞病毒感染诊断和治疗中的应用[J] 中华血液学杂志. 2009;30(2):77–81. [Google Scholar]
- 6.秦 亚溱, 刘 艳荣, 李 金兰, et al. 慢性髓系白血病不同bcr/abl融合基因转录子与临床关系的研究[J] 中华血液学杂志. 2003;24(7):347–350. [Google Scholar]
- 7.秦 亚溱, 阮 国瑞, 李 金兰, et al. 定量检测wt1基因表达水平在急性髓系白血病微量残留病监测中的意义[J] 中华血液学杂志. 2005;26(11):649–652. [PubMed] [Google Scholar]
- 8.Tamaki H, Mishima M, Kawakami M, et al. Monitoring minimal residual disease in leukemia using real-time quantitative polymerase chain reaction for Wilms tumor gene (WT1)[J] Int J Hematol. 2003;78(4):349–356. doi: 10.1007/BF02983561. [DOI] [PubMed] [Google Scholar]
- 9.Ogawa H, Tamaki H, Ikegame K, et al. The usefulness of monitoring WT1 gene transcripts for the prediction and management of relapse following allogeneic stem cell transplantation in acute type leukemia[J] Blood. 2003;101(5):1698–1704. doi: 10.1182/blood-2002-06-1831. [DOI] [PubMed] [Google Scholar]
- 10.Candoni A, Toffoletti E, Gallina R, et al. Monitoring of minimal residual disease by quantitative WT1 gene expression following reduced intensity conditioning allogeneic stem cell transplantation in acute myeloid leukemia[J] Clin Transplant. 2011;25(2):308–316. doi: 10.1111/j.1399-0012.2010.01251.x. [DOI] [PubMed] [Google Scholar]
- 11.Candoni A, Tiribelli M, Toffoletti E, et al. Quantitative assessment of WT1 gene expression after allogeneic stem cell trans-plantation is a useful tool for monitoring minimal residual disease in acute myeloid leukemia[J] Eur J Haematol. 2009;82(1):61–68. doi: 10.1111/j.1600-0609.2008.01158.x. [DOI] [PubMed] [Google Scholar]
- 12.Woehlecke C, Wittig S, Arndt C, et al. Prognostic impact of WT1 expression prior to hematopoietic stem cell transplantation in children with malignant hematological diseases[J] J Cancer Res Clin Oncol. 2015;141(3):523–529. doi: 10.1007/s00432-014-1832-y. [DOI] [PubMed] [Google Scholar]
- 13.Lyu X, Xin Y, Mi R, et al. Overexpression of Wilms tumor 1 gene as a negative prognostic indicator in acute myeloid leukemia[J] PloS One. 2014;9(3):e92470. doi: 10.1371/journal.pone.0092470. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Boublikova L, Kalinova M, Ryan J, et al. Wilms' tumor gene 1 (WT1) expression in childhood acute lymphoblastic leukemia: a wide range of WT1 expression levels, its impact on prognosis and minimal residual disease monitoring[J] Leukemia. 2006;20(2):254–263. doi: 10.1038/sj.leu.2404047. [DOI] [PubMed] [Google Scholar]
- 15.金 松, 刘 代红, 许 兰平, et al. 血液系统恶性疾病异基因造血干细胞移植后wt1基因动态检测的意义[J] 中华内科杂志. 2008;47(7):578–581. [PubMed] [Google Scholar]
- 16.Chiusa L, Francia di Celle P, et al. Prognostic value of quantitative analysis of WT1 gene transcripts in adult acute lymphoblastic leukemia[J] Haematologica. 2006;91(2):270–271. [PubMed] [Google Scholar]
- 17.Knechtli CJ, Goulden NJ, Hancock JP, et al. Minimal residual disease status as a predictor of relapse after allogeneic bone marrow transplantation for children with acute lymphoblastic leukaemia[J] Br J Haematol. 1998;102(3):860–871. doi: 10.1046/j.1365-2141.1998.00873.x. [DOI] [PubMed] [Google Scholar]
- 18.van der Velden VH, Wijkhuijs JM, van Dongen JJ. Non-specific amplification of patient-specific Ig/TCR gene rearrangements depends on the time point during therapy: implications for minimal residual disease monitoring[J] Leukemia. 2008;22(3):641–644. doi: 10.1038/sj.leu.2404925. [DOI] [PubMed] [Google Scholar]
- 19.Zhao XS, Yan CH, Liu DH, et al. Combined use of WT1 and flow cytometry monitoring can promote sensitivity of predicting relapse after allogeneic HSCT without affecting specificity[J] Ann Hematol. 2013;92(8):1111–1119. doi: 10.1007/s00277-013-1733-1. [DOI] [PubMed] [Google Scholar]


