Abstract
目的
探讨动态监测RUNX1-RUNX1T1转录本水平在儿童t(8;21)急性髓系白血病(AML)预后评估中的价值。
方法
以2010年1月至2016年4月就诊于郑州大学人民医院的55例儿童t(8;21)AML患者为研究对象,应用实时荧光定量PCR(RQ-PCR)动态监测患者的RUNX1-RUNX1T1转录本水平,分析其变化与疾病预后的关系。
结果
初诊时患者骨髓细胞中的RUNX1-RUNX1T1转录本水平与复发及预后无关。1个疗程诱导缓解治疗后,骨髓细胞中RUNX1-RUNX1T1转录本水平比诊断时下降大于2个对数级(a>2 Log)者与a≤2 Log者相比:5年累积复发率(CIR)分别为(24.3±8.4)%及(52.6±9.7)%(χ2=9.046,P=0.003),5年无复发生存(RFS)率分别为(71.6±12.7)%及(48.1±13.2)%(χ2=5.814,P=0.016),5年总生存(OS)率分别为(76.9±12.5)%及(48.9±14.7)%(χ2=6.346,P=0.012),差异均有统计学意义。多因素Cox回归模型结果显示,1个疗程诱导缓解后RUNX1-RUNX1T1转录本下降是否大于2 Log是影响RFS(HR=0.263,95% CI 0.081~0.851,P=0.026)与OS(HR=0.214,95% CI 0.057~0.808,P=0.023)的独立预后因素。巩固治疗及治疗结束随访期间动态监测RUNX1-RUNX1T1转录本水平变化,共有16例患者发生分子学复发,其中13例患者发生了血液学复发,分子学复发至血液学复发的中位时间为4.0(1.5~5.8)个月。对2例分子学复发后的患者及时采取异基因造血干细胞移植治疗后,患者未发生血液学复发。
结论
通过RQ-PCR动态监测儿童t(8;21)AML患者的RUNX1-RUNX1T1转录本水平,可以将儿童t(8;21)AML细分为相对低危组和相对高危组并提前预测血液学复发,为实现儿童t(8;21)AML的精准分层和风险-适应治疗提供科学依据。
Keywords: 白血病,髓样,急性, 融合基因,RUNX1-RUNX1T1, 肿瘤,残余, 儿童, 预后
Abstract
Objective
To investigate the prognostic value of dynamic monitoring of RUNX1-RUNX1T1 transcript in pediatric patients with t(8;21) acute myeloid leukemia (AML).
Methods
The clinical features and RUNX1-RUNX1T1 transcript levels of 55 pediatric t(8;21) AML patients, newly diagnosed from Jan. 2010 to Apr. 2016, were analyzed retrospectively. The relationship between the minimal residual disease (MRD) and prognosis was analysed by dynamic monitoring of RUNX1-RUNX1T1 transcript levels using real-time quantitative PCR (RQ-PCR) technology.
Results
The RUNX1-RUNX1T1 transcript levels in bone marrow cells at diagnosis was not related to relapse. After one course of induction therapy, patients with a more than 2 Log reduction of RUNX1-RUNX1T1 transcript levels (>2 Log) had lower 5 years cumulative incidence of relapse (CIR) [(24.3±8.4) % vs (52.6±9.7) %, χ2=9.046, P=0.003], relapse-free survival (RFS) [(71.6±12.7) % vs (48.1±13.2) %, χ2=5.814, P=0.016], and better overall survival (OS) [(76.9±12.5) % vs (48.9±14.7) %, χ2=6.346, P=0.012], compared to patients with a less than 2 Log reduction (a<2 Log). Multivariate Cox survival analysis suggested that a>2 Log reduction in RUNX1-RUNX1T1 transcript levels after a course of induction therapy was an independent prognostic factor for RFS (HR=0.263, 95%CI 0.081–0.851, P=0.026) and OS (HR=0.214, 95% CI 0.057–0.808, P=0.023). During consolidation therapy and follow-up period, molecular relapse of 16 cases and hematologic relapse of 13 cases were identified by continuous dynamic monitoring of RUNX1-RUNX1T1 transcript levels, with a median interval of 4.0 (1.5–5.8) months from the molecular relapse to hematologic relapse. 2 cases of molecular relapse who received timely allogeneic hematopoietic stem cell transplantation did not experience hematologic relapse.
Conclusion
Dynamic monitoring RUNX1-RUNX1T1 transcript levels by RQ-PCR technique can subdivide patients into relatively low and high risk group, early screen patients at high risk of relapse and provide a scientific basis for precision stratification and risk-adapted therapy for pediatric t(8;21) AML children.
Keywords: Leukemia, myeloid, acute; Gene fusion, RUNX1-RUNX1T1; Neoplasm, residual; Child; Prognosis
儿童t(8;21)急性髓系白血病(AML)预后相对较好[1]–[3],但仍有约三分之一的患者最终复发,一旦复发则预后很差[4]–[5]。因此,如何将复发风险高的患者早期识别出来,及时提高治疗强度,以期达到降低复发率、提高总生存率的目的,是临床上亟待解决的问题。白血病微小残留病(MRD)监测,对于评估治疗反应和早期发现高复发风险的患者至关重要[6]。实时荧光定量PCR(RQ-PCR)技术检测白血病细胞的敏感性和特异性很高,是监测MRD水平的常用方法之一[7]。本研究中,我们探讨利用RQ-PCR动态监测RUNX1-RUNX1T1转录本水平在儿童t(8;21)AML预后评估中的价值,现总结如下。
病例与方法
一、病例
以2010年1月至2016年4月我科确诊并规律治疗的55例初诊儿童t(8;21)AML患者为研究对象,诊断参照2016年WHO分类标准[8]。入组标准:①年龄<16岁;②接受规律足量治疗;③细胞遗传学检测发现t(8;21)和(或)RUNX1-RUNX1T1融合基因阳性。本研究获我院伦理委员会批准,患者监护人均签署知情同意书。
二、治疗方案
采用标准的DAE(柔红霉素+阿糖胞苷+依托泊苷)方案进行诱导缓解治疗。完全缓解(CR)后予4~6个疗程的巩固治疗,所用方案为蒽环类+中剂量阿糖胞苷或大剂量阿糖胞苷方案。2例患者分子学复发后行异基因造血干细胞移植(allo-HSCT)治疗。
三、RUNX1-RUNX1T1融合基因的检测
1.RNA提取:抽取骨髓液4~5 ml,EDTA抗凝,以淋巴细胞分离液分离单个核细胞,按TRIzol试剂(美国Invitrogen公司产品)说明书提取总RNA,于波长260 nm处紫外分光光度计定量,置于−80 °C冰箱保存备用。
2.cDNA合成:逆转录体系20 µl,包括总RNA 1 µg、RNasin 20 U、dNTP 1 mmol、随机引物100 ng、M-MLV逆转录酶200 U。37 °C 60 min,95 °C 5 min灭活M-MLV逆转录酶,cDNA置于−20 °C冰箱保存。
3.RQ-PCR反应条件及体系:在Prism 7500实时荧光定量PCR仪(美国ABI公司产品)上进行。反应体系为10 µl,其中上、下游引物各0.1 µmol/L,TaqMan探针0.2 mol/L,2×Taq Man universal PCR Mastermix(美国ABI公司产品)5 µl,cDNA 1 µl。PCR条件:50 °C 2 min;95 °C 10 min,95 °C 15 s,62 °C 1 min,40个循环。内参基因选用Abl。Abl和RUNX1-RUNX1T1的引物、探针均选用欧洲抗癌项目公布的序列[9]–[10]。
4.RQ-PCR标准曲线制作:首先扩增K562细胞cDNA,将PCR产物分别插入pGEM-Teasy质粒载体中,经过细菌转化、筛选、鉴定、扩增,提取DNA并测其浓度,计算出拷贝数,用质粒稀释液10倍系列将质粒稀释成102~106拷贝,制成质粒标准品,用于制作Abl及RUNX1-RUNX1T1标准曲线。扩增待测样本,利用标本的Ct值,根据标准曲线分别计算出各份标本Abl及RUNX1-RUNX1T1的拷贝数。为保证准确性,对于拷贝数<500的样品均进行第2次扩增,RUNX1-RUNX1T1拷贝数取两次结果的平均数。
四、随访
RUNX1-RUNX1T1融合基因监测时间点包括:初诊时、每次诱导缓解后、每次巩固治疗后、allo-HSCT前、allo-HSCT后、治疗结束时;治疗结束后2年内每3个月检测1次。随访截止日期为2016年5月1日,中位随访时间为16(1~76)个月。
五、主要研究指标
完全缓解(CR)、复发、无复发生存(RFS)、累积复发率(CIR)、总生存(OS)的定义依照国际工作组(IWG)2013年指南[11]。主要观察指标为RFS、OS,次要观察指标为CIR。分子学复发定义为RUNX1-RUNX1T1转录本水平上升至大于0.001。经过前期系列探索发现,本研究资料用第1个疗程后RUNX1-RUNX1T1转录本水平下降是否大于2个对数级(2 Log)临床意义最明显,故选取此为界值。
六、统计学处理
利用SPSS 22.0和R 3.3.1软件进行数据分析、处理,利用GraphPad Prism 5.01作图。非正态分布的两独立随机变量采用Spearman秩相关法进行关联性分析。单因素生存分析采用Kaplan-Meier法,组间RFS、OS的比较采用Log-rank检验;组间CIR的比较采用R软件cmprsk分析;采用Cox比例风险回归模型进行多因素分析。均采用双侧检验,P<0.05为差异有统计学意义。
结果
1.患者的临床特征与总体预后:55例儿童t(8;21)AML患者中,中位年龄为9(1~16)岁,男女比为1.4∶1,WBC<20×109/L者占67.3%,中位HGB与PLT分别为65(38~122)g/L和30(2~122)×109/L。1个疗程诱导化疗后共有53例患者获得CR,5年的RFS、OS率分别为(65.7±9.6)%、(62.0±9.3)%。Log-rank检验显示不同年龄、性别、WBC、HGB及PLT分组患者5年RFS、OS率差异均无统计学意义(表1)。
表1. 影响55例儿童t(8;21)急性髓系白血病患者无复发生存(RFS)及总生存(OS)的单因素分析.
| 因素 | 例数 | 5年RFS |
5年OS |
||||||
| 率(%) | 标准误(%) | χ2值 | P值 | 率(%) | 标准误(%) | χ2值 | P值 | ||
| 年龄 | 0.020 | 0.887 | 0.171 | 0.679 | |||||
| <10岁 | 28 | 67.5 | 10.6 | 77.4 | 9.3 | ||||
| 10~16岁 | 27 | 52.0 | 16.1 | 50.2 | 16.4 | ||||
| 性别 | 0.012 | 0.913 | 0.022 | 0.881 | |||||
| 男 | 31 | 65.6 | 11.6 | 67.5 | 12.9 | ||||
| 女 | 24 | 58.5 | 14.4 | 64.4 | 14.6 | ||||
| WBC | 0.034 | 0.853 | 0.004 | 0.948 | |||||
| <20×109/L | 37 | 63.1 | 12.4 | 65.6 | 12.7 | ||||
| ≥20×109/L | 18 | 57.6 | 15.5 | 65.8 | 15.3 | ||||
| HGB | 1.110 | 0.292 | 0.425 | 0.514 | |||||
| <60 g/L | 23 | 68.5 | 14.0 | 65.8 | 14.0 | ||||
| ≥60 g/L | 32 | 58.6 | 11.7 | 63.4 | 13.9 | ||||
| PLT | 2.333 | 0.127 | 0.958 | 0.328 | |||||
| <30×109/L | 27 | 75.4 | 12.9 | 74.7 | 13.0 | ||||
| ≥30×109/L | 28 | 48.0 | 13.0 | 56.2 | 14.2 | ||||
2.初诊时RUNX1-RUNX1T1转录本水平:初诊时患者的RUNX1-RUNX1T1转录本中位数为0.965(0.005~3.001),Spearson相关分析显示其与患者年龄(rs=0.216,P=0.113)、性别(rs=−0.025,P=0.854)、HGB(rs=0.190,P=0.165)及PLT(rs=0.099,P=0.472)均无明显相关性。并且,Log-rank检验显示初诊时RUNX1-RUNX1T1转录本水平的高低(以0.965为界)与RFS、OS均无明显相关性(P值均>0.05)。
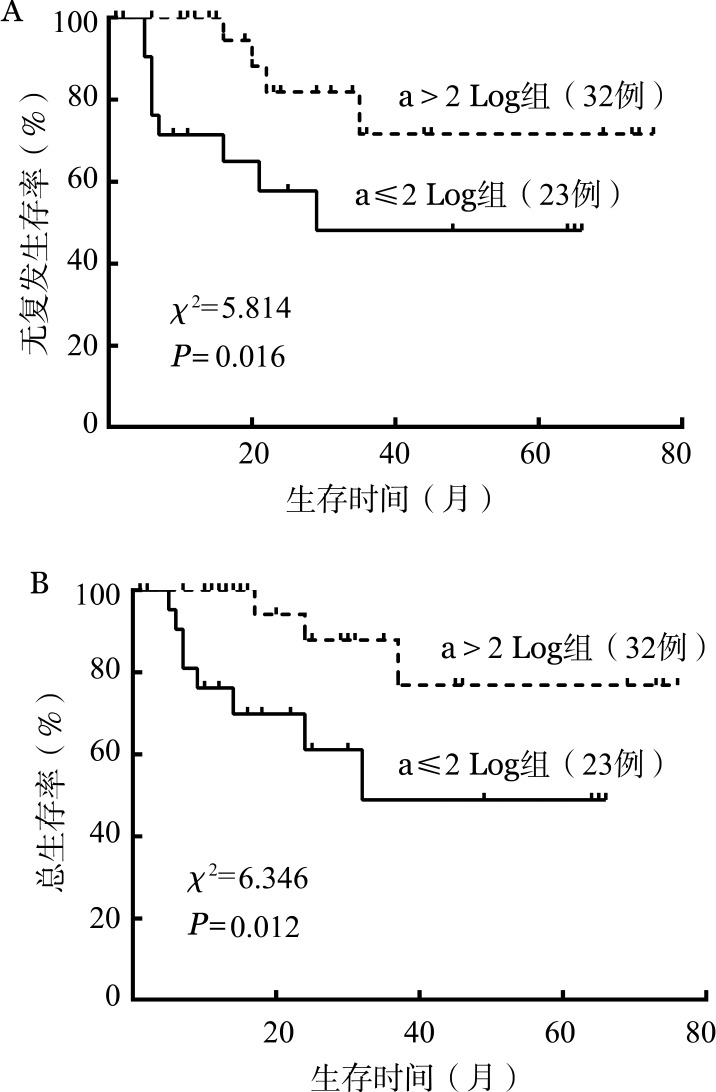
3.单因素分析诱导缓解后RUNX1-RUNX1T1转录本下降水平对预后的影响:评估1个疗程诱导缓解治疗后RUNX1-RUNX1T1转录本下降水平对CIR、RFS和OS的影响。以初诊时RUNX1-RUNX1T1转录本水平为基线,根据1个疗程诱导缓解后RUNX1-RUNX1T1转录本水平是否比诊断时下降2 Log,可以将患者分为a≤2 Log组和a>2 Log组。R软件cmprsk分析提示,诱导缓解治疗后a≤2 Log组5年CIR为(52.6±9.7)%,而a>2 Log组5年CIR仅为(24.3±8.4)%,差异有统计学意义(χ2=9.046,P=0.003)(图1)。Log-rank检验显示,a≤2 Log组与a>2 Log组5年RFS率分别为(48.1±13.2)%和(71.6±12.7)%(χ2=5.814,P=0.016),5年OS率分别为(48.9±14.7)%和(76.9±12.5)%(χ2=6.346,P=0.012),差异均有统计学意义(图2)。
图1. 1个疗程诱导缓解治疗后RUNX1-RUNX1T1转录本水平下降是否大于2个对数级(a>2 Log)对累积复发率(CIR)的影响.
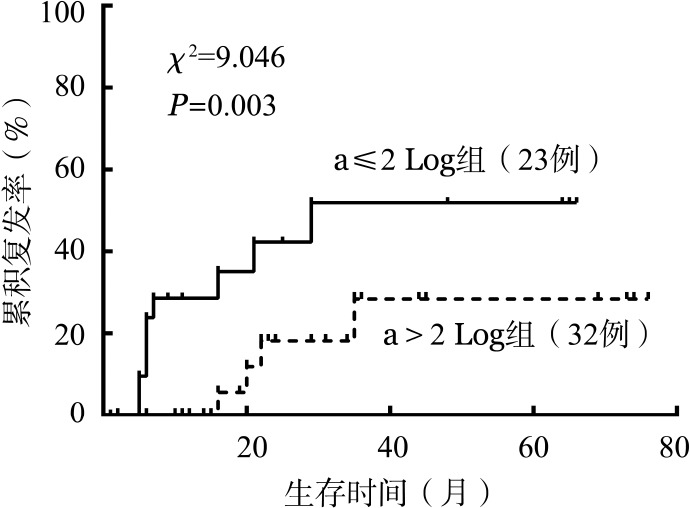
图2. 1个疗程诱导缓解治疗后RUNX1-RUNX1T1转录本水平下降是否大于2个对数级(a>2 Log)对无复发生存(A)及总生存(B)的影响.
4.多因素Cox分析诱导缓解后RUNX1-RUNX1T1转录本下降水平对预后的影响:为了进一步评估诱导缓解治疗后RUNX1-RUNX1T1转录本下降是否大于2 Log的预后价值,我们以全部患者诊断时的临床特征(年龄、性别、WBC、HGB、PLT)以及诱导缓解后RUNX1-RUNX1T1转录本下降是否大于2 Log为自变量,应用Cox比例风险回归模型进行多因素生存分析。结果发现,只有诱导缓解治疗后RUNX1-RUNX1T1转录本下降是否大于2 Log,是影响RFS的独立预后因素(HR=0.263,95%CI 0.081~0.851,P=0.026),并且也是影响OS的独立预后因素(HR=0.214,95% CI 0.057~0.808,P=0.023)。
5.动态监测RUNX1-RUNX1T1转录本水平变化在预测复发中的作用:除了评估诱导缓解治疗后RUNX1-RUNX1T1转录本下降水平具有预后价值之外,我们还动态监测患者RUNX1-RUNX1T1转录本水平变化。巩固治疗期间和治疗结束随访过程中,共有16例患者发生分子学复发,其中13例患者最终发生了血液学复发,从分子学复发至血液学复发的中位时间间隔为4.0(1.5~5.8)个月。我们对2例分子学复发后的患者及时采取了allo-HSCT治疗,至今2例患者均处于分子学完全缓解状态。
讨论
儿童AML的危险分层主要根据初诊时的细胞遗传和分子生物学结果,t(8;21)或RUNX1-RUNX1T1融合基因阳性被认为是一种预后相对较好的分子遗传学标志,但由于白血病的高度异质性,并非所有的儿童t(8;21)AML均能取得满意的治疗效果,其5年OS率仅有70%左右。因此,亟需探索新的方法和标准,将儿童t(8;21)AML中复发风险高、预后差的患者早期识别出来,进而尽早调整治疗方法和强度,以期达到降低CIR、提高OS率的目的。
为了弥补单纯通过分子遗传学对白血病进行预后分层的不足,根据患者对治疗的反应,进而对患者的复发风险进行动态评估,并给与风险-适应治疗,成为近年来白血病领域研究的热点[12]–[14]。动态监测MRD水平,评估治疗反应和疾病预后,进而对白血病患者进行风险-适应治疗,已经明显降低了儿童急性淋巴细胞白血病(ALL)的CIR,使得儿童ALL的5年OS率提高到了90%左右[15]。应用RQ-PCR监测MRD水平以预测白血病复发,进而调整治疗方案,在成人t(8;21)AML中也有相关报道[16]。然而,关于RQ-PCR监测MRD在儿童t(8;21)AML中的预后和危险度再分层价值,仅有极少数小样本研究报道[17]–[18]。因此,我们以儿童t(8;21)AML特征性的RUNX1-RUNX1T1融合基因为分子靶点,应用RQ-PCR技术,探讨了RUNX1-RUNX1T1转录本水平的变化在预测白血病复发和OS中的作用。
我们的研究显示,初诊时患者的RUNX1-RUNX1T1转录本水平与RFS、OS率均无明显的相关性,这与Pigazzi等[17]研究结果一致。然而,1个疗程诱导缓解治疗后RUNX1-RUNX1T1转录本下降水平是否大于2 Log,是RFS、OS的独立预后因素。基于我们的这项发现,可以根据诱导缓解后RUNX1-RUNX1T1转录本下降水平在疾病治疗早期就识别出复发风险高的患者,从而将儿童t(8;21)AML进一步细分为相对高危组和相对低危组。
诱导缓解治疗后RUNX1-RUNX1T1转录本下降水平,在一定程度上反映了患者白血病细胞对治疗的敏感性[7]。下降幅度大的,可能单纯通过化疗就可以达到治愈的目的;而下降幅度小的,可能需要包括allo-HSCT在内的、更为强烈的治疗方式才能达到治愈的目的。在成人t(8;21)AML相关研究中,Zhu等[16]通过监测治疗后RUNX1-RUNX1T1转录本下降水平,来识别高危复发和低危复发患者,对于高危复发者采用allo-HSCT,对于低危复发患者采用大剂量化疗,基于上述个体化治疗实现了降低CIR、提高OS率的目标。对于儿童t(8;21)AML患者是否也可以采取这种以MRD为导向的风险-适应治疗,来提高其治疗效果,尚需前瞻性、大样本的随机对照临床研究加以证实。
儿童t(8;21)AML的治疗周期较长,巩固治疗期间及治疗结束后动态监测RUNX1-RUNX1T1转录本水平变化在预测复发中也具有重要意义。Leroy等[19]对成人t(8;21)AML缓解期患者随访发现,检测到RUNX1-RUNX1T1融合基因并不能预示复发,只有该基因表达水平明显上升或高于0.001时才提示临床复发。Lane等[20]报道缓解期患者骨髓中RUNX1-RUNX1T1转录本水平增加1个对数级,其复发风险增加8倍。我们发现,儿童t(8;21)AML患者从分子学复发至血液学复发的中位时间间隔为4.0(1.5~5.8)个月,这与Yin等[21]关于成人t(8;21)AML的报道一致。从分子学复发至临床复发往往经历数月时间,这为采取有效的干预措施以尽量避免临床全面复发,提供了宝贵的窗口期。我们对2例分子学复发后的患者及时采取了allo-HSCT,至今2例患者仍无复发生存。由此可见,巩固治疗以及治疗结束后随访期间,仍然需要密切关注患者的MRD状态,对分子学复发或RUNX1-RUNX1T1转录本水平逐渐升高的患者,充分利用分子学复发至临床复发的窗口期,及时调整治疗策略,以期达到提高挽救治疗成功率的目的。
总而言之,RQ-PCR动态监测儿童t(8;21)AML患者的MRD水平,根据1个疗程诱导缓解治疗后RUNX1-RUNX1T1转录本水平下降幅度评估治疗反应,可以将儿童t(8;21)AML细分为相对高危组和相对低危组,早期识别出复发风险高的患者;根据持续缓解期间MRD水平的动态变化,能够提前预测血液学复发,最终为实现儿童t(8;21)AML的动态精准分层和风险-适应治疗提供科学依据。受制于回顾性研究的天然缺陷,我们的研究结果尚需大样本、前瞻性的研究进一步证实。另外,尽管RUNX1-RUNX1T1转录本水平的动态监测使得以动态危险度分层为基础的精准治疗成为可能,但最终能否降低儿童t(8;21)AML的CIR,提高OS,仍然需要进一步的临床试验加以证明。
Funding Statement
基金项目:国家自然科学基金(81300417);河南省重点科技攻关计划(132102310120);河南省医学科技攻关计划(201003108)
Fund program: National Nature Science Foundation of China(81300417); Key Science and Technology Project of Henan(132102310120); Medical Science and Technology Research Project of Henan(201003108)
References
- 1.Pession A, Masetti R, Rizzari C, et al. Results of the AIEOP AML 2002/01 multicenter prospective trial for the treatment of children with acute myeloid leukemia[J] Blood. 2013;122(2):170–178. doi: 10.1182/blood-2013-03-491621. [DOI] [PubMed] [Google Scholar]
- 2.陈 玉梅, 刘 天峰, 阮 敏, et al. 79例儿童t(8;21)急性髓系白血病的核型及预后分析[J] 中国医学科学院学报. 2009;31(5):542–546. doi: 10.3881/j.issn.1000-503X.2009.05.006. [DOI] [PubMed] [Google Scholar]
- 3.Zwaan CM, Kolb EA, Reinhardt D, et al. Collaborative Efforts Driving Progress in Pediatric Acute Myeloid Leukemia[J] J Clin Oncol. 2015;33(27):2949–2962. doi: 10.1200/JCO.2015.62.8289. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Harrison CJ, Hills RK, Moorman AV, et al. Cytogenetics of childhood acute myeloid leukemia: United Kingdom Medical Research Council Treatment trials AML 10 and 12[J] J Clin Oncol. 2010;28(16):2674–2681. doi: 10.1200/JCO.2009.24.8997. [DOI] [PubMed] [Google Scholar]
- 5.von NC, Reinhardt D, Sander A, et al. Prognostic impact of specific chromosomal aberrations in a large group of pediatric patients with acute myeloid leukemia treated uniformly according to trial AML-BFM 98[J] J Clin Oncol. 2010;28(16):2682–2689. doi: 10.1200/JCO.2009.25.6321. [DOI] [PubMed] [Google Scholar]
- 6.Rubnitz JE, Inaba H, Dahl G, et al. Minimal residual disease-directed therapy for childhood acute myeloid leukaemia: results of the AML02 multicentre trial[J] Lancet Oncol. 2010;11(6):543–552. doi: 10.1016/S1470-2045(10)70090-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Jourdan E, Boissel N, Chevret S, et al. Prospective evaluation of gene mutations and minimal residual disease in patients with core binding factor acute myeloid leukemia[J] Blood. 2013;121(12):2213–2223. doi: 10.1182/blood-2012-10-462879. [DOI] [PubMed] [Google Scholar]
- 8.Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J] Blood. 2016;127(20):2391–2405. doi: 10.1182/blood-2016-03-643544. [DOI] [PubMed] [Google Scholar]
- 9.Gabert J, Beillard E, van der Velden VH, et al. Standardization and quality control studies of ‘real-time’ quantitative reverse transcriptase polymerase chain reaction of fusion gene transcripts for residual disease detection in leukemia-a Europe Against Cancer program[J] Leukemia. 2003;17(12):2318–2357. doi: 10.1038/sj.leu.2403135. [DOI] [PubMed] [Google Scholar]
- 10.Beillard E, Pallisgaard N, van der Velden VH, et al. Evaluation of candidate control genes for diagnosis and residual disease detection in leukemic patients using ‘real-time’ quantitative reverse-transcriptase polymerase chain reaction (RQ-PCR)-a Europe against cancer program[J] Leukemia. 2003;17(12):2474–2486. doi: 10.1038/sj.leu.2403136. [DOI] [PubMed] [Google Scholar]
- 11.Cheson BD, Bennett JM, Kopecky KJ, et al. Revised recommendations of the international working group for diagnosis, standardization of response criteria, treatment outcomes, and reporting standards for therapeutic trials in acute myeloid leukemia[J] J Clin Oncol. 2003;21(24):4642–4649. doi: 10.1200/JCO.2003.04.036. [DOI] [PubMed] [Google Scholar]
- 12.Terwijn M, van Putten WL, Kelder A, et al. High prognostic impact of flow cytometric minimal residual disease detection in acute myeloid leukemia: data from the HOVON/SAKK AML 42A study[J] J Clin Oncol. 2013;31(31):3889–3897. doi: 10.1200/JCO.2012.45.9628. [DOI] [PubMed] [Google Scholar]
- 13.丁 超, 晁 红颖, 陈 苏宁. 核心结合因子相关急性髓系白血病的治疗进展[J] 临床荟萃. 2014;29(10):1114–1118. doi: 10.3969/j.issn.1004-583X.2014.10.009. [DOI] [Google Scholar]
- 14.王 志东, 秦 亚溱, 刘 艳荣, et al. 实时定量RT-PCR方法监测急性髓系白血病患者造血干细胞移植后AML1-ETO融合基因mRNA水平的临床意义[J] 中华血液学杂志. 2008;29(10):672–675. doi: 10.3321/j.issn:0253-2727.2008.10.006. [DOI] [Google Scholar]
- 15.Pieters R, de Groot-Kruseman H, Van der Velden V, et al. Successful Therapy Reduction and Intensification for Childhood Acute Lymphoblastic Leukemia Based on Minimal Residual Disease Monitoring: Study ALL10 From the Dutch Childhood Oncology Group[J] J Clin Oncol. 2016;34(22):2591–2601. doi: 10.1200/JCO.2015.64.6364. [DOI] [PubMed] [Google Scholar]
- 16.Zhu HH, Zhang XH, Qin YZ, et al. MRD-directed risk stratification treatment may improve outcomes of t(8;21) AML in the first complete remission: results from the AML05 multicenter trial[J] Blood. 2013;121(20):4056–4062. doi: 10.1182/blood-2012-11-468348. [DOI] [PubMed] [Google Scholar]
- 17.Pigazzi M, Manara E, Buldini B, et al. Minimal residual disease monitored after induction therapy by RQ-PCR can contribute to tailor treatment of patients with t(8;21) RUNX1-RUNX1T1 rearrangement[J] Haematologica. 2015;100(3):e99–101. doi: 10.3324/haematol.2014.114579. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Zhang L, Cao Z, Ruan M, et al. Monitoring the AML1/ETO fusion transcript to predict outcome in childhood acute myeloid leukemia[J] Pediatr Blood Cancer. 2014;61(10):1761–1766. doi: 10.1002/pbc.25109. [DOI] [PubMed] [Google Scholar]
- 19.Leroy H, de Botton S, Grardel-Duflos N, et al. Prognostic value of real-time quantitative PCR (RQ-PCR) in AML with t(8;21)[J] Leukemia. 2005;19(3):367–372. doi: 10.1038/sj.leu.2403627. [DOI] [PubMed] [Google Scholar]
- 20.Lane S, Saal R, Mollee P, et al. A > or =1 log rise in RQ-PCR transcript levels defines molecular relapse in core binding factor acute myeloid leukemia and predicts subsequent morphologic relapse[J] Leuk Lymphoma. 2008;49(3):517–523. doi: 10.1080/10428190701817266. [DOI] [PubMed] [Google Scholar]
- 21.Yin JA, O'Brien MA, Hills RK, et al. Minimal residual disease monitoring by quantitative RT-PCR in core binding factor AML allows risk stratification and predicts relapse: results of the United Kingdom MRC AML-15 trial[J] Blood. 2012;120(14):2826–2835. doi: 10.1182/blood-2012-06-435669. [DOI] [PubMed] [Google Scholar]


