Abstract
目的
探讨曲尼司特对病毒性心肌炎(VMC)小鼠心肌纤维化的作用。
方法
72只BALB/C小鼠完全随机分为对照组、模型组和干预组(n=24), 对照组小鼠腹腔内注射Eagle's培养液, 模型组和干预组腹腔注射科萨奇病毒B3建立VMC模型, 干预组建模后予曲尼司特灌胃(每日200mg/kg), 维持给药到取材前一天。分别在造模后7、14、28d三个时间点每组各取8只小鼠心肌组织, 行苏木精-伊红染色和Masson染色观察病理改变; 甲苯胺蓝和硫瑾染色观察肥大细胞(MC)计数; RT-PCR及Westernblot检测结缔组织生长因子(CTGF)、I型胶原蛋白(ColI)的mRNA及蛋白表达量; 并分别对CTGFmRNA与MC计数和ColImRNA的表达进行相关性分析。
结果
各时间点模型组心肌病理积分及胶原容积分数高于对照组, 曲尼司特干预后降低(P<0.05)。模型组MC计数、CTGF和ColImRNA及蛋白的表达高于对照组, 曲尼司特干预后降低, 但仍高于对照组(P<0.05)。模型组7d、14d时心肌MC计数与CTGFmRNA呈正相关(r=0.439, P=0.049);模型组7d、14d时心肌组织CTGFmRNA与ColImRNA呈正相关(r=0.646, P=0.007), 28d时亦呈正相关(r=0.326, P=0.031)。
结论
曲尼司特可能通过抑制MC的聚集、降低CTGF和ColI的表达, 减轻VMC小鼠心肌纤维化效应。
Keywords: 曲尼司特, 病毒性心肌炎, 心肌纤维化, 结缔组织生长因子, I型胶原蛋白, 小鼠
Abstract
Objective
To investigate the effect of tranilast on myocardial fibrosis in mice with viral myocarditis (VMC).
Methods
Male balb/c mice (n=72) were randomly divided into control, VMC and tranilast groups (n=24 each). In the VMC and tranilast groups, the mice were infected with Coxsackie virus B3 (CVB3) to prepare VMC model, while the control group was treated with Eagle's medium. After modeling, the tranilast group was administrated with tranilast [200 mg/(kg.d)] until the day before sampling. On days 7, 14 and 28 after CVB3 or Eagle's medium infection, heart specimens (n=8) were taken and examined after Toluidine blue staining and Nissl staining for counts of mast cells (MC), hematoxylin-eosin staining for myocardial pathological changes, and Masson staining for myocardial fibrosis. The expression of CTGF and type I collagen (Col I) in the myocardial tissue was measured by RT-PCR and Western blot. The correlations of CTGF mRNA expression with MC counts and Col I expression were analyzed.
Results
The myocardial pathological changes and collagen volume fraction in the VMC group were significantly higher than in the control group at all three time points (P < 0.05). Tranilast treatment significantly decreased the myocardial pathological changes and collagen volume fraction compared with the VMC group (P < 0.05). The mRNA and protein expression of CTGF and Col I increased in the VMC group compared with the control group, and the increases were reduced with tranilast treatment (P < 0.05). The number of MC was positively correlated to CTGF mRNA expression on the 7th day and 14th day (r=0.439, P=0.049) in the VMC group. There were positive correlations between the mRNA expression of Col I and CTGF on the 7th day and 14th day (r=0.646, P=0.007) and the 28th day (r=0.326, P=0.031).
Conclusions
Tranilast may inhibit the aggregation of MC and down-regulate the expression of CTGF, relieving myocardial fibrosis of mice with VMC.
Keywords: Tranilast, Viral myocarditis, Myocardial fibrosis, Connective tissue growth factor, Type I collagen, Mice
病毒性心肌炎(viral myocarditis, VMC)是儿童后天性心脏病最常见的心血管疾病之一。柯萨奇病毒B3(coxsackievirus B3, CVB3)是VMC最主要的病原体。临床上VMC患者多数预后良好,部分呈急性爆发感染导致猝死,也有部分患者呈慢性感染,可进展为心肌纤维化,导致扩张型心肌病。迄今VMC发病机制尚未完全明确,亦无特效治疗方法。曲尼司特是一种抗变态反应药,本课题组前期研究已证实其能减少小鼠心肌肥大细胞(mast cell, MC)数目、抑制TGF-β1和骨桥蛋白的表达,改善心肌纤维化[1]。近年来研究表明结缔组织生长因子(connective tissue growth factor, CTGF)也参与组织器官纤维化疾病发生发展。本实验通过建立VMC小鼠模型,利用曲尼司特对VMC小鼠干预,通过心肌MC计数、检测CTGF及Ⅰ型胶原蛋白(type Ⅰ collagen, Col Ⅰ)的表达,进一步探讨曲尼司特在VMC小鼠心肌纤维化中的作用机制。
1. 材料与方法
1.1. 实验动物和病毒
健康的清洁级4周龄纯种雄性BALB/C小鼠(体重17.1±0.7 g)由中南大学湘雅医学院动物学部提供,饲养于SPF环境中。嗜心性CVB3 Nancy株由本实验室扩增保存。
1.2. 主要试剂
曲尼司特购于中国药科大学制药厂,CTGF、Col Ⅰ引物由南京金斯瑞生物科技公司合成,逆转录试剂盒购于Fermentas公司,兔抗小鼠CTGF一抗购于美国Lifespan公司,兔抗小鼠Col Ⅰ一抗购于美国Abcam公司,抗兔二抗购于南京凯基生物公司。
1.3. 动物分组
72只BALB/C小鼠完全随机分为对照组、模型组和干预组,每组24只。动物模型的建立方法参照参考文献[2]。
1.4. 标本采集
以病毒接种日为0 d,根据VMC发生发展的急性期、亚急性期和慢性期,分别于建模后的7、14、28 d从对照组、模型组、干预组各随机挑选8只小鼠,断颈处死,开胸摘取心脏。心脏标本分为2份,一份用PBS缓冲液清洗后在4%多聚甲醛中固定,经脱水、透明、浸蜡、包埋,制备组织切片用于病理学检查;另一份放入新的EP管中保存在-80℃冰箱,用于RT-PCR和Western blot检测CTGF、Col Ⅰ的mRNA及蛋白的表达。
1.5. 病理学检测
常规苏木精-伊红(HE)染色,光镜下观察心肌组织病理改变,并计算心肌组织病理积分。计分方法:每个标本随机选取5张切片,每张切片随机观察5个视野,计算每个视野中炎症细胞浸润和坏死区域面积与整个视野的面积之比。计分标准:无明显病变计0分,病变面积 < 25%计1分,25%~50%计2分,50%~75%计3分,>75%计4分。
Masson三色染色,光镜下观察心肌组织纤维化并计算心肌组织胶原容积分数(CVF)。计算方法:CVF=胶原面积/总面积×100%。
1.6. 肥大细胞计数
常规石蜡切片,甲苯胺蓝和硫瑾染色,光镜下观察肥大细胞数量,每个标本随机选取5张切片,每张切片随机观察5个高倍镜视野,计数肥大细胞,取平均值。
1.7. RT-PCR法检测CTGF及Col Ⅰ mRNA表
达无菌条件下提取小鼠心肌组织总RNA,采用逆转录试剂盒合成cDNA。引物序列见表 1。PCR反应体系共20 μL,包括cDNA 1.6 μL,2×Taq PCR MasterMix 10 μL,上下游引物各0.5 μL,Nuclear-free水补足体积至20 μL。CTGF mRNA反应条件:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸30 s,共30个循环;72℃再延伸10 min,4℃保存。Col Ⅰ mRNA反应条件:95 ℃预变性5 min;95 ℃变性30 s,57.5 ℃退火30 s,72℃延伸30 s,共35个循环;72℃再延伸10 min,4℃保存。PCR产物行1.5%琼脂糖凝胶电泳,110 V恒压下电泳30 min,采用凝胶电泳成像系统观察,结果以目的基因条带与内参基因条带灰度值的比值表示,实验重复3次。
1.
PCR引物序列及长度

|
1.8. Western blot法检测CTGF及Col Ⅰ蛋白表
达无菌条件下提取小鼠心肌组织总蛋白,BCA法测定蛋白浓度。制备10%SDS-PAGE分离胶电泳,电转至PVDF膜;5%脱脂牛奶常温下封闭3 h,加一抗于4℃孵育过夜,洗膜后加入二抗常温孵育1 h,洗膜后将现配的ECL发光液滴于PVDF膜上,凝胶成像仪成像并检测其OD值。结果以目的蛋白条带和内参β-actin条带的OD比值表示,实验重复3次。
1.9. 统计学分析
采用SPSS 19.0统计软件包对实验数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验;两组间比较采用成组t检验。相关分析采用Pearson积差相关系数分析,P < 0.05为差异有统计学意义。
2. 结果
2.1. 动物模型评定
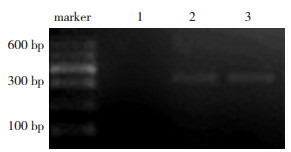
整个实验过程中无小鼠死亡,全部纳入研究。对照组小鼠一般情况可,无异常表现;模型组和干预组在感染CVB3后,出现觅食减少、焦躁、易激惹、竖毛、拱背、毛色暗淡、粗糙、易掉毛等现象;干预组以上表现比模型组轻。模型组和干预组小鼠心肌组织内可检测到CVB3 mRNA,对照组小鼠心肌组织内则未检测到(图 1)。
1.
各组心肌组织CVB3 mRNA表达
1、2、3分别为对照组、模型组、干预组。
2.2. 心肌组织病理改变
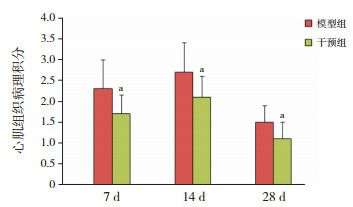
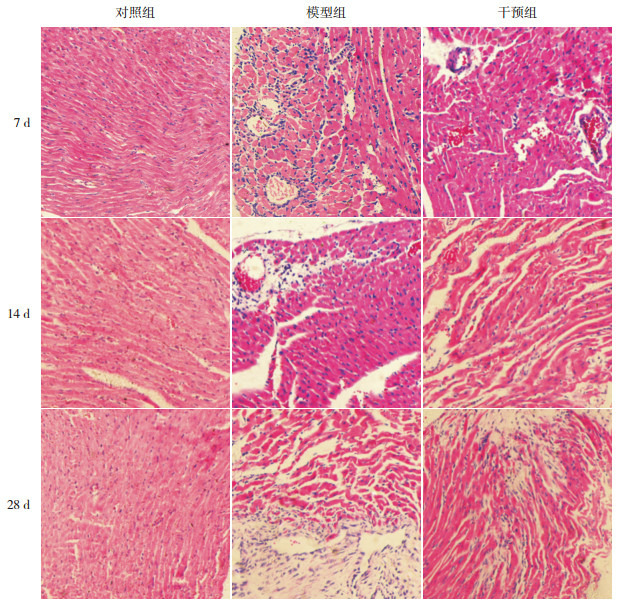
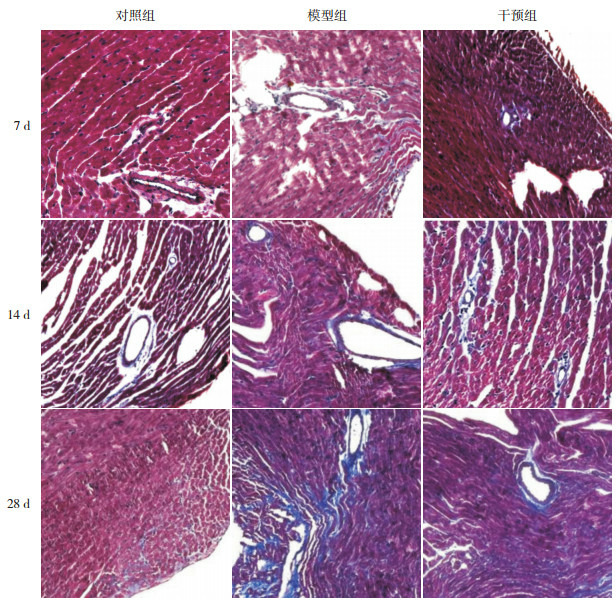
HE染色可观察到对照组小鼠心肌细胞排列规则、整齐,形态正常,心肌间质及血管周围未见炎性细胞浸润。模型组7 d时可观察到心肌细胞水肿,部分细胞崩解坏死,心肌血管周围及心肌间质伴有广泛的炎性细胞浸润,以淋巴细胞为主;14 d时心肌组织坏死加重,细胞排列紊乱,仍然可见炎性细胞浸润,部分血管周围可见少许成纤维细胞;28 d时,心肌血管周围及间质基本上未见炎性细胞,可见大量的成纤维细胞。干预组各时间点病变程度较模型组轻。以对照组小鼠心肌病理积分为0,干预组各时间点心肌病理积分均较模型组低(P < 0.05)。见图 2~3。
2.
各时间点各组心肌组织病理积分比较(n=8)
对照组小鼠病理积分为0;a示与同时间点模型组比较,P<0.05。
3.
各时间点各组心肌组织HE染色结果(×100)
对照组小鼠心肌细胞排列规则、整齐,形态正常,心肌间质及血管周围未见炎性细胞浸润。模型组7 d时可观察到心肌细胞水肿,部分细胞崩解坏死,心肌血管周围及心肌间质伴有广泛的炎性细胞浸润,以淋巴细胞为主;14 d时心肌组织坏死加重,细胞排列紊乱,仍然可见炎性细胞浸润,部分血管周围可见少许成纤维细胞;28 d时心肌血管周围及间质基本上未见炎性细胞,可见大量的成纤维细胞。各时间点干预组病变程度较模型组轻。
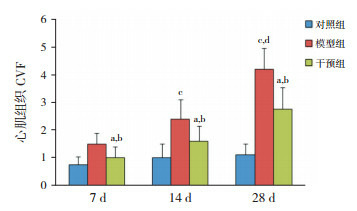
Masson三色染色可观察到各时间点对照组小鼠心肌血管周围及间质极少见蓝染的胶原纤维。模型组7 d、14 d时血管周围可见胶原纤维较对照组增多,但心肌间质未见明显胶原纤维;28 d时可见大量排列紊乱的胶原纤维;各时间点干预组小鼠胶原纤维较对照组多,但较模型组少。各时间点干预组CVF高于对照组,但低于模型组(P < 0.05)。见图 4~5。
4.
时间点心肌组织CVF比较(n=8)
a示与同时间点对照组比较,P<0.05;b示与同时间点模型组比较,P<0.05;c示与同组7 d时比较,P<0.05;d示与同组14 d时比较,P<0.05。
5.
各时间点各组心肌组织Masson染色结果(×100)
各时间点对照组小鼠心肌血管周围及间质蓝染的胶原纤维极少见。模型组7 d、14 d时血管周围可见胶原纤维较对照组增多,但心肌间质未见明显胶原纤维;28 d时可见大量排列紊乱的胶原纤维。各时间点,干预组小鼠胶原纤维较对照组多,但较模型组少。
2.3. 心肌肥大细胞计数
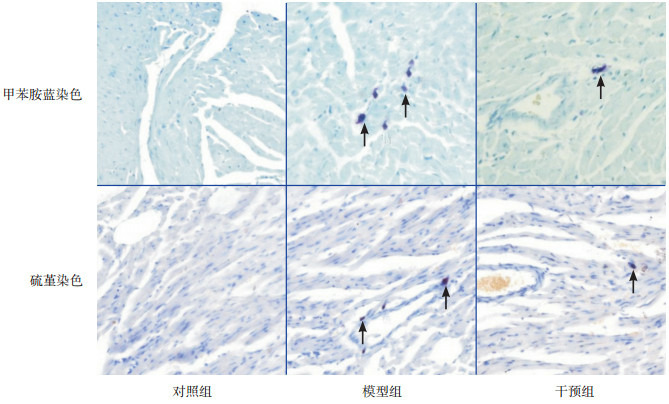
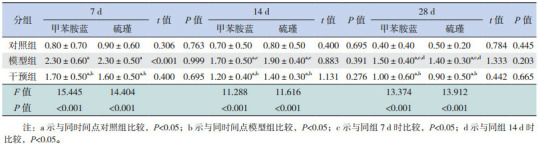
甲苯胺蓝染色法及硫瑾染色法中肥大细胞呈蓝紫色或紫红色,光镜下观察,肥大细胞分布在心肌之间和靠近血管的位置。对照组中肥大细胞极少见,模型组肥大细胞计数明显增多,形态不规则,主要分布在血管周围;干预组肥大细胞计数较对照组多,但较模型组少(图 6)。各时间点干预组肥大细胞计数均高于对照组,但低于模型组(P < 0.05);甲苯胺蓝染色法和硫瑾染色法肥大细胞计数差异无统计学意义(P>0.05)(表 2)。
6.
各组肥大细胞染色结果(×200)
对照组心肌组织中极少见蓝紫色肥大细胞;模型组及干预组血管周围可见肥大细胞聚集,呈不规则状。干预组的肥大细胞计数少于模型组。图中箭头所示为肥大细胞。
2.
各时间点各组肥大细胞计数比较 (x±s,个/高倍镜视野,n=8)
|
2.4. RT-PCR检测CTGF及Col Ⅰ mRNA表达
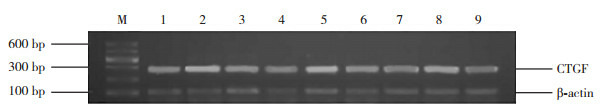
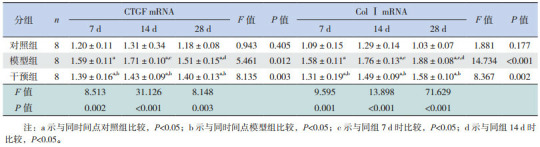
对照组、模型组和干预组均有CTGF mRNA表达(图 7)。各时间点对照组相比差异无统计学意义(P>0.05);模型组7 d时CTGF mRNA表达高于对照组,14 d达高峰,28 d时较高峰期下降;各时间点干预组CTGF mRNA表达均高于对照组,低于模型组(P < 0.05)。见表 3。
7.
RT-PCR检测各时间点各组心肌组织CTGF mRNA表达
M为Marker;1、4、7分别为对照组7、14、28 d条带;2、5、8分别为模型组7、14、28 d条带;3、6、9分别为干预组7、14、28 d条带。
3.
各时间点各组心肌组织CTGF mRNA及Col Ⅰ mRNA的相对表达量比较 (x±s)
|
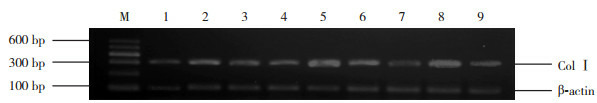
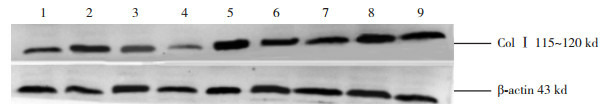
对照组、模型组和干预组小鼠心肌组织中均有Col Ⅰ mRNA表达(图 8)。各时间点对照组Col Ⅰ mRNA的表达差异无统计学意义(P>0.05);模型组7 d时Col Ⅰ mRNA表达开始增多,14 d时较7 d时增多,28 d达高峰;各时间点干预组Col Ⅰ mRNA的表达低于模型组,高于对照组(P < 0.05)。见表 3。
8.
RT-PCR检测各时间点各组心肌组织Col Ⅰ mRNA表达
M为Marker;1、4、7分别为对照组7、14、28 d条带;2、5、8分别为模型组7、14、28 d条带;3、6、9分别为干预组7、14、28 d条带。
2.5. Western blot检测CTGF及Col Ⅰ蛋白表达
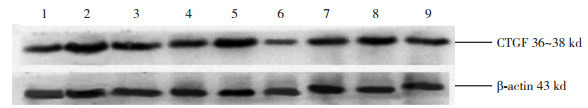
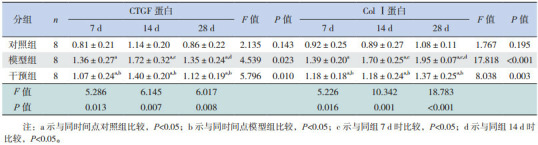
Western blot检测心肌组织CTGF蛋白的表达(图 9)。统计学结果提示CTGF蛋白与CTGFmRNA表达趋势一致(表 4)。
9.
Western blot检测各时间点各组心肌组织CTGF蛋白的表达
1、4、7分别为对照组7、14、28 d条带;2、5、8分别为模型组7、14、28 d条带;3、6、9分别为干预组7、14、28 d条带。
4.
Western blot检测各时间点各组心肌组织CTGF蛋白及Col Ⅰ蛋白的相对表达量比较 (x±s)
|
Western blot检测心肌细胞Col Ⅰ蛋白的表达(图 10)。统计学结果提示Col Ⅰ蛋白与Col Ⅰ mRNA表达趋势一致(表 4)。
10.
Western blot检测各时间点各组心肌组织Col Ⅰ蛋白的表达
1、4、7分别为对照组7、14、28 d条带;2、5、8分别为模型组7、14、28 d条带;3、6、9分别为干预组7、14、28 d条带。
2.6. 肥大细胞计数与CTGF mRNA相关性分析
模型组7 d、14 d时心肌组织中CTGF mRNA表达与肥大细胞计数(甲苯胺蓝染色)呈正相关(r=0.439,P=0.049)(图 11)。模型组28 d时心肌组织中CTGF mRNA表达与肥大细胞计数(甲苯胺蓝染色)无相关(r=-0.171,P=0.686)。
11.
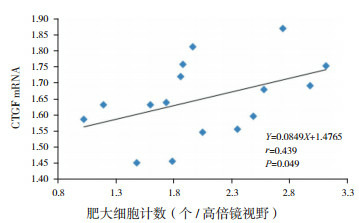
模型组7 d、14 d CTGF mRNA与肥大细胞计数(甲苯胺蓝染色)的相关图
2.7. 心肌组织CTGF mRNA与Col Ⅰ mRNA相
关性分析模型组7 d、14 d时心肌组织CTGF mRNA与Col Ⅰ mRNA呈正相关(r=0.646,P=0.007)(图 12);模型组28 d时心肌组织CTGF mRNA与Col Ⅰ mRNA亦呈正相关(r=0.326,P=0.031)(图 13)。
12.
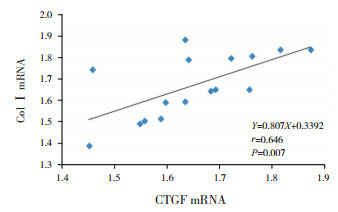
模型组7 d、14 d CTGF mRNA与Col ⅠmRNA相关图
13.
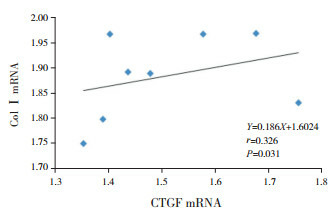
模型组28 d CTGF mRNA与Col Ⅰ mRNA相关图
3. 讨论
肥大细胞是机体重要的免疫细胞,在天然免疫中可以吞噬和清除病原体、释放大量介质及募集炎性细胞以启动早期的炎症反应。本实验中,BALB/C小鼠在感染CVB3后7 d可观察到肥大细胞计数增高,14 d时肥大细胞计数较前有所减少,28 d时肥大细胞计数仍高于对照组,与本课题组前期研究结果一致[1, 3]。提示肥大细胞在心肌感染CVB3早期即参与炎症反应。在动物模型研究中发现,肥大细胞可以被病原体直接激活或通过Toll样受体、Fc受体或者补体受体等间接介导的机制激活,参与纤维化过程[4]。肥大细胞缺陷型小鼠模型的组织病理学严重程度比非缺陷型轻,通过移植肥大细胞至缺陷型小鼠,可使其病理学改变更严重,佐证了肥大细胞参与的炎性细胞浸润及组织坏死[5]。
肥大细胞通过脱颗粒释放的多种生物活性介质刺激心脏成纤维细胞增殖和胶原合成[6]。CTGF是肥大细胞脱颗粒释放的细胞因子之一[7]。肥大细胞促纤维化作用可能通过增加CTGF的合成促进纤维母细胞增殖[8]等多种机制介导其与心肌细胞外基质间相互作用,最终造成心肌纤维化。本实验中,模型组小鼠肥大细胞计数与7 d、14 d时CTGF的表达呈正相关,与28 d时CTGF的表达无相关性,提示在病毒性心肌炎急性期和亚急性期肥大细胞可能通过增加CTGF表达参与纤维的发展过程。进入慢性期,肥大细胞数目减少,CTGF表达仍高,提示肥大细胞是作为调节CTGF的一个因素,心肌纤维化的病理过程中机体内亦存在其他的机制参与CTGF的表达。
本研究中,BALB/C小鼠在感染CVB3后,CTGF于7 d表达开始增加,于14 d达高峰,28 d表达量较14 d时下降但仍高于对照组,提示其参与机体早期的炎症反应,与李恒等[9]的研究结果相符。研究证实,CTGF与心肌纤维化严重程度相关[10]。Col Ⅰ的表达量亦从7 d时开始增高,于28 d时达高峰,且与CTGF的表达呈正相关,提示CTGF是心肌纤维化的重要细胞因子之一。体外研究发现组织损伤后,CTGF具有单核细胞趋化效应[11],通过核因子-κB提高细胞间黏附分子-1、单核细胞趋化蛋白-1诱导炎性细胞浸润[12],可诱导心肌成纤维细胞向肌成纤维细胞的分化,并促进Ⅰ型胶原和Ⅲ型胶原的表达,造成细胞外基质胶原累积[13]。动物模型研究发现[14]由微小RNA诱导CTGF基因沉默,心脏成纤维细胞表达趋化因子、基质金属蛋白酶、细胞间接触蛋白等表达减少,提示CTGF通过影响心肌成纤维细胞参与心肌纤维化过程。本研究发现在心肌组织纤维化高峰期时Col Ⅰ的表达达高峰,CTGF的表达较高峰期下降,这可能是因为纤维化是一个动态的过程,在炎症急性期CTGF表达增高,促进成纤维细胞的转化及Col Ⅰ的表达开启早期纤维化过程,已分化成的肌成纤维细胞通过旁分泌、自分泌等调节细胞外基质胶原蛋白的表达;进入慢性期,CTGF仍促进成纤维细胞增殖及分化,先后累积的肌成纤维细胞使Col Ⅰ进一步表达,细胞外胶原累积,造成慢性期心肌纤维化、心肌重构;另外,慢性期心肌组织的自我调节也可能减少CTGF的表达。
本研究结果显示曲尼司特使VMC小鼠心肌病理积分、胶原容积分数、肥大细胞计数、CTGF和Col Ⅰ的表达降低,提示在心肌纤维化过程中曲尼司特发挥有益效应,具有抗纤维化作用。既往研究发现肥大细胞稳膜定剂色甘酸钠可以减少CTGF的表达[15],张庆勇等[16]报道曲尼司特可以减轻肥大细胞聚集和脱颗粒,降低CVF,提示曲尼司特可能通过抑制肥大细胞聚集、脱颗粒降低CTGF的表达以发挥其抗纤维化效应。本课题组前期研究发现TGF-β1参与心肌纤维化的发生发展[1]。既往研究发现在体内外TGF-β1和CTGF单独存在时均不能导致持续性纤维化,当二者同时存在时才能引起严重的纤维化改变。TGF-β1可通过磷脂酰肌醇-3-激酶/蛋白激酶(PI3K/Akt)依赖的Smad 2途径刺激CTGF mRNA的表达,曲尼司特可通过抑制磷酸化的Smad 2的表达,从而减少CTGF的产生[17]。活化的成纤维细胞可大量表达CTGF[18],曲尼司特能抑制非TGF-β1依赖的炎性因子诱导的成纤维细胞向肌成纤维细胞增殖和分化[19],减少成纤维细胞生成TGF-β1,抑制TGF-β1诱导的CTGF的产生,进而减少肌成纤维细胞胶原蛋白的分泌。
近年来曲尼司特用于抗器官纤维化的研究,本实验结果提示曲尼司特能抑制肥大细胞的聚集及降低CTGF的表达以减轻Col Ⅰ的沉积,具有减轻小鼠心肌纤维化的效应。
Biography
文纯, 女, 硕士, 医师
Funding Statement
湖南省自然科学基金(13JJ3034)
References
- 1.黄 林枫, 文 纯, 谢 圭, et al. 曲尼司特对病毒性心肌炎小鼠心肌纤维化的作用. http://www.zgddek.com/CN/abstract/abstract13513.shtml. 中国当代儿科杂志. 2014;16(11):1154–1161. doi: 10.7499/j.issn.1008-8830.2014.11.017. [DOI] [PubMed] [Google Scholar]
- 2.蔡 姿丽, 杨 敏, 黄 林枫, et al. 病毒性心肌炎小鼠心肌骨桥蛋白和I型胶原表达的动态变化. 中南大学学报(医学版) 2012;37(3):271–277. doi: 10.3969/j.issn.1672-7347.2012.03.011. [DOI] [PubMed] [Google Scholar]
- 3.李 辉, 黄 林枫, 文 纯, et al. 心脏肥大细胞及Toll样受体4在小鼠病毒性心肌炎中的作用. http://www.zgddek.com/CN/abstract/abstract13192.shtml. 中国当代儿科杂志. 2013;15(10):896–902. doi: 10.7499/j.issn.1008-8830.2013.10.019. [DOI] [PubMed] [Google Scholar]
- 4.Moon TC, Befus AD, Kulka M. Mast cell mediators: their differential release and the secretory pathways involved. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4231949/ Front Immunol. 2014;5:569. doi: 10.3389/fimmu.2014.00569. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Higuchi H, Hara M, Yamamoto K, et al. Mast cells play a critical role in the pathogenesis of viral myocarditis. Circulation. 2008;118(4):363–372. doi: 10.1161/CIRCULATIONAHA.107.741595. [DOI] [PubMed] [Google Scholar]
- 6.Hügle T. Beyond allergy: the role of mast cells in fibrosis. http://www.ncbi.nlm.nih.gov/pubmed/25184789. Swiss Med Wkly. 2014;144:w13999. doi: 10.4414/smw.2014.13999. [DOI] [PubMed] [Google Scholar]
- 7.韩 晓静, 陈 晓玲, 康 林, et al. 大鼠肺纤维化形成中肺内肥大细胞结缔组织生长因子的表达. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgyyslxzz201103021. 中国应用生理学杂志. 2011;27(3):325–328. [PubMed] [Google Scholar]
- 8.Kunzmann S, Schmidt-Weber C, Zingg JM, et al. Connective tissue growth factor expression is regulated by histamine in lung fibroblasts: potential role of histamine in airway remodeling. J Allergy Clin Immunol. 2007;119(6):1398–1407. doi: 10.1016/j.jaci.2007.02.018. [DOI] [PubMed] [Google Scholar]
- 9.李 恒, 高 霞. 转化生长因子-β1及结缔组织生长因子在病毒性心肌炎中的表达. 蚌埠医学院学报. 2012;37(9):1020–1023. doi: 10.3969/j.issn.1000-2200.2012.09.004. [DOI] [Google Scholar]
- 10.孙 景辉, 张 圳, 翟 淑波, et al. 结缔组织生长因子在病毒性心肌炎心肌组织中的变化. 中华儿科杂志. 2011;49(10):782–787. doi: 10.3760/cma.j.issn.0578-1310.2011.10.016. [DOI] [PubMed] [Google Scholar]
- 11.Cicha I, Yilmaz A, Klein M, et al. Connective tissue growth factor is overexpressed in complicated atherosclerotic plaques and induces mononuclear cell chemotaxis in vitro. Arterioscler Thromb Vasc Biol. 2005;25(5):1008–1013. doi: 10.1161/01.ATV.0000162173.27682.7b. [DOI] [PubMed] [Google Scholar]
- 12.Mason RM. Fell-Muir lecture: Connective tissue growth factor (CCN2) --a pernicious and pleiotropic player in the development of kidney fibrosis. Int J Exp Pathol. 2013;94(1):1–16. doi: 10.1111/j.1365-2613.2012.00845.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Daniels JT, Schultz GS, Blalock TD, et al. Mediation of transforming growth factor-beta(1)-stimulated matrix contraction by fibroblasts: a role for connective tissue growth factor in contractile scarring. Am J Pathol. 2003;163(5):2043–2052. doi: 10.1016/S0002-9440(10)63562-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Tank J, Lindner D, Wang X, et al. Single-target RNA interference for the blockade of multiple interacting proinflammatory and profibrotic pathways in cardiac fibroblasts. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=7f3321ffe1f8030ea47aab56f2cdb216. J Mol Cell Cardiol. 2014;66:141–156. doi: 10.1016/j.yjmcc.2013.11.004. [DOI] [PubMed] [Google Scholar]
- 15.Sharma A, Abraham T, Sampaio A, et al. Sodium cromolyn reduces expression of CTGF, ADAMTS1, and TIMP3 and modulates post-injury patellar tendon morphology. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=ae6ba00b0a3ad3b8535e9a929dbbe7e7. J Orthop Res. 2011;29(5):678–683. doi: 10.1002/jor.21291. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.张 庆勇, 王 志华, 李 晓波, et al. 肥大细胞聚集和脱颗粒促进冠状动脉微血管栓塞后心肌内胶原纤维的沉积. 浙江大学学报(医学版) 2010;39(2):187–192. doi: 10.3785/j.issn.1008-9292.2010.02.013. [DOI] [Google Scholar]
- 17.白 寿军, 张 亚敏, 李 彩霞, et al. 曲尼司特对TGF-β1刺激的人肾小管上皮细胞表达结缔组织生长因子的影响. 华中科技大学学报(医学版) 2009;38(4):477–480. doi: 10.3870/j.issn.1672-0741.2009.04.015. [DOI] [Google Scholar]
- 18.刘 波, 黄 晓帆, 李 冬寒, et al. Forskolin激活cAMP信号通路调控小鼠心肌成纤维细胞结缔组织生长因子的表达. 华中科技大学学报(医学版) 2015;44(1):1–9. doi: 10.3870/j.issn.1672-0741.2015.01.001. [DOI] [Google Scholar]
- 19.刘 虎子, 刘 爱军. 曲尼司特对转化生长因子-β1诱导的心脏成纤维细胞表型转化的影响. 中国药物与临床. 2012;12(8):1018–1020. doi: 10.3969/j.issn.1671-2560.2012.08.014. [DOI] [Google Scholar]


