Abstract
目的
探究机械激活性离子通道压电蛋白Piezo1通过Notch信号通路介导人牙周膜干细胞(hPDLSC)成骨分化作用机制。
方法
选取自2016年1月1日—2018年1月1日就诊于北京儿童医院正畸科的8~14岁儿童因阻生而拔出的年轻恒牙的牙周膜组织为细胞来源,采用酶消化法对hPDLSC进行提取。采用免疫组织化学染色法检测角蛋白、波形蛋白的表达和流式细胞术对hPDLSC的标志物CD146和STRO-1进行鉴定。构建和筛选siRNA-Piezo1基因干扰载体和Piezo1基因过表达质粒。应用Flexcell 4000T机械牵张应力仪器构建体外牵张力学hPDLSC细胞模型。实验分成5组:siRNA干扰组、过表达组、空白对照组、牵张应力组和阴性对照组。荧光定量聚合酶链反应(RT-qPCR)检测Piezo1、Notch1和成骨基因碱性磷酸酶(ALP)、Runt相关基因2(Runx2)、骨钙素(OCN)和骨涎蛋白(BSP)的表达。Western blot检测成骨标志蛋白ALP和Runx2的表达。Fluo-3 AM探针检测细胞内钙离子含量。
结果
hPDLSC波形蛋白染色阳性,角蛋白染色阴性。流式细胞仪检测hPDLSC标志物STRO-1表达阳性,CD146表达阳性。空病毒载体、siRNA-Piezo1干扰序列和Piezo1过表达载体序列均可以通过慢病毒转染hPDLSC,而且转染效率较高,均在90%。逆转录聚合酶链反应结果显示,siRNA干扰组、过表达组、空白对照组、牵张应力组和阴性对照组Piezo1 mRNA的表达水平差异有统计学意义(F=9.573,P<0.05);过表达组Piezo1 mRNA的表达水平明显高于siRNA干扰组,差异有统计学意义(q=3.893,P<0.05);牵张应力组Piezo1 mRNA的表达水平明显高于空白对照组,差异有统计学意义(q=2.006,P<0.05)。Notch1和成骨基因ALP、Runx2、OCN和BSP的mRNA表达具有同样的趋势。Western blot检测结果显示siRNA干扰组、过表达组、空白对照组、牵张应力组和阴性对照组成骨标志蛋白ALP蛋白表达差异有统计学意义(F=11.207,P<0.001);过表达组ALP蛋白的表达水平明显高于siRNA干扰组,差异有统计学意义(q=2.991,P<0.05);牵张应力组ALP蛋白的表达水平明显高于空白对照组,差异有统计学意义(q=3.007,P<0.05)。Runx2蛋白表达具有同样趋势。细胞内钙离子检测结果显示,过表达组和牵张应力组细胞内钙离子荧光强度明显高于siRNA干扰组。
结论
机械牵张应力可以促进Piezo1蛋白的表达,以Ca2+为第二信使,激活Notch1信号通路,激活ALP、Runx2、OCN和BSP的表达,促进hPDLSC成骨分化。而siRNA-Piezo1干扰质粒可以阻断这一进程,反之,Piezo1的过表达质粒可以促进hPDLSC成骨分化进程。
Keywords: 人牙周膜干细胞, 机械激活离子通道, Piezo1, 分化, 信号通路
Abstract
Objective
To explore the mechanism of Piezo1 protein in mediating the osteogenic differentiation of human periodontal ligament stem cells (hPDLSCs) via the Notch signaling pathway.
Methods
In this study, young permanent teeth extracted from impacted teeth of 8-14-year-old children from January 1, 2016 to January 1, 2018 in the Department of Orthodontic, Beijing Children's Hospital were selected as cell sources. hPDLSCs were extracted by enzymatic digestion. Immunohistochemical staining was used to detect the expression of keratin and vimentin, and flow cytometry was used to identify the markers (CD146 and STRO-1) of hPDLSCs. The construction and screening of Piezo1 siRNA gene interference vector and Piezo1 gene overexpression plasmid were completed. Flexcell 4000T mechanical distraction stress instrument was used to construct hPDLSC cell model in vitro. According to the preliminary results, the experiment was divided into five groups: siRNA interference group, overexpression group, blank control group, stretch stress group, and negative control group. Real time quantitative polymerase chain reaction (RT-qPCR) was used to detect the expression of Piezo1, Notch1, alkaline phosphatase (ALP), Runt-related transcription factor 2 (Runx2), osteocalcin (OCN), and bone sialoprotein (BSP). Western blot was used to detect the expression of ALP and Runx2. Fluo-3 AM probe was used to detect intracellular calcium content.
Results
Vimentin staining of hPDLSCs was positive, and keratin staining was negative. Flow cytometry was used to detect the expression of STRO-1 and CD146, markers of hPDLSC. Empty viral vectors, siRNA-Piezo1 interference sequence, and Piezo1 overexpression vector sequence could be transfected into hPDLSC by lentivirus, and the transfection efficiency was high (approximately 90%). The reverse transcription-polymerase chain reaction (RT-PCR) results showed that there were significant differences in Piezo1 gene levels among the siRNA interference group, overexpression group, blank control group, stretch stress group, and negative control group (F=9.573, P<0.05). The level of Piezo1 in the overexpression group was significantly higher than that in the siRNA interference group (q=3.893, P<0.05). The level of Piezo1 in the stretch stress group was significantly higher than that in the blank control group (q=2.006, P<0.05). The expression of Notch1 and osteogenic genes ALP, Runx2, OCN, and BSP had the same trend. Western blot results showed that there were significant differences in the expression of ALP in the siRNA interference group, overexpression group, blank control group, stretch stress group, and negative control group (F=11.207, P<0.001). The expression level of ALP in the overexpression group was significantly higher than that in the siRNA interference group (q=2.991, P<0.05). The expression of ALP in the stretch stress group was significantly higher than that in the blank control group (q=3.007, P<0.05). The expression of Runx2 protein showed the same trend. The intracellular calcium fluorescence intensity of the overexpression group was significantly higher than that of the siRNA interference group, and the intracellular calcium fluorescence intensity of the stretch stress group was significantly higher than that of the siRNA interference group.
Conclusion
Mechanical stretch stress can promote the expression of Piezo1 protein. Ca2+ is the second messenger, activates the Notch1 signaling pathway and the expression of ALP, Runx2, OCN, and BSP; and promotes the osteogenic differentiation of hPDLSC. The siRNA-Piezo1 interfering plasmid can block this process. On the contrary, the overexpression plasmid of Piezo1 can promote the osteogenic differentiation of PDLSCs.
Keywords: human periodontal ligament stem cells, mechanically activated ion channels, Piezo1, differentiation, signaling pathways
牙齿发育不良是指患儿的上下牙齿对位不良,影响日常生活,通常采用正畸治疗[1]–[2],主要通过牙齿矫形器,给予适当的、持续的力量,使牙位移动,从而达到矫正效果[3]–[4]。既往研究[5]–[6]主要集中于分析牙周膜的作用,即牙周膜组织在持续应力刺激下可以不断的形成新的骨性结构,促进牙槽骨的改建,从而达到矫形的目的,但是具体的机制尚未明了。
近年来,随着人牙周膜干细胞(human periodontal ligament stem cells,hPDLSC)的分离成功,研究的热点主要集中于牙周膜干细胞的成骨分化方面[7]–[8]。本研究以hPDLSC为研究对象,构建体外机械牵张应力细胞模型,以新型机械激活性离子通道压电蛋白Piezo1为切入点,构建Piezo1蛋白的过表达载体和siRNA干扰载体,从过表达Piezo1蛋白和抑制Piezo1蛋白两个方向上探究Piezo1蛋白在hPDLSC向成骨细胞分化的作用机制。以成骨基因碱性磷酸酶(alkaline phosphatase,ALP)、Runt相关基因2(Runt-related transcription factor 2,Runx2)、骨钙素(osteocalcin,OCN)和骨涎蛋白(bone sialoprotein,BSP)为成骨的标志物[9]–[12],探究Piezo1在促进hPDLSC成骨分化方面的作用。
1. 材料和方法
1.1. hPDLSC的分离、培养
选取2016年1月1日—2018年1月1日就诊于北京儿童医院正畸科的8~14岁儿童因阻生而拔出的年轻恒牙的牙周膜组织为细胞来源,研究方案通过北京儿童医院伦理委员会同意并通过,取得儿童直系监护人的知情同意授权书。纳入标准:所有儿童均无活动性牙齿感染,细胞均来源于因阻生而拔出的恒牙牙周膜组织。排除标准:有明显牙周炎或感染症状的患儿。
收集牙周膜组织后采用酶消化法提取hPDLSC。采用眼科剪和无菌刀片刮取牙周膜组织,用预热的PBS溶液冲洗3次,加入Ⅰ型胶原蛋白酶消化处理50 min,置于37 °C恒温箱中,每5 min摇晃一次,使牙周膜组织与胶原蛋白酶充分混合,常温离心机3 000 r·min−1离心5 min,弃掉上清液,加入含15%胎牛血清的DMEM培养基,制成细胞悬液,然后接种于25 cm×25 cm的Flask's培养瓶中,放入37 °C,15%CO2浓度细胞培养箱中进行原代干细胞培养。
1.2. hPDLSC的鉴定
本研究采用免疫组织化学染色法检测角蛋白(pan-cytokeratin)、波形蛋白(vimentin)的表达。选取第3代hPDLSC作为实验细胞,以2×104细胞量接种于预先铺有无菌圆形玻璃板的24孔板中,加入含15%胎牛血清的DMEM培养基,37 °C,15%CO2浓度细胞培养箱中孵育48 h,待细胞融合率达80%时,弃掉培养基,加入预热的PBS溶液冲洗3次,加入4%多聚甲醛孵育20 min,PBS溶液冲洗3次,加入0.4%Triton X-100孵育5 min,PBS溶液冲洗3次,5%BSA封闭20 min,加入一抗(pan-cytokeratin,vimentin兔抗人一抗),4 °C低温水箱孵育过夜,PBS溶液冲洗3次,加入二抗(山羊抗兔CY3二抗)孵育10 min,使用DAB工作液进行染色。
采用流式细胞术对hPDLSC的标志物CD146和STRO-1进行鉴定,收集第3代hPDLSC细胞,加入无血清的DMEM培养基,制备细胞悬液,细胞密度控制在每毫升3×107个;加入5支EP管,每管100 µL,加入一抗体系:STRO-1兔抗人一抗,CD146兔抗人一抗,STRO-1和CD146的同型对照单抗以及PBS空白对照,加入到5支EP管中,4 °C低温避光孵育20 min,PBS漂洗,采用流式细胞仪检测表面蛋白CD146和STRO-1。
1.3. siRNA-Piezo1干扰载体的构建
siRNA-Piezo1干扰载体的构建和筛选由上海吉凯公司完成。首先通过Pubmed Genebank查询人源Piezo1蛋白的基因序列以及ORF序列和3′-UTR序列。根据siRNA靶点设计原理,构建siRNA-Piezo1的干扰序列。设计3种干扰序列,具体如下。siRNA-Piezo1-homo-3299:GCGTCATCATCGTGTGTAAGA;siRNA-Piezo1-homo-5762:GCCTCAAGTACTTCATCATCAACT;siRNA-Piezo1-homo-1875:GCGTCTTCCTTAGCCATTACT。选取上海吉凯公司提供的hU6-MCS-CMV-EGFP慢病毒载体作为酶切对象,加入siRNA-Piezo1干扰序列后,转染人胚肾293T细胞,进行克隆测定,然后进行质粒的抽提、慢病毒的包装以备用。
1.4. Piezo1过表达载体的构建
Piezo1基因过表达载体的构建和筛选由上海吉凯公司完成。首先对目的基因进行过表达引物设计,Piezo1(4589-11)序列为:ACGGGACTAAGCGCATTGCAATTTCC。然后逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)扩增目的基因序列,将目的基因扩增序列加入线性化表达载体,选取上海吉凯公司提供的hU6-MCS-CMV-EGFP慢病毒载体作为酶切对象,加入Piezo1基因过表达载体序列后,转染人胚肾293T细胞,进行克隆测定,然后进行质粒的抽提,慢病毒的包装以备用。
1.5. 应用Flexcell 4000T机械牵张应力仪器构建体外牵张力学hPDLSC细胞模型和细胞分组
将hPDLSC接种于Flexcell公司的BIO膜性六孔板中,加入含15%胎牛血清的DMEM培养基,待细胞融合率达50%时,加入无血清的DMEM培养基进行“同位化”处理,孵育过夜后,加入含15%胎牛血清的DMEM培养基,将膜性六孔板加载Flexcell 4000T机械牵张应力仪器,根据预实验结果,即牵张应力作用时间为12 h对细胞的牵张应力作用最明显,所以选取12 h牵张应力进行后续试验。同时设置六孔板形变量为15%,每分钟6个循环。
本实验分成5组:空白对照组:不加载机械牵张应力;牵张应力组:加载12 h机械牵张应力;阴性对照组:加载12 h机械牵张应力,并且转染空白无序序列的慢病毒转染hPDLSC(不含有功能质粒的慢病毒);siRNA干扰组:加载12 h机械牵张应力,并且转染siRNA-Piezo1干扰序列的慢病毒转染hPDLSC;过表达组:加载12 h机械牵张应力,并且转染Piezo1过表达序列的慢病毒转染hPDLSC。
1.6. 荧光定量聚合酶链反应(real time quantitative polymerase chain reaction,RT-qPCR)检测Piezo1、Notch1和成骨基因的表达
利用胰蛋白酶收集上述各组细胞,经PBS溶液清洗3次,常温离心机1 500 r·min−1离心5 min,取沉淀,加入1 mL Trizol溶剂,提取细胞总RNA,保证RNA纯度范围为1.8~2.1,然后利用TAKARA逆转录试剂盒的要求,采用20 µL反应体系逆转录为cDNA,−80 °C保存,采用TAKARA荧光定量PCR试剂盒(SYBR Premix Ex TaqⅡ试剂盒)的要求,采用FTC-2000 RT-qPCR系统和50 µg反应体系对样本DNA进行分析,溶解曲线确定Tm值为53.7 °C,统计并记录各组样本的CT值,采用2−△△CT法对Piezo1基因和成骨基因OCN和BSP的表达进行统计。Piezo1、OCN、BSP和内参基因磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)引物设计由上海生工公司设计并检测合格(表1)。
表 1. 引物序列.
Tab 1 Primer sequences
| 引物名称 | 引物序列(5′-3′) |
| Piezo1 | 正义链:5′-CATCTTGGTGGTCTCCTCTCTCT-3′ |
| 反义链:5′-CTGGCATCCACATCCCTCTCATC-3′ | |
| ALP | 正义链:5′-GGGCACCGTTCAGCTTCC-3′ |
| 反义链:5′-CCACAACTTATTTCTTTCC-3′ | |
| Runx2 | 正义链:5′-GCACAAACATGGCCAGATTCA-3′ |
| 反义链:5′-AAGCCATGGTGCCCGTTAG-3′ | |
| OCN | 正义链:5′-TAGTGAAGAGACCCAGGCGCT-3′ |
| 反义链:5′-ATAGGCCTCCTGAAAGCCGA-3′ | |
| BSP | 正义链:5′-ACGATTTCCAGTTCAGGGCA-3′ |
| 反义链:5′-TCCTCTCCATAGCCCAGTGT-3′ | |
| Notch1 | 正义链:5′-GCGATTTCAAGGCTGACTTG-3′ |
| 反义链:5′-CCTTTGAAGAAGACAGCCGA-3′ | |
| GADPH | 正义链:5′-CCACCGTCAACGCTGAGAAC-3′ |
| 反义链:5′-TGGTGAAGACGCCAGTGGA-3′ |
1.7. Fluo-3 AM探针检测细胞内钙离子含量
利用胰蛋白酶收集上述各组细胞,经PBS溶液清洗3次,接种于预先铺有细胞圆形玻璃爬片的24孔板,加入不含钙离子的培养基,孵育24 h,采用Hank's平衡盐溶液清洗3次,加入预先1︰5稀释的Fluo-3 AM工作液,避光孵育30 min,树胶封片,倒置荧光显微镜观察细胞内钙离子含量。
1.8. Western blot检测成骨标志蛋白ALP和Runx2的表达
预冷处理各组细胞,经PBS溶液清洗3次,加入1 mL RIPA细胞裂解液,冰上裂解30 min,收集入1.5 mL离心管中,4 °C、5 000 r·min−1离心5 min(离心半径为3 cm)后取上清,95 °C煮沸后,收集蛋白备用。制备浓缩胶10 mL,分离胶20 mL。上样后(每孔上样量为20 µL)电泳分离,转膜后用BSA封闭,封闭的时间为30 min,封闭后PBST溶液洗膜,重复3次,加入一抗(兔抗人)(ALP、Runx2、OCN和BSP)1︰10 000稀释后加入样本离子膜(孵育的温度为4 °C,时间为>12 h);第二天用PBST稀释液洗膜3次,加用山羊抗兔IgG二抗(1︰1 000)稀释后孵育1.5 h(孵育温度为37 °C),用PBST稀释液洗膜3次,用DAB显影液处理样本。应用Image J软件分析蛋白灰度,计算相对表达量。
1.9. 统计学分析
采用SPSS 19.0软件对数据进行统计学分析,定量资料采用均数±标准差表示,各组间Piezo1 mRNA的相对表达量、蛋白表达量、钙离子含量等比较采用方差分析,组间比较采用q检验,认为P<0.05具有统计学差异。
2. 结果
2.1. hPDLSC的鉴定结果
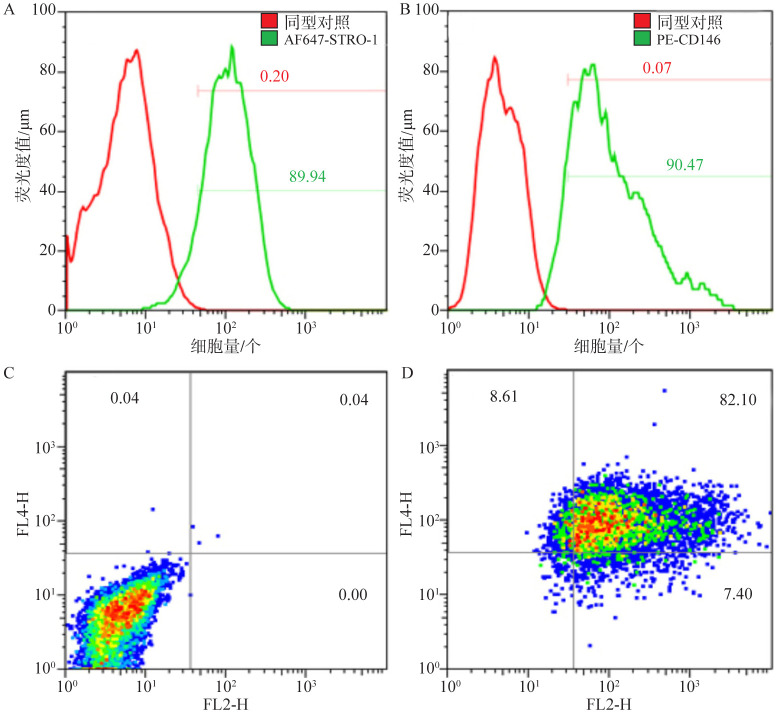
免疫组织化学染色结果显示,hPDLSC波形蛋白染色阳性,角蛋白染色阴性。流式细胞术检测hPDLSC标志物STRO-1表达阳性,CD146表达阳性(图1、2)。
图 1. hPDLSC的鉴定 免疫组织化学染色.
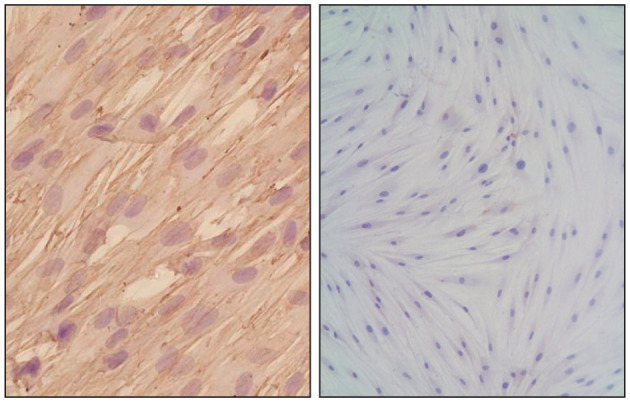
Fig 1 Identification of hPDLSC immunohistochemical staining
左:波形蛋白染色阳性 × 200;右:角蛋白染色阴性 × 100。
图 2. 流式细胞仪检测结果.
Fig 2 The results of the flow cytometry
A:STRO-1表达阳性;B:CD146表达阳性;C:STRO-1和CD146同型对照;D:STRO-1和CD146双标阳性。
2.2. RT-PCR筛选3种序列的Piezo1 mRNA表达结果
RT-PCR检测结果显示:阴性对照组中Piezo1 mRNA相对表达量为(1.25±0.02),siRNA-Piezo1-homo-3299序列,siRNA-Piezo1-homo-5762序列和siRNA-Piezo1-homo-1875序列中Piezo1 mRNA相对表达量分别为1.03±0.02、0.22±0.01、1.17±0.03,各组比较差异有统计学意义(F=12.009,P=0.000);并且siRNA-Piezo1-homo-5762与另外2组相比,Piezo1 mRNA相对表达量明显减少,差异有统计学意义(q=3.021,3.548,P<0.05)。
2.3. siRNA-Piezo1干扰序列和Piezo1过表达载体序列转染hPDLSC的结果
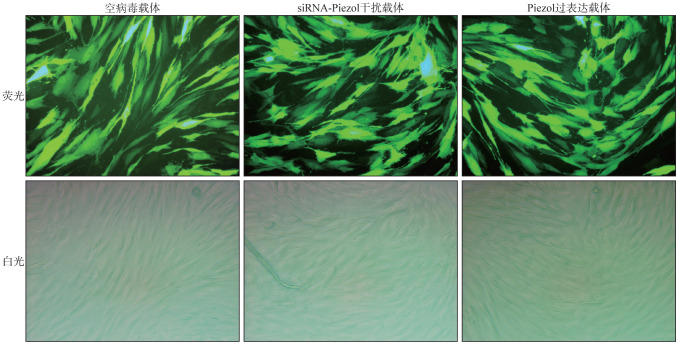
空病毒载体、siRNA-Piezo1干扰序列和Piezo1过表达载体序列均可以通过慢病毒转染hPDLSC,而且转染效率较高,均在90%(图3)。
图 3. siRNA-Piezo1干扰序列和Piezo1过表达载体序列转染hPDLSC 倒置荧光显微镜 × 400.
Fig 3 The siRNA-Piezo1 interference sequence and Piezo1 overexpression vector sequence were transfected into hPDLSC inverted fluorescence microscope × 400
2.4. RT-PCR检测Piezo1、Notch1和成骨基因的表达
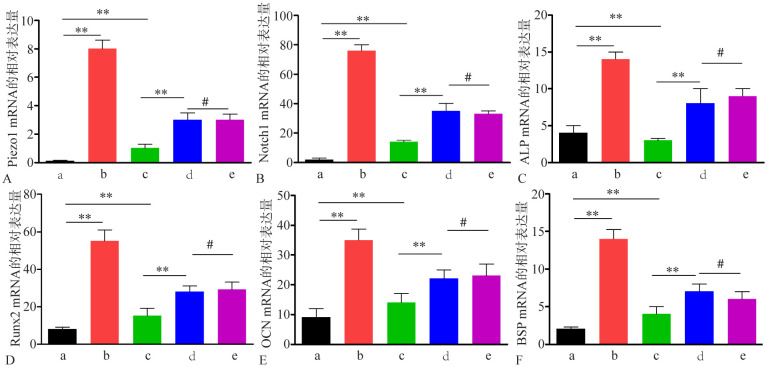
siRNA干扰组、过表达组、空白对照组、牵张应力组和阴性对照组Piezo1 mRNA的表达水平差异有统计学意义(F=9.573,P<0.05)。过表达组、空白对照组Piezo1 mRNA表达水平明显高于siRNA干扰组,差异有统计学意义(q=3.893,P<0.05;q=2.113,P<0.05)。牵张应力组Piezo1 mRNA表达水平明显高于空白对照组,差异有统计学意义(q=2.006,P<0.05),但是与阴性对照组比较,差异无统计学意义(q=0.208,P>0.05)(图4A)。siRNA干扰组、过表达组、空白对照组、牵张应力组和阴性对照组Notch1 mRNA的表达水平差异有统计学意义(F=11.003,P<0.05)。过表达组、空白对照组Notch1 mRNA水平明显高于siRNA干扰组,差异具有统计学意义(q=2.991,P<0.05;q=2.463,P<0.05)。牵张应力组Notch1 mRNA表达水平明显高于空白对照组,差异有统计学意义(q=2.331,P<0.05),但是与阴性对照组比较,差异无统计学意义(q=0.188,P>0.05)(图4B)。成骨基因ALP、Runx2、OCN和BSP的表达也有同样的趋势(图4C~F)。
图 4. RT-qPCR检测Piezo1、Notch1和成骨基因ALP、Runx2、OCN和BSP的表达结果.
Fig 4 The expression of piezo1, Notch1, ALP, Runx2, OCN and BSP were detected by RT-qPCR
A~F:分别为Piezo1、Notch1、ALP、Runx2、OCN、BSP mRNA的表达水平;a~e:分别为siRNA干扰组、过表达组、空白对照组、牵张应力组和阴性对照组。**为P<0.05;#为P>0.05。
2.5. Western blot检测成骨标志蛋白ALP和Runx2的表达
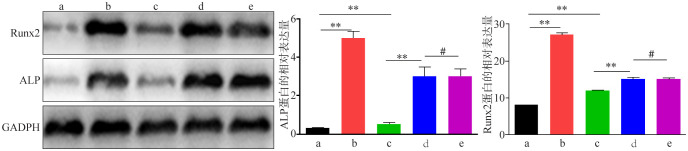
Western blot检测成骨标志蛋白ALP和Runx2的表达结果见图5。siRNA干扰组、过表达组、空白对照组、牵张应力组和阴性对照组ALP蛋白差异有统计学意义(F=11.207,P<0.001);过表达组和空白对照组ALP蛋白表达水平明显高于siRNA干扰组,差异有统计学意义(q=2.991,P<0.05;q=2.451,P<0.05);牵张应力组ALP蛋白表达水平明显高于空白对照组,差异有统计学意义(q=3.007,P<0.05)。但是牵张应力组ALP蛋白表达水平与阴性对照组比较,差异无统计学意义(q=0.451,P>0.05)。
图 5. Western blot检测ALP和Runx2的表达.
Fig 5 The expression of ALP and Runx2 was detected by Western blot
左:ALP和Runx2的蛋白条带;中:ALP的表达;右:Runx2的表达。a~e:分别为siRNA干扰组、过表达组、空白对照组、牵张应力组和阴性对照组。**为P<0.05;#为P>0.05。
siRNA干扰组、过表达组、空白对照组、牵张应力组和阴性对照组Runx2蛋白差异有统计学意义(F=18.473,P<0.001);过表达组和空白对照组Runx2蛋白表达水平明显高于siRNA干扰组,差异有统计学意义(q=3.499,P<0.05;q=3.568,P<0.05);牵张应力组Runx2蛋白表达水平明显高于空白对照组,差异有统计学意义(q=2.661,P<0.05)。但是牵张应力组Runx2蛋白表达水平与阴性对照组比较,差异无统计学意义(q=0.328,P>0.05)。
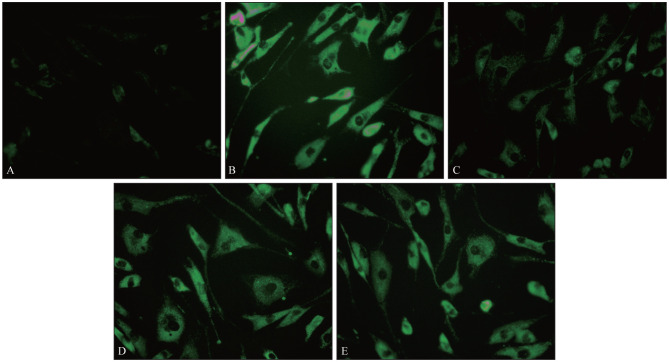
2.6. 细胞内钙离子检测结果
siRNA干扰组、过表达组、空白对照组、牵张应力组和阴性对照组细胞内钙离子检测结果见图6。由图6可见,过表达组、牵张应力组细胞内钙离子荧光强度明显高于siRNA干扰组。采用Image J软件统计细胞内钙离子荧光强度,结果显示siRNA干扰组、过表达组、空白对照组、牵张应力组和阴性对照组钙离子荧光强度分别为102.03 µm±15.02 µm、473.57 µm±34.37 µm、158.29 µm±10.55 µm、247.98 µm±11.45 µm、259.23 µm±10.24 µm,差异有统计学意义(F=10.009,P<0.05)。过表达组、空白对照组细胞内钙离子荧光强度明显高于siRNA干扰组,差异有统计学意义(q=2.571,P<0.05;q=2.336,P<0.05);牵张应力组细胞内钙离子荧光强度明显高于空白对照组,差异有统计学意义(q=3.124,P<0.05)。但是牵张应力组细胞内钙离子荧光强度与阴性对照组比较,差异无统计学意义(q=0.995,P>0.05)。
图 6. 细胞内钙离子检测结果.
Fig 6 The result of the intracellular calcium
A:siRNA干扰组;B:过表达组;C:空白对照组;D:牵张应力组;E:阴性对照组。
3. 讨论
既往有文献[13]报道,在正畸科矫正口齿发育不良的过程中,机械应力刺激可以促进牙周骨组织的重建。适度机械牵张应力刺激对牙齿的正畸存在积极意义,但是具体的作用机制尚未明了。Song等[14]通过构建体外机械牵张应力模型,以成纤维细胞为对象,探究机械牵张应力对于口齿矫形的作用,结果表明,机械牵张应力可以通过内质网应激系统刺激成纤维细胞的增殖与凋亡,从而影响正畸效果。所以,本研究利用Flexcell 4000T机械牵张应力仪器构建体外牵张应力刺激下的细胞模型,以机械敏感性离子通道Piezo1为研究的切入点,以Ca2+为第二信使,传递机械信号,通过Notch1信号通路,激活成骨基因ALP、Runx2、OCN和BSP的表达,进而促进hPDLSC的成骨分化作用。
Piezo1蛋白离子通道是近年来新发现的一种机械敏感性离子通道,有学者[15]–[16]报道,Piezo1蛋白离子通道与骨性关节炎的软骨细胞密切相关,而且可以被阳离子非特异性阻滞剂GsMT4所阻断。另外,通过冰冻电子显微镜解析Piezo1蛋白的三维立体结构,发现Piezo1蛋白是一种7跨膜的三棱锥状结构,Ca2+可通过Piezo1蛋白离子通道,从而发挥作用[17]。本研究中利用Fluo-3 AM探针检测细胞内钙离子含量,利用绿色荧光探针特异性结合细胞内的钙离子,结果显示,过表达组细胞内钙离子荧光强度明显高于siRNA干扰组,差异有统计学意义(P<0.05)。说明Piezo1蛋白离子通道表达量增多后,在机械应力刺激下,可以有更多的Ca2+涌入细胞内,发挥第二信使的作用。另外牵张应力组细胞内钙离子荧光强度明显高于空白对照组,差异有统计学意义(P<0.05),说明机械牵张应力刺激可以促进Piezo1蛋白的表达。另外本研究采用RT-PCR检测Piezo1 mRNA水平的表达,结果证明机械应力的确可以促进Piezo1蛋白的表达。
RNA干扰技术是分子生物学领域常用的一种阻断基因表达的方法[18]–[19]。本研究利用siRNA干扰技术,构建siRNA-Piezo1干扰质粒和Piezo1过表达质粒,并且通过慢病毒转染hPDLSC细胞,利用RT-PCR检测目的基因Piezo1的表达。结果证明,过表达组Piezo1 mRNA的表达水平明显高于siRNA干扰组(P<0.05),说明过表达组的Piezo1表达量要高于siRNA干扰组。另外,牵张应力组Piezo1 mRNA的表达水平明显高于空白对照组(P<0.05),说明牵张应力可以促进Piezo1的表达。成骨基因ALP是成骨细胞表型最重要的生物标志物,是成骨细胞矿化的标志之一[20]。Runx2是骨形成的标志蛋白,反应了骨细胞的生物活性[21]。故此本研究采用成骨基因ALP、Runx2、OCN和BSP的表达作为检测Piezo1在促进PDLSC成骨分化方面的作用。RT-PCR结果和Western blot结果表明,过表达组ALP、Runx2、OCN和BSP的mRNA和蛋白表达水平要明显高于siRNA干扰组(P<0.05)。结果说明,过表达组hPDLSC的成骨能力高于siRNA干扰组。牵张应力组ALP、Runx2、OCN和BSP的mRNA和蛋白表达水平明显高于空白对照组(P<0.05),结果说明牵张应力可以促进PDLSC成骨分化。
Notch1信号通路分子是与干细胞的分化密切相关的一类分子,邱申彩等[22]的研究表明,Notch1的过表达载体可以促进hPDLSC的分化和增殖。本研究RT-PCR结果表明,siRNA-Piezo1可以降低Notch1的表达,抑制成骨基因ALP、Runx2、OCN和BSP的表达,而Piezo1过表达质粒可以促进Notch1的表达,促进成骨基因ALP、Runx2、OCN和BSP的表达。与hPDLSC的成骨分化结果相结合,笔者认为,机械牵张应力可以促进hPDLSC成骨分化的作用是通过Notch1信号通路介导。
综上所述,机械牵张应力可以促进Piezo1蛋白的表达,以Ca2+为第二信使,激活Notch1信号通路,激活ALP、Runx2、OCN和BSP的表达,促进hPDLSC成骨分化。而siRNA-Piezo1干扰质粒可以阻断这一进程,反之,Piezo1的过表达质粒可以促进PDLSC成骨分化进程。
Funding Statement
[基金项目] 河北省高等学校科学技术研究项目(Z2019023)
Supported by: Scientific and Technological Research Projects of Colleges and Universities in Hebei Province (Z2019023).
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.吴 晓光. 口腔正畸治疗牙周病致前牙移位的效果分析[J] 中西医结合心血管病电子杂志. 2017;5(31):182–183. [Google Scholar]; Wu XG. Analysis of the effect of orthodontic treatment on anterior teeth displacement caused by periodontal disease[J] Cardiovasc Dis J Integr Tradit Chin West Med. 2017;5(31):182–183. [Google Scholar]
- 2.李 薇, 于 世德, 文 静, et al. 口腔正畸治疗中微型种植体支抗的稳定和安全性[J] 全科口腔医学电子杂志. 2017;4(16):16–17. [Google Scholar]; Li W, Yu SD, Wen J, et al. Stability and safety of micro implant anchorage in orthodontic treatment[J] Electron J Gen Stomatol. 2017;4(16):16–17. [Google Scholar]
- 3.张 维合. 牙齿矫正器底座金属粉末精密注塑模具设计[J] 中国塑料. 2017;31(6):118–122. [Google Scholar]; Zhang WH. Design of metal injection mould for bases of orthodontic appliances[J] Chin Plast. 2017;31(6):118–122. [Google Scholar]
- 4.申 岩岩. 口腔牙齿矫正中不同材料矫正器的应用效果差异分析[J] 当代医学. 2018;24(5):75–76. [Google Scholar]; Shen YY. Analysis of the application effect of different materials in orthodontic treatment[J] Contemp Med. 2018(5):75–76. [Google Scholar]
- 5.Zhao D, Wu Y, Xu C, et al. Cyclic-stretch induces apoptosis in human periodontal ligament cells by activation of caspase-5[J] Arch Oral Biol. 2017;73:129–135. doi: 10.1016/j.archoralbio.2016.10.009. [DOI] [PubMed] [Google Scholar]
- 6.张 华菁, 李 盛楠, 徐 晓南, et al. 力与炎症因子对牙周膜细胞破骨调控因子表达的影响[J] 中国医学科学院学报. 2017;39(5):602–610. doi: 10.3881/j.issn.1000-503X.2017.05.002. [DOI] [PubMed] [Google Scholar]; Zhang HJ, Li SN, Xu XN, et al. Effects of force and inflammatory factors on the expressions of osteogenesis regulators in human periodontal ligament cells[J] Acta Acad Med Sinicae. 2017;39(5):602–610. doi: 10.3881/j.issn.1000-503X.2017.05.002. [DOI] [PubMed] [Google Scholar]
- 7.Wada N, Tomokiyo A, Gronthos S, et al. Immunomodulatory properties of PDLSC and relevance to periodontal regeneration[J] Curr Oral Health Rep. 2015;2(4):245–251. [Google Scholar]
- 8.甄 蕾, 刘 宏伟. 人牙周膜干细胞体外诱导分化为神经元样细胞的实验研究[J] 华西口腔医学杂志. 2009;27(1):71–74. [PubMed] [Google Scholar]; Zhen L, Liu HW. Differentiation of human periodontal ligament stem cells into neuron-like cells in vitro[J] West China J Stomatol. 2009;27(1):71–74. [PubMed] [Google Scholar]
- 9.Cha Y, Jeon M, Lee HS, et al. Effects of in vitro osteogenic induction on in vivo tissue regeneration by dental pulp and periodontal ligament stem cells[J] J Endod. 2015;41(9):1462–1468. doi: 10.1016/j.joen.2015.04.010. [DOI] [PubMed] [Google Scholar]
- 10.Kim SY, An SY, Lee JS, et al. Zanthoxylum schinifolium enhances the osteogenic potential of periodontal ligament stem cells[J] In Vitro Cell Dev Biol Anim. 2015;51(2):165–173. doi: 10.1007/s11626-014-9824-4. [DOI] [PubMed] [Google Scholar]
- 11.Moshaverinia A, Chen C, Akiyama K, et al. Encapsulated dental-derived mesenchymal stem cells in an injectable and biodegradable scaffold for applications in bone tissue engineering[J] J Biomed Mater Res A. 2013;101(11):3285–3294. doi: 10.1002/jbm.a.34546. [DOI] [PubMed] [Google Scholar]
- 12.Zhang C, Lu Y, Zhang L, et al. Influence of different intensities of vibration on proliferation and differentiation of human periodontal ligament stem cells[J] Arch Med Sci. 2015;11(3):638–646. doi: 10.5114/aoms.2015.52370. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Taraslia V, Lymperi S, Pantazopoulou V, et al. A high-resolution proteomic landscaping of primary human dental stem cells: identification of SHED- and PDLSC-specific biomarkers[J] Int J Mol Sci. 2018;19(1):158–169. doi: 10.3390/ijms19010158. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Song J, Zhang Q, Wang S, et al. Cleavage of caspase-12 at Asp94, mediated by endoplasmic reticulum stress (ERS), contributes to stretch-induced apoptosis of myoblasts[J] J Cell Physiol. 2018;233(12):9473–9487. doi: 10.1002/jcp.26840. [DOI] [PubMed] [Google Scholar]
- 15.李 晓飞, 张 钊, 李 晓东, et al. 新型机械激活离子通道蛋白Piezo1通过MAPK/ERK1/2信号通路介导软骨细胞凋亡的机制[J] 中华医学杂志. 2016;96(31):2472–2477. [Google Scholar]; Li XF, Zhang Z, Li XD, et al. Mechanism of the Piezo1 protein-induced apoptosis of the chondrocytes through the MAPK/ERK1/2 signal pathway[J] Nat Med J China. 2016;96(31):2472–2477. doi: 10.3760/cma.j.issn.0376-2491.2016.31.007. [DOI] [PubMed] [Google Scholar]
- 16.李 晓飞, 张 钊, 王 天宝, et al. Piezo1蛋白经MAPK/ERK5信号通路介导软骨细胞凋亡的机制研究[J] 中华骨科杂志. 2016;36(12):795–803. [Google Scholar]; Li XF, Zhang Z, Wang TB, et al. Mechanism of Piezo1 protein induced apoptosis of osteoarthritis chondrocytes through MAPK/ERK5 signal pathway[J] Chin J Orthop. 2016;36(12):795–803. [Google Scholar]
- 17.Zhao Q, Zhou H, Chi S, et al. Structure and mechanogating mechanism of the Piezo1 channel[J] Nature. 2018;554(7693):487–492. doi: 10.1038/nature25743. [DOI] [PubMed] [Google Scholar]
- 18.Janssen HL, Reesink HW, Lawitz EJ, et al. Treatment of HCV infection by targeting microRNA[J] N Engl J Med. 2013;368(18):1685–1694. doi: 10.1056/NEJMoa1209026. [DOI] [PubMed] [Google Scholar]
- 19.Chi X, Gatti P, Papoian T. Safety of antisense oligonucleotide and siRNA-based therapeutics[J] Drug Discov Today. 2017;22(5):823–833. doi: 10.1016/j.drudis.2017.01.013. [DOI] [PubMed] [Google Scholar]
- 20.谢 丽敏, 刘 丹丹, 宗 菲, et al. 不同浓度的抗菌肽RISE-AP12®对体外培养成骨细胞生物活性的影响[J] 口腔医学. 2017;37(2):114–120. [Google Scholar]; Xie LM, Liu DD, Zong F, et al. Effects of different concentrations of antimicrobial peptide rise-ap12® on the biological activity of osteoblasts in vitro[J] Stomatology. 2017;37(2):114–120. [Google Scholar]
- 21.涂 艳, 熊 莉娜, 柳 湘洁, et al. 淫羊藿苷对成骨细胞成骨分化的影响及Wnt/-catenin信号系统的关系研究[J] 中国中医急症. 2017;26(3):448–450, 466. [Google Scholar]; Tu Y, Xiong LN, Liu XJ, et al. Effect of Icariin on osteogenic differentiation of osteoblasts and research on the relationship of Wnt/-catenin signal system[J] Chin J Emerg Medicine. 2017;26(3):448–450, 466. [Google Scholar]
- 22.邱 申彩, 龙 晏, 陈 晓燕, et al. 超表达Notch胞内结构域对人牙周膜干细胞增殖及成骨分化的影响[J] 中华口腔医学杂志. 2019;54(5):315–321. [Google Scholar]; Qiu SC, Long Y, Chen XY, et al. Effects of overexpression of Notch intracellular domain on proliferation and osteogenic differentiation of human periodontal ligament stem cells[J] Chin J Stomatol. 2019;54(5):315–321. doi: 10.3760/cma.j.issn.1002-0098.2019.05.005. [DOI] [PubMed] [Google Scholar]