Abstract
目的
探讨硼替佐米中枢神经系统(CNS)毒性的临床特点、诊断和治疗。
方法
报道5例由硼替佐米引起的CNS毒性患者并结合现有文献探讨其临床特点。
结果
5例患者中有4例在应用硼替佐米后出现了中枢性发热,主要表现为持续性高热、周身无汗、未能找到感染病灶、对退热药不敏感,停用硼替佐米后症状好转。4例患者中有3例伴随顽固性低钠血症,1例明确诊断为抗利尿不当综合征(SIAD),可能是硼替佐米同时影响了下丘脑体温调节中枢和抗利尿激素神经分泌细胞所致。1例患者诊断为可逆性后部脑病综合征(PRES),表现为应用硼替佐米后出现意识障碍,头CT示双侧半卵圆中心白质密度减低,停用硼替佐米后患者症状消失且未再复发。此外,我们还发现血小板计数可能与硼替佐米CNS毒性的严重程度相关。
结论
硼替佐米的CNS毒性非常罕见,表现为3种形式:SIAD、PRES和中枢性发热,及时识别和治疗对于预防不可逆的神经并发症非常重要。
Abstract
Objective
To investigate the clinical features, diagnosis, and treatment of the central nervous system (CNS) toxicity caused by bortezomib.
Methods
This study reports five new cases of CNS toxicity caused by bortezomib to elucidate its characteristics along with a review of the literature.
Results
CNS toxicity caused by bortezomib presents in three clinical forms: syndrome of inappropriate antidiuresis (SIAD), posterior reversible encephalopathy syndrome (PRES), and central fever, which is the most common clinical manifestation. Four of our five patients developed central fever after the administration of bortezomib, manifested as persistent high fever, anhidrosis, and absence of infective foci; the symptom could be improved by discontinuance of bortezomib. Of these patients, three concurrently presented with refractory hyponatremia and one was clearly diagnosed with SIAD. The bortezomib could have caused damages to the hypothalamus and induced both central fever and SIAD. In addition, one patient was diagnosed with PRES due to disturbance of consciousness and epilepsy after taking bortezomib. After discontinuation of bortezomib, the symptoms disappeared and did not recur. We also found that thrombocytopenia may be related to the severity of the CNS toxicity of bortezomib.
Conclusion
Cases of CNS toxicity of bortezomib are extremely rare and present as SIAD, PRES and central fever. Early detection and treatment of bortezomib are very important to prevent irreversible neurological complications.
第一代蛋白酶体抑制剂硼替佐米的应用在多发性骨髓瘤(MM)的治疗进展中具有划时代的意义,并在临床上得到了广泛应用[1]。硼替佐米最常见的不良反应为周围神经炎、胃肠道症状和血小板减少[2],而累及中枢神经系统(CNS)的毒性相对少见。硼替佐米CNS毒性的相关报道比较少,既往文献报道的表现形式主要有两种:抗利尿不当综合征(syndrome of inappropriate antidiuresis,SIAD)和可逆性后部脑病综合征(posterior reversible encephalopathy syndrome,PRES)。我们在600余例接受硼替佐米治疗的患者中共发现5例由硼替佐米引起的CNS毒性患者,现结合文献复习,报道如下。
病例资料
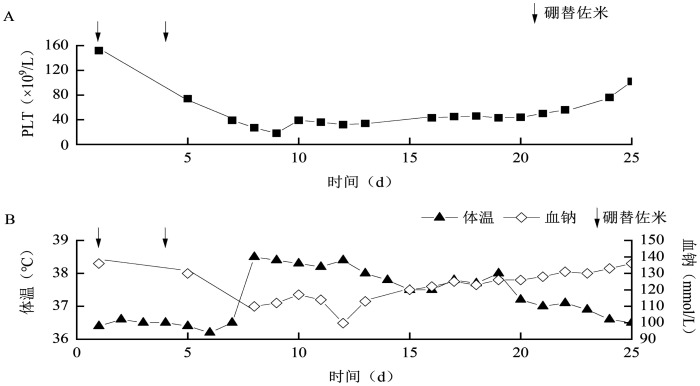
例1,男,53岁,2018年6月确诊为MM,2018年9月4日在接受第3个疗程VDD(硼替佐米+多柔比星脂质体+地塞米松)方案的第2次硼替佐米治疗后出现便秘腹泻交替,查血钠130 mmol/L,予停用硼替佐米。2018年9月8日患者出现发热,体温38.5 °C,无畏寒、寒战,精神状态差。查体:无汗,双侧瞳孔对光反射迟钝,球结膜水肿。血常规:WBC 5.21×109/L,HGB 113 g/L,PLT 18×109/L。血钠109.9 mmol/L,皮质醇及甲状腺功能正常。予补钠、退热、抗感染后患者体温仍高(38.2~38.5°C),无汗,嗜睡,完善头胸腹CT未见异常。2018年9月12日晚患者出现间断意识障碍,血钠99.8 mmol/L,尿钠>40 mmol/L,考虑SIAD,予限液、托伐普坦片等治疗后患者次日意识恢复,后续患者汗出热退,血钠逐渐上升至136 mmol/L。患者于院外停止化疗,未再出现类似情况。
例2,女,73岁,因MM进展参与DVd[达雷妥尤单抗(Dara)+硼替佐米+地塞米松]方案的临床试验,患者接受第5个疗程第8天的Vd(硼替佐米+地塞米松)方案治疗,3 d后出现高热(体温39.5 °C),伴双手不自主抖动,周身无汗,血压126/79 mmHg(1 mmHg=0.133 kPa)。血常规:WBC 9.92×109/L,HGB 135 g/L,PLT 68×109/L;血钠124.4 mmol/L。胸腹CT检查未见明显感染灶。予补钠、退热、抗感染治疗后患者体温仍高(38.0~39.5 °C)。5 d后患者出现神志不清,答不切题,体温39.9 °C,复查PLT 15×109/L,血钠122 mmol/L,24 h尿钠24.73 mmol/L(<40 mmol/L,暂不支持SIAD的诊断)。血培养、G试验、GM试验均为阴性。头CT:双侧半卵圆中心白质密度减低。患者应用硼替佐米后相继出现周围神经病加重、中枢性发热、意识障碍及顽固性低钠血症,考虑硼替佐米所致CNS毒性可能性大,嘱暂停化疗,物理降温。患者补钠后血钠仍低,予托伐普坦治疗,后血钠逐渐恢复至133 mmol/L,体温及意识也逐渐恢复。
例3,男,62岁,2020年5月因MM进展入院,予Dara+VRD(硼替佐米+来那度胺+地塞米松)方案化疗,因患者PLT低(24×109/L),硼替佐米推迟2 d应用。患者注射第1针硼替佐米2 d后出现发热(体温38.5 °C),无畏寒、寒战,血常规:WBC 2.19×109/L,HGB 61 g/L,PLT 17×109/L;血钠127.2 mmol/L。予积极抗感染和退热治疗后,患者仍发热(体温38~38.5 °C),周身无汗,GM实验、G实验和血培养均阴性。考虑不除外硼替佐米相关CNS毒性,暂停化疗,予冰袋物理降温,高渗盐水输注。3 d后患者体温略下降(37.5~38 °C),仍无汗,仍有低钠血症(血钠127~132 mmol/L),嘱加用托伐普坦口服治疗,后患者血钠逐渐上升至正常。约1周后患者开始出汗,体温逐渐降至正常。后改予Dara+IRD(伊沙佐米+来那度胺+地塞米松)方案治疗,未再出现发热及低钠血症。
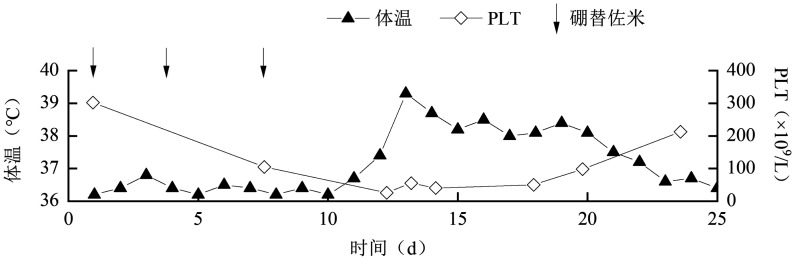
例4,女,62岁,2019年4月确诊MM,2019年9月24日完成第6周期VRD方案的第3次硼替佐米注射,25日出现腹泻伴双下肢麻木及酸痛。查电解质大致正常,予止泻,患者腹泻缓解,但双下肢仍酸痛。2019年9月28日患者诉行走后头晕,测卧位血压130/80 mmHg,坐位血压106/67 mmHg,考虑体位性低血压,予补液。2019年9月29日患者出现发热(体温最高39.2 °C),无汗,无畏寒、寒战,未发现感染病灶,予积极抗感染及退热治疗后患者体温仍高(37.8~38.2 °C),查血常规:WBC 7.56×109/L,ANC 5.94×109/L,HGB 110 g/L,PLT 26×109/L;C反应蛋白、降钙素原、内毒素、GM试验、G试验和血培养均阴性。患者应用硼替佐米后出现典型的中枢性发热,伴明显的双下肢麻木疼痛及体位性低血压,不能排除硼替佐米的神经毒性,暂停化疗后患者接受中医治疗(针灸等)、营养神经等支持治疗,持续发热1周后开始出汗,体温逐渐降至正常,双下肢酸痛缓解,但仍有麻木。患者后续行Rd(来那度胺+地塞米松)方案巩固治疗,未再出现上述情况。
例5,男,67岁,2018年12月确诊为MM,后行BCD(硼替佐米+环磷酰胺+地塞米松)、VRD方案治疗,治疗期间患者反复出现低钠血症(血钠最低106 mmol/L)及一过性意识障碍,间断伴腹泻(大便次数最多达30次/d),生化常规示尿酸低(84 µmol/L)、尿素氮低(2.18 mmol/L),脑弥散加权成像(DWI)扫描未见异常扩散受限,不支持PRES。上述症状一般在应用硼替佐米2 d后出现,考虑硼替佐米不耐受,停用硼替佐米,后续应用Rd方案治疗,未再出现上述情况,疾病稳定。
上述5例患者的临床资料见表1。
表1. 5例由硼替佐米引起中枢神经系统毒性的多发性骨髓瘤(MM)患者的临床资料.
| 例号 | 性别 | 年龄(岁) | 诊断 | 不良反应 | 症状 | 体温 | PLT(×109/L) | 血钠(mmol/L) | 尿钠(mmol/L) | 治疗方案 | 处理 | 转归 |
| 1 | 男 | 53 | MM初治 | SIAD;中枢性发热 | 表情淡漠、嗜睡、间断性意识障碍 | 持续发热、无汗 | 23 | 99.8 | >40 | VDD×2达PR→第3疗程VDD第2次硼替佐米注射 | 停用硼替佐米;限水、补钠、托伐普坦、氢化可的松减少尿钠;人血免疫球蛋白静滴减轻神经毒性;甘露醇减轻脑水肿 | 意识及行动逐渐恢复,血钠水平恢复正常。半年后患者出现疾病进展,使用Dara治疗无效,因疾病进展死亡 |
| 2 | 女 | 73 | MM进展 | 中枢性发热;PRES;顽固性低钠血症 | 意识障碍 | 持续发热、无汗 | 15 | 122 | 24.73 | BCD×4达CR→TD、MP方案治疗,持续CR→疾病进展→入组DVd临床试验,Vd第5个疗程第8天 | 停止化疗;托伐普坦、补钠;物理降温 | 后续未再化疗,未再出现低钠血症、持续性发热、意识障碍等情况,疾病稳定 |
| 3 | 男 | 62 | MM进展 | 中枢性发热;顽固性低钠血症 | 精神萎靡 | 持续发热、无汗 | 17 | 127.2 | NA | BCD×3、VRD×3达PR→auto-HSCT后达VGPR→VRD×2巩固→Rd维持→疾病进展→Dara+VRD第1疗程 | 停用硼替佐米;冰袋物理降温;托伐普坦、补钠 | 改用Dara+IRD方案治疗;未再出现低钠血症、持续性发热 |
| 4 | 女 | 62 | MM初治 | 中枢性发热 | 腹泻、体位性低血压、双下肢酸痛 | 持续发热、无汗 | 26 | 正常 | NA | VRD×5达sCR→第6疗程VRD第3次硼替佐米注射 | 停用硼替佐米;中医疗法(针灸) | Rd方案治疗,未再出现持续性发热 |
| 5 | 男 | 67 | MM初治 | SIAD? | 精神淡漠,反应迟钝,腹泻 | 无 | 47 | 106 | NA | BCD×3、VRD | 停用硼替佐米;限水、补钠 | Rd方案治疗,未再出现低钠血症,疾病稳定 |
注:SIAD:抗利尿不当综合征;PRES:可逆性后部脑病综合征;sCR:严格意义的完全缓解;CR:完全缓解;VGPR:非常好的部分缓解;PR:部分缓解;VDD:硼替佐米+多柔比星脂质体+地塞米松;BCD:硼替佐米+环磷酰胺+地塞米松;TD:沙利度胺+地塞米松;MP:美法仑+泼尼松;DVd:达雷妥尤单抗(Dara)+硼替佐米+地塞米松;Vd:硼替佐米+地塞米松;VRD:硼替佐米+来那度胺+地塞米松;Rd:来那度胺+地塞米松;IRD:伊沙佐米+来那度胺+地塞米松;NA:未获得
讨论及文献复习
硼替佐米的CNS毒性很少报道,本文结合既往文献提出了硼替佐米CNS毒性的三种形式:SIAD、PRES和中枢性发热。
SIAD是指多种原因引起体内精氨酸加压素不恰当分泌、渗透压调定点“重置”或加压素受体突变造成的水潴留,以低渗性低钠血症、尿渗透压>血渗透压为特征的一组临床综合征[3]。SIAD一般与肿瘤、肺部疾病、CNS疾病以及药物有关[4]。患者出现高/正常血容量性低钠血症、低尿酸、低尿素氮和尿钠水平>40 mmol/L通常提示可诊断该综合征。
文献报道了7例考虑硼替佐米相关的SIAD(表2)[5]–[11],男女比例相当。SIAD通常发生在硼替佐米治疗的第1~3疗程,停用硼替佐米、限制液体摄入、补高渗盐水等治疗后患者血钠及症状均可恢复。此外,精氨酸加压素拮抗剂托伐普坦在治疗硼替佐米导致的SIAD中也有重要价值[9],[11]。
表2. 硼替佐米引起抗利尿不当综合征的文献报道.
| 文献来源 | 性别 | 年龄(岁) | 诊断 | 治疗方案 | 临床表现 | 血钠(mmol/L) | 尿渗透压(mOsm/kg·H2O)(参考值:40~400) | 尿钠(mmol/L) |
| Brodmann等[5] | 女 | 77 | MCL进展 | 第2疗程B单药 | 进行性共济失调、言语不清和意识混乱 | 112 | 317 | 94 |
| Paydas等[6] | 男 | 69 | MM进展后缓解 | 第4疗程BD方案 | 嗜睡 | 123 | 升高 | 76 |
| Shimazu等[7] | 男 | 64 | MM初治 | 第1~2疗程BD方案 | 嗜睡 | 110 | 525 | 145 |
| Lv等[8] | 男 | 44 | MM初治 | 第3疗程BD方案 | 远端肢体疲乏及麻木 | 121.6 | 443 | 147.7 |
| Carreño等[9] | 女 | 81 | MM初治 | 第2疗程BD方案 | 定向障碍、嗜睡和乏力 | 112 | 升高 | NA |
| Peng等[10] | 女 | 68 | MM初治 | 第3疗程VMP方案 | 恶心呕吐、头晕、乏力 | 101 | 421 | 133 |
| O'Connor-Byrne等[11] | 女 | 67 | MM二次进展 | 第1~2疗程BD方案 | 恶心、腹痛 | 118 | 503 | 70 |
| 文献来源 | 甲状腺功能 | 肾上腺皮质功能 | ADH(pmol/L) | 发热 | PLT降低 | CT/MRI | 处理 | 转归 |
| Brodmann等[5] | NA | NA | NA | 无 | NA | NA | 限水补钠 | 停用硼替佐米,电解质恢复正常,评估疾病达完全缓解 |
| Paydas等[6] | 正常 | 正常 | NA | 无 | 有 | NA | 限水 | 停用硼替佐米,血钠恢复 |
| Shimazu等[7] | NA | NA | 2.4 | 有 | 有 | 正常 | 限水补钠 | 低钠血症纠正,但持续失眠,死于呼吸衰竭 |
| Lv等[8] | 正常 | 正常 | NA | 无 | 无 | NA | 限水补钠 | 血钠恢复,随后接受MPT方案治疗,血钠持续正常 |
| Carreño等[9] | 正常 | 正常 | NA | 无 | NA | 正常 | 限水托伐普坦 | 限水后一过性好转,2个月后症状再次出现,予托伐普坦后患者未再出现症状。疾病处于缓解状态 |
| Peng等[10] | 正常 | 正常 | NA | 有 | NA | NA | 限水 | 改用MPR方案治疗,未再发生低钠血症,疾病控制良好 |
| O'Connor-Byrne等[11] | 正常 | 正常 | NA | 无 | NA | NA | 限水补钠托伐普坦 | 血钠恢复正常,硼替佐米与托伐普坦同时应用后未再出现低钠血症 |
注:MCL:套细胞淋巴瘤;MM:多发性骨髓瘤;B:硼替佐米;BD:硼替佐米+地塞米松;VMP:硼替佐米+美法仑+泼尼松;MPT:美法仑+泼尼松+沙利度胺;MPR:美法仑+泼尼松+来那度胺;ADH:抗利尿激素;NA:未获得
硼替佐米引起SIAD的机制尚不清楚,可能和长春新碱类似,通过对神经垂体和下丘脑系统的直接毒性导致渗透压调定点“重置”而引起SIAD[12]。此外,有研究通过免疫组织化学的方法发现单克隆浆细胞中抗利尿激素表达阳性,认为SIAD可能与肿瘤溶解综合征有关[13],但这个机制不能解释获得疾病缓解的MM患者出现SIAD。
本研究5例患者中有4例发生了顽固性低钠血症,其中2例患者处于疾病缓解状态,3例既往应用硼替佐米时无不良反应。例1满足SIAD的诊断标准,排除了CNS疾病、肺部疾病及肿瘤溶解引起的SIAD,最终考虑与硼替佐米的CNS毒性有关。例5在硼替佐米治疗期间反复出现低钠血症,生化常规提示血浆渗透压低(低尿酸及低尿素氮),且在限水及补钠后血钠可恢复,停用硼替佐米后未再出现低钠血症,亦不能除外硼替佐米所致SIAD。
PRES是一种以头痛、癫痫发作、精神状态改变和视觉障碍为特征的临床综合征,产生机制是血管内皮功能障碍和脑自动调节功能失败,血脑屏障破坏,继而引起的脑水肿[14],CT显示为等或低密度,MRI为T1W1等或低信号,T2W1高信号[14]–[15]。多数病例(70%~80%)与高血压相关,也可由子痫、肾功能不全、自身免疫性疾病和免疫抑制疗法(如环孢素和他克莫司)等引发[14],[16],硼替佐米相关的PRES也陆续被报道[17]–[22]。
文献报道了6例硼替佐米相关PRES(表3),女性多见。PRES通常发生在硼替佐米应用的第1个疗程,也有报道发生在第2、3个疗程[17]–[18],既往一线硼替佐米治疗耐受的患者挽救治疗时应用硼替佐米也可发生PRES[22]。硼替佐米相关PRES很大程度上可逆,停用硼替佐米、控制血压及癫痫后,2~3 d内神经症状可缓解,数周后复查影像学可见病灶消失[19]。
表3. 硼替佐米引起可逆性后部脑病综合征(PRES)的文献报道.
| 文献来源 | 性别 | 年龄(岁) | 诊断 | 血压(mmHg) | 临床表现 | CT/MRI | 脑脊液 |
| Kelly等[17] | 男 | 66 | WM难治 | 中度高血压 | 全身性强直-阵挛性癫痫发作、精神状态改变 | 脑MRI:枕叶的皮质下白质中显示出广泛的不对称高信号 | NA |
| Kager等[18] | 女 | 62 | MM进展 | 183/94 | 视物模糊、头痛、癫痫、精神状态改变(嗜睡) | 脑CT:皮层下和顶枕白质中存在低密度区域 | NA |
| Terwiel等[19] | 女 | 58 | MM进展 | 升高 | 无痛性双侧视力下降、强直-阵挛性癫痫发作 | 脑MRI:双侧枕部皮质及白质不对称高信号 | NA |
| Oshikawa等[20] | 女 | 54 | MM初治 | 140/85 | 全身性强直-阵挛性癫痫发作、精神状态改变(嗜睡) | 脑MRI:枕叶和丘脑皮层下白质中广泛不对称高强度信号 | 蛋白细胞分离(细胞数:3/mm3,总蛋白:95 mg/dl);HSV、VZV和HHV-6分子检查均为阴性 |
| Ho等[21] | 女 | 51 | MM初治 | 217~184/ 125~98 | 视物模糊、头痛、全身性强直-阵挛性癫痫发作、精神状态改变 | 脑MRI:双侧额顶叶至枕叶皮质下区高信号 | NA |
| Nixon等[22] | 女 | 71 | MM进展 | 175/67 | 额叶搏动性头痛、全身性强直-阵挛性癫痫发作 | 脑CT:枕叶白质可见低密度区。脑MRI:大脑白质双侧弥漫性水肿,主要累及脑桥和小脑 | NA |
| 文献来源 | 治疗方案 | 处理 | 转归 |
| Kelly等[17] | 第3疗程B单药 | 停用硼替佐米;予降压药 | 未再发作,3个月后复查脑MRI正常 |
| Kager等[18] | 第2疗程BD方案 | 停用硼替佐米;拉贝洛尔降压治疗;劳拉西泮治疗癫痫 | 约3 d神经症状消失 |
| Terwiel等[19] | 第1疗程BD方案 | 停用硼替佐米;拉贝洛尔和氨氯地平降压;苯妥英钠治疗癫痫发作 | 视力在数周内逐渐恢复,但没有完全恢复。2周后复查MRI脑水肿消失。数月后死于MM进展 |
| Oshikawa等[20] | 第1疗程BD方案 | 停用硼替佐米;甲泼尼龙冲击治疗:1 g/d,连续3 d | 意识两天内恢复正常,未再有癫痫发作。1周后和1个月后复查脑MRI显示大脑病变有显著改善 |
| Ho等[21] | 第1疗程BT方案 | 地西泮、丙戊酸控制抽搐;尼卡地平控制血压 | 2 d后症状恢复,2周后复查脑MRI显示疾病明显缓解 |
| Nixon等[22] | 一线治疗曾应用VMP方案达部分缓解,疾病进展后挽救治疗第1疗程VMP方案时出现PRES | 苯妥英钠;插管以保护气道;静脉注射拉贝洛尔降血压 | 神经症状未再发作,5个月后死于难治性MM |
注:WM:华氏巨球蛋白血症;MM:多发性骨髓瘤;B:硼替佐米;BD:硼替佐米+地塞米松;BT:硼替佐米+沙利度胺;VMP:硼替佐米+美法仑+泼尼松;HSV:单纯疱疹病毒;VZV:水痘-带状疱疹病毒;HHV-6:人疱疹病毒-6型;NA:未获得
硼替佐米导致PRES的机制尚不明确,可能机制如下:①硼替佐米抑制NF-κB的激活,导致包括血管内皮生长因子(VEGF)在内的细胞生长因子转录水平降低。此前研究表明,抗VEGF的药物如贝伐单抗可通过影响内皮细胞功能破坏血脑屏障进而引起PRES[23]。因此,硼替佐米可能通过NF-κB途径对血脑屏障产生破坏,导致PRES。②硼替佐米还可能通过引起自主神经功能障碍导致脑血管收缩、痉挛,进而产生PRES。
例2考虑存在PRES,患者在应用硼替佐米后出现一过性精神状态改变(意识障碍),且头CT示双侧半卵圆中心白质密度减低,患者虽有低钠血症,但其血钠水平(122~130 mmol/L)一般很少导致意识障碍,在停用硼替佐米及普通支持治疗后其精神症状可逆,结合患者发病特点及影像学检查,诊断其合并PRES。既往文献报道,有37% CT阴性的患者MRI诊断为PRES[24],因而若怀疑患者存在PRES,推荐首选头MRI检查作为PRES诊断的“金标准”。
除顽固性低钠血症及精神状态改变外,本文报道的5例患者中有4例在应用硼替佐米治疗后的2~5 d内出现了持续性高热,其共同特点为:①持续数日至数周的高热;②周身无汗;③虽然高热,但中毒症状不明显,未发现感染灶且抗感染治疗无效;④予退热药后体温仍高,物理降温有效。综合上述特点考虑患者为中枢性发热,而停用硼替佐米后未再出现,我们认为硼替佐米与其高度相关。众所周知,人体的体温调节中枢位于下丘脑,下丘脑前部病变,特别是视前区体温敏感神经元的病变,会引起体温整合功能障碍,从而导致中枢性高热[25]。本文报道的4例患者中有3例同时合并顽固性低钠血症,且1例明确诊断为SIAD,抗利尿激素的合成也位于下丘脑,因此我们推测,硼替佐米可能通过影响下丘脑导致中枢性发热和SIAD同时发生。
此外,5例患者在硼替佐米CNS不良反应发生期间均有3~4级血小板减少,且血小板减少的严重程度和临床症状(如发热、低钠血症、精神状态等)的严重程度一致(图1、2)。既往文献报道,脑源性神经营养因子(BDNF)主要在人血小板中储存和运输,对神经纤维和神经元起营养支持作用[26],BDNF的减少和硼替佐米诱导的周围神经病变有关[27]。因而,我们推测硼替佐米诱发CNS毒性的另外一个可能的机制为硼替佐米引起PLT降低,使得BDNF释放减少,进而间接损伤CNS。PLT或许可作为硼替佐米CNS毒性严重程度的预判指标。
图1. 例1治疗过程中PLT(A)及体温、血钠(B)变化.
图2. 例4治疗过程中体温及PLT变化.
硼替佐米的CNS毒性为相对少见的不良反应,我们在此报道并进行文献复习,希望提高广大医师对该不良反应的认识。
References
- 1.Ludwig H, Khayat D, Giaccone G, et al. Proteasome inhibition and its clinical prospects in the treatment of hematologic and solid malignancies[J] Cancer. 2005;104(9):1794–1807. doi: 10.1002/cncr.21414. [DOI] [PubMed] [Google Scholar]
- 2.Scott K, Hayden PJ, Will A, et al. Bortezomib for the treatment of multiple myeloma[J] Cochrane Database Syst Rev. 2016;4:CD010816. doi: 10.1002/14651858.CD010816.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Cuesta M, Thompson CJ. The syndrome of inappropriate antidiuresis (SIAD)[J] Best Pract Res Clin Endocrinol Metab. 2016;30(2):175–187. doi: 10.1016/j.beem.2016.02.009. [DOI] [PubMed] [Google Scholar]
- 4.Ellison DH, Berl T. Clinical practice. The syndrome of inappropriate antidiuresis[J] N Engl J Med. 2007;356(20):2064–2072. doi: 10.1056/NEJMcp066837. [DOI] [PubMed] [Google Scholar]
- 5.Brodmann S, Gyr Klaas E, Cathomas R, et al. Severe hyponatremia in a patient with mantle cell lymphoma treated with bortezomib: a case report and review of the literature[J] Onkologie. 2007;30(12):651–654. doi: 10.1159/000109979. [DOI] [PubMed] [Google Scholar]
- 6.Paydas S. Hyponatremia is not a rare adverse event in bortezomib-treated patients[J] Chemotherapy. 2011;57(5):434–436. doi: 10.1159/000334088. [DOI] [PubMed] [Google Scholar]
- 7.Shimazu Y, Fujimura K. Hyponatremia in a multiple myeloma patient treated with bortezomib[J] Hematol Oncol. 2017;35(4):929–930. doi: 10.1002/hon.2381. [DOI] [PubMed] [Google Scholar]
- 8.Lv CL, Li J. Bortezomib as a probable cause of the syndrome of inappropriate antidiuretic hormone secretion: A case report and review of the literature[J] Mol Clin Oncol. 2017;7(4):667–672. doi: 10.3892/mco.2017.1366. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Carreño A, Hernández B, Mayoralas Á, et al. Syndrome of inappropriate secretion of antidiuretic hormone (SIADH) due to bortezomib in a case of light chain multiple mieloma. Treatment with tolvaptan[J] Nefrologia. 2017;37(5):558–559. doi: 10.1016/j.nefro.2016.10.015. [DOI] [PubMed] [Google Scholar]
- 10.Peng B, Chen H, Lou X. Bortezomib-induced syndrome of inappropriate antidiuresis in a patient with multiple myeloma: A case report and literature review[J] Int J Clin Pharmacol Ther. 2017;55(12):910–914. doi: 10.5414/CP203109. [DOI] [PubMed] [Google Scholar]
- 11.O'Connor-Byrne N, Glavey S, Tudor R, et al. Bortezomib-induced hyponatremia: tolvaptan therapy permits continuation of lenalidomide, bortezomib and dexamethasone therapy in relapsed myeloma[J] Exp Hematol Oncol. 2019;8:4. doi: 10.1186/s40164-019-0128-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Robertson GL, Bhoopalam N, Zelkowitz LJ. Vincristine neurotoxicity and abnormal secretion of antidiuretic hormone[J] Arch Intern Med. 1973;132(5):717–720. [PubMed] [Google Scholar]
- 13.Nakayama-Ichiyama S, Yokote T, Iwaki K, et al. Syndrome of inappropriate antidiuretic hormone secretion associated with plasma cell myeloma[J] Br J Haematol. 2011;152(2):125. doi: 10.1111/j.1365-2141.2010.08462.x. [DOI] [PubMed] [Google Scholar]
- 14.Hinchey J, Chaves C, Appignani B, et al. A reversible posterior leukoencephalopathy syndrome[J] N Engl J Med. 1996;334(8):494–500. doi: 10.1056/NEJM199602223340803. [DOI] [PubMed] [Google Scholar]
- 15.Casey SO, Sampaio RC, Michel E, et al. Posterior reversible encephalopathy syndrome: utility of fluid-attenuated inversion recovery MR imaging in the detection of cortical and subcortical lesions[J] AJNR Am J Neuroradiol. 2000;21(7):1199–1206. [PMC free article] [PubMed] [Google Scholar]
- 16.Fugate JE, Rabinstein AA. Posterior reversible encephalopathy syndrome: clinical and radiological manifestations, pathophysiology, and outstanding questions[J] Lancet Neurol. 2015;14(9):914–925. doi: 10.1016/S1474-4422(15)00111-8. [DOI] [PubMed] [Google Scholar]
- 17.Kelly K, Kalachand R, Murphy P. Bortezomib-induced reversible posterior leucoencephalopathy syndrome[J] Br J Haematol. 2008;141(5):566. doi: 10.1111/j.1365-2141.2008.07088.x. [DOI] [PubMed] [Google Scholar]
- 18.Kager LM, Kersten MJ, Kloppenborg RP, et al. Reversible posterior leucoencephalopathy syndrome associated with bortezomib in a patient with relapsed multiple myeloma[J] BMJ Case Rep. 2009 doi: 10.1136/bcr.06.2009.1926. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Terwiel E, Hanrahan R, Lueck C, et al. Reversible posterior encephalopathy syndrome associated with bortezomib[J] Intern Med J. 2010;40(1):69–71. doi: 10.1111/j.1445-5994.2009.02097.x. [DOI] [PubMed] [Google Scholar]
- 20.Oshikawa G, Kojima A, Doki N, et al. Bortezomib-induced posterior reversible encephalopathy syndrome in a patient with newly diagnosed multiple myeloma[J] Intern Med. 2013;52(1):111–114. doi: 10.2169/internalmedicine.52.8799. [DOI] [PubMed] [Google Scholar]
- 21.Ho CH, Lo CP, Tu MC. Bortezomib-induced posterior reversible encephalopathy syndrome: clinical and imaging features[J] Intern Med. 2014;53(16):1853–1857. doi: 10.2169/internalmedicine.53.2383. [DOI] [PubMed] [Google Scholar]
- 22.Nixon NA, Parhar K. Posterior reversible encephalopathy syndrome resulting from repeat bortezomib usage[J] BMJ Case Rep. 2014 doi: 10.1136/bcr-2014-204592. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Glusker P, Recht L, Lane B. Reversible posterior leukoencephalopathy syndrome and bevacizumab[J] N Engl J Med. 2006;354(9):980–982; discussion 980-982. doi: 10.1056/NEJMc052954. [DOI] [PubMed] [Google Scholar]
- 24.Singer S, Grommes C, Reiner AS, et al. Posterior Reversible Encephalopathy Syndrome in Patients With Cancer[J] Oncologist. 2015;20(7):806–811. doi: 10.1634/theoncologist.2014-0149. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Morrison SF. Central neural control of thermoregulation and brown adipose tissue[J] Auton Neurosci. 2016;196:14–24. doi: 10.1016/j.autneu.2016.02.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Fujimura H, Altar CA, Chen R, et al. Brain-derived neurotrophic factor is stored in human platelets and released by agonist stimulation[J] Thromb Haemost. 2002;87(4):728–734. [PubMed] [Google Scholar]
- 27.Broyl A, Corthals SL, Jongen JL, et al. Mechanisms of peripheral neuropathy associated with bortezomib and vincristine in patients with newly diagnosed multiple myeloma: a prospective analysis of data from the HOVON-65/GMMG-HD4 trial[J] Lancet Oncol. 2010;11(11):1057–1065. doi: 10.1016/S1470-2045(10)70206-0. [DOI] [PubMed] [Google Scholar]