Abstract
目的
探究 3D 打印 Ti6Al4V-4Cu 合金对小鼠 BMSCs 及小鼠单核巨噬细胞系 RAW264.7 炎症及成骨基因表达的影响。
方法
通过选择性激光熔融技术制备 Ti6Al4V 与 Ti6Al4V-4Cu 合金,依据医疗器械生物学评价标准制备两种材料浸提液。通过细胞计数试剂盒 8 法检测两种浸提液对小鼠 BMSCs、小鼠 RAW264.7 细胞增殖的影响。两种浸提液与小鼠 BMSCs 共培养 3 d 后,通过实时荧光定量 PCR 法检测成骨相关基因Ⅰ型胶原(collagen type Ⅰ,Col-Ⅰ)、ALP、Runx 家族转录因子 2(Runx family transcription factor 2,Runx-2)、骨保护素(osteoprotegerin,OPG)、骨桥蛋白(osteopontin,OPN)mRNA 的表达;与小鼠 RAW264.7 共培养 1 d 后,通过实时荧光定量 PCR 法检测炎症相关基因 IL-4、一氧化氮合成酶 2(nitric oxide synthase 2,iNOS)mRNA 的表达,并收集两组上清液通过 ELISA 法检测其中 VEGF-a、BMP-2 的分泌量。将两组上清液制备成成骨条件培养基,与 BMSCs 共培养 3 d,实时荧光定量 PCR 法检测成骨相关基因 Col-Ⅰ、ALP、Runx-2、OPG、OPN mRNA 的表达。
结果
与 Ti6Al4V 合金浸提液比较,Ti6Al4V-4Cu 合金浸提液对 BMSCs 及小鼠 RAW264.7 细胞的增殖影响不明显;但是可促进 BMSCs OPG mRNA 的表达,减少小鼠 RAW264.7 细胞炎症相关基因 iNOS mRNA 的表达、促进抑炎因子 IL-4 mRNA 的表达,还可促进小鼠 RAW264.7 细胞分泌 VEGF-a 及 BMP-2,而 Ti6Al4V-4Cu 成骨条件培养基又可促进 BMSCs 成骨相关基因 Col-Ⅰ、ALP、Runx-2、OPG、OPN mRNA 的表达,上述指标差异均有统计学意义(P<0.05)。
结论
3D 打印 Ti6Al4V-4Cu 合金通过释放铜离子,促进 RAW264.7 细胞分泌 VEGF-a 及 BMP-2,从而通过骨免疫调节促进成骨发生,为金属假体的应用奠定了理论基础。
Keywords: 3D 打印技术, Ti6Al4V-4Cu 合金, 成骨微环境, 骨免疫调节
Abstract
Objective
To investigate the effects of three-dimensional (3D) printed Ti6Al4V-4Cu alloy on inflammation and osteogenic gene expression in mouse bone marrow mesenchymal stem cells (BMSCs) and mouse mononuclear macrophage line RAW264.7.
Methods
Ti6Al4V and Ti6Al4V-4Cu alloys were prepared by selective laser melting, and the extracts of the two materials were prepared according to the biological evaluation standard of medical devices. The effects of two kinds of extracts on the proliferation of mouse BMSCs and mouse RAW264.7 cells were detected by cell counting kit 8 method. After co-cultured with mouse BMSCs for 3 days, the expression of osteogenesis- related genes [collagen type Ⅰ (Col-Ⅰ), alkaline phosphatase (ALP), Runx family transcription factor 2 (Runx-2), osteoprotegerin (OPG), and osteopontin (OPN)] were detected by real-time fluorescence quantitative PCR. After co-cultured with mouse RAW264.7 cells for 1 day, the expressions of inflammation-related genes [interleukin 4 (IL-4) and nitric oxide synthase 2 (iNOS)] were detected by real-time fluorescence quantitative PCR, and the supernatants of the two groups were collected to detect the secretion of vascular endothelial growth factor a (VEGF-a) and bone morphogenetic protein 2 (BMP-2) by ELISA. The osteogenic conditioned medium were prepared with the supernatants of the two groups and co-cultured with BMSCs for 3 days. The expressions of osteogenesis-related genes (Col-Ⅰ, ALP, Runx-2, OPG, and OPN) were detected by real-time fluorescence quantitative PCR.
Results
Compared with Ti6Al4V alloy extract, Ti6Al4V-4Cu alloy extract had no obvious effect on the proliferation of BMSCs and RAW264.7 cells, but it could promote the expression of OPG mRNA in BMSCs, reduce the expression of iNOS mRNA in RAW264.7 cells, and promote the expression of IL-4 mRNA. It could also promote the secretions of VEGF-a and BMP-2 in RAW264.7 cells. Ti6Al4V-4Cu osteogenic conditioned medium could promote the expressions of Col-Ⅰ, ALP, Runx-2, OPG, and OPN mRNAs in BMSCs. The differences were all significant (P<0.05).
Conclusion
3D printed Ti6Al4V-4Cu alloy can promote RAW264.7 cells to secret VEGF-a and BMP-2 by releasing copper ions, thus promoting osteogenesis through bone immune regulation, which lays a theoretical foundation for the application of metal prosthesis.
Keywords: Three-dimensional printing, Ti6Al4V-4Cu alloy, osteogenic microenvironment, bone immune regulation
骨缺损通常由创伤、感染、肿瘤、先天畸形等骨骼疾病引起[1],骨移植是主要治疗方法。但自体骨移植供骨部位有限且易发生取骨相关并发症,同种异体骨移植又存在免疫原性和疾病传播风险[2]。生物材料的出现为骨缺损修复提供了一种选择,钛及其合金因具有良好的生物相容性、较低的弹性模量及抗腐蚀性等优点,在骨科植入领域中应用广泛[3-6]。然而,钛合金本身的生物惰性并不利于骨组织长入[7],且植入人体后会引起组织免疫反应,不利于骨组织生长[8-9]。因此给予材料抑制炎症的能力,有助于促进成骨发生[10-12]。
铜离子是体内维持细胞功能的重要微量元素[13],在骨折修复过程中起着重要作用[14],维持血清中适当的铜离子含量可以延缓女性骨质疏松的发生[15]。同时,铜离子对体内的免疫调节反应至关重要[16],在炎症急性期,铜离子的代谢明显增强[17],且有研究表明铜离子可以抑制炎症反应,从而促进成骨发生[18]。因此,我们考虑将铜元素引入钛合金中,从而改善钛合金的生物性能。传统方法通常采用在钛合金表面添加涂层的方式对其进行改性,然而存在涂层与金属材料黏附性差、易脱落等问题[19],3D 打印技术的发展为解决这一问题提供了可能。前期研究中我们通过选择性激光熔融(selective laser melting,SLM)技术成功制造了一组含铜元素的 Ti6Al4V-xCu(x=0wt%、2wt%、4wt%、6wt%)合金[20]。预实验提示 Ti6Al4V-4Cu 合金对细胞毒性较小,且铜元素含量适当,故本研究选择 Ti6Al4V-4Cu,观察该材料对小鼠 BMSCs 及小鼠单核巨噬细胞系 RAW264.7 的影响,探讨 Ti6Al4V-4Cu 合金的生物相容性及是否具有促进成骨发生的特性,以期探究铜元素在成骨材料中的应用,并制备一种具有免疫调节功能的骨科植入材料。
1. 材料与方法
1.1. 实验动物及主要试剂、仪器
4 周龄雄性 C57 小鼠 5 只,体质量 10~15 g,由陆军军医大学(原第三军医大学)实验动物中心 提供。
小鼠单核巨噬细胞系 RAW264.7 购自中国科学院细胞库。Ti6Al4V 粉末(飞而康快速制造科技有限责任公司)。L-DMEM 培养基、FBS、0.25% 胰蛋白酶(HyClone 公司,美国);青霉素-链霉素溶液(上海碧云天生物技术公司);细胞计数试剂盒 8(cell counting kit 8,CCK-8;合肥 Biosharp 公司);ELISA 酶联免疫试剂盒(北京博奥森生物技术有限公司);RNAiso Plus 试剂盒、定量 PCR 试剂盒 TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus)、逆转录试剂盒 PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)(Takara 公司,日本)。SLM 3D 打印机( Concept Laser GmbH 公司,德国);扫描电镜(Phenom-World 公司,荷兰);X 射线能谱分析(energy dispersive spectrometer,EDS)仪(Hitachi 公司,日本)。
1.2. 3D 打印 Ti6Al4V 与 Ti6Al4V-4Cu 合金样件的制备与材料表征
3D 打印 Ti6Al4V 与 Ti6Al4V-4Cu 合金样件由中国科学院福建物质结构研究所提供。以 Ti6Al4V 粉末为原材料,通过 SLM 3D 打印机制备 Ti6Al4V 合金样件(直径 15 mm、厚度 1 mm)。然后采用交叉孵育技术,将 Ti6Al4V 粉末与纯铜粉(99.99%)混合(铜粉质量比 4wt%),同法制备 Ti6Al4V-4Cu 合金样件(直径 15 mm、高 1 mm)。两种合金样件各打印 12 个。取 Ti6Al4V-4Cu 合金样件,采用扫描电镜观察微观结构,EDS 仪分析合金基体元素分布,确定是否成功制备。
用 2 000 目砂纸打磨材料样件表面,以 SiO2-H2O2 溶液对样件抛光后,用丙酮、75% 乙醇、无水乙醇、去离子水分别对样件超声清洗 30 min,烘干后采用高温高压对材料消毒灭菌以用于细胞实验。
1.3. Ti6Al4V-4Cu 合金生物相容性及成骨性能检测
1.3.1. 小鼠 BMSCs 分离培养
将 5 只 4 周龄雄性 C57 小鼠脱颈处死,浸入 75% 乙醇溶液中消毒处理 5 min,于无菌环境中取出两侧股骨,去除表面软组织后用 PBS 洗涤 3 次;剪去股骨干骺端与股骨头,用 5 mL 注射器吸取含 10%FBS 与 1% 青霉素-链霉素溶液的 L-DMEM 培养基冲洗骨髓腔,将冲洗出的细胞混悬液加到 25 cm2培养皿,置于 37℃、5%CO2 细胞孵箱中孵育;24 h 后去掉未贴壁细胞,每 3 天换液 1 次,5~7 d 后传代,经鉴定后选取第 3~8 代细胞用于实验。
1.3.2. Ti6Al4V 与 Ti6Al4V-4Cu 合金浸提液的制备
依照医疗器械生物学评价标准(GB/T 16886.12-2017/ISO 10993-12-2005),将灭菌后的 3D 打印 Ti6Al4V 与 Ti6Al4V-4Cu 合金样件放入无菌 50 mL 离心管中,按照 3 cm2/mL 向离心管中加入无血清 L-DMEM 培养基,混匀后放入 37℃、5%CO2 细胞孵箱中,72 h 后收集浸提液,添加 10%FBS 及 1% 青霉素-链霉素溶液备用。
1.3.3. CCK-8 法检测细胞增殖
将 BMSCs 以 2×103个/孔密度铺于 96 孔板中,分为 3 组,每组设 3 个复孔。24 h 后弃原始培养基,分别更换培养基为含 10%FBS 及 1% 青霉素-链霉素溶液的 L-DMEM 培养基(A 组)、Ti6Al4V 合金浸提液(B 组)、Ti6Al4V-4Cu 合金浸提液(C 组),每 3 天换液 1 次。分别于 1、3、5 d 依据 CCK-8 试剂盒说明书检测各组细胞的增殖情况,以 450 nm 处检测吸光度(A)值表示。
另外,取小鼠 RAW264.7 细胞以 2×103个/孔密度铺于 96 孔板中,同上法分组培养后,于 1、2、3 d 检测各组细胞增殖情况,以 450 nm 处 A 值表示。
1.3.4. 实时荧光定量 PCR 检测
① 对 BMSCs 成骨相关基因表达的影响:将 BMSCs 以 1×105个/孔密度铺于 6 孔板中,分为 2 组,每组 3 个复孔。24 h 后弃原始培养基,分别加入含 Ti6Al4V 合金浸提液(A 组)与 Ti6Al4V-4Cu 合金浸提液(B 组)的成骨诱导培养基(含 10 mmol/L β-甘油磷酸钠、1 mmol/L 维生素 C、0.1 mmol/L 地塞米松的 DMEM 培养基),置于 37℃、5% CO2 细胞孵箱中诱导培养 3 d。根据 Trizol 试剂盒说明书提取两组 RNA,测定浓度后,按照逆转录试剂盒 PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)说明书方法提取 cDNA;再以 SYBR 荧光定量法检测成骨相关基因Ⅰ型胶原(collagen type Ⅰ,Col-Ⅰ)、ALP、Runx 家族转录因子 2(Runx family transcription factor 2,Runx-2)、骨保护素(osteoprotegerin,OPG)、骨桥蛋白(osteopontin,OPN)的 mRNA 表达,每组重复 3 次,取均值。② 对小鼠 RAW264.7 细胞炎症相关基因表达的影响:将小鼠 RAW264.7 细胞以 1×105个/孔密度铺于 6 孔板中,24 h 后同上法分组成骨诱导 1 d。采用相同方法检测炎症相关基因 IL-4、一氧化氮合成酶 2(nitric oxide synthase 2,iNOS)的 mRNA 表达,每组重复 3 次,取均值。以上均以 2–ΔΔCt值计算各目的基因相对表达量。相关引物序列由上海生工生物工程股份有限公司合成,引物序列见表 1。
表 1.
Primer sequences for real-time fluorescent quantitative PCR
实时荧光定量 PCR 各基因引物序列
| 基因
Gene |
上游引物(5'→3')
Forward primer(5'→3') |
下游引物(5'→3')
Reverse primer(5'→3') |
| GAPDH | AGGTCGGTGTGAACGGATTTG | TGTAGACCATGTAGTTGAGGTCA |
| ALP | CCAACTCTTTTGTGCCAGAGA | GGCTACATTGGTGTTGAGCTTTT |
| Col-Ⅰ | GCTCCTCTTAGGGGCCACT | CCACGTCTCACCATTGGGG |
| OPG | ACCCAGAAACTGGTCATCAGC | CTGCAATACACACACTCATCACT |
| OPN | AGCAAGAAACTCTTCCAAGCAA | GTGAGATTCGTCAGATTCATCCG |
| Runx-2 | AAATGCCTCCGCTGTTATGAA | GCTCCGGCCCACAAATCT |
| iNOS | GTTTACCATGAGGCTGAAATCC | CCTCTTGTCTTTGACCCAGTAG |
| IL-4 | GGTCTCAACCCCCAGCTAGT | GCCGATGATCTCTCTCAAGTGAT |
1.3.5. ELISA 法检测小鼠 RAW264.7 细胞分泌的相关因子
将小鼠 RAW264.7 细胞以 1×105个/孔密度铺于 6 孔板中,分为 2 组,每组 4 个复孔。24 h 后分别更换培养基为 Ti6Al4V 合金浸提液(A 组)与 Ti6Al4V-4Cu 合金浸提液(B 组)。1 d 后收集培养基,以离心半径 15.9 cm、1 500 r/min 离心 5 min,取上清,按照 ELISA 酶联免疫试剂盒说明书检测上清液中 VEGF-a 与 BMP-2 的含量。
1.3.6. RAW264.7 细胞条件培养基对 BMSCs 成骨相关基因表达的影响
将小鼠 RAW264.7 细胞以 1×105个/孔密度铺于 6 孔板中,分为 2 组,每组 3 个复孔。24 h 后分别更换培养基为 Ti6Al4V 合金浸提液(A 组)与 Ti6Al4V-4Cu 合金浸提液(B 组),1 d 后收集培养基,以离心半径 15.9 cm、1 500 r/min 离心 5 min 后取上清,与 L-DMEM 成骨诱导培养基 1∶1 混合,分别制备 Ti6Al4V 与 Ti6Al4V-4Cu 成骨条件培养基。将 BMSCs 以 1×105个/孔密度铺于 6 孔板中,24 h 后分别更换为 Ti6Al4V 与 Ti6Al4V-4Cu 成骨条件培养基,3 d 后同 1.3.4 方法检测成骨相关基因 Col-Ⅰ、ALP、Runx-2、OPG、OPN 的 mRNA 相对表达量。
1.4. 统计学方法
采用 GraphPad Prism 统计软件进行分析。数据以均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用 LSD 检验;两组间比较采用独立样本 t 检验;检验水准 α=0.05。
2. 结果
2.1. 3D 打印 Ti6Al4V 与 Ti6Al4V-4Cu 合金样件的表征
通过 3D 打印制备的 Ti6Al4V 与 Ti6Al4V-4Cu 合金样件外观均呈金属光泽,表面光滑,直径 15 mm、厚度 1 mm,二者无明显区别(图 1a)。Ti6Al4V-4Cu 合金扫描电镜观察示,深灰色为针状 α 相(密排六方结构),银灰色为 β 相(体心立方结构),合金组织是以 β 相为基体,与针状 α 相密集排列组成(图 1b)。EDS 分析显示,铜元素质量百分比为4.08%±0.83%,说明成功制备 Ti6Al4V-4Cu 合金(图 1c)。
图 1.
Characterization of 3D printed Ti6Al4V and Ti6Al4V-4Cu alloy samples
3D 打印 Ti6Al4V 与 Ti6Al4V-4Cu 合金样件表征
a. 材料外观;b. 扫描电镜观察(×2 000);c. EDS 分析
a. Material appearance; b. Scanning electron microscope observation (×2 000); c. Energy dispersive spectrometer analysis

2.2. Ti6Al4V-4Cu 合金生物相容性及成骨性能检测
2.2.1. CCK-8 法检测细胞增殖
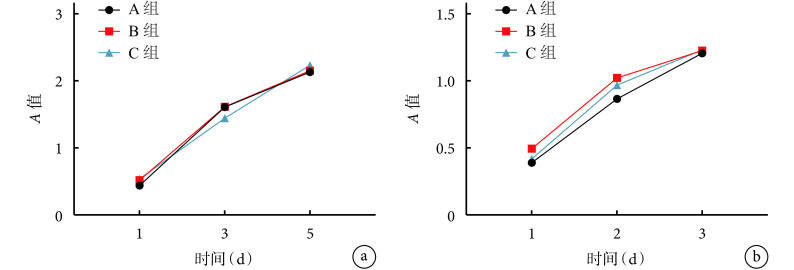
① 浸提液对 BMSCs 的影响:第 1 天,B、C 组 A 值显著高于 A 组,差异有统计学意义(P<0.05);B、C 组间差异无统计学意义(P>0.05)。第 3、5 天,各组间A 值比较差异均无统计学意义(P>0.05)。② 浸提液对 RAW264.7 细胞的影响:除第 1、2 天,B 组A 值显著高于 A 组,差异有统计学意义(P<0.05)外,其余各时间点各组间差异均无统计学意义(P>0.05)。见图 2。
图 2.
Detection of cell proliferation by CCK-8 method
CCK-8 法检测细胞增殖
a. 浸提液对 BMSCs 的影响;b. 浸提液对 RAW264.7 细胞的影响
a. Effect of extract on BMSCs; b. Effect of extract on RAW264.7 cells
2.2.2. 实时荧光定量 PCR 检测
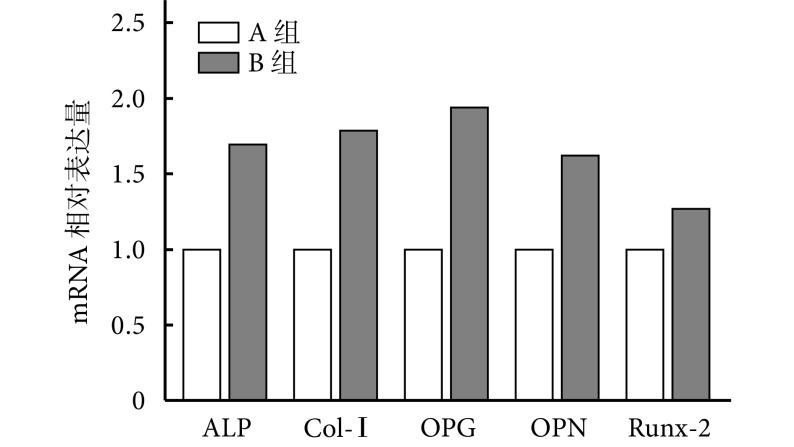
① 对 BMSCs 成骨相关基因表达的影响:除 B 组 OPG mRNA 相对表达量显著高于 A 组,差异有统计学意义(t=9.168,P=0.001)外,两组 Col-Ⅰ、ALP、Runx-2、OPN mRNA 相对表达量比较差异均无统计学意义(P>0.05)。② 对小鼠 RAW264.7 细胞炎症相关基因表达的影响:与 A 组比较,B 组 IL-4 mRNA 相对表达量明显增加,iNOS mRNA 相对表达量明显下降,差异均有统计学意义(P<0.05)。见图 3。
图 3.
Detection of osteogenesis- and inflammation-related genes expression by real-time fluorescence quantitative PCR
实时荧光定量 PCR 检测成骨及炎症相关基因表达
a. 对 BMSCs 成骨相关基因表达的影响;b. 对小鼠 RAW264.7 细胞炎症相关基因表达的影响
a. Effect on the expression of osteogenesis-related genes in BMSCs; b. Effect on the expression of inflammation-related genes in mouse RAW264.7 cells
2.2.3. ELISA 法检测小鼠 RAW264.7 细胞分泌的相关因子
B 组上清液中 VEGF-a 与 BMP-2 的含量分别为(11.169±0.984)ng/L、(0.163±0.063)μg/L,显著高于 A 组的(9.070±0.518)ng/L、(0.070±0.013)μg/L,差异均有统计学意义(t=3.269,P=0.017;t=2.506,P=0.046)。
2.2.4. RAW264.7 细胞条件培养基对 BMSCs 成骨相关基因表达的影响
B 组 BMSCs 成骨相关基因 Col-Ⅰ、ALP、Runx-2、OPG、OPN mRNA 相对表达量均显著高于 A 组,差异有统计学意义(P<0.05)。见图 4。
图 4.
Real-time fluorescence quantitative PCR to detect the effect of RAW264.7 conditioned medium on expression of osteogenesis-related genes in BMSCs
实时荧光定量 PCR 检测 RAW264.7 条件培养基对 BMSCs 成骨相关基因表达的影响
3. 讨论
近年来,许多研究报道了生物材料具有良好的骨诱导作用[21-24],但具体作用机制仍未明确[25]。生物材料在体内外的差异表现,使得人们越来越关注体内的免疫调节机制研究[26]。骨生物材料植入后,免疫细胞通常首先产生应答反应[27],由此形成免疫微环境,在组织修复与再生中起着核心作用[11]。巨噬细胞作为调节免疫微环境最重要的细胞之一,在骨形成中也发挥着重要作用[28],这为研究者们开发具有骨免疫调节作用的材料奠定了理论基础[12]。Liu 等[29]为聚醚醚酮材料制备锌涂层,Shi 等[30]将铜离子掺入二氧化硅纳米球中,Zhang 等[31]制备了掺锌的纳米涂层,Zhang 等[32]制备了含有 β-磷酸钙涂层的镁支架,均是利用了金属元素调节巨噬细胞,营造一个适当的免疫微环境,从而促进成骨发生。Honda 等[33]研究也验证了当细胞外钙离子浓度达 14 mmol/L 时可促进小鼠巨噬细胞 J774A.1 分泌 BMP-2,从而促进成骨发生。此外,动物实验也证明,没有巨噬细胞的及时参与,骨折无法修复[26]。这些都说明了巨噬细胞在成骨发生中具有重要作用,然而如何利用巨噬细胞的可塑性达到促成骨发生目的,将是未来开发新型骨科材料的方向。
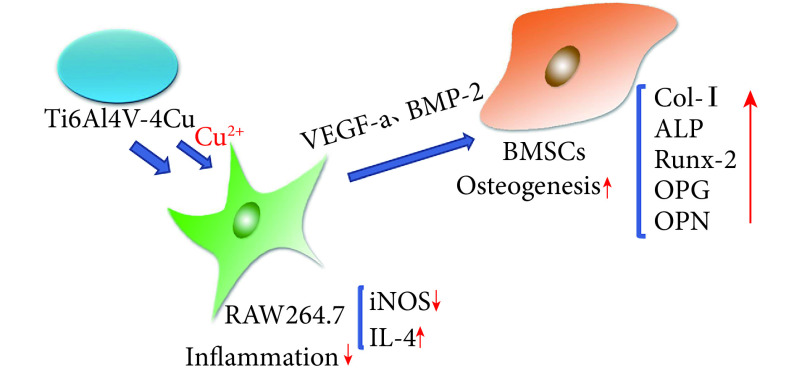
我们认为铜离子可以通过调节巨噬细胞从而影响成骨发生,因此本研究通过 3D 打印制备了 Ti6Al4V 及 Ti6Al4V-4Cu 合金,观测 Ti6Al4V-4Cu 合金中铜离子对小鼠 BMSCs 与小鼠 RAW264.7 细胞增殖的影响,确定了 Ti6Al4V-4Cu 合金对细胞无毒性作用。其次,通过 Ti6Al4V 与 Ti6Al4V-4Cu 合金浸提液分别与小鼠 RAW264.7 细胞共培养 24 h 后,观测到铜离子可增强抗炎因子 IL-4 的表达,减少炎症因子 iNOS 的表达,从而减少了炎症发生,营造了一个良好的免疫微环境;同时,我们从两种培养上清液中均检测出巨噬细胞分泌的 BMP-2 和 VEGF-a,且 Ti6Al4V-4Cu 合金组含量较高。另外,我们将 Ti6Al4V 与 Ti6Al4V-4Cu 合金浸提液分别与小鼠 BMSCs 共培养 3 d,检测成骨相关基因的表达,发现相比于 Ti6Al4V,Ti6Al4V-4Cu 促进了 OPG mRNA 表达,但 Col-Ⅰ、ALP、Runx-2、OPN mRNA 的表达却无明显差异。然而,将培养基换为 RAW264.7 细胞条件培养基,分别与小鼠 BMSCs 共培养 3 d 后发现,Ti6Al4V-4Cu 组各成骨相关基因表达均显著增加。结合前期检测结果显示,条件培养基中有巨噬细胞分泌的 BMP-2 和 VEGF-a,而且有文献报道巨噬细胞可以通过分泌 BMP-2[33-35]和 VEGF-a[36]促进成骨发生,因此我们认为铜离子可以降低小鼠 RAW264.7 细胞向炎症方向极化的可能,同时促进细胞分泌 BMP-2 和 VEGF-a,从而通过免疫调节营造一个良好的成骨微环境,促进成骨发生(图 5),为金属假体的应用提供了理论依据。同时,也有研究表明铜具有模拟缺氧的能力[30],从而促进血管生成。Zhang 等[37]在磷酸钙骨水泥材料中引入铜离子,使其兼具成骨和成血管功能。究其原因,Weng 等[38]认为铜离子以剂量依赖方式促进内皮细胞增殖;Li 等[39]的研究表明铜离子是通过缺氧诱导因子 1α(hypoxia inducible factor 1α,HIF-1α)通路增强 VEGF-a 的表达,从而增强血管生成;Rigiracciolo 等[40]在对乳腺癌的研究中发现,铜离子剂量依赖性诱导 HIF-1α 和 VEGF-a 基因表达,而施以铜离子螯合剂时,又抑制了乳腺癌中血管的生成。因此,铜离子在促血管生成方面具有很大潜力,是生物材料中比较有前景的添加剂,当然本实验所用 Ti6Al4V-4Cu 合金是否也具有促血管生成的能力,有待进一步研究。
图 5.
Mechanism of copper ion promoting osteogenesis through bone immunomodulation
铜离子通过骨免疫调节促进成骨发生的机制
综上述,与不含铜的 Ti6Al4V 合金相比,铜离子能够赋予材料良好的免疫调节性能,通过改变巨噬细胞炎症表型,促使其分泌 BMP-2 和 VEGF-a,从而促进成骨发生。本研究为了解生物材料诱导成骨发生的机制奠定了基础,为骨诱导材料的设计及研究提供了新的策略。下一步我们将继续完善该材料在成血管及动物体内的相关研究,进一步探究成骨发生机制。
作者贡献:张臣科参与实验设计与实施、数据收集整理及统计分析、文章撰写;卢衍锦参与 Ti6Al4V 和 Ti6Al4V-4Cu 材料的设计制备及成分分析;郭宇鹏参与实验设计及文章内容审阅;陈万参与实验设计;唐红、李怀胜参与部分实验的实施;唐康来负责文章审阅;何清义参与实验设计、数据分析及对文章内容进行批评性审阅。
利益冲突:所有作者声明,在课题研究和文章撰写过程中不存在利益冲突。课题经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道。
机构伦理问题:所有动物实验均经中国人民解放军第三军医大学实验动物福利伦理审查委员会批准(AMUWEC2018602)。实验动物生产许可证号:SCXK(渝)20170002,使用许可证号:SYXK(渝)2017002。
Funding Statement
国家自然科学基金资助项目(81672177);国家重点研发计划资助项目(2016YFC1100500);国家自然科学基金青年项目(51801198)
National Natural Science Foundation of China (81672177); National Key Research and Development of China (2016YFC1100500); Youth Program of National Natural Science Foundation of China (51801198)
References
- 1.Wu XC, Stroll SI, Lantigua D, et al Eggshell particle-reinforced hydrogels for bone tissue engineering: an orthogonal approach. Biomater Sci. 2019;7(7):2675–2685. doi: 10.1039/C9BM00230H. [DOI] [PubMed] [Google Scholar]
- 2.Dimitriou R, Mataliotakis GI, Angoules AG, et al Complications following autologous bone graft harvesting from the iliac crest and using the RIA: a systematic review. Injury. 2011;Suppl 2:S3–S15. doi: 10.1016/j.injury.2011.06.015. [DOI] [PubMed] [Google Scholar]
- 3.万志鹏, 蒋文涛, 王宠, 等 三维打印 Ti-6Al-4V 合金孔洞几何特征与空间分布研究. 生物医学工程学杂志. 2017;34(6):876–882. doi: 10.7507/1001-5515.201703048. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Hanawa T Titanium-tissue interface reaction and its control with surface treatment. Front Bioeng Biotechnol. 2019;7:170. doi: 10.3389/fbioe.2019.00170. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Li Y, Ding Y, Munir K, et al Novel β-Ti35Zr28Nb alloy scaffolds manufactured using selective laser melting for bone implant applications. Acta Biomater. 2019;87:273–284. doi: 10.1016/j.actbio.2019.01.051. [DOI] [PubMed] [Google Scholar]
- 6.Wang CC, Hu HX, Li ZP, et al Enhanced osseointegration of titanium alloy implants with laser microgrooved surfaces and graphene oxide coating. ACS Appl Mater Interfaces. 2019;11(43):39470–39483. doi: 10.1021/acsami.9b12733. [DOI] [PubMed] [Google Scholar]
- 7.Bosshardt DD, Chappuis V, Buser D Osseointegration of titanium, titanium alloy and zirconia dental implants: current knowledge and open questions. Periodontol. 2000;2017, 73(1):2–40. doi: 10.1111/prd.12179. [DOI] [PubMed] [Google Scholar]
- 8.Li RC, Deng CJ, Li XX, et al Copper-incorporated bioactive glass-ceramics inducing anti-inflammatory phenotype and regeneration of cartilage/bone interface. Theranostics. 2019;9(21):6300–6313. doi: 10.7150/thno.36120. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.彭建强, 易志新, 武明鑫, 等 氧化应激活化 RAW264.7 巨噬细胞对 MC3T3-E1 成骨细胞迁移、增殖及成骨基因表达影响的实验研究. 中国修复重建外科杂志. 2016;30(9):1146–1152. doi: 10.7507/1002-1892.20160234. [DOI] [PubMed] [Google Scholar]
- 10.Chen XN, Wang ML, Chen FY, et al Correlations between macrophage polarization and osteoinduction of porous calcium phosphate ceramics. Acta Biomater. 2020;103:318–332. doi: 10.1016/j.actbio.2019.12.019. [DOI] [PubMed] [Google Scholar]
- 11.Julier Z, Park AJ, Briquez PS, et al Promoting tissue regeneration by modulating the immune system. Acta Biomater. 2017;53:13–28. doi: 10.1016/j.actbio.2017.01.056. [DOI] [PubMed] [Google Scholar]
- 12.Chen Z, Klein T, Murray RZ, et al Osteoimmunomodulation for the development of advanced bone biomaterials. Materials Today. 2016;19(6):304–321. doi: 10.1016/j.mattod.2015.11.004. [DOI] [Google Scholar]
- 13.Fraga CG Relevance, essentiality and toxicity of trace elements in human health. Mol Aspects Med. 2005;26(4-5):235–244. doi: 10.1016/j.mam.2005.07.013. [DOI] [PubMed] [Google Scholar]
- 14.李永乐, 何强, 范先东, 等 人脐血对兔骨折愈合期间全血微量元素含量的影响. 中国修复重建外科杂志. 2013;27(6):673–679. doi: 10.7507/1002-1892.20130150. [DOI] [Google Scholar]
- 15.Mir E, Hossein-Nezhad A, Bahrami A, et al Adequate serum copper concentration could improve bone density, postpone bone loss and protect osteoporosis in women. Iranian Journal of Public Health. 2007;36(2):24–29. [Google Scholar]
- 16.Djoko KY, Ong CI, Walker MJ, et al The role of copper and zinc toxicity in innate immune defense against bacterial pathogens. J Biol Chem. 2015;290(31):18954–18961. doi: 10.1074/jbc.R115.647099. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Tapiero H, Townsend DM, Tew KD Trace elements in human physiology and pathology. Copper. Biomed Pharmacother. 2003;57(9):386–398. doi: 10.1016/S0753-3322(03)00012-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Ren L, Wong HM, Yan CH, et al Osteogenic ability of Cu-bearing stainless steel. J Biomed Mater Res B Appl Biomater. 2015;103(7):1433–1444. doi: 10.1002/jbm.b.33318. [DOI] [PubMed] [Google Scholar]
- 19.Liu F, Wang F, Shimizu T, et al Hydroxyapatite formation on oxide films containing Ca and P by hydrothermal treatment. Ceramics International. 2006;32(5):527–531. doi: 10.1016/j.ceramint.2005.04.006. [DOI] [Google Scholar]
- 20.Guo S, Lu YJ, Wu SQ, et al Preliminary study on the corrosion resistance, antibacterial activity and cytotoxicity of selective-laser-melted Ti6Al4V-xCu alloys. Mater Sci Eng C Mater Biol Appl. 2017;72:631–640. doi: 10.1016/j.msec.2016.11.126. [DOI] [PubMed] [Google Scholar]
- 21.Bohner M, Miron RJ A proposed mechanism for material-induced heterotopic ossification. Materials Today. 2019;22:132–141. doi: 10.1016/j.mattod.2018.10.036. [DOI] [Google Scholar]
- 22.康明, 黄杰华, 张理选, 等 壳聚糖/胡须/磷酸钙骨水泥复合生物材料的力学性能及对诱导多能干细胞成骨潜能的影响. 中国修复重建外科杂志. 2018;32(7):959–967. [Google Scholar]
- 23.邓廉夫, 燕宇飞 骨修复材料的研究现状与进展. 中国修复重建外科杂志. 2018;32(7):815–820. doi: 10.7507/1002-1892.201806028. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.满星云, 索海瑞, 刘家利, 等 基于三维打印的磷酸三钙骨组织工程支架烧结工艺研究. 生物医学工程学杂志. 2020;37(1):112–118. doi: 10.7507/1001-5515.201906065. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Chen XN, Wang J, Chen Y, et al Roles of calcium phosphate-mediated integrin expression and MAPK signaling pathways in the osteoblastic differentiation of mesenchymal stem cells. J Mater Chem B. 2016;4(13):2280–2289. doi: 10.1039/C6TB00349D. [DOI] [PubMed] [Google Scholar]
- 26.Pajarinen J, Lin T, Gibon E, et al Mesenchymal stem cell-macrophage crosstalk and bone healing. Biomaterials. 2019;196:80–89. doi: 10.1016/j.biomaterials.2017.12.025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Hotchkiss KM, Reddy GB, Hyzy SL, et al Titanium surface characteristics, including topography and wettability, alter macrophage activation. Acta Biomater. 2016;31:425–434. doi: 10.1016/j.actbio.2015.12.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Luo J, Ding X, Song W, et al Inducing macrophages M2 polarization by dexamethasone laden mesoporous silica nanoparticles from titanium implant surface for enhanced osteogenesis. Acta Metallurgica Sinica (English Letters) 2019;10:1253–1260. [Google Scholar]
- 29.Liu W, Li J, Cheng M, et al Zinc-modified sulfonated polyetheretherketone surface with immunomodulatory function for guiding cell fate and bone regeneration. Adv Sci (Weinh) 2018;5(10):1800749. doi: 10.1002/advs.201800749. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Shi M, Chen Z, Farnaghi S, et al Copper-doped mesoporous silica nanospheres, a promising immunomodulatory agent for inducing osteogenesis. Acta Biomater. 2016;30:334–344. doi: 10.1016/j.actbio.2015.11.033. [DOI] [PubMed] [Google Scholar]
- 31.Zhang RR, Liu XJ, Xiong ZY, et al The immunomodulatory effects of Zn-incorporated micro/nanostructured coating in inducing osteogenesis. Artif Cells Nanomed Biotechnol. 2018;46(sup1):1123–1130. doi: 10.1080/21691401.2018.1446442. [DOI] [PubMed] [Google Scholar]
- 32.Zhang XF, Chen QP, Mao XL Magnesium enhances osteogenesis of BMSCs by tuning osteoimmunomodulation. Biomed Res Int. 2019;2019:7908205. doi: 10.1155/2019/7908205. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Honda Y, Anada T, Kamakura S, et al Elevated extracellular calcium stimulates secretion of bone morphogenetic protein 2 by a macrophage cell line. Biochem Biophys Res Commun. 2006;345(3):1155–1160. doi: 10.1016/j.bbrc.2006.05.013. [DOI] [PubMed] [Google Scholar]
- 34.Chen ZT, Wu CT, Gu WY, et al Osteogenic differentiation of bone marrow MSCs by β-tricalcium phosphate stimulating macrophages via BMP2 signalling pathway. Biomaterials. 2014;35(5):1507–1518. doi: 10.1016/j.biomaterials.2013.11.014. [DOI] [PubMed] [Google Scholar]
- 35.Champagne CM, Takebe J, Offenbacher S, et al Macrophage cell lines produce osteoinductive signals that include bone morphogenetic protein-2. Bone. 2002;30(1):26–31. doi: 10.1016/S8756-3282(01)00638-X. [DOI] [PubMed] [Google Scholar]
- 36.Freytes DO, Kang JW, Marcos-Campos I, et al Macrophages modulate the viability and growth of human mesenchymal stem cells. J Cell Biochem. 2013;114(1):220–229. doi: 10.1002/jcb.24357. [DOI] [PubMed] [Google Scholar]
- 37.Zhang J, Wu H, He F, et al Concentration-dependent osteogenic and angiogenic biological performances of calcium phosphate cement modified with copper ions. Mater Sci Eng C Mater Biol Appl. 2019;99:1199–1212. doi: 10.1016/j.msec.2019.02.042. [DOI] [PubMed] [Google Scholar]
- 38.Weng L, Boda SK, Teusink MJ, et al Binary doping of strontium and copper enhancing osteogenesis and angiogenesis of bioactive glass nanofibers while suppressing osteoclast activity. ACS Appl Mater Interfaces. 2017;9(29):24484–24496. doi: 10.1021/acsami.7b06521. [DOI] [PubMed] [Google Scholar]
- 39.Li H, Li J, Jiang J, et al An osteogenesis/angiogenesis-stimulation artificial ligament for anterior cruciate ligament reconstruction. Acta Biomaterialia. 2017;54:399–410. doi: 10.1016/j.actbio.2017.03.014. [DOI] [PubMed] [Google Scholar]
- 40.Rigiracciolo DC, Scarpelli A, Lappano R, et al Copper activates HIF-1alpha/GPER/VEGF signalling in cancer cells. Oncotarget. 2015;6(33):34158–34177. doi: 10.18632/oncotarget.5779. [DOI] [PMC free article] [PubMed] [Google Scholar]