Resumo
Fundamento
Os glicocorticóides (GCs) são amplamente prescritos para o tratamento de numerosos distúrbios clínicos devido às suas propriedades anti-inflamatórias e imunomoduladoras, e um dos efeitos indesejáveis mais comuns desses medicamentos é a dislipidemia.
Objetivo
Avaliar o efeito da quercetina, um flavonoide derivado de plantas, no perfil lipídico de ratos tratados com glicocorticóides em altas doses.
Métodos
Um total de 32 ratos Sprague-Dawley foram distribuídos aleatoriamente entre quatro grupos (8 ratos por grupo) e tratados por 6 semanas com uma das seguintes opções : (i) solução salina normal; (ii) 40 mg/kg de succinato sódico de metilprednisolona (MP); (iii) MP + 50 mg/kg de quercetina; (iv) MP + 150 mg/kg de quercetina. O MP foi injetado por via subcutânea e a quercetina foi administrada por gavagem oral 3 dias por semana. No final do estudo, o perfil lipídico dos animais foi medido através de kits enzimáticos. Os dados foram analisados e a significância estatística foi estabelecida em p <0,05.
Resultados
Os níveis séricos médios de colesterol total (CT), triglicerídeos (TG) e LDL aumentaram drasticamente em animais tratados com GC em comparação com o grupo controle. Ambas as doses de quercetina (50 e 150 mg/kg) melhoraram o CT (43% e 45%), LDL (56% e 56%) e TG (46% e 55%, respectivamente). A razão Apo B/A1 diminuiu mais de 20% após a ingestão de Anti-Inflamatory Agents.
Conclusões
Esses dados sugerem que a ingestão de quercetina Quercetin; induzida por glicocorticóides. (Arq Bras Cardiol. 2020; 115(1):102-108)
Keywords: Ratos Sprague-Dawley, Anti-inflamatórios, Queraracina, Glicocorticoides, Dislipidemias, Triglicérides, Colesterol
Introdução
Glicocorticoides como prednisona, metilprednisolona e dexametasona são amplamente prescritos para o tratamento de numerosas doenças clínicas, incluindo doenças pulmonares, gastrointestinais, hematológicas, cutâneas e renais, bem como transplantes de órgãos, principalmente devido às suas propriedades anti-inflamatórias e imunomoduladoras.1 Embora esses medicamentos tenham tais benefícios, seus efeitos adversos, como hiperglicemia, hipertensão, hiperlipidemia, osteoporose, atrofia muscular e obesidade, devem ser levados a sério.2 O metabolismo lipídico deficiente é uma das reações indesejáveis mais comuns; a utilização de GCs em altas doses ou administrados em longo prazo causam nos usuários uma aparência semelhante à da síndrome de Cushing. Em outras palavras, a hipercolesterolemia e a hipertrigliceridemia são altamente prevalentes em pacientes submetidos a terapia com GC por períodos prolongados e, em última análise, podem levar a riscos de aterosclerose.3 - 4 No entanto, quando a administração desses medicamentos imunossupressores é inevitável, devemos procurar alguns medicamentos ou produtos naturais para minimizar seus efeitos indesejáveis.
A quercetina, 3,3’,4’,5,7-penta-hidroxiflavona, 2-(3,4-di-hidroxifenil)-3,5,7-tri-hidroxi-4H-cromen-4-ona, C15H10O7, é um flavonoide derivado de planta, isolado de cebolas, maçãs, uvas, vegetais folhosos e chá;5 , 6 Esse composto de polifenol de ocorrência natural é geralmente conhecido por suas propriedades antioxidantes e anti-inflamatórias e foi relatado como sendo um fator de melhora do sistema de defesa antioxidante, diminuindo a incidência de doenças cardiovasculares, neoplásicas e inflamatórias.7 - 9 Como o equilíbrio oxidante-antioxidante e o status da inflamação desempenham um papel importante na etiologia de muitas doenças, os compostos flavonoides têm sido destacados como agentes preventivos ou terapêuticos naturais10 , 11 . Além disso, alguns estudos anteriores relataram impacto benéfico da quercetina na síndrome metabólica e no metabolismo lipídico.12 , 13 O objetivo deste estudo é avaliar o efeito da quercetina no perfil lipídico de ratos tratados com glicocorticoide em altas doses.
Materiais e métodos
Animais
Um total de 32 ratos Sprague-Dawley com idades entre 6 e 7 meses, pesando 210 ± 30 gramas, foram obtidos do Razi Institute (Karaj, Irã). Os animais foram aclimatados às condições laboratoriais padrão (temperatura 20-25 °C e ciclo de 12 horas claro/escuro) por 10 dias antes do início do experimento principal. Foram fornecidas ad libitum água limpa e dieta padrão de ração peletizada (Danbehparvar, Thran, Irã). O protocolo experimental estava de acordo com os Principles of Laboratory Animal Care. 14 O tamanho da amostra foi calculado com 80% de potência, utilizando um teste bilateral com nível de significância de 5% e com base no tamanho do efeito de 0,5.
Produtos químicos
Succinato sódico de metilprednisolona (MP) foi utilizado como glicocorticoide (SOLU-MEDROL, Pfizer Pharmaceuticals, NY, EUA) para gerar dislipidemia induzida por GC.15 A quercetina, com uma pureza de 95%, foi obtida da Sigma-Aldrich Chemicals (St. Louis, MO, EUA) e a suspensão de quercetina foi preparada adicionando-se quercetina à solução aquosa de carboximetilcelulose (CMC) a 0,05%, imediatamente antes de ser administrada por gavagem oral.
Procedimento experimental
Trinta e dois animais foram distribuídos aleatoriamente em quatro grupos, utilizando o esquema de randomização em bloco. Cada grupo experimental continha oito ratos que foram tratados por seis semanas. Todos os grupos foram injetados por via subcutânea (s.c.) com MP (40 mg/kg de peso corporal), exceto o grupo controle que recebeu solução salina normal três dias por semana. Cada um dos três grupos injetados com glicocorticoide recebeu um dos seguintes tratamentos: CMC como placebo, 50 mg/kg de quercetina ou 150 mg/kg de quercetina. Todos os tratamentos foram administrados três dias por semana, por via oral. Ao final do estudo, todos os animais foram anestesiados com injeção intraperitoneal (i.p.) de cetamina juntamente com xilazina (50 mg/kg e 30 mg/kg, respectivamente).15 , 16 As amostras de sangue foram coletadas por punção cardíaca e imediatamente centrifugadas a 3000 rpm por 10 min para isolamento sérico e armazenadas a -80°C até a análise do perfil lipídico. Os ratos foram submetidos a jejum por 12 a 14 horas e todas as amostras de sangue foram coletadas entre 8 e 10 horas da manhã. Foram utilizados kits enzimáticos disponíveis no mercado para medir as concentrações séricas de colesterol total (CT), lipoproteína de alta densidade (HDL, high-density lipoprotein ) e triglicérides (TG) em duplicata (Pars Azmoon Co., Teerã, Irã), e Apo A e Apo B foram medidos através de métodos imunoturbidimétricos (biorexfars LTD, Irã). O nível de lipoproteína de baixa densidade (LDL, low-density lipoprotein ) foi calculado utilizando-se a equação de Friedewald.17 Os animais foram pesados no início e ao final do estudo.
Análise estatística
Todos os dados foram apresentados como média ± desvio padrão (DP) e analisados pelo Statistical Package for Social Sciences (versão 23.0; SPSS Inc., Chicago, EUA). O teste de Kolmogorov-Smirnov foi utilizado para avaliar a normalidade dos dados. As diferenças estatísticas entre os grupos foram avaliadas através da análise de variância (ANOVA One-Way) seguida pelo teste post hoc de Bonferroni. A significância estatística foi estabelecida em p<0,05.
Resultados
Embora o peso corporal médio dos ratos tenha sido o mesmo em todos os grupos no início do experimento, após seis semanas de intervenção, todos os animais tratados com glicocorticóides apresentaram uma redução significativa de peso em comparação com seus próprios pesos iniciais e com seus controles pareados por idade ( Tabela 1 ).
Tabela 1. – Peso corporal inicial e final (gramas) dos grupos experimentais.
| Peso corporal | Controle | MP | MP+Q50 | MP+Q150 |
|---|---|---|---|---|
| Inicial | 212±29 | 212±27 | 210±28 | 212±28 |
| Final | 214±30† | 182±22*,‡ | 185±20*,‡ | 180±16*,‡ |
Os dados são apresentados como Média ± DP. N = 8 para todos os grupos. MP: metilprednisolona; Q50: quercetina 50 mg/kg; Q150: quercetina 150 mg/kg; Análise de variância (ANOVA) seguida pelo teste de Bonferroni. *p <0,05 comparado ao grupo controle, †p <0,05 comparado ao grupo MP, ‡p <0,05 comparado ao peso inicial do mesmo grupo.
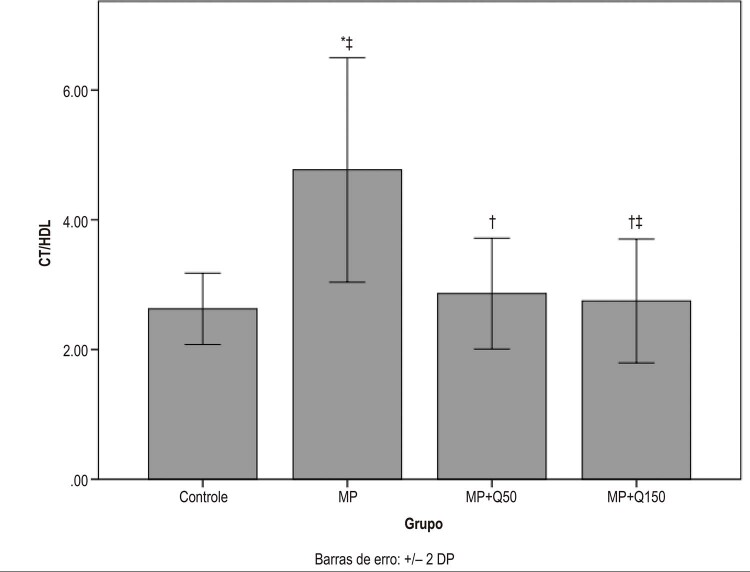
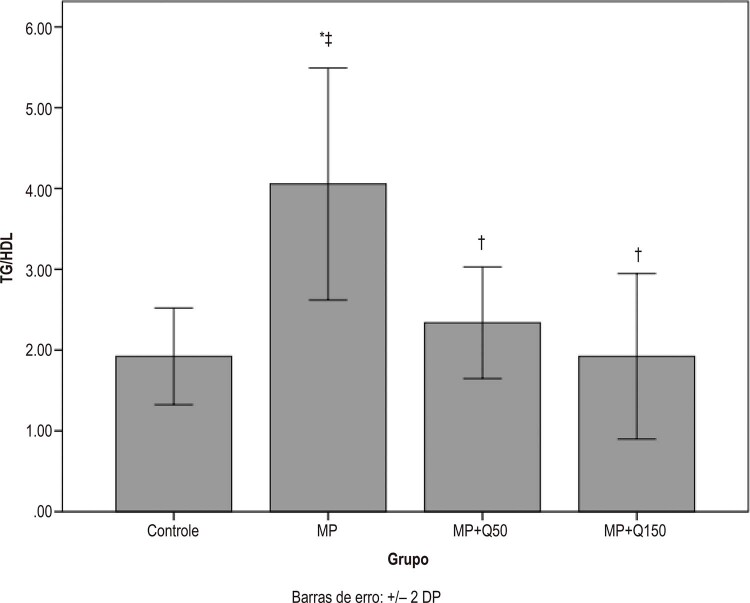
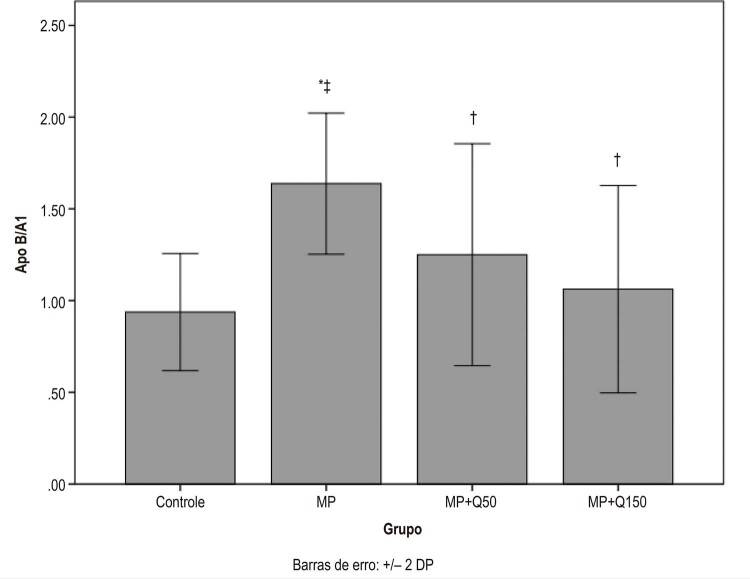
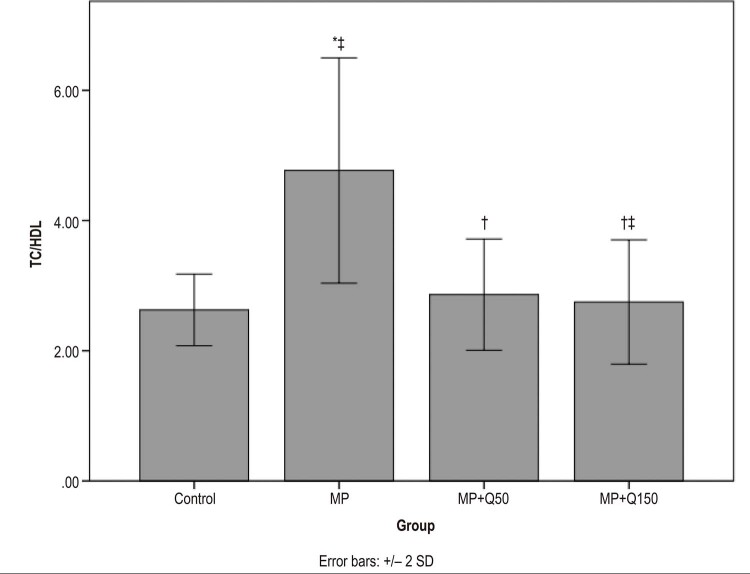
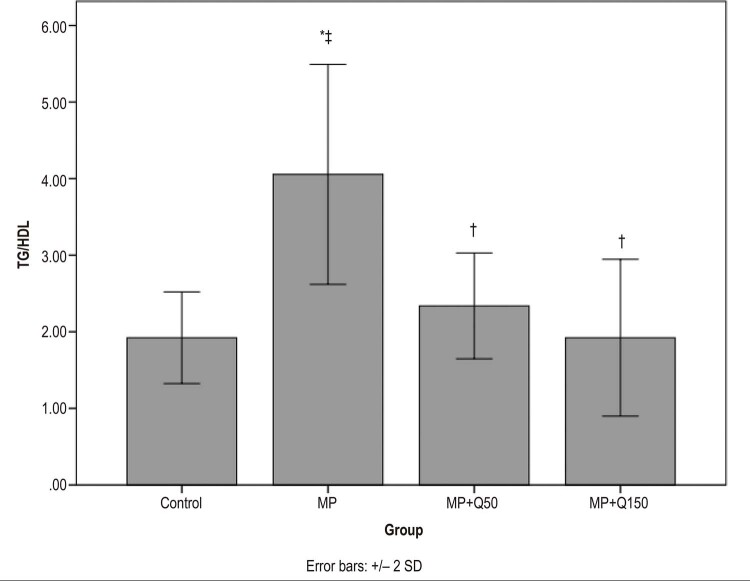
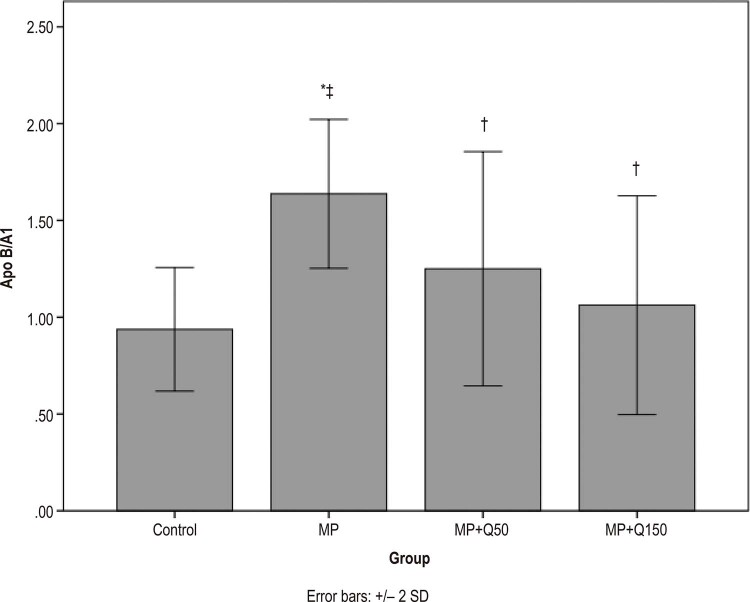
Após seis semanas de injeção de metilprednisolona, os níveis médios de colesterol e triglicérides no plasma aumentaram drasticamente em animais tratados com glicocorticoides, em comparação com o grupo controle. Ambas as doses de quercetina (50 e 150 mg/kg) melhoraram a hipercolesterolemia e a hipertrigliceridemia em comparação com o grupo MP, e a mesma tendência foi observada nos níveis de LDL. Além disso, a injeção de MP causou um aumento moderado nos níveis de HDL, os quais não sofreram alteração significativa após a suplementação com quercetina. No entanto, a redução das razões CT/HDL, TG/HDL e LDL/HDL foi estatisticamente e clinicamente significativa. Além disso, a razão Apo B/A1 diminuiu mais de 20% após a ingestão de quercetina ( Tabela 2 ; Figuras 1-3 ). Parece que uma dose mais alta de quercetina não possui superioridade visível para a melhora do colesterol e apolipoproteínas. No entanto, foi encontrada uma correlação negativa entre a dose de quercetina e TG, bem como a razão CT/HDL (-0,87 e -0,75, respectivamente).
Tabela 2. – Perfil lipídico dos grupos experimentais após seis semanas de intervenção.
| Controle | MP | MP+Q50 | MP+Q150 | Valor de p | |
|---|---|---|---|---|---|
| CT (mg/dl) | 89,12±3,35 | 193,50±12,77*,‡ | 108,75±15,47*,† | 105,87±11,25*,† | <0,001 |
| HDL (mg/dl) | 34,25±3,69 | 41,37±5,75* | 38,25±4,77 | 39,00±4,07 | =0,03 |
| LDL (mg/dl) | 41,87±3,79 | 119,22±12,70*,‡ | 52,72±15,15† | 52,22±10,87† | <0,001 |
| TG (mg/dl) | 65,00±4,34 | 164,50±9,36*,‡ | 88,87±12,93*,† | 73,25±11,33†,‡ | <0,001 |
| CT/HDL | 2,62±0,27 | 4,76±0,86*,‡ | 2,86±0,42† | 2,74±0,47†,‡ | <0,001 |
| TG/HDL | 1,92±0,29 | 4,05±0,71*,‡ | 2,33±0,34† | 1,92±0,51† | <0,001 |
| LDL/HDL | 1,24±0,23 | 2,95±0,73*,‡ | 1,39±0,43† | 1,36±0,38† | <0,001 |
| Apo B/ Al | 0,93±0,16 | 1,63±0,19*,‡ | 1,25±0,30† | 1,06±0,28† | <0,001 |
Os dados são apresentados como Média ± DP. n = 8 para todos os grupos. MP: metilprednisolona; Q50: quercetina 50 mg/kg; Q150: quercetina 150 mg/kg; CT: colesterol total; TG: triglicerídeos; HDL: lipoproteína de alta densidade; LDL: lipoproteína de baixa densidade; ApoB/Al: razão Apolipoproteína B para Apolipoproteína Al; Análise de variância (ANOVA) seguida pelo teste de Bonferroni. *p <0,05 comparado ao grupo controle, †p <0,05 comparado ao grupo MP, ‡p <0,05 comparado ao MP + Q50.
Figura 1. – Média da razão colesterol total/HDL em diferentes grupos. Dados apresentados como Média ± DP. N = 8 para todos os grupos. MP: metilprednisolona; Q50: quercetina 50 mg/kg; Q150: quercetina 150 mg/kg; CT: colesterol total; HDL: lipoproteína de alta densidade; *p<0,05 comparado ao grupo controle, †p<0,05 comparado ao grupo MP, ‡p<0,05 comparado ao MP + Q50.
Discussão
Nossos resultados revelaram que a administração de altas doses de glicocorticoide por 6 semanas aumentou drasticamente a concentração sérica de colesterol total, LDL e triglicérides. No entanto, a suplementação oral com duas doses diferentes de quercetina, como uma flavona de ocorrência natural tendo sido anteriormente relatada como benéfica na síndrome metabólica, reverteu de maneira evidente os efeitos indesejáveis da metilprednisolona. Foram escolhidas diferentes doses de quercetina, uma vez que a dose mais baixa pode ser fornecida por uma dieta rica em quercetina e a mais alta pode ser conseguida com a utilização de suplementos disponíveis comercialmente.18 Desnecessário dizer que a diferente taxa metabólica de ratos e humanos foi levada em consideração para a determinação da dose.19 Os resultados finais indicaram que 150 mg/kg de quercetina não foram muito mais eficazes que 50 mg/kg para melhorar o perfil lipídico, exceto pela concentração de TG, que desceu ao nível dos controles como resultado da administração de doses elevadas de quercetina. A metilprednisolona também causou um aumento moderado no nível de HDL, o qual não foi alterado significativamente após a suplementação com quercetina.
Embora o impacto hiperlipidêmico dos GCs tenha sido observado nas últimas décadas, os mecanismos moleculares ainda não são bem reconhecidos. Alguns estudos in vitro e in vivo demonstraram que esses fármacos anti-inflamatórios podem aumentar diretamente a produção hepática de HDL, up-regular a atividade da lipoproteína lipase e prejudicar o catabolismo do LDL, reduzindo a expressão e a atividade dos receptores hepáticos de LDL.15 , 20 Consequentemente, contribuem para o desenvolvimento de fígado gorduroso, aumentando a síntese de ácidos graxos e diminuindo a β-oxidação.21
Por outro lado, os flavonoides têm sido descritos como moduladores do metabolismo lipídico. Eles atuam principalmente através da inibição da fosfodiesterase, alteração da absorção hepática de colesterol e produção e secreção de triglicérides.22 - 25 Além disso, a quercetina, como um potente antioxidante distribuído tanto na bicamada lipídica quanto na fase aquosa da célula, pode suprimir a peroxidação lipídica pela atividade de eliminação de radical.26 Grandes estudos demonstraram que a razão Apo B/Al é superior ao colesterol total e TG para prever o risco cardiovascular em ambos os sexos e em todas as faixas etárias.27 Considerando que a razão Apo B/Al é uma medida do número de partículas aterogênicas de Apo B sobre o número de partículas anti-aterogênicas de Apo Al, existe também a possibilidade de a mesma ser um fator mais importante que a quantidade de lipídios transportada por partícula. No presente estudo, a ingestão de quercetina diminuiu significativamente a razão Apo B/AI, o que pode ser um importante indicador de menor risco cardiovascular no futuro.27 , 28
Ao final da intervenção, todos os animais tratados com glicocorticoides apresentaram uma redução significativa de peso em comparação aos seus controles, o que pode ter sido causado por anorexia induzida por glicocorticoides nos ratos, relatada anteriormente,29 ou por proteólise e perda muscular graves.30 Uma das limitações deste estudo foi a falta de dados precisos sobre a ingestão alimentar dos animais, o que poderia ser muito útil para a interpretação da perda de peso induzida por GC nos ratos. No geral, nossos achados estão de acordo com estudos anteriores que relataram efeitos benéficos dos flavonoides no metabolismo lipídico.31 Esta é a primeira pesquisa que avalia o impacto da quercetina na hiperlipidemia induzida por GC. No entanto, o efeito hipolipidêmico de alguns outros flavonoides foi relatado em ratos tratados com GC.32 Outras propriedades favoráveis da quercetina na melhora da densidade óssea e na modificação da glicemia tornam esse flavonoide uma excelente opção para controlar os efeitos colaterais dos glicocorticoides.33
Conclusão
A administração de quercetina, em doses de 50 e 150 mg/kg, pode reverter os efeitos indesejáveis de altas doses de glicocorticoides no perfil lipídico de ratos e pode ser considerada para terapia combinada com GCs para minimizar a dislipidemia resultante.
Figura 2. – Média da razão triglicerídeos para HDL em diferentes grupos. Dados apresentados como Média ± EP. n = 8 para todos os grupos. MP: metilprednisolona; Q50: quercetina 50 mg/kg; Q150: quercetina 150 mg/kg; TG: triglicerídeos; HDL: lipoproteína de alta densidade; *p<0,05 comparado ao grupo controle, †p<0,05 comparado ao grupo MP, ‡p<0,05 comparado ao MP + Q50.
Figura 3. – Média da razão de Apolipoproteína B para Apolipoproteína Al em diferentes grupos. Dados apresentados como Média ± EP. n = 8 para todos os grupos. MP: metilprednisolona; Q50: quercetina 50 mg/kg; Q150: quercetina 150 mg/kg; ApoB/Al: razão Apolipoproteína B para Apolipoproteína Al; *p<0,05 comparado ao grupo controle, †p<0,05 comparado ao grupo MP, ‡p<0,05 comparado ao MP + Q50.
Vinculação acadêmica
Este artigo é parte de dissertação de Mestrado de Hoda Derakhshanian pela Tehran University of Medical Sciences.
Aprovação ética e consentimento informado
Este estudo foi aprovado pelo Comitê de Ética do Tehran University of Medical Sciences sob o número de protocolo 11157. Todos os procedimentos envolvidos nesse estudo estão de acordo com a Declaração de Helsinki de 1975, atualizada em 2013.
Fontes de financiamento
Este artigo é financiado pelo Tehran University of Medical Sciences.
ERRATA
Edição de Julho de 2020, vol. 115 (1), págs. 102-108
No Artigo Original “Quercetina Melhora o Perfil Lipídico e Apolipoproteico em Ratos Tratados com Glicocorticóides em Altas Doses” com, número de DOI: https://doi.org/10.36660/abc.20180397, publicado no periódico Arquivos Brasileiros de Cardiologia, 115(1):102-108, na página 102, incluir mais uma afiliação para o autor Ahmad Reza Dehpour. Incluir a instituição: Experimental Medicine Research Center, Tehran University of Medical Sciences, Tehran, Irã.
Referências
- 1.1. Arafah BM. Pharmacology of glucocorticoids. In: Levine A, editor. Adrenal disorders. Contemporary endocrinology. Cham: Humana Press; 2018. p. 67-81.
- 2.2. Moghadam-Kia S, Werth VP. Prevention and treatment of systemic glucocorticoid side effects. Int J Dermatol. 2010;49(3):239-48. [DOI] [PMC free article] [PubMed]
- 3.3. Staels B, van Tol A, Chan L, Verhoeven G, Auwerx J. Variable effects of different corticosteroids on plasma lipids, apolipoproteins, and hepatic apolipoprotein mRNA levels in rats. Arterioscler Thromb. 1991;11(3):760-9. [DOI] [PubMed]
- 4.4. Yadav A, Jahan A, Yadav TP, Sachdev N, Chitkara A, Asare R. Effect of glucocorticoids on serum lipid profile and endothelial function and arterial wall mechanics. Indian J Pediatr. 2013;80(12):1007-14. [DOI] [PubMed]
- 5.5. Bentz AB. A Review of quercetin: chemistry, antioxident properties, and bioavailability. J Young Investig. 2009 apr.
- 6.6. Shah PM, Priya VV, Gayathri R. Quercetin-a flavonoid: a systematic review. J Pharm Sci Res. 2016;8(8):878-80.
- 7.7. D’Andrea G. Quercetin: a flavonol with multifaceted therapeutic applications? Fitoterapia. 2015 Oct;106:256-71. [DOI] [PubMed]
- 8.8. Li Y, Yao J, Han C, Yang J, Chaudhry MT, Wang S, et al. Quercetin, inflammation and immunity. Nutrients. 2016;8(3):167. [DOI] [PMC free article] [PubMed]
- 9.9. David AVA, Arulmoli R, Parasuraman S. Overviews of biological importance of quercetin: a bioactive flavonoid. Pharmacogn Rev. 2016;10(20):84-9. [DOI] [PMC free article] [PubMed]
- 10.10. Ginwala R, Bhavsar R, Chigbu DI, Jain P, Khan ZK. Potential role of flavonoids in treating chronic inflammatory diseases with a special focus on the anti-inflammatory activity of apigenin. Antioxidants. 2019;8(2):pii:E35. [DOI] [PMC free article] [PubMed]
- 11.11. Javanbakht MH, Djalali M, Daneshpazhooh M, Zarei M, Eshraghian MR, Derakhshanian H, et al. Evaluation of antioxidant enzyme activity and antioxidant capacity in patients with newly diagnosed pemphigus vulgaris. Clin Exp Dermatol. 2015;40(3):313-7. [DOI] [PubMed]
- 12.12. Santhakumar AB, Battino M, Alvarez-Suarez JM. Dietary polyphenols: structures, bioavailability and protective effects against atherosclerosis. Food Chem Toxicol. 2018 Mar;113:49-65. [DOI] [PubMed]
- 13.13. Sahebkar A. Effects of quercetin supplementation on lipid profile: a systematic review and meta-analysis of randomized controlled trials. Crit Rev Food Sci Nutr. 2017;57(4):666-76. [DOI] [PubMed]
- 14.14. National Research Council. Guide for the care and use of laboratory animals. 8th ed. Washington (DC): National Academies Press; 2011.
- 15.15. Hazra A, Pyszczynski NA, DuBois DC, Almon RR, Jusko WJ. Modeling of corticosteroid effects on hepatic low-density lipoprotein receptors and plasma lipid dynamics in rats. Pharm Res. 2008;25(4):769-80. [DOI] [PMC free article] [PubMed]
- 16.16. Green C, Knight J, Precious S, Simpkin S. Ketamine alone and combined with diazepam or xylazine in laboratory animals: a 10 year experience. Lab Anim. 1981;15(2):163-70. [DOI] [PubMed]
- 17.17. Friedewald WT, Levy RI, Fredrickson DS. Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge. Clin Chem. 1972;18(6):499-502. [PubMed]
- 18.18. de Vrie JH, Janssen PL, Hollman PC, van Staveren WA, Katan MB. Consumption of quercetin and kaempferol in free-living subjects eating a variety of diets. Cancer Lett. 1997;114(1-2):141-4. [DOI] [PubMed]
- 19.19. Nair AB, Jacob S. A simple practice guide for dose conversion between animals and human. J Basic Clin Pharm. 2016;7(2):27-31. [DOI] [PMC free article] [PubMed]
- 20.20. Sholter DE, Armstrong PW. Adverse effects of corticosteroids on the cardiovascular system. Can J Cardiol. 2000;16(4):505-11. [PubMed]
- 21.21. Van De Wier B, Koek GH, Bast A, Haenen GR. The potential of flavonoids in the treatment of non-alcoholic fatty liver disease. Crit Rev Food Sci Nutr. 2017;57(4):834-55. [DOI] [PubMed]
- 22.22. Seiva FR, Chuffa LG, Braga CP, Amorim JP, Fernandes AA. Quercetin ameliorates glucose and lipid metabolism and improves antioxidant status in postnatally monosodium glutamate-induced metabolic alterations. Food Chem Toxicol. 2012;50(10):3556-61. [DOI] [PubMed]
- 23.23. Peluso MR. Flavonoids attenuate cardiovascular disease, inhibit phosphodiesterase, and modulate lipid homeostasis in adipose tissue and liver. Exp Biol Med. 2006;231(8):1287-99. [DOI] [PubMed]
- 24.24. Rivera L, Morón R, Sánchez M, Zarzuelo A, Galisteo M. Quercetin ameliorates metabolic syndrome and improves the inflammatory status in obese Zucker rats. Obesity. 2008;16(9):2081-7. [DOI] [PubMed]
- 25.25. Mbikay M, Mayne J, Sirois F, Fedoryak O, Raymond A, Noad J, et al. Mice fed a high-cholesterol diet supplemented with quercetin-3-glucoside show attenuated hyperlipidemia and hyperinsulinemia associated with differential regulation of PCSK9 and LDLR in their liver and pancreas. Mol Nutr Food Res. 2018;62(9):1700729. [DOI] [PubMed]
- 26.26. Ishisaka A, Ichikawa S, Sakakibara H, Piskula MK, Nakamura T, Kato Y, et al. Accumulation of orally administered quercetin in brain tissue and its antioxidative effects in rats. Free Radic Biol Med. 2011;51(7):1329-36. [DOI] [PubMed]
- 27.27. Sathe CA, Chogle SA, Bharadwaj D. Apo B/Apo A1 ratio: a risk marker in patients with cardiovascular disease. Int J Res Med. 2017;6(2):20-3.
- 28.28. Panayiotou A, Griffin M, Georgiou N, Bond D, Tyllis T, Tziakouri-Shiakalli C, et al. ApoB/ApoA1 ratio and subclinical atherosclerosis. Int Angiol. 2008;27(1):74-80. [PubMed]
- 29.29. Simpson CW, Dicara LV, Wolf G. Glucocorticoid anorexia in rats. Pharmacol Biochem Behav. 1974;2(1):19-25. [DOI] [PubMed]
- 30.30. Löfberg E, Gutierrez A, Wernerman J, Anderstam B, Mitch WE, Price SR, et al. Effects of high doses of glucocorticoids on free amino acids, ribosomes and protein turnover in human muscle. Eur J Clin Invest. 2002;32(5):345-53. [DOI] [PubMed]
- 31.31. Sangeetha KSS, Reddy CUM, Kalkura SN. Flavonoids: therapeutic potential of natural pharmacological agents. Int J Pharm Sci Res. 2016;7(10):3924-30.
- 32.32. Dugani AM, Alkhetally WI, Elghedafi EO, Alkayed FW. Effects of the aqueous extract from Abelmoschus esculentus L peel on hyperglycemia and hyperlipidemia induced by dexamethasone in rats. Libyan Int. Med. Univ. J. 2018;3(1):3-7.
- 33.33. Derakhshanian H, Djalali M, Djazayery A, Nourijelyani K, Ghadbeigi S, Pishva H, et al. Quercetin prevents experimental glucocorticoid-induced osteoporosis: a comparative study with alendronate. Can J Physiol Pharmacol. 2013;91(5):380-5. [DOI] [PubMed]