Abstract
目的
:研究酱头对乙醇诱导的人胃上皮细胞(GES-1)的保护作用及其抗大鼠胃溃疡的作用和机制。
方法
:将细胞分为正常对照组、模型对照组、酱头95%醇提物组、酱头50%醇提物组、酱头水煎提取物组,采用1%乙醇建模,MTT法检测GES-1细胞增殖情况。60只SD大鼠随机分为正常对照组、模型对照组、雷尼替丁组,酱头95%醇提物小、中、大剂量组(150、300、600 mg/kg),连续灌胃14 d。采用无水乙醇建模,比较各组大鼠胃溃疡面积及溃疡抑制率;扫描电镜观察胃黏膜损伤程度;酶联免疫吸附测定法检测血清中肿瘤坏死因子(TNF)-α、白介素(IL)-6、IL-1β水平,胃组织中丙二醛(MDA)含量,超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、过氧化氢酶(CAT)活性。
结果:
三种酱头提取物中,酱头95%醇提物对于GES-1细胞的保护作用最强。动物实验中,与正常对照组比较,模型对照组胃黏膜上出现大量溃疡,而酱头95%醇提物各剂量组及雷尼替丁组溃疡面积较模型对照组明显减小(均 P<0.05)。与模型对照组比较,酱头95%醇提物各剂量组及雷尼替丁组均可明显降低大鼠血清中TNF-α、IL-1β和IL-6水平及胃组织中MDA含量,提高胃组织中SOD、CAT、GSH活性(均 P<0.05)。
结论
:酱头95%醇提物可通过降低血清中TNF-α、IL-1β和IL-6水平及胃组织中MDA含量,提高胃组织中SOD、CAT、GSH活性,起到治疗乙醇诱导胃溃疡的作用。
Abstract
Objective
: To investigate the protective effect of Fallopia denticuta(FD) against ethanol-induced gastric ulcer and its mechanism.
Methods
: Human gastric epithelial GES-1 cells were divided into normal control group, model control group, FD 95% alcohol extract group, FD 50% alcohol extract group and FD decoction extract group. Gastric ulcer was induced by treatment with 1% ethanol in GES-1 cells. The cell proliferation was detected with MTT method in each group. Sixty SD rats were randomly divided into normal control group, model control group, ranitidine group and low-dose, medium-dose, high-dose FD 95% alcohol extract groups (150, 300, 600 mg/kg). The corresponding drugs were administrated by gavage for 14 d. The gastric ulcer model was induced by intragastric administration of anhydrous ethanol. The gastric ulcer area and ulcer inhibition rate of rats were measured in each group; the degree of gastricmucosal damage was observed by scanning electron microscopy; the levels of tumor necrosis factor (TNF)-α, interleukin (IL)-6, IL-1β in serum and the content of malondialdehyde (MDA), superoxide dismutase (SOD), glutathione (GSH), catalase (CAT) in gastric tissues were detected by ELISA method.
Results
: 95% alcohol extract of FD had the strongest protective effect on proliferation of GES-1 cells. In animal experiments, compared with the normal control group, a large area of ulcers appeared on the gastric mucosa in the model control group, while the ulcer areas of the FD groups and ranitidine group were significantly smaller than that of the model control group (all P<0.05). Compared with the model control group, FD groups and ranitidine group significantly reduced the levels of TNF-α, IL-1β, IL-6 in serum and the MDA content in the gastric tissues, and increased the activity of SOD, CAT and GSH in gastric tissues (all P<0.05).
Keywords: Gastric ulcer, Fallopia denticuta, Anti-inflammation, Antioxidant, GES-1 cells, Rats
无特定病原体(specific pathogen free,SPF);超氧化物歧化酶(superoxide dismutase,SOD);丙二醛(malondialdehyde,MDA);谷胱甘肽(glutathione,GSH);过氧化氢酶(catalase,CAT);肿瘤坏死因子(tumor necrosis factor,TNF);白介素(interleukin,IL);酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA);
酱头,又名绛头、赤地胆,大红药,为云南省彝族民间常用中草药,来源于蓼科何首乌属植物齿叶蓼[ F. denticuta (Huang) A.J.Li]的块根,其性味苦、寒,中医学理论认为其具有健脾和中、清热解毒、调经止血的作用。酱头主要分布于云南、贵州,其含有甾体、酚酸、黄烷醇及酰胺等多种活性成分 [1] ,民间用于治疗痢疾、消化不良和慢性肝炎 [2] 。酱头具有收敛、止泻、消炎、止痛的作用 [3] ,由此推测酱头可能具有治疗胃溃疡的作用。本研究通过乙醇诱导的GES-1细胞损伤模型对三种酱头提取物的活性进行初筛,根据初筛结果进行大鼠体内抗胃溃疡实验,探究酱头抗胃溃疡作用及机制,以期为酱头中药资源的开发和利用提供理论依据。
1材料与方法
1.1动物、试剂和仪器
SPF级健康雄性SD大鼠60只,5~6周龄,体重为(200±20) g,购自昆明医科大学SPF实验动物中心,动物生产许可证号:SCXK (滇) K 2015-0005。大鼠饲养于SPF级动物房7 d以适应实验室环境,垫料每2 d更换一次,自由摄食及饮水。大鼠造模前禁食不禁水24 h。人胃上皮细胞(GES-1)购自中国细胞资源库。
酱头根块采自云南文山,经昆明理工大学生命科学与技术学院崔秀明研究员鉴定为蓼科何首乌属植物齿叶蓼的块根。DMEM高糖培养基(批号AAG203799)、四甲基偶氮唑盐(批号M2123)为美国Thermo Hyclone公司产品;胎牛血清(批号20190724)为天津海硕源科技有限公司产品;戊巴比妥钠为北京华业寰宇化工有限公司产品;雷尼替丁胶囊(批号H44021173)为广东恒建制药有限公司产品;SOD试剂盒(批号20191116)、MDA试剂盒(批号20191116)、微量还原型GSH试剂盒(批号20191114)、CAT试剂盒(批号20191115)为南京建成生物工程研究所产品;TNF-α试剂盒(批号1910037R)、IL-6试剂盒(批号1910019R)、IL-1β试剂盒(批号1910026R)为江苏酶免实业有限公司产品。
JE3002电子天平为上海浦春计量仪器有限公司产品;AX124ZH分析天平为常州奥豪斯仪器有限公司产品;Excelsior AS真空组织脱水机、HM340E石蜡切片机为美国ThermoFisher Scientific公司产品;JB-P5包埋机为武汉俊杰电子有限公司产品;SU8100扫描电子显微镜为日本日立公司产品;CB 1400V医用洁净工作台为苏洁医疗器械(苏州)有限公司产品;CO 2-80A-IR型培养箱为上海丙林电子科技有限公司产品。
1.2酱头提取物的制备
称取适量酱头粉末,分别以95%、50%乙醇溶液浸提以及水煎提取,提取液减压浓缩后得到酱头95%醇提物、酱头50%醇提物、酱头水煎提取物,各称取1 mg,加入0.1%二甲基亚砜的无血清培养基定容至1 mL。
1.3细胞实验观察三种酱头提取物的活性
将细胞从液氮中取出,于37 ℃烘箱中融化1 min,吸出细胞悬液,加入含有4 mL培养基的EP管中,抽吸混匀,150× g离心5 min,吸出上清液,加入含有4 mL培养基的EP管中,抽吸混匀后加入直径6 cm培养皿中,于37 ℃、5%二氧化碳培养箱中培养24 h。次日,吸出旧培养基溶液,加入无菌磷酸盐缓冲液洗涤细胞,加入新的培养基溶液,继续培养 [4] 。以含10%胎牛血清、0.1%二甲基亚砜、1%青‒链霉素的DMEM培养基培养细胞至对数生长期,以胰蛋白酶消化后,传代。
将细胞分为正常对照组、模型对照组、酱头95%醇提物组、酱头50%醇提物组、酱头水煎提取物组,以1×10 5/个孔的密度分别接种于96孔板中,于37 ℃、5%二氧化碳培养箱中培养24 h。弃旧培养基,每孔中加入含抗生素培养基溶液100 μL,酱头95%醇提物组、酱头50%醇提物组、酱头水煎提取物组分别加入1 mg/mL酱头50%醇提物、酱头95%醇提物、酱头水煎提取物溶液100 μL,培养2 h,除正常对照组外其他各组加入适量1%乙醇溶液并继续培养24 h [5] 。更换培养基溶液,加入20 μL的MTT溶液,37 ℃、5%二氧化碳培养箱中培养5 h。将96孔板取出,吸出上层液体,酶标仪测定490 nm波长下的吸光度值, 计算细胞增殖率。细胞增殖率%=(实验组吸光度值–正常对照组吸光度值)/正常对照组吸光度值×100%。
1.4动物实验观察三种酱头醇提物对胃溃疡的作用
1.4.1动物分组及给药
将60只雄性SD大鼠随机分成正常对照组(等渗氯化钠溶液+0.2%吐温-80)、模型对照组(等渗氯化钠溶液+0.2%吐温-80)、雷尼替丁组(150 mg/kg雷尼替丁溶液+0.2%吐温-80) [6] 、酱头95%醇提物小、中、大剂量组(150、300、600 mg/kg酱头95%醇提物+0.2%吐温-80)。各组均灌胃给药14 d,每日1次。各组大鼠均于第13天灌胃后禁食不禁水。第14天给药后1 h,正常对照组灌胃0.5 mL/100 g等渗氯化钠溶液,其余大鼠均灌胃0.5 mL/100 g无水乙醇造模 [7] ,通过观察胃黏膜组织形态判定造模成功与否。
1.4.2ELISA检测大鼠血清TNF-α、IL-1β、IL-6水平
造模后1 h,各组大鼠腹腔注射3%戊巴比妥钠45 mg/kg麻醉,腹主动脉采血,1500× g离心15 min,吸出血清液,–80 ℃冰箱保存待测。血清4 ℃解冻后,ELISA测定各组大鼠血清TNF-α、IL-1β及IL-6水平。
1.4.3肉眼观察胃组织溃疡情况
造模取血后将大鼠脱臼处死,剪下胃组织,沿胃大弯剪开,用冰等渗氯化钠溶液将胃黏膜清洗干净,肉眼观察各组胃黏膜的损伤情况,拍照。应用ImageJ软件测定胃黏膜溃疡面积,同时计算溃疡抑制率,溃疡抑制率(%)=(模型对照组平均溃疡面积–实验组平均溃疡面积)/模型对照组平均溃疡面积×100% [8] 。剪取适量大小的胃组织于标记好的脱水盒中,浸泡于4%多聚甲醛中,以便后续制作病理切片。剩余组织于–80 ℃冰箱中保存备用。
1.4.4ELISA检测大鼠胃黏膜组织MDA含量及SOD、GSH、CAT活性
剪取适量胃组织,称重,液氮下研磨至粉碎,按质量∶体积 = 1∶9加入等渗氯化钠溶液,得10%的组织匀浆液,4 ℃、13 000× g离心10 min,吸取上清液,测定MDA含量及SOD、GSH、CAT活性。检测步骤均严格按试剂盒说明书进行。
1.4.5苏木精-伊红染色电镜下观察胃黏膜组织病理学改变
取出固定液中的胃组织,用自来 水冲洗30 min,真空组织脱水机中脱水:30%、 50%、75%乙醇各2 h,85%、90%、95%乙醇各1.5 h, 无水乙醇脱水两次,每次各1 h,二甲苯透明两次,各20 min,熔融石蜡浸泡两次,各1 h。包埋,将胃组织从脱水盒内取出并放入包埋框中,倒入熔融石蜡,蜡凝固后取出并修整蜡块,切片机切片,厚5 μm。40 ℃温水上将组织展平,载玻片捞起切片,60 ℃烘箱内烤片。切片透明、复水,自来水洗。苏木素、伊红染色,脱水透明,中性树胶封片。扫描电镜镜检,图像采集分析。
1.5统计学方法
应用SPSS 20.0软件进行统计分析。正态分布的计量资料以均数±标准差( )表示,组间比较采用ANOVA单因素方差分析, P<0.05为差异有统计学意义。
2结果
2.1三种酱头提取物活性初筛结果
加入乙醇后,模型对照组细胞增殖率为–18%, 说明乙醇使GES-1细胞大量死亡,细胞呈负增殖状态,造模成功。酱头50%醇提物组、酱头95%醇提物组、酱头水煎提取物组细胞增殖率提高至 113%、153%、52%,均高于模型对照组(均 P< 0.01)。结果提示,三种酱头提取物均可保护GES-1 细胞,减少乙醇的伤害,其中酱头95%醇提物保护作用最强(均 P<0.05)。
2.2各组大鼠胃黏膜损伤大体观察结果
正常对照组胃黏膜较厚,呈淡粉色,有较多褶皱,无出血点;模型对照组胃黏膜出现大量条状溃疡,宽度约为2 mm,纵穿整个胃黏膜部分,胃黏膜松弛、变薄,损伤严重,说明造模成功;雷尼替丁组及酱头95%醇提物各剂量组胃黏膜损伤有明显改善,尤其是大剂量组胃黏膜表面光滑有褶皱,仅有少量出血点。见 图1。各组溃疡面积和溃疡抑制率见 表1。模型对照组溃疡面积最大,雷尼替丁组及酱头95%醇提物大、中、小剂量组溃疡面积较模型对照组减小(均 P<0.01);酱头95%醇提物各剂量组溃疡面积均小于雷尼替丁组(均 P<0.01);随着剂量增加,酱头95%醇提物各组溃疡面积依次减小。结果提示,酱头提取物能改善乙醇造成的胃黏膜损伤,且药效呈现剂量依赖性。
图 1 .
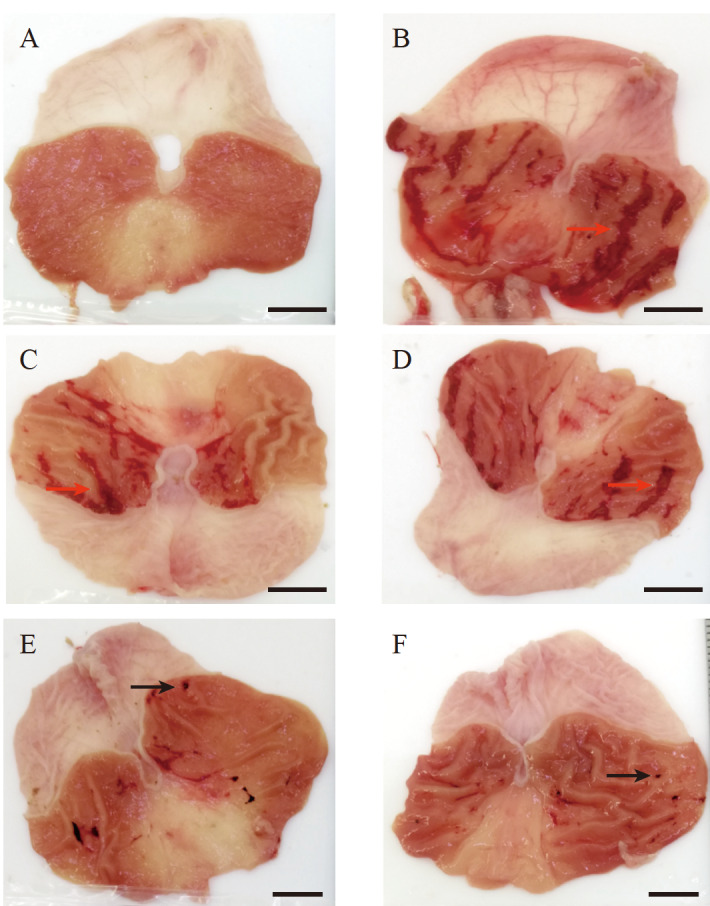
各组大鼠胃黏膜损伤情况A:正常对照组; B:模型对照组; C:雷尼替丁组; D:酱头95%醇提物小剂量组; E:酱头95%醇提物中剂量组; F:酱头95%醇提物大剂量组. 图中深红色和黑色的部分为溃疡(红色箭头指示条状溃疡,黑色箭头指示点状溃疡). 正常对照组无溃疡,胃黏膜形态正常; 模型对照组出现大量溃疡; 雷尼替丁及酱头提取物各剂量组溃疡均较模型对照组减少. 标尺=10 mm.
表 1 各组大鼠胃黏膜溃疡面积及溃疡抑制率比较
Table 1 Gastric mucosal ulcer areas and ulcer inhibition rates in each group
( , n=10)
|
组 别 |
溃疡面积(mm 2) |
溃疡抑制率(%) |
|
正常对照组 |
0 |
— |
|
模型对照组 |
291±98 |
— |
|
雷尼替丁组 |
155±37 ** |
51±9 |
|
酱头95%醇提物 |
||
|
小剂量组 |
114±23 ** ## |
47±8 |
|
中剂量组 |
93±20 ** ## |
69±9 ## |
|
大剂量组 |
55±11 ** ## |
82±3 ## |
“—”:无相关数据. 与模型对照组比较, ** P<0.01;与雷尼替丁组比较, ## P<0.01.
2.3各组大鼠胃组织病理学观察结果
正常对照组胃黏膜组织黏膜层结构完整,黏膜上皮细胞未见脱落,胃腺数量丰富,排列规整紧密,清晰可见,上皮细胞形态正常,无坏死,黏膜层未见明显损伤,黏膜下层无水肿,无炎症细胞浸润;模型对照组组织黏膜层有损伤,局部黏膜上皮细胞脱落,胃腺排列疏松,可见较多胃腺上皮细胞坏死,细胞核固缩深染或碎裂溶解,间质可见出血,黏膜下层纤维结缔组织疏松,大量炎症细胞浸润;雷尼替丁及酱头95%醇提物大、中、小剂量组大鼠胃黏膜损伤情况明显改善,上皮细胞少见脱落,黏膜表面黏膜层结构完整,少有出血点,尤其是大剂量组几乎未见出血性损伤,腺体无损伤,黏膜下层无明显水肿,炎症细胞轻微浸润。见 图2。结果提示,雷尼替丁及酱头95%醇提物均具有较好的胃黏膜保护作用。
图 2 .
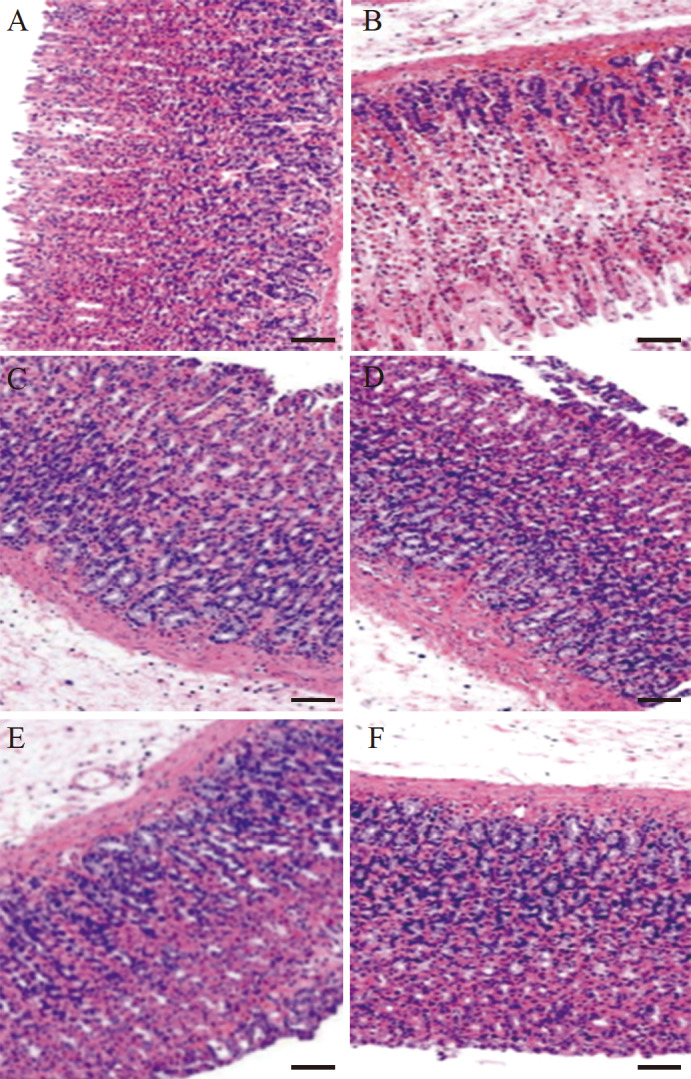
各组大鼠胃黏膜病理学改变(HE染色)A:正常对照组; B:模型对照组; C:雷尼替丁组; D:酱头95%醇提物小剂量组; E:酱头95%醇提物中剂量组; F:酱头95%醇提物大剂量组. 正常对照组无间质出血及细胞坏死,细胞形态正常; 模型对照组细胞间质出血增加;雷尼替丁及酱头95%醇提物各剂量组间质出血均减少. 标尺=20 μm.
2.4各组大鼠血清TNF-α、IL-1β和IL-6水平比较
与正常对照组比较,模型对照组血清TNF-α、IL-1β和IL-6水平升高(均 P<0.01),而酱头95%醇提物各剂量组和雷尼替丁组较模型对照组血清TNF-α、IL-1β和IL-6水平均降低(均 P<0.05),且 大、中、小剂量酱头95%醇提物组血清TNF-α、IL- 1β和IL-6水平随着给药浓度的增加而降低,呈剂量依赖性。见 表2。结果提示,酱头95%醇提物能抑制炎症的发生和蔓延,具有较好的抗炎作用。
表 2 各组大鼠血清TNF-α、IL-1β和IL-6水平比较
Table 2 TNF-α, IL-1β and IL-6 levels in serum of rats in each group
( , n=10,ng/L)
|
组 别 |
TNF-α |
IL-6 |
IL-1β |
|
正常对照组 |
174±20 |
68±21 |
29±9 |
|
模型对照组 |
249±24 ** |
98±13 ** |
67±17 ** |
|
雷尼替丁组 |
212±17 ## |
78±5 ## |
47±5 ## |
|
酱头95%醇提物 |
|||
|
小剂量组 |
218±21 # |
82±11 # |
50±8 # |
|
中剂量组 |
205±10 ## |
75±12 ## |
41±11 ## |
|
大剂量组 |
185±15 ## △ △ |
64±4 ## △ △ |
32±9 ## △ △ |
与正常对照组比较, ** P<0.01;与模型对照组比较, # P<0.05, ## P<0.01;与雷尼替丁组比较, △ △ P<0.01. TNF:肿瘤坏死因子;IL:白介素.
2.5各组大鼠胃黏膜组织MDA含量和SOD、GSH、CAT活性比较
与正常对照组比较,模型对照组胃组织中SOD、GSH、CAT活性下降,MDA含量增加(均 P<0.01),雷尼替丁组和酱头95%醇提物各剂量组胃组织中SOD、GSH、CAT活性较模型对照组增强,MDA含量减少(均 P<0.05),且上述效果随着酱头95%醇提物剂量的改变而变化。见 表3。结果提示,酱头95%醇提物具有较好的抗氧化作用。
表 3 各组大鼠胃黏膜组织MDA含量及SOD、GSH、CAT活性比较
Table 3 Comparison of MDA contents and SOD, GSH, CAT activities in gastric mucosa tissue of rats in each group
( )
|
组 别 |
n |
MDA(nmol/mg) |
SOD(U/mg) |
GSH(μmol/L) |
CAT(U/mg) |
|
正常对照组 |
10 |
0.95±0.24 |
27.06±4.80 |
76.90±10.72 |
4.30±1.17 |
|
模型对照组 |
10 |
3.19±0.49 ** |
10.87±1.67 ** |
19.95±7.28 ** |
1.70±0.26 ** |
|
雷尼替丁组 |
10 |
2.13±0.30 ## |
14.88±2.55 ## |
41.57±8.75 ## |
2.40±0.31 ## |
|
酱头95%醇提物小剂量组 |
10 |
2.61±0.46 # |
13.04±1.39 # |
31.30±11.10 # |
2.10±0.53 # |
|
酱头95%醇提物中剂量组 |
10 |
1.17±0.15 ## △ △ |
19.70±1.94 ## △ △ |
58.34±6.36 ## △ △ |
3.11±0.51 ## △ △ |
|
酱头95%醇提物大剂量组 |
10 |
1.46±0.34 ## △ △ |
22.65±2.16 ## △ △ |
70.75±5.29 ## △ △ |
4.04±0.88 ## △ △ |
与正常对照组比较, ** P<0.01;与模型对照组比较, # P<0.05, ## P<0.01;与雷尼替丁组比较, △ △ P<0.01. MDA:丙二醛;SOD:超氧化物歧化酶;GSH:谷胱甘肽;CAT:过氧化氢酶.
3讨论
胃溃疡是一种胃黏膜攻击因子与保护因子失衡而导致的消化性溃疡,典型症状为上腹部疼痛,呈烧灼样疼痛、反酸、食欲缺乏,常在进食后1 h出现疼痛,经1~2 h后缓解,极易发展为胃癌 [9] 。酱头作为一种民间药,常用于治疗胃痛、内出血等疾病,而胃溃疡的基本症状就是胃痛、胃出血。因此,本研究探究了酱头的抗胃溃疡活性。本研究首先采用乙醇诱导的GES-1细胞损伤模型比较了三种酱头提取物的活性。结果发现,酱头95%醇提物对GES-1细胞保护作用最好。然后,以酱头95%醇提物进行了体内抗胃溃疡实验,探究酱头抗胃溃疡的作用及机制。结果表明,酱头95%醇取物大、中、小剂量组均具有较好的胃黏膜保护作用,均能通过降低炎症因子水平、提高抗氧化因子水平,抑制乙醇诱导大鼠胃溃疡的发生,减轻胃黏膜损伤,从而治疗胃溃疡。
胃黏膜受损出血,胃组织细胞出血坏死,核因子κB信号通路被激活,产生TNF-α、IL-1β和IL-6等多种炎症因子,导致中性粒细胞浸润,黏膜下层水肿,细胞核固缩或溶解,细胞出血、坏死,加剧胃黏膜损伤程度 [ 10- 11] 。IL-6是活化的T细胞和成纤维细胞产生的淋巴因子,也可由激活的单核巨噬细胞产生,胃黏膜受损,单核巨噬细胞激活,产生大量IL-6,高浓度的IL-6会触发体内氧化应激,产生大量的氧自由基。氧自由基是含有一个不成对电子的原子团,这种物质非常活跃,在体内到处夺取其他物质的电子,与各种物质反应,其与生物膜的磷脂、酶和膜受体相关的多不饱和脂肪酸的侧链及核酸等大分子物质起脂质过氧化反应形成大量脂质过氧化产物,如MDA [12] ,这些过氧化产物会使细胞膜失去功能或死亡,也会直接与蛋白质核酸作用,导致细胞甚至器官的病变或死亡。而体内天然的抗氧化剂能直接提供电子使氧自由基还原,迅速消灭自由基,如SOD和CAT就是存在于人体正常组织中清除氧自由基的重要酶系统成分 [10] 。另外,GSH、别嘌呤醇、维生素C、维生素E等均具有清除或抑制氧自由基的作用。本文资料显示,酱头95%醇取物可通过降低TNF-α、IL-1β和IL-6水平,减少炎症细胞浸润,减缓细胞出血、坏死,提高胃黏膜抗乙醇的能力,并通过提高SOD、GSH、CAT活性,抑制和清除体内的氧自由基,减少MDA含量,维护细胞膜屏障,从而达到抗乙醇诱导的胃溃疡的作用。
综上所述,酱头可通过降低TNF-α、IL-1β、IL-6水平和MDA含量,减缓炎症反应,保护胃黏膜;同时提高SOD、GSH、CAT等保护因子的活性,减少氧自由基的聚集,维持细胞膜屏障,达到治疗胃溃疡的效果,其中酱头95%醇提物大剂量组效果甚至优于雷尼替丁。然而,本研究只限于评价酱头提取物抗乙醇诱导的胃溃疡,而导致胃溃疡的原因有很多,如非甾体抗炎药的滥用、幽门螺杆菌的侵袭等。因此,今后需要建立其他类型的胃溃疡模型来进一步论证酱头对胃溃疡的治疗作用,以期为酱头的临床应用提供精准依据。
COMPETING INTERESTS
所有作者均声明不存在利益冲突
Funding Statement
云南省重大科技专项(2018ZF014); 国家自然科学基金(21562029); 国家重点研发计划(2017YFC1701900)
References
- 3.刘 艺. 云南酱头的化学成分及其体外抗炎活性研究[D]. 昆明: 昆明理工大学, 2019 ; LIU Yi. Studies on the chemical constituents and anti-inflammatory activity in vitro from the root of Fallopia denticuta of Yunnan[D]. Kunming: Kunming University of Science and Technology, 2019. (in Chinese)
- 4.唐丽萍, 刘 光, 杨景越, 等. 民族药酱头原植物考证[J]. 中药材, 2006, 29(5): 498-500 ; TANG Liping, LIU Guang, YANG Jingyue, et al. Textual research on the original plants of national medicinal Fallopia denticuta[J]. Chinese Materia Medica, 2006, 29(5): 498-500. (in Chinese)
- 5.唐丽萍, 杨淑达, 胡炜彦, 等. 彝族民间药酱头的生药学鉴定[J]. 云南中医学院学报, 2007, 30(6): 14-17 ; TANG Liping, YANG Shuda, HU Weiyan, et al. Pharmacognosy identification of the folk medicinal Fallopia denticuta of Yi people[J]. Journal of Yunnan College of Traditional Chinese Medicine, 2007, 30(6): 14-17. (in Chinese)
- 6.ZHANG Y, SUN J, DONG Y, et al. Vicenin‐2 inhibits the Helicobacterium pylori infection associated gastric carcinogenic events through modulation of PI3K/AKT and Nrf2 signaling in GES‐1 cells[J/OL] . J Biochem Mol Toxicol. . 2021;35(3):e22680. doi: 10.1002/jbt.22680. [DOI] [PubMed] [Google Scholar]
- 7.刘煜洪. 广藿香醇胃液代谢物β-广藿香烯抗胃溃疡及溃疡性结肠炎的研究[D]. 广州: 广州中医药大学, 2018 ; LIU Yuhong. β-patchoulene, a transformation product of patchouli alcohol in gastric juice, protect against Gastric ulcer and ulcerative colitis[D]. Guangzhou: Guangzhou University of Traditional Chinese Medicine, 2018. (in Chinese)
- 8.沈贵芳, 郭 伟, 赵伟春, 等. 腹水草抗大鼠乙醇型胃溃疡的作用及机制研究[J]. 中国中西医结合杂志, 2012, 32(10): 1370-1373 . [PubMed]; SHEN Guifang, GUO Wei, ZHAO Weichun, et al. Antiulcer effects and mechanism study of veronicastrum axillare on ethanol induced gastric ulcer rats[J]. Chinese Journal of Integrated Traditional Chinese and Western Medicine, 2012, 32(10): 1370-1373. (in Chinese) . [PubMed]
- 9.刘谚哲. 人参多糖对大鼠乙醇诱导胃黏膜损伤的保 护作用及机制研究[D]. 长春: 吉林大学, 2020 ; LIU Yanzhe. Gastroprotective effects and mechanisms of Ginseng polysaccharide on ethanol-induced injury in rats[D]. Changchun: Jilin University, 2020. (in Chinese)
- 10. 马 麟, 张 昕, 陈焕鑫, 等. 沉香提取液对乙醇致大鼠胃溃疡的保护作用及机制[J]. 中国医药导报, 2019, 16(24): 15-18 ; MA Lin, ZHANG Xin, CHEN Huanxin, et al. Protective effect and mechanism of Chinese eaglewood extract on gastric ulcer induced by ethanol in rats[J]. China Medical Herald, 2019, 16(24): 15-18. (in Chinese)
- 11. 巩子汉, 王 强, 段永强, 等. 白及多糖对胃溃疡模型大鼠胃组织TNF-α、IL-1β、IL-6及JNK、p38MAPK基因蛋白表达水平的影响[J]. 中药药理与临床, 2019, 35(4): 90-95 ; GONG Zihan, WANG Qiang, DUAN Yongqiang, et al. Effects of Baiji polysaccharides on the expression levels of TNF-α, IL-1β, IL-6 and JNK, p38MAPK gene protein in gastric tissue of rats with gastric ulcer[J]. Pharmacology and Clinics of Chinese Materia Medica, 2019, 35(4): 90-95. (in Chinese)
- 12.TRINOVITA E, CHANY SAPUTRI F, MUN’IM A. Potential gastroprotective activity of rice bran (oryza sativa L.) extracted by ionic liquid-microwave-assisted extraction against ethanol-induced acute gastric ulcers in rat model[J] Sci Pharm. . 2018;86(3):35. doi: 10.3390/scipharm86030035. [DOI] [PubMed] [Google Scholar]
- 13.陈汉斌. 醇式黄连碱的合成与抗炎、抗胃溃疡作用研究[D]. 广州: 广州中医药大学, 2018 ; CHEN Hanbin. Investigation on the effect of synthetic coptisine free base on anti-inflammation and anti-gastric ulcer[D]. Guangzhou: Guangzhou University of Traditional Chinese Medicine, 2018. (in Chinese)
- 14.XUE Z, SHI G, FANG Y, et al. Protective effect of polysaccharides from Radix Hedysari on gastric ulcers induced by acetic acid in rats[J] . Food Funct. . 2019;10(7):3965–3976. doi: 10.1039/C9FO00433E. [DOI] [PubMed] [Google Scholar]


