Resumen
Objetivos:
Determinar si los pacientes con cardiopatía chagásica (CCh) presentaron choques apropiados del desfibrilador automático implantable (DAI) de manera más precoz que los pacientes con cardiopatía isquémica (CI).
Métodos:
Estudio de cohorte retrospectivo que incluyó los pacientes con CCh y CI en quienes se implantó un DAI entre los años 2009 y 2018 en un hospital de alta complejidad. El seguimiento se realizó hasta los 36 meses, evaluándose el momento del primer choque apropiado del dispositivo.
Resultados:
Se incluyeron 64 pacientes, 20 con CCh y 44 con CI. Se observó que una mayor proporción de pacientes con CCh presentaron choques apropiados durante el primer año (hazard ratio [HR]: 8.4; intervalo de confianza del 95% [IC95%]: 2.09-34.02; p = 0.0027) y a 3 años (HR: 4.61; IC95%: 1.51-14.07; p = 0.0072). El 100% de la población con CCh e implante del DAI como prevención secundaria de muerte súbita presentaron choques apropiados durante los primeros 26 meses de seguimiento.
Conclusiones:
Los pacientes con CCh presentaron choques apropiados del DAI de manera más precoz que los pacientes con CI. Todos los pacientes con CCh y DAI como prevención secundaria presentaron choques apropiados, representando una población de mayor riesgo. Esta información apoya la indicación del DAI en estos pacientes a pesar de la escasa evidencia en ensayos aleatorizados.
Palabras clave: Desfibrilador automático implantable, Cardiopatía chagásica, Enfermedad de Chagas, Cardiopatía isquémica, Muerte súbita
Abstract
Objetives:
To assess if patients with Chagasic heart disease (CHD) received effective automatic implantable defibrillator (AID) shocks earlier than patients with ischemic heart disease (IHD).
Methods:
Retrospective cohort of patients with CHD and IHD who received an implantable cardioverter defibrillator (ICD) between 2009 and 2018, in a tertiary hospital. We evaluated the time between the implant of ICD and the first effective shock in patients with CHD and compared it with the IHD control population.
Results:
We included a total of 64 patients, 20 with CHD and 44 with IHD. CHD patients presented earlier an effective shock than patients with IHD during the first year (hazard ratio [HR]: 8.4; 95% confidence interval [95% CI]: 2.09-34.02; p = 0.0027), and at three years (HR: 4.61; 95% CI: 1.51-14.07; p = 0.0072). 100% of CHD patients who received the ICD as secondary prevention of sudden cardiac death presented an effective shock during the first 26 months of follow-up.
Conclusions:
Patients with CHD received effective ICD shocks earlier than the IHD patients. All patients with CHD and ICD as secondary prevention had an appropriate ICD shock at short term, representing the highest risk population, and supporting the indication of the device in a setting where randomized clinical trials are lacking.
Keywords: Automatic implantable defibrillator, Chagas cardiomyopathy, Chagas disease, Ischemic heart disease, Sudden death
Introducción
Se estima que en la actualidad viven unos 8-10 millones de personas con enfermedad de Chagas en el mundo1. Durante décadas fue una enfermedad desatendida circunscrita a zonas rurales de Latinoamérica2; sin embargo, en los últimos años, los movimientos migratorios y la transmisión no vectorial han hecho que sea diagnosticada en zonas no endémicas, lo que preocupa cada vez más a la comunidad internacional3,4. Se estima que del 20% al 30% de las personas con serología positiva desarrollarán compromiso miocárdico1, siendo la muerte súbita la principal causa de decesos en esta población5. La evidencia para el uso de un desfibrilador automático implantable (DAI) tanto en prevención secundaria como en prevención primaria de la muerte súbita es amplia. En diversos estudios se ha demostrado una reducción del riesgo absoluto de muerte súbita en prevención primaria del 23% y del 4% al 8% en prevención secundaria6,7; sin embargo, los grandes ensayos internacionales tienen como limitante la inclusión mínima o nula de pacientes con cardiopatía de Chagásica (CCh), a diferencia de los sujetos con cardiopatía isquémica (CI), quienes constituyen la mayor población de estos estudios. La evidencia con que contamos actualmente sobre pacientes con CCh y DAI proviene de datos arrojados por estudios prospectivos o retrospectivos, con muestras pequeñas, en los que se observó una alta tasa de terapias apropiadas y de manera más precoz a pesar del manejo antiarrítmico óptimo8. Por otro lado, existe una asociación entre los choques apropiados del DAI y el deterioro de la calidad de vida, la alteración del estado emocional, el incremento de las hospitalizaciones por insuficiencia cardiaca y el aumento de la mortalidad por todas las causas9,10. Sobre la base de estas consideraciones, nuestro objetivo fue determinar si los pacientes con CCh presentan choques apropiados del DAI de manera más precoz que los sujetos con CI.
Método
Diseño del estudio
Estudio de cohorte retrospectivo, observacional y unicéntrico, que incluyó todos los pacientes con diagnóstico de CCh o CI a quienes se implantó un DAI en el servicio de cardiología del Sanatorio Güemes, en Buenos Aires, Argentina, desde noviembre de 2009 hasta octubre de 2018. Se tomó como criterio de valoración principal el primer episodio de choque apropiado del DAI, definido como toda descarga de alta energía administrada como respuesta a una taquiarritmia ventricular sostenida evaluada mediante el interrogatorio del dispositivo. Como criterio de valoración secundario se comparó el tiempo al primer choque del DAI según la estrategia de prevención de muerte súbita (primaria o secundaria), conforme lo establecido en las normativas europeas de prevención de la muerte súbita publicadas en el año 201511. El seguimiento de los pacientes se realizó a través de la historia clínica electrónica institucional, donde se plasma la información acerca del interrogatorio de los dispositivos en cada visita. Se seleccionaron como puntos de corte para evaluar eventos los meses 12 y 36 luego del implante del DAI. La decisión de comparar los pacientes con CCh con una cohorte de sujetos con CI y DAI se basa en el amplio conocimiento que actualmente se tiene sobre el comportamiento del dispositivo en esta última población. No se tuvieron en cuenta para el análisis de los criterios de valoración primario y secundario las terapias antitaquicardia (ATP) por parte del DAI.
Selección de los pacientes
Los pacientes incluidos con diagnóstico de CCh debían tener al menos dos pruebas serológicas diagnósticas diferentes positivas: enzimoinmunoanálisis de adsorción, prueba de inmunofluorescencia o hemoaglutinación indirecta; y además ausencia de enfermedad coronaria y hallazgos electrocardiográficos y ecocardiográficos compatibles con CCh. Los pacientes con CI debían presentar antecedentes de infarto del miocardio o enfermedad coronaria documentados en la historia clínica, y en todos los casos tratados previamente al implante del DAI de acuerdo con las normativas locales. Todos los pacientes incluidos en el presente estudio debían tener un seguimiento mínimo de 12 meses. Los pacientes perdidos en el seguimiento después de los 12 meses, al igual que todos aquellos que aún no cumplían los 36 meses de seguimiento desde la fecha del implante del DAI, fueron incluidos para el análisis de eventos, considerándose el último control cardiológico como momento de censura.
Análisis estadístico
Las variables categóricas se expresaron como frecuencias y proporciones, y las continuas como media y desvío estándar o mediana e intervalo intercuartílico según su tipo de distribución. Los análisis comparativos se realizaron con la prueba de ji al cuadrado o la prueba exacta de Fisher para las variables categóricas, y con la prueba t de Student o la prueba de Mann-Whitney para las continuas, según correspondiera. Se elaboraron curvas de Kaplan-Meier y las diferencias entre grupos se analizaron mediante prueba de log-rank, considerando significativo un valor de p < 0.05. Se realizaron análisis de subgrupos para determinar la influencia de variables como el sexo, la función del ventrículo izquierdo y los fármacos antiarrítmicos sobre los resultados principales de valoración. Los datos se analizaron utilizando los software MedCalc® versión 18.2.1 y Epi Info® versión 7.0.
Resultados
Características generales de la población con DAI
Entre noviembre de 2009 y octubre de 2018 se implantó un DAI a 118 pacientes, de los cuales 22 (18.6%) tenían diagnóstico de CCh y 48 (40.6%) de CI. Se excluyeron del presente análisis dos pacientes del grupo de CCh y cuatro del grupo de CI por tener un seguimiento menor de 1 año. En ningún caso se presentó concomitancia de las dos enfermedades.
Las características basales de las poblaciones con CCh y CI se describen en la tabla 1.
Tabla 1.
Características basales de la población en el momento del implante del DAI
| Característica | Chagas (n = 20) | Isquemia (n = 44) | p |
|---|---|---|---|
| Edad, años (± DE) | 54.6 ± 9.6 | 65.3 ± 9.7 | 0.0001 |
| Sexo masculino | 13 (65%) | 39 (88.6%) | 0.024 |
| Indicación primaria | 14 (70%) | 32 (72.7%) | 0.82 |
| TRC | 0 | 3 (6.8%) | 0.5 |
| Comorbilidad | |||
| Hipertensión arterial | 9 (45%) | 32 (72.7%) | 0.03 |
| Diabetes mellitus | 3 (15%) | 21 (47.7%) | 0.02 |
| Dislipidemia | 2 (10%) | 13 (29.5%) | 0.16 |
| Tabaquismo | 7 (35%) | 28 (63.6%) | 0.032 |
| Fibrilación auricular | 7 (35%) | 8 (18.1%) | 0.14 |
| BAV completo | 3 (15%) | 1 (2.2%) | 0.16 |
| Valvulopatía grave | 0 | 3 (6.8%) | 0.57 |
| ClCr, ml/min (DE) | 83.5 ± 29.1 | 70.2 ± 26.1 | 0.3 |
| Tratamiento | |||
| IECA/ARA II | 14 (70%) | 30 (68.1%) | 0.8 |
| Betabloqueantes | 17 (85%) | 33 (75%) | 0.3 |
| Sacubitril/valsartán | 0 | 1 (2.2%) | 1 |
| Antialdosterónicos | 8 (40%) | 30 (68.1%) | 0.03 |
| Digoxina | 0 | 2 (4.5%) | 0.8 |
| Amiodarona | 16 (80%) | 19 (43%) | 0.006 |
| Ivabradina | 0 | 3 (6.8%) | 0.57 |
| Bloqueantes cálcicos | 2 (10%) | 3 (6.8%) | 1 |
| Estatinas | 3 (15%) | 28 (63.3%) | 0.0008 |
| Furosemida | 5 (25%) | 19 (43.1%) | 0.26 |
| Ecocardiograma | |||
| DDVI, mm (DE) | 65.4 ± 8.2 | 62.6 ± 8.2 | 0.21 |
| FEVI, % (DE) | 37.6 ± 12.8 | 31.2 ± 8.2 | 0.053 |
ARA II: antagonistas de los receptores de la angiotensina; BAV: bloqueo auriculoventricular; ClCr: aclaramiento de creatinina; DDVI: diámetro diastólico del ventrículo izquierdo; DE: desvío estándar; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima convertidora de la angiotensina 2;
TRC: terapia de resincronización.
Choques apropiados por grupo
El periodo de seguimiento considerando los pacientes chagásicos e isquémicos fue de 26.8 ± 11 meses. Durante los primeros 12 meses, el criterio de valoración principal se observó en siete pacientes con CCh (35%) y en tres con CI (6.82%) (hazard ratio [HR]: 8.44; intervalo de confianza del 95% [IC95%]: 2.09-34.02; p = 0.0027) (Fig. 1 y Tabla 2). En el seguimiento a 36 meses, nueve pacientes con CCh (45%) y siete con CI (15%) habían presentado choques apropiados (HR: 4.61; IC95%: 1.51-14.07; p = 0.0072) (Fig. 2 y Tabla 2). El tiempo medio hasta el primer choque en el grupo de pacientes con CCh fue de 23.2 meses (± 3.19), mientras que en el grupo con CI fue de 32.9 meses (± 1.15). En tres pacientes con CCh (15%) y cuatro con CI (9%) el primer choque apropiado del DAI fue durante una tormenta arrítmica.
Figura 1.
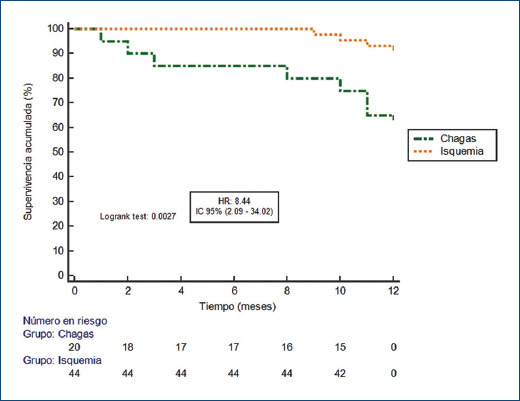
Curva de supervivencia libre de choques apropiados del DAI según la etiología de la miocardiopatía durante los primeros 12 meses posteriores al implante.
Tabla 2.
Criterios de valoración principal y secundario
| Criterios de valoración | CI (n = 44) | CCh (n = 20) | HR (IC95%) | p |
|---|---|---|---|---|
| Principal | n (%) | |||
| 12 meses | 3 (6.8) | 7 (35) | 8.4 (2.09-34.02) | 0.0027 |
| 36 meses | 7 (15.9) | 9 (45) | 4.6 (1.51-14.07) | 0.0072 |
| Secundario (eventos a 36 meses) | ||||
| Prevención primaria | 4 (12.9) | 3 (21.4) | 1.6 (0.3-8.4) | 0.48 |
| Prevención secundaria | 3 (23) | 6 (100) | 10.1 (1.7-58.8) | < 0.001 |
CCh: cardiopatía chagásica; CI: cardiopatía isquémica; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
En la parte superior se muestra el resultado principal de valoración (proporción de choques apropiados) por CCh o CI a 12 y 36 meses, y el punto de valoración secundario (proporción de choques apropiados) por cardiopatía y tipo de prevención de muerte súbita a 36 meses.
Figura 2.
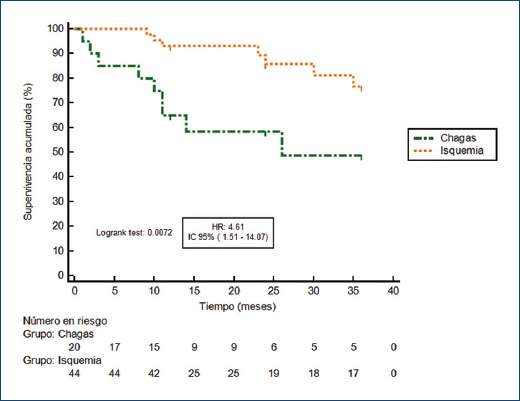
Curva de supervivencia libre de choques apropiados del DAI según la etiología de la miocardiopatía durante los primeros 36 meses posteriores al implante.
Choques apropiados por grupo y tipo de indicación del desfibrilador
A los 36 meses, cuatro pacientes (12.9%) con CI e implante de DAI como prevención primaria de muerte súbita habían presentado choques apropiados, con un tiempo medio hasta el primer choque de 33.4 ± 1.37 meses, mientras que tres pacientes (23%) con indicación de prevención secundaria presentaron eventos, con un tiempo medio hasta el primer choque apropiado de 32.9 ± 1.41 meses. En el grupo de pacientes con CCh e implante de DAI como prevención primaria de muerte súbita, tres pacientes (21.4%) presentaron choques apropiados durante los 36 meses posteriores al implante del dispositivo, con un tiempo medio hasta el primer choque apropiado de 30 ± 3 meses, mientras que seis pacientes (100%) de la población con CCh en quienes se implantó el dispositivo como prevención secundaria presentaron eventos durante los primeros 26 meses de seguimiento, con una media de tiempo de 10.16 ± 3.7 meses hasta el primer choque apropiado (Fig. 3 y Tabla 2). Al comparar los pacientes a quienes se implantó el DAI como prevención secundaria de muerte súbita, observamos que aquellos con CCh tenían mayor probabilidad de presentar choques apropiados del dispositivo en comparación con los que tenían CI (HR: 10.1; IC 95%: 1.7-58.8; p < 0.001), mientras que en el grupo de pacientes que recibieron el dispositivo como prevención primaria de muerte súbita no hubo diferencia significativa en la probabilidad de presentar choques apropiados (HR: 1.69; IC95%: 0.3-8.4; p = 0.48).
Figura 3.
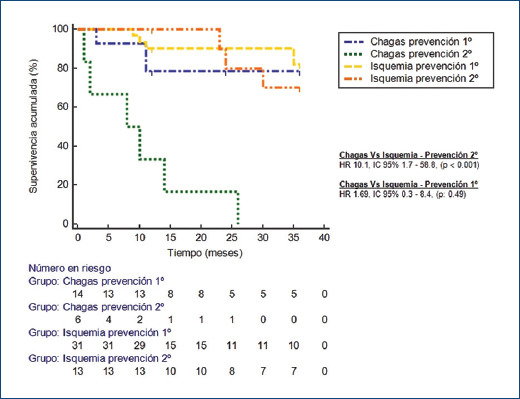
Curva de supervivencia libre de choques apropiados según la etiología de la miocardiopatía y el tipo de indicación de prevención del DAI durante los primeros 36 meses posteriores al implante.
Discusión
En nuestros hallazgos destaca que, durante el seguimiento, los pacientes con CCh presentaron en mayor porcentaje y de manera más precoz choques apropiados del dispositivo (en promedio 9.7 meses antes) que los sujetos con CI. Este comportamiento por parte de los pacientes con CCh de presentar choques del DAI de manera más prematura ya había sido descrito12, tendencia que estaría claramente influenciada por el sustrato producido por la enfermedad sobre el miocardio, ya que, como se observó en nuestro análisis, la población con CI presenta en mayor proporción factores que tradicionalmente se asocian a un aumento de la probabilidad de presentar choques apropiados del DAI (menor fracción de eyección del ventrículo izquierdo y menor uso de fármacos antiarrítmicos)13. Llama la atención que el total de la población con CCh e implante de DAI como prevención secundaria de muerte súbita presentó choques apropiados durante los primeros 26 meses de seguimiento, representando el grupo de mayor riesgo para recibir terapias por parte del dispositivo; comportamiento que también había sido observado en series previas14,15, en las que esta población tenía el doble de riesgo de presentar descargas efectivas del DAI en comparación con los pacientes con cardiopatías de otras etiologías8. Los hallazgos de nuestro estudio pueden ser explicados por la alta carga arrítmica presente en los pacientes con CCh16,17. En la CCh, la inflamación producida por la agresión parasitaria al miocardio genera fibrosis y alteración de la propagación eléctrica intercelular, presentando en la etapa crónica disautonomía, denervación y marcada reinervación simpática. Esta disfunción autonómica estaría implicada en la aparición de complejos ventriculares prematuros frecuentes y formación de circuitos reentrantes que, junto con la presencia de aneurismas apicales del ventrículo izquierdo, frecuentes en los pacientes con CCh, constituyen un sustrato altamente favorable para la génesis de arritmias ventriculares graves5. En los pacientes con CCh, las taquiarritmias ventriculares tienen longitudes de ciclos más prolongadas que en los pacientes con CI, por lo cual presentan mejor tolerancia a dichas arritmias18. Además, en registros previos de pacientes con CCh portadores de DAI se observó que cerca del 76% de los episodios de taquiarritmias ventriculares pueden interrumpirse con ATP de manera efectiva; sin embargo, un porcentaje no despreciable de eventos culminan con choques apropiados del DAI, como se observó en nuestra serie19,20.
Se ha documentado que los choques apropiados en los pacientes con CCh y DAI tienen como sustrato taquicardias ventriculares que no logran ser revertidas por la ATP, o la aceleración de taquicardias ventriculares a zona de fibrilación ventricular por parte de esta terapia, lo cual, asociado a la recurrencia temprana de las arritmias ventriculares en los pacientes con CCh, explicaría el gran número de sujetos que experimentan choques durante los primeros años posteriores al implante del DAI21,22. En nuestro estudio, los pacientes con CCh y DAI como prevención secundaria de muerte súbita presentaron el primer choque apropiado del dispositivo posterior a una fibrilación ventricular en cuatro casos y luego de ATP fallidas durante una taquicardia ventricular monomórfica en los dos casos restantes. Estas observaciones también explicarían por qué en nuestra serie un mayor porcentaje de pacientes con CCh presentaron la primera descarga apropiada del DAI durante una tormenta arrítmica, en comparación con los sujetos con CI (15 vs. 9%). Cabe señalar que la indicación del DAI en la mayoría de los sujetos con CCh y tormenta arrítmica fue como prevención secundaría de muerte súbita, mientras que en el grupo con CI fue como prevención primaria, siendo el episodio de tormenta arrítmica en este último grupo desencadenado en tres casos por un nuevo evento isquémico coronario, a diferencia de la población con CCh, en la que no se pudo establecer una causa clara de dicho evento, siendo la tormenta arrítmica sin desencadenantes un fenómeno usual en la CCh20,22.
Considerando la alta tasa de choques apropiados del DAI en los pacientes con CCh, se ha intentado implementar medidas con el objetivo de disminuir las arritmias ventriculares graves que requieran terapias por parte del dispositivo. La ablación por radiofrecuencia ha demostrado ser efectiva, alcanzando porcentajes de éxito superiores al 80%, sin complicaciones de gravedad y con tasas libres de eventos al año de seguimiento que llegan a ser superiores al 75%23,24. Por otro lado, en sujetos refractarios a estas medidas se podría considerar el trasplante cardiaco, el cual ha demostrado una sobrevida cercana al 46% a los 10 años en algunas series25.
Por último, es necesario considerar una serie de limitaciones importantes de este estudio. En primer lugar, su carácter observacional y unicéntrico, aunque no existen hasta el momento estudios prospectivos aleatorizados que comparen pacientes con CCh y DAI. En segundo lugar, el número pequeño de sujetos incluidos, aunque la muestra concuerda con el número de pacientes promedio aportados por cada institución en estudios multicéntricos. Por otro lado, el tamaño de la muestra no permitió realizar un análisis multivariado del tiempo hasta un evento, por lo que no se pudo controlar potenciales confundidores. En este sentido, las características de la población con CI (mayor edad, menor uso de amiodarona y peor fracción de eyección) favorecerían la presencia de más eventos arrítmicos, difiriendo de lo observado en nuestros resultados y fortaleciendo nuestras conclusiones. Finalmente, al no tener en cuenta en nuestro análisis de eventos las ATP apropiadas, se podría estar subestimando el número real de arritmias ventriculares en los pacientes con CCh y CI.
Conclusiones
Los pacientes con CCh presentaron choques apropiados del DAI con más frecuencia y en menor tiempo que los sujetos con CI. En el subgrupo de pacientes con CCh y DAI como prevención secundaria, todos experimentaron una arritmia reiterada que requirió choque del dispositivo, representando el grupo de mayor riesgo. Esta información apoya la indicación del DAI en estos pacientes a pesar de la escasa evidencia en ensayos aleatorizados. Es necesario investigar nuevas estrategias terapéuticas, fortalecer las ya conocidas e implementarlas de manera más temprana para mejorar el pronóstico de los pacientes con enfermedad de Chagas.
Financiamiento
Ninguno.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Bibliografía
- 1.Mills RM. Chagas disease:epidemiology and barriers to treatment. Am J Med. 2020;133:1262–126. doi: 10.1016/j.amjmed.2020.05.022. [DOI] [PubMed] [Google Scholar]
- 2.Ventura-García L, Roura M, Pell C, Pool R, Aldasoro E, Mun J. Socio-cultural aspects of Chagas disease:a systematic review of qualitative research. PLoS Negl Trop Dis. 2013;7:2410. doi: 10.1371/journal.pntd.0002410. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Requena-Méndez A, Aldasoro E, de Lazzari E, Sicuri E, Brown M, Moore DAj, et al. Prevalence of Chagas disease in Latin-American migrants living in Europe:a systematic review and meta-analysis. PLoS Negl Trop Dis. 2015;9:1–15. doi: 10.1371/journal.pntd.0003540. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Schmunis GA, Yadon ZE. Chagas disease:a Latin American health problem becoming a world health problem. Acta Trop. 2010;115:14–21. doi: 10.1016/j.actatropica.2009.11.003. [DOI] [PubMed] [Google Scholar]
- 5.Di Toro D, Baranchuk A. Sudden cardiac death in Chagas disease. Int Cardiovasc Forum J. 2016;7:26–32. [Google Scholar]
- 6.Al-Jefairi N, Burri H. Relevance of guideline-based ICD indications to clinical practice. Indian Heart J. 2014;66:82–7. doi: 10.1016/j.ihj.2013.11.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Ezekowitz JA, Armstrong PW, McAlister FA. Implantable cardioverter defibrillators in primary and secondary prevention:a systematic review of randomized, controlled trials. Ann Intern Med. 2003;138:445–53. doi: 10.7326/0003-4819-138-6-200303180-00007. [DOI] [PubMed] [Google Scholar]
- 8.Barbosa MP, Da Costa Rocha MO, De Oliveira AB, Lombardi F, Ribeiro AL. Efficacy and safety of implantable cardioverter-defibrillators in patients with Chagas disease. Europace. 2013;15:957–62. doi: 10.1093/europace/eut011. [DOI] [PubMed] [Google Scholar]
- 9.Borne RT, Varosy PD, Masoudi FA. Implantable cardioverter-defibrillator shocks:epidemiology, outcomes, and therapeutic approaches. JAMA Int Med. 2013;173:859–65. doi: 10.1001/jamainternmed.2013.428. [DOI] [PubMed] [Google Scholar]
- 10.Cardinalli-Neto A, Bestetti RB, Cordeiro JA, Rodrigues VC. Predictors of all-cause mortality for patients with chronic Chagas'heart disease receiving implantable cardioverter defibrillator therapy. J Cardiovasc Electrophysiol. 2007;18:1236–40. doi: 10.1111/j.1540-8167.2007.00954.x. [DOI] [PubMed] [Google Scholar]
- 11.Priori SG, Blomström-Lundqvist C, Mazzanti A, Blom N, Borggrefe M, Camm J, et al. Guía ESC 2015 sobre el tratamiento de pacientes con arritmias ventriculares y prevención de la muerte súbita cardiaca. Rev Esp Cardiol. 2016;69:176–1-77. [Google Scholar]
- 12.Pereira FT, Rocha EA, Monteiro M, Lima N, Rodrigues Sobrinho CR, Pires N, eto R. Clinical course after cardioverter-defibrillator implantation:Chagasic versus ischemic patients. Arq Bras Cardiol. 2016;107:99–105. doi: 10.5935/abc.20160101. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Zeitler EP, Al-Khatib SM, Friedman DJ, Yoon Han J, Poole JE, Bardy GH, et al. Predicting appropriate shocks in patients with heart failure:patient level meta-analysis from SCD-HeFT and MADIT II. J Cardiovasc Electrophysiol. 2017;28:1345–51. doi: 10.1111/jce.13307. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Cardinalli-Neto A, Greco OT, Bestetti RB. Automatic implantable cardioverter-defibrillators in Chagas'heart disease patients with malignant ventricular arrhythmias. Pacing Clin Electrophysiol. 2006;29:467–70. doi: 10.1111/j.1540-8159.2006.00377.x. [DOI] [PubMed] [Google Scholar]
- 15.Baranchuk A, Femenia F, López-Diez JC, Muratore C, Valentino M, Retyk E, et al. Fragmented surface ECG was a poor predictor of appropriate therapies in patients with Chagas'cardiomyopathy and ICD implantation (fragmented ECG in CHAgas'cardiomyopathy study) Ann Noninvasive Electrocardiol. 2014;19:43–9. doi: 10.1111/anec.12077. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Grupi CJ, Moffa PJ, Barbosa SA, Sanches PC, Barragan Filho EG, Bellotti GM, et al. Holter monitoring in Chagas'heart disease. Sao Paulo Med J. 1995;113:835–40. doi: 10.1590/s1516-31801995000200015. [DOI] [PubMed] [Google Scholar]
- 17.De Paola A, Horowitz LN, Miyamoto MH, Pinheiro R, Ferreira DF, Terzian AB, et al. Angiographic and electrophysiologic substrates of ventricular tachycardia in chronic Chagasic myocarditis. Am J Cardiol. 1990;65:360–3. doi: 10.1016/0002-9149(90)90302-h. [DOI] [PubMed] [Google Scholar]
- 18.Mayo OP, Costa G, Speranza R, Alfie A, Robi M, Deluso D, et al. Evolución del sustrato arritmogénico de las arritmias ventriculares graves en miocardiopatías chagásica e isquémico-necróticas. Rev Electro y Arritmias. 2018;10:3–14. [Google Scholar]
- 19.Rassi FM, Minohara L, Rassi A, Correia LC, Marin-Neto JA, da S, ilva Menezes A. Systematic review and meta-analysis of clinical outcome after implantable cardioverter-defibrillator therapy in patients with Chagas heart disease. JACC Clin Electrophysiol. 2019;5:1213–23. doi: 10.1016/j.jacep.2019.07.003. [DOI] [PubMed] [Google Scholar]
- 20.Muratore CA, Batista Sa LA, Chiale PA, Eloy R, Tentori MC, Escudero J, et al. Implantable cardioverter defibrillators and Chagas'disease:results of the ICD Registry Latin America. EP Europace. 2009;11:164–8. doi: 10.1093/europace/eun325. [DOI] [PubMed] [Google Scholar]
- 21.Lima AP, Elias TG, Lima AM, Rocha ZB, Lima LM, Andrade RP. Mecanismos arritmogênicos deflagradores de choque em chagásicos portadores de cardioversor-desfibrilador implantável. J Cardiac Arrhythmias. 2014;27:22–6. [Google Scholar]
- 22.Flores-Ocampo J, Nava S, Márquez MF, Gómez-Flores J, Colín L, López A, et al. Predictores clínicos de tormenta arrítmica en pacientes con cardiomiopatía chagásica con un desfibrilador automático implantable. Arch Cardiol Mex. 2009;79:263–7. [PubMed] [Google Scholar]
- 23.Scanavacca M. Epicardial ablation for ventricular tachycardia in chronic Chagas heart disease. Arq Bras Cardiol. 2014;102:524–8. doi: 10.5935/abc.20140082. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Henz BD, Do Nascimento TA, Dietrich CD, Dalegrave C, Hernandes V, Mesas CE, et al. Simultaneous epicardial and endocardial substrate mapping and radiofrequency catheter ablation as first-line treatment for ventricular tachycardia and frequent ICD shocks in chronic chagasic cardiomyopathy. J Interv Card Electrophysiol. 2009;26:195–205. doi: 10.1007/s10840-009-9433-4. [DOI] [PubMed] [Google Scholar]
- 25.Benatti RD, Oliveira GH, Bacal F. Heart transplantation for Chagas cardiomyopathy. J Heart Lung Transplant. 2017;36:597–603. doi: 10.1016/j.healun.2017.02.006. [DOI] [PubMed] [Google Scholar]


