Abstract
Sauerstoff (O2) ist ein Arzneimittel und soll in der Akuttherapie bei Vorliegen einer Hypoxämie ärztlich verordnet und dokumentiert, regelmäßig überwacht und reevaluiert werden. Zur Überwachung dient in der Akutmedizin die Pulsoxymetrie, bei Risikopatienten sind arterielle Blutgase zu bestimmen. Sowohl eine Hypoxämie als auch eine Hyperoxämie sind bei akut Kranken zu vermeiden. Es sollten Zielbereiche der O2-Sättigung (SpO2 [pulsoxymetrisch gemessene O2-Sättigung]) festgelegt werden. Diese hängen vom Hyperkapnierisiko und vom Beatmungsstatus ab: spontan atmende Patienten ohne bzw. mit Hyperkapnierisiko: Ziel‑SpO2 = 92–96 % bzw. 88–92 %, beatmete Patienten: arterielle O2-Sättigung zwischen 92 und 96 %. Die Zielbereiche gelten bis auf wenige Ausnahmen für alle Erwachsenen unabhängig von der Diagnose. Die O2-Applikationssysteme werden nach Patientensicherheit und -komfort ausgewählt. Bei Beendigung der O2-Gabe kann es bei vulnerablen Menschen zur Reboundhypoxämie kommen.
Schlüsselwörter: Hyperkapnie, Patientensicherheit, Oxymetrie, Hypoxie, Sauerstoffinhalationstherapie
Abstract
Oxygen (O2) is a drug that is prescribed for acute treatment of hypoxemia and must be documented, regularly monitored, and re-evaluated. In acute care pulse oximetry is used for monitoring, while arterial blood gases should be obtained in high-risk patients. Hypoxemia and hyperoxemia should be avoided in acutely ill patients. Target ranges of O2 saturation (SpO2, saturation measured by pulse oximetry) are defined based on the risk of hypercapnia and the ventilation status, i.e., spontaneously breathing patients without and with risk of hypercapnia: target SpO2 92–96% and 88–92%, respectively, ventilated patients: arterial O2 saturation between 92% and 96%. Apart from few exceptions, the target ranges are valid for all adults independent of diagnosis. Choice of O2 applications systems is based on patient safety and patient comfort. After discontinuation of O2 therapy, rebound hypoxemia can occur in vulnerable patients.
Keywords: Hypercapnia, Patient safety, Oximetry, Hypoxia, Oxygen inhalation therapy
Lernziele
Nach Lektüre dieses Beitrags …
können Sie Indikationen der Sauerstofftherapie in der Akutmedizin benennen,
wissen Sie, welches die Zielbereiche der Sauerstoffsättigung bei akut Kranken sind,
sind Ihnen die Empfehlungen zur Verordnung, Dokumentation und Überwachung einer Sauerstofftherapie im stationären und prästationären Bereich bekannt,
kennen Sie die verschiedenen Applikationssysteme von Sauerstoff mit deren Vor- und Nachteilen und die wichtigsten Sauerstoffquellen,
sind Ihnen die Indikationen und Limitationen der Anwendung von High-Flow-Sauerstoff geläufig.
Einleitung
Sauerstoff (O2) wird in den Körperzellen benötigt, um aus den Nährstoffen Energie zu gewinnen. Im Blut wird er überwiegend an das Hämoglobin
Hämoglobin
(Hb) des Erythrozyten gebunden. Die Menge von O2 im Blut kann mittels Messung der Sauerstoffsättigung des Hämoglobins oder Bestimmung des O2-Partialdrucks (paO2 [a: arteriell]) ermittelt werden.
Sauerstoff ist ein Arzneimittel
Arzneimittel
mit spezifischen Eigenschaften, einem definierten Dosis-Wirkungs-Bereich
Dosis-Wirkungs-Bereich
und unerwünschten Wirkungen
Unerwünschte Wirkung
. Im Jahr 2015 wurden 14 % einer Stichprobe von über 55.000 britischen Krankenhauspatienten mit Sauerstoff behandelt, davon hatten 42 % keine Verordnung für O2
Verordnung für O2
. In den letzten Jahren wurden zahlreiche randomisierte kontrollierte Studien und Metaanalysen zur Sauerstofftherapie veröffentlicht. Medizinisches Personal ist dennoch häufig unsicher über die Relevanz einer Hypoxämie und es besteht ein eingeschränktes Bewusstsein für die Risiken einer Hyperoxämie. Die Behandlung mit Sauerstoff in der Akutmedizin wird von der Langzeitsauerstofftherapie abgegrenzt. Letztere wird hier nicht behandelt.
Die Sauerstoffsättigung
Sauerstoffsättigung
ist der zentrale Zielparameter in der Akutmedizin und hat den Vorteil eines gemeinsamen Zielparameters in Pulsoxymetrie (SpO2 [pulsoxymetrisch gemessene Sauerstoffsättigung]) und Blutgasanalysen (SaO2 [arterielle Sauerstoffsättigung]). In einer großen britischen Studie an 37.000 Patienten lag die SpO2 im Median bei 98 % für Erwachsene im Alter von 18–64 Jahren, für Ältere bei 96 % [1].
Die Pulsoxymetrie
Pulsoxymetrie
hat eine hohe Sensitivität, aber nur geringe Spezifität zur Erfassung von Hypoxämien. Eine pulsoxymetrische Sauerstoffsättigung von unter 92 % hatte bei Patienten mit Exazerbation einer chronisch-obstruktiven Lungenerkrankung (COPD [„chronic obstructive pulmonary disease“]) eine Sensitivität von 100 % und eine Spezifität von 86 %, um eine arterielle Hypoxämie (pO2 [Sauerstoffpartialdruck] unter 60 mm Hg) vorherzusagen [2]. Bei kritisch kranken Patienten liegt das 95 %-Konfidenzintervall der Abweichung von pulsoxymetrischer zu arterieller Sättigung bei ±4 % [3].
Bei einer Hypoxämie
Hypoxämie
ist der Sauerstoffpartialdruck oder der Sauerstoffgehalt im arteriellen Blut erniedrigt. Eine Hypoxie
Hypoxie
bezeichnet dagegen die Luft oder Gewebe mit erniedrigtem pO2. Häufigste pathophysiologische Ursachen der Hypoxämie in der Akutmedizin sind Ventilations‑/Perfusionsinhomogenitäten der Lunge, Shunts oder die alveoläre Hypoventilation.
Wiederholt wurde an großen Kollektiven von prästationären und stationären Patienten die Assoziation einer Hypoxämie mit erhöhter Sterblichkeit
Erhöhte Sterblichkeit
beschrieben [4, 5]. Bei 27.722 Krankenhauspatienten ging die mindestens einmalige Messung einer pulsoxymetrischen Sättigung unter 92 % mit einer Krankenhaussterblichkeit von 6 % gegenüber 2 % von Patienten ohne Hypoxämie einher [4]. Auch an großen Kollektiven von stationären Patienten und solchen im Rettungseinsatz wurde ein Zusammenhang zwischen einer Hypoxämie und erhöhter Sterblichkeit berichtet [4, 5]. Es ist jedoch unklar, welchen Einfluss die Sauerstofftherapie auf das Überleben und andere patientenrelevante Endpunkte hat, da randomisierte Studien mit permissiver Hypoxämie im Erwachsenenbereich fehlen.
Es gibt zahlreiche Argumente gegen Hyperoxie
Hyperoxie
und Hyperoxämie als Therapieziel, da durch Hyperoxämie infolge medizinischer O2-Verabreichung eine Reihe von unerwünschten Wirkungen beschrieben wurde [6]. Eine Metaanalyse von 25 randomisierten kontrollierten Studien an 16.037 Patienten mit verschiedenen akuten Erkrankungen wie Sepsis, Schlaganfall, Trauma, Herzinfarkt und Herzstillstand zeigte mit hoher Evidenz ein erhöhtes relatives Risiko der Sterblichkeit im Krankenhaus unter Hyperoxämie [7]. Hohe O2-Konzentrationen verursachen bei Gesunden direkte Lungentoxizität
Lungentoxizität
und Resorptionsatelektasen
Resorptionsatelektase
[8, 9]. Eine Hyperoxämie mit SpO2 > 96 % kann zu fälschlich beruhigenden SpO2-Werten führen und das Erkennen der Verschlechterung von Patienten mit Hypoxämie verzögern [10, 11]. Bei COPD war eine prästationäre Hyperoxämie mit erhöhter Krankenhaussterblichkeit verbunden [12]. In 21 Studien an 7597 Patienten verbesserten Hyperoxie und eine daraus resultierende Hyperoxämie intra- und postoperativ die Wundheilung nicht [13].
Der Ansatz der permissiven Hypoxämie
Permissive Hypoxämie
wurde bisher nicht in randomisierten Studien bei Erwachsenen gegenüber Normoxämie untersucht. Die einzigen Arbeiten, in denen dieses Konzept nach eigener Literaturrecherche randomisiert geprüft worden war, waren einerseits die NeOProM-Kollaboration [14], in der 4965 Frühgeborene
Frühgeborenes
randomisiert entweder mit einer Ziel‑SpO2 von 85–89 % oder einer SpO2 zwischen 91 und 95 % mit Sauerstoff behandelt worden waren. Bezüglich der Sterblichkeit ergab sich kein Unterschied, allerdings fanden sich in der Patientengruppe mit restriktiver Sauerstoffgabe mehr Fälle (9 % gegenüber 7 %), die aufgrund einer nekrotisierenden Enterokolitis operiert werden mussten oder starben. In einer zweiten Untersuchung (COAST-Studie) wurden im Median 7 Monate alte Kinder mit Pneumonie entweder mit Sauerstoff behandelt oder eine Hypoxämie mit einer SpO2 von 80–91 % toleriert. Für die Sauerstofftherapie ergab sich kein Überlebensvorteil [15]. Beide Studien sind nicht auf Erwachsene übertragbar, da sowohl bei Frühgeborenen als auch bei Säuglingen
Säugling
der Nachweis von fetalem Hämoglobin zu einer höheren Hypoxämietoleranz
Höhere Hypoxämietoleranz
führt. Der mittelfristig tolerierbare Bereich der Hypoxämie bleibt damit bei kranken Erwachsenen weiter unklar.
Es gibt adaptierte Patienten mit chronischer Hypoxämie
Chronische Hypoxämie
(z. B. Feten, Patienten mit Mischzyanose, Bevölkerungsgruppen, die in großer Höhe leben, oder solche mit chronischer Hypoventilation), die trotz Hypoxämie weder Atemnot angeben noch von einer Sauerstofftherapie profitieren. Anpassungsvorgänge
Anpassungsvorgang
an eine chronische Hypoxämie dauern mehrere Wochen, es steigen der Hämoglobinwert, das Herzzeit- und auch das Atemminutenvolumen. Die Erfahrung der Anpassung an chronische Hypoxämie kann aber nicht auf Menschen mit akuter Hypoxämie übertragen werden.
Aus historischen Veröffentlichungen der Höhen- und Flugmedizin [16] ist bekannt, dass ohne Adaptation Hypoxämien ab einer Höhe von 6700 m mit Sättigungswerten von unter 70 % innerhalb kurzer Zeit zu Bewusstseinsverlust führen und selbst nach Akklimatisierung über mehrere Tage tödlich sind. Bei akut Kranken sind Anpassungsvorgänge der chronischen Hypoxämie nicht vorhanden. Selbst gesunde Probanden haben bei Hypoxämien mit Sättigungen < 80 % kognitive Einschränkungen
Kognitive Einschränkung
[17].
Der genaue Bereich, innerhalb dessen eine Hypoxämie mittelfristig toleriert („How low can you go?“) wird, ist mangels vorliegender kontrollierter Studien unbekannt. Bei Patienten mit koronarer Herzkrankheit wurde in Ruhe bei SaO2 < 85 % (SaO2: arterielle Sauerstoffsättigung) myokardiales Laktat
Myokardiales Laktat
produziert [18]. Oberhalb einer Sättigung von 85 % konnte in Ruhe in diesen Studien keine Laktatproduktion nachgewiesen werden.
Diagnostik einer Hypoxämie und Lagerung von Patienten
Hypoxämie bedarf als Warnzeichen erhöhter klinischer Aufmerksamkeit
Klinische Aufmerksamkeit
, differenzialdiagnostischer Abklärung
Abklärung
und nachfolgender Behandlung. Die zugrunde liegenden Ursachen sollen festgestellt und behandelt werden. Bei der Einschätzung von Patienten mit Atemnot sollen neben der Sauerstoffsättigung auch Atemfrequenz, Pulsfrequenz, Blutdruck, Temperatur und Bewusstseinslage bestimmt werden.
Sauerstoff soll verabreicht werden, um eine Hypoxämie, also einen Sauerstoffmangel
Sauerstoffmangel
, nicht um Atemnot zu behandeln (evidenzbasierte Empfehlung der deutschen S3-Leitlinie [1]).
Zur Linderung von Atemnot
Atemnot
durch Sauerstoff wurden 3 Metaanalysen an verschiedenen Patienten (COPD, Krebserkrankungen) identifiziert [19, 20, 21]. Mit hoher Evidenz war er hierzu nicht effektiver als Druckluft
Druckluft
. Bei Atemnot ohne Hypoxämie kommen in der Palliativmedizin zunächst nichtmedikamentöse Verfahren
Nichtmedikamentöses Verfahren
zur Anwendung. Der Einsatz von Opioiden
Opioid
bei Atemnot ist gut untersucht, und eine nachgewiesen wirksame medikamentöse Maßnahme bei Dyspnoe ohne Hypoxämie.
Die Pulsoxymetrie soll in allen klinischen Situationen verfügbar sein, in denen Sauerstoff medizinisch verwendet wird, und zur Überwachung der Sauerstofftherapie regelmäßig eingesetzt werden ([22], evidenzbasierte Empfehlung der S3-Leitlinie). Arterielle Blutgasanalysen
Arterielle Blutgasanalyse
zur Überwachung und Indikationsstellung einer Sauerstofftherapie sollten unter stationären Bedingungen bei folgenden Patientengruppen durchgeführt werden:
Kritisch Kranken, z. B. im Schock oder mit metabolischen Störungen
Beatmeten Patienten
Patinten mit hohem O2-Bedarf (über 6 l O2/min bzw. FiO2 [„fraction of inspired oxygen“, inspiratorische Sauerstofffraktion] über 0,4)
Patienten mit Hyperkapnierisiko (z. B. COPD, schweres Asthma, Adipositas mit BMI [Body-Mass-Index] > 40 kg/m2)
Menschen ohne zuverlässiges Pulsoxymetriesignal
Für stabile Patienten außerhalb der genannten Indikationen sollte keine routinemäßige Bestimmung der Blutgase erfolgen. Blutgasanalysen aus arterialisiertem Kapillarblut
Arterialisiertes Kapillarblut
am Ohrläppchen können im stationären Bereich zur Patienteneinschätzung außerhalb der Intensivstation eingesetzt werden ([23, 24, 25], evidenzbasierte Empfehlung der S3-Leitlinie).
Venöse Blutgasanalysen sollen für die Überwachung der Sauerstofftherapie nicht verwendet werden. Sie können lediglich bei einem pvCO2 (venöser Kohlendioxidpartialdruck) < 45 mm Hg eine Hyperkapnie ausschließen ([26, 27, 28, 29]; evidenzbasierte Empfehlung der S3-Leitlinie).
Zusätzlich zur Sauerstofftherapie sind bei Hypoxämie Allgemeinmaßnahmen
Allgemeinmaßnahme
wie die Lagerung zur Verbesserung der Oxygenierung sinnvoll. Bei der Lagerung hypoxämischer wacher Patienten ist zusätzlich zur Sauerstofftherapie die Patientenpräferenz zu berücksichtigen. Bei einigen Betroffenen kann eine aufrechte Oberkörperlagerung
Aufrechte Oberkörperlagerung
zu einer Verbesserung der Oxygenierung führen, bei Menschen mit COVID-19 („coronavirus disease 2019“) wurde ein positiver Effekt der Bauchlagerung
Bauchlagerung
beobachtet („self-proning“). Bei morbid Adipösen (BMI > 50 kg/m2) ist akutes Atemversagen bei Flachlagerung beschrieben und soll vermieden werden [25].
Zur Behandlung und Vorbeugung des V.-cava-Kompressionssyndroms
V.-cava-Kompressionssyndrom
ist von Schwangeren mit Hypoxämie eine Linksseitenlage
Linksseitenlage
einzunehmen.
Sauerstofftherapie
Applikationsart
Sauerstoffzufuhrsysteme
Sauerstoffzufuhrsystem
bestehen aus 2 Komponenten, zum einen derjenigen für die O2-Bereitstellung
O2-Bereitstellung
(z. B. Druckgasflaschen) und zum zweiten dem Hilfsmittel
Hilfsmittel
zur Abgabe an den Patienten (z. B. Brille oder Maske s. Tab. 1). Die Auswahl beider Elemente richtet sich nach den klinischen Gegebenheiten und den Bedürfnissen des Kranken.
| Sauerstoffapplikationssystem | Abbildung | Vorteile | Nachteile |
|---|---|---|---|
|
Nasenbrillen (FiO2 = 0,26–0,54) |
|
Hoher Patientenkomfort Geringe Kosten Keine Beeinträchtigung von Essen und Trinken |
FiO2 begrenzt FiO2 abhängig von Mundöffnung und Atemfrequenz |
|
Nasensonden (FiO2 = 0,2–0,4) |
|
Belegen nur ein Nasenostium Geringe Kosten |
Schleimhautirritation |
|
Einfache Gesichtsmasken (FiO2 = 0,35–0,60) |
Ohne Abbildung |
FiO2 unabhängig von Mundöffnung Geringe Kosten |
Niedriger Patientenkomfort Hyperkapnierisiko bei Fluss < 5 l/min Beeinträchtigung von Essen und Trinken |
|
Venturi-Masken (FiO2 = 0,24–0,60) |
|
Geringeres Risiko von Hyperoxie und Hyperkapnie Geringe Aerosolbildung |
Niedriger Patientenkomfort Erfahrung beim Personal notwendig Beeinträchtigung von Essen und Trinken |
|
Reservoirmasken (FiO2 = 0,6–0,9) |
|
Hoher FiO2 Geeignet für Notfallsituation vor allem prästationär |
Niedriger Patientenkomfort Hyperkapnierisiko bei Fluss < 5 l/min Beeinträchtigung von Essen und Trinken |
|
High-Flow-Kanülen (FiO2 = 0,3–1,0) |
|
Hoher FiO2 Gute FiO2-Kontrolle Hoher Patientenkomfort bei guter Anpassung und Befeuchtung Akzeptable Aerosolbildung Moderater PEEP CO2-Auswaschung im Totraum |
Höherer Personalaufwand und Kosten Erfahrung beim Personal notwendig In der Regel nur stationär verfügbar |
|
Beatmungsmasken (FiO2 = 0,25–1,0) |
|
Hoher FiO2 Geringe Aerosolbildung (2-Schlauch bzw. Filter) |
Niedriger Patientenkomfort (u. a. Druckstellen, Klaustrophobie) Höherer Personalaufwand und Kosten |
Abbildungen aus [30]
FiO2 „fraction of inspired oxygen“ (inspiratorische Sauerstofffraktion), PEEP positiver endexspiratorischer Druck
Nasenbrillen
Nasenbrille
sollten bei niedrigen O2-Flussraten
Niedrige O2-Flussrate
(d. h. < 6 l/min) primär verwendet werden, alternativ Venturi-Masken mit niedriger Sauerstoffabgabe ([31, 32, 33, 34, 35], evidenzbasierte Empfehlung der S3-Leitlinie, s. Tab. 1). Sauerstoff soll nicht oder nur kurzzeitig (Richtwert unter 10 min, wenn keine Druckluft vorhanden ist) für eine Vernebelung, z. B. von Medikamenten, bei Patienten mit Hyperkapnierisiko verwendet werden. Reservoirmasken sind bei Patienten mit Hyperkapnierisiko mit besonderer Vorsicht einzusetzen – am ehesten im prästationären Bereich. Im Krankenhaus sind Venturi-Masken
Venturi-Maske
und High-Flow-Sauerstoff sicherere Alternativen. Bei Ersteren wird nach dem Bernoulli-Prinzip Sauerstoff durch eine sich verjüngende Düse geleitet und das in hoher Flussrate einströmende Luft-Sauerstoff-Gemisch in der Maske zur Einatmung verwirbelt. Die Steuerung des FiO2 erfolgt über auswechselbare, verschiedenfarbige Düsen zwischen 24 und 60 %. Im Unterschied zu Nasenbrillen wird mit der Venturi-Maske unter höheren Flussraten kein höherer FiO2 erzielt. Die Durchflussrate für Venturi-Masken soll über den angegebenen Mindestdurchflussraten liegen (z. B. 2 l/min bei 24 %, blauer Düse, und 15 l/min bei 60 %, grüner Düse).
Sauerstoff soll von geschultem Personal
Geschultes Personal
auf dem Gebiet der Sauerstofftherapie angewendet, überwacht und gesteuert werden. Patienten sollen über die Sauerstofftherapie informiert und darin geschult werden.
In Deutschland wird O2 im stationären Bereich meist über zentrale Anlagen
Zentrale Anlage
mit reinem, druckverdichtetem Sauerstoff (100 %) bereitgestellt. Im stationären Bereich muss sichergestellt sein, dass die Sauerstoffzufuhr über Wandanschlüsse (sechskantig) erfolgt, die reinen Sauerstoff liefern, und nicht aus anderen Anschlüssen, die mit Druckluft oder anderen Gasen versehen sind. Das medizinische Personal ist darin zu schulen, bei Röhrendurchflussmessgeräten die korrekte O2-Flussrate abzulesen. Als mobile Sauerstoffquellen
Mobile Sauerstoffquelle
werden in der Akutmedizin u. a. im prästationären Bereich O2-Druckgasflaschen mit Druckbegrenzer und Rastung verwendet. Hierbei ist zu beachten, dass die Laufreserve der Sauerstoffquelle für den Einsatz, z. B. den Transport des Patienten, ausreichend sichergestellt ist. Dabei sind Flaschenvolumen, Füllgrad und Sauerstoffflussrate zu beachten.
Zielbereiche der Sauerstoffsättigung
Sauerstoff soll für jeden stationären Patienten unter Angabe eines Zielbereichs der Sauerstoffsättigung ärztlich verordnet werden. Ein Vorschlag der S3-Leitlinie zur ärztlichen Verordnung
Ärztliche Verordnung
Zur Festlegung von Zielbereichen ist von Bedeutung, wann Hypoxämie und Hyperoxämie für akut Erkrankte wahrscheinlich gefährdend sind und in welchem Bereich es sich um eine nicht schädliche und damit sichere Sauerstofftherapie
Sichere Sauerstofftherapie
handelt. Dabei spielt eine Rolle, ob der Patient beatmet ist und ob er ein Hyperkapnierisiko hat oder nicht. Für diese 3 Patientengruppen sollen die in Abb. 2 genannten Zielbereiche der Sauerstofftherapie gelten. Ausnahmen einer Sauerstofftherapie ohne Zielbereich der Sauerstoffsättigung sind Clusterkopfschmerz, Kohlenmonoxidintoxikation sowie kritisch kranke Patienten, bei denen keine Pulsoxymetrie abgeleitet werden kann.
Der Zielbereich der akuten Sauerstofftherapie für nichtbeatmete Patienten
Nichtbeatmeter Patient
ohne Hyperkapnierisiko soll bei einer pulsoxymetrischen Sättigung zwischen 92 % und 96 % liegen ([7, 13, 36], evidenzbasierte Empfehlung der S3-Leitlinie).
Eine Sauerstofftherapie für akut kranke, nichtbeatmete Patienten mit Hyperkapnierisiko
Hyperkapnierisiko
(z. B. COPD, aber auch BMI > 40 kg/m2, Erwachsene mit neuromuskulärer Erkrankung oder schwerer Skoliose) soll bei einer Sättigung von über 92 % nicht durchgeführt bzw. reduziert und erst bei unter 88 % begonnen werden ([12, 37], evidenzbasierte Empfehlung der S3-Leitlinie). Bei chronischer Hyperkapnie
chronischer Hyperkapnie
führt je nach Grunderkrankung bei 22–40 % der Betroffenen eine Hyperoxämie zu einem signifikanten paCO2-Anstieg. Als Ursache wird v. a. aufgrund von Untersuchungen bei COPD-Patienten diskutiert, dass die pulmonale Vasokonstriktion nicht ventilierter Areale bei Hyperoxämie aufgehoben wird. Außerdem kommt es bei ihr zu einer Reduktion des Atemminutenvolumens; ferner nimmt oxygeniertes Hämoglobin durch den Haldane-Effekt
Haldane-Effekt
schlechter Kohlendioxid auf [38].
Bei beatmeten Patienten
Beatmeter Patienten
soll eine arterielle Sauerstoffsättigung von 92–96 % angestrebt werden. Neben arteriellen Blutgasmessungen soll bei akzeptabler Übereinstimmung (Abweichung bis 2 %) und im präklinischen Bereich die pulsoxymetrische Messung der Sauerstoffsättigung zur Steuerung der Sauerstoffzufuhr verwendet werden ([39, 40, 41, 42, 43, 44], evidenzbasierte Empfehlung der S3-Leitlinie).
In 7 randomisierten Studien wurde für überwiegend invasiv beatmete Patienten auf Intensivstationen die liberale gegenüber einer konservativen Sauerstofftherapie verglichen. Zielbereiche der Sauerstoffsättigung waren in den Studien nicht einheitlich, und die eingeschlossenen Patientenkollektive waren heterogen. In 2 Studien (eine mit ARDS-Patienten [„acute respiratory distress syndrome“, akutes Atemnotsyndrom], eine zweite mit Subgruppenanalyse von Patienten mit Sepsis) waren niedrige Zielbereiche der Normoxämie (SpO2: 88–92 %) mit erhöhter Sterblichkeit verbunden [42, 45], in den anderen Studien wurden höhere Zielbereiche untersucht.
Patienten, die trotz Flussraten
Flussrate
von mehr als 6 l Sauerstoff/min
6 l Sauerstoff/min
eine SpO2 von 92 % nicht erreichen, sollen unverzüglich durch einen erfahrenen Arzt in der Diagnostik und Behandlung von Menschen mit akutem Atemversagen oder von kritisch Kranken eingeschätzt werden.
Eine nichtinvasive Beatmung
Nichtinvasive Beatmung
soll primär bei Menschen mit hyperkapnischem Atemversagen mit konsekutiver Hypoxämie, besonders bei COPD mit Exazerbation und kardialem Lungenödem, eingesetzt werden, bei denen der pH-Wert < 7,35 beträgt. Bei hypoxämischen und moderat hyperkapnischen Patienten kann alternativ HFNC („high flow nasal cannula“, High-Flow-Sauerstofftherapie
High-Flow-Sauerstofftherapie
) zur Anwendung kommen ([46, 47], evidenzbasierte Empfehlung der S3-Leitlinie).
Sauerstofftherapie bei besonderen Patientengruppen
Nach Expertenmeinung ergeben sich keine anderen Zielbereiche der Sauerstofftherapie für Patienten mit akutem Koronarsyndrom
Akutes Koronarsyndrom
. In 2 Cochrane-Metaanalysen fand sich keine Evidenz für die routinemäßige Sauerstoffgabe beim akuten Myokardinfarkt, unerwünschte Effekte waren nicht ausgeschlossen [48, 49].
Auch bei Menschen mit neurologischen Erkrankungen
Neurologische Erkrankung
gelten nach Studienlage keine anderen Zielbereiche der Sauerstofftherapie. Bei ihnen sollte insbesondere eine Hyperoxämie vermieden werden.
Die Behandlung von Schwangeren
Schwangere
, inklusive solchen mit Asthma, sollte auf den Sauerstoffzielwerten basieren, von denen angenommen wird, dass sie bei anderen erwachsenen Patientengruppen angemessen sind.
Bei einer Kohlenmonoxidvergiftung
Kohlenmonoxidvergiftung
soll unabhängig von der Sauerstoffsättigung (SpO2) eine 100 %-Sauerstoffgabe oder Beatmung mit 100 % O2
100 % O2
unverzüglich und für die Dauer von bis zu 6 h erfolgen. Bei schwerer Kohlenmonoxidvergiftung (z. B. mit anhaltender Bewusstseinsstörung) kann eine hyperbare Sauerstofftherapie
Hyperbare Sauerstofftherapie
durchgeführt werden.
Während der kardiopulmonalen Wiederbelebung
Kardiopulmonale Wiederbelebung
soll der höchstmögliche Sauerstofffluss verwendet werden. Bei Wiedereintritt der spontanen Zirkulation und zuverlässiger Überwachungsmöglichkeit der Sauerstoffsättigung sollte ein Zielsättigungsbereich von 92–96 % angestrebt werden [50, 51].
Die Sauerstoffbehandlung von erwachsenen Patienten mit infektiösen Erkrankungen
Infektiöse Erkrankung
, die durch Aerosole übertragbar sind (z. B. SARS-CoV‑2 [„severe acute respiratory syndrome coronavirus 2“]), soll nach den gleichen Prinzipien und Zielbereichen wie bei anderen Patienten mit Hypoxämie erfolgen ([52], evidenzbasierte Empfehlung der S3-Leitlinie).
Bei Patienten mit Clusterkopfschmerz
Clusterkopfschmerz
soll Sauerstoff mit einer Flussrate von mindestens 12 l/min über mindestens 15 min z. B. über eine Reservoirmaske verabreicht werden ([53, 54], evidenzbasierte Empfehlung der S3-Leitlinie).
Bei allen Verfahren mit Sedierung
Sedierung
mit dem Ziel der erhaltenen Spontanatmung soll vor und während des Eingriffs und in der Aufwachphase die Sauerstoffsättigung kontinuierlich pulsoxymetrisch überwacht werden.
Bei endoskopischen Eingriffen
Endoskopischer Eingriff
sollten unter Sedierung bei Auftreten einer Hypoxämie (SpO2 < 92 % bzw. 88 % bei Risiko eines hyperkapnischen Atemversagens) das Vorliegen einer Hypoventilation geprüft und Sauerstoff als Bestandteil eines multimodalen Konzepts
Multimodales Konzept
(z. B. Freihaltung der Atemwege, assistierte Beatmung) verabreicht werden.
High-Flow-Sauerstoff
Bei stationären Patienten mit einem akuten hypoxischen Lungenversagen
Hypoxisches Lungenversagen
ohne Hyperkapnie sollte bei 6 l O2/min über Nasenbrille/Maske und einer Sauerstoffsättigung von < 92 % eine Sauerstofftherapie über High-Flow-Sauerstoff eingeleitet werden. In eine Cochrane-Metaanalyse zu dessen Einsatz auf Intensivstation wurden 22 randomisierte kontrollierte Studien mit über 5000 Patienten eingeschlossen. High-Flow-Sauerstoff war gegenüber konventionellem Sauerstoff nicht mit einer reduzierten Krankenhaussterblichkeit assoziiert, allerdings war das Risiko der Eskalation auf nichtinvasive Beatmung bzw. Intubation geringer [55].
Patienten unter High-Flow-Sauerstofftherapie sollten kontinuierlich am Monitor überwacht, engmaschig reevaluiert und Abbruchkriterien
Abbruchkriterium
dieser Behandlung festgelegt werden.
Befeuchtung von Sauerstoff
Bei der Verabreichung von Sauerstoff mit geringem Fluss (Maske oder Nasenkanülen) oder kurzfristiger Gabe mit hohem Fluss soll aufgrund von Ergebnissen randomisierter Studien und einer Metaanalyse keine Befeuchtung
Keine Befeuchtung
verwendet werden ([56, 57], evidenzbasierte Empfehlung der S3-Leitlinie).
Überwachung und Dokumentation der Sauerstofftherapie
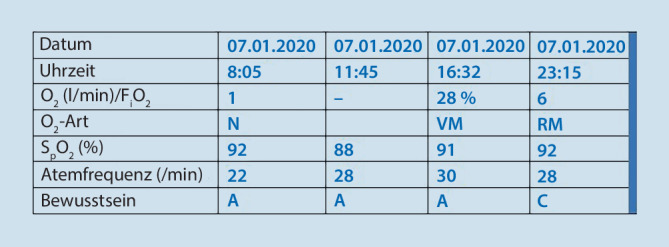
Eine schriftliche Dokumentation der Sauerstofftherapie soll Standard sein (Muster s. Abb. 3). Unter Sauerstofftherapie sind in vorgegebenen Intervallen
Vorgegebenes Intervall
, z. B. alle 6 h, die vollständige Erhebung und Dokumentation der Vitalzeichen
Vitalzeichen
erforderlich.
Beendigung der Sauerstofftherapie
Die Sauerstoffzufuhr sollte verringert werden, wenn ein Patient klinisch stabil ist und die Sauerstoffsättigung über dem Zielbereich liegt oder sich über mehrere Stunden in diesem befindet. Bei Patienten ohne Hyperkapnierisiko, die klinisch stabil sind und unter 2 l O2/min mit der Sauerstoffsättigung über mehrere Stunden im Zielbereich liegen, sollte die Sauerstofftherapie beendet werden. Bei Menschen, bei denen das Risiko eines hyperkapnischen Atemversagens besteht, sollten aufgrund des Risikos einer Reboundhypoxämie
Reboundhypoxämie
als niedrigste Menge vor Beendigung 0,5–1 l/min gewählt werden. Patienten sollten nach Beginn, Veränderung oder Beendigung der Sauerstofftherapie klinisch und pulsoxymetrisch für mindestens 5 min kontinuierlich überwacht werden.
Wenn eine Sauerstofftherapie nicht beendet werden kann, sollte sie auch nach der Entlassung
Entlassung
aus dem Krankenhaus fortgesetzt werden. Eine Reevaluation der hiervon Betroffenen sollte wenige Wochen nach Beginn der Sauerstofftherapie erfolgen, um zu prüfen, ob die Indikation für eine Langzeitsauerstofftherapie
Langzeitsauerstofftherapie
besteht.
Fazit für die Praxis
Sauerstoff (O2) ist ein Arzneimittel und muss schriftlich verordnet, überwacht und dokumentiert und von geschulten Anwendern verabreicht werden.
Indikation für die O2-Therapie in der Akutmedizin ist in der Regel die Hypoxämie – nicht Atemnot. Ausnahmen sind Clusterkopfschmerz, Kohlenmonoxidvergiftung und Patienten mit schwerer Atemnot, wenn keine Pulsoxymetrie ableitbar ist.
Sauerstoff wird am sichersten und für Patienten am komfortabelsten über Sauerstoffbrillen/-sonden, Venturi-Masken oder als High-Flow-Sauerstoff gegeben.
Die Pulsoxymetrie ist für die Überwachung der O2-Therapie Standard. Bei bestimmten Patienten müssen Blutgasanalysen durchgeführt werden.
Hypoxämie und Hyperoxämie sind unter O2-Therapie zu vermeiden.
Für jeden Patienten soll eine Ziel‑O2-Sättigung festgelegt werden.
Ohne Hyperkapnierisiko und bei Beatmung beträgt die Zielsättigung 92–96 %, mit Hyperkapnierisiko ohne Beatmung 88–92 %.
Mit O2-Therapie aus dem Krankenhaus entlassene Patienten müssen reevaluiert werden.
CME-Fragebogen
Welche Sauerstoffsättigung kann bei kranken Erwachsenen mit akuter Hypoxämie mittelfristig (d. h. über Stunden bis Tage anhaltend) toleriert werden?
Unbekannt
70 %
80 %
85 %
90 %
Eine 65-jährige Patientin mit fortgeschrittener COPD (chronisch-obstruktive Lungenerkrankung [„chronic obstructive pulmonary disease“]) wird mit Atemnot ins Krankenhaus eingeliefert. Mit einem Fluss von 8 l/min über eine Reservoirmaske ist sie somnolent bei einer O2-Sättigung von 95 %. Welcher Schritt ist am ehesten indiziert?
Unveränderte Fortführung der Sauerstofftherapie
Gabe eines Antidots
Wechsel des Sauerstoffsystems, z. B. auf eine Venturi-Maske mit 28 % FiO2 („fraction of inspired oxygen“ [inspiratorische Sauerstofffraktion])
Intubation und Beatmung
Erhöhung des Sauerstoffflusses zur Vermeidung der Rückatmung
Ein 40-jähriger morbider adipöser Patient (BMI [Body-Mass-Index] = 56 kg/m2) wird mit einer COVID-19-Pneumonie (COVID-19: „coronavirus disease 2019“) mit dem Rettungswagen in die Klinik gebracht. Die initiale Sättigung liegt bei 85 % bei einer Atemfrequenz von 26/min. Mit welcher Zielsättigung sollte Sauerstoff auf dem Transport verabreicht werden (SpO2: pulsoxymetrisch gemessene Sauerstoffsättigung)?
SpO2 > 90 %
SpO2 = 85–90 %
SpO2 = 88–92 %
SpO2 = 92–96 %
SpO2 = 98–100 %
Ein 40-jähriger morbider adipöser Patient (BMI [Body-Mass-Index] = 56 kg/m2) mit einer COVID-19-Pneumonie (COVID-19: „coronavirus disease 2019“) wird im Verlauf intubiert (letzter paCO2 [arterieller Kohlendioxidpartialdruck]: 52 mm Hg vor Intubation). Mit welcher Zielsättigung sollte Sauerstoff nun verabreicht werden (SaO2: arterielle Sauerstoffsättigung, SpO2: pulsoxymetrisch gemessene Sauerstoffsättigung)?
SpO2 > 90 %
SpO2 = 85–90 %
SpO2 = 88–92 %
SaO2 = 92–96 %
SpO2 = 88–96 %
Ein 80-jähriger Patient ohne Begleiterkrankungen hat 5 Tage nach einer Cholezystektomie eine SpO2 (pulsoxymetrisch gemessene Sauerstoffsättigung) von 98 % unter 2 l O2/min. Welcher Maßnahme ist am ehesten angezeigt?
Sauerstoff unverändert weitergeben
Sauerstoff auf 1,5 l/min reduzieren
Sauerstoff auf 1 l/min reduzieren
Sauerstoff auf 0,5 l/min reduzieren
Sauerstofftherapie beenden
Eine 59-jährige Patientin mit Exazerbation einer Lungenfibrose auf der Warteliste zur Lungentransplantation benötigt 10 l O2/min, um eine Sättigung von 92 % (Ziel 92–96 %) zu erreichen. Die Patientin gibt trockene Schleimhaut an, ihre Atemfrequenz ist 26/min. Welcher Schritt ist am ehesten indiziert?
Implantation einer extrakorporalen Membranoxygenierung (sog. Wach-ECMO)
Wechsel auf High-Flow-Sauerstoff unter kontinuierlichem Monitoring
Reduktion der Flussrate
Nasenpflege
Intubation
In welcher Situation sollte Sauerstoff auch ohne Vorhandensein einer Hypoxämie verabreicht werden?
Schwerste Atemnot ohne Hypoxämie
Akuter Myokardinfarkt
Schwerer Schlaganfall
Kohlenmonoxidvergiftung
Entbindung
Ein 68-jähriger Patient mit Leberzirrhose hat trotz 8 l O2/min über Nasenbrille nur eine O2-Sättigung von 88 %, aber keine Atemnot. Welcher Schritt ist am ehesten indiziert?
Abklärung eines Shunts
Wechsel auf High-Flow-Sauerstoff
Intubation und Beatmung
Venöse Blutgasanalyse
Bauchlagerung („self-proning“)
Ein 70-jähriger, männlicher COPD-Patient (COPD: chronisch-obstruktive Lungenerkrankung [„chronic obstructive pulmonary disease“]) mit Exazerbation wird aus stationärer Behandlung mit häuslichem Sauerstoff entlassen, da ohne Sauerstoff die SpO2 (pulsoxymetrisch gemessene Sauerstoffsättigung) in Ruhe wiederholt unter 88 % gemessen wurde. Welcher Maßnahme ist am ehesten angezeigt?
Langzeitsauerstofftherapie mit einer Ziel‑O2-Sättigung > 96 %
Überprüfung der Sauerstofftherapie nach 6 Wochen im ambulanten Bereich
Einleitung einer häuslichen nichtinvasiven Beatmung
Beginn einer Opiattherapie
Beendigung der Sauerstofftherapie nach 1 Woche
Bei welchen Patienten unter Sauerstofftherapie ist die Bestimmung arterieller Blutgase nicht indiziert?
Kritisch kranken Patienten
Beatmeten Patienten
Patienten mit schwerer Hypoxämie (über 6 l O2/min, um eine SpO2 [pulsoxymetrisch gemessene Sauerstoffsättigung] von 92 % zu erreichen)
Patienten mit Hyperkapnierisiko (z. B. COPD [chronisch-obstruktive Lungenerkrankung [„chronic obstructive pulmonary disease“]], schweres Asthma, Adipositas mit BMI [Body-Mass-Index] > 40 kg/m2)
Stabilen Patienten ohne Hyperkapnierisiko und mit niedrigem O2-Bedarf
Einhaltung ethischer Richtlinien
Interessenkonflikt
Gemäß den Richtlinien des Springer Medizin Verlags werden Autoren und Wissenschaftliche Leitung im Rahmen der Manuskripterstellung und Manuskriptfreigabe aufgefordert, eine vollständige Erklärung zu ihren finanziellen und nichtfinanziellen Interessen abzugeben.
Autoren
J. Gottlieb: A. Finanzielle Interessen: Deutsche Gesellschaft für Pneumologie – Förderung der S3-Leitlinie: Sauerstoff in der Akuttherapie beim Erwachsenen. – B. Nichtfinanzielle Interessen: Angestellter Internist und Pneumologe (MH [Medizinische Hochschule] Hannover), Koordinator der S3 Leitlinie: Sauerstoff in der Akuttherapie beim Erwachsene (AWMF [Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e.V.] 020-021) | Mitgliedschaften: DGP (Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin), ERS (European Respiratory Society), ISHLT (International Society of Heart and Lung Transplantation), DTG (Deutsche Transplantationsgesellschaft).
Wissenschaftliche Leitung
Die vollständige Erklärung zum Interessenkonflikt der Wissenschaftlichen Leitung finden Sie am Kurs der zertifizierten Fortbildung auf www.springermedizin.de/cme.
Der Verlag
erklärt, dass für die Publikation dieser CME-Fortbildung keine Sponsorengelder an den Verlag fließen.
Für diesen Beitrag wurden vom Autor keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes
Aus Gründen der besseren Lesbarkeit wird auf die gleichzeitige Verwendung männlicher und weiblicher Sprachformen verzichtet.

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Gottlieb J, Capetian P, Hamsen U, Janssens U, Karagiannidis C, Kluge S, et al. German S3 guideline—oxygen therapy in the acute care of adult patients. Pneumologie. 2021;101(2):214–252. doi: 10.1159/000520294. [DOI] [PubMed] [Google Scholar]
- 2.Kelly AM, McAlpine R, Kyle E. How accurate are pulse oximeters in patients with acute exacerbations of chronic obstructive airways disease? Respir Med. 2001;95(5):336–340. doi: 10.1053/rmed.2001.1046. [DOI] [PubMed] [Google Scholar]
- 3.Ebmeier SJ, Barker M, Bacon M, Beasley RC, Bellomo R, Knee Chong C, et al. A two centre observational study of simultaneous pulse oximetry and arterial oxygen saturation recordings in intensive care unit patients. Anaesth Intensive Care. 2018;46(3):297–303. doi: 10.1177/0310057X1804600307. [DOI] [PubMed] [Google Scholar]
- 4.Bleyer AJ, Vidya S, Russell GB, Jones CM, Sujata L, Daeihagh P, et al. Longitudinal analysis of one million vital signs in patients in an academic medical center. Resuscitation. 2011;82(11):1387–1392. doi: 10.1016/j.resuscitation.2011.06.033. [DOI] [PubMed] [Google Scholar]
- 5.Goodacre S, Turner J, Nicholl J. Prediction of mortality among emergency medical admissions. Emerg Med J. 2006;23(5):372–375. doi: 10.1136/emj.2005.028522. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Hafner S, Beloncle F, Koch A, Radermacher P, Asfar P. Hyperoxia in intensive care, emergency, and peri-operative medicine: Dr. Jekyll or Mr. Hyde? A 2015 update. Ann Intensive Care. 2015;5(1):42. doi: 10.1186/s13613-015-0084-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Chu DK, Kim LHY, Young PJ, Zamiri N, Almenawer SA, Jaeschke R, et al. Mortality and morbidity in acutely ill adults treated with liberal versus conservative oxygen therapy (IOTA): a systematic review and meta-analysis. Lancet. 2018;391(10131):1693–1705. doi: 10.1016/S0140-6736(18)30479-3. [DOI] [PubMed] [Google Scholar]
- 8.Edmark L, Kostova-Aherdan K, Enlund M, Hedenstierna G. Optimal oxygen concentration during induction of general anesthesia. Anesthesiology. 2003;98(1):28–33. doi: 10.1097/00000542-200301000-00008. [DOI] [PubMed] [Google Scholar]
- 9.Sackner MA, Landa J, Hirsch J, Zapata A. Pulmonary effects of oxygen breathing. A 6-hour study in normal men. Ann Intern Med. 1975;82(1):40–43. doi: 10.7326/0003-4819-82-1-40. [DOI] [PubMed] [Google Scholar]
- 10.Downs JB, Smith RA. Increased inspired oxygen concentration may delay diagnosis and treatment of significant deterioration in pulmonary function. Crit Care Med. 1999;27(12):2844–2846. doi: 10.1097/00003246-199912000-00050. [DOI] [PubMed] [Google Scholar]
- 11.Beasley R, Aldington S, Robinson G. Is it time to change the approach to oxygen therapy in the breathless patient? Thorax. 2007;62(10):840–841. doi: 10.1136/thx.2006.068866. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Austin MA, Wills KE, Blizzard L, Walters EH, Wood-Baker R. Effect of high flow oxygen on mortality in chronic obstructive pulmonary disease patients in prehospital setting: randomised controlled trial. BMJ. 2010;341:c5462. doi: 10.1136/bmj.c5462. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Wetterslev J, Meyhoff CS, Jorgensen LN, Gluud C, Lindschou J, Rasmussen LS. The effects of high perioperative inspiratory oxygen fraction for adult surgical patients. Cochrane Database Syst Rev. 2015 doi: 10.1002/14651858.CD012631.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Askie LM, Darlow BA, Finer N, Schmidt B, Stenson B, Tarnow-Mordi W, et al. Association between oxygen saturation targeting and death or disability in extremely preterm infants in the neonatal oxygenation prospective meta-analysis collaboration. JAMA. 2018;319(21):2190–2201. doi: 10.1001/jama.2018.5725. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Maitland K, Kiguli S, Olupot-Olupot P, Hamaluba M, Thomas K, Alaroker F, et al. Randomised controlled trial of oxygen therapy and high-flow nasal therapy in African children with pneumonia. Intensive Care Med. 2021;47(5):566–576. doi: 10.1007/s00134-021-06385-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Wyss-Dunant E. Acclimatization shock; studies in the Himalaya mountains. Minerva Med. 1955;46(21):675–685. [PubMed] [Google Scholar]
- 17.van der Post J, Noordzij LA, de Kam ML, Blauw GJ, Cohen AF, van Gerven JM. Evaluation of tests of central nervous system performance after hypoxemia for a model for cognitive impairment. J Psychopharmacol. 2002;16(4):337–343. doi: 10.1177/026988110201600408. [DOI] [PubMed] [Google Scholar]
- 18.Neill WA. Effects of arterial hypoxemia and hyperoxia on oxygen availability for myocardial metabolism. Patients with and without coronary heart disease. Am J Cardiol. 1969;24(2):166–171. doi: 10.1016/0002-9149(69)90399-3. [DOI] [PubMed] [Google Scholar]
- 19.Cranston JM, Crockett A, Currow D. Oxygen therapy for dyspnoea in adults. Cochrane Database Syst Rev. 2008 doi: 10.1002/14651858.CD004769.pub2.. [DOI] [PubMed] [Google Scholar]
- 20.Uronis H, McCrory DC, Samsa G, Currow D, Abernethy A. Symptomatic oxygen for non-hypoxaemic chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2011;6:CD006429. doi: 10.1002/14651858.CD006429.pub2. [DOI] [PubMed] [Google Scholar]
- 21.Uronis HE, Currow DC, McCrory DC, Samsa GP, Abernethy AP. Oxygen for relief of dyspnoea in mildly- or non-hypoxaemic patients with cancer: a systematic review and meta-analysis. Br J Cancer. 2008;98(2):294–299. doi: 10.1038/sj.bjc.6604161. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Pedersen T, Nicholson A, Hovhannisyan K, Moller AM, Smith AF, Lewis SR. Pulse oximetry for perioperative monitoring. Cochrane Database Syst Rev. 2014;3:CD002013. doi: 10.1002/14651858.CD002013.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Zavorsky GS, Cao J, Mayo NE, Gabbay R, Murias JM. Arterial versus capillary blood gases: a meta-analysis. Respir Physiol Neurobiol. 2007;155(3):268–279. doi: 10.1016/j.resp.2006.07.002. [DOI] [PubMed] [Google Scholar]
- 24.Magnet FS, Majorski DS, Callegari J, Schwarz SB, Schmoor C, Windisch W, et al. Capillary PO2 does not adequately reflect arterial PO2 in hypoxemic COPD patients. Int J Chron Obstruct Pulmon Dis. 2017;12:2647–2653. doi: 10.2147/COPD.S140843. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Ekkernkamp E, Welte L, Schmoor C, Huttmann SE, Dreher M, Windisch W, et al. Spot check analysis of gas exchange: invasive versus noninvasive methods. Respiration. 2015;89(4):294–303. doi: 10.1159/000371769. [DOI] [PubMed] [Google Scholar]
- 26.Lim BL, Kelly AM. A meta-analysis on the utility of peripheral venous blood gas analyses in exacerbations of chronic obstructive pulmonary disease in the emergency department. Eur J Emerg Med. 2010;17(5):246–248. doi: 10.1097/MEJ.0b013e328335622a. [DOI] [PubMed] [Google Scholar]
- 27.Byrne AL, Bennett M, Chatterji R, Symons R, Pace NL, Thomas PS. Peripheral venous and arterial blood gas analysis in adults: are they comparable? A systematic review and meta-analysis. Respirology. 2014;19(2):168–175. doi: 10.1111/resp.12225. [DOI] [PubMed] [Google Scholar]
- 28.Bingheng LJC, Yu C, Yijuan Y. Comparison of peripheral venous and arterial blood gas in patients with acute exacerbation of chronic obstructive pulmonary disease (AECOPD): a metaanalysis. Notfall Rettungsmed. 2019;22:620–627. doi: 10.1007/s10049-018-0469-9. [DOI] [Google Scholar]
- 29.Bloom BM, Grundlingh J, Bestwick JP, Harris T. The role of venous blood gas in the emergency department: a systematic review and meta-analysis. Eur J Emerg Med. 2014;21(2):81–88. doi: 10.1097/MEJ.0b013e32836437cf. [DOI] [PubMed] [Google Scholar]
- 30.AWMF online (2021) Sauerstoff in der Akuttherapie beim Erwachsenen. https://www.awmf.org/leitlinien/detail/ll/020-021.html. Zugegriffen: 10.06.2022
- 31.Costello RW, Liston R, McNicholas WT. Compliance at night with low flow oxygen therapy: a comparison of nasal cannulae and Venturi face masks. Thorax. 1995;50(4):405–406. doi: 10.1136/thx.50.4.405. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Nolan KM, Winyard JA, Goldhill DR. Comparison of nasal cannulae with face mask for oxygen administration to postoperative patients. Br J Anaesth. 1993;70(4):440–442. doi: 10.1093/bja/70.4.440. [DOI] [PubMed] [Google Scholar]
- 33.Eastwood GM, O’Connell B, Gardner A, Considine J. Evaluation of nasopharyngeal oxygen, nasal prongs and facemask oxygen therapy devices in adult patients: a randomised crossover trial. Anaesth Intensive Care. 2008;36(5):691–694. doi: 10.1177/0310057X0803600510. [DOI] [PubMed] [Google Scholar]
- 34.Stausholm K, Rosenberg-Adamsen S, Skriver M, Kehlet H, Rosenberg J. Comparison of three devices for oxygen administration in the late postoperative period. Br J Anaesth. 1995;74(5):607–609. doi: 10.1093/bja/74.5.607. [DOI] [PubMed] [Google Scholar]
- 35.Ayhan H, Iyigun E, Tastan S, Orhan ME, Ozturk E. Comparison of two different oxygen delivery methods in the early postoperative period: randomized trial. J Adv Nurs. 2009;65(6):1237–1247. doi: 10.1111/j.1365-2648.2009.04984.x. [DOI] [PubMed] [Google Scholar]
- 36.Siemieniuk RAC, Chu DK, Kim LH, Guell-Rous MR, Alhazzani W, Soccal PM, et al. Oxygen therapy for acutely ill medical patients: a clinical practice guideline. BMJ. 2018;363:k4169. doi: 10.1136/bmj.k4169. [DOI] [PubMed] [Google Scholar]
- 37.Kopsaftis Z, Carson-Chahhoud KV, Austin MA, Wood-Baker R. Oxygen therapy in the pre-hospital setting for acute exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2020;1:CD005534. doi: 10.1002/14651858.CD005534.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Abdo WF, Heunks LM. Oxygen-induced hypercapnia in COPD: myths and facts. Crit Care. 2012;16(5):323. doi: 10.1186/cc11475. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Girardis M, Busani S, Damiani E, Donati A, Rinaldi L, Marudi A, et al. Effect of conservative vs conventional oxygen therapy on mortality among patients in an intensive care unit: the oxygen-ICU randomized clinical trial. JAMA. 2016;316(15):1583–1589. doi: 10.1001/jama.2016.11993. [DOI] [PubMed] [Google Scholar]
- 40.Panwar R, Hardie M, Bellomo R, Barrot L, Eastwood GM, Young PJ, et al. Conservative versus liberal oxygenation targets for mechanically ventilated patients. A pilot multicenter randomized controlled trial. Am J Respir Crit Care Med. 2016;193(1):43–51. doi: 10.1164/rccm.201505-1019OC. [DOI] [PubMed] [Google Scholar]
- 41.Asfar P, Schortgen F, Boisrame-Helms J, Charpentier J, Guerot E, Megarbane B, et al. Hyperoxia and hypertonic saline in patients with septic shock (HYPERS2S): a two-by-two factorial, multicentre, randomised, clinical trial. Lancet Respir Med. 2017;5(3):180–190. doi: 10.1016/S2213-2600(17)30046-2. [DOI] [PubMed] [Google Scholar]
- 42.Barrot L, Asfar P, Mauny F, Winiszewski H, Montini F, Badie J, et al. Liberal or conservative oxygen therapy for acute respiratory distress syndrome. N Engl J Med. 2020;382(11):999–1008. doi: 10.1056/NEJMoa1916431. [DOI] [PubMed] [Google Scholar]
- 43.ICU-ROX Investigators and the Australian and New Zealand Intensive Care Society Clinical Trials Group. Mackle D, Bellomo R, Bailey M, et al. Conservative oxygen therapy during mechanical ventilation in the ICU. N Engl J Med. 2020;382(11):989–998. doi: 10.1056/NEJMoa1903297. [DOI] [PubMed] [Google Scholar]
- 44.Barbateskovic M, Schjorring OL, Russo Krauss S, Jakobsen JC, Meyhoff CS, Dahl RM, et al. Higher versus lower fraction of inspired oxygen or targets of arterial oxygenation for adults admitted to the intensive care unit. Cochrane Database Syst Rev. 2019;2019(11):CD012631. doi: 10.1002/14651858.CD012631.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Young P, Mackle D, Bellomo R, Bailey M, Beasley R, Deane A, et al. Conservative oxygen therapy for mechanically ventilated adults with sepsis: a post hoc analysis of data from the intensive care unit randomized trial comparing two approaches to oxygen therapy (ICU-ROX) Intensive Care Med. 2020;46(1):17–26. doi: 10.1007/s00134-019-05857-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Berbenetz N, Wang Y, Brown J, Godfrey C, Ahmad M, Vital FM, et al. Non-invasive positive pressure ventilation (CPAP or bilevel NPPV) for cardiogenic pulmonary oedema. Cochrane Database Syst Rev. 2019;4:CD005351. doi: 10.1002/14651858.CD005351.pub4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Osadnik CR, Tee VS, Carson-Chahhoud KV, Picot J, Wedzicha JA, Smith BJ. Non-invasive ventilation for the management of acute hypercapnic respiratory failure due to exacerbation of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017;7:CD004104. doi: 10.1002/14651858.CD004104.pub4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Cabello JB, Burls A, Emparanza JI, Bayliss SE, Quinn T. Oxygen therapy for acute myocardial infarction. Cochrane Database Syst Rev. 2016;12:CD007160. doi: 10.1002/14651858.CD007160.pub4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Burls A, Emparanza JI, Quinn T, Cabello JB. Oxygen use in acute myocardial infarction: an online survey of health professionals’ practice and beliefs. Emerg Med J. 2010;27(4):283–286. doi: 10.1136/emj.2009.077370. [DOI] [PubMed] [Google Scholar]
- 50.Holmberg MJ, Nicholson T, Nolan JP, Schexnayder S, Reynolds J, Nation K, et al. Oxygenation and ventilation targets after cardiac arrest: a systematic review and meta-analysis. Resuscitation. 2020;152:107–115. doi: 10.1016/j.resuscitation.2020.04.031. [DOI] [PubMed] [Google Scholar]
- 51.Wang CH, Chang WT, Huang CH, Tsai MS, Yu PH, Wang AY, et al. The effect of hyperoxia on survival following adult cardiac arrest: a systematic review and meta-analysis of observational studies. Resuscitation. 2014;85(9):1142–1148. doi: 10.1016/j.resuscitation.2014.05.021. [DOI] [PubMed] [Google Scholar]
- 52.Alhazzani W, Moller MH, Arabi YM, Loeb M, Gong MN, Fan E, et al. Surviving sepsis campaign: guidelines on the management of critically ill adults with coronavirus disease 2019 (COVID-19) Intensive Care Med. 2020;46(5):854–887. doi: 10.1007/s00134-020-06022-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Cohen AS, Burns B, Goadsby PJ. High-flow oxygen for treatment of cluster headache: a randomized trial. JAMA. 2009;302(22):2451–2457. doi: 10.1001/jama.2009.1855. [DOI] [PubMed] [Google Scholar]
- 54.Bennett MH, French C, Schnabel A, Wasiak J, Kranke P, Weibel S. Normobaric and hyperbaric oxygen therapy for the treatment and prevention of migraine and cluster headache. Cochrane Database Syst Rev. 2015;12:CD005219. doi: 10.1002/14651858.CD005219.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Lewis SR, Baker PE, Parker R, Smith AF. High-flow nasal cannulae for respiratory support in adult intensive care patients. Cochrane Database Syst Rev. 2021;3:CD010172. doi: 10.1002/14651858.CD010172.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Wen Z, Wang W, Zhang H, Wu C, Ding J, Shen M. Is humidified better than non-humidified low-flow oxygen therapy? A systematic review and meta-analysis. J Adv Nurs. 2017;73(11):2522–2533. doi: 10.1111/jan.13323. [DOI] [PubMed] [Google Scholar]
- 57.Poiroux L, Piquilloud L, Seegers V, Le Roy C, Colonval K, Agasse C, et al. Effect on comfort of administering bubble-humidified or dry oxygen: the oxyrea non-inferiority randomized study. Ann Intensive Care. 2018;8(1):126. doi: 10.1186/s13613-018-0472-9. [DOI] [PMC free article] [PubMed] [Google Scholar]