Abstract
Einleitung
Im Rahmen einer akuten COVID-19-Infektion (Coronavirus SARS-CoV‑2 Infektion) treten in 10–60 % der Patient:innen Kopfschmerzen auf, die Tage und in einem kleineren Teil (ca. 10 %) der Patient:innen Wochen oder länger anhalten können. Weniger bekannt ist aber, dass auch nach einer COVID-19-Impfung anhaltende Kopfschmerzen auftreten können.
Methode
Retrospektive Beschreibung der Kopfschmerzen und des Verlaufs in einer Fallserie von 32 ambulanten Patienten mit anhaltenden Kopfschmerzen, die sich in zeitlichem Zusammenhang mit einer COVID-19-Impfung verstärkt haben oder neu aufgetreten sind.
Ergebnis
In der Mehrzahl der Patient:innen kam es zur Verstärkung eines vorbestehenden Migränekopfschmerzes. Bei 2 Patient:innen traten seltene sekundäre Kopfschmerzsyndrome wie intrakranielle Hypertension oder Donnerschlagkopfschmerz auf. Die Kopfschmerzen manifestierten sich in über 50 % der Patient:innen innerhalb der ersten 48 h nach Impfung. Über 50 % der Patient:innen sprachen auf eine Akuttherapie mit einem Triptan an.
Schlussfolgerung
Über den pathophysiologischen Zusammenhang zwischen Impfung und anhaltenden Kopfschmerzen bestehen noch keine klaren Vorstellungen. Die kurze Latenz, die partielle Wirksamkeit von Kortison und erste Befunde, die eine Erhöhung von verschiedenen Entzündungsmarkern im Verlauf der Kopfschmerzen bei COVID-Infektion zeigen, weisen auf eine mögliche Beteiligung des angeborenen Immunsystems und hier des Inflammasoms hin. Des Weiteren weist das Ansprechen auf eine Triptangabe bei einem Teil der Patienten auf eine Aktivierung des trigeminovaskulären Systems hin.
Schlüsselwörter: COVID-19-Infektion, Trigeminovaskuläres System, Dauerkopfschmerz, Migräne, Inflammasom
Abstract
Introduction
In the setting of acute COVID-19 infection, headache occurs in 10–60% of patients and may last for days and, in a smaller proportion of patients, weeks (about 10%). However, it is less recognized that headache may also occur after vaccination with a short latency and may persist for a longer period in a still unclear number of patients.
Methods
Retrospective description of headache and course in a case series of 32 outpatients with headache that changed or recurred after COVID-19 vaccination.
Results
The majority of patients experienced an exacerbation of migraine headache; rare headache syndromes such as intracranial hypertension or thunderclap headache occurred in 2 patients. Headache manifested in more than 50% of patients within the first 48 h after vaccination. Over 50% of patients who received a triptan improved.
Conclusion
The pathophysiological relationship between vaccination and persistent headache is not yet clearly understood. The short latency, partial efficacy of cortisone, and initial findings showing an increase of various inflammatory markers during the course of headache in COVID infection suggest a possible involvement of the innate immune system and here the inflammasome. Furthermore, the response to triptan in a proportion of patients also indicates activation of the trigeminovascular system.
Keywords: COVID-19 infection, Trigeminovascular system, Chronic daily headache, Migraine, Inflammasome
Einleitung
In den letzten 2 Jahren hat die COVID-19-Pandemie die Gesellschaft, aber auch die klinische Forschung beherrscht und völlig neue Aspekte dieser viralen Infektion wurden berichtet. Wie für fieberhafte virale Infektionen (z. B. Influenza A [19]) nicht unüblich sind Kopfschmerzen ein häufiges Symptom der akuten COVID-19-Infektion [34]. Diese treten in der Regel schon zu Beginn der Erkrankung auf und sind bei Patient:innen mit einer primären Kopfschmerzerkrankung in der Vorgeschichte intensiver und länger anhaltend als bei Patient:innen ohne eine solche Vorgeschichte [25]. Weitere Risikofaktoren für die Ausbildung eines Kopfschmerzes sind jüngeres Lebensalter und eine Anosmie oder Ageusie im Rahmen der COVID-19-Infektion [27, 33]. Bei der Mehrzahl der Patient:innen vergehen diese Kopfschmerzen innerhalb von wenigen Tagen oder Wochen [27]. Die Kopfschmerzen werden als holozephal und zum Teil migräneartig oder auch spannungskopfschmerzartig beschrieben [27]. Andererseits finden sich aber auch Berichte, die eine Persistenz dieser Kopfschmerzen über die akute Erkrankung hinaus beschreiben [2, 9, 27]. Interessanterweise zeigt sich in einigen Untersuchungen als auch in einer Metaanalyse, dass das frühe Auftreten von Kopfschmerzen in der Infektion mit einer besseren Prognose bezüglich der COVID-Erkrankung korreliert [2, 27, 34].
In der letzten Zeit wurden auch verschiedene Berichte bezüglich der Auslösung von akuten, meist nur wenige Stunden anhaltenden Kopfschmerzen nach verschiedenen Formen von COVID-19-Impfungen publiziert. So berichten 57,5 % der Patient:innen einen holozephalen Kopfschmerz, der etwa 14,5 h nach der Impfung mit ChAdOx1 nCoV-19 (Vaxzevria®, AstraZeneca) beginnt und etwa im Mittel 16 h anhält [10]. Für den BioNTech-Impfstoff (BNT162b2; Comirnaty®, Pfizer) werden ähnliche Zahlen berichtet (Beginn nach 18 h, mittlere Dauer 14,2 h; [11]). Eine 2022 veröffentlichte Metaanalyse, welche 84 Publikationen in Hinblick auf das Auftreten von akuten Kopfschmerzen untersuchte, fand eine Häufigkeit von 22 % nach der ersten Impfung, 29 % nach der zweiten Impfung und von 10 bis 12 % nach Placebo [3]. Dabei wurde aber nicht in kurz anhaltende oder über Wochen persistierende Kopfschmerzen unterschieden. Die Häufigkeit von Kopfschmerzen nach der Impfung korrelierte invers mit dem Alter und Frauen waren etwas häufiger betroffen [13]. Eine Altersabhängigkeit der Impfnebenwirkungen wird auch von Jayadevan et al. in einer indischen Kohorte beschrieben [15]. Die Kopfschmerzsymptomatik wird bei ca. 1/3 der Patienten als migräneartig pulsierend mit Licht- und Lärmempfindlichkeit angegeben [3], wobei über 50 % der Patient:innen den nach der Vakzination auftretenden Kopfschmerz als intensiver und schwerer bezeichneten als den sonst spontan auftretenden Kopfschmerz [29]. In den bei Castaldo et al. [3] eingeschlossenen Studien fehlten allerdings Informationen zur durchschnittlichen Dauer zwischen Injektion und Beginn der Kopfschmerzen, Kopfschmerzcharakteristika, Wirkung von Akutmedikation oder vorbestehenden Kopfschmerzen. Sekiguchi konnte zeigen, dass die Kopfschmerzen nach Impfung bei Menschen mit vorbestehenden primären Kopfschmerzen ca. doppelt so häufig waren (13,9 % zu 30,9 %; [28]). Zusammenfassend kann gesagt werden, dass nach COVID-19-Impfungen häufig kurz anhaltende Kopfschmerzen berichtet werden, wobei das Zeitintervall zwischen Impfung und Kopfschmerzen mit weniger als 24 h anzugeben ist. Eine indische Studie beobachtete, dass Kopfschmerzen bei 3 % der Patient:innen sogar schon innerhalb von 30 min auftraten [16]. Andererseits berichteten auch im Durchschnitt 18,4 % der Patient:innen, die im Placeboarm der verschiedenen Zulassungsstudien für die Impfstoffe waren, über Kopfschmerzen, wobei die Patient:innen im Verumarm im Durchschnitt in 36,5 % solche berichteten [14]. Es gibt allerdings auch vereinzelte Berichte über eine Besserung bis zu einer vollständigen Remission vorbestehender Kopfschmerzen [12].
Neben diesen akuten und in der Regel nur kurzeitig bestehenden Kopfschmerzen nach COVID-19-Impfung (in Deutschland eingesetzte Impfstoffe [Tab. 1]) finden sich jetzt zunehmend Hinweise, dass nach Impfung auch für Wochen bis Monate anhaltende Kopfschmerzen auftreten können, wobei dies eine in der Literatur wenig beschriebene Nebenwirkung ist. Bisher besteht auch bezüglich der Therapie dieser anhaltenden Kopfschmerzen keine Klarheit. Im Folgenden sollen die Erfahrungen eines tertiären Kopfschmerzzentrums mit der Klassifikation und auch ersten Therapieansätzen bei anhaltenden Kopfschmerzen nach COVID-19-Impfung berichtet werden.
| Name | Firma | WHO-Zulassung | Typ |
|---|---|---|---|
| Comirnaty® (BNT162b2) | Pfizer/BioNTech | 31.12.2020 | mRNA-Impfstoff |
| Vaxzevria® (ChAdOx1/AZD1222) | AstraZeneca | 16.02.2021 | Adenovirus-Vektorimpfstoff |
| Jcovden® Ad26COV2.5 | Janssen-Cilag | 12.03.2021 | Adenovirus-Vektorimpfstoff |
| Spikevax® | Moderna Biotech | 30.04.2021 | mRNA-Impfstoff |
| Nuvaxovid® | Novavax | 20.12.2021 (EMA) | Spike-Protein (klassischer Impfstoff) |
mRNA Boten –> Ribonukleinsäure
EMA European Medicines Agency
Methode
Wir sahen am Oberbayerischen Kopfschmerzzentrum im Zeitraum von 4/2021 bis 6/2022 insgesamt 32 erwachsene Patient:innen, die im zeitlichen Zusammenhang (bis zu 14 Tagen) nach einer COVID-19-Impfung über anhaltende, zum Teil tägliche Kopfschmerzen klagten. Diese stellten sich selbstständig oder auf Überweisung des niedergelassenen Neurologen bei uns vor. Alle Patient:innen bis auf zwei, die auswärtig diagnostiziert wurden, wurden von einem der Autoren persönlich gesehen (AS, RR). Die Daten wurden retrospektiv anhand der Routinearztbriefe erfasst und mithilfe deskriptiver Methoden (absolute Häufigkeiten, Prozent, Mittelwerte, Standardabweichungen, Minima/Maxima) aufbereitet.
Ergebnisse
Patient:innen: 23 Frauen und 9 Männer im Alter von 18 bis 75 Jahren (mittleres Alter 43,2 ± 16,5 Jahre) wurden eingeschlossen. Detaillierte Fallbeschreibungen finden sich in Tab. 2.
| Nr. | Alter | Geschlecht | KS-Vorgeschichte | Aktuelle Diagnose | Frequenz | Intensität | Beginn in Bezug zur Impfung | Akute Therapie (Wirkung +, − oder unbekannt) |
Prophylaxe (Wirkung +, − oder unbekannt) |
Verlauf bis zur letzten (Verlaufs‑)Visite | Dauer | Impfstoff |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Patient:innen mit Kopfschmerz in der Vorgeschichte | ||||||||||||
| 1 | 23 | m | Ja | Intrakranielle Hypertension | Täglich | „Stärkere Intensität“ | > 7 d ≤ 14 d | Liquorablass, Acetazolamid | Keine | Remission | Nach 6 Wochen | AZ, Erstimpfung |
| 2 | 22 | w | Ja | NDPH | Täglich | 4–5/10 | > 48 h ≤ 7 d | Zolmitriptan (unbekannt), Thomapyrin (−), Naratriptan (−), Sumatriptan (+), AscoTop nasal (+) | Amitriptylin (−), Mirtazapin (−), Metoprolol bzw. Metoprololsuccinat (+), Acetazolamid (unbekannt), Botox (unbekannt), Topiramat (−) | Unter Metoprolol 30 % Besserung in der Intensität | ≥ 18 Monate | BT, Erstimpfung |
| 3 | 31 | w | Ja | NDPH | Täglich | 8–10/10 | ≤ 48 h | Ibuprofen (−), AscoTop (unbekannt) | Topiramat (unbekannt) | Unverändert | ≥ 20 Tage | BT, Zweitimpfung |
| 4 | 29 | m | Ja | NDPH | Täglich | 8–10/10 | > 48 h ≤ 7 d | Ibuprofen (−), Thomapyrin (−), Novalgin (−), Paracetamol (+) | Amitriptylin (unbekannt) | Unverändert | ≥ 4 Wochen | BT, Erstimpfung |
| 5 | 30 | w | Ja | Nicht näher bezeichneter Kopfschmerz mit Migränecharakteristika | Täglich | 6/10 | > 7 d ≤ 14 d | Ibuprofen (−), Naratriptan (+) | Keine | Vollständige Remission, als Grund wird Absetzen von Letrozol diskutiert | Nach 14 Tagen | BT, Zweitimpfung |
| 6 | 58 | m | Ja | NDPH | Fast täglich | 2–4/10 | Nicht genauer erhoben | k. A. | Amitriptylin (+), Kortison (+) | Besserung auf 15 Tage/Monat | ≥ 9 Monate | BT, Erstimpfung |
| 7 | 55 | w | Ja | NDPH | Täglich | 9/10 | ≤ 48 h | Rizatriptan (+) | Prednisolon (+) | Unter Prednisolon kurzfristige Besserung, Intensität insgesamt niedriger mit 3–7/10, nach Absetzen wieder stärkere KS | ≥ 4 Monate | BT, Boosterimpfung (im März 2020 bereits Coronainfektion) |
| 8 | 65 | m | Ja |
Migräne ohne Aura (deutliche Verschlechterung vorbestehender Migräne) |
3- bis 4‑mal monatlich Attacken von 1 bis 4 Tagen, also 3–16 Tage/Monat | „Stärkste Intensität“ | ≤ 48 h | Naratriptan (unbekannt), Naproxen (unbekannt), Formigran (+) | Candesartan bei erhöhtem Blutdruck | Unverändert | ≥ 8 Monate | BT, Zweitimpfung |
| 9 | 66 | m | Ja |
V. a. Spannungskopfschmerz, DD Migräne (deutliche Verschlechterung bei vorbestehender Migräne) |
Unbekannt | Bis zu 7/10 | ≤ 48 h | ASS (unbekannt) | Metoprolol (unbekannt) | Abklingend zum Zeitpunkt der letzten Verlaufsvisite | Unbekannt | BT, Zweitimpfung |
| 10 | 61 | w | Ja | Status migraenosus (14 Tage bzw. 4 Wochen) | Täglich für 2 bzw. 4 Wochen nach der Zweit- und Boosterimpfung | k. A. | Nicht genauer erhoben | Rizatriptan kombiniert mit Naproxen (+) | Botox (+), Candesartan (unbekannt) | Status migraenosus abklingend nach jeweils 4 Wochen, nach Botoxtherapie 10 Tage/Monat, letzte Verlaufsuntersuchung nach 13 Monaten | BT, Zweitimpfung & MO, Boosterimpfung | |
| 11 | 58 | w | Ja | Migräne ohne Aura (deutliche Verschlechterung vorbestehender Migräne) | 8–12 Tage/Monat | Bis zu 8/10 | ≤ 48 h | Tramal (−) | Amitriptylin (unbekannt) | Unverändert | ≥ 10 Monate | BT, Erstimpfung & Zweitimpfung |
| 12 | 26 | w | Ja |
Migräne mit visuell-sensibler Aura (deutliche Verschlechterung vorbestehender Migräne) |
k. A. | „Stärkste Kopfschmerzen“ | ≤ 48 h | Paracetamol (−) | Keine | Unverändert | ≥ 10 Tage | BT, Zweitimpfung |
| 13 | 75 | w | Ja |
Vestibuläre Migräne (deutliche Verschlechterung vorbestehender vestibulärer Migräne) |
k. A. | k. A. | ≤ 48 h | Keine | Amitriptylin (unbekannt), Candesartan (unbekannt) | Unverändert | ≥ 10 Monate | BT, Zweitimpfung |
| 14 | 59 | w | Ja |
Migräne mit und ohne Aura (deutliche Verschlechterung vorbestehender Migräne) |
3–6 Attacken/Monat | k. A. | Nicht genauer erhoben | Eletriptan (+), Zolmitriptan (+), Prednisolon (unbekannt), Eletriptan kombiniert mit Naproxen (unbekannt) | Keine | Unverändert | Unbekannt | AZ, Erstimpfung & MO, Boosterimpfung |
| 15 | 43 | w | Ja | Migräne ohne Aura (deutliche Verschlechterung vorbestehender Migräne) | 13–18 Tage/Monat | 5–6/10 | ≤ 48 h | Naratriptan kombiniert mit Naproxen (+) | Kortison (+), Topiramat (+) | Besserung unter Kortison, nach Absetzen von Kortison wieder vermehrt Kopfschmerz, unter Topiramat leichte Besserung | ≥ 18 Monate | BT, Erstimpfung, Zweitimpfung & Boosterimpfung |
| 16 | 29 | w | Ja | NDPH | Täglich | Dauerhaft 6–7/10 mit Verstärkung auf 8–9/10 | > 48 h ≤ 7 d | Einfache Analgetika (−) | Amitriptylin (abgesetzt wegen Nebenwirkungen), Kortison, (unbekannt), Flunarizin (unbekannt) | Unverändert | ≥ 10 Monate | MO, Erstimpfung |
| 17 | 52 | w | Ja | NDPH | Täglich | Dauerhaft 5–7/10 mit überlagerten intensiveren Migräneattacken | > 48 h ≤ 7 d | Keine Angaben | Escitalopram (unbekannt), Amitriptylin (unbekannt) | Unverändert | ≥ 14 Tage | BT, Zweitimpfung & MO, Boosterimpfung |
| 18 | 26 | w | Ja | NDPH | Täglich | 4–5/10 bis 6–8/10 | ≤ 48 h | Ibuprofen (unbekannt) | Amitriptylin (abgesetzt wegen Nebenwirkungen), Prednisolon (unbekannt), Metoprolol (unbekannt) | Unverändert | ≥ 6 Monate | BT, Boosterimpfung, zusätzlich Infektion 4 Tage nach Impfung |
| 19 | 53 | w | Ja | Status migraenosus, DD chronische Migräne ohne Aura | Täglich | 6/10, Exazerbationen bis zu 8–9/10 | ≤ 48 h | Ibuprofen (unbekannt) | Candesartan (unbekannt), Bisoprolol (unbekannt), Prednisolon (unbekannt), Opipramol (unbekannt) | Unverändert | ≥ 12 Monate | BT, Erstimpfung & Zweitimpfung |
| 20 | 49 | m | Ja | NDPH vom Spannungstyp | Täglich | 6–10/10 | ≤ 48 h | Keine Angaben | Amitriptylin (unbekannt) | Unverändert | ≥ 8 Monate | BT, Zweitimpfung |
| 21 | 33 | w | Ja | NDPH, V. a. MOH | Täglich | 6–10/10 | > 48 h ≤ 7 d | Ibuprofen (unbekannt) | Pregabalin (unbekannt), Kortison (unbekannt), Duloxetin (unbekannt), Bisoprolol (unbekannt), Amitriptylin (+) | Kurzfristige Besserung unter Amitriptylin, sonst unverändert | ≥ 7 Monate | Unbekannt |
| 22 | 31 | w | Ja |
Migräne mit Aura (deutliche Verschlechterung vorbestehender Migräne) |
Täglich | 1–8/10 | > 7 d ≤ 14 d | Ibuprofen (−), Rizatriptan (−), Thomapyrin (+) | Keine | Unverändert | ≥ 6 Monate | MO, Boosterimpfung |
| 23 | 28 | w | Ja | NDPH migräneartig | täglich | 5–7/10 | ≤ 48 h | Keine | Prednisolon (unbekannt), Amitriptylin (unbekannt) | Unverändert | ≥ 6 Monate | BT, Zweitimpfung |
| Patient:innen ohne Kopfschmerz in der Vorgeschichte | ||||||||||||
| 24 | 64 | w | Nein | Permanenter Kopfschmerz, unspezifisch | Fast täglich | 4–8/10 | ≤ 48 h | Novalgin-Infusion (unbekannt), Ibuprofen (unbekannt), Paracetamol (unbekannt) | Keine | Unverändert | ≥ 40 Tage | AZ, Erstimpfung |
| 25 | 56 | m | Nein | NDPH | Täglich | 5–7/10 | > 48 h ≤ 7 d | Klassische Analgetika (−), Naratriptan (unbekannt) | Prednisolon (unbekannt), Amitriptylin (unbekannt), Kortison (unbekannt), Mirtazapin (unbekannt) | Unverändert | ≥ 11 Monate | AZ, weiterer Anstieg der KS nach MO, Boosterimpfung |
| 26 | 18 | w | Nein | NDPH, migräneartig | Täglich | 6–10/10 | ≤ 48 h | ASS (−), Ibuprofen (−), Paracetamol (−), Novalgin (−), Sumatriptan (unbekannt) | Metoprolol (−), Topiramat (unbekannt) | Unverändert | ≥ 10 Monate | BT, Erstimpfung |
| 27 | 25 | w | Nein | NDPH migräneartig, DD Status migraenosus | Täglich | k. A. | ≤ 48 h | Aspirin (−), Ibuprofen (unbekannt), Novalgin (unbekannt) | Keine | Unverändert | ≥ 7 Tage | BT, Boosterimpfung |
| 28 | 34 | m | Nein | Akuter Donnerschlagkopfschmerz; Bildgebung und Liquor unauffällig | k. A. | Anfangs 10/10 | 4 Wochen | Ibuprofen (−), Thomapyrin (−), Novalgin (−), Paracetamol (+) | Keine | Donnerschlag-KS rückläufig | ≥ 2 Monate | AZ, Erstimpfung |
| 29 | 59 | w | Nein | Spannungskopfschmerz (auswärtige Diagnose) | Täglich | k. A. | ≤ 48 h | Ibuprofen (−), Paracetamol (−) | Amineurin (+, abgesetzt wegen Nebenwirkungen), Mirtazapin (+) | Vollständige Remission unter Mirtazapin | Nach 4 Monaten | MO, Boosterimpfung |
| 30 | 49 | w | Nein | NDPH (spannungskopfschmerzartig) | Täglich | > 4/10 | > 7 d ≤ 14 d | Ibuprofen (+), Kortison (+) | Prednisolon (unbekannt), Amitriptylin (+) | Rückläufig | ≥ 3 Monate | 2. Boosterimpfung |
| Keine Angabe bezüglich Kopfschmerz in der Vorgeschichte | ||||||||||||
| 31 | 23 | m | k. A. | NDPH | Täglich | 2–5/10 | ≤ 48 h | Keine wirksame Akutmedikation | Amitriptylin (+, abgesetzt wegen Nebenwirkungen), Mirtazapin (unbekannt) | 30 % Besserung der Intensität unter Amitriptylin | ≥ 13 Monate | AZ |
| 32 | 52 | w | k. A. | Kopfschmerzen und Zunahme der myasthenischen Symptomatik | Unbekannt | k. A. | > 7 d ≤ 14 d | Paracetamol (unbekannt) | Candesartan bei arterieller Hypertonie, Prednisolon (unbekannt) | Unverändert | ≥ 4 Monate | BT, Zweitimpfung |
AZ AstraZeneca, BT BioNTech, MO Moderna, MOH „medication overuse headache“ (Kopfschmerz bei Medikamentenübergebrauch, Diagnose 8.2 der ICHD-3), NDPH „new daily persistent headache“ (neu aufgetretener täglicher Kopfschmerz, Diagnose 4.10 der ICHD-3)
Impfung.
In 12 Patient:innen war es die Erstimpfung (38 %); in 12 die Zweitimpfung (38 %) und 5‑mal handelte es sich um die Boosterimpfung (16 %), 1‑mal um eine zweite Boosterimpfung. Bei zwei Patient:innen fehlte die Angabe. Beim Impfstoff handelte es sich um Vaxzevria® (AstraZeneca, 6 Patient:innen), Comirnaty® (BioNTech/Pfizer, 21 Patient:innen) und Spikevax® (Moderna, 3 Patient:innen). In 2 Patient:innen konnte der Impfstoff nicht erfragt werden. 4 Patient:innen berichteten über ein Auftreten anhaltender Kopfschmerzen nach der Erstimpfung und eine weitere Verschlechterung nach Zweit- bzw. Boosterimpfung.
Kopfschmerz.
Die Kopfschmerzen fingen bei der Mehrzahl der Patient:innen (53 %) innerhalb von 48 h nach Impfung an; bei weiteren 19 % innerhalb von 3 bis 7 Tagen, in 16 % in der 2. Woche und in 13 % war der Beginn nicht genauer dokumentiert worden.
Folgende Diagnosen wurden gestellt: Eine Patient:in zeigte in der Lumbalpunktion einen erhöhten Liquordruck (62 cm H2O) bei unauffälliger MRT-Bildgebung im Sinne einer intrakraniellen Hypertension, eine Patient:in stellte sich unter dem Bild eines Donnerschlagkopfschmerz vor. Bei 16 Patient:innen (50 %) wurde ein neu aufgetretener täglicher Kopfschmerz (NDPH) mit in 14 Patient:innen migräneartigen Symptomen diagnostiziert (d. h., es lag ein seit dem Beginn nach der Impfung täglicher Kopfschmerz vor seit > 3 Monaten, 11 dieser Patient:innen berichteten von primären Kopfschmerzen in der Vorgeschichte), in einem Patienten eine Verschlechterung der bekannten Migräne im Sinne einer jetzt chronischen Migräne (Kopfschmerzen an ≥ 15 Tagen/Monat, aber nicht täglich), bei weiteren 7 Patient:innen (22 %) kam es zu einer Verschlechterung einer vorbestehenden episodischen Migräne mit Zunahme der Häufigkeit und/oder Intensität und in 2 Patient:innen (6 %) zu einem anhaltenden Status migraenosus (d. h. seit dem Beginn nach der Impfung tägliche migräneartige Kopfschmerzen, jedoch noch < 3 Monate Dauer). Bei 4 Patient:innen (13 %) wurden die Kopfschmerzen als Spannungskopfschmerz (bzw. NDPH mit spannungskopfschmerzartigen Beschwerden) eingeordnet. 23 Patient:innen (72 %) berichteten über Kopfschmerzen in der Vorgeschichte (durchwegs episodische Migräne), 7 Patient:innen (22 %) hatten keine vorbestehenden Kopfschmerzen, bei 2 Patient:innen (6 %) fehlte die Angabe.
Verlauf und Therapie.
21 Patient:innen stellten sich nur einmal vor, wobei die Kopfschmerzen zum Zeitpunkt der Erstvorstellung teils bereits seit einigen Monaten anhielten. 11 Patient:innen wurden über einen Zeitraum von zwei Monaten bis einem Jahr beobachtet. Der Verlauf der Beschwerden war in 5 Patient:innen (16 %) anhaltend ohne Besserung. Die Patient:in mit der intrakraniellen Hypertonie, eine Patient:in mit nicht näher bezeichnetem Kopfschmerz und eine Patient:in mit Spannungskopfschmerz remittierten im Beobachtungszeitraum. Die Patient:in mit dem Donnerschlagkopfschmerz remittierte weitgehend innerhalb von 3 Wochen. 8 Patient:innen (25 %) berichteten über eine Teilremission mit signifikanter Besserung entweder der Frequenz (von tgl. auf hochfrequent episodisch) oder der Intensität.
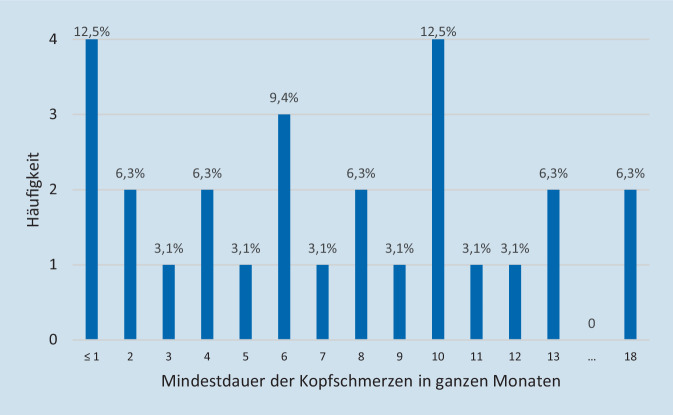
Die Kopfschmerzen dauerten bei der letzten durchgeführten (Verlaufs‑)Visite bereits mindestens 7 Tage bis 18 Monate an (M = 6,9 ± 5,1 Monate; siehe Abb. 1).
Medikation.
Die Mehrzahl (69 %) setzten klassische Analgetika zur Akuttherapie ein, 13 % Kombinationspräparate, 34 % Triptane und eine Patient:in Opioide (Mehrfachnennung möglich). Über 50 % der Patient:innen mit einer Triptaneinnahme und 50 % der Patient:innen unter Analgetika zeigten ein sehr gutes bis gutes Ansprechen. Zur Prophylaxe wurden am häufigsten Amitriptylin (16 Patient:innen) sowie Prednisolon (für 5–7 Tage) in 11 Patient:innen eingesetzt. Daneben gab es die Verordnung von Topiramat (4 Patient:innen), Flunarizin (eine Patient:in) sowie Metoprolol (eine Patient:in). Zwei Patient:innen mit Teilremission zeigten diese Besserung unter Amitriptylin, eine Patient:in jeweils unter Metoprolol bzw. Topiramat. Bei 2 Patient:innen wurde eine Besserung unter Kortison beobachtet, wobei eine Patient:in sich nach dem Absetzen von Prednisolon wieder verschlechterte.
Diskussion
Soweit diese unkontrollierte Fallserie es zulässt, kann man folgende Schlussfolgerungen formulieren:
Eine wenige Tage anhaltende Verschlechterung von vorbestehenden Kopfschmerzen, seltener auch neue, vorher nicht bekannte Kopfschmerzen können nach COVID-19 Impfung bei einem Teil der Patient:innen beobachtet werden. Es ergibt sich kein Hinweis auf einen Unterschied zwischen den Impfstoffen.
Ein kleiner, bisher nicht quantifizierter Teil dieser Patient:innen berichtet über anhaltende Kopfschmerzen nach der Impfung. Diese manifestieren sich bei der Mehrzahl als Verschlechterung einer vorbestehenden Migräne, zum Teil dann auch in Form von täglichen Kopfschmerzen bzw. anhaltendem Status migraenosus. Die Verschlechterung kann für Wochen bis Monate anhalten.
In wenigen Patient:innen können sich auch seltene Kopfschmerzsyndrome wie der Donnerschlagkopfschmerz und die intrakranielle Hypertension nach der COVID-19-Impfung manifestieren. Ob ein kausaler Zusammenhang oder nur eine zufällige zeitliche Koinzidenz besteht, ist unklar.
Bei einem Teil der Patienten weist der therapeutische Effekt von Triptanen auf die Aktivierung des trigeminovaskulären Systems hin und erlaubt eine Abgrenzung gegenüber dem Spannungskopfschmerz, bei dem eine Wirksamkeit von Triptanen in der Regel nicht gesehen wird.
Was ist bekannt bezüglich COVID-19 und Kopfschmerz?
Kopfschmerzen im Rahmen einer COVID-19-Infektion sind gut beschrieben und treten in etwa 10–60 % der Patient:innen auf, wobei die Zahlen von Studie zu Studie variieren [25, 27]. Generell ist das Vorliegen einer Anosmie ein Risikofaktor für das Auftreten von Kopfschmerzen wie auch das Vorliegen einer Migräne/eines primären Kopfschmerzes in der Vorgeschichte [27, 33]. Bei ausgeprägter systemischer Entzündungsaktivität werden die Kopfschmerzen mehr migräneartig beschrieben [18]. Über die Ursachen dieser Kopfschmerzen besteht weitgehend Unklarheit. Generell werden vier Mechanismen diskutiert. Pajo und Kollegen diskutieren einen direkten Befall des ZNS durch SARS-CoV‑2, einerseits hämatogen, alternativ durch retrograden Transport über den Nervus vagus aus Lunge und/oder Darm oder über den Nervus olfactorius [26]. Als Argument für eine hämatogene Verbreitung wurde das Neuauftreten von hyperdensen Läsionen im Marklager in T2-gewichteten MRT-Bildern gesehen, die mit der Schwere der Infektion korrelieren [23]. Für einen direkten Befall der Meningen und des Gehirns durch das COVID-19-Virus gibt es aber keine histologischen Hinweise [30]. Der Bezug von COVID-19 zu einer Anosmie wurde mit einer Invasion über den Nervus olfactorius in Verbindung gebracht, wobei jetzt aber eher der Befall der olfaktorischen Stützzellen und nicht primär der Nervenzellen als Ursache gesehen wird [21]. Insgesamt wird das COVID-19-Virus als nicht neurotrop angesehen. Bei COVID-19-Infektion tritt der Kopfschmerz typischerweise zeitgleich mit den anderen Symptomen der Infektion auf, sodass inflammatorische/immunologische Mechanismen denkbar sind, wobei hier zwischen dem angeborenen Immunsystem und dem adaptiven Immunsystem unterschieden werden muss. In ersten Studien wurde auch in der Tat eine Assoziation mit Entzündungsmarkern des angeborenen Immunsystems (HMGB1, NLRP3 und ACE2) und der Schwere der Kopfschmerzen beschrieben [1].
Bezüglich der im Rahmen einer Impfung auftretenden Kopfschmerzen findet sich nur eine begrenzte Zahl von Berichten, die fast ausschließlich die kurzfristig und nur wenige Stunden anhaltenden nach der Impfung auftretenden Kopfscherzen behandeln. Andererseits zeigt eine Analyse von italienischen Krankkassendaten eine Erhöhung der durchschnittlichen Kopfschmerztage um den Faktor 2,8–3,5 nach Impfung, dieses fand sich insbesondere für den BioNTech(Comirnaty®)- und den AstraZeneca(Vaxzevria®)-Impfstoff [24]. Es wird von Consoli et al. ein(e) Patient:in beschrieben, der/die einen Tag nach der Impfung mit Comirnaty® einen 11 Tage anhaltenden Status migraenosus entwickelte [4]. Ähnlich beschrieben Suwanwela und Kollegen in einer Fallserie 8 Patient:innen, die nach der Impfung mit dem chinesischen Impfstoff CoronaVac® innerhalb von 60 min auraartige Beschwerden entwickelten, die für bis zu 14 Tage anhielten und zum Teil mit Kopfschmerzen einhergingen. Die Mehrzahl der Patient:innen hatte eine Migräneanamnese und war weiblich [31]. Auch wird in der Literatur das Auftreten eines reversiblen zerebralen Vasokonstriktionssyndroms (RCVS) im Zusammenhang mit einer COVID-19-Impfung beschrieben [8] sowie auch einer reversiblen intrakraniellen Hypertension [32]. Die Mechanismen, wie eine COVID-19-Impfung diese Kopfschmerzerkrankungen auslöst, sind unverstanden.
Ein Vergleich von Kopfschmerzen nach COVID-19-Infektion mit den kurzfristigen Kopfschmerzen nach Impfung zeigte, dass die Kopfschmerzen nach Impfung kürzer und tendenziell leichter in der Intensität sind [6]. Die Studie zeigte auch, dass eine Vorgeschichte bezüglich primärer Kopfschmerzen das Risiko von Kopfschmerzen nach Impfung erhöht (OR 2,16), ebenso wie die Vorgeschichte mit Kopfschmerzen nach Influenzaimpfung (OR 4,84), weibliches Geschlecht (OR 1,96), Kopfschmerzen im Rahmen einer COVID-Infektion (OR 4,3) und auch vorbestehende Schilddrüsenerkrankungen (OR 1,54; [6]). Nicht ungewöhnlich für Kopfschmerzen überwiegt sowohl in unserer Fallserie wie auch in der Literatur das weibliche Geschlecht, wobei das Verhältnis ca. dem Verhältnis bei den Migräneerkrankungen entspricht. Der Beginn der Kopfschmerzen war in der Mehrheit der Patient:innen innerhalb von 48 h und die maximale Intensität war im Mittel 8,1 (±1,9) von 10 VAS. Die Kopfschmerzen konnten sowohl nach der Erstimpfung als auch nach späteren Impfungen auftreten. In mehr als 70 % der Patient:innen bestand eine Migräne in der Vorgeschichte. Dies deckt sich mit den Daten von Sekiguchi et al. (2022; [28]), die zeigten, dass Kopfschmerzen nach Impfung doppelt so häufig auftraten, wenn primäre Kopfschmerzen vorbestanden.
Die Einordnung der anhaltenden Kopfschmerzen nach COVID-19-Impfung nach ICHD‑3 ist nicht ganz einfach. In den Fällen mit einer vorbestehenden, aktiven Migräne und einer akut einsetzenden über Monate anhaltenden Verschlechterung könnte als Diagnose eine chronische Migräne diskutiert werden. In den Patient:innen mit über Tage anhaltenden Migränekopfschmerzen mit und ohne Auren würde man von einem Migränestatus ausgehen, je nach Verlauf dann mit Remission bzw. Übergang in einen NDPH (s. unten) oder eine chronische Migräne. Andererseits können die Patient:innen den Beginn ihrer Kopfschmerzen meist für den Tag genau festlegen, sodass für Patient:innen mit länger als 3 Monate anhaltenden täglichen Kopfschmerzen auch die Diagnose eines neu aufgetretenen täglichen Kopfschmerzes (engl. „new daily persisting headache“ [NDPH]; IHS III 4.10) diskutiert werden kann. Interessanterweise wurden als Ursache des NDPH in der Vergangenheit immer wieder auch Virusinfektionen diskutiert wie z. B. mit dem Epstein-Barr-Virus, dem Herpes-simplex-Virus Typ 6 oder auch COVID-19-Infektionen [5, 7]. Gemeinsam ist, dass die Latenz bis zum Beginn der Kopfschmerzen in der vorliegenden Fallserie in der Mehrzahl weniger als 48 h betrug. Diese Latenz ist zu kurz, um von einer Immunantwort des adaptiven, erworbenen Immunsystems auszugehen, da mit einem Auftreten von Antikörpern frühestens nach 5 bis 7 Tagen zu rechnen ist. Alternativ wäre eine überschießende Entzündungsantwort des inerten, angeborenen Immunsystems zu diskutieren, welches direkt durch das Virus aktiviert wird und über verschiedene Mechanismen (zellulär wie auch humoral) sekundär das adaptive Immunsystem aktiviert. In diese Befunde passt auch, dass Patient:innen, die nach Influenzaimpfung über Kopfschmerzen klagen, vermehrt auch nach COVID-19-Impfung bzw. -Infektion über Kopfschmerzen klagen [6]. Auch in dieser Studie war die Latenz zwischen Impfung und Beginn der Kopfschmerzen mit 1,8 Tagen sehr kurz und Frauen waren knapp 2:1 häufiger betroffen, was relativ gut mit der Verteilung der Patient:innen mit anhaltenden Kopfschmerzen nach COVID-19-Impfung in unserer Fallserie übereinstimmt.
Kontrollierte Therapiestudien zu Post-COVID-Kopfschmerzen bzw. Post-COVID-Impfungs-Kopfschmerzen sind bisher nicht publiziert worden. In den meisten Studien wurden bei Kopfschmerzen im Rahmen der Infektion klassische Analgetika wie z. B. Ibuprofen und Paracetamol eingesetzt, wobei bezüglich der Effektivität keine genauen Angaben gemacht werden [2, 27]. In einem Review wird davon ausgegangen, dass 26 % der Patient:innen mit COVID-Kopfschmerzen auf die Standardanalgetika eine komplette Beschwerdefreiheit und weitere 54 % eine Besserung berichten [27]. Zum Vergleich führten in der hier beschriebenen Fallserie einfache Schmerzmittel nur in 27 % zu einer Minderung der Kopfschmerzen, in 36 % nicht. In weiteren 36 % war die Wirkung unbekannt. Dies könnte ein Hinweis darauf sein, dass lang anhaltende Kopfschmerzen nach Impfung möglicherweise schwerer behandelbar sind als nach COVID-Infektion, und sollte in Behandlungsstudien genauer untersucht werden.
In einer Fallserie von 6 Patient:innen mit Kopfschmerzen im Verlauf einer Infektion konnten diese durch eine nasal verabreichte Blockade des Ganglion sphenopalatinum (SPG) mit Lokalanästhetika signifikant gebessert werden [22]. Ähnlich wird in einer retrospektiven Serie in 27 Patient:innen (12 Frauen, 15 Männer) mit Post-COVID-Kopfschmerzen von einer signifikanten Besserung nach einer Blockade des Nervus occipitalis major berichtet [17]. In einer weiteren unkontrollierten Fallserie (N = 37, 24 Frauen, 13 Männer) besserten sich Kopfschmerzen im Rahmen der Infektion bzw. Post-COVID-Kopfschmerzen auf die Gabe von 2 × 50 mg Indometacin tgl. für 5 Tage [20]. Studien zur akuten und prophylaktischen Therapie der Postimpfungskopfschmerzen fehlen bisher. In unserer Serie wurde keine Therapie systematisch eingesetzt, sondern meist die schon bestehende Therapie modifiziert. Als Akutmedikation zeigten sowohl Analgetika, aber auch Triptane eine Wirksamkeit. Eine Prophylaxe, wie sie in der Migräne eingesetzt wird, zeigte sich in einer kleinen Anzahl von Patient:innen erfolgreich (Amitriptylin, Topiramat, Metoprolol sowie Prednisolon). Grundsätzlich lässt dies auch an eine Aktivierung des trigeminovaskulären Systems bei Kopfschmerzen nach Impfung bei einem nennenswerten Anteil der Patient:innen denken, welche eine Abgrenzung zu Spannungskopfschmerzen darstellt, die auch im Rahmen der COVID-19-Infektionen beschrieben wurden. Auch die erfolgreiche Therapie durch SPG-Blockade bzw. Indometacin bei Post-COVID-Kopfschmerzen lässt sich so interpretieren. Bisher wurde über die Mechanismen, die für den Kopfschmerz verantwortlich sind, nichts berichtet. Die Wirksamkeit von Prednisolon wäre mit der Wirkung von Kortison auf den NF-κB-Signalweg und die mtROS-abhängige Aktivierung des NLRP3-Inflammasoms vereinbar [35]. Andere Hemmstoffe des Inflammasoms sind in der Kopfschmerztherapie nicht eingeführt, sodass die Hemmung der Inflammasomaktivierung ein in der Zukunft zu testender Therapieansatz sein könnte (z. B. IL-1-Antagonisten).
Fazit für die Praxis
Zusammenfassend ist festzuhalten, dass Kopfschmerzen nach COVID-19-Impfung schon nach der ersten Impfung innerhalb von wenigen Stunden auftreten können. Meist sind diese Kopfschmerzen von begrenzter Dauer. Es gibt aber nicht ganz selten Patient:innen mit über Monate anhaltenden Kopfschmerzen. Risikofaktoren sind weibliches Geschlecht, eine Migräne in der Vorgeschichte bzw. Kopfschmerzen bei früheren Influenzaimpfungen. Der Zeitverlauf und erste Ergebnisse aus serologischen Untersuchungen nach COVID-Erkrankung lassen eine Beteiligung des angeborenen Immunsystems (Aktivierung des NLRP3-Inflammasoms) vermuten. Möglicherweise sind Therapien, wie sie auch bei der Migräne eingesetzt werden, erfolgversprechend. Studien zur Wirksamkeit von spezifisch das Inflammasom hemmenden Substanzen stehen noch aus.
Einhaltung ethischer Richtlinien
Interessenkonflikt
A. Straube gibt an: Für Vortragstätigkeit und Beratung: Allergan, Novartis, Lundbeck, Lilly, Sanofi, Teva. Forschungsunterstützung: Novartis, DFG, Universität München. R. Ruscheweyh gibt an: Honorare für Vorträge oder Advisory Boards sowie Unterstützung für Kongressreisen von Hormosan, Novartis, Lilly, Lundbeck, Allergan, Teva. T. Klonowski gibt an: Zuschuss für Kongressteilnahme von Teva.
Für diesen Beitrag wurden von den Autor/-innen keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Bolay H, Karadas Ö, Oztürk B, Sonkaya R, Tasdelen B, Bulut TDS, Gülbahar Ö, Özge A, Baykan B. HMGB1, NLRP3, IL-6 and ACE2 levels are elevated in COVID-19 with headache: a window to the infection-related headache mechanism. J Headache Pain. 2021;22(1):94. doi: 10.1186/s10194-021-01306-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Caronna E, Ballvé A, Llauradó A, Gallardo VJ, Ariton DM, Lallana S, López Maza S, Gadea OM, Quibus L, Restrepo JL, Rodrigo-Gisbert M, Vilaseca A, Hernandez Gonzalez M, Martinez GM, Alpuente A, Torres-Ferrus M, Pujol Borrell R, Alvarez-Sabin J, Pozo-Rosich P. Headache: a striking prodromal and persistent symptom, predictive of COVID-19 clinical evolution. Cephalalgia. 2020;40(13):1410–1421. doi: 10.1177/0333102420965157. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Castaldo M, Waliszewska-Prosół M, Koutsokera M, Robotti M, Straburzyński M, Apostolakopoulou L, Capizzi M, Çibuku O, Ambat FDF, Frattale I, Gadzhieva Z, Gallo E, Gryglas-Dworak A, Halili G, Jusupova A, Koperskaya Y, Leheste AR, Manzo ML, Marcinnò A, Marino A, Mikulenka P, Ong BE, Polat B, Popovic Z, Rivera-Mancilla E, Roceanu AM, Rollo E, Romozzi M, Ruscitto C, Scotto di Clemente F, Strauss S, Taranta V, Terhart M, Tychenko I, Vigneri S, Misiak B, Martelletti P, Raggi A, European Headache Federation School of Advanced Studies (EHF-SAS) Headache onset after vaccination against SARS-CoV-2: a systematic literature review and meta-analysis. J Headache Pain. 2022;23(1):41. doi: 10.1186/s10194-022-01400-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Consoli S, Dono F, Evangelista G, D’Apolito M, Travaglini D, Onofrj M, Bonanni L. Status migrainosus: a potential adverse reaction to Comirnaty (BNT162b2, BioNtech/Pfizer) COVID-19 vaccine—a case report. Neurol Sci. 2022;43(2):767–770. doi: 10.1007/s10072-021-05741-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Diaz-Mitoma F, Vanast WJ, Tyrrell DL. Increased frequency of Epstein-Barr virus excretion in patients with new daily persistent headaches. Lancet. 1987;1(8530):411–415. doi: 10.1016/s0140-6736(87)90119-x. [DOI] [PubMed] [Google Scholar]
- 6.Ekizoglu E, Gezegen H, Yalınay Dikmen P, Orhan EK, Ertaş M, Baykan B. The characteristics of COVID-19 vaccine-related headache: clues gathered from the healthcare personnel in the pandemic. Cephalalgia. 2022;42(4-5):366–375. doi: 10.1177/03331024211042390. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Evers S. Neu aufgetretener täglicher Kopfschmerz. Nervenheilkunde. 2022;41:176–182. doi: 10.1055/a-1740-5720. [DOI] [Google Scholar]
- 8.Finsterer J. First reported case of reversible cerebral vasoconstriction syndrome after a SARS-CoV-2 vaccine. Cureus. 2021;13(11):e19987. doi: 10.7759/cureus.19987. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Ghosn J, Piroth L, Epaulard O, Le Turnier P, Mentré F, Bachelet D, Laouénan C, French COVID cohort study and investigators groups Persistent COVID-19 symptoms are highly prevalent 6 months after hospitalization: results from a large prospective cohort. Clin Microbiol Infect. 2021;27(7):1041.e1–1041.e4. doi: 10.1016/j.cmi.2021.03.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Göbel CH, Heinze A, Karstedt S, Morscheck M, Tashiro L, Cirkel A, Hamid Q, Halwani R, Temsah MH, Ziemann M, Görg S, Münte T, Göbel H. Headache attributed to vaccination against COVID-19 (Coronavirus SARS-coV-2) with the ChAdox1 ncoV-19 (AZD1222) vaccine: a multicenter observational cohort study. Pain Ther. 2021;10(2):1309–1330. doi: 10.1007/s40122-021-00296-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Göbel CH, Heinze A, Karstedt S, Morscheck M, Tashiro L, Cirkel A, Hamid Q, Halwani R, Temsah MH, Ziemann M, Görg S, Münte T, Göbel H. Clinical characteristics of headache after vaccination against COVID-19 (coronavirus SARS-CoV-2) with the BNT162b2 mRNA vaccine: a multicentre observational cohort study. Brain Commun. 2021;3(3):fcab169. doi: 10.1093/braincomms/fcab169. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.González-Menacho J, Villas-Roca M, Castañé H, Joven J, Camps J, Iftimie S. Can COVID-19 vaccines relieve severe tension-type headache and migraine? Med Hypotheses. 2022;161:110812. doi: 10.1016/j.mehy.2022.110812. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Green MS, Peer V, Magid A, Hagani N, Anis E, Nitzan D. Gender differences in adverse events following the Pfizer-bioNtech COVID-19 vaccine. Vaccines. 2022;10(2):233. doi: 10.3390/vaccines10020233. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Haas JW, Bender FL, Ballou S, Kelley JM, Wilhelm M, Miller FG, Rief W, Kaptchuk TJ. Frequency of adverse events in the placebo arms of COVID-19 vaccine trials: a systematic review and meta-analysis. JAMA Netw Open. 2022;5(1):e2143955–PMC8767431. doi: 10.1001/jamanetworkopen.2021.43955. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Jayadevan R, Shenoy R, Anithadevi T. Survey of symptoms following COVID-19 vaccination in India. 2021. [Google Scholar]
- 16.Kamble B, Bashar MA, Mishra CP. Incidence, pattern and severity of adverse events following immunization (AEFis) associated with chadox1 nCOV-19 corona virus vaccine (recombinant) among the Healthcare workers of a tertiary care institute of eastern Uttar Pradesh, India. Cureus. 2021;14(2):e21848. doi: 10.7759/cureus.21848. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Karadaş Ö, Gül HL, Öztürk B, Sonkaya AR, Özön AÖ, Shafiyev J, Sir E. Greater occipital nerve block efficacy in COVID-19 associated headache: a preliminary study. Acta Neurobiol Exp. 2021;81(4):386–392. [PubMed] [Google Scholar]
- 18.Karadaş Ö, Öztürk B, Sonkaya AR, Taşdelen B, Özge A, Bolay H. Latent class cluster analysis identified hidden headache phenotypes in COVID-19: impact of pulmonary infiltration and IL-6. Neurol Sci. 2021;42(5):1665–1673. doi: 10.1007/s10072-020-04978-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Khandaker G, Dierig A, Rashid H, King C, Heron L, Booy R. Systematic review of clinical and epidemiological features of the pandemic influenza A (H1N1) 2009. Influenza Other Respir Viruses. 2011;5(3):148–156. doi: 10.1111/j.1750-2659.2011.00199.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Krymchantowski AV, Silva-Néto RP, Jevoux C, Krymchantowski AG. Indomethacin for refractory COVID or post-COVID headache: a retrospective study. Acta Neurol Belg. 2022;122(2):465–469. doi: 10.1007/s13760-021-01790-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Liang F, Wang Y. COVID-19 Anosmia: high prevalence, plural neuropathogenic mechanisms, and scarce neurotropism of SARS-coV-2? Viruses. 2021;13(11):2225. doi: 10.3390/v13112225. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Machado FC, Carone Neto G, Carone RSD. Sphenopalatine ganglion block for refractory COVID-19 headache: a descriptive case series. Braz J Anesthesiol. 2021;71(6):667–669. doi: 10.1016/j.bjane.2021.04.024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Marcic L, Marcic M, Kojundzic SL, Marcic B, Capkun V, Vukojevic K. Personalized approach to patient with MRI brain changes after SARS-coV-2 infection. J Pers Med. 2021;11(6):442. doi: 10.3390/jpm11060442. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Mattiuzzi C, Lippi G. Headache after COVID-19 vaccination: updated report from the Italian Medicines Agency database. Neurol Sci. 2021;42(9):3531–3532. doi: 10.1007/s10072-021-05354-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Membrilla JA, de Lorenzo Í, Sastre M, Díaz de Terán J. Headache as a cardinal symptom of Coronavirus disease 2019: a cross-sectional study. Headache. 2020;60(10):2176–2191. doi: 10.1111/head.13967. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Pajo AT, Espiritu AI, Apor ADAO, Jamora RDG. Neuropathologic findings of patients with COVID-19: a systematic review. Neurol Sci. 2021;42(4):1255–1266. doi: 10.1007/s10072-021-05068-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Sampaio Rocha-Filho PA. Headache associated with COVID-19: epidemiology, characteristics, pathophysiology, and management. Headache. 2021;62(6):650–656. doi: 10.1111/head.14319. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Sekiguchi K, Watanabe N, Miyazaki N, Ishizuchi K, Iba C, Tagashira Y, Uno S, Shibata M, Hasegawa N, Takemura R, Nakahara J, Takizawa T. Incidence of headache after COVID-19 vaccination in patients with history of headache: a cross-sectional study. Cephalalgia. 2022;42(3):266–272. doi: 10.1177/03331024211038654. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Silvestro M, Tessitore A, Orologio I, Sozio P, Napolitano G, Siciliano M, Tedeschi G, Russo A. Headache worsening after COVID-19 vaccination: an online questionnaire-based study on 841 patients with migraine. J Clin Med. 2021;10(24):5914. doi: 10.3390/jcm10245914. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Solomon IH, Normandin E, Bhattacharyya S, Mukerji SS, Keller K, Ali AS, Adams G, Hornick JL, Padera RF, Jr, Sabeti P. Neuropathological features of Covid-19. N Engl J Med. 2020;383(10):989–992. doi: 10.1056/NEJMc2019373. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Suwanwela NC, Kijpaisalratana N, Tepmongkol S, Rattanawong W, Vorasayan P, Charnnarong C, Tantivattana J, Roongruang S, Ongphichetmetha T, Panjasriprakarn P, Chutinet A, Akarathanawat W, Saver JL. Prolonged migraine aura resembling ischemic stroke following CoronaVac vaccination: an extended case series. J Headache Pain. 2022;23(1):13. doi: 10.1186/s10194-022-01385-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Thunstedt DC, Straube A, Schöberl F. Isolated intracranial hypertension following COVID-19 vaccination: a case report. Cephalagia Rep. 2021;4:1–3. [Google Scholar]
- 33.Tolebeyan AS, Zhang N, Cooper V, Kuruvilla DE. Headache in patients with severe acute respiratory syndrome Coronavirus 2 infection: a narrative review. Headache. 2020;60(10):2131–2138. doi: 10.1111/head.13980. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Trigo J, García-Azorín D, Planchuelo-Gómez Á, Martínez-Pías E, Talavera B, Hernández-Pérez I, Valle-Peñacoba G, Simón-Campo P, de Lera M, Chavarría-Miranda A, López-Sanz C, Gutiérrez-Sánchez M, Martínez-Velasco E, Pedraza M, Sierra Á, Gómez-Vicente B, Arenillas JF, Guerrero ÁL. Factors associated with the presence of headache in hospitalized COVID-19 patients and impact on prognosis: a retrospective cohort study. J Headache Pain. 2020;21(1):94. doi: 10.1186/s10194-020-01165-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Yang JW, Mao B, Tao RJ, Fan LC, Lu HW, Ge BX, Xu JF. Corticosteroids alleviate lipopolysaccharide-induced inflammation and lung injury via inhibiting NLRP3-inflammasome activation. J Cell Mol Med. 2020;24(21):12716–12725. doi: 10.1111/jcmm.15849. [DOI] [PMC free article] [PubMed] [Google Scholar]