Abstract
偏侧化是人脑结构的基本特征,揭示偏侧化的遗传效应是阐明其发生机制的先决条件。多模态磁共振影像技术的发展为全面探测大脑偏侧化及其遗传机制提供了技术手段。通过结合磁共振影像数据,现已可以用基因-遗传度等方法对人脑结构偏侧化的个体差异进行定量遗传映射研究,而双生子模型为研究先天遗传和后天环境对大脑的影响提供了天然的试验模型。基于磁共振影像的双生子研究表明,人脑结构组织的偏侧化是有基因作为遗传基础的。本文以定量遗传分析为视角,着重从遗传度的偏侧化、偏侧化的遗传度及遗传相关性三大层面,回顾分析半脑偏侧化的基因效应及共变的基因机制研究的最新进展,并提出该领域发展的局限性和挑战。这一系统的回顾旨在快速地引导科研人员了解人脑左右半球差异的起源与遗传机制的研究现状,为进一步理解和探讨偏侧的认知行为个体差异提供了遗传依据。
Keywords: 磁共振成像, 偏侧化, 遗传度, 遗传相关性, 双生子研究
Abstract
Hemispheric asymmetry is a fundamental organizing principle of the human brain. Answering the genetic effects of the asymmetry is a prerequisite for elucidating developmental mechanisms of brain asymmetries. Multi-modal magnetic resonance imaging (MRI) has provided an important tool for comprehensively interpreting human brain asymmetry and its genetic mechanism. By combining MRI data, individual differences in brain structural asymmetry have been investigated with quantitative genetic brain mapping using gene-heritability. Twins provide a useful natural model for studying the effects of genetics and environment on the brain. Studies based on MRI have found that the asymmetry of human brain structure has a genetic basis. From the perspective of quantitative genetic analysis, this article reviews recent findings on the genetic effects of asymmetry and genetic covariance between hemispheres from three aspects: the asymmetry of heritability, the heritability of asymmetry and the genetic correlation. At last, the article shows the limitations and future research directions in this field. The purpose of this systematic review is to quickly guide researchers to understand the origins and genetic mechanism of interhemispheric differences, and provide a genetic basis for further understanding and exploring individual differences in laterized cognitive behavior.
Keywords: magnetic resonance imaging, asymmetry, heritability, genetic correlation, twin study
引言
半球偏侧化是人脑的基本组织结构[1-3]。大脑的不对称性或偏侧化,通过大部分人左半球比右半球更具语言功能优势得以体现[4-5]。磁共振影像(magnetic resonance imaging,MRI)技术的发展为全面解读人脑偏侧化提供了重要手段[6]。
大量的 MRI 影像研究表明,正常大脑的一些结构表型(如脑灰质体积、皮层厚度、脑白质完整性及脑功能活动等)存在偏侧化[6-8],这些结构表型的偏侧化被认为与语言、运动及其他认知能力的功能偏侧化有关[9],因此,阐明偏侧化的遗传效应对于理解两半球表型差异的潜在机制和认知行为偏侧化的基因起源具有重要意义。
人脑半球偏侧化通常在个体发育中形成,是遗传和环境共同作用的产物。一系列证据暗示人脑半球偏侧化的成因主要受到基因的影响[10-11]。研究者们通过超声波、解剖分析技术等方法,在胎儿和新生儿大脑中发现了不同层面的半球偏侧化,尤其是大脑结构的偏侧化[12-13];同时,在分子遗传学水平上研究基因转录的过程中,也发现了基因活动的偏侧化,这些偏侧化的产物或能影响婴幼儿的发育以及改变成人大脑的神经回路[14-15]。值得关注的是,随着多模态 MRI 的发展,研究者能够从海量 MRI 数据中提取人脑结构信息,鉴于 MRI 获取的大脑结构表型随时间变化相对稳定,并能够在遗传效应的检测方面增加其统计功效[17],多数神经影像遗传学研究均基于 MRI 进行人脑结构及其偏侧化的遗传效应研究[18-21],并用遗传度进行映射。在定量经典遗传学中,所有的性状变异都可以归因于遗传或环境因素以及它们的交互作用。其中,由遗传因素引起的群体内性状变异的比例定义为该性状的遗传度。因此,利用双生子这一天然模型可以通过遗传度来量化基因对大脑偏侧化影响的程度 [16]。现阶段,基于多模态 MRI 的研究均提示大脑偏侧化具有遗传基础,这可为理解人脑偏侧化的基因起源及后续定位影响偏侧化的特定基因提供重要依据。
当前基于偏侧化的遗传效应的探讨主要围绕着三个问题:① 基因对左右半球同源脑表型的影响是否存在半球差异,即遗传度的偏侧化;② 左右半球同源脑表型的偏侧化程度是否主要受基因影响,即偏侧化的遗传度;③ 左右半球同源脑表型是否存在共享的基因及共享程度如何,从而决定基因控制半球共变的程度,即遗传相关性。需要指出的是,人脑结构偏侧化的遗传机制研究仍处在初期阶段,针对上述三个问题,国内外研究缺乏系统性综述,因此,本文将以遗传度和遗传相关性为主要考察因素,分别从遗传度的偏侧化、偏侧化的遗传度及遗传相关性三大层面,对人脑结构偏侧化的遗传效应这一领域进行综述介绍。
1. 基于双生子的定量遗传分析描述
1.1. 遗传度
广义遗传度反映了对遗传度估计的加性、显性和交互的基因贡献,具体计算公式如式(1)所示:
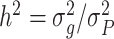 |
1 |
其中,h2是遗传度,σg2是由遗传因素引起的性状变异,σP2是总的表型(测量)性状变异。这个定义包含了遗传变异的多个来源,所以广义遗传度对于选择性动物育种以及某些类型的人类行为遗传学研究尤为重要。而狭义遗传度仅反映加性(等位)遗传效应对遗传度估计的贡献,具体计算公式如式(2)所示:
 |
2 |
σa2是由加性遗传因素引起的性状变异。这种加性遗传效应只是总遗传效应的一部分,它指的是由等位基因置换的加性效应对表型变异的解释程度,进而使异卵双生子等位基因的遗传贡献是同卵双生子的一半。由于分子遗传学实验将等位基因变异映射到性状变异,因此狭义遗传度是大多数现代遗传学研究的焦点,这其中也包括影像遗传学研究。
遗传度估计值在 0~1 之间,其中,遗传度为 0,则表明性状变异不受基因影响,而 1 表示性状变异完全由基因决定。对于遗传度为 0.5 的估计值,则意味着在特定群体中某一性状变异的 50% 是由遗传变异引起的。遗传度估计在统计上呈现出的差异具有统计学意义则表明该性状受到基因影响强烈,进而使其成为特定遗传分析的目标。另外,遗传度的研究可以初步揭示影响大脑性状的遗传信息,有助于在遗传分析中对具有遗传性的脑表型进行优先排序[22],因此遗传度的计算是一个有价值的分析。
1.2. 遗传相关性
遗传相关性是指两个变量间遗传度的重叠程度,具体定义为两个变量之间的遗传协方差除以它们的遗传方差乘积的平方根[23]。如果遗传相关性系数很高,则认为左右半球大部分变异受共同的遗传因素影响[24]。遗传相关性检验的是基因对左右脑性状协变的贡献程度,通过研究大脑两侧同源区域间的遗传相关性,研究者可以确定影响一个半球表型变化的遗传因素在何种程度上影响对侧半球,进而探究左右半球的组织结构共变的遗传基础。关于遗传相关性,需要注意的是,两个性状间的遗传相关性存在的原因有可能是某些遗传变异同时影响两个性状,或者是影响性状的遗传变异在基因组排列上彼此接近(称为连锁不平衡);另外,如果任何一个性状的遗传度都很低,那么即使性状间的遗传协方差很高,这种高的遗传协方差对遗传相关性的贡献可能也很小。
2. 人脑结构偏侧化的遗传效应研究
回顾已有双生子研究发现,基于结构磁共振影像(structural MRI,sMRI)及弥散磁共振影像(diffusion MRI,dMRI)等模态,不论是从人脑遗传度的偏侧化研究层面还是人脑偏侧化的遗传度层面,亦或是遗传相关性层面,都表明人脑结构的偏侧化是具有遗传基础的。
2.1. 人脑结构的遗传度的偏侧化研究
大多数偏侧化的遗传效应研究均是围绕着遗传度的偏侧化进行,即聚焦在基因对左右半脑结构的影响是否存在偏侧化,也就是遗传贡献的半球差异。目前相关的研究主要集中在大脑灰质特定脑区或大脑白质特定的纤维束层面。
2.1.1. 基于 sMRI 的遗传度的偏侧化研究
遗传度的偏侧化研究多数是基于 sMRI 对大脑灰质体积、皮层厚度或表面积等结构表型进行遗传度的半球差异比较。如 Eyler 等[25]通过研究左右半球同源脑区皮层表面积和厚度的遗传度,发现不存在遗传度的半球差异,因此,研究者认为基因对左右半球的影响呈现对称的模式,即基因在决定偏侧的脑表型方面作用不大。类似地,另有几篇研究也报道了左右脑区具有相似的遗传度估计[26-27],尽管 Zhao 等[28]对遗传度的估计是基于单核苷酸多态性(single nucleotide polymorphism,SNP)进行的,但仍可以作为狭义遗传度的概念反映出特定脑表型的遗传信息。与上述不同的是,多数遗传度的偏侧化研究均表明,大脑某侧半球受基因影响更强烈,即存在遗传度的半球差异,如 Geschwind 等[29]通过研究利手与皮层偏侧基因模型的关系,发现左侧颞叶和左侧额叶的体积受环境影响较强,但是对应的右侧脑区受基因影响较大,存在遗传的右偏效应,进而暗示右脑结构更易受基因影响,而左脑更易受环境因素的塑造,这可能是由于左脑的发育周期更长所导致;而 Yoon 等[30]通过分析 8 岁双生子皮层厚度的遗传度,发现左半球涉及语言加工和躯体感觉系统的脑区更易受基因的影响,存在遗传的左偏效应,这与 7~9 岁儿童智商和体格发育相符,类似的左偏效应在其后续的皮层表面积的遗传度研究中得到进一步证实[31],这意味着大脑皮层在发育过程中可能经历不同的基因影响,其中语言主导的左侧皮层比右侧更易受基因影响;另外,van der Lee 等[32]基于体素水平上也发现了左半球的语言区遗传度更高。
上述遗传度的偏侧化研究结果表明,不对称的遗传效应存在于大多数的脑结构表型中,且具有区域特异性。部分差异性的结论可能是由于遗传和环境交互效应形成的半球局部形态学特征或发育的影响所导致的不同的遗传度估计。
2.1.2. 基于 dMRI 的遗传度的偏侧化研究
迄今为止,基于 dMRI 的脑白质遗传度的偏侧化研究还非常少。如 Yoon 等[33]通过研究健康同龄儿童双生子的人脑结构变化的遗传效应,发现总脑容量包括灰质和白质均受基因影响较强,且这种影响是左偏的,即相较于右半球脑白质体积,基因对左半球的脑白质体积的影响更强。此外,左侧脑叶体积的结构变异也表现出较强的基因效应,特别是左颞叶和左顶叶对应的白质结构变异的遗传度较大。上述研究结果表明,脑白质体积总量及特定脑叶存在着左偏的遗传效应。再进一步考虑到发育可能会影响遗传因素对大脑结构变异的效应,这种脑白质遗传度的左偏可能和人脑右半球神经回路较晚的成熟过程有关[34]。
2.2. 人脑结构的偏侧化的遗传度研究现状
基于人脑结构的偏侧化的遗传效应研究范畴,部分研究者还对人脑左右半球的差异进行了遗传度分析,即探讨左右半脑结构的偏侧化程度是否具有较强的遗传效应。目前相关的研究也主要集中在脑白质纤维束或特定脑区层面。需要说明的是,遗传度的偏侧化和偏侧化的遗传度是两个不同的概念,并不能预期人脑某一特定表型的偏侧化受基因影响强烈,其遗传度就存在较强的半球差异,反之亦然。
2.2.1. 基于 sMRI 的偏侧化的遗传度研究
大部分的人脑结构偏侧化的遗传度研究均聚焦探讨基因对皮下核团偏侧化的变异的贡献。如 Eyler 等[25]基于脑体积参数,采用标准偏侧化指标,测得苍白球遗传度为 0.32,伏核为 0.37,均为中等的遗传度水平;另外,Guadalupe 等[35]基于家族谱系的研究发现苍白球、海马体、壳核和丘脑的皮下组织的偏侧化指标也显示出中等的遗传度。除皮下核团外,Kong 等[6]对大脑皮层区域的偏侧化进行研究,发现在全脑水平上,皮层厚度和表面积的偏侧化程度较低,但其统计上具有显著的遗传度,且在脑区水平上,额中回、扣带回、颞上回等区域的皮层厚度和表面积的偏侧化也存在较强的遗传效应。
上述研究表明,基因对人脑结构的偏侧化是有贡献的,结合已有研究检测到的胎儿行为上和解剖上的不对称性[36-39],可以推测出两半球之间的差异至少在子宫发育中已进行基因编码[14]。
2.2.2. 基于 dMRI 的偏侧化的遗传度研究
目前仅有个别研究者聚焦于脑白质纤维束偏侧化的遗传效应研究,如 Jahanshad 等[40]基于体素水平计算脑白质纤维的各向异性分数(fractional anisotropy,FA)的偏侧化程度,揭示了额枕下束和丘脑前辐射的纤维束 FA 的偏侧化受基因的强烈影响,且该研究者还进一步发现配准模板和样本量大小并不会影响基因因素对脑白质偏侧的决定作用。有意思的是,研究者还发现遗传/环境对个体间大脑偏侧化差异的影响具有年龄效应,即具有不同偏侧化发育轨迹的大脑白质结构受遗传/环境影响比例不同,研究者通过将弓状束分段(长段、前段和后段)并分析各段偏侧化的遗传影响,发现长段的 FA 与平均弥散系数(mean diffusivity,MD)偏侧化受基因影响较强,而涉及语言和社会认知等高阶处理的弓状束后段的偏侧化发育最迟达到稳定,受基因影响最弱[41]。
上述研究表明人脑白质纤维束的偏侧化受基因的影响强烈,且这种影响与纤维束的偏侧化程度及发育密切相关,这可能与人脑白质纤维束偏侧化异质性有关[42],进而导致偏侧化后发育的脑白质纤维更容易收到环境压力的侵害,进而使基因的效力相对更低。
2.3. 左右半球的遗传相关性的研究现状
大脑左右半球偏侧化的遗传效应还可以用遗传相关性来探讨,通过研究大脑两半球同源区域间的遗传相关性,研究者可以确定左右半球对应结构是否存在相同遗传因素影响及影响程度如何,从而检验了遗传对左右半脑的性状之间协变的贡献,进而提供了左右半球的组织结构共变的基因洞察[43]。
目前,左右半球的遗传相关性研究仅在脑灰质层面进行,脑白质层面上还相对匮乏。基于皮层表面积及皮层厚度,研究者发现左右半球脑室、皮下核团及扣带回、额中回、海马旁回、颞上回、顶下回等特定脑区的遗传相关性都很高[6, 25]。类似的,Guadalupe 等[35]也发现部分皮下核团的左右结构体积间的遗传相关性很高,这表明左右半脑间存在相当程度的共享基因共同影响两半球。值得注意的是,当遗传相关性为 1 时,表示左右半脑存在完全共享的基因,而以上大多数结构的遗传相关性在统计上均显著不同于 1,进而暗示尽管影响左右半球结构变异的大多数基因是共享的,但每个半球都存在一些特异的基因,这些半球内独有的基因效应为大脑结构偏侧化的遗传做出贡献。
3. 总结和展望
基于 MRI 的研究表明,人脑结构偏侧化是有遗传基础的。尽管如此,基于定量遗传分析和神经影像研究的局限性在一定程度上限制了人脑结构偏侧化遗传机制的进一步研究。
首先作为描述群体特性的遗传度,针对的是基因在特定群体成员性状变异的影响程度,这可能是具有人群特异性的,即遗传度不是一个表型的固定属性,它的估计取决于遗传因素、环境因素及其交互作用的相对贡献,对不同人群的分析可能会导致对遗传度的不同估计[26, 44],因此当祖先或环境改变后不具备普遍性;其次,遗传度和遗传相关性着重强调的是多个微效基因型值累加的加性基因效应[45],但对于哪些特定基因起作用,涉及多少基因,或者任何一个基因对性状的影响如何并未可知,因此无法对影响偏侧化的具体特定基因进行定位,进而局限了人们理解典型及非典型的大脑偏侧的生物学机制;此外,研究表明遗传度会随着人群发育、老化而改变[22, 46],具有区域特异性,因此当使用神经成像措施作为连接基因、环境和行为的中间表型时,应考虑特定大脑区域和人群年龄的影响[46];最后,目前大部分研究都是基于 MRI 在单条纤维束或脑区水平上进行研究,忽略了半脑全局连接水平上偏侧化的遗传效应,进而缺乏对大脑整体组织模式偏侧化底层机制的基因信息的思考。
在基于 MRI 对人脑结构偏侧化的遗传效应分析中,今后还面临着诸多挑战。其一,考虑到“人脑连接组”能从全局系统层面更好地描述人脑结构连接模式及规律,因此未来基于复杂脑网络展开偏侧化的遗传效应探讨,将有助于在连接组织关系层面上更好地理解人脑偏侧化的遗传机制,从而提供独立于体积或皮层厚度等特性的大脑结构的遗传信息。其二,鉴于人脑在不同发育阶段的特异性偏侧化特点及在脑疾病状态下的异常偏侧化,利用纵向发育及疾病分析探索正常发育及病理性脑的偏侧化的遗传机制将是未来研究的重要课题。其三,针对脑结构偏侧化遗传效应研究中具有强烈遗传度/遗传相关性的脑表型,筛选出与半球特异性相关的基因多态性位点,将对于理解人脑偏侧化的基因机制及探索其生化通路有着重要意义。
综上所述,本文分别从遗传度的偏侧化、偏侧化的遗传度及遗传相关性三个方面回顾了基于 MRI 的人脑结构偏侧化的遗传效应的近期研究,探索了其偏侧化的定量遗传证据。未来随着基因数据、多模态影像数据及基因分析技术的整合发展,将为洞察人脑偏侧化的发生机制和进化起源提供更精准的遗传依据,进而使从偏侧化的视角探讨神经发育障碍的病因学成为现实。
利益冲突声明:本文全体作者均声明不存在利益冲突。
Funding Statement
国家自然科学基金重点项目(81830052)
References
- 1.Corballis M C, Häberling I S The many sides of hemispheric asymmetry: a selective review and outlook. J Int Neuropsychol Soc. 2017;23(9-10):710–718. doi: 10.1017/S1355617717000376. [DOI] [PubMed] [Google Scholar]
- 2.Ocklenburg S, Güntürkün O. The lateralized brain - the neuroscience and evolution of hemispheric asymmetries. London, UK: Academic Press, 2018.
- 3.Hirnstein M, Hugdahl K, Hausmann M Cognitive sex differences and hemispheric asymmetry: a critical review of 40 years of research. Laterality. 2019;24(2):204–252. doi: 10.1080/1357650X.2018.1497044. [DOI] [PubMed] [Google Scholar]
- 4.尚韡, 王乐, 段凯凯, 等 Broca区的脑半球偏侧化静息态功能连接研究. 中西医结合心脑血管病杂志. 2017;15(8):917–923. doi: 10.3969/j.issn.1672-1349.2017.08.006. [DOI] [Google Scholar]
- 5.Corballis M C The evolution of lateralized brain circuits. Front Psychol. 2017;8:1021. doi: 10.3389/fpsyg.2017.01021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Kong X Z, Mathias S R, Guadalupe T, et al Mapping cortical brain asymmetry in 17, 141 healthy individuals worldwide via the ENIGMA Consortium. Proc Natl Acad Sci U S A. 2018;115(22):E5154–E5163. doi: 10.1073/pnas.1718418115. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Calabria M, Costa A, Green D W, et al Neural basis of bilingual language control. Ann N Y Acad Sci. 2018;1426(1):221–235. doi: 10.1111/nyas.13879. [DOI] [PubMed] [Google Scholar]
- 8.Xiang L A-O, Crow T, Roberts N Automatic analysis of cross-sectional cerebral asymmetry on 3D in vivo MRI scans of human and chimpanzee . J Neurosci Res. 2019;97(6):673–682. doi: 10.1002/jnr.24391. [DOI] [PubMed] [Google Scholar]
- 9.Toga A W, Thompson P M Mapping brain asymmetry. Nat Rev Neurosci. 2003;4(1):37–48. doi: 10.1038/nrn1009. [DOI] [PubMed] [Google Scholar]
- 10.Güntürkün O, Ocklenburg S Ontogenesis of lateralization. Neuron. 2017;94(2):249–263. doi: 10.1016/j.neuron.2017.02.045. [DOI] [PubMed] [Google Scholar]
- 11.Wiberg A, Ng M, Al Omran Y, et al Handedness, language areas and neuropsychiatric diseases: insights from brain imaging and genetics. Brain. 2019;142(10):2938–2947. doi: 10.1093/brain/awz257. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.de Kovel C G F, Lisgo S, Karlebach G, et al Left-Right asymmetry of maturation rates in human embryonic neural development. Biol Psychiatry. 2017;82(3):204–212. doi: 10.1016/j.biopsych.2017.01.016. [DOI] [PubMed] [Google Scholar]
- 13.de Kovel C G F, Lisgo S N, Fisher S E, et al Subtle left-right asymmetry of gene expression profiles in embryonic and foetal human brains. Sci Rep. 2018;8(1):12606. doi: 10.1038/s41598-018-29496-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Ocklenburg S, Schmitz J, Moinfar Z, et al Epigenetic regulation of lateralized fetal spinal gene expression underlies hemispheric asymmetries. eLife. 2017:e22784. doi: 10.7554/eLife.22784. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Muntané G, Santpere G, Verendeev A, et al Interhemispheric gene expression differences in the cerebral cortex of humans and macaque monkeys. Brain Struct Funct. 2017;222(7):3241–3254. doi: 10.1007/s00429-017-1401-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.王雪雯, 傅一笑, 唐金香, 等 双生子研究方法在精神障碍研究中的应用与进展. 四川精神卫生. 2019;32(2):181–184. [Google Scholar]
- 17.Blokland G A, de Zubicaray G I, Mcmahon K L, et al Genetic and environmental influences on neuroimaging phenotypes: a meta-analytical perspective on twin imaging studies. Twin Res Hum Genet. 2012;15(3):351–371. doi: 10.1017/thg.2012.11. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Vuoksimaa E, Panizzon M S, Hagler D J, et al Heritability of white matter microstructure in late middle age: a twin study of tract-based fractional anisotropy and absolute diffusivity indices. Hum Brain Mapp. 2017;38(4):2026–2036. doi: 10.1002/hbm.23502. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Thompson P M, Ge T, Glahn D C, et al Genetics of the connectome. Neuroimage. 2013;80:475–488. doi: 10.1016/j.neuroimage.2013.05.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Brouwer R O, Panizzon M S, Glahn D O, et al Genetic influences on individual differences in longitudinal changes in global and subcortical brain volumes: results of the ENIGMA plasticity working group. Hum Brain Mapp. 2017;38(9):4444–4458. doi: 10.1002/hbm.23672. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.马兴顺, 贺越, 李晓, 等 遗传和环境因素对青少年脑灰质容积和皮层厚度影响的双生子研究. 中国神经精神疾病杂志. 2018;44(6):354–359. doi: 10.3969/j.issn.1002-0152.2018.06.006. [DOI] [Google Scholar]
- 22.Gao W, Grewen K, Knickmeyer R C, et al A review on neuroimaging studies of genetic and environmental influences on early brain development. Neuroimage. 2019;185:802–812. doi: 10.1016/j.neuroimage.2018.04.032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Ge T, Chen C Y, Vettermann R, et al The shared genetic basis of human fluid intelligence and brain morphology. Cereb Cortex. 2018;29(8):3471–3481. doi: 10.1093/cercor/bhy216. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Elliott L T, Sharp K, Alfaro-Almagro F, et al Genome-wide association studies of brain imaging phenotypes in UK Biobank. Nature. 2018;562(7726):210–216. doi: 10.1038/s41586-018-0571-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Eyler L T, Vuoksimaa E, Panizzon M S, et al Conceptual and data-based investigation of genetic influences and brain asymmetry: a twin study of multiple structural phenotypes. J Cogn Neurosci. 2014;26(5):1100–1117. doi: 10.1162/jocn_a_00531. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Liu S, Li A, Zhu M, et al Genetic influences on cortical myelination in the human brain. Genes Brain Behav. 2019;18(4):e12537. doi: 10.1111/gbb.12537. [DOI] [PubMed] [Google Scholar]
- 27.Wen W, Thalamuthu A, Mather K A, et al Distinct genetic influences on cortical and subcortical brain structures. Scientific Reports. 2016;6:32760. doi: 10.1038/srep32760. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Zhao B, Ibrahim J G, Li Y, et al Heritability of regional brain volumes in large-scale neuroimaging and genetic studies. Cereb Cortex. 2019;29(7):2904–2914. doi: 10.1093/cercor/bhy157. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Geschwind D H, Miller B L, Decarli C, et al Heritability of lobar brain volumes in twins supports genetic models of cerebral laterality and handedness. Proc Natl Acad Sci U S A. 2002;99(5):3176–3181. doi: 10.1073/pnas.052494999. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Yoon U, Fahim C, Perusse D, et al Lateralized genetic and environmental influences on human brain morphology of 8-year-old twins. Neuroimage. 2010;53(3):1117–1125. doi: 10.1016/j.neuroimage.2010.01.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Yoon U, Perusse D, Evans A C Mapping genetic and environmental influences on cortical surface area of pediatric twins. Neuroscience. 2012;220:169–178. doi: 10.1016/j.neuroscience.2012.06.030. [DOI] [PubMed] [Google Scholar]
- 32.van der Lee S J, Roshchupkin G V, Adams H H, et al Gray matter heritability in family-based and population-based studies using voxel-based morphometry. Hum Brain Mapp. 2017;38(5):2408–2423. doi: 10.1002/hbm.23528. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Yoon U, Perusse D, Lee J M, et al Genetic and environmental influences on structural variability of the brain in pediatric twin: deformation based morphometry. Neurosci Lett. 2011;493(1/2):8–13. doi: 10.1016/j.neulet.2011.01.070. [DOI] [PubMed] [Google Scholar]
- 34.Lebel C, Deoni S The development of brain white matter microstructure. Neuroimage. 2018;182(1):207–218. doi: 10.1016/j.neuroimage.2017.12.097. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Guadalupe T, Mathias S R, Vanerp T, et al Human subcortical brain asymmetries in 15, 847 people worldwide reveal effects of age and sex. Brain Imaging Behav. 2017;11(5):1497–1514. doi: 10.1007/s11682-016-9629-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Parma V, Brasselet R, Zoia S, et al The origin of human handedness and its role in pre-birth motor control. Sci Rep. 2017;7(1):16804. doi: 10.1038/s41598-017-16827-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Young G. Causality and Development. Berlin, Germany: Springer, Cham, 2019.
- 38.Barzilay E, Bar-Yosef O, Dorembus S, et al Fetal brain anomalies associated with ventriculomegaly or asymmetry: an MRI-based study. AJNR Am J Neuroradiol. 2017;38(2):371–375. doi: 10.3174/ajnr.A5009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Andescavage N N, Du Plessis A, Mccarter R, et al Complex trajectories of brain development in the healthy human fetus. Cereb Cortex. 2017;27(11):5274–5283. doi: 10.1093/cercor/bhw306. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Jahanshad N, Lee A D, Barysheva M, et al Genetic influences on brain asymmetry: a DTI study of 374 twins and siblings. Neuroimage. 2010;52(2):455–469. doi: 10.1016/j.neuroimage.2010.04.236. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Budisavljevic S, Dell'acqua F, Rijsdijk F V, et al Age-related differences and heritability of the perisylvian language networks. J Neurosci. 2015;35(37):12625–12634. doi: 10.1523/JNEUROSCI.1255-14.2015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Zhong S, He Y, Shu H, et al Developmental changes in topological asymmetry between hemispheric brain white matter networks from adolescence to young adulthood. Cereb Cortex. 2017;27(4):2560–2570. doi: 10.1093/cercor/bhw109. [DOI] [PubMed] [Google Scholar]
- 43.Brainstorm C, Anttila V, Bulik-Sullivan B, et al Analysis of shared heritability in common disorders of the brain. Science. 2018;360(6395):eaap8757. doi: 10.1126/science.aap8757. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Lee S J, Zhang J, Neale M C, et al Quantitative tract-based white matter heritability in 1- and 2-year-old twins. Hum Brain Mapp. 2019;40(4):1164–1173. doi: 10.1002/hbm.24436. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Kennedy J T, Astafiev S V, Golosheykin S, et al Shared genetic influences on adolescent body mass index and brain structure: a voxel-based morphometry study in twins. Neuroimage. 2019;199:261–272. doi: 10.1016/j.neuroimage.2019.05.053. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Teeuw J, Brouwer R M, Koenis M, et al Genetic influences on the development of cerebral cortical thickness during childhood and adolescence in a Dutch longitudinal twin sample: the brainscale study. Cereb Cortex. 2019;29(3):978–993. doi: 10.1093/cercor/bhy005. [DOI] [PubMed] [Google Scholar]


