Abstract
下肢截肢后残肢的肌肉萎缩对患者康复十分不利。为探明残肢肌肉萎缩的生物力学机制,本研究利用大腿截肢患者残肢的磁共振断层影像(MRI),建立了包含肌肉、骨骼以及主要血管的残肢有限元模型,研究分析了下肢假肢接受腔对残肢软组织及血管的生物力学影响。结果发现,旋股外侧动脉降支因挤压而发生的狭窄最为严重,股深动脉的狭窄则相对较小;旋股外侧静脉的降支、股静脉、股深静脉狭窄的程度依次降低,大隐静脉的狭窄程度较为严重。前侧肌群中应力应变最高;下侧肌群在股骨的末端处出现应力集中,并且其他生物力学指标在下侧区域中也相对较高。本研究在一定程度上揭示了接受腔对血管的挤压是导致肌肉萎缩的重要原因,这为进一步研究残肢肌肉的萎缩机制和采取有效的预防措施提供了理论参考。
Keywords: 接受腔, 残肢, 肌肉萎缩, 有限元模型, 血管
Abstract
Muscle atrophy of the residual limb after lower-limb amputation is a disadvantage of amputees' rehabilitation. To investigate the biomechanics mechanism of muscle atrophy of the residual limb, we built a finite element model of a residual limb including muscle, skeletons and main vessels based on magnetic resonance images of a trans-femoral amputee, and studied the biomechanics effects of the socket of the lower-limb prosthesis on the soft tissue and vessels in the residual limb. It was found that the descending branch of the lateral femoral circumflex artery suffered the most serious constriction due to the extrusion, while that of the deep femoral artery was comparatively light. Besides, the degree of the constriction of the descending branch of the lateral femoral circumflex vein, femoral vein and deep femoral vein decreased in turn, and that of the great saphenous vein was serious. The stress-strain in the anterior femoral muscle group were highest, while the stress concentration of the inferior muscle group was observed at the end of the thighbone, and other biomechanical indicators at the inferior region were also high. This study validated that the extrusion of the socket on the vessels could cause muscle atrophy to some degree, and provided theoretical references for learning the mechanism of muscle atrophy in residual limb and its effective preventive measures.
Keywords: socket, residual limb, muscle atrophy, finite element model, vessel
引言
下肢截肢术后经常伴随着各种并发症,残肢肌肉萎缩是其中之一[1-2]。截肢患者须定期对假肢接受腔进行修型,这给截肢患者生活带来很大不便,也增大了患者恢复运动能力的难度。如果没有及时地对接受腔进行修型,则会导致残肢与接收腔之间松动,产生软组织上的应力集中,特别是在骨突出的地方,极易对软组织造成损伤[3]。
许多学者对肌肉萎缩的机制进行了研究。一种观点认为,正常情况下运动神经对其支配的骨骼肌有“营养作用”,其末梢经常释放某些物质,持续调节被支配肌肉的代谢活动,影响其结构、生理生化的变化[4]。因此,当肌肉由于废用失去神经的营养作用时必将逐渐产生萎缩。另外,一些学者通过实验发现,特异性的神经冲动不仅能够防止肌肉萎缩,而且可以增加特定肌纤维的数量。因而他们认为,肌肉废用时运动神经冲动的降低,是直接造成残肢萎缩的原因之一[5-6]。此外,还有一种观点认为,肌肉废用时的氧化应激反应是促进肌肉萎缩的重要因素。由于氧化应激的作用,体内可产生过氧化脂质,一方面使溶酶体通透性增强,促进蛋白质分解;另一方面使线粒体功能减退,阻碍蛋白质的合成[7]。两方面共同作用,最终导致蛋白质含量减少,产生肌肉萎缩[8-9]。截肢术后伴随着残肢肌肉的废用,必定引起肌肉萎缩。
然而,Caron 等[10]的实验发现,1% 和 20% 氧气浓度环境下培养的肌细胞蛋白质的合成与分解速率是不同的,并且通过测量蛋白激酶与糖原合成酶激酶-3 发现,在低氧暴露环境下,肌细胞里面的蛋白激酶与糖原合成酶激酶-3 都有所减少,从而说明低氧环境对蛋白质的合成具有抑制作用,即缺氧也会导致肌肉萎缩。基于此,本研究猜测:残肢内部的血管受到来自于接受腔的压迫,影响了血液中氧分的供应,从而导致了残肢肌肉萎缩的产生。与此同时,本研究期望探索一条有效的途径了解假肢接受腔对下肢残肢内部组织的力学影响。
大量研究表明,在研究假肢接收腔与残肢之间载荷传递方面,有限元是最为有效的方法之一[3, 11-14],特别是近年来,有限元模拟已从简化的二维模型发展到非线性三维模型,从单一步态静态模拟发展到了全周期步态动态模拟[11],相关研究工作也让我们对假肢接收腔、残肢的几何形状和力学属性,以及残肢表面的摩擦性质有了进一步了解。然而,前人有关残肢的研究主要聚焦于残肢表面的应力分布以及患者的舒适程度,关于血管受到的影响则主要集中在血管树几何结构的改变以及动脉内血流动力学状态的变化[15-17],对血管本身受到的挤压状况很少给予关注。因此,本研究旨在通过有限元模型,分析探讨接收腔对残肢软组织及血管的影响。
1. 模型与研究方法
1.1. 研究对象
本研究对象为一位 24 岁大腿截肢男性(由于外伤实施大腿截肢术),身高 175 cm,体重 80 kg,身体状况良好,无其他神经、骨骼和肌肉病史。本研究已获得香港理工大学人类受试者伦理委员会的批准(批准文号:HSEARS20130828001),参与者已签署知情同意书。
1.2. 模型建立及边界条件
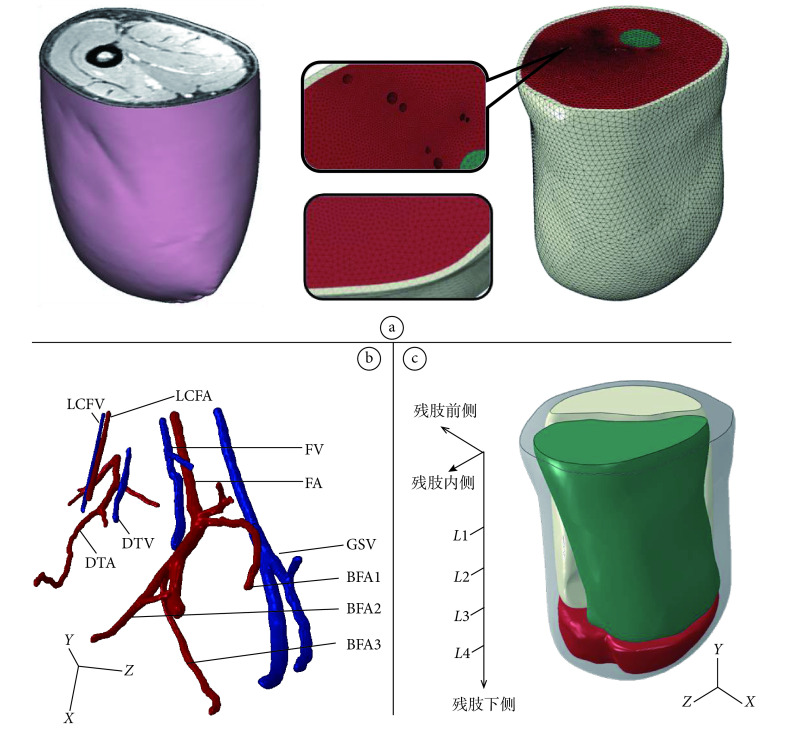
为确保模型的准确性和真实性,本研究对患者残肢进行了核磁共振成像(magnetic resonance imaging,MRI)扫描,沿大腿残肢间隔 1.5 mm 进行一次冠状面成像。根据不同的灰度值和血管在 MRI 图像中灰白色管状结构的显示特征,采用 MIMICS(version 10.0,Materialise,比利时)和 Rapidform(version 2004,INUS technology INC,韩国)对肌肉、骨骼及主要血管进行三维重建(见图 1a)。根据重建的残肢外表面,利用商业软件 Pro/E(version 5.0,Parametric Technology Corporation,美国)建立内表面与残肢外形一致、厚度为 4 mm 的接受腔模型[12],接受腔材料为聚丙烯均聚物。将各个实体模型导入有限元软件 ABAQUS(version 6.4,Dassault Systèmes Simulia Corporation,美国),通过布尔运算组装得到系统模型。其中,软组织中包含具有血管形态的空腔,骨头和肌肉作为一个整体,残肢与接受腔被考虑为相互接触的不同结构,摩擦系数设为 0.5。各个组成部分材料均假设为均匀、线弹性和各向同性。取软组织、骨头和接受腔的弹性模量分别为 200 kPa、10 GPa、1 500 MPa,取泊松比分别 0.49、0.3、0.3[12]。采用四面体线性单元 C3D4 对模型进行离散化,在血管的邻近部位进行适当加密(见图 1a),离散后的模型单元数量为 1 461 351。将大腿动静脉血压假设为一常数,取大腿中部的平均动脉压 13.3 kPa[18]作为动脉血管边界条件,取大腿中部静脉压 5.32 kPa[19]作为静脉血管的边界条件。将残肢的上表面进行固定,在接受腔的末端施加外载荷[14]。根据 Lee 等[20]测得的外载荷曲线,选取外载荷最大的时刻,采用准静态的方式将外载加于接受腔末端,从下往上、从后往前、从内向外三个方向的力分别为 780、135、122 N,力矩分别为 4.5、20.13、21.7 N·m。
图 1.
The models and diagrams
模型和示意图
a. the geometrical model and mesh model of the transfemoral residual limb; b. the geometrical model of the vascular tree in the residual limb; c. the schematic diagram of the muscles in the residual limb
a. 大腿残肢的几何模型和网格模型;b. 残肢血管树几何模型;c. 残肢肌群划分示意图
2. 结果
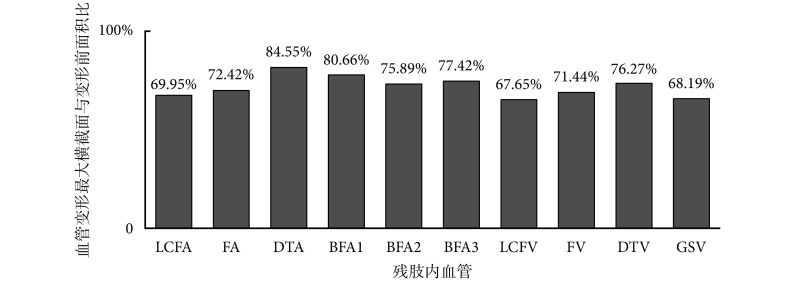
为详细分析血管所受挤压情况,本研究利用 MRI 图像重建出残肢主要血管模型,并且根据残肢血管的解剖结构及生理功能,将动脉血管模型分为 6 个部分(见图 1b),其中,FA 段为股动脉,DTA 段为股深动脉,LCFA 段为旋股外侧动脉的降支,BFA1、BFA2、BFA3 分别为股动脉的 3 个分支;将静脉血管划分为 4 个部分(见图 1b),其中,FV 段为股静脉,DTV 段为股深静脉,LCFV 段为旋股外侧静脉的降支,GSV 段为大隐静脉。选取血管变形最大的横截面,将其变形后与变形前的面积比作为衡量该段血管狭窄程度的指标。图 2 显示的是动、静脉各段血管狭窄的情况,从中可以看出,动脉血管中旋股外侧动脉的降支因挤压而发生的狭窄最为严重,而股深动脉的狭窄程度相对较小。在静脉血管中也有类似的规律,旋股外侧静脉的降支、股静脉、股深静脉的狭窄程度依次降低,大隐静脉的狭窄程度也较为严重。
图 2.
The stenosis of the veins and arteries in the residual limb
大腿残肢内动、静脉血管的狭窄情况
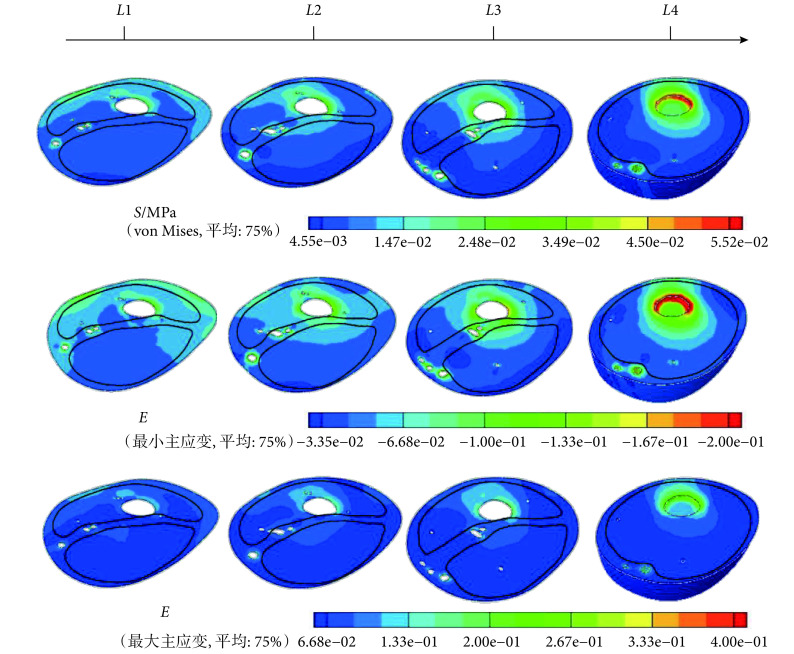
本研究根据人体解剖结构将残肢肌肉划分出三个区域,即前侧肌群、内后侧肌群和下侧肌群(见图 1c)。其中,前侧肌群由缝匠肌与股四头肌构成;内后侧肌群域包含耻骨肌、股薄肌、长收肌、短收肌、大收肌、股二头肌、半腱肌、半膜肌;考虑到截肢手术的特殊性,将股骨末端以下的肌肉定义为下侧肌群。同时,从残肢近端到远端选取了四个间隔相同的横截面,即 L1、L2、L3、L4(见图 1c),以便更加直观地分析残肢的应力应变情况。图 3 和表 1 显示了这三个区域的应力应变,可以看出,前侧肌群中的应变和应力水平最高;下侧肌群在股骨的末端处出现应力集中,并且其他指标在下侧区域中也相对较高。
图 3.
The stress and strain distributions in different cross-sections of the residual limb
残肢不同横截面上的应力应变分布
表 1. von Mises stress, tensile stain and compressive strain in different regions.
不同区域的 von Mises 应力、拉应变以及压应变
| 残肢肌肉区域 | von Mises 应力/kPa | 拉应变 | 压应变 | |||||
| 最大值 | 平均值 | 最大值 | 平均值 | 最大值 | 平均值 | |||
| 前侧肌群 | 62.70 | 12.30 | 0.27 | 0.05 | –0.28 | –0.06 | ||
| 内后侧肌群 | 30.30 | 5.90 | 0.12 | 0.02 | –0.14 | –0.03 | ||
| 下侧肌群 | 93.00 | 7.10 | 0.19 | 0.02 | –0.21 | –0.03 | ||
3. 讨论
从计算结果可以看出,旋股外侧动脉的降支由于挤压发生的狭窄最为严重。在解剖生理学中,缝匠肌及股四头肌(即本研究定义的前侧肌群),主要是由旋股外侧动脉的降支提供氧分。基于此,我们认为,前侧肌群的萎缩会相对严重。事实上,Schmalz 等[2]通过超声波扫描术,对 17 例穿戴假肢半年以上的下肢截肢者进行研究也发现,大腿股四头肌、缝匠肌的萎缩最为明显,减少量在 11.7%~30.4% 之间,这为我们的观点提供了很好的印证。
图 2 显示了静脉血管的变形情况。下肢静脉持续受压,会导致静脉回流量减少,细胞间液增多,组织中淤血,长此以往,将引起组织中的细胞死亡[21]。因此,下肢残肢静脉因挤压造成的回流受阻,也可能是导致残肢肌肉萎缩的因素之一。由于不同的下肢深静脉只收集相应动脉作用区域的静脉血,我们认为,旋股外侧静脉降支受的挤压较为严重,会使前侧肌群更容易发生萎缩。
通过比较残肢软组织应变可以看出,前侧肌群的变形程度要高于内后侧和下侧肌群。虽然本研究模型没有完整建立肌群内部的血管,但不难推测前侧肌群中的血管受到的挤压相对严重,前侧肌群氧气的供应以及静脉回流受到了较大的阻碍。
此外,Portnoy 等[13]认为较高的拉应变、压应变以及 von Mises 应力能够造成深层组织的损伤,因此,本研究认为这些指标较高的区域,更容易发生肌细胞的死亡,进而导致该部分肌肉萎缩。
本研究旨在利用包含肌肉、骨骼以及主要血管的残肢有限元模型,从生物力学角度研究接受腔对大腿残肢肌肉萎缩的影响。目前,关于大腿残肢的生物力学研究相对较少,本研究为阐释接受腔对大腿残肢肌肉萎缩的生物力学影响提供了有效途径。模拟过程中,将残肢有限元模型中各个组成部分材料假设为均匀、线弹性和各向同性,这主要是因为,Sanders 等[22]通过有限元模拟与实验的对比研究发现,在这一假设下有限元计算能够有效且快速地预测小腿残肢中生物力学参数分布规律。此外,本研究只采用准静态的外载荷加载方式对某一特定步态进行了分析,并且没有考虑接受腔的修型对残肢产生的影响。我们认为,这些假设都会影响模拟结果的精准程度,但不影响定性分析结果,即接受腔对大腿残肢内血管的挤压,是造成大腿残肢萎缩的重要原因。在今后的工作中,我们将尝试采用更加贴合实际的材料属性、更加精确的接受腔模型以及施加动态载荷进行模拟,更精确地评估接受腔对肌肉萎缩的影响,深入研讨这一过程中的生物力学机制。同时,增加病例和采用更多手段研究(临床跟踪和动物实验等)将是本研究后续的重要研究内容。
4. 结论
为研究假肢接受腔对血管的挤压与肌肉萎缩之间的关系,本研究建立了包含肌肉、骨骼与血管的大腿残肢有限元模型,在接受腔末端施加外载荷,综合血管变形和软组织应力应变分布进行分析,结果发现:
(1)旋股外侧动脉的降支由于挤压发生的狭窄最为严重。
(2)前侧肌群的变形程度要高于内后侧和下侧肌群,因此前侧肌群更易产生肌肉萎缩。
(3)本研究在一定程度上揭示了接受腔对血管的挤压是导致残肢肌肉萎缩的重要原因,这为进一步深入研究残肢肌肉萎缩机制和采取有效预防措施提供了理论参考。
Funding Statement
国家自然科学基金(11602064)
References
- 1.Fraisse N, Martinet N, Kpadonou T G, et al Muscles of the below-knee amputees. Ann Readapt Med Phys. 2008;51(3):218–227. doi: 10.1016/j.annrmp.2008.01.012. [DOI] [PubMed] [Google Scholar]
- 2.Schmalz T, Blumentritt S, Reimers C D Selective thigh muscle atrophy in trans-tibial amputees: an ultrasonographic study. Archives of Orthopaedic and Trauma Surgery. 2001;121(6):307–312. doi: 10.1007/s004020000227. [DOI] [PubMed] [Google Scholar]
- 3.Sanders J E, Harrison D S, Allyn K J, et al Clinical utility of in-socket residual limb volume change measurement: case study results. Prosthet Orthot Int. 2009;33(4):378–390. doi: 10.3109/03093640903214067. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Aagaard P, Suetta C, Caserotti P, et al Role of the nervous system in sarcopenia and muscle atrophy with aging: strength training as a countermeasure. Scand J Med Sci Sports. 2010;20(1):49–64. doi: 10.1111/sms.2010.20.issue-1. [DOI] [PubMed] [Google Scholar]
- 5.Bongers K S, Fox D K, Ebert S M, et al Skeletal muscle denervation causes skeletal muscle atrophy through a pathway that involves both Gadd45a and HDAC4. Am J Physiol Endocrinol Metab. 2013;305(7):E907–E915. doi: 10.1152/ajpendo.00380.2013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Dirks M L, Wall B T, Snijders T, et al Neuromuscular electrical stimulation prevents muscle disuse atrophy during leg immobilization in humans. Acta Physiol (Oxf) 2014;210(3):628–641. doi: 10.1111/apha.12200. [DOI] [PubMed] [Google Scholar]
- 7.Guillot M, Charles A L, Chamaraux-Tran T N, et al Oxidative stress precedes skeletal muscle mitochondrial dysfunction during experimental aortic cross-clamping but is not associated with early lung, heart, brain, liver, or kidney mitochondrial impairment. J Vasc Surg. 2014;60(4):1043–51.e5. doi: 10.1016/j.jvs.2013.07.100. [DOI] [PubMed] [Google Scholar]
- 8.邢国刚, 樊小力, 宋新爱, 等 废用性肌肉萎缩的研究. 国外医学·物理医学与康复分册. 2000;20(4):145–150. [Google Scholar]
- 9.Glass D J Skeletal muscle hypertrophy and atrophy signaling pathways. Int J Biochem Cell Biol. 2005;37(10):1974–1984. doi: 10.1016/j.biocel.2005.04.018. [DOI] [PubMed] [Google Scholar]
- 10.Caron M A, Thériault M È, Paré M , et al Hypoxia alters contractile protein homeostasis in L6 myotubes. FEBS Lett. 2009;583(9):1528–1534. doi: 10.1016/j.febslet.2009.04.006. [DOI] [PubMed] [Google Scholar]
- 11.Jia Xiaohong, Zhang Ming, Lee W C C Load transfer mechanics between trans-tibial prosthetic socket and residual limb-dynamic effects. J Biomech. 2004;37(9):1371–1377. doi: 10.1016/j.jbiomech.2003.12.024. [DOI] [PubMed] [Google Scholar]
- 12.Lee W C C, Zhang Ming, Jia Xiaohong, et al Finite element modeling of the contact interface between trans-tibial residual limb and prosthetic socket. Med Eng Phys. 2004;26(8):655–662. doi: 10.1016/j.medengphy.2004.04.010. [DOI] [PubMed] [Google Scholar]
- 13.Portnoy S, Yizhar Z, Shabshin N, et al Internal mechanical conditions in the soft tissues of a residual limb of a trans-tibial amputee. J Biomech. 2008;41(9):1897–1909. doi: 10.1016/j.jbiomech.2008.03.035. [DOI] [PubMed] [Google Scholar]
- 14.Zhang M, Mak A F T, Roberts V C Finite element modelling of a residual lower-limb in a prosthetic socket: a survey of the development in the first decade. Med Eng Phys. 1998;20(5):360–373. doi: 10.1016/S1350-4533(98)00027-7. [DOI] [PubMed] [Google Scholar]
- 15.Yan F, Jiang W, Dong W, et al Blood flow and oxygen transport in the descending branch of lateral femoral circumflex arteries after transfemoral amputation: a numerical study. J Med Biol Eng. 2017;37(1):63–73. doi: 10.1007/s40846-016-0202-4. [DOI] [Google Scholar]
- 16.Dong Ruiqi, Li Xiaolong, Yan Fei, et al The spatial structure changes of thigh arterial trees after transfemoral amputation: case studies. J Med Imaging Health Inf. 2016;6(3):688–692. doi: 10.1166/jmihi.2016.1725. [DOI] [Google Scholar]
- 17.李小龙, 晏菲, 董瑞琪, 等 一种表征残肢血管结构变形的参数方法. 医用生物力学. 2016;31(1):19–23. [Google Scholar]
- 18.Kirkendall W M, Burton A C, Epstein F H, et al Recommendations for human blood pressure determination by sphygmomanometers. Circulation. 1967;36(6):980–988. doi: 10.1161/01.CIR.36.6.980. [DOI] [PubMed] [Google Scholar]
- 19.朱大年, 郑黎明. 人体解剖生理学. 上海: 复旦大学出版社, 2002.
- 20.Lee W C C, Frossard L A, Hagberg K, et al Kinetics of transfemoral amputees with osseointegrated fixation performing common activities of daily living. Clin Biomech (Bristol, Avon) 2007;22(6):665–673. doi: 10.1016/j.clinbiomech.2007.02.005. [DOI] [PubMed] [Google Scholar]
- 21.Wyllie A H Apoptosis: cell death in tissue regulation. J Pathol. 1987;153(4):313–316. doi: 10.1002/(ISSN)1096-9896. [DOI] [PubMed] [Google Scholar]
- 22.Sanders J E, Daly C H Normal and shear stresses on a residual limb in a prosthetic socket during ambulation: comparison of finite element results with experimental measurements. J Rehabil Res Dev. 1993;30(2):191–204. [PubMed] [Google Scholar]