Abstract
目的
基于大豆异黄酮(SI)对区域脑血流(rCBF)、铁死亡、炎症反应和血脑屏障(BBB)通透性的级联调控作用,探讨SI抗脑缺血/再灌注损伤机制。
方法
将120只雄性SD大鼠随机分为假手术组(Sham组)、缺血/再灌注组(I/R组)和大豆异黄酮预处理组(SI组),40只/组。采用改良线栓法合并激光多普勒血流仪(LDF)建立大鼠局灶性脑缺血/再灌注损伤模型。术中各组大鼠通过LDF实时监测脑皮层血流动态变化;术后通过光镜和透射电镜观察脑组织病理形态、神经元和BBB超微结构变化,评估神经缺损程度,量化脑梗死、脑水肿和BBB破坏程度,分光光度法检测缺血半暗带Fe2+、谷胱甘肽(GSH)、丙二醛(MDA)、髓过氧化物酶(MPO)含量,ELISA法测定血清TNF-α和IL-1β活性,Western blot法和IHC法检测病灶周围GPX4、MMP-9和Occludin表达。
结果
插线成功后I/R组和SI组大鼠rCBF均呈现骤降趋势,而拔线后I/R组rCBF上升慢于SI组;rCBF存在插线后不稳定和拔线后未复流状况。I/R组神经细胞固缩严重,线粒体变小、膜密度增加、嵴减少,紧密连接松散、基底膜厚薄不均,SI组各结构损伤相较于I/R组呈不同程度减轻。与Sham组相比,I/R组神经缺损评分、脑梗死体积、脑含水量和伊文思蓝渗透量明显增加(P < 0.01),Fe2+和MDA含量增多、GSH含量及GPX4表达降低(P < 0.01),MPO含量和血清TNF-α、IL-1β活性增高(P < 0.01),MMP-9表达增多、Occludin表达减少(P < 0.01);与I/R组相比,SI组神经缺损评分、脑梗死体积、脑含水量和伊文思蓝渗透量降低(P < 0.05或P < 0.01),Fe2+和MDA含量减少、GSH含量及GPX4表达升高(P < 0.05或P < 0.01),MPO含量和血清TNF-α、IL-1β活性降低(P < 0.05或P < 0.01),MMP-9表达下调、Occludin表达上调(P < 0.05,P < 0.01)。
结论
SI预处理可能通过改善脑血流,抑制铁死亡、炎症反应和保护BBB,进而减轻脑缺血/再灌注损伤。
Keywords: 大豆异黄酮, 脑缺血/再灌注, rCBF, 铁死亡, 炎症反应, 血脑屏障
Abstract
Objective
To explore the mechanism that mediates the effect of soybean isoflavones (SI) against cerebral ischemia/reperfusion (I/R) injury in light of the regulation of regional cerebral blood flow (rCBF), ferroptosis, inflammatory response and blood-brain barrier (BBB) permeability.
Methods
A total of 120 male SD rats were equally randomized into sham-operated group (Sham group), cerebral I/R injury group and SI pretreatment group (SI group). Focal cerebral I/R injury was induced in the latter two groups using a modified monofilament occlusion technique, and the intraoperative changes of real-time cerebral cortex blood flow were monitored using a laser Doppler flowmeter (LDF). The postoperative changes of cerebral pathological morphology and the ultrastructure of the neurons and the BBB were observed with optical and transmission electron microscopy. The neurological deficits of the rats was assessed, and the severities of cerebral infarction, brain edema and BBB disruption were quantified. The contents of Fe2+, GSH, MDA and MPO in the ischemic penumbra were determined with spectrophotometric tests. Serum levels of TNF-α and IL-1βwere analyzed using ELISA, and the expressions of GPX4, MMP-9 and occludin around the lesion were detected with Western blotting and immunohistochemistry.
Results
The rCBF was sharply reduced in the rats in I/R group and SI group after successful insertion of the monofilament. Compared with those in Sham group, the rats in I/R group showed significantly increased neurological deficit scores, cerebral infarction volume, brain water content and Evans blue permeability (P < 0.01), decreased Fe2+ level, increased MDA level, decreased GSH content and GPX4 expression (P < 0.01), increased MPO content and serum levels of TNF-α and IL-1β (P < 0.01), increased MMP-9 expression and lowered occludin expression (P < 0.01). All these changes were significantly ameliorated in rats pretreated with IS prior to I/R injury (P < 0.05 or 0.01).
Conclusion
SI preconditioning reduces cerebral I/R injury in rats possibly by improving rCBF, inhibiting ferroptosis and inflammatory response and protecting the BBB.
Keywords: soybean isoflavones, cerebral ischemia/reperfusion, regional cerebral blood flow, ferroptosis, inflammatory response, blood-brain barrier
缺血性脑卒中严重威胁患者生存质量且呈年轻化发病趋势[1]。血管再通恢复血供是治疗缺血性脑卒中的首要措施,但易诱发脑缺血/再灌注损伤(CIRI)[2],对患者预后不利。随着介入溶栓的广泛开展,CIRI的发生率越来越高,损伤后的神经功能障碍也愈发突出,因此,改善CIRI后的功能恢复已经成为一个亟待解决的关键问题。
缺血再灌注后微血管“无复流”是再灌注损伤的重要因素之一。研究表明,脑缺血再灌注早期延迟性低灌注比缺血缺氧阶段对预后的影响更明显[3]。血脑屏障(BBB)保障着中枢神经系统(CNS)内环境的相对稳定[4]。BBB结构和功能的失调是再灌注诱导脑组织继发性损伤的重要的病理生理基础,进一步加重脑组织炎症反应、血管源性脑水肿、神经细胞死亡等[5]。研究发现铁死亡也参与缺血再灌注诱导的神经细胞死亡并诱发炎症反应[6, 7]。炎症是介导BBB损伤的重要病理因素,而BBB损伤又加重神经细胞死亡。因此,降低血管紧张度改善低灌注,抑制炎症反应、保护BBB、减轻神经元铁死亡之间的级联损伤反应将可能改善CIRI后的神经功能恢复,成为治疗再灌注后继发性损伤的一个重要的途径。
流行病学研究显示,食用异黄酮类食物的比重与卒中发生率呈负相关[8]。大豆异黄酮(SI)作为天然的“植物雌激素” [9],已被证实在抗肿瘤、延缓衰老、预防心血管疾病等方面发挥着积极功效[10, 11]。研究发现SI对神经细胞凋亡还具有改善作用[9, 12, 13],而SI能否通过改善脑血流量和抑制铁死亡途径及其炎症级联损伤反应保护BBB进而减轻CIRI尚未见报道。
本实验通过SI预适应、复制局灶性脑缺血再灌注损伤模型,利用激光多普勒血流仪(LDF)实时记录并分析区域脑血流(rCBF)变化,结合脑组织病理形态、超微结构及相关分子改变,旨在探讨SI对脑I/R后脑血流量、铁死亡、炎症反应和血脑屏障的影响,以期为临床防治缺血性脑卒中提供理论和实验基础。
1. 材料和方法
1.1. 主要试剂与仪器
SI(Acmec,纯度40%);硅胶栓线(北京西浓科技公司);红四氮唑(TTC,Solarbio);伊文思蓝(EB,Macklin);Fe2+、GSH、MDA和MPO试剂盒(南京建成生物工程研究所);TNF-α和IL-1β ELISA试剂盒(上海原鑫生物公司);GPX4抗体(Bioss);MMP-9和Occludin抗体(Wanleibio);电泳仪(Servicebio);激光多普勒血流仪(Perimed)。
1.2. 动物分组和给药
120只SPF级雄性SD大鼠(260~280 g)随机分为Sham组、I/R组和SI组,40只/组。SI组按120 mg·kg-1·d-1灌胃配制好的大豆异黄酮溶液[9],Sham组和I/R组灌胃等体积的生理盐水,3组大鼠术前均连续灌胃21 d。实验动物由济南朋悦动物繁育公司提供[许可证号:SCXK(鲁)2019-0003],且经蚌埠医学院实验动物管理和伦理委员会审查并批准(伦审编号:2021-206)。
1.3. LDF指导大鼠脑I/R模型制备
术前用1%戊巴比妥钠(60 mg/kg)腹腔注射、麻醉大鼠,俯卧位置于试验台上,剃毛后消毒术野,剪开额顶部皮肤,清理表面筋膜及渗出液,直至完全暴露颅骨视野,使用牙科钻在横窦上方、上矢状窦外侧及冠状缝下方处[14]打磨骨窗,至穿透颅骨但未破坏硬脑膜为宜,生物胶探头固定于此,待血流趋于稳定后开始记录rCBF(受麻醉作用时效的限制,rCBF记录时长≤4 h)。
采用改良Longa法[15]制备模型,将大鼠仰卧位轻放并固定,颈部剪毛、消毒,逐层分离皮下组织,直至充分暴露右侧颈总动脉(CCA),颈外动脉(ECA)和颈内动脉(ICA),近心端结扎CCA和ECA,于CCA开一V型缺口,插入栓线并经动脉分叉入ICA,约18~20 mm后稍感阻力时停止,闭塞2 h后拔出栓线,逐层缝合后入笼基础饲养,再灌注24 h后取脑并测定各项指标(Sham组仅将栓线略插入ICA,未导致脑中动脉闭塞;I/R组和SI组严格按上述步骤执行)。
1.4. 光镜和透射电镜观察脑组织病理形态、神经元和BBB超微结构
将新鲜脑组织放入4%多聚甲醛溶液中固定24 h,经脱水、浸蜡、包埋、切片(4 μm)、烘烤,苏木精-伊红染色(HE染色)等操作后,于光镜下观察脑组织病理形态改变。
在冰盘上取1 mm3脑组织,经2.5%戊二醛固定6 h、1%锇酸固定2 h、室温脱水、渗透包埋、聚合、超薄切片(60 nm)、铀铅双染等步骤后,于电镜下观察神经元和BBB超微结构变化。
1.5. 神经缺损评分及脑梗死体积检测
参照Longa评价指标[15]:0分指正常活动(剔除);1分指对侧前肢不完全伸展;2分指朝对侧转圈;3分指朝对侧倾倒;4分指无意识和爬行能力(剔除)。
麻醉后立即取脑,-80 ℃冰箱冷冻,隔日切6片厚度为2 mm的脑片浸没于2% TTC染液中,37 ℃恒温箱中遮光水浴17 min,多聚甲醛固定15 min后拍照并导入Image J分析。
1.6. EB渗透量和脑含水量测定
取样前1 h经股静脉注射2% EB溶液(4 mL/kg),于既定取样时间点灌洗心脏至流出澄清液,脑组织称重后置于甲酰胺溶液(1 mL/100 mg)中浸泡,54 ℃孵育24 h,离心后使用酶标仪(波长632 nm)测定上清液光密度值,根据标准曲线换算EB含量[16]。
再灌注24 h后常规麻醉,快速分离病灶侧脑并称取湿重,100 ℃烤箱中放置24 h后记录干重,脑含水量=(湿重–干重)/湿重×100%。
1.7. 分光光度法检测缺血半暗带Fe2+、GSH、MDA和MPO含量
于冰盘上迅速剪取缺血半暗带脑组织,称重后根据重量和体积1∶ 9配制成相应的匀浆液,13 200 r/min离心25 min后分装上清液,逐步加入样品及工作试剂,记录待测样品浓度或各管吸光度值,代入相应的测试盒计算公式检测各项指标含量。
1.8. ELISA法测定血清TNF-α和IL-1β活性
取腹主动脉血置于冷凝管中,室温静置1 h,3200 r/min离心35 min后收集上清液,参照试剂盒说明书操作,记录标准孔和样本孔的吸光度值,根据标准浓度和标准孔吸光度值绘制标准曲线,把样本孔吸光度值代入标准曲线,求得TNF-α和IL-1β活性。
1.9. Western blot法和IHC法检测病灶周围GPX4、MMP-9和Occludin表达
低温环境下及时称取脑组织匀浆并裂解,13 200 r/min离心15 min后分装上清液,蛋白定量、变性、上样(40 μg),电泳、转膜、封闭,GPX4(1∶500)、MMP-9(1∶500)和Occludin(1∶ 500)抗体4 ℃孵育过夜,洗膜,二抗避光孵育2 h,再次洗膜后显影条带。
蜡块切片后经脱蜡水化、抗原修复、内源酶阻断、血清封闭、一抗(与Western blot浓度相同)4 ℃孵育过夜、二抗遮光孵育55 min、DAB显色、细胞核复染、脱水封片等步骤后,置于镜下观察。
1.10. 统计学方法
采用GraphPad Prism 8软件进行统计学分析。计量资料以均数±标准差表示,组间差异采用单因素方差分析。P < 0.05时认为差异有统计学意义。
2. 结果
2.1. 造模阶段rCBF动态变化
插线成功后,I/R组(图 1A)和SI组(图 1B)rCBF均呈现骤降趋势、降幅均大于70%;缺血2 h期间rCBF保持相对稳定;拔线后,I/R组rCBF上升慢于SI组。rCBF存在插线后不稳定(低灌注,图 1C)和拔线后未复流(单纯缺血,图 1D)状况,不符合脑I/R造模要求并舍去[血流灌注量(PU)=测量区域内运动的血细胞数量×血细胞的平均运动速度]。
1.
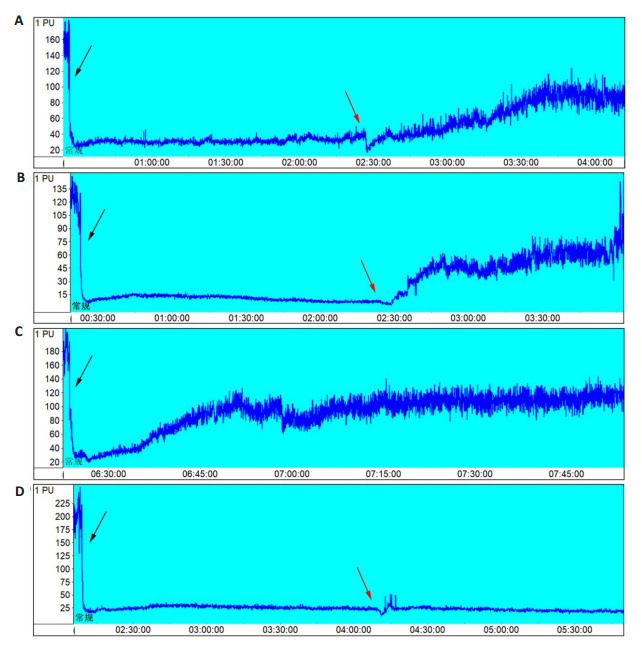
区域脑血流动态变化
Dynamic changes of regional cerebral blood flow (rCBF). A: Changes of rCBF in I/R group. B: Changes of rCBF in SI group. C: Unstable rCBF after monofilament insertion. D: Restored rCBF after monofilament removal. The black arrows indicate the time points of monofilament insertion, and the red arrows indicate monofilament removal.
2.2. 脑组织病理形态和超微结构变化
Sham组神经细胞胞体饱满,核仁清晰,间质无水肿;I/R组细胞核固缩严重,间质呈水肿、空泡化;SI组细胞轻微皱缩,核仁可见,间质含少量水肿及空泡区,SI组脑组织病理损伤程度介于Sham组和I/R组之间(图 2A)。
2.
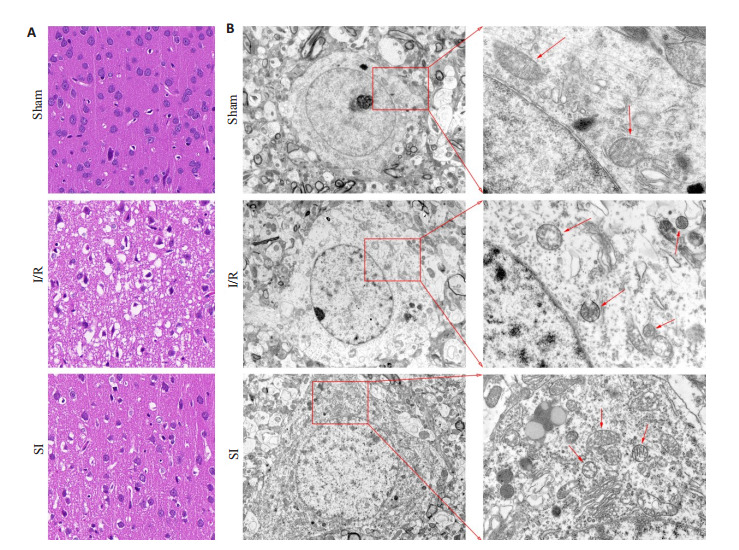
脑组织病理形态及神经元超微结构变化
Changes of cerebral pathologies (A; HE staining, Original magnification: × 400) and ultrastructure of the neurons under transmission electron microscopy (B; left, ×2500; right, ×8000). The arrows indicate the mitochondria.
Sham组神经元结构完整,线粒体大小尚可,呈椭圆形,嵴排列整齐,线粒体双层膜轮廓清晰;I/R组神经元胞膜破裂严重,线粒体变小,呈圆形,嵴减少、模糊不清,线粒体膜密度增加、双层膜视野不明显,具有铁死亡特征性表现;SI组神经元胞膜轻度破裂,线粒体大小不一,呈椭圆形及圆形,嵴数目明显增加,线粒体双层膜和高密度膜皆有分布,SI组神经元损伤程度介于Sham组和I/R组之间(图 2B)。
Sham组内皮细胞(图 3A)未见明显水肿、胞核呈扁平长梭形,紧密连接(图 3B)较致密,基底膜(图 3C)厚薄均一,星形胶质细胞足突(图 3D)无水肿、耦连性较好,血管腔(图 3E)饱满;I/R组内皮细胞水肿严重,紧密连接松散,基底膜厚薄不均,星形胶质细胞足突大面积水肿,管腔明显塌陷;SI组内皮细胞轻度水肿、胞核呈不规则形,紧密连接包括致密区和松散区,基底膜厚薄尚可,星形胶质细胞足突小范围水肿,管腔局部塌陷,SI组BBB损伤程度介于Sham组和I/R组之间(图 3)。
3.
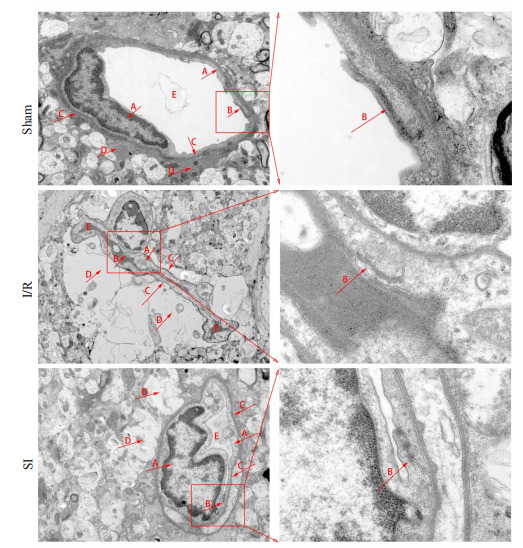
血脑屏障超微结构变化
Ultrastructural changes of the blood-brain barrier (left, ×4000; right, ×20 000). A: Endothelial cells. B: Tight junctions. C: Basement membranes. D: Astrocytes. E: Vascular lumens.
2.3. 神经缺损评分、脑梗死体积、脑含水量和EB渗透量变化
与Sham组相比,I/R组大鼠神经缺损评分(图 4A)、脑梗死体积(图 4B、C)、脑含水量(图 4D)和EB渗透量(图 4E、F)明显增加(P < 0.01),经SI预处理后,大鼠神经缺损评分、脑梗死体积、脑含水量和EB渗透量显著降低(P < 0.05)。
4.
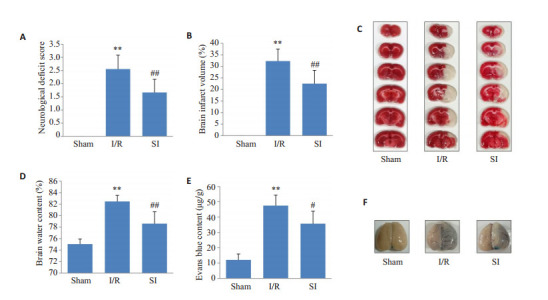
神经缺损评分、脑梗死体积、脑含水量和EB渗透量变化
Changes of the neurological deficit score (A), brain infarct volume (B, C; TTC staining), brain water content (D) and Evans blue permeability (E, F; EB staining). **P < 0.01 vs Sham; #P < 0.05, ##P < 0.01 vs I/R (n=6).
2.4. 缺血半暗带Fe2+、GSH、MDA含量和GPX4表达变化
与Sham组相比,I/R组大鼠缺血半暗带Fe2(+ 图 5A)和MDA(图 5D)含量增高、GSH(图 5B)含量降低(P < 0.01);与I/R组相比,SI组Fe2+和MDA含量降低、GSH含量增高(P < 0.01)。
5.
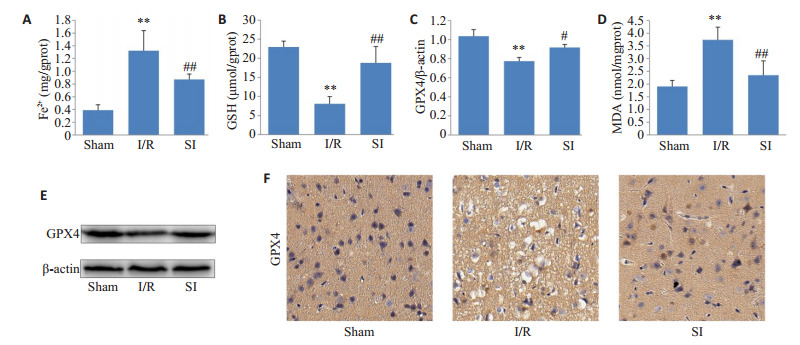
铁死亡有关指标变化
Changes in indicators related to ferroptosis. A: Content of Fe2+. B: Content of GSH. C: Quantitative analysis of GPX4 expression. D: Content of MDA (n=6). E: GPX4 expression detected by Western blotting (n=3). F: GPX4 expression detected by immunohistochemistry (×400). **P < 0.01 vs Sham; #P < 0.05, ##P < 0.01 vs I/R.
Western blot结果显示(图 5C、E),I/R组GPX4表达相较于Sham组有所降低(P < 0.01),使用SI预处理后,GPX4表达升高(P < 0.05)。IHC后GPX4阳性细胞胞浆、胞核呈棕黄色。Sham组细胞多见深棕色强阳性表达,I/R组细胞多呈浅棕色片状弱阳性表达,SI组细胞既有深棕色也有棕黄色和无色,阳性表达介于Sham组和I/R组之间(图 5F)。
2.5. 脑组织MPO含量和血清TNF-α、IL-1β活性变化
I/R组大鼠脑组织MPO(图 6A)含量和血清TNF-α(图 6B)、IL-1β(图 6C)活性相较于Sham组明显增高(P < 0.01)。与I/R组相比,SI组MPO含量和TNF-α、IL-1β活性减低(P < 0.05,P < 0.01)。
6.
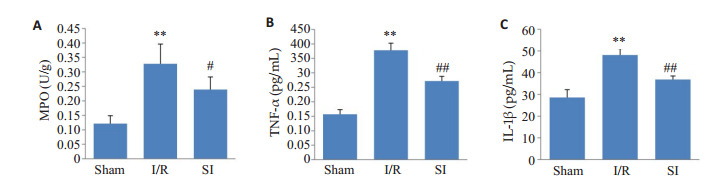
炎症反应有关指标变化
Changes in indicators related to inflammatory response (n=6). A: Content of MPO. B: Activity of TNF-α. C: Activity of IL-1β. **P < 0.01 vs Sham; #P < 0.05, ##P < 0.01 vs I/R.
2.6. 病灶周围MMP-9和Occludin表达变化
Western blot结果显示(图 7A~C),与Sham组相比,I/R组MMP-9表达增多、Occludin表达减少(P < 0.01);与I/R组相比,SI组MMP-9表达下调、Occludin表达上调(P < 0.05,P < 0.01)。
7.
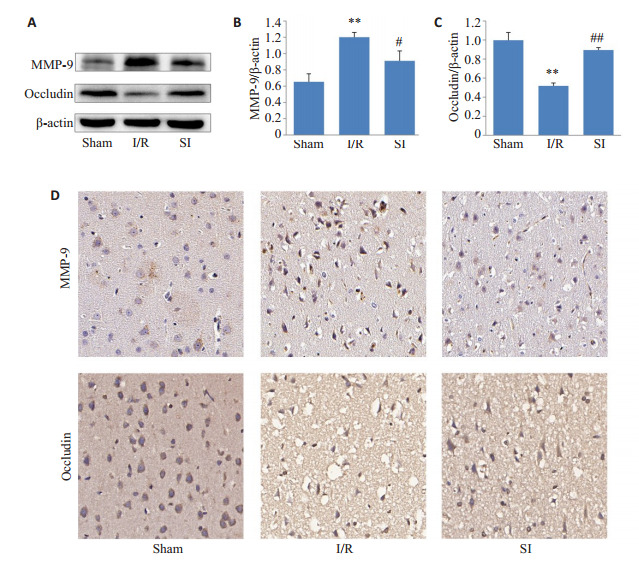
血脑屏障损伤有关指标变化
Changes in indicators related to blood-brain barrier injury. A: Expression of MMP- 9 and Occludin detected by Western blotting (n=3). B: Quantitative analysis of MMP- 9 expression. C: Quantitative analysis of occludin expression. D: Expression of MMP-9 and occludin detected by immunohistochemistry (×400). **P < 0.01 vs Sham; #P < 0.05, ##P < 0.01 vs I/R.
IHC后MMP-9与Occludin阳性细胞胞浆呈棕黄色。对于MMP-9而言,Sham组细胞仅有少量浅棕色弱阳性表达,I/R组细胞多为深棕色片状强阳性表达,SI组细胞以棕黄色和浅棕色为主,阳性表达介于Sham组和I/R组之间;对于Occludin来说,Sham组细胞深棕色强阳性表达较多,I/R组细胞以浅棕色片状弱阳性表达为主,SI组细胞多为棕黄色,阳性表达介于Sham组和I/R组之间(图 7D)。
3. 讨论
铁死亡是一种以铁依赖性脂质过氧化为主要特征的非经典程序性死亡形式[17],是继凋亡、坏死和自噬后被定义更具特异性的靶向神经元调控形式[6],其形态学标志性特征为线粒体皱缩、双层膜密度增加、嵴减少或模糊不清[18, 19]。铁死亡是氧化应激驱动的特殊死亡形式,其本质是GSH耗尽,GPX4活性下降,脂质过氧化物不能通过GPX4催化的谷胱甘肽还原酶反应代谢,Fe2+氧化脂质产生活性氧,从而促进铁死亡[20]。铁死亡分子层面的特异性主要体现在铁代谢紊乱、脂质过氧化物聚集、氨基酸抗氧化系统失衡[17]。不稳定铁池中释放的高反应活性Fe2+一方面促进Fenton反应产生脂质活性氧,另一方面参与脂质代谢中脂氧合酶催化亚基的构成,二者通过直接或间接途径攻击磷脂中多不饱和脂肪酸,导致生物膜破坏及过氧化产物MDA毒性蓄积;GSH/GPX4是重要的内源性抗氧化体系,GSH不仅能直接清除异常自由基,更可作为铁死亡核心催化酶GPX4的辅因子,利用自身还原性抑制或逆转脂质过氧化[21]。
SI是从大豆中精提取的黄酮类化合物[12],因能竞争性地与雌激素受体结合且存在透过BBB的脂溶特性,其在体内发挥包括中枢神经保护在内的广泛雌激素样生物学效应[8, 10, 11, 13],已用于CIRI的保护性研究。本课题组前期研究发现[9],120 mg·kg-1·d-1剂量的SI灌胃预处理对于大鼠CIRI的保护效果相对较好,因此本研究继续按照此剂量对大鼠术前干预,通过大脑中动脉阻塞复制局灶性脑缺血再灌注模型,缺血2 h再灌注24 h后,发现缺血半暗带区神经细胞核固缩严重,间质呈水肿、空泡化,线粒体皱缩、双层膜密度增加、嵴减少或模糊不清,Fe2+和MDA含量增高、GSH含量及GPX4表达降低,提示铁死亡参与脑缺血再灌注损伤。SI预处理后能明显减轻神经元形态和超微结构的损伤性变化,明显降低Fe2+和MDA含量、提高GSH含量及GPX4表达,提示SI能通过减轻氧化应激抑制铁死亡发挥神经元保护作用。
再灌注后微血管发生的“无复流”现象是CIRI的重要因素之一。再灌注后初期的低灌注加重细胞死亡的风险,改善脑血流与神经功能缺陷密切相关,预示更好的预后,可成为缓解CIRI的一个治疗策略[3]。LDF作为一项微创、敏感和非侵入式的微循环血流监测技术,其能通过监测大鼠rCBF动态变化,实现对脑功能损伤程度和模型成功率的可视化分析[22]。本研究通过LDF监测发现,再灌注初期I/R组rCBF恢复缓慢甚至无复流,表明血管再通早期大脑仍处于低灌注甚至缺血状态。经SI预处理的大鼠rCBF恢复明显快于I/R组,提示SI能改善再灌注初期脑血流量。同时发现,SI组神经功能缺陷评分明显低于I/R组,提示SI具有改善缺血再灌注后神经功能的作用。鉴于脑血管个体差异性及行为学评价主观性,本实验于术中实时监测rCBF变化以保证模型同质性,观察并剔除插线后低灌注和拔线后未复流状况;发现在符合模型组和药物组的血流变化特征后,其对应分组的脑梗死体积稳定性较高,说明LDF能实现较早期对活体脑I/R模型成功率的客观评价。
缺血再灌注诱导BBB损伤,BBB结构和功能的失调又加重神经细胞死亡。BBB结构和功能的稳定主要靠微血管内皮细胞及胞间的紧密连接、基底膜及膜内的周细胞、以及星形胶质细胞足突共同维持,其中紧密连接对限制细胞旁通透性很关键,Occludin作为重要的跨膜蛋白,其与胞质附着蛋白、连接黏附分子等协作以稳固紧密连接;基底膜由细胞外基质成分如Ⅳ型胶原、层粘连蛋白等组成,其结构连续和带负电的生理特性既保护了内皮细胞也保障了血管腔的充盈[4, 23]。MMP-9是脑I/R急性期与BBB损伤关系最密切的蛋白酶之一,正常情况下以低水平表达维持基础代谢需求,病理状态下可经中性粒细胞转录及炎症介质诱导进一步表达和活化[24]。本实验通过Western blot法和IHC法观察到再灌注后病灶周围MMP-9表达显著增多。既往研究表明,活化的MMP-9可通过降解Occludin和细胞外基质破坏BBB完整性,而通过给药抑制MMP-9表达能有效减轻脑水肿[25, 26]。本实验发现I/R组MMP-9表达增多,Occludin表达减少,进一步通过电镜观察到紧密连接松散、基底膜厚薄不均、管腔塌陷,提示活化MMP-9能导致BBB损伤;而经SI预处理后,MMP-9表达下调、Occludin表达上调。伊文氏蓝(EB)与大分子量血浆白蛋白高亲和力的特性[27],生理状态下EB难以跨越BBB进入脑组织,因此EB渗透量的高低可用于客观衡量BBB损伤程度。本研究发现I/R组EB渗透量和脑含水量较Sham组明显增多,提示BBB完整性受损;而SI组EB渗透量和含水量相较于I/R组显著减少,BBB损伤程度明显改善,SI通过抑制MMP-9表达、上调Occludin表达保护BBB结构和功能的稳定性,从而减少神经元死亡。
炎症的过度激活是再灌注初期低灌注的主要因素,同时炎症又是介导BBB损伤的重要病理因素。缺血后,神经元损伤或坏死,固有免疫细胞识别病灶并异常活化,以分泌过量炎症因子、趋化因子等,进而诱导外周血白细胞,尤其是中性粒细胞向病灶及周边募集、浸润,促使脑组织由缺血性损伤转向炎症性损伤[5]。稳态条件下CNS依靠BBB低渗特性与外周免疫系统分隔,而当CNS炎症环境存在并进一步破坏BBB后,再灌注后脑内与炎症有关的神经毒性物质会释放到外周血循环,从而介导外周免疫细胞及促炎细胞因子TNF-α、IL-1β等过度表达[28],因此外周血TNF-α和IL-1β活性是间接检验脑内炎症反应与脑损伤程度的可靠指标。有研究发现,下调MPO含量及TNF-α、IL-1β活性可减轻神经元损伤程度[29, 30]。本研究观察到SI组MPO含量和TNF-α、IL-1β活性相较于I/R组明显降低,提示SI对脑缺血再灌注后的神经元保护作用与抑制炎症反应有关。另外有研究[7, 31]表明,铁死亡能够诱导花生四烯酸自胞膜磷脂池中催化、释放,后可经脂氧合酶和环加氧酶进一步代谢为白三烯、前列腺素等促炎介质,加重脑缺血再灌注后炎症级联反应。黄毓慧等[19]的研究表明,通过抑制铁死亡能显著降低炎症因子TNF-α表达。
综上所述,细胞死亡是缺血再灌注损伤的最严重病理过程,再灌注初期脑血流延迟性低灌流和BBB结构和功能损伤是神经元死亡重要因素,炎症是缺血再灌注后低灌流及BBB结构和功能失衡的重要诱导因素,同时,铁死亡又可加重炎症反应的级联效应。本研究揭示SI预处理可能通过抑制炎症反应,改善脑血流、减轻BBB的损伤程度,进而抑制铁死亡,减轻CIRI,改善CIRI后的神经功能恢复。
Biography
李晒,E-mail: 1920406277@qq.com
Funding Statement
安徽省教育厅自然科学重大研究项目(KJ2021ZD0091);国家级大学生创新项目(202110367041);安徽省大学生创新项目(S202010367039)
Contributor Information
李 晒 (Shai LI), Email: 1920406277@qq.com.
赵 士弟 (Shidi ZHAO), Email: zhsdi@126.com.
References
- 1.王 陇德, 王 金环, 彭 斌, et al. 《中国脑卒中防治报告2016》概要. 中国脑血管病杂志. 2017;14(4):217–24. doi: 10.3969/j.issn.1672-5921.2017.04.010. [王陇德, 王金环, 彭斌, 等. 《中国脑卒中防治报告2016》概要[J]. 中国脑血管病杂志, 2017, 14(4): 217-24.] [DOI] [Google Scholar]
- 2.Campbell BCV, Khatri P. Stroke. Lancet. 2020;396(10244):129–42. doi: 10.1016/S0140-6736(20)31179-X. [Campbell BCV, Khatri P. Stroke[J]. Lancet, 2020, 396(10244): 129-42.] [DOI] [PubMed] [Google Scholar]
- 3.Hauck EF, Apostel S, Hoffmann JF, et al. Capillary flow and diameter changes during reperfusion after global cerebral ischemia studied by intravital video microscopy. J Cereb Blood Flow Metab. 2004;24(4):383–91. doi: 10.1097/00004647-200404000-00003. [Hauck EF, Apostel S, Hoffmann JF, et al. Capillary flow and diameter changes during reperfusion after global cerebral ischemia studied by intravital video microscopy[J]. J Cereb Blood Flow Metab, 2004, 24 (4): 383-91.] [DOI] [PubMed] [Google Scholar]
- 4.Sweeney MD, Sagare AP, Zlokovic BV. Blood-brain barrier breakdown in Alzheimer disease and other neurodegenerative disorders. Nat Rev Neurol. 2018;14(3):133–50. doi: 10.1038/nrneurol.2017.188. [Sweeney MD, Sagare AP, Zlokovic BV. Blood-brain barrier breakdown in Alzheimer disease and other neurodegenerative disorders[J]. Nat Rev Neurol, 2018, 14(3): 133-50.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Varatharaj A, Galea I. The blood-brain barrier in systemic inflammation. Brain Behav Immun. 2017;60:1–12. doi: 10.1016/j.bbi.2016.03.010. [Varatharaj A, Galea I. The blood-brain barrier in systemic inflammation[J]. Brain Behav Immun, 2017, 60: 1-12.] [DOI] [PubMed] [Google Scholar]
- 6.Fricker M, Tolkovsky AM, Borutaite V, et al. Neuronal cell death. Physiol Rev. 2018;98(2):813–80. doi: 10.1152/physrev.00011.2017. [Fricker M, Tolkovsky AM, Borutaite V, et al. Neuronal cell death [J]. Physiol Rev, 2018, 98(2): 813-80.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Tang DL, Chen X, Kang R, et al. Ferroptosis: molecular mechanisms and health implications. Cell Res. 2021;31(2):107–25. doi: 10.1038/s41422-020-00441-1. [Tang DL, Chen X, Kang R, et al. Ferroptosis: molecular mechanisms and health implications[J]. Cell Res, 2021, 31(2): 107-25.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Kim IS. Current perspectives on the beneficial effects of soybean isoflavones and their metabolites for humans. Antioxidants: Basel. 2021;10(7):1064–73. doi: 10.3390/antiox10071064. [Kim IS. Current perspectives on the beneficial effects of soybean isoflavones and their metabolites for humans[J]. Antioxidants: Basel, 2021, 10(7): 1064-73.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.赵 士弟, 陈 耀, 董 银凤, et al. 大豆异黄酮对全脑缺血/再灌注大鼠海马神经细胞凋亡的影响. https://www.cnki.com.cn/Article/CJFDTOTAL-SHEY201504013.htm. 上海交通大学学报: 医学版. 2015;35(4):521–9. [赵士弟, 陈耀, 董银凤, 等. 大豆异黄酮对全脑缺血/再灌注大鼠海马神经细胞凋亡的影响[J]. 上海交通大学学报: 医学版, 2015, 35(4): 521-9.] [Google Scholar]
- 10.Li N, Wu XT, Zhuang W, et al. Soy and isoflavone consumption and multiple health outcomes: umbrella review of systematic reviews and meta-analyses of observational studies and randomized trials in humans. Mol Nutr Food Res. 2020;64(4):e1900751–9. doi: 10.1002/mnfr.201900751. [Li N, Wu XT, Zhuang W, et al. Soy and isoflavone consumption and multiple health outcomes: umbrella review of systematic reviews and meta-analyses of observational studies and randomized trials in humans[J]. Mol Nutr Food Res, 2020, 64(4): e1900751-9.] [DOI] [PubMed] [Google Scholar]
- 11.Applegate CC, Rowles JL, Ranard KM, et al. Soy consumption and the risk of prostate cancer: an updated systematic review and metaanalysis. Nutrients. 2018;10(1):E40–8. doi: 10.3390/nu10010040. [Applegate CC, Rowles JL, Ranard KM, et al. Soy consumption and the risk of prostate cancer: an updated systematic review and metaanalysis[J]. Nutrients, 2018, 10(1): E40-8.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.赵 士弟, 陈 耀, 姜 丽娜, et al. 大豆异黄酮对脑缺血/再灌注诱导的线粒体损伤和脑细胞凋亡的影响. 中国病理生理杂志. 2014;30(12):2172–8. doi: 10.3969/j.issn.1000-4718.2014.12.010. [赵士弟, 陈耀, 姜丽娜, 等. 大豆异黄酮对脑缺血/再灌注诱导的线粒体损伤和脑细胞凋亡的影响[J]. 中国病理生理杂志, 2014, 30(12): 2172-8.] [DOI] [Google Scholar]
- 13.邵 晓洁, 管 文婕, 洪 占梅, et al. 大豆异黄酮通过NF-κB p65信号通路抑制Aβ1-42诱导的海马神经元炎症和凋亡. https://www.cnki.com.cn/Article/CJFDTOTAL-YAOL202206013.htm. 中国药理学通报. 2022;38(6):874–9. [邵晓洁, 管文婕, 洪占梅, 等. 大豆异黄酮通过NF-κB p65信号通路抑制Aβ1-42诱导的海马神经元炎症和凋亡[J]. 中国药理学通报, 2022, 38(6): 874-9.] [Google Scholar]
- 14.Cahill J, Zhang JH, Chen J, et al. Animal models of acute neurological injuries. Humana Press. 2009;106:39–45. [Cahill J, Zhang JH, Chen J, et al. Animal models of acute neurological injuries[J]. Humana Press, 2009, 106: 39-45.] [Google Scholar]
- 15.Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 1989;20(1):84–91. doi: 10.1161/01.STR.20.1.84. [Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91.] [DOI] [PubMed] [Google Scholar]
- 16.Liang YB, Song PP, Chen W, et al. Inhibition of caspase-1 ameliorates ischemia-associated blood-brain barrier dysfunction and integrity by suppressing pyroptosis activation. Front Cell Neurosci. 2020;14:540669–78. doi: 10.3389/fncel.2020.540669. [Liang YB, Song PP, Chen W, et al. Inhibition of caspase-1 ameliorates ischemia-associated blood-brain barrier dysfunction and integrity by suppressing pyroptosis activation[J]. Front Cell Neurosci, 2020, 14: 540669-78.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Chen X, Kang R, Kroemer G, et al. Broadening horizons: the role of ferroptosis in cancer. Nat Rev Clin Oncol. 2021;18(5):280–96. doi: 10.1038/s41571-020-00462-0. [Chen X, Kang R, Kroemer G, et al. Broadening horizons: the role of ferroptosis in cancer[J]. Nat Rev Clin Oncol, 2021, 18(5): 280-96.] [DOI] [PubMed] [Google Scholar]
- 18.胡 淼, 童 旭辉, 黄 杰, et al. 基于铁死亡探讨AMPK抗小鼠脑缺血/再灌注损伤的作用及机制. 华中科技大学学报: 医学版. 2021;50(4):418–23. doi: 10.3870/j.issn.1672-0741.2021.04.002. [胡淼, 童旭辉, 黄杰, 等. 基于铁死亡探讨AMPK抗小鼠脑缺血/再灌注损伤的作用及机制[J]. 华中科技大学学报: 医学版, 2021, 50 (4): 418-23.] [DOI] [Google Scholar]
- 19.黄 毓慧, 张 共鹏, 梁 欢, et al. 抑制铁死亡可减轻脓毒症小鼠的心肌损伤: 脂钙蛋白-2的作用. https://www.j-smu.com/CN/10.12122/j.issn.1673-4254.2022.02.13. 南方医科大学学报. 2022;42(2):256–62. doi: 10.12122/j.issn.1673-4254.2022.02.13. [黄毓慧, 张共鹏, 梁欢, 等. 抑制铁死亡可减轻脓毒症小鼠的心肌损伤: 脂钙蛋白-2的作用[J]. 南方医科大学学报, 2022, 42(2): 256-62.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Bao ZH, Hou XB, Li HL, et al. The mechanism and progress of ferroptosis in pancreatic cancer. Acta Histochem. 2022;124(6):151919–30. doi: 10.1016/j.acthis.2022.151919. [Bao ZH, Hou XB, Li HL, et al. The mechanism and progress of ferroptosis in pancreatic cancer[J]. Acta Histochem, 2022, 124(6): 151919-30.] [DOI] [PubMed] [Google Scholar]
- 21.Wang PN, Cui YM, Ren QQ, et al. Mitochondrial ferritin attenuates cerebral ischaemia/reperfusion injury by inhibiting ferroptosis. Cell Death Dis. 2021;12:447–55. doi: 10.1038/s41419-021-03725-5. [Wang PN, Cui YM, Ren QQ, et al. Mitochondrial ferritin attenuates cerebral ischaemia/reperfusion injury by inhibiting ferroptosis[J]. Cell Death Dis, 2021, 12: 447-55.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Wang RR, Wang HL, Liu YA, et al. Optimized mouse model of embolic MCAO: from cerebral blood flow to neurological outcomes. J Cereb Blood Flow Metab. 2022;42(3):495–509. doi: 10.1177/0271678X20917625. [Wang RR, Wang HL, Liu YA, et al. Optimized mouse model of embolic MCAO: from cerebral blood flow to neurological outcomes [J]. J Cereb Blood Flow Metab, 2022, 42(3): 495-509.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Sweeney MD, Zhao Z, Montagne A, et al. Blood-brain barrier: from physiology to disease and back. Physiol Rev. 2019;99(1):21–78. doi: 10.1152/physrev.00050.2017. [Sweeney MD, Zhao Z, Montagne A, et al. Blood-brain barrier: from physiology to disease and back[J]. Physiol Rev, 2019, 99(1): 21-78.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Liao BY, Geng LL, Zhang F, et al. Adipocyte fatty acid-binding protein exacerbates cerebral ischaemia injury by disrupting the blood-brain barrier. Eur Heart J. 2020;41(33):3169–80. doi: 10.1093/eurheartj/ehaa207. [Liao BY, Geng LL, Zhang F, et al. Adipocyte fatty acid-binding protein exacerbates cerebral ischaemia injury by disrupting the blood-brain barrier[J]. Eur Heart J, 2020, 41(33): 3169-80.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.唐 兆华, 王 文涛, 刘 自力, et al. 阻断ERK信号通路降低大鼠脑创伤后MMP-9的表达及减轻脑水肿. https://www.j-smu.com/CN/10.12122/j.issn.1673-4254.2020.07.16. 南方医科大学学报. 2020;40(7):1018–22. doi: 10.12122/j.issn.1673-4254.2020.07.16. [唐兆华, 王文涛, 刘自力, 等. 阻断ERK信号通路降低大鼠脑创伤后MMP-9的表达及减轻脑水肿[J]. 南方医科大学学报, 2020, 40(7): 1018-22.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Wu X, Fu SM, Liu Y, et al. NDP-MSH binding melanocortin-1 receptor ameliorates neuroinflammation and BBB disruption through CREB/Nr4a1/NF-κB pathway after intracerebral hemorrhage in mice. J Neuroinflammation. 2019;16(1):192–8. doi: 10.1186/s12974-019-1591-4. [Wu X, Fu SM, Liu Y, et al. NDP-MSH binding melanocortin-1 receptor ameliorates neuroinflammation and BBB disruption through CREB/Nr4a1/NF-κB pathway after intracerebral hemorrhage in mice[J]. J Neuroinflammation, 2019, 16(1): 192-8.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Ehlerding EB, Lan XL, Cai WB. "albumin hitchhiking" with an Evans blue analog for cancer theranostics. Theranostics. 2018;8(3):812–4. doi: 10.7150/thno.24183. [Ehlerding EB, Lan XL, Cai WB. "albumin hitchhiking" with an Evans blue analog for cancer theranostics[J]. Theranostics, 2018, 8 (3): 812-4.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Sanmarco LM, Polonio CM, Wheeler MA, et al. Functional immune cell-astrocyte interactions. J Exp Med. 2021;218(9):e20202715–23. doi: 10.1084/jem.20202715. [Sanmarco LM, Polonio CM, Wheeler MA, et al. Functional immune cell-astrocyte interactions[J]. J Exp Med, 2021, 218(9): e20202715-23.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Qin SS, Yang CH, Huang WH, et al. Sulforaphane attenuates microglia-mediated neuronal necroptosis through down-regulation of MAPK/NF-κB signaling pathways in LPS-activated BV-2 microglia. Pharmacol Res. 2018;133:218–35. doi: 10.1016/j.phrs.2018.01.014. [Qin SS, Yang CH, Huang WH, et al. Sulforaphane attenuates microglia-mediated neuronal necroptosis through down-regulation of MAPK/NF-κB signaling pathways in LPS-activated BV-2 microglia[J]. Pharmacol Res, 2018, 133: 218-35.] [DOI] [PubMed] [Google Scholar]
- 30.Cai W, Liu SX, Hu MY, et al. Functional dynamics of neutrophils after ischemic stroke. Transl Stroke Res. 2020;11(1):108–21. doi: 10.1007/s12975-019-00694-y. [Cai W, Liu SX, Hu MY, et al. Functional dynamics of neutrophils after ischemic stroke[J]. Transl Stroke Res, 2020, 11(1): 108-21.] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Kagan VE, Mao GW, Qu F, et al. Oxidized arachidonic and adrenic PEs navigate cells to ferroptosis. Nat Chem Biol. 2017;13(1):81–90. doi: 10.1038/nchembio.2238. [Kagan VE, Mao GW, Qu F, et al. Oxidized arachidonic and adrenic PEs navigate cells to ferroptosis[J]. Nat Chem Biol, 2017, 13(1): 81-90.] [DOI] [PMC free article] [PubMed] [Google Scholar]


