Abstract
Hintergrund
Die Hüftdysplasie ist ein bekannter Grund für Hüftschmerzen bei Jugendlichen und jungen Erwachsenen. Die präoperative Bildgebung wurde durch die Fortschritte der MRT in den letzten Jahren immer wichtiger und hat heute einen hohen Stellenwert.
Ziel der Arbeit
Dieser Artikel soll einen Überblick über die präoperative Bildgebung bei Hüftdysplasie geben. Die azetabuläre Version, assoziierte femorale Deformitäten (Cam-Deformität, Valgus und femorale Antetorsion) und intraartikuläre Pathologien (Labrum- und Knorpelschäden) sowie verschiedene Messmethoden und Normwerte werden beschrieben.
Methoden
Die präoperative Bildgebung bei Hüftdysplasie beginnt mit dem a. p. Becken-Röntgenbild.
Die Schnittbildgebung (CT oder MRT) ist der Goldstandard zur Beurteilung der azetabulären Version, der Cam-Deformität und zur Messung der femoralen Antetorsion. Die azetabuläre Version und Überdachung sowie assoziierte femorale Deformitäten können detailliert analysiert werden. Für die femorale Antetorsion sollten die verschiedenen Messmethoden und Normalwerte berücksichtigt werden. Diese sind vor allem bei Patienten mit erhöhter femoraler Antetorsion zu beachten. Die MRT ermöglicht die Beurteilung der Labrumhypertrophie und subtile Zeichen der Hüftinstabilität. 3‑D-Knorpelmapping mittels MRT ermöglicht eine Quantifizierung der Knorpeldegeneration. Ossäre 3D Modelle mittels 3D‑CT und zunehmend mittels MRT ermöglichen zudem die Detektion extraartikulärer Pathologien, (z. B. ischiofemorales Impingement) die als Differenzialdiagnosen zu berücksichtigen sind.
Ergebnisse und Diskussion
Die Hüftdysplasie kann in anteriore, laterale und posteriore Dysplasie eingeteilt werden. Kombinierte Deformitäten sind bei der Hüftdysplasie häufig, eine Cam-Deformität kann bei bis zu 86 % der Patienten vorliegen. Valgusdeformitäten wurden bei 44 % beschrieben. Eine Hüftdysplasie kombiniert mit erhöhter femoraler Antetorsion kann bei bis zu 52 % der Patienten vorliegen. Bei erhöhter femoraler Antetorsion kann zudem ein posteriores intra- und extraartikuläres (ischiofemorales) Impingement zwischen dem Trochanter minor und dem Tuber ischiadicum auftreten. Labrumläsionen und -hypertrophie, subchondrale Zysten und Knorpelschäden sind typische Kollateralschäden bei Patienten mit Hüftdysplasie. Die Hypertrophie des M. iliocapsularis ist ein Instabilitäts Zeichen. Bei der präoperativen Bildgebung sind sowohl die azetabuläre Version und Morphologie als auch die femoralen Deformitäten zu berücksichtigen. Labrum- und Knorpelschäden sowie die assoziierten Deformitäten (u. a. Cam-Deformität und femorale Antetorsion) sind wichtig für die Therapieplanung von Patienten mit Hüftdysplasie. Die biochemische MRT-Bildgebung mittels Knorpelmapping-Techniken (u. a. dGEMRIC) hat großes Potenzial die präoperative Diagnostik und die Patientenselektion zu verbessern.
Schlüsselwörter: Femorale antetorsion, Knorpel, Femoroazetabuläres Impingement, Hüftdysplasie, Magnetresonanztomographie
Abstract
Background
Developmental dysplasia of the hip (DDH) is a known reason for hip pain for adolescents and young adults. Preoperative imaging is increasingly recognized as an important factor due to the recent advances in MR imaging.
Objectives
The aim of this article is to give an overview of preoperative imaging for DDH. The acetabular version and morphology, associated femoral deformities (cam deformity, valgus and femoral antetorsion) and intraarticular pathologies (labrum and cartilage damage) and cartilage mapping are described.
Methods
After an initial evaluation with AP radiographs, CT or MRI represent the methods of choice for the preoperative evaluation of the acetabular morphology and cam deformity, and for the measurement of femoral torsion. Different measurement techniques and normal values should be considered, especially for patients with increased femoral antetorsion because this could lead to misinterpretation and misdiagnosis. MRI allows analysis of labrum hypertrophy and subtle signs for hip instability. 3D MRI for cartilage mapping allows quantification of biochemical cartilage degeneration and yields great potential for surgical decision-making. 3D-CT and, increasingly, 3D MRI of the hip to generate 3D pelvic bone models and subsequent 3D impingement simulation can help to detect posterior extraarticular ischiofemoral impingement.
Results and discussion
Acetabular morphology can be divided in anterior, lateral and posterior hip dysplasia. Combined osseous deformities are common, such as hip dysplasia combined with cam deformity (86%). Valgus deformities were reported in 44%. Combined hip dysplasia and increased femoral antetorsion can occur in 52%. Posterior extraarticular ischiofemoral impingement between the lesser trochanter and the ischial tuberosity can occur in patients with increased femoral antetorsion. Typically, labrum damage and hypertrophy, cartilage damage, subchondral cysts can occur in hip dysplasia. Hypertrophy of the muscle iliocapsularis is a sign for hip instability. Acetabular morphology and femoral deformities (cam deformity and femoral anteversion) should be evaluated before surgical therapy for patients with hip dysplasia, considering the different measurement techniques and normal values of femoral antetorsion.
Keywords: Femoral antetorsion, Cartilage, Femoracetabular impingement, Hip dysplasia, Magnetic resonance imaging
Die präoperative Bildgebung bei Hüftdysplasie zur Analyse der Morphologie der Hüftpfanne und des proximalen Oberschenkels sowie der damit verbundenen Deformitäten (cam-deformität, Valgus und femorale Antetorsion) und intraartikulären Pathologien (Labrum- und Knorpelschäden) sowie Knorpelmapping ist notwendig, um eine adäquate Evaluation des Gelenks zu gewährleisten.
Einleitung
Die Hüftdysplasie ist definiert als verminderte Überdachung (anterior oder lateral) des Femurkopfes und als das Vorliegen einer zu steil gestellten Hüftpfanne. Das Grundproblem ist die verkleinerte Facies lunata bei Patienten mit Hüftdysplasie [64]. Pathophysiologisch führen die lateralen Druckspitzen auf Knorpel und Labrum durch die statische Überbelastung am Pfannenrand zu einer lateral betonten Hüftgelenksarthrose [44]. Die Beckenform bei Hüftdysplasie erscheint typischerweise viereckig oder rektangulär und die Beckenschaufel innenrotiert, während das Tuber ischiadicum außenrotiert erscheint [35, 74]. Die Tendenz des Femurkopfs zur Migration nach superolateral und die resultierende Instabilität können bei Patienten mit einer Coxa valga et antetorta (Valgusdeformität und erhöhte femorale Antetorsion) zusätzlich verstärkt werden kann.
Verschiedene chirurgische Therapien zur Behandlung der Hüftdysplasie wurden beschrieben. Das gemeinsame biomechanische Ziel der Beckenosteotomien ist eine Reduktion der pathologisch erhöhten lateralen Druckspitzen der dysplastischen Hüften [62]. Beckenosteotomien, allen voran die periazetabuläre Osteotomie (PAO), ermöglichen die korrigierende Reorientierung des dysplastischen Azetabulums zur Verbesserung der Überdachung des Femurkopfs. Dadurch können in der Mehrheit der Fälle die Gelenkfunktion wiederhergestellt, die Hüftschmerzen reduziert und langfristig das native Hüftgelenk erhalten werden [33].
Ziel der Arbeit
Dieser Artikel soll einen Überblick über die präoperative Bildgebung bei Hüftdysplasie geben. Die azetabuläre Version und femorale Deformitäten, die Cam-Deformität, Labrum und Knorpel-Bildgebung sowie die verschiedenen Messmethoden und Normwerte der femoralen Antetorsion werden beschrieben.
Methoden
Die präoperative Bildgebung bei Hüftdysplasie beginnt mit der a.-p. (anteroposterior) Beckenübersicht als Röntgenaufnahme. Diese werden im ersten Artikel in dieser Ausgabe ausführlich besprochen. Die wichtigsten Parameter sind der lateraler Zentrum-Eck-Winkel (LCE-Winkel, „lateral center edge“) und der azetabuläre Index (AI, Synonym: AC-Winkel oder Tragflächenwinkel) (Tab. 1). Definiert wird die Hüftdysplasie als LCE-Winkel von weniger als 18° (Tab. 1) von Tönnis und Kollegen [77]. Ein LCE-Winkel zwischen 20 und 25° definiert die grenzwertige Hüftdysplasie (Borderline-Hüftdysplasie) [41]. Weitere radiologische diagnostische Parameter für die Hüftdysplasie sind der azetabuläre Index > 14° und eine Femurkopfextrusion > 27 % (Tab. 1). Die a.-p. Beckenübersichtsaufnahme wird meistens mit einer lateralen oder axialen Aufnahme des proximalen Femurs ergänzt [72]. Auf dieser kann der anteriore Schenkelhals beurteilt und der Alphawinkel gemessen werden [47]. Dabei hat sich die modifizierte Dunn-Projektion (45° Hüftflexion in maximaler Hüftabduktion, Zentralstrahl auf den Femurkopf ausgerichtet) als sensitivste Aufnahme zur initialen und postoperativen Beurteilung des anterolateralen Schenkelhalses gezeigt [60]. Häufig wird die diagnostische Abklärung ergänzt mit einer Faux-Profil-Aufnahme zur Berechnung des vorderen Pfannendachwinkel (englisch „anterior center edge“). Der Normwert beträgt > 25°, ein Winkel unter 20° ist pathologisch und beschreibt die ventrale Dysplasie.
| Parameter | Hüftdysplasie | Interpretation |
|---|---|---|
| Radiologische Diagnose Beckenröntgenbild a.-p. | Lateraler Zentrum-Eck-Winkel < 20° | Hüftdysplasie |
| Lateraler Zentrum-Eck-Winkel 20–25° | Grenzwertige Hüftdysplasie | |
| Azetabulärer Index > 14° | Hüftdysplasie | |
| Femurkopfextrusion > 27 % | Hüftdysplasie | |
| FEAR-Index > 5° | Instabilitätszeichen | |
| Unterbrochene Shenton-Linie | Instabilitätszeichen | |
| CCD-Winkel > 139° | Valgusdeformität | |
| MRT axial | Azetabuläre Morphologie | Anteriore oder laterale Hüftdysplasie |
| Azetabuläre Anteversion | Orientierung Azetabulum | |
| Alphawinkel > 55° | Cam-Deformität | |
| Femorale Antetorsion | Falls erhöht, Cave posteriores Impingement | |
| Kombinierte Anteversion | McKibbin-Index | |
| MRT Muskulatur | Hypertrophie M. iliocapsularis | Instabilitätszeichen |
| MRT Labrum | Labrumhypertrophie | Statische Überlastung durch defizitäre Überdachung |
| MRT Knorpel | Knorpelschaden | Wichtig für Entscheidung hüftgelenkserhaltende Operation ja/nein |
| Arthro-MRT | Kontrastmittel im posterioren Gelenkspalt | Instabilitätszeichen oder Zeichen der Degeneration |
| Beckenform (Röntgenbild) | Typischerweise innenrotierte Beckenschaufel und außenrotierte Schambeinäste | Im Vergleich zu außenrotierter Beckenschaufel bei azetabulärer Retroversion |
| 3‑D-Modell | Patientenspezifische Impingement-Analyse | Bei erhöhter femoraler Antetorsion und Verdacht auf ischiofemorales Impingement |
| Zusatzsequenzen MRT |
Knorpelmapping Größe Facies lunata |
Bei grenzwertiger Hüftdysplasie |
CCD Centrum-Collum-Diaphyse, FEAR „femoro-epiphyseal acetabular roof“
Die Beckenübersichtsaufnahme kann liegend oder stehend erfolgen und sollte beckenzentriert erfolgen [72] und nicht hüftzentriert wie zur Planung einer Hüftprothese. Die Beckenübersichtsaufnahme sollte mit innenrotierten Beinen (15°) und mit einem Film-Fokus-Abstand von 1,2 m erfolgen [72]. Dabei sollte auf die Beckenorientierung und -kippung geachtet werden, welche vor allem die Darstellung der azetabulären Version beeinflussen können [73]. Auf der Beckenübersichtsaufnahme kann zudem die superolaterale „Pistol-grip“-Deformität erkannt werden.
Die Tönnis-Klassifikation ermöglicht eine erste Einschätzung der degenerativen Veränderungen auf dem Röntgenbild
Die Tönnis-Klassifikation beruht vor allem auf der Gelenkspaltverschmälerung und ermöglicht eine erste Einschätzung der degenerativen Veränderungen [75]. Alternativ kann die Kellgren-Lawrence-Klassifikation verwendet werden. Bei fortgeschrittener Arthrose (ab Tönnis-Grad 2) oder bei Alter über 40 Jahren hat eine hüftgelenkserhaltende Operation, z. B. eine PAO, zur Behandlung einer Hüftdysplasie deutlich geringere Erfolgsaussichten und die Hüfttotalprothesenimplantation sollte erwogen werden [62]. Weiter kann bei vermuteter Beinlängendifferenz ein Röntgenbild beider Beine oder eine EOS-Beinaufnahme angefertigt werden.
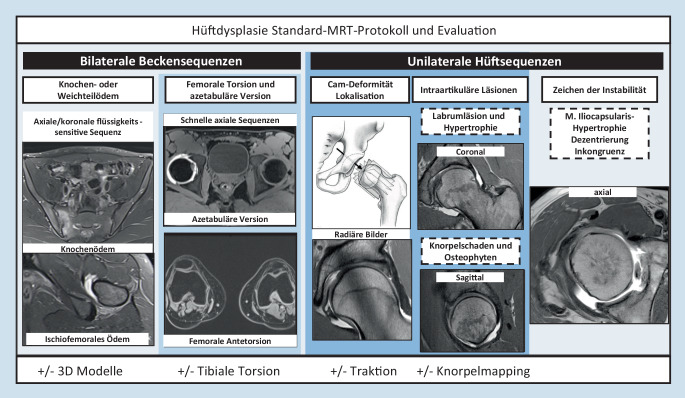
Die Schnittbildgebung (CT oder MRT) ist der Goldstandard zur Beurteilung der azetabulären und femoralen Morphologie, der assoziierten Deformitäten wie der Cam-Deformität und zur Messung der femoralen Antetorsion [21, 80]. Die MRT bei 1,5 T oder zunehmend bei 3 T hat einen hohen Stellenwert und wird in unserer Abteilung routinemäßig bei Patienten mit Hüftdysplasie angewendet. Initial wurde die MRT aufgrund der hohen Sensitivität zur Detektion von Labrum- und Knorpelschäden durchgeführt. Ein mögliches MRT-Protokoll der Hüfte bei Patienten, die für eine gelenkserhaltende Operation, z. B. im Rahmen einer Hüftdysplasie, evaluiert werden, wird in Abb. 1 dargestellt. Grundsätzlich unterscheiden wir beckenzentrierte und hüftzentrierte Sequenzen für unterschiedliche Fragestellungen [42].
Sequenzen mit einem großen „field of view“ des gesamten Beckens (gesamtes Becken abgebildet) dienen einerseits der Detektion von ossären Stressreaktionen (Abb. 2c) oder entzündlichen Veränderungen des Gelenks und der periartikulären Strukturen (z. B. Symphyse, Iliosakralgelenk [15] oder ischiofemorales Ödem [78]) und andererseits der Erkennung von relevanten Nebendiagnosen im kleinen Becken oder in der Leiste [69] (z. B. inkarzerierte Leistenhernie oder Ovarialzyste). Hierfür werden flüssigkeitssensitive Sequenzen verwendet (fettgesättigte T2 TSE- oder TIRM‑/STIR Sequenzen) [42]. Schnelle axiale Sequenzen über Becken und Knie (z. B. dreidimensionale [3-D] T1w-Dixon-VIBE [„volumetric interpolated breath-hold examination“]) haben einen guten Kontrast zwischen Knochen und Weichteilen und können somit zur Messung der femoralen Antetorsion ([68]; Abb. 3b) und der azetabulären Version verwendet werden.
Hüftzentrierte Bilder (unilaterales Hüftgelenk abgebildet) dienen in erster Linie zur Detektion von chondrolabralen Schäden, wobei bevorzugt die direkte MR-Arthrographie oder ein natives Protokoll bei 3 T verwendet werden können. Dafür werden hochaufgelöste Bilder in den Standardorientierungen (koronal, axial und sagittal) akquiriert oder sie werden aus einer 3‑D-Sequenz rekonstruiert. Für die hüftzentrierten Sequenzen können entweder 2D-TSE/FSE-Sequenzen verwendet werden (direkt) oder es werden isotrope 3‑D-Sequenzen (z. B. 3D-T2w-TRUFI) akquiriert und mittels MPR in allen Ebenen rekonstruiert [40].
Zusätzlich zu den üblichen Standardsequenzen können radiäre Bilder zur Beurteilung der Cam-Deformität und von chondrolabralen Schäden akquiriert werden. Diese rotieren orthogonal um die Schenkelhalsachse und erlauben somit eine zirkumferenzielle Darstellung des Schenkelhals-Kopf-Übergangs. Alternativ können dafür axial oblique Sequenzen verwendet werden, die jedoch weniger sensitiv in der Detektion von Cam-Deformitäten sind [50].
Zusätzlich zu dem beschriebenen Protokoll in Abb. 1 können weitere Sequenzen zur Messung der tibialen Torsion, zur Erstellung von 3‑D-Modellen und spezifische hochauflösende Sequenzen für Knorpelmapping (z. B. „delayed gadolinium enhanced MRI of cartilage“ [dGEMRIC]) hinzugefügt werden. Eine Kombination mit Traktion [56] bei vorgängiger Arthrographie erscheint sinnvoll bei fortgeschrittenem Patientenalter.
Die CT wurde vorwiegend in amerikanischen Studien als Standard bezeichnet, im Rahmen der präoperativen Abklärung bei Patienten mit Hüftdysplasie [46, 80]. Im Vergleich zur MR-Arthrographie erlaubt die CT-Arthrographie ebenfalls die Detektion chondrolabraler Läsionen mit einer hohen diagnostischen Genauigkeit. Vorteil der CT ist die hohe Verfügbarkeit, kürzere Untersuchungszeit und die Erstellung von patientenspezifischen 3‑D-Modelle. Diese 3‑D-Modelle können zur PAO-Planung oder zur Impingement-Simulation verwendet werden, was vor allem bei Patienten mit erhöhter femoraler Antetorsion hilfreich sein kann [36]. Erste Studien haben erfolgreich MRT-basierte 3‑D-Modelle zu diesem Zweck verwendet [82, 83].
In den folgenden Abschnitten werden die radiologischen Parameter detailliert beschrieben.
Die azetabuläre Version
Die Messung der azetabulären Version erfolgt auf axialen T1w-Bildern und kann analog zur Messung im CT erfolgen. Studien belegen die gute Korrelation zwischen CT und MRT bei Erwachsenen und pädiatrischen Patienten [17, 53]. Die azetabuläre Version wurde in einer aktuellen CT-Studie [61] von 1–3 Uhr gemessen: 8° bei 1 Uhr, 15° bei 2 Uhr und 21° bei 3 Uhr. Frühere Studien haben eine azetabuläre Version bei 3 Uhr zwischen 17 und 25° [27] und bis zu 27° für weibliche Patienten und 19° für männliche Patienten mit Hüftdysplasie beschrieben [34]. Neun mögliche Kombinationen der azetabulären Version und der femoralen Antetorsion wurden beschrieben (Tab. 2). Je nach Kombination können diese z. B. eine anteriore Instabilität verstärken, wenn eine erhöhte azetabuläre Version kombiniert mit einer femoralen Antetorsion vorliegt [34, 77].
| Erhöhte femorale Antetorsion | Normale femorale Antetorsion | Femorale Retrotorsion | |
| Erhöhte azetabuläre Version | Posteriores FAI, erhöhte Innenrotation | – | Mögliche Kompensation |
| Normale azetabuläre Version | – | Normal 10–25° | – |
| Azetabuläre Retroversion | Mögliche Kompensation | – | Anteriores FAI, tiefe Innenrotation |
FAI femoroazetabuläres Impingement
Die azetabuläre Morphologie kann in anteriore, laterale und posteriore Dysplasie eingeteilt werden mithilfe des sogenannten anterioren und posterioren Sektorwinkel (AASA [„anterior acetabular sector angle“] und PASA). Die Summe von AASA und PASA ergibt den HASA („horizontal acetabular sector angle“).
In einer früheren Studie wurde beschrieben, dass bis zu 17 % der Patienten mit Hüftdysplasie eine azetabuläre Retroversion aufweisen [37], während Tönnis sogar bei 29 % der Patienten mit Hüftdysplasie eine azetabuläre Version < 10° festgestellt hat. Nachfolgende Studien haben eine tiefere Häufigkeit angegeben [43].
Proximale femorale Deformitäten
Kombinierte femorale Deformitäten sind bei der Hüftdysplasie häufig, typisch ist eine ellipsoide Form des Femurkopfes [63]. Eine Cam-Deformität kann bei bis zu 86 % der Patienten vorliegen [80] (definiert als reduzierter Offset oder Alphawinkel > 55°). Valgusdeformitäten wurden bei 44 % beschrieben [6], während nur bis zu 4 % eine Coxa vara aufweisen. Eine Hüftdysplasie kombiniert mit erhöhter femoraler Antetorsion kann bei bis zu 52 % der Patienten vorliegen [80] (definiert als > 20°) (Abb. 3). Weiter wurde eine erhöhte femorale Antetorsion (definiert als > 35°) bei 8–23 % beschrieben [34]. Die femorale Antetorsion ist abhängig vom Geschlecht und beträgt 27° (Frauen) und 19° (Männer), gemessen bei Patienten mit Hüftschmerzen mit der Murphy-Methode [34]. Eine femorale Antetorsion unter 0° (= femorale Retrotorsion) tritt selten in Kombination mit einer Hüftdysplasie auf. Bei erhöhter femoraler Antetorsion > 35° kann ein posteriores intra- und extraartikuläres (ischiofemorales) Impingement zwischen dem Trochanter minor und dem Tuber ischiadicum vor allem bei Extension und Außenrotation der Hüfte auftreten [36]. Das knöcherne Anschlagen zwischen Ischium und Trochanter minor/major führt möglicherweise zu einer anterioren Translation des Femurkopfs und damit zu einer dynamischen Instabilität [36].
Die Cam-Deformität wird klassischerweise mittels Alphawinkel quantifiziert, wie von Nötzli initial beschrieben [47]. Die MRT mit radiären Bildern erlaubt die detaillierte Beschreibung und Ausdehnung der Cam-Deformität [55]. Weiter kann eine „offset ratio“ unter 0,17 verwendet werden zur Diagnostik der Cam-Deformität [80]. Die Cam-Deformität ist Folge der aufgehobenen Schenkelhalstaillierung. Typischerweise ist der Femurkopf-Schenkelhals-Übergang bei der Hüftdysplasie ellipsoid geformt [63]. Die Cam-Deformität ist meist anterior-superior oder anterior-lateral lokalisiert [1].
Die Beschreibung des Schweregrades und der Ausdehnung der Cam-Deformität erfolgt mittels CT/MRT unter Verwendung des Zifferblattsystems [42] (z. B. 3 Uhr entspricht anterior). Diese wurde mehrfach beschrieben und gehört bereits zur Standarddiagnostik, deswegen verzichten wir hier auf weitere Ausführungen [25].
Valgusdeformitäten werden meistens auf a.-p. Röntgenbildern diagnostiziert mittels CCD-Winkel. Meistens wurde eine Valgusdeformität als CCD-Winkel > 139° definiert [6, 77], obwohl es unterschiedliche Definitionen gibt.
Femorale Antetorsion
Konventionelle Röntgenbilder (wie die Dunn-Rippstein Aufnahme) sind nicht verlässlich zur Bestimmung der femoralen Antetorsion [29] und erfordert eine Diagnostik mittels Schnittbildern. Die femorale Antetorsion wurde zwar bereits vor Jahrzehnten untersucht, u. a. von Tönnis und Kollegen in den 1990er-Jahren [76, 77]. Jedoch wurde die femorale Antetorsion selten auf Schnittbildern (CT oder MRT) quantifiziert [29]. Aufgrund der zunehmenden Wichtigkeit wird die femorale Antetorsion detailliert behandelt. Die Diagnostik kann mittels CT oder MRT erfolgen, beide Modalitäten weisen eine gute Reproduzierbarkeit und Reliabilität auf [17, 21]. Die CT wird aufgrund der einfacheren Verfügbarkeit vielfach verwendet, jedoch konnte in mehreren Studien gezeigt werden, dass mittels Akquisition von schnellen MRT-Bildern des Beckens und des Knies (für femorale Kondylenebene) eine akkurate Bestimmung der femoralen Torsion verlässlich möglich ist. Die Messung mittels MRT ist besonders für junge Frauen im gebärfähigen Altern sinnvoll, sie hat den Vorteil, auf ionisierende Strahlung verzichten zu können [21].
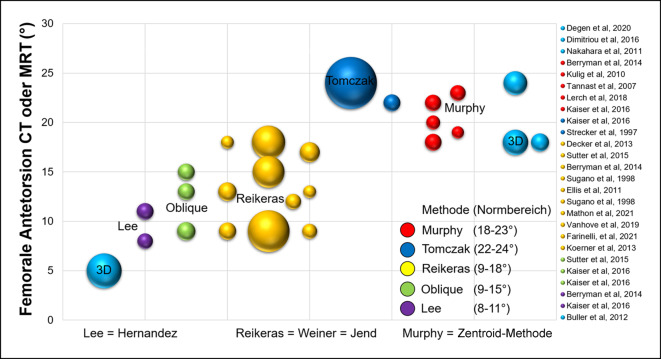
Bei der Messung der femoralen Antetorsion sollten die verschiedenen Messmethoden [57] und entsprechende Normalwerte berücksichtigt werden. Die Messmethoden gehen vom Femurkopfzentrum aus, und unterscheiden sich in der Wahl des zweiten proximalen Referenzpunkts [57]. Je weiter distal dieser Referenzpunkt gesetzt wird, desto höher fallen die gemessenen Werte aus. Diese Unterschiede können beim selben Patienten bis zu 20° betragen [57]. Diese Unterschiede sind vor allem bei Patienten mit erhöhter femoraler Antetorsion und bei Valgusdeformitäten zu beachten [59]. Die Normwerte der jeweiligen Messmethoden sollten beachtet werden (Tab. 3). Für die Murphy-Methode (Abb. 4) wurden Normalwerte von 18–23° beschrieben [2, 22], hingegen wurden für die Reikeras-Methode Normalwerte von 9–18° beschrieben [9, 26]. Aufgrund der verschiedenen Messmethoden besteht die Gefahr von falsch hohen oder falsch tiefen Messwerten, was zu Fehldiagnosen führen kann, sofern keine standardisierte Messmethode verwendet wird.
| Autor (Jahr) | Messmethode | Beschreibung |
|---|---|---|
| Lee et al. 2006 [57] | CT, axiale Schichten | Lee-Methode: Linie zur Verbindung vom Femurkopfzentrum und der Mitte des Schenkelhalses auf dem ersten axialen Schnitt, auf dem eine Verbindung zwischen Schenkelhals und Trochanter major sichtbar ist |
| Reikerås et al. 1983 [57] | CT, axiale Schichten | Reikeras-Methode: Linie zur Verbindung vom Femurkopfzentrum und der Mitte des Schenkelhalses auf einem axialen Schnitt, auf welchem der anteriore und der posteriore Kortex des Schenkelhalses parallel sind |
| Tomczak et al. 1997 [57] | MRT, axiale Schichten | Tomczak-Methode: Linie zur Verbindung vom Femurkopfzentrum und dem Zentrum des Trochanter major an der Basis des Schenkelhalses |
| Murphy et al. 1987 [57] | CT, axiale Schichten | Murphy-Methode: Linie zur Verbindung vom Femurkopfzentrum und der Mitte des Zentroids auf einem axialen Schnitt am Oberrand des Trochanter minor |
| Jarret et al. 2010 [57] | CT, axial oblique Schichten | Jarret-Methode: Linie zur Verbindung vom Femurkopfzentrum und der Mitte des Schenkelhalses auf einer schrägen Ebene in der Schenkelhalsachse |
Eine aktuelle Studie hat bei Patienten mit erhöhter femoraler Antetorsion > 35° ein posteriores extraartikuläres ischiofemorales Impingement festgestellt [36]. Dieses kann zwischen dem Tuber ischiadicum und dem Trochanter major und/oder dem Trochanter minor auftreten. Dafür wurden CT-basierte 3‑D-Modelle ausgewertet und ein ossäres Impingement simuliert. Weiter kann zur Diagnostik des ischiofemoralen Impingements mittels flüssigkeitssensitiven Sequenzen das ischiofemorale Ödem (im M. quadratus femoris) diagnostiziert werden und ein reduzierter ischiofemoraler Abstand gemessen werden [4, 78].
Aufgrund der verschiedenen Messmethoden der femoralen Antetorsion besteht die Gefahr von falschen Messwerten
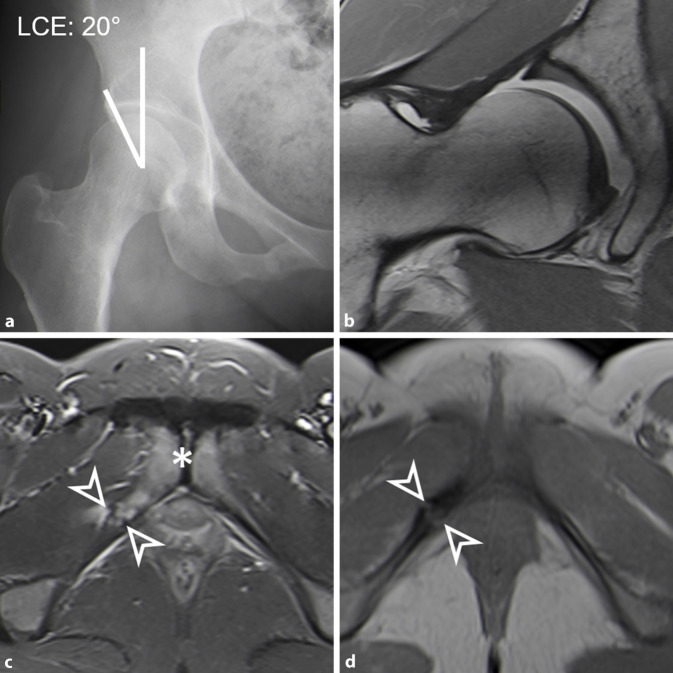
Typischerweise wurde bei Patienten mit einer Hüftdysplasie eine anteriore Labrumläsion und eine Adaption des Labrums mit Hypertrophie und mukoider Degeneration beobachtet [42]. Je nach Schweregrad der Minderüberdachung bzw. der bereits bestehenden Gelenkdegeneration kann es auch zu paralabralen Ganglien, Knochenzysten oder einer Knorpeldelamination führen (Abb. 3). Die Instabilität kann in Kombination mit der Cam-Deformität auch bei Patienten mit Hüftdysplasie zu einer Sressfraktur am Pfannenrand führen (Os acetabuli) (Abb. 5). Osteophyten treten im Vergleich zum Impingement-Patienten tendenziell später auf [19]. Eine Vielzahl von intraoperativen Klassifikationen existieren für chondrolabrale Läsionen, die meisten basierend auf intraoperativen Bildern [81]. Zudem wurden auch mehrere MRT-Klassifikationen für Labrumläsionen beschrieben [3, 7, 55], mit denen eine hohe Sensitivität von über 90 % zur Detektion von Labrumläsionen mittels MR-Arthrographie der Hüfte erzielt wurde [14].
Die typische Knorpelläsion ist eine oberflächliche oder entspricht einer „Inside-out“-Läsion bei der es zu einer teppichartigen Delamination des azetabulären Knorpels von zentral nach peripher mit Riss bis ins Labrum kommt. Im Gegensatz zum Cam-FAI, wo der Knorpel sich aufgrund der repetitiven Scherkräfte von der chondrolabralen Übergangszone aus nach zentral ablöst. Die MRT-Diagnostik von Knorpelschäden ist aufgrund der dünnen Knorpelschichten, die einander direkt anliegen, schwierig. Die MR-Arthrographie ermöglicht die Detektion von Knorpelschäden mit höherer diagnostischer Genauigkeit als das native MRT, und hat den Vorteil, dass sie bei Bedarf mit der Applikation von Traktion kombiniert werden kann, um insbesondere die Darstellung der Knorpeldelaminationen zu verbessern [54, 67].
Außerdem ermöglicht die MRT die Beurteilung von subtilen Zeichen der Hüftinstabilität. Diese Zeichen sind einerseits die Hypertrophie des M. iliocapsularis im Vergleich zum M. rectus femoris auf axialen Schichten [18] sowie die anteriore Dezentrierung oder Subluxation des Femurkopfs (Abb. 3c). Letzteres wurde in der MR-Arthrographie beschrieben und ist gemäß aktueller Literatur ein nützliches Zeichen zur Beurteilung der Instabilität bei Patienten mit grenzwertiger Hüftdysplasie [84].
Beckenkippung, „pelvic incidence“ und „Hip-spine“-Syndrom
Die Beckenkippung ist ein dynamischer Parameter, welcher die azetabuläre Überdachung beeinflussen kann. Deshalb wurde beschrieben, dass die Beckenkippung zu beachten sei bei geplanter PAO. Leider existieren verschiedene Definitionen der Beckenkippung (u. a. „pelvic tilt“), was zu Missverständnissen führen kann. Grundsätzlich kann gesagt werden, dass eine anteriore Beckenkippung die anteriore azetabuläre Überdachung erhöht. Eine signifikante Korrelation zwischen „pelvic tilt“ und azetabulärer Version (CT-Messung) wurde bei 100 Patienten mit Hüftarthrose aufgrund einer Hüftdysplasie (p < 0,001; r = 0,389) beschrieben [49]. Eine kürzlich erschienene Studie zeigte eine bessere Korrelation (p < 0,001; r = 0,58) zwischen „pelvic tilt“ und azetabulärer Version (CT-Messung) [35]. Nach bilateraler PAO wurde eine leichte Reduktion der anterioren Beckenkippung beschrieben, jedoch erfolgten die Messungen auf dem Röntgenbild [8]. Außerdem ist die Beckenkippung abhängig von der Körperposition und variiert zwischen stehender und sitzender Position.
Für die Wirbelsäulenchirurgie werden drei Parameter der sagittalen Balance verwendet: „pelvic tilt“, „sacral slope“ und „pelvic incidence“ [30, 51]. Kürzlich wurden bei Patienten mit Hüftdysplasie diese drei Parameter folgendermaßen beschrieben : „pelvic tilt“ von 10°, „pelvic incidence“ von 55° und „sacral slope“ von 44°, gemessen beim liegenden Patienten im CT [35]. „Pelvic incidence“ ist ein statischer Parameter, der sich nicht verändert zwischen stehender und sitzender Position [31]. Bei Patienten mit Hüftdysplasie und erhöhter azetabulärer Version > 25° (CT) wurde eine signifikant höhere „pelvic incidence“ von 57° gefunden im Vergleich zu Patienten mit azetabulärer Retroversion („pelvic incidence“ von 42°) [35]. Weiter wurde eine tiefere „pelvic incidence“ bei Hüft-Impingement-Patienten gefunden [51]. In einer anderen Übersichtsarbeit wurde „pelvic tilt“ als „spinopelvic tilt“ bezeichnet [23]. Für die anteriore Beckenkippung wurde der sogenannte „anterior pelvic plane tilt“ gemessen [23]. In einer kürzlich publizierten Übersichtsarbeit wurde das lumbo-pelvine-azetabuläre Alignment detailliert beschrieben [20]. Dabei wurden u. a. sowohl die verschiedenen radiologischen Parameter beschrieben als auch vier verschiedene Typen der Beckenform und deren sagittales (lumbopelvines) Alignment [20]. Eine Beckenform Typ D (erhöhte pelvic incidence) kann die azetabuläre Anteversion verstärken, was bei Patienten mit Hüftdysplasie wichtig sein könnte.
Initial wurden Rückenschmerzen, welche mit einer anterioren Beckenkippung und Hyperlordose assoziiert waren, als sogenanntes „Hip-spine“-Syndrom beschrieben [48]. Dieses „Hip-spine“-Syndrom wurde bei Kindern mit kongenitaler Hüftluxation beschrieben [39]. Kürzlich hat eine biomechanische Studie eine höhere Belastung der lumbalen Facettengelenke bei Patienten mit Hüftschmerzen und posteriorem ischiofemoralem Impingement beschrieben [16]. Möglicherweise gibt es funktionelle Kompensationsmechanismen, sodass eine verminderte anteriore azetabuläre Überdachung durch anteriore Beckenkippung und Hyperlordose kompensiert wird. Umgekehrt kann möglicherweise ein Cam-Typ Hüft-Impingement durch posteriore Beckenkippung kompensiert werden [51].
Ergebnisse und Diskussion
Mehrere Langzeitstudien haben die Ergebnisse nach PAO evaluiert. Diese Studien wurden in einer Grafik in einer früheren Übersichtsarbeit zusammengefasst [32]. Für die erste Serie von 75 Hüften, welche mittels der PAO nach Ganz therapiert wurden, sind die Resultate nach 20 und 30 Jahren beschrieben worden [33, 62]. Bei dieser Gruppe hatten nach 20 Jahren 40 % der Hüften eine Hüfttotalprothese, jedoch war die Gruppe bezüglich vorbestehender Arthrose und Voroperationen sehr heterogen [62]. Dabei war für ein schlechtes Langzeitüberleben der Hüftgelenke folgender Faktor maßgebend: eine vorbestehende Arthrose, wobei Hüften mit einem Arthrosegrad > 1 nach Tönnis zu 88 % nach 20 Jahren eine Hüfttotalprothese hatten. Zudem waren weitere klinische Faktoren (erhöhtes Alter, vorbestehende starke Schmerzen und Hinken) assoziiert mit verfrühtem endoprothetischem Ersatz. Weitere radiologische Faktoren, welche mit einem schlechteren Langzeitergebnis assoziiert waren, sind in Tab. 4 zusammengefasst.
| Prädiktoren für eine Hüfttotalprothese | Risikoquantifizierung |
|---|---|
| Postoperativer Extrusionsindex | 11 % Risikozunahme pro Prozent weniger |
| „Lateral center edge“-Winkel unter 0° präoperativ | 4,7fach erhöhtes Risiko nach 9 Jahren |
| Exzessive laterale und proximale Dislokation des Femurkopfes präoperativ | 4fach erhöhtes Risiko nach 9 Jahren |
| Postoperative Breite der Sklerosezone < 2,5 cm | 6fach erhöhtes Risiko nach 9 Jahren |
| Vorhandenes Os acetabuli | 3,6fach erhöhtes Risiko nach 9 Jahren |
| Azetabuläre Anteversion unter 10° | 4,3fach erhöhtes Risiko nach 9 Jahren |
Eine kürzlich erschiene systematische Analyse von Studien zeigte, dass das präoperative Alter und der präoperative Arthrosegrad die stärksten Einflussfaktoren für das Langzeitergebnis (10 und 20 Jahre) darstellen [70]. Diese Studien zeigten, dass die präoperative Bildgebung bei Patienten mit Hüftdysplasie vor allem zur Evaluation von Knorpelschäden prognostisch wichtig ist.
Für 1,5 T wurde mittels dGEMRIC ein Prädiktor für den Verlauf nach PAO beschrieben [24]. Nach einer mittleren Untersuchungszeit von 32 Monaten war ein tieferer anteriorer präoperativer dGEMRIC-Werte als Hinweis auf eine fortgeschrittene biochemische Knorpeldegeneration mit einem schlechteren Outcome assoziiert [24]. Neue Entwicklungen im Bereich der Sequenztechnik und in der Bildverarbeitung mittels neuronaler Netzwerke („machine learning“ oder „deep learning“) ermöglichen die Erstellung von 3‑D-Knorpelmodellen für eine frühe, objektive Quantifizierung von Knorpelschäden ([52, 58]; Abb. 6).
Fazit für die Praxis
Grundlage der präoperativen Bildgebung vor hüftgelenkerhaltenden Eingriffen sind die Beckenübersichtsaufnahme zur Beurteilung der azetabulären Überdachung und Version sowie die initiale Beurteilung des Arthrosegrades.
Die MRT sollte beckenzentrierte, flüssigkeitssensitive Sequenzen zur Detektion von Begleitpathologien, axiale Sequenzen zur Bestimmung der Femurtorsion sowie hüftzentrierte, multiplanare Sequenzen zur Detektion chondrolabraler Schäden beinhalten.
Die direkte MR-Arthrographie der Hüfte oder alternativ die native 3 T MRT sind die Methoden der Wahl zur Detektion von chondrolabralen Schäden.
Die azetabuläre Morphologie kann in anteriore, laterale und posteriore Dysplasie eingeteilt werden. Kombinierte Deformitäten sind bei der Hüftdysplasie häufig.
Radiologische prädiktive Faktoren für ein schlechteres Outcome wurden beschrieben.
Bei der präoperativen Bildgebung sind sowohl die azetabuläre Morphologie als auch die femoralen Deformitäten, u. a. die femorale Antetorsion und cam Deformitäten zu berücksichtigen.
Abkürzungen
- AASA
„Anterior acetabular sector angle“
- AI
Azetabulärer Index
- CCD-Winkel
Centrum-Collum-Diaphysen-Winkel
- dGEMRIC
„Delayed gadolinium enhanced MRI of cartilage“
- FAI
Femoroazetabuläres Impingement
- FEAR
„Femoro-epiphyseal acetabular roof“
- FSE
„Fast spin echo“
- HASA
„Horizontal acetabular sector angle“
- LCE
„Lateral center edge“
- MPR
„Multi planar reconstruction“
- PAO
Periazetabuläre Osteotomie
- PASA
„Posterior acetabular sector angle“
- STIR
„Short tau inversion recovery“
- TIRM
„Turbo-inversion recovery magnitude“
- TRUFI
„True fast imaging with steady precession“
- TSE
Turbo Spin Echo
- VIBE
„Volumetric interpolated breath-hold examination“
Funding
Open access funding provided by University of Bern
Einhaltung ethischer Richtlinien
Interessenkonflikt
T.D. Lerch und F. Schmaranzer geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autor/-innen keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Agricola R, Waarsing JH, Arden NK, et al. Cam impingement of the hip: a risk factor for hip osteoarthritis. Nat Rev Rheumatol. 2013;9:630–634. doi: 10.1038/nrrheum.2013.114. [DOI] [PubMed] [Google Scholar]
- 2.Berryman F, Pynsent P, McBryde C. A semi-automated method for measuring femoral shape to derive version and its comparison with existing methods. Int J Numer Method Biomed Eng. 2014;30:1314–1325. doi: 10.1002/cnm.2659. [DOI] [PubMed] [Google Scholar]
- 3.Blankenbaker DG, De Smet AA, Keene JS, Fine JP. Classification and localization of acetabular labral tears. Skelet Radiol. 2007;36:391–397. doi: 10.1007/s00256-006-0240-z. [DOI] [PubMed] [Google Scholar]
- 4.Bredella MA, Azevedo DC, Oliveira AL, et al. Pelvic morphology in ischiofemoral impingement. Skelet Radiol. 2015;44:249–253. doi: 10.1007/s00256-014-2041-0. [DOI] [PubMed] [Google Scholar]
- 5.Buller LT, Rosneck J, Monaco FM, et al. Relationship between proximal femoral and acetabular alignment in normal hip joints using 3-dimensional computed tomography. Am J Sports Med. 2012;40:367–375. doi: 10.1177/0363546511424390. [DOI] [PubMed] [Google Scholar]
- 6.Clohisy JC, Nunley RM, Carlisle JC, Schoenecker PL. Incidence and characteristics of femoral deformities in the dysplastic hip. Clin Orthop Relat Res. 2009;467:128–134. doi: 10.1007/s11999-008-0481-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Czerny C, Hofmann S, Neuhold A, et al. Lesions of the acetabular labrum: accuracy of MR imaging and MR arthrography in detection and staging. Radiology. 1996;200:225–230. doi: 10.1148/radiology.200.1.8657916. [DOI] [PubMed] [Google Scholar]
- 8.Daley E, Nahm N, Koueiter D, Zaltz I. Does compensatory anterior pelvic tilt decrease after bilateral periacetabular osteotomy? Clin Orthop Relat Res. 2019;477:1168–1175. doi: 10.1097/CORR.0000000000000560. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Decker S, Suero EM, Hawi N, et al. The physiological range of femoral antetorsion. Skelet Radiol. 2013;42:1501–1505. doi: 10.1007/s00256-013-1687-3. [DOI] [PubMed] [Google Scholar]
- 10.Degen N, Sass J, Jalali J, et al. Three-dimensional assessment of lower limb alignment: Reference values and sex-related differences. Knee. 2020;27:428–435. doi: 10.1016/j.knee.2019.11.009. [DOI] [PubMed] [Google Scholar]
- 11.Dimitriou D, Tsai T-Y, Yue B, et al. Side-to-side variation in normal femoral morphology: 3D CT analysis of 122 femurs. Orthop Traumatol Surg Res. 2016;102:91–97. doi: 10.1016/j.otsr.2015.11.004. [DOI] [PubMed] [Google Scholar]
- 12.Ellis AR, Noble PC, Schroder SJ, et al. The cam impinging femur has multiple morphologic abnormalities. J Arthroplasty. 2011;26:59–65. doi: 10.1016/j.arth.2011.04.028. [DOI] [PubMed] [Google Scholar]
- 13.Farinelli L, Baldini M, Bucci A, et al. Axial and rotational alignment of lower limb in a Caucasian aged non-arthritic cohort. Eur J Orthop Surg Traumatol. 2021;31:221–228. doi: 10.1007/s00590-020-02763-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Freedman BA, Potter BK, Dinauer PA, et al. Prognostic value of magnetic resonance arthrography for Czerny stage II and III acetabular labral tears. Arthroscopy. 2006;22:742–747. doi: 10.1016/j.arthro.2006.03.014. [DOI] [PubMed] [Google Scholar]
- 15.Giaconi J, Waldman L, Robinson J, et al. Prevalence of sacroiliitis among patients referred for hip MR arthrography. Skelet Radiol. 2022;51:795–799. doi: 10.1007/s00256-021-03885-7. [DOI] [PubMed] [Google Scholar]
- 16.Gómez-Hoyos J, Khoury A, Schröder R, et al. The hip-spine effect: a biomechanical study of ischiofemoral impingement effect on lumbar facet joints. Arthroscopy. 2017;33:101–107. doi: 10.1016/j.arthro.2016.06.029. [DOI] [PubMed] [Google Scholar]
- 17.Goronzy J, Blum S, Hartmann A, et al. Is MRI an adequate replacement for CT scans in the three-dimensional assessment of acetabular morphology? Acta Radiol. 2019;60:726–734. doi: 10.1177/0284185118795331. [DOI] [PubMed] [Google Scholar]
- 18.Haefeli PC, Steppacher SD, Babst D, et al. An increased iliocapsularis-to-rectus-femoris ratio is suggestive for instability in borderline hips. Clin Orthop Relat Res. 2015;473:3725–3734. doi: 10.1007/s11999-015-4382-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Hanke MS, Steppacher SD, Anwander H, et al. What MRI findings predict failure 10 years after surgery for femoroacetabular impingement? Clin Orthop Relat Res. 2017;475:1192–1207. doi: 10.1007/s11999-016-5040-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Heimkes, et al. Heimkes et al. Lumbo-pelvino-acetabular alignment-basics and clinical consequences. Orthopädie. 2022;51:962–968. doi: 10.1007/s00132-022-04321-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Hesham K, Carry PM, Freese K, et al. Measurement of femoral version by MRI is as reliable and reproducible as CT in children and adolescents with hip disorders. J Pediatr Orthop. 2017;37:557–562. doi: 10.1097/BPO.0000000000000712. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Kaiser P, Attal R, Kammerer M, et al. Significant differences in femoral torsion values depending on the CT measurement technique. Arch Orthop Trauma Surg. 2016;136:1259–1264. doi: 10.1007/s00402-016-2536-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Khoury AN, Hatem M, Bowler J, Martin HD. Hip-spine syndrome: rationale for ischiofemoral impingement, femoroacetabular impingement and abnormal femoral torsion leading to low back pain. J Hip Preserv Surg. 2020;7:390–400. doi: 10.1093/jhps/hnaa054. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Kim SD, Jessel R, Zurakowski D, et al. Anterior delayed gadolinium-enhanced MRI of cartilage values predict joint failure after periacetabular osteotomy. Clin Orthop Relat Res. 2012;470:3332–3341. doi: 10.1007/s11999-012-2519-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Klenke FM, Hoffmann DB, Cross BJ, Siebenrock KA. Validation of a standardized mapping system of the hip joint for radial MRA sequencing. Skelet Radiol. 2015;44:339–343. doi: 10.1007/s00256-014-2026-z. [DOI] [PubMed] [Google Scholar]
- 26.Koerner JD, Patel NM, Yoon RS, et al. Femoral version of the general population: does „normal“ vary by gender or ethnicity? J Orthop Trauma. 2013;27:308–311. doi: 10.1097/BOT.0b013e3182693fdd. [DOI] [PubMed] [Google Scholar]
- 27.Kohno Y, Nakashima Y, Akiyama M, et al. Does native combined anteversion influence pain onset in patients with dysplastic hips? Clin Orthop Relat Res. 2015;473:3716–3722. doi: 10.1007/s11999-015-4373-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Kulig K, Harper-Hanigan K, Souza RB, Powers CM. Measurement of femoral torsion by ultrasound and magnetic resonance imaging: concurrent validity. Phys Ther. 2010;90:1641–1648. doi: 10.2522/ptj.20090391. [DOI] [PubMed] [Google Scholar]
- 29.Kuo TY, Skedros JG, Bloebaum RD. Measurement of femoral anteversion by biplane radiography and computed tomography imaging: comparison with an anatomic reference. Invest Radiol. 2003;38:221–229. doi: 10.1097/01.RLI.0000059542.90854.EF. [DOI] [PubMed] [Google Scholar]
- 30.Lazennec J-Y, Brusson A, Rousseau M-A. Hip-spine relations and sagittal balance clinical consequences. Eur Spine J. 2011;20(5):686–698. doi: 10.1007/s00586-011-1937-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Legaye J, Duval-Beaupère G, Hecquet J, Marty C. Pelvic incidence: a fundamental pelvic parameter for three-dimensional regulation of spinal sagittal curves. Eur Spine J. 1998;7:99–103. doi: 10.1007/s005860050038. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Lerch TD, Steppacher SD, Liechti EF, et al. Bernese periacetabular osteotomy. : indications, technique and results 30 years after the first description. Orthopade. 2016;45:687–694. doi: 10.1007/s00132-016-3265-6. [DOI] [PubMed] [Google Scholar]
- 33.Lerch TD, Steppacher SD, Liechti EF, et al. One-third of hips after periacetabular osteotomy survive 30 years with good clinical results, no progression of arthritis, or conversion to THA. Clin Orthop Relat Res. 2017;475:1154–1168. doi: 10.1007/s11999-016-5169-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Lerch TD, Todorski IAS, Steppacher SD, et al. Prevalence of femoral and acetabular version abnormalities in patients with symptomatic hip disease: a controlled study of 538 hips. Am J Sports Med. 2018;46:122–134. doi: 10.1177/0363546517726983. [DOI] [PubMed] [Google Scholar]
- 35.Lerch TD, Boschung A, Schmaranzer F, et al. Lower pelvic tilt, lower pelvic incidence, and increased external rotation of the iliac wing in patients with femoroacetabular impingement due to acetabular retroversion compared to hip dysplasia. Bone Joint Open. 2021;2:813–824. doi: 10.1302/2633-1462.210.BJO-2021-0069.R1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Lerch TD, Zwingelstein S, Schmaranzer F, et al. Posterior extra-articular ischiofemoral impingement can be caused by the lesser and greater Trochanter in patients with increased femoral version: dynamic 3D CT-based hip impingement simulation of a modified FABER test. Orthop J Sports Med. 2021;9:2325967121990629. doi: 10.1177/2325967121990629. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Li PLS, Ganz R. Morphologic features of congenital acetabular dysplasia: one in six is retroverted. Clin Orthop Relat Res. 2003 doi: 10.1097/01.blo.0000081934.75404.36. [DOI] [PubMed] [Google Scholar]
- 38.Mathon P, Micicoi G, Seil R, et al. Healthy middle-aged Asian and Caucasian populations present with large intra- and inter-individual variations of lower limb torsion. Knee Surg Sports Traumatol Arthrosc. 2021;29:1083–1089. doi: 10.1007/s00167-020-06096-0. [DOI] [PubMed] [Google Scholar]
- 39.Matsuyama Y, Hasegawa Y, Yoshihara H, et al. Hip-spine syndrome: total sagittal alignment of the spine and clinical symptoms in patients with bilateral congenital hip dislocation. Spine (Phila Pa 1976) 2004;29:2432–2437. doi: 10.1097/01.brs.0000143671.67779.14. [DOI] [PubMed] [Google Scholar]
- 40.Mayer SW, Skelton A, Flug J, et al. Comparison of 2D, 3D, and radially reformatted MR images in the detection of labral tears and acetabular cartilage injury in young patients. Skelet Radiol. 2021;50:381–388. doi: 10.1007/s00256-020-03566-x. [DOI] [PubMed] [Google Scholar]
- 41.McClincy MP, Wylie JD, Yen Y-M, Novais EN. Mild or borderline hip dysplasia: are we characterizing hips with a lateral center-edge angle between 18° and 25° appropriately? Am J Sports Med. 2019;47:112–122. doi: 10.1177/0363546518810731. [DOI] [PubMed] [Google Scholar]
- 42.Meier MK, Lerch TD, Hanke MS, et al. Imaging in joint-preserving hip surgery. Radiologe. 2022;62:271–284. doi: 10.1007/s00117-022-00973-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Meier MK, Schmaranzer F, Kaim T, et al. Combined femoral and acetabular version is sex-related and differs between patients with hip dysplasia and acetabular retroversion. Eur J Radiol. 2023;158:110634. doi: 10.1016/j.ejrad.2022.110634. [DOI] [PubMed] [Google Scholar]
- 44.Murphy SB, Ganz R, Müller ME. The prognosis in untreated dysplasia of the hip. A study of radiographic factors that predict the outcome. J Bone Joint Surg Am. 1995;77:985–989. doi: 10.2106/00004623-199507000-00002. [DOI] [PubMed] [Google Scholar]
- 45.Nakahara I, Takao M, Sakai T, et al. Gender differences in 3D morphology and bony impingement of human hips. J Orthop Res. 2011;29:333–339. doi: 10.1002/jor.21265. [DOI] [PubMed] [Google Scholar]
- 46.Nepple JJ, Wells J, Ross JR, et al. Three patterns of acetabular deficiency are common in young adult patients with acetabular dysplasia. Clin Orthop Relat Res. 2017;475:1037–1044. doi: 10.1007/s11999-016-5150-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Nötzli HP, Wyss TF, Stoecklin CH, et al. The contour of the femoral head-neck junction as a predictor for the risk of anterior impingement. J Bone Joint Surg Br. 2002;84:556–560. doi: 10.1302/0301-620X.84B4.0840556. [DOI] [PubMed] [Google Scholar]
- 48.Offierski CM, MacNab I. Hip-spine syndrome. Spine. 1983;8:316–321. doi: 10.1097/00007632-198304000-00014. [DOI] [PubMed] [Google Scholar]
- 49.Okuzu Y, Goto K, Okutani Y, et al. Hip-spine syndrome: acetabular anteversion angle is associated with anterior pelvic tilt and lumbar hyperlordosis in patients with acetabular dysplasia: a retrospective study. JB JS Open Access. 2019;4:e0025. doi: 10.2106/JBJS.OA.18.00025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Rakhra KS, Sheikh AM, Allen D, Beaulé PE. Comparison of MRI alpha angle measurement planes in femoroacetabular impingement. Clin Orthop Relat Res. 2009;467:660–665. doi: 10.1007/s11999-008-0627-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Rivière C, Hardijzer A, Lazennec J-Y, et al. Spine-hip relations add understandings to the pathophysiology of femoro-acetabular impingement: a systematic review. Orthop Traumatol Surg Res. 2017;103:549–557. doi: 10.1016/j.otsr.2017.03.010. [DOI] [PubMed] [Google Scholar]
- 52.Ruckli AC, Schmaranzer F, Meier MK, et al. Automated quantification of cartilage quality for hip treatment decision support. Int J Comput Assist Radiol Surg. 2022;17:2011–2021. doi: 10.1007/s11548-022-02714-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Samim M, Eftekhary N, Vigdorchik JM, et al. 3D-MRI versus 3D-CT in the evaluation of osseous anatomy in femoroacetabular impingement using Dixon 3D FLASH sequence. Skelet Radiol. 2019;48:429–436. doi: 10.1007/s00256-018-3049-7. [DOI] [PubMed] [Google Scholar]
- 54.Schmaranzer F, Klauser A, Kogler M, et al. Diagnostic performance of direct traction MR arthrography of the hip: detection of chondral and labral lesions with arthroscopic comparison. Eur Radiol. 2015;25:1721–1730. doi: 10.1007/s00330-014-3534-x. [DOI] [PubMed] [Google Scholar]
- 55.Schmaranzer F, Todorski IAS, Lerch TD, et al. Intra-articular lesions: imaging and surgical correlation. Semin Musculoskelet Radiol. 2017;21:487–506. doi: 10.1055/s-0037-1606133. [DOI] [PubMed] [Google Scholar]
- 56.Schmaranzer F, Lerch TD, Strasser U, et al. Usefulness of MR arthrography of the hip with and without leg traction in detection of intra-articular bodies. Acad Radiol. 2018 doi: 10.1016/j.acra.2018.10.008. [DOI] [PubMed] [Google Scholar]
- 57.Schmaranzer F, Lerch TD, Siebenrock KA, et al. Differences in femoral torsion among various measurement methods increase in hips with excessive femoral torsion. Clin Orthop Relat Res. 2019 doi: 10.1097/CORR.0000000000000610. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Schmaranzer F, Afacan O, Lerch TD, et al. Magnetization-prepared 2 rapid gradient-echo MRI for B1 insensitive 3D T1 mapping of hip cartilage: an experimental and clinical validation. Radiology. 2021;299:150–158. doi: 10.1148/radiol.2021200085. [DOI] [PubMed] [Google Scholar]
- 59.Schmaranzer F, Meier MK, Lerch TD, et al. Coxa valga and antetorta increases differences among different femoral version measurements : potential implications for derotational femoral osteotomy planning. Bone Joint Open. 2022;3:759–766. doi: 10.1302/2633-1462.310.BJO-2022-0102.R1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Smith KM, Gerrie BJ, McCulloch PC, et al. Comparison of MRI, CT, Dunn 45° and Dunn 90° alpha angle measurements in femoroacetabular impingement. Hip Int. 2018;28:450–455. doi: 10.5301/hipint.5000602. [DOI] [PubMed] [Google Scholar]
- 61.Spiker AM, Fields KG, Nguyen JT, et al. Characterization of version in the dysplastic hip and the need for subsequent femoral derotational osteotomy after periacetabular osteotomy. J Hip Preserv Surg. 2020;7:575–582. doi: 10.1093/jhps/hnaa045. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Steppacher SD, Tannast M, Ganz R, Siebenrock KA. Mean 20-year followup of Bernese periacetabular osteotomy. Clin Orthop Relat Res. 2008;466:1633–1644. doi: 10.1007/s11999-008-0242-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Steppacher SD, Tannast M, Werlen S, Siebenrock KA. Femoral morphology differs between deficient and excessive acetabular coverage. Clin Orthop Relat Res. 2008;466:782–790. doi: 10.1007/s11999-008-0141-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Steppacher SD, Lerch TD, Gharanizadeh K, et al. Size and shape of the lunate surface in different types of pincer impingement: theoretical implications for surgical therapy. Osteoarthritis Cartilage. 2014;22:951–958. doi: 10.1016/j.joca.2014.05.010. [DOI] [PubMed] [Google Scholar]
- 65.Strecker W, Keppler P, Gebhard F, Kinzl L. Length and torsion of the lower limb. J Bone Joint Surg Br. 1997;79:1019–1023. doi: 10.1302/0301-620X.79B6.0791019. [DOI] [PubMed] [Google Scholar]
- 66.Sugano N, Noble PC, Kamaric E. A comparison of alternative methods of measuring femoral anteversion. J Comput Assist Tomogr. 1998;22:610–614. doi: 10.1097/00004728-199807000-00019. [DOI] [PubMed] [Google Scholar]
- 67.Sutter R, Zubler V, Hoffmann A, et al. Hip MRI: how useful is intraarticular contrast material for evaluating surgically proven lesions of the labrum and articular cartilage? AJR Am J Roentgenol. 2014;202:160–169. doi: 10.2214/AJR.12.10266. [DOI] [PubMed] [Google Scholar]
- 68.Sutter R, Dietrich TJ, Zingg PO, Pfirrmann CWA. Assessment of femoral antetorsion with MRI: comparison of oblique measurements to standard transverse measurements. AJR Am J Roentgenol. 2015;205:130–135. doi: 10.2214/AJR.14.13617. [DOI] [PubMed] [Google Scholar]
- 69.Sutter R, Pfirrmann CWA. Update on femoroacetabular impingement: what is new, and how should we assess it? Semin Musculoskelet Radiol. 2017;21:518–528. doi: 10.1055/s-0037-1606141. [DOI] [PubMed] [Google Scholar]
- 70.Tan JHI, Tan SHS, Rajoo MS, et al. Hip survivorship following the Bernese periacetabular osteotomy for the treatment of acetabular dysplasia: a systematic review and meta-analysis. Orthop Traumatol Surg Res. 2022;108:103283. doi: 10.1016/j.otsr.2022.103283. [DOI] [PubMed] [Google Scholar]
- 71.Tannast M, Kubiak-Langer M, Langlotz F, et al. Noninvasive three-dimensional assessment of femoroacetabular impingement. J Orthop Res. 2007;25:122–131. doi: 10.1002/jor.20309. [DOI] [PubMed] [Google Scholar]
- 72.Tannast M, Siebenrock KA, Anderson SE. Femoroacetabular impingement: radiographic diagnosis—what the radiologist should know. AJR Am J Roentgenol. 2007;188:1540–1552. doi: 10.2214/AJR.06.0921. [DOI] [PubMed] [Google Scholar]
- 73.Tannast M, Fritsch S, Zheng G, et al. Which radiographic hip parameters do not have to be corrected for pelvic rotation and tilt? Clin Orthop Relat Res. 2015;473:1255–1266. doi: 10.1007/s11999-014-3936-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 74.Tannast M, Pfannebecker P, Schwab JM, et al. Pelvic morphology differs in rotation and obliquity between developmental dysplasia of the hip and retroversion. Clin Orthop Relat Res. 2012;470:3297–3305. doi: 10.1007/s11999-012-2473-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 75.Tönnis D. General radiography of the hip joint. In: Tönnis D, editor. Congenital dysplasia, dislocation of the hip. New York, NY: Springer; 1987. [Google Scholar]
- 76.Tönnis D, Heinecke A. Diminished femoral antetorsion syndrome: a cause of pain and osteoarthritis. J Pediatr Orthop. 1991;11:419–431. doi: 10.1097/01241398-199107000-00001. [DOI] [PubMed] [Google Scholar]
- 77.Tönnis D, Heinecke A. Acetabular and femoral anteversion: relationship with osteoarthritis of the hip. J Bone Joint Surg Am. 1999;81:1747–1770. doi: 10.2106/00004623-199912000-00014. [DOI] [PubMed] [Google Scholar]
- 78.Torriani M, Souto SCL, Thomas BJ, et al. Ischiofemoral impingement syndrome: an entity with hip pain and abnormalities of the quadratus femoris muscle. AJR Am J Roentgenol. 2009;193:186–190. doi: 10.2214/AJR.08.2090. [DOI] [PubMed] [Google Scholar]
- 79.Vanhove F, Noppe N, Fragomen AT, et al. Standardization of torsional CT measurements of the lower limbs with threshold values for corrective osteotomy. Arch Orthop Trauma Surg. 2019;139:795–805. doi: 10.1007/s00402-019-03139-1. [DOI] [PubMed] [Google Scholar]
- 80.Wells J, Nepple JJ, Crook K, et al. Femoral morphology in the dysplastic hip: three-dimensional characterizations with CT. Clin Orthop Relat Res. 2017;475:1045–1054. doi: 10.1007/s11999-016-5119-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Yamamoto T, Zurmühle CA, Stetzelberger VM, et al. The new Bern chondrolabral classification is reliable and reproducible. Clin Orthop Relat Res. 2021;479:1002–1013. doi: 10.1097/CORR.0000000000001706. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 82.Zeng G, Degonda C, Boschung A, et al. Three-dimensional magnetic resonance imaging bone models of the hip joint using deep learning: dynamic simulation of hip impingement for diagnosis of intra- and extra-articular hip impingement. Orthop J Sports Med. 2021;9:23259671211046916. doi: 10.1177/23259671211046916. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 83.Zeng G, Schmaranzer F, Degonda C, et al. MRI-based 3D models of the hip joint enables radiation-free computer-assisted planning of periacetabular osteotomy for treatment of hip dysplasia using deep learning for automatic segmentation. Eur J Radiol. 2021;8:100303. doi: 10.1016/j.ejro.2020.100303. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 84.Zurmühle CA, Kuner V, McInnes J, et al. The crescent sign—a predictor of hip instability in magnetic resonance arthrography. J Hip Preserv Surg. 2021;8:164–171. doi: 10.1093/jhps/hnab067. [DOI] [PMC free article] [PubMed] [Google Scholar]