









Il processo di “valutazione” è riconosciuto dal mondo scientifico come strumento indispensabile per il miglioramento della qualità dell’assistenza sanitaria. Nel mondo delle valutazioni, l’Health Technology Assessment (HTA) riveste un ruolo centrale, concentrandosi sulla tecnologia sanitaria e analizzandone gli effetti diretti e indiretti, a breve e lungo termine. L’HTA viene, infatti, definito come un processo multidisciplinare che sintetizza le informazioni sugli aspetti sanitari, economici, organizzativi, etici, sociali e giuridici legati all’uso di una tecnologia sanitaria in modo sistematico, trasparente e robusto [1]. L’obiettivo è supportare la formulazione di politiche sanitarie sicure ed efficaci, incentrate sui pazienti e volte ad acquisire il massimo valore [1, 2]. Le caratteristiche salienti dell’HTA sono rappresentate dalla sua multidisciplinarietà e interdisciplinarietà, indispensabili per analizzare da più prospettive l’impatto della tecnologia sanitaria, e dalle sue finalità di veicolo delle informazioni scientifiche al mondo decisionale [2]. Altro aspetto fondamentale del processo di HTA è la sistematicità: alimentano una valutazione HTA, infatti, le evidenze scientifiche adeguatamente raccolte, analizzate e sintetizzate [1]. Tali evidenze riguardano diversi aspetti della tecnologia, descritti dallo European Network per l’Health Technology Assessment (EUnetHTA) in un core model di nove domini, tool prodotto con l’obiettivo di standardizzare processi e contenuti dell’HTA [3]. Tali domini comprendono: il problema di salute e l’uso corrente della tecnologia, le caratteristiche della tecnologia, la sicurezza, l’efficacia, i costi e la valutazione economica, gli aspetti organizzativi, etici, sociali e, infine, quelli legali [3].
Il processo di HTA prevede le seguenti fasi: definizione della policy question; elaborazione del protocollo di HTA; definizione delle domande di ricerca sulle diverse dimensioni/domini da valutare, ricerca delle evidenze scientifiche; analisi e sistematizzazione delle evidenze scientifiche disponibili; revisione/appraisal esterna; stesura del report di HTA; pubblicazione e dissemination del report di HTA; uso del report di HTA; aggiornamento del report di HTA [4] ed eventuale reassessment della tecnologia oggetto di valutazione [5].
L’HTA ha, quindi, un ruolo chiave nel fornire le informazioni evidence based necessarie affinché i decision maker prendano le giuste decisioni al fine di promuovere un sistema sanitario equo, efficiente e di alta qualità [6]. Inoltre, l’HTA si configura come strumento di governance, in quanto consente di guidare in maniera razionale i sistemi sanitari. Il governo dell’innovazione in sanità, infatti, deve basarsi sulla conoscenza delle potenzialità, i vantaggi e gli svantaggi dell’utilizzo delle diverse tecnologie, al fine di poter valutare il beneficio effettivo derivante dal loro impiego [7]. L’HTA ha, quindi, un ruolo chiave nella promozione di un approccio basato sulle evidenze per l’ottimizzazione delle tecnologie, al fine di migliorare la sicurezza, la qualità e l’uso appropriato delle risorse in sanità. In un contesto come quello attuale, infatti, al fine di coniugare sostenibilità e accesso all’innovazione secondo la prospettiva della Value Based Health Care (VBHC), appare indispensabile introdurre, diffondere ed implementare strumenti evidence-based, orientati alla razionalizzazione delle risorse disponibili, secondo logiche di equità sociale ed efficienza allocativa [8]. Per affrontare le sfide attuali del nostro Servizio Sanitario Nazionale (SSN) occorre, quindi, riorganizzare il sistema tenendo in considerazione le esigenze di tutti gli stakeholders e ponendo al centro il “valore”.
Nel 2019 l’Expert Panel on Effective Ways of Investing in Health (EXPH), istituito dalla Commissione Europea, ha approvato un importante documento dal titolo Opinion on Defining value in Value-Based Healthcare [9]. L’EXPH propone l’assistenza sanitaria basata sul valore come un concetto completo fondato su quattro value-pillars: un’assistenza adeguata per raggiungere gli obiettivi personali dei pazienti (valore personale), il conseguimento di migliori risultati possibili con le risorse disponibili (valore tecnico), un’equa distribuzione delle risorse tra tutti i gruppi di pazienti (valore allocativo) e il contributo dell’assistenza sanitaria alla partecipazione e alla connessione sociale (valore sociale).
In un contesto come quello attuale, quindi, secondo la prospettiva della VBHC, appare indispensabile introdurre, diffondere ed implementare strumenti evidence-based come l’HTA [9]. I campi in cui l’HTA può essere applicato sono molteplici: dal mondo del farmaco e dei vaccini a quello dei dispositivi medici, dalle grandi apparecchiature alle procedure mediche e chirurgiche e ai sistemi di supporto all’attività assistenziale [1, 2]. Anche la Sanità Pubblica deve avvalersi di tale strumento per supportare scelte di valore per l’intera popolazione, e tra i suoi principali campi di interesse ritroviamo la prevenzione primaria delle malattie infettive (vaccinazioni). Anche il Piano Nazionale di Prevenzione Vaccinale (PNPV) 2017-2019 [10], recependo le raccomandazioni dell’Organizzazione Mondiale della Sanità (OMS) del 2005 [11], ha richiamato l’HTA come elemento indispensabile per la valutazione delle vaccinazioni da offrire alla popolazione.
Oggi la principale sfida del SSN è rispondere efficacemente al crescente bisogno di salute della popolazione attraverso l’allocazione efficiente di risorse sanitarie e la creazione di valore sia per il singolo sia per la comunità. Questa sfida si manifesta in molteplici scenari, ivi compreso quello delle Malattie infettive Prevenibili da Vaccino (MPV), che hanno avuto e hanno un ruolo centrale nell’ambito delle attività di Sanità Pubblica.
Tra queste, merita particolare attenzione l’influenza, alla luce del suo rilevante burden clinico, epidemiologico ed economico. Gli ultimi anni sono stati caratterizzati da importanti progressi e nuove opportunità nell’ambito della vaccinazione antinfluenzale grazie all’introduzione di nuovi vaccini. Una delle principali innovazioni nell’ambito della vaccinazione antinfluenzale è rappresentata dall’introduzione di vaccini prodotti su colture cellulari. Fino a qualche anno addietro le preparazioni vaccinali antinfluenzali erano ottenute esclusivamente da virus coltivati in uova embrionate di pollo che presentavano, però, alcune limitazioni tecnico-economiche associate a tali substrati. Pertanto, negli ultimi anni, sono state esplorate le piattaforme di coltura cellulare che, in combinazione con altre tecnologie (virus vivi attenuati e proteine ricombinanti, utilizzo di adiuvanti, sistemi di somministrazione), possono essere utilizzate sia per la produzione di vaccini stagionali, sia per mitigare la carenza di vaccino in caso di situazioni di pandemia [12]. Questa moderna tecnologia presenta notevoli vantaggi rispetto al metodo convenzionale di produzione di vaccini antinfluenzali che impiegano uova di pollo embrionate e consente ai produttori di rispondere rapidamente all’aumento della domanda mondiale di vaccini influenzali stagionali e pandemici [13].
Secondo quanto affermato dal Centers for Disease Control and Prevention) [14], la tecnologia delle colture cellulari è potenzialmente più flessibile rispetto alla tecnologia tradizionale, che si basa su un’adeguata fornitura di uova. Inoltre, il vaccino antinfluenzale a base di cellule che utilizza i virus vaccinali candidati (Candidate Vaccine Viruses - CVVs) propagati nella coltura cellulare può potenzialmente offrire una protezione migliore rispetto ai tradizionali vaccini antinfluenzali a base di uova, in quanto più simili ai virus dell’influenza in circolazione.
Nel 2016 è stato approvato negli Stati Uniti il Vaccino Influenzale Quadrivalente prodotto su coltura cellulare (cell culture-derived Quadrivalent Influenza Vaccine, QIVc; Flucelvax Tetra®) che protegge da quattro ceppi di virus dell’influenza: A(H3N2), A(H1N1) e due lineages del virus di tipo B [15]. Il QIVc, a ottobre 2018, ha ottenuto il parere positivo per l’uso a partire dai nove anni d’età, da parte del Comitato che valuta i farmaci per l’uso umano (CHMP) dell’Agenzia Europea del Farmaco (European Medicines Agency, EMA) [16] ed è stato “lanciato” in Europa a partire dalla stagione influenzale 2019/20. Il 3 marzo 2021 la Food and Drug Administration (FDA) ha approvato l’estensione dell’utilizzo del vaccino a partire dai due anni di età [17], così come anche l’EMA [18] e l’Agenzia Italiana del Farmaco (AIFA) [19]. Nel mese di ottobre 2021 la FDA ha approvato l’estensione dell’utilizzo di Flucelvax Tetra® a partire dai sei mesi di vita [20].
Al fine di fornire evidenze sulla sostenibilità relativa all’introduzione del QIVc nel contesto italiano, nel 2019 è stato pubblicato un rapporto di HTA su questa tecnologia sanitaria [21, 22]. Il report ha valutato le implicazioni sanitarie, organizzative, economiche ed etiche dell’introduzione del QIVc nel SSN italiano, evidenziando che l’introduzione di Flucelvax Tetra® avrebbe potuto evitare in Italia da 145.553 a 273.541 episodi di influenza (sia sintomatica che asintomatica) dovuta al sottotipo A(H3N2), rappresentando una scelta altamente costo-efficace dalla prospettiva del SSN, essendo il rapporto incrementale di costo-efficacia, allora valutato, inferiore a 30.000 €/QALY. Inoltre, dal punto di vista societario l’introduzione di questo vaccino era risultata essere cost-saving. L’analisi di Budget Impact inclusa nel report di HTA del 2019, aveva, inoltre, dimostrato che, ipotizzando una penetrazione progressiva sul mercato di Flucelvax Tetra® (5% nella stagione 2019/20, 10% nella stagione 2020/21 e 15% nella stagione 2021/22), l’impatto sul budget sarebbe risultato esiguo con un aumento delle spese regionali per la campagna vaccinale di 0,29-0,51%, e quindi sostenibile in tutte le Regioni italiane incluse quelle in Piano di Rientro [21].
Tuttavia, negli ultimi due anni sono state prodotte ulteriori evidenze scientifiche sul QIVc e nuovi comparatori sono oggi presenti nello scenario vaccinale contro l’influenza. Inoltre, da ottobre 2020 Flucelvax Tetra® ha ricevuto dall’EMA l’estensione di utilizzo a partire dal secondo anno di vita [18]. Pertanto, in un contesto come quello attuale, al fine di coniugare sostenibilità e accesso all’innovazione, appare indispensabile promuovere anche il reassessment delle tecnologie sanitarie al fine di razionalizzare le risorse disponibili secondo logiche di efficienza allocativa.
Sulla base delle premesse descritte, il presente report si pone come obiettivo principale quello di effettuare una nuova valutazione del vaccino QIVc al fine di analizzarne le principali implicazioni sanitarie, economiche, organizzative, etiche e sociali. Tale valutazione, focalizzata al contesto di cura italiano, affronta le seguenti tematiche:
l’epidemiologia dell’influenza stagionale in Italia;
il burden dell’influenza stagionale in Italia;
i vaccini antinfluenzali attualmente disponibili in Italia;
il vaccino quadrivalente da coltura cellulare (Flucelvax Tetra®): una revisione sistematica e meta-analisi di immunogenicità, efficacia e sicurezza;
la valutazione economica dell’introduzione del vaccino antinfluenzale quadrivalente da coltura cellulare nel contesto di cura italiano (update da nuova indicazione);
gli aspetti organizzativi della vaccinazione antinfluenzale in Italia;
la valutazione etica sull’utilizzo del vaccino antinfluenzale quadrivalente da coltura cellulare in Italia;
il valore della vaccinazione antinfluenzale nel quadro più complessivo della Value-based Healthcare.
Il report si chiude, infine, con gli elementi chiave per il processo decisionale che sintetizzano quanto descritto nel report. L’elaborazione di questo Report è avvenuta, secondo la metodologia HTA, attraverso la creazione di un gruppo di lavoro multidisciplinare che ha identificato, analizzato e, successivamente, sintetizzato tutte le informazioni disponibili sull’argomento. Sono state, quindi, eseguite revisioni sistematiche della letteratura scientifica esistente e le evidenze sono state selezionate secondo criteri di inclusione precostituiti, organizzate sulla base dei domini HTA seguendo il Core Model® di EuNetHTA [3]. Coerentemente con l’approccio dell’HTA, la stesura del presente report ha previsto, inoltre, la definizione e l’attivazione di un tavolo multidisciplinare di esperti per discutere e approfondire le tematiche legate alla tecnologia sanitaria oggetto di valutazione. Questa attività ha rappresentato una fase di appraisal, in cui i risultati della ricerca effettuata per l’elaborazione del report sono stati sottoposti all’attenzione di un expert panel che ha fornito indicazioni utili a rifinire e sistematizzare i risultati dello studio e delle evidenze prodotte. La stesura del presente report si è conclusa il 25 luglio 2022.
L’influenza è una malattia infettiva virale delle vie respiratorie prevenibile mediante vaccinazione. L’influenza è caratterizzata da un andamento epidemiologico stagionale a carattere epidemico. Infatti, nei climi temperati dell’emisfero nord le epidemie stagionali si verificano principalmente durante l’inverno mentre nelle regioni tropicali l’epidemia stagionale dell’influenza può verificarsi durante tutto l’anno, causando focolai più irregolari.
L’influenza rappresenta un rilevante problema di Sanità Pubblica per il suo notevole impatto sulla salute delle popolazioni dal punto di vista epidemiologico, clinico ed economico. Si stima che a livello globale ogni anno si verifichino 3-5 milioni di casi severi di influenza e 290.000-650.000 decessi per cause respiratorie [1]. Inoltre, nelle stagioni ad alta intensità le epidemie influenzali determinano alti tassi di assenteismo lavorativo e scolastico con elevata riduzione della produttività. Infine, nel periodo del picco epidemico gli ambulatori e gli ospedali possono andare incontro ad un sovraccarico e intralcio dell’attività assistenziale a causa dell’elevato numero di casi di influenza.
L’Influenza è causata da differenti virus a RNA appartenenti alla famiglia degli Orthomyxovirus. Sulla base delle loro differenze antigeniche, ad oggi sono noti quattro diversi virus influenzali: il tipo A, B, C e D. I virus dell’influenza A e B sono i principali responsabili delle epidemie stagionali e della classica sintomatologia influenzale. Il virus dell’influenza C viene rilevato meno frequentemente e di solito provoca infezioni lievi, subcliniche o anche asintomatiche; pertanto, questo virus ha una minor rilevanza per la salute pubblica. I virus D colpiscono principalmente i bovini ma, al momento, non è nota la loro capacità di infettare l’uomo o di causare malattie nelle persone [1].
I virus dell’influenza di tipo A sono classificati in sottotipi in base alle combinazioni di due glicoproteine di superficie, l’emoagglutinina (HA) e la neuraminidasi (NA). Al momento sono noti 18 diversi sottotipi di emoagglutinina (HA 1-18) e 11 di neuraminidasi (N1-11). I virus influenzali A hanno come serbatoio non solo l’uomo ma anche gli animali, sia selvatici che domestici (uccelli, suini, equini) e per questo motivo, oltre alle epidemie stagionali, possono causare anche pandemie influenzali [1, 2].
I virus dell’influenza B non sono classificati in sottotipi, ma possono essere suddivisi nei due lineage Yamagata e Victoria: entrambi i lineage possono infettare solamente l’uomo. In generale, i virus B tendono a causare forme meno gravi di influenza rispetto ai virus influenzali di tipo A [1].
I virus influenzali sono caratterizzati da una spiccata tendenza a mutare a livello genetico, con conseguente presentazione di varianti antigeniche delle due glicoproteine HA e NA che permettono al virus di eludere la risposta immunitaria dell’ospite sviluppata in seguito a precedenti infezioni. Per questo motivo la maggior parte della popolazione risulta immunologicamente suscettibile alle nuove varianti influenzali e, di conseguenza, queste possono diffondersi facilmente [3]. I meccanismi di mutazione alla base della variabilità genetica dei virus influenzali sono l’antigenic drift (o deriva antigenica) e l’antigenic shift (o spostamento antigenico). L’antigenic drift può verificarsi nei virus influenzali di tipo A, B e C e consiste in mutazioni puntiformi a carico dei geni che codificano l’emoagglutinina e la neuraminidasi. Ciò si traduce in cambiamenti graduali dei virus che determinano le epidemie stagionali nell’uomo. L’antigenic shift, invece, si verifica solo nei virus influenzali di tipo A (caratterizzati per avere un serbatoio anche negli animali). Questo meccanismo porta a grandi cambiamenti genetici e può derivare sia da un ri-assortimento di segmenti di RNA fra virus influenzali umani e animali (aviari o suini), oppure a seguito di un salto di specie, quindi per trasmissione diretta di virus influenzali non-umani all’uomo [2, 3]. Si sviluppa, quindi, una nuova variante virale con notevoli differenze antigeniche rispetto ai sottotipi virali già circolanti. Se la nuova variante ha la capacità di infettare l’uomo, un’elevata contagiosità e trasmissibilità ed è in grado di causare la malattia, può portare allo sviluppo di pandemie influenzali.
I virus influenzali si trasmettono principalmente per via aerea da persona a persona attraverso goccioline di saliva (droplet nuclei) emesse dai soggetti infetti e malati attraverso colpi di tosse, starnuti o semplicemente con il parlare, oppure mediante aerosol di piccole goccioline infettanti. Queste goccioline aerodisperse possono raggiungere le mucose delle vie respiratorie superiori di persone che si trovano entro sei piedi di distanza (circa 1,8 m) dalle persone infette contagiose [4]. Inoltre, la trasmissione può avvenire anche mediante contatto diretto con persone infette (ad esempio attraverso le mani contaminate sugli occhi, sul naso o sulla bocca) o indiretto per contatto di superfici contaminate dal virus dell’influenza. Ambienti chiusi, affollati e con scarso ricambio di aria facilitano la diffusione dei virus influenzali [3, 4]. I virus influenzali possono essere trasmessi anche da soggetti apparentemente sani: infatti, le persone sono contagiose da 1-2 giorni prima della comparsa della sintomatologia e lo rimangono fino a 5-10 giorno dopo. Il periodo di contagiosità può essere più prolungato in bambini e adulti che hanno condizioni di immunocompromissione [3].
L’influenza può avere un decorso asintomatico, sintomatico senza complicazioni oppure dare un quadro clinico severo. Infatti, durante una stagione influenzale fino al 75% delle infezioni può essere asintomatico [5]. Quando l’infezione evolve verso la sintomatologia, l’influenza è caratterizzata da una repentina manifestazione di sintomi generali e respiratori: febbre/febbricola improvvisa (superiore a 38°C), mal di testa, dolori muscolari, malessere generale, astenia, mal di gola, raffreddore, tosse non catarrale e congiuntivite. Nei bambini, i picchi febbrili possono raggiungere anche i 40°C e si possono avere anche sintomi gastrointestinali come nausea, vomito e diarrea.
I casi non gravi di influenza hanno un decorso benigno e generalmente si risolvono entro pochi giorni: la febbre di solito si risolve entro 3-4 giorni e altri sintomi entro circa 7 giorni. Alcuni sintomi, come astenia o tosse possono durare più a lungo (2 o più settimane) [2, 4].
Quando il quadro clinico è severo, l’influenza può evolvere verso gravi complicanze e portare al decesso. I soggetti ad aumentato rischio delle forme severe di influenza sono i bambini piccoli (fra i 6 mesi e i 5 anni), gli anziani, i soggetti con patologie croniche (come diabete, malattie cardiovascolari, patologie dell’apparato respiratorio, obesità, tumori…), coloro che si trovano in condizioni di immunosoppressione per patologia o per trattamento farmacologico e donne in gravidanza [2].
La complicanza più comune è correlata alla comparsa di una sovrainfezione batterica, per esempio da Streptococcus pneumoniae o Staphylococcus aureus, a carico dell’apparato respiratorio che può quindi portare allo sviluppo di bronchite, ed aggravarsi fino allo sviluppo di polmoniti e di infiammazioni a livello dell’orecchio (otite o sinusite, soprattutto nei bambini). Si possono avere anche delle complicanze a carico dell’apparato cardiovascolare (come miocarditi) e del sistema nervoso (encefaliti), o l’aggravamento di malattie preesistenti. Le complicanze possono essere addirittura letali [2, 6]. La maggior parte dei decessi associati all’influenza si verifica nella popolazione anziana di età superiore ai 65 anni [2, 4].
Nei soggetti in cui l’influenza decorre in modo non grave, non è raccomandata alcuna terapia antivirale specifica, ma una terapia di supporto per alleviare la sintomatologia. Viene inoltre raccomandato al malato di rimanere a riposo presso la propria abitazione al fine di ridurre il rischio di diffondere il patogeno all’interno delle comunità frequentate. I soggetti a rischio di un decorso clinico grave o che presentano una forma severa di influenza, invece, devono essere sottoposti il prima possibile (idealmente entro 48 ore dalla comparsa dei sintomi) a terapia farmacologica antivirale, con somministrazione di inibitori della neuraminidasi [1].
L’intervento di prevenzione più efficace nei confronti dell’influenza è la vaccinazione. Attualmente sono disponibili differenti tipologie e formulazioni di vaccini anti-influenzali caratterizzati da un buon profilo di efficacia e sicurezza. Queste diverse tipologie di vaccini hanno differenti indicazioni di utilizzo in base all’età e differenti livelli di appropriatezza in base alle caratteristiche della persona da vaccinare secondo le raccomandazioni nazionali annuali.
L’ultimo aggiornamento dell’Istituto Nazionale di Statistica (ISTAT) riporta che la popolazione residente in Italia al 1° gennaio 2021 consiste in 59.236.213 abitanti, di cui il 51,3% rappresentato dalla popolazione femminile [7]. La popolazione è composta per il 12,9% da soggetti di età 0-14 anni, il 63,6% di età 15-64 anni e per il 23,5% da popolazione anziana di età ≥ 65 anni, con un’età media di 45,9 anni. In particolare, nel periodo 2017-2021 si è avuto un aumento di circa 1 punto percentuale nella popolazione anziana (22,4% nel 2017) [8]. Nel 2020, la speranza di vita alla nascita è stata pari a 82,1 anni, con valori più alti nelle donne rispetto alla popolazione maschile (84,5 anni e 79,8 anni, rispettivamente).
Ormai da tempo l’Italia si trova in una condizione di regresso demografico, come conferma la tendenza in netta diminuzione del tasso di crescita totale, che ha toccato il valore minimo di -6 per 1.000 abitanti nel 2020. Questa situazione è caratterizzata da un lato, da un aumento della speranza di vita alla nascita che favorisce quindi l’aumento della popolazione anziana e molto anziana e dall’altro un drastico decremento nei tassi di natalità (6,8 x 1.000 abitanti nel 2020) e della popolazione più giovane [8]. Inoltre, la pandemia di COVID-19 ha accentuato il fenomeno di recessione demografica già in atto. Nel 2020, il nuovo “record” in negativo di nascite (405.000) e l’elevato numero di decessi (740.000) hanno contribuito ad aggravare una dinamica demografica naturale già critica [9]. Nel 2020, come conseguenza dell’eccesso di mortalità determinato dalla pandemia di COVID-19, la speranza di vita alla nascita ha subito un’inflessione negativa in entrambi i sessi, scendendo a 82 anni (-1,2 anni rispetto al 2019) [10].
I dati riferiti al 2020 indicano che in media il 72% della popolazione italiana si trova in uno stato di buona salute: questo valore diminuisce all’aumentare dell’età, con un valore massimo di 97,8% per i soggetti di età 0-14 anni e un valore minimo 28,4% per i soggetti di età pari o superiore a 75 anni. Parallelamente la percentuale di soggetti che hanno almeno una malattia cronica aumenta con l’età (da 8,9% nei soggetti 0-14 anni a 86,3% nella popolazione ≥ 75 anni). Circa il 65% della popolazione più anziana ha due o più patologie croniche. Fra le malattie croniche oggetto di rilevazione da parte di ISTAT, l’ipertensione è la patologia a maggior prevalenza (18,3%), seguita da artrosi e artrite (14,7%), malattie allergiche (11,6%), osteoporosi (8,1%) e diabete (5,9%). Per tutte queste patologie si osserva una tendenza in aumento della prevalenza all’aumentare dell’età, con gli incrementi maggiori a partire dai 45 anni [11]. Nel 2020, circa il 18,6% della popolazione italiana di età superiore a 14 anni era fumatore, con un consumo medio giornaliero di quasi 11 sigarette al giorno. La percentuale di fumatori è comunque piuttosto rilevante in adolescenza (6,3%) e nei giovani adulti (19,5-22,9%). Anche nella popolazione anziana, la percentuale di fumatori è piuttosto elevata nella fascia di età compresa fra i 65-74 anni (14,4%) e diminuisce nei soggetti di età superiore ai 75 anni (5,8%) [12].
Per quanto riguarda la popolazione pediatrica e adolescente, negli ultimi anni si è assistito ad un aumento delle condizioni croniche, spesso associate anche ad errati stili di vita adottati fin da età precoci, come non corrette abitudini alimentari o la sedentarietà. I dati della sorveglianza nazionale OKkio alla Salute riferiti al 2019 hanno evidenziato come quasi il 30% dei bambini di età fra 6 e 10 anni si trovi in una condizione di eccesso ponderale (20,4% in sovrappeso e 11,8% in obesità/obesità grave) [13]. L’insorgenza di una condizione di sovrappeso o obesità in età pediatrica e adolescente espone i soggetti fin da età precoci a difficoltà respiratorie, problemi articolari, mobilità ridotta, o disturbi dell’apparato digerente e di carattere psicologico ed aumenta il rischio di sviluppare precocemente altri fattori di rischio per patologie cardiovascolari o dismetabolismi (come il diabete tipo 2) e ipercolesterolemia [14]. In questo contesto la pandemia di COVID-19 ha avuto notevoli ripercussioni anche sulla popolazione pediatrica: se da una parte, la malattia risulta essere meno grave rispetto alla popolazione adulta e anziana e con pochi decessi dall’inizio dell’epidemia nei soggetti più giovani [15], le conseguenze secondarie o indirette della pandemia hanno avuto una portata ben più rilevante sullo stato di salute della popolazione giovane. I periodi di lockdown hanno cambiato le abitudini alimentari e gli stili di vita delle famiglie, quindi anche dei bambini e degli adolescenti, verso un generale eccesso di assunzione di cibo. Questo comporta un aumento del rischio di squilibri nutrizionali quali-quantitativi, di sovrappeso, di obesità o di condizioni cardiovascolari [16]. Inoltre, se durante la prima ondata epidemica la popolazione adolescente ha mostrato un’iniziale capacità di resilienza di fronte a un fenomeno imprevedibile, a partire dall’autunno del 2020 è chiaramente emersa una fragilità psicologica fra gli adolescenti [17]. Tra gli effetti indiretti dell’emergenza pandemica da SARS-CoV-2, si è anche osservato un calo delle coperture vaccinali per le vaccinazioni raccomandate e obbligatorie in età pediatrica e adolescente [18-20].
Per quanto riguarda l’adesione ai programmi di prevenzione verso le malattie infettive vaccino-prevenibili, la Sorveglianza Passi ha registrato un valore medio nazionale di copertura vaccinale (CV) anti-influenzale del 9,2% per la popolazione di età 18-64 anni nel periodo 2017-2020, con CV più elevate fra i soggetti con almeno una patologia cronica (22,1%) rispetto a chi non presenta malattie croniche (6,7%). Inoltre, si è osservata una tendenza in aumento delle CV all’aumentare dell’età: dal 5,1% nella popolazione di 18-34 anni a 15,2% per la fascia di età 50-64 anni [21]. La sorveglianza PASSI d’Argento, dedicata alla popolazione anziana, ha registrato una CV più elevata (48,7%) nel medesimo periodo di osservazione; tuttavia, questo valore è ben al di sotto della soglia di obiettivo minimo di copertura vaccinale (75%) previsto dalle raccomandazioni nazionali [22]. Anche nella popolazione anziana si ha una tendenza in aumento delle CV all’aumentare dell’età, ma senza raggiungere l’obiettivo minimo (72% nella popolazione di età superiore agli 85 anni) [23].
Per quanto riguarda l’età pediatrica, fino alla stagione influenzale 2019-2020 la vaccinazione anti-influenzale era raccomandata solamente ai bambini a rischio di complicanze da influenza per pre-esistenti patologie. Nel contesto pandemico, solo nelle ultime due stagioni influenzali (2020-2021 e 2021-2022), il Ministero della Salute ha individuato la popolazione pediatrica sana, in particolare i bambini di 6 mesi-6 anni di età, come uno dei gruppi a cui raccomandare la vaccinazione anti-influenzale [24,25].
Il primo programma internazionale di sorveglianza dell’influenza è stato avviato dall’Organizzazione Mondiale della Sanità (OMS) negli anni ’50: l’Italia ne ha preso parte successivamente attraverso il progetto European Influenza Surveillance Scheme (EISS) promosso dall’Unione Europea (UE).
In Italia, il sistema di sorveglianza dell’influenza Influnet è stato inizialmente avviato in forma sperimentale nella stagione 1999-2000 e, a seguito della Conferenza Stato Regioni del 28 settembre 2000, ha assunto una forma istituzionale con l’obiettivo di monitorare i dati epidemiologici e virologici dell’influenza nel corso delle stagioni epidemiche [26]. Influnet è coordinato dall’Istituto Superiore di Sanità (ISS) in collaborazione con il Ministero della Salute e si avvale del supporto dei Medici di Medicina Generale (MMG) e dei Pediatri di Libera Scelta (PLS), dei referenti presso le ASL e le Regioni e della rete dei Laboratori di riferimento regionale per l’influenza. I medici sentinella segnalano i casi di sindrome simil influenzale (Influenza-Like-Illness, ILI) osservati tra i loro assistiti e, insieme ad altri medici operanti nel territorio e negli ospedali, si occupano della raccolta di campioni biologici per l’identificazione di virus circolanti. Per questo motivo, la sorveglianza Influnet si articola in una sorveglianza epidemiologica e in una sorveglianza virologica. L’ISS si occupa di raccogliere ed elaborare le segnalazioni di ILI e i referti di laboratorio per redigere settimanalmente il bollettino epidemiologico e virologico che viene pubblicato su una pagina web del Ministero della Salute e sul portale online dedicato. La sorveglianza è attiva a partire dalla 42a settimana dell’anno fino alla 17a settimana dell’anno seguente [27-29].
Influnet Epi è il sistema di sorveglianza epidemiologica che per mezzo dei medici sentinella (MMG e PLS) monitora l’andamento stagionale delle ILI, utilizzato come proxy dell’incidenza dell’influenza. Settimanalmente vengono notificati i casi di ILI da parte di un campione di circa 1.000 MMG e PLS distribuiti nel territorio italiano. Il caso di ILI viene individuato secondo la definizione clinica europea proposta dall’European Centre for Disease Prevention and Control (ECDC) nel 2014, al fine di uniformare la rilevazione dei casi a livello europeo. Nelle ILI si includono le manifestazioni acute con sintomi generali e respiratori. In particolare, il caso ILI è un soggetto che presenta un improvviso e rapido insorgere di almeno uno tra i seguenti sintomi generali [30]:
febbre o febbricola;
malessere/spossatezza;
mal di testa;
dolori muscolari;
e almeno uno tra i seguenti sintomi respiratori:
tosse;
mal di gola;
respiro affannoso.
La sorveglianza Influnet Epi è coordinata dal reparto di epidemiologia, biostatistica e modelli matematici dell’ISS.
Influnet Vir è il sistema di sorveglianza virologica che, in collaborazione con la rete di laboratori di riferimento regionale Rete InfluNet, si occupa della caratterizzazione dei virus influenzali epidemici. Questa sorveglianza è coordinata dal Centro Nazionale dell’OMS per l’influenza (National Influenza Centre, NIC) dell’ISS che periodicamente individua i laboratori della Rete Influnet che si occuperanno delle indagini virologiche. Le attività di Influnet Vir si focalizzano principalmente sulla caratterizzazione dei virus circolanti nel periodo invernale e sull’analisi del grado di omologia antigenica tra ceppi epidemici e vaccinali. Questa ultima attività è fondamentale per l’aggiornamento annuale della composizione del vaccino anti-influenzale. Inoltre, il NIC e i laboratori di riferimento monitorano anche i casi di infezione zoonotica da virus influenzali che, per il loro potenziale rischio pandemico, devono essere rilevati e notificati tempestivamente [25].
Più recentemente, dalla stagione pandemica 2009-2010, è stato attivato un ulteriore sistema di monitoraggio volto a monitorare l’andamento delle forme gravi e complicate di influenza confermata. Le Regioni e le Province a statuto autonomo devono segnalare al Ministero e all’ISS i casi gravi e complicati di influenza confermata in laboratorio, le cui condizioni prevedano il ricovero in terapia intensiva e/o il ricorso alla terapia in Ossigenazione extracorporea a membrana (ECMO). Grazie a questo ulteriore sistema di sorveglianza è possibile raccogliere dati sulle forme severe di influenza e sui decessi per aumentare il grado di conoscenza sull’epidemiologia delle forme gravi nel Paese, anche in termini di possibili fattori di rischio e cambiamenti nel corso dell’epidemia influenzale [31, 32].
Grazie all’integrazione di più sistemi di sorveglianza è possibile valutare con maggior accuratezza sia la diffusione, l’intensità e la severità delle infezioni da virus influenzali circolanti che l’efficacia delle misure preventive adottate nei confronti dell’influenza.
Nel presente capitolo è stata condotta un’analisi dell’epidemiologia dell’influenza stagionale nella popolazione italiana attraverso la raccolta e la rielaborazione dei dati pubblicati nei report dei sistemi di sorveglianza Influnet Epi e Influnet Vir per le stagioni influenzali dal 2010-2011 al 2021-2022.
È stata effettuata un’analisi dei dati epidemiologici delle stagioni influenzali di interesse, per la popolazione totale e le classi di età 0-4 anni, 5-14 anni, 15-64 anni, ≥ 65 anni, mediante la valutazione dei seguenti indicatori:
incidenza cumulativa delle ILI;
incidenza settimanale massima delle ILI;
analisi del periodo epidemico (inizio, fine, durata).
Al fine di avere una omogeneità nella definizione della durata del periodo epidemico per tutte le stagioni influenzali esaminate è stato considerato come livello basale un valore di incidenza settimanale di ILI ≥ 2 casi per 1.000 assistiti.
I valori medi calcolati si riferiscono alle stagioni influenzali dal 2010/2011 al 2019/2020; sono state escluse nei calcoli dei valori medi le ultime due stagioni (2020/2021 e 2021/2022) perché fortemente influenzate dalla circolazione di SARS-CoV-2 e delle sue varianti e dall’adozione di interventi di controllo della pandemia.
È stata effettuata una valutazione delle informazioni virologiche raccolte nelle stagioni epidemiche di interesse. In particolare:
sono stati calcolati il tasso di positività dei campioni analizzati sul totale dei campioni raccolti. Il tasso di positività medio è stato calcolato considerando le stagioni influenzali dal 2010-2011 al 2019-2020;
è stata condotta un’analisi della caratterizzazione virologica (virus influenzali A e virus influenzali B) dei campioni positivi;
è stata condotta un’analisi della tipizzazione dei campioni positivi ai virus influenzali A (H1N1pdm09, H3N2, virus A non sottotipizzato) e dei campioni positivi ai virus influenzali B (lineage Victoria e lineage Yamagata).
Nelle 10 stagioni epidemiche osservate (dal 2010-2011 al 2019-2020), in media circa il 10,4% della popolazione italiana è risultata affetta da ILI. La popolazione anziana in tutte le stagioni influenzali ha mostrato valori di incidenza cumulativa di ILI più bassi rispetto alle altre fasce di età. Viceversa, la popolazione pediatrica e adolescente (0-4 anni, 5-14 anni) è stata caratterizzata da tassi di incidenza di ILI più elevati (Fig. 1). La stagione 2017-2018 si è distinta per un livello di intensità epidemico molto alto, con i più elevati valori di incidenza cumulativa di ILI per tutte le fasce di età rispetto alle altre stagioni e un valore medio di incidenza del 14,3% per la popolazione totale. La stagione 2020-2021 presenta un andamento sicuramente “anomalo” rispetto alle precedenti stagioni influenzali, con un valore di incidenza per ILI ai minimi storici (4,0%) in tutte le classi di età. Invece, i dati della stagione epidemica 2021-2022 mostrano un nuovo aumento dell’incidenza cumulativa di ILI (11,0%) rispetto alla stagione precedente (Tab. I).
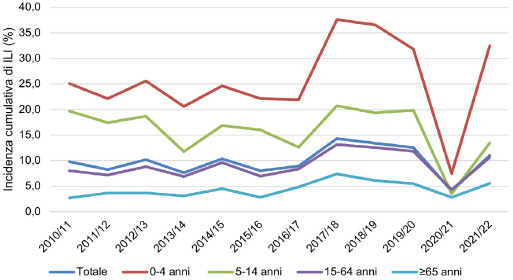
Incidenza cumulativa di ILI (%) nelle stagioni influenzali dal 2010/11 al 2021/22 nelle diverse classi di età (da: ISS. Influnet).
Incidenza cumulativa delle ILI (%), per stagione influenzale e classe di età, nelle stagioni 2010/11-2021/22. Il valore medio è stato calcolato considerando le stagioni influenzali dal 2010/11 al 2019/20 (da: ISS. Influnet).
| Incidenza cumulativa ILI (%) | ||||||
|---|---|---|---|---|---|---|
| Classe di età | Totale | Livello intensità | ||||
| Stagione | 0-4 aa | 5-14 aa | 15-64 aa | ≥ 65 aa | ||
| 2010/11 | 25,1 | 19,7 | 8,0 | 2,7 | 9,8 | Basso* |
| 2011/12 | 22,2 | 17,5 | 7,2 | 3,7 | 8,2 | Intermedio* |
| 2012/13 | 25,6 | 18,7 | 8,8 | 3,7 | 10,2 | Intermedio* |
| 2013/14 | 20,6 | 11,8 | 6,9 | 3,1 | 7,6 | Intermedio* |
| 2014/15 | 24,6 | 16,9 | 9,6 | 4,5 | 10,4 | Medio-Alto* |
| 2015/16 | 22,1 | 16,0 | 6,9 | 2,8 | 8,0 | Basso* |
| 2016/17 | 22,0 | 12,6 | 8,4 | 4,9 | 9,0 | Medio-Alto** |
| 2017/18 | 37,6 | 20,7 | 13,2 | 7,4 | 14,3 | Molto Alto** |
| 2018/19 | 36,6 | 19,3 | 12,6 | 6,1 | 13,4 | Alto** |
| 2019/20 | 31,8 | 19,9 | 11,8 | 5,5 | 12,6 | Basso** |
| Valore medio | 26,8 | 17,3 | 9,3 | 4,4 | 10,4 | |
| 2020/21 | 7,5 | 3,5 | 4,3 | 2,8 | 4,0 | Basale** |
| 2021/22 | 32,4 | 13,5 | 10,6 | 5,5 | 11,0 | Basso** |
* Soglia epidemica: incidenza settimanale ≥ 2 casi di ILI per 1.000 assistiti;
** Soglia epidemica in base al Moving Epidemic Method (MEM).
In tutte le stagioni influenzali considerate (dal 2010-2011 al 2021-2022) si può osservare un andamento in diminuzione dei tassi di incidenza cumulativa per ILI all’aumentare dell’età. In particolare, nelle stagioni 2010-2011/2019-2020 il valore medio di incidenza cumulativa di ILI è stato più basso (4,4%) nella popolazione anziana di età uguale o superiore a 65 anni e massimo (26,8%) nella popolazione infantile (0-4 anni). Durante la stagione epidemica 2017-2018, il tasso di incidenza cumulativa di ILI per la popolazione di 0-4 anni ha raggiunto il picco massimo del 37,6%. In questa stessa stagione influenzale, si è registrato il valore di massima incidenza cumulativa per ILI anche nella popolazione di età ≥ 65 anni (7,4%). Anche nella stagione influenzale 2021-2022, in cui si registra un incremento di incidenza di ILI rispetto alla stagione 2020-2021 (che aveva avuto una intensità basale), si conferma l’andamento decrescente dell’incidenza cumulativa di ILI passando dalla fascia di popolazione più giovanile (32,4% per bambini di 0-4 anni) a quelle più adulte (10,6%) e anziane (5,5%) (Tab. I).
L’andamento del picco di massima incidenza settimanale di ILI (‰) nelle stagioni influenzali dal 2010-2011 al 2021-2022 è comparabile con quello dell’incidenza cumulativa di ILI (%). Il valore medio di incidenza settimanale massima di ILI calcolato nelle 10 stagioni influenzali considerate (dal 2010-2011 al 2019-2020) è di 10,53 casi per 1.000 assistiti. Nella stagione influenzale 2017-2018 si è registrata l’incidenza settimanale più alta per l’intera popolazione (14,74‰). In particolare, si può osservare come in tutte le stagioni influenzali i valori di incidenza settimanale massima di ILI siano superiori nella popolazione pediatrica (29,87‰) e come questi tendano a diminuire in tutte le altre fasce di età, con un andamento decrescente verso la popolazione sempre più anziana (4,16‰) (Fig. 2). Anche nell’analisi per fasce di età, la stagione influenzale 2017-2018 mostra i valori di incidenza massima di ILI più elevati (41,03‰ nella classe 0-4 anni, 22,97‰ nella classe 5-14 anni, 14,51‰ nella classe 15-64 anni e 8,55‰ nella classe ≥ 65 anni). Elevati tassi di incidenza settimanale massima di ILI sono stati registrati anche nella stagione influenzale 2018-2019 e risultano comparabili con quelli della stagione 2017-2018. I valori minimi di incidenza settimanale rispetto a tutte le stagioni esaminate, invece, caratterizzano la stagione 2020-2021. Per l’ultima stagione influenzale 2021-2022 si evidenziano due picchi epidemici con una incidenza settimanale massima di 5,16 casi per 1.000 assistiti alla settimana 52 e di 5,29 casi per 1.000 assistiti alla settimana 13 (Tab. II).
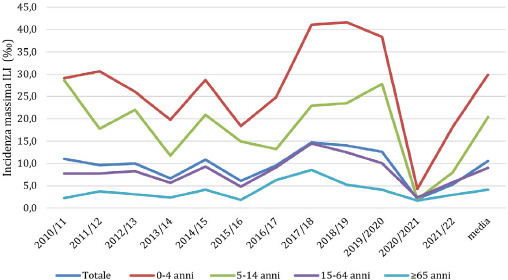
Incidenza settimanale massima di ILI (‰) nelle stagioni 2010/11–2021/22 (per 1.000 assistiti). Il valore medio è stato calcolato considerando le stagioni influenzali dal 2010/11 al 2019/20 (da: ISS. Influnet).
Incidenza settimanale massima di ILI (‰) nelle stagioni 2010/11–2021/22 (per 1.000 assistiti) e relativa settimana. Il valore medio è stato calcolato considerando le stagioni influenzali dal 2010/11 al 2019/20 (da: ISS. Influnet).
| Incidenza settimanale massima di ILI (‰) e relativa settimana | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Totale | 0-4 aa | 5-14 aa | 15-64 aa | 65+ aa | ||||||
| Stagione | Inc max | Settimana | Inc max | Settimana | Inc max | Settimana | Inc max | Settimana | Inc max | Settimana |
| 2010/11 | 11,04 | 5 | 29,12 | 5 | 28,59 | 5 | 7,8 | 5 | 2,26 | 2 |
| 2011/12 | 9,64 | 5 | 30,64 | 4 | 17,8 | 4 | 7,78 | 5 | 3,78 | 5 |
| 2012/13 | 9,99 | 6 | 26,06 | 6 | 22,07 | 5 | 8,24 | 7 | 3,09 | 7 |
| 2013/14 | 6,67 | 6 | 19,83 | 5 | 11,79 | 6 | 5,68 | 6 | 2,36 | 7 |
| 2014/15 | 10,87 | 4 | 28,71 | 4 | 20,92 | 4 | 9,33 | 4 | 4,15 | 6 |
| 2015/16 | 6,14 | 8 | 18,44 | 8 | 14,98 | 8 | 4,81 | 6 | 1,78 | 8 |
| 2016/17 | 9,55 | 52 | 24,9 | 52 | 13,27 | 51 | 9,15 | 1 | 6,32 | 1 |
| 2017/18 | 14,74 | 2 | 41,03 | 4 | 22,97 | 3 | 14,51 | 2 | 8,55 | 1 |
| 2018/19 | 14,06 | 5 | 41,61 | 5 | 23,53 | 5 | 12,53 | 5 | 5,24 | 5 |
| 2019/20 | 12,62 | 5 | 38,33 | 5 | 27,74 | 5 | 10,03 | 5 | 4,12 | 5 |
| Media | 10,53 | 5 | 29,87 | 5 | 20,37 | 4 | 8,99 | 5 | 4,16 | 5 |
| 2020/21 | 2,04 | 45 | 4,31 | 8 | 2,01 | 5 | 2,39 | 45 | 1,65 | 46 |
| 2021/22 | 5,16-5,29 | 52-13 | 18,20-16,35 | 46-13 | 5,46-8,02 | 47-13 | 5,79-4,75 | 52-13 | 2,96-2,32 | 52-13 |
Generalmente l’incidenza settimanale massima di ILI si verifica intorno alla 4a-5a settimana dell’anno (fine gennaio-inizio febbraio), anche se in alcune stagioni il picco epidemico è stato raggiunto anticipatamente (45a settimana nella stagione 2020-2021) o in ritardo (8a settimana nella stagione 2015-2016) (Tab. II).
Considerando come soglia epidemica un’incidenza settimanale di due casi di ILI per 1.000 assistiti, in media il periodo epidemico inizia intorno alla 50a settimana e ha una durata di 16 settimane durante le stagioni influenzali dal 2010-2011 al 2019-2020. Nel periodo precedente la pandemia di COVID-19, le stagioni 2018-2019 e 2019-2020 sono state caratterizzate da una durata maggiore del periodo epidemico (19 settimane) mentre la stagione 2011-2012 è stata di minor durata (13 settimane). Per la stagione influenzale 2020-2021, non si può parlare di periodo epidemico in quanto solo in corrispondenza della 45a settimana di sorveglianza si è avuto un valore di incidenza settimanale di ILI > 2 casi per 1.000 assistiti nella popolazione totale. Per la stagione influenzale 2021-2022, invece, l’esordio epidemico è stato precoce, fin dalla 42a settimana e si è protratto per 28 settimane (fine periodo epidemico 17a settimana) sebbene l’incidenza di ILI sia stata a bassa intensità (Tab. III).
Descrizione del periodo epidemico: settimana di inizio, di fine e durata (n° di settimane) delle stagioni influenzali 2010/11-2021/22 nella popolazione totale. Il valore medio è stato calcolato considerando le stagioni influenzali dal 2010/11 al 2019/20 (da: ISS. Influnet).
| Periodo epidemico nella popolazione totale | |||
|---|---|---|---|
| Stagione | Settimana inizio | Settimana fine | Durata (n. settimane) |
| 2010/11 | 50 | 11 | 14 |
| 2011/12 | 51 | 11 | 13 |
| 2012/13 | 51 | 13 | 15 |
| 2013/14 | 52 | 13 | 14 |
| 2014/15 | 51 | 13 | 15 |
| 2015/16 | 52 | 14 | 16 |
| 2016/17 | 48 | 9 | 14 |
| 2017/18 | 48 | 12 | 17 |
| 2018/19 | 47 | 13 | 19 |
| 2019/20 | 46 | 12 | 19 |
| Media | 50 | 12 | 16 |
| 2020/21 | 45 | 45 | 1 |
| 2021/22 | 42 | 17 | 28 |
L’analisi del periodo epidemico per classi di età per le stagioni 2010-2011/2019-2020 evidenzia come l’esordio sia anticipato nella popolazione pediatrica (45a settimana) rispetto alle fasce di età più grandi. In particolare, l’inizio del periodo pandemico è più tardivo nella popolazione anziana (52a settimana). Parallelamente, la fine del periodo epidemico avviene più tardi per la popolazione dei primi anni di vita (in media verso la 15a settimana per i soggetti di età 0-4 anni) rispetto alle altre fasce di età. Infatti, la conclusione del periodo epidemico avviene più precocemente nelle altre classi di età: ad esempio, verso l’8a settimana per i soggetti di età superiore a 65 anni. Questo determina che mediamente il periodo epidemico è più prolungato nella fascia di età 0-4 anni (24 settimane) ed è decisamente più ridotto nella popolazione anziana (circa 8 settimane) (Fig. 3).
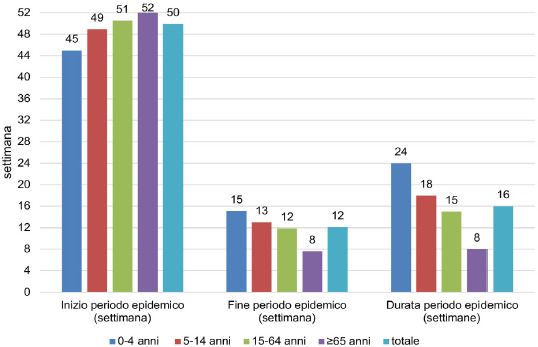
Valori medi della settimana di inizio e fine periodo epidemico e della durata del periodo epidemico, per la popolazione totale e nelle classi di età, nelle stagioni influenzali 2010/11-2019/20 (da: ISS. Influnet).
Nelle stagioni influenzali considerate (dal 2010-2011 al 2019-2020), il tasso medio di positività per uno dei virus influenzali (virus A o virus B) dei campioni biologici esaminati dal sistema di sorveglianza virologica è stato del 31%. Il tasso di positività più elevato (38%) è stato calcolato per la stagione influenzale 2012-2013. Anche per le stagioni influenzali 2011-2012, 2014-2015, 2017-2018 e 2018-2019 sono stati ottenuti tassi di positività superiori al 30%. Se si considerano le stagioni influenzali prima della pandemia di COVID-19, il tasso di positività minimo, pari al 23%, è stato registrato negli anni 2012-2014 e 2019-2020. Tuttavia, la stagione influenzale 2019-2020 potrebbe aver risentito della circolazione di SARS-CoV-2, delle relative misure di restrizione adottate a partire dalla fine di febbraio/inizio marzo 2020 e dalla riduzione dell’attività del sistema di sorveglianza virologica dell’influenza a causa dell’emergenza pandemica. Nella stagione influenzale 2020-2021 si evidenzia una totale assenza di virus influenzali nei campioni biologici raccolti, a fronte comunque di un numero estremamente ridotto di campioni prelevati (circa 6.800). La stagione influenzale 2021-2022 è caratterizzata da un tasso di positività molto basso (15%) per la circolazione di altri patogeni, tra cui il SARS-CoV-2 identificato nel 29% dei campioni (Tab. IV).
Numero di campioni raccolti, numero di campioni positivi e tasso di positività dei campioni analizzati sul totale raccolti (da: ISS. Influnet).
| Campioni raccolti (N.) | Campioni positivi (n.) | Tasso positività (n./N.) | |
|---|---|---|---|
| 2010/11 | 9.229 | 2.880 | 31% |
| 2011/12 | 4.667 | 1.671 | 36% |
| 2012/13 | 5.535 | 2.125 | 38% |
| 2013/14 | 4.444 | 1.036 | 23% |
| 2014/15 | 10.299 | 3.708 | 36% |
| 2015/16 | 8.971 | 2.422 | 27% |
| 2016/17 | 12.034 | 3.518 | 29% |
| 2017/18 | 16.135 | 5.494 | 34% |
| 2018/19 | 20.009 | 6.368 | 32% |
| 2019/20 | 16.146 | 3.760 | 23% |
| Media | 31% | ||
| 2020/21 | 6.818 | 0 | 0% |
| 2021/22 | 13.063 | 1.899 | 15% |
Nelle 12 stagioni influenzali analizzate, i virus influenzali A hanno presentato una maggior frequenza di circolazione rispetto ai virus influenzali B. In particolare, nelle stagioni epidemiche del 2011-2012, 2013-2014, 2016-2017 e 2018-2019 i virus influenzali A hanno rappresentato quasi la totalità dei virus isolati dai campioni positivi (96,5, 97, 95, 99,8% rispettivamente). Comunque, anche nelle stagioni 2010-2011, 2014-2015, 2019-2020 la frequenza dei virus A è stata molto alta. Nella stagione 2021-2022 ha nuovamente circolato solo il virus A (99,7%). Invece, i virus influenzali B hanno circolato con maggior frequenza durante le stagioni epidemiche 2012-2013 (58%), 2015-2016 (57%) e 2017-2018 (60%). È da sottolineare che, comunque, anche quando i virus B erano prevalenti sono stati isolati al massimo nel 60% dei campioni positivi (Fig. 4).
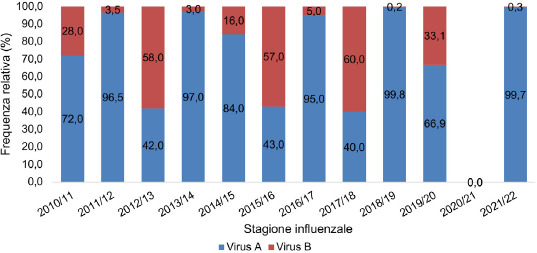
Distribuzione dei virus influenzali A e B nelle stagioni influenzali 2010/11-2021/22 (da: ISS. Influnet).
Per quanto riguarda la tipizzazione dei virus influenzali A si nota una certa variabilità di frequenza durante le stagioni influenzali per il sottotipo H1N1pdm09 e il sottotipo H3N2. Il sottotipo H1N1pdm09 ha avuto una maggior frequenza durante le stagioni influenzali 2010-2011, 2021-2013 e 2017-2018 (86%, 80%, 89,9% rispettivamente). Invece, durante le stagioni influenzali 2011-2012 e 2016-2017 quasi la totalità dei virus A isolati apparteneva al sottotipo H3N2 (Fig. 5). Nella stagione 2021-2022 il sottotipo H3N2 è stato isolato nel 71% dei campioni positivi (da notare che il 28,7% dei campioni non è stato tipizzato).
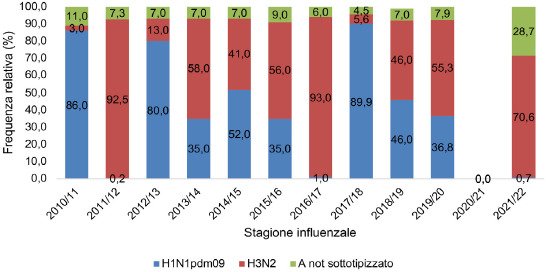
Distribuzione dei virus influenzali A in Italia nelle stagioni influenzali dal 2010/2011 al 2021/2022 (da: ISS. Influnet).
L’identificazione dei virus influenzali B è avvenuta in maniera discontinua durante le stagioni influenzali considerate (dal 2010-2011 al 2021-2022). Il lineage Victoria è stato il virus B prevalente durante le stagioni influenzali 2010-2011 e 2015-2016 (94 e 95%, rispettivamente) mentre il lineage Yamagata ha avuto una frequenza relativa maggiore nelle stagioni influenzali 2012-2013, 2014-2015, 2016-2017 e 2017-2018 (Fig. 6). Nella stagione 2018-2019 sono stati identificati solo 9 virus B (0,2%), di cui 3 virus Yamagata, 2 Victoria e 4 ceppi con lineage non identificato. Per la stagione 2019-2020 dei 1.245 virus B identificati fino alla 12a settimana non sono disponibili i lineage di appartenenza. Nella stagione 2021-2022 sono stati identificati solo 6 virus B, di cui però non è specificato il lineage.
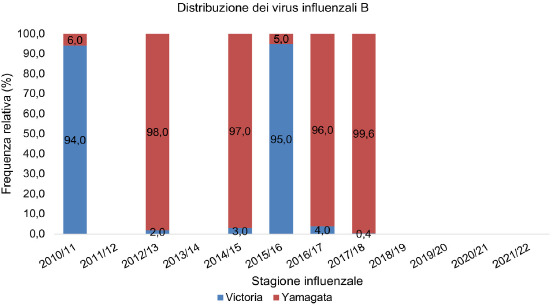
Distribuzione dei due lineaes Victoria e Yagamata del virus B in Italia nelle stagioni influenzali dal 2010/2011 al 2021/2022 (da: ISS. Influnet).
Gli andamenti temporali dei casi di ILI notificati nel sistema di sorveglianza Influnet nelle stagioni influenzali dal 2010-2011 ad oggi evidenziano una certa variabilità delle curve epidemiche annuali, con stagioni in cui l’intensità è stata elevata (2017-2018 e 2018-2019) e con altre stagioni caratterizzate da una bassa intensità (come anche nelle ultime due stagioni influenzali).
Dall’analisi dei dati di sorveglianza epidemiologica delle stagioni influenzali antecedenti la pandemia di COVID-19 (dal 2010-2011 al 2019-2020) si nota che la popolazione anziana è caratterizzata dai più bassi tassi di incidenza di ILI (cumulativa e massima) e da una durata epidemica ridotta (mediamente di 8 settimane), con inizio verso la fine di dicembre (settimana 52) e conclusione verso la fine di febbraio (settimana 8). Nella popolazione anziana (≥ 65 anni), l’incidenza settimanale massima di ILI oscilla, in base alla stagione, fra l’1,8 e l’8,6‰: questi valori corrispondono ad un minimo di 25.000 fino ad un massimo di quasi 120.000 casi di ILI settimanali. Considerando che l’incidenza cumulativa oscilla fra il 2,7 e il 7,4%, in ogni stagione si ha un minino di 377.000 casi di ILI fino ad un massimo di oltre 1,03 milioni di anziani da curare e assistere in un breve arco temporale. Per quanto questi valori possano sembrare ridotti, è opportuno sottolineare come i soggetti di questa fascia di età siano ad aumentato rischio per complicanze da influenza (che può evolvere anche in esiti particolarmente negativi, come il decesso).
I dati di sorveglianza epidemiologica nel periodo dal 2010-2011 al 2019-2020, invece, mostrano andamenti opposti per la popolazione pediatrica e adolescente, che hanno sempre presentato i più elevati valori di incidenza di ILI e una durata epidemica maggiore. In particolare, nella classe di età 0-4 anni, in media il periodo epidemico si estende per quasi tutta la stagione influenzale, con una durata media di 24 settimane. Inoltre, i valori di incidenza settimanale massima di ILI oscillano fra il 18,4 e il 41,6‰, che corrispondono a circa 41.000-92.000 casi di ILI settimanali. In queste stagioni influenzali, l’incidenza cumulativa è del 20,6-37,6%, che corrispondono a 456.000-833.000 bambini con ILI. Nella fascia di età 5-14 anni, mediamente il periodo epidemico ha una durata di 18 settimane, con esordio ad inizio del mese di dicembre (settimana 49) e conclusione a fine marzo (settimana 13). I tassi di incidenza massima di ILI sono lievemente più bassi (11,8-28,6‰) e generano dai 64.000 fino a circa 155.000 casi di ILI ogni 7 giorni. L’incidenza cumulativa oscilla da un minimo dell’11,8% a un massimo del 20,7%, corrispondendo ad una numerosità totale di ILI compresa fra 639.000 e oltre 1,1 milioni di casi. In queste fasce di età, l’influenza, sebbene abbia generalmente un decorso benigno, può essere responsabile di ricoveri ospedalieri (nei bambini più piccoli) e un numero rilevante di giorni di scuola persi, di giornate di lavoro perse da parte dei genitori e di un aumentato consumo di risorse sanitarie dovute a visite mediche, utilizzo di farmaci antipiretici e uso di antibiotici [33]. Inoltre, è da sottolineare che, per gli alti tassi di incidenza, la popolazione più giovane rappresenta la principale fonte di infezione per la popolazione generale e, in particolar modo, può trasmettere l’infezione alle categorie di soggetti maggiormente a rischio di morbosità e mortalità correlate alla sindrome influenzale come i soggetti anziani o coloro che presentano una patologia cronica (diabetici, broncopneumopatici, cardiopatici ecc.). Infine, è opportuno tenere in considerazione come negli ultimi anni sia aumentata la quota di soggetti giovani che presentano una condizione di eccesso ponderale, la quale a sua volta aumenta il rischio di sviluppare precocemente altri fattori di rischio per patologie croniche cardiovascolari, del metabolismo o respiratorie. In futuro, questo potrebbe portare ad un aumento dei casi gravi di influenza anche nella popolazione dei giovani adulti e degli adulti, proprio per aumento delle patologie croniche in queste fasce di età.
Dall’analisi dei dati della sorveglianza virologica emerge che nelle dieci stagioni 2010-2011/2019-2020, vi è stata una predominate circolazione del virus A in 7 stagioni e del virus B nelle altre 3 stagioni. In questo ultimo caso la percentuale di virus B non ha superato il 60% (58% nella stagione 2012-2013, 57% nella stagione 2015-2016 e 60% nella stagione 2017-2018). Fra i virus A, ha circolato maggiormente il sottotipo H3N2, mentre nelle stagioni in cui i virus B sono stati tipizzati, si è avuto una maggior circolazione del lineage Yamagata.
Le ultime settimane della stagione influenzale 2019-2020 sono state interessate dalla circolazione di SARS-CoV-2 [34]. Dai dati di sorveglianza di Influnet sembra che l’epidemia stagionale si sia interrotta bruscamente in maniera anticipata alla 13a settimana del 2020. Probabilmente, le misure di prevenzione e protezione adottate in risposta all’emergenza pandemica potrebbero aver impedito da un lato una regolare e continua sorveglianza e dall’altro potrebbero aver bloccato o rallentato la circolazione dei virus influenzali nella popolazione [35].
La stagione influenzale 2020-2021 ha avuto un andamento anomalo rispetto alle stagioni precedenti, con tassi di incidenza di ILI estremamente bassi e una totale assenza di virus influenzali identificati nei campioni respiratori raccolti e analizzati dal sistema di sorveglianza virologica Influnet. A livello globale anche nelle regioni temperate dell’emisfero nord, si è avuto un andamento analogo, con una stagione influenzale caratterizzata da una circolazione virale ben al disotto dei livelli inter-stagionali, con sporadici isolamenti di virus A e B [36]. In particolare, a livello europeo, sono stati identificati soli 865 campioni positivi ai virus influenzali, per il 50% di tipo A (con i sottotipi H3N2 e H1N1pdm09 all’incirca egualmente distribuiti) e per il 50% di tipo B. Questo ha rappresentato una drastica riduzione, del 99,5%, dell’isolamento dei virus influenzali rispetto allo stesso periodo dell’anno precedente [37].
Nella stagione influenzale 2021-2022, a livello italiano si è osservata una ripresa dell’intensità (anche se a bassi valori) della stagione influenzale (in termini di incidenza cumulativa e settimanale massima di ILI) rispetto alla stagione 2020-2021. In particolare, la stagione influenzale 2021-2022, è stata caratterizzata da due picchi epidemici: un primo picco epidemico tra la settimana 44 e la settimana 5 e un secondo picco che si è esteso fra la settimana 10 e la 17, la stagione si è quindi conclusa con un livello di incidenza di ILI pari a 2,83 casi per 1.000 assistiti. Nella stagione 2019-2020, ovvero l’ultima stagione con epidemia di sindromi simil-influenzali, l’incidenza di ILI stimata per la 17a settimana è stata nettamente inferiore (0,42 ‰). A partire dall’inizio della sorveglianza, nella stagione influenzale 2021-2022 sono stati stimati circa 6,5 milioni di casi di ILI. Tuttavia, se si considera il tasso di positività dei campioni biologici analizzati dal sistema di sorveglianza virologica per questa ultima stagione, questo risulta essere piuttosto basso (14%), quasi la metà del valore medio calcolato per le stagioni influenzali dal 2010-2011 al 2019-2020, indicando la co-circolazione dei altri patogeni, tra cui il SARS-CoV-2 (identificato nel 29% dei campioni).
Nell’ultimo decennio l’influenza ha rappresentato, e in futuro continuerà a rappresentare, un rilevante problema di Sanità Pubblica per l’elevata incidenza dei casi. Infatti, dopo la notevole riduzione dell’incidenza di ILI nel periodo di emergenza pandemica (2020-2021) grazie agli interventi di controllo e prevenzione dell’infezione da SARS-CoV-2, i dati della stagione 2021-2022 influenzale mostrano che i virus influenzali continuano a circolare e la loro diffusione è pronta ad aumentare appena vengono ridotte le restrizioni applicate per il controllo della pandemia di COVID-19. In questo contesto la sorveglianza epidemiologica e virologica risulta uno strumento fondamentale per comprendere e prevedere meglio l’epidemiologia di influenza e le sue fluttuazioni nel tempo.
L’influenza è una malattia infettiva con un elevato livello di contagiosità e con importanti implicazioni di salute pubblica, soprattutto in ragione del potenziale rischio di complicanze a carico di alcuni gruppi della popolazione. L’Organizzazione Mondiale della Sanità (OMS) nella Global Influenza Strategy 2019-2030 ha riportato che ogni anno, nel mondo, i casi di influenza ammontano a 1 miliardo, con 3-5 milioni di casi severi e 290.000-650.000 decessi [1].
Le complicanze più frequenti sono a carico dell’apparato respiratorio e comprendono, in particolare, la polmonite batterica secondaria a sovra-infezione da Streptococcus pneumoniae, Haemophilus influenzae o Staphylococcus aureus, e le riacutizzazioni di bronchite cronica e altre patologie polmonari croniche. Altre complicanze sono a carico dell’orecchio, del sistema nervoso e cardiovascolare e, principalmente associata all’influenza di tipo B, nei bambini che assumono acido acetilsalicilico vi è la sindrome di Reye [2]. L’insorgenza di tali complicanze comporta a sua volta ricoveri ospedalieri, visite ambulatoriali e cure farmacologiche con conseguenti costi per il Servizio Sanitario Nazionale (SSN). Il rilevante impatto dell’influenza è stato messo in luce anche dal gruppo di lavoro del Burden of Communicable Diseases in Europe (BCoDE) project che, con un approccio che ha visto l’utilizzo dei Disability-Adjusted Life Years (DALYs), ha stimato che il 30% del burden di 31 patologie infettive considerate nello studio sia imputabile a influenza [3]. Un altro aspetto da considerare, quando si affronta il burden legato all’influenza, è la mortalità associata all’infezione; il Centro europeo per il controllo delle malattie (ECDC) stima che, in media, circa 40.000 persone muoiano prematuramente ogni anno a causa dell’influenza nell’Unione Europea (UE). Il 90% dei decessi si verifica tuttavia in soggetti di età superiore ai 65 anni, specialmente tra quelli con condizioni cliniche croniche di base [4]. La mortalità legata all’influenza risulta, inoltre, verosimilmente sottostimata: infatti, in una rilevante quota di casi non si procede all’accertamento diagnostico e l’influenza non viene riportata come causa del decesso [5]. Considerando che la popolazione over 65 costituisce il 21,7% della popolazione italiana [6] e che la sorveglianza PASSI e PASSI D’ARGENTO ha rilevato che nella popolazione italiana tra i 18 e i 65 anni il 12% degli uomini e il 13% delle donne ha almeno una patologia cronica e che queste percentuali salgono a 37 e 34%, rispettivamente per uomini e donne, dopo i 65 anni, possiamo meglio inquadrare il contesto in cui, ogni stagione, si diffonde l’influenza [7].
Questo capitolo si pone l’obiettivo di descrivere il burden dell’influenza stagionale nella popolazione italiana, di tutte le età, analizzando tanto le complicanze, quanto le ospedalizzazioni e la mortalità ad essa associate.
Per la stesura di questo capitolo ci si è avvalsi di due approcci metodologici: la conduzione di due revisioni di letteratura e la consultazione e rielaborazione dei dati presenti nei flussi sanitari italiani ad accesso libero.
Per quanto riguarda le revisioni di letteratura, la prima, aggiornata al 31/04/2022, è stata condotta su PubMed, ricercando le revisioni sistematiche e le metanalisi che hanno indagato il burden dell’influenza a livello internazionale, in termini di ospedalizzazioni, complicanze e decessi. Sono stati esclusi gli articoli sull’influenza pandemica mentre non sono state effettuate restrizioni in base all’età dei soggetti studiati. Il processo di selezione è stato effettuato sulla base di titolo e abstract e, successivamente, full text.
La seconda revisione, invece, è stata un aggiornamento al 31/04/2022, della revisione del 2021 di Giacchetta et al. [8]. Gli articoli esitati dalla ricerca sono stati sottoposti ad un processo di selezione sulla base di titolo ed abstract, in prima battuta, e dei full text, in seconda, al fine di identificare quelli che riportassero i risultati degli studi primari condotti sulla popolazione italiana e relativi all’insorgenza di complicanze e/o ospedalizzazioni o alla mortalità correlata all’influenza. I criteri di inclusione sono stati: 1) studi relativi all’influenza stagionale; 2) studi che abbiano valutato mortalità e/o complicanze e/o ospedalizzazioni legate all’influenza. Non sono stati applicati criteri di restrizione in funzione dell’età. I criteri di esclusione sono stati: 1) case report; 2) studi di natura esclusivamente economica; 3) studi relativi alle pandemie influenzali; 4) review narrative; 5) studi che si focalizzassero solamente su rilevazioni epidemiologiche o sulla sorveglianza virologica di casi di Influenza Like Illness (ILI) o di influenza confermata in laboratorio.
Con riferimento alle banche dati disponibili è stato consultato l’archivio FluNews per quanto riguarda i casi gravi, intesi come quei casi in cui è stato necessario il ricovero in Unità di Terapia Intensiva (UTI) e/o l’uso dell’Extra Corporeal Membrane Oxygenation (ECMO) [9], i decessi e l’eccesso di mortalità. Sono stati raccolti i dati dalla stagione influenzale 2013/14 alla stagione 2021/22; di questi è stata acquisita, ove disponibile, l’informazione stratificata per età e (sotto)tipo virale. È stato, inoltre, interrogato il sistema informativo territoriale su sanità e salute dell’Istat Health for All (HFA) per quanto riguarda i tassi di dimissione per polmonite e influenza, dal 1999 al 2020, nella popolazione generale, specifici e standardizzati per età, e i tassi di mortalità per polmonite e influenza dal 1990 al 2018 nella popolazione generale, sempre specifici e standardizzati per età. In HFA i tassi di ospedalizzazione fanno riferimento alle dimissioni ospedaliere in regime ordinario e di day hospital da istituti di cura pubblici e privati accreditati nella cui diagnosi principale alla dimissione figurano i codici 480-487 della Classificazione Internazionale delle Malattie, IX revisione, Modificazione Clinica (ICD-9-CM). I tassi di mortalità, invece, sono riferiti ai decessi nella cui causa iniziale si ritrovano i codici 480-487 della Classificazione Internazionale delle Malattie, IX revisione (ICD-9) fino al 2002 e i codici J10- J18 della Classificazione Internazionale delle Malattie, X revisione (ICD-10) dal 2003 in poi.
Infine, sono stati consultati anche EuroMOMO, per quanto riguarda i dati sulla mortalità dalla stagione 2018/19 a quella 2021/22, Flunews Europa per la mortalità in relazione alle stagioni 2020/21 e 2021/22 e FluView Interactive/CDC, per i dati sulla mortalità dalla stagione 2018/19 alla stagione 2021/22.
Si riporta di seguito la descrizione, emersa dalla consultazione delle diverse fonti, del burden dell’influenza in termini di complicanze e mortalità. Per entrambe le fattispecie sono stati inseriti dei focus sulla popolazione adulta a rischio, sulla popolazione anziana e su quella pediatrica. La descrizione dei risultati parte dall’analisi dei dati sanitari disponibili per poi estendersi alle evidenze di letteratura internazionali e nazionali.
Per quanto riguarda la revisione delle review della letteratura internazionale, questa ha restituito 23 lavori eleggibili [8, 10-31]. I dettagli relativi alla selezione degli studi sono consultabili alla Figura 1.
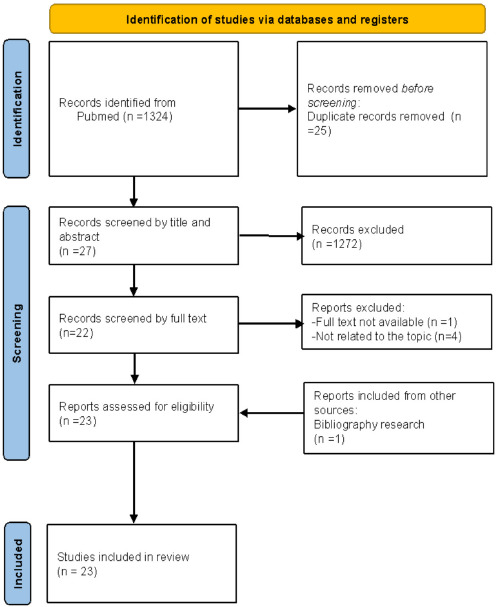
PRISMA flow diagram della revisione sistematica delle systematic review e metanalisi sul burden dell’influenza a livello internazionale.
Dei 23 lavori eleggibili, nove (39,1%) riguardano i pazienti pediatrici, due (8,7%) le donne in gravidanza, quattro (17,4%) i pazienti adulti ed anziani e, infine, otto (34,8%) tutte le età. Dei 23 lavori, 13 (56,5%) hanno valutato tra gli outcomes la mortalità, pertanto sono stati consultati per alimentare il sotto-capitolo di riferimento [8, 13, 15-16, 19-21, 24, 26, 28-31].
Per quanto riguarda l’aggiornamento della revisione italiana [8], è stato incluso un solo studio [32], che si è aggiunto ai 16 già ricompresi nella revisione di Giacchetta et al. del 2021. I dettagli relativi alla selezione degli studi sono consultabili alla Figura 2. Dei 17 lavori eleggibili, tre (17,6%) riguardano i pazienti pediatrici, sei (35,3%) i soggetti adulti ed anziani e otto (47%) tutte le età.
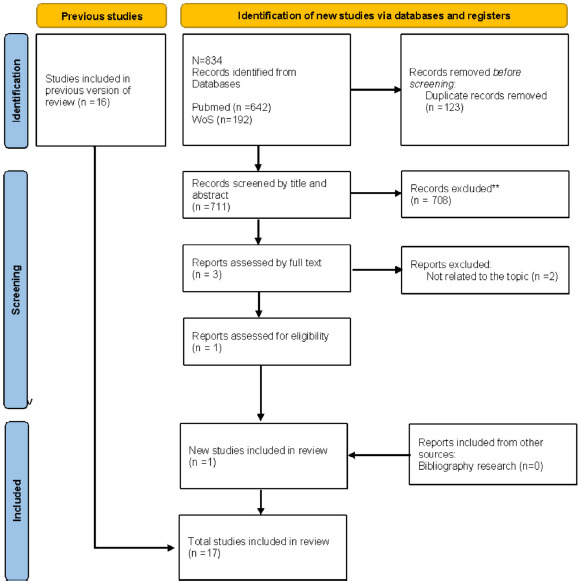
PRISMA flow diagram dell’aggiornamento della revisione di Giacchetta et al. (2021).
I dati nazionali, estrapolati dai rapporti FluNews, relativi ai casi gravi dovuti all’influenza, mettono in evidenza l’ampia variabilità registrata tra l’anno 2018/19 che conta 812 casi gravi, di cui l’83% con condizioni di rischio preesistenti, come il diabete, tumori, malattie cardiovascolari e/o respiratorie e obesità, e la stagione 2015/16 che ha fatto registrare il minor numero di casi gravi (89 casi). Nella stagione 2019/20, l’ultima di cui si dispone di dati, sono stati registrati 164 casi gravi, di cui l’82% aveva almeno una condizione di rischio preesistente [33]. In relazione ai sottotipi virali, durante le diverse stagioni influenzali i ceppi di tipo A hanno sempre dato il maggior contributo in termini di casi gravi (Tab. I). Si evidenzia, inoltre, come in entrambe le stagioni di cui sono disponibili i dati stratificati per classe di età, la maggior parte dei casi gravi si sia concentrata nella fascia al di sopra dei 64 anni e come circa l’80% dei casi abbia fatto registrare un’età superiore a 50 anni (Tab. II).
Casi gravi e deceduti suddivisi per stagione e sottotipo virale.
| Casi gravi | Di cui deceduti | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Stagione | N | (Sotto) tipo % | N | Letalità | (Sotto) tipo % | ||||||
| A(H1N1) | A(H3N2) | A ns | B | A(H1N1) | A(H3N2) | A ns | B | ||||
| 2013/14 | 93 | 48 | 26 | 14 | 12 | 16 | 17,2% | 69 | NA* | NA | NA |
| 2014/15 | 648 | 76 | 13 | 7 | 4 | 163 | 25,2% | 72 | 17 | 7 | 4 |
| 2015/16 | 89 | 70 | 9 | 4 | 17 | 32 | 36,0% | 56 | 16 | 15 | 13 |
| 2016/17 | 230 | 6 | 63 | 27 | 4 | 68 | 29,6% | 10 | 69 | 20 | 1 |
| 2017/18 | 764 | 52 | 21 | 9 | 37 | 173 | 22,6% | 49 | 0 | 7 | 44 |
| 2018/19 | 812 | 67 | 16 | 17 | 0 | 205 | 25,2% | NA | NA | NA | NA |
| 2019/20 | 169 | 51 | 22 | 18 | 7 | 35 | 20,7% | NA | NA | NA | NA |
NA: il Report 2013/14 di FluNews non riporta i dati stratificati per sottotipo, a eccezione del dato per A(H1N1).
Stratificazione dei casi gravi per classe di età e sotto(tipo) per le stagioni 2018/19 e 2019/20.
| Stagione | Età | N. totale (%) | H1N1 % | H3N2 % | A ns % | B % |
|---|---|---|---|---|---|---|
| 2018/2019 | 0-4 | 20 (3%) | 65% | 15% | 20% | 0% |
| 5-14 | 8 (1%) | 38% | 25% | 37% | 0% | |
| 15-49 | 138 (18%) | 72% | 4% | 23% | 1% | |
| 50-64 | 258 (33%) | 80% | 7% | 13% | 0% | |
| 65-74 | 199 (25%) | 65% | 18% | 17% | 0% | |
| 75+ | 164 (21%) | 47% | 36% | 17% | 0% | |
| 2019/2020 | 0-4 | 3 (2%) | 0% | 67% | 0% | 33% |
| 5-14 | 5 (3%) | 0% | 20% | 0% | 80% | |
| 15-49 | 26 (16%) | 62% | 15% | 12% | 11% | |
| 50-64 | 62 (37%) | 64% | 16% | 18% | 2% | |
| 65-74 | 36 (22%) | 50% | 25% | 19% | 6% | |
| 75+ | 35 (21%) | 32% | 31% | 34% | 3% |
Nonostante sia noto che un’ampia parte della popolazione pediatrica sia colpita dall’influenza, si conta, ogni anno, solo un esiguo numero di casi gravi. Secondo i dati di FluNews, infatti, nella stagione 2018/19, solo 20 casi gravi (3%) appartenevano alla fascia di età 0-4 anni; una situazione analoga si è presentata durante la stagione 2019/20 con soli 3 casi gravi (2%) in questa fascia di età. È da sottolineare, tuttavia, che, stando ai dati di ospedalizzazione riportati da HFA, la popolazione di età inferiore ai 14 anni fa registrare tassi di ospedalizzazione secondi solo alla fascia di popolazione anziana (Figg. 3A, B).
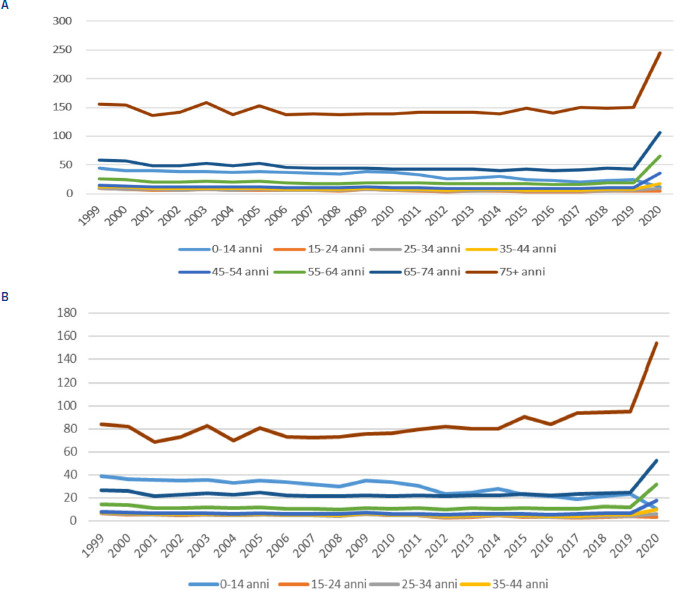
A. Tasso di ospedalizzazioni (su 10.000) per influenza e polmonite in Italia, per classe di età (maschi); B. Tasso di ospedalizzazioni (su 10.000) per influenza e polmonite in Italia, per classe di età (femmine).
La letteratura internazionale avvalora la necessità di non sottovalutare i dati relativi ai ricoveri legati all’influenza nella popolazione pediatrica, nonostante siano esigui rispetto all’incidenza dell’influenza nella stessa popolazione. Wang et al. hanno evidenziato che su circa 109,5 milioni casi di influenza tra i bambini di età inferiore ai 5 anni, 10,1 milioni hanno visto un interessamento delle vie respiratorie inferiori e 870.000 hanno portato al ricovero ospedaliero [29]. Un’altra revisione, effettuata su circa 8 milioni di soggetti, ha stimato che, nel 2008, in tutto il mondo, si sono verificati 90 milioni (95% CI 49-162 milioni) nuovi casi di influenza nei bambini con un’età inferiore ai 5 anni, di cui 20 milioni (13-32 milioni) di casi di infezioni acute delle basse vie respiratorie (ALRI) (13% di tutti i casi di ALRI in età pediatrica) e 1 milione di casi di ALRI gravi associate all’influenza (7% dei casi di tutte le ALRI gravi in età pediatrica) [20]. Si evidenzia, inoltre, come i bambini di età compresa tra 3 e 5 anni abbiano una incidenza maggiore di influenza rispetto ai bambini di età ≤ 2 anni, anche se la gravità dei sintomi e il rischio di ospedalizzazione sono maggiori per i bambini di età ≤ 2 [11]. Lo conferma anche il dato che riporta come la più alta incidenza di ricoveri per polmonite associata all’influenza nei bambini sia stata riscontrata in quelli di età inferiore a 2 anni (3,7 per 10.000 anni bambino) [25]. Si stima, inoltre, in riferimento alla popolazione con età inferiore ai 18 anni, che una percentuale variabile tra lo 0,3 e il 20% abbia necessitato di un ricovero, tra il 7 e il 55% abbia utilizzato antibiotici, mentre tra il 76 e il 99% abbia utilizzato farmaci antipiretici o altri farmaci per il sollievo dei sintomi [14]. Questi dati permettono di comprendere il peso economico e assistenziale, sia diretto che indiretto, legato all’influenza nella popolazione pediatrica, peso che ha spinto alcuni paesi ad adottare politiche di immunizzazione antinfluenzale per la popolazione pediatrica sana. Gli Stati Uniti, ad esempio, raccomandano, dal 2008, la vaccinazione annuale a tutti i bambini di età pari o superiore a 6 mesi, così come, tra gli altri, il Canada, Hong Kong, Singapore, la Finlandia, con delle differenze rispetto al limite di età superiore a cui la vaccinazione viene proposta. Nel Regno Unito, la Joint Commission on Vaccination and Immunization (JCVI) ha recentemente raccomandato l’estensione del programma di vaccinazione antinfluenzale ai bambini a basso rischio di età compresa tra 2 e 17 anni.
La letteratura nazionale ci permette di descrivere le principali complicanze legate all’influenza nella popolazione italiana di età inferiore a 14 anni visitati dal Pediatra di Libera Scelta (PLS) per sintomi di ILI: il 10,8% ha sviluppato un’otite media acuta, il 9% infezioni del tratto respiratorio inferiore, il 7,9% bronchite acuta, lo 0,7% respiro ansante e lo 0,4% polmonite [34]. Un altro studio ha esaminato un campione di soggetti di età inferiore ai 15 anni che si è rivolto al Pronto Soccorso (PS), evidenziando che le complicanze che portavano i pazienti in PS erano otite media (13,9%), bronchite (8,5%), polmonite (8,1%), respiro ansante (5,4%), bronchiolite (3,1%), croup (3,1%), esacerbazione dell’asma (2,2%) [35]. Anche le complicazioni di tipo neurologico, seppur non frequenti, sono descritte nella popolazione pediatrica italiana, dove, tra i pazienti con influenza associata a manifestazioni neurologiche, il 53,3% ha sviluppato un’encefalite da influenza [36].
Passando alla popolazione adulta, i dati FluNews sulle complicanze relative all’influenza, evidenziano come il 33 e il 37,1% dei casi gravi abbia mostrato un’età tra i 50 e i 64 anni rispettivamente nella stagione 2018/19 e 2019/20.
I tassi di ospedalizzazione per polmonite e influenza estratti da HFA mostrano, nella fascia di età 45-64 anni, valori due volte superiori negli uomini rispetto alle donne. I valori risultano maggiori nel sesso maschile rispetto a quello femminile anche nelle fasce di età inferiore sebbene meno marcatamente. Il Centre for Disease Control (CDC) mostra che, nella stagione 2017/18, il tasso di ospedalizzazioni legate all’influenza nella fascia di età 18-49 anni è stato di 55,7 su 100.000 abitanti; nella fascia di età successiva, quella 50-64 anni, è stato di 195 su 100.000 abitanti [5].
Di importante menzione con riferimento alla popolazione adulta italiana è lo studio di Sessa et al., a cui hanno partecipato 202 medici di medicina generale (MMG) che hanno effettuato, durante la stagione 2009/10, circa 270.000 visite, di cui oltre 6.000 per sintomi associabili a ILI. Lo studio ha stimato che circa il 20% dei pazienti fosse a rischio di complicanze influenzali, o in quanto over 65enne (12%) oppure perché presentante condizioni croniche concomitanti, quali disturbi respiratori, come asma o broncopneumopatia cronica ostruttiva (BPCO) (7,3%), malattie cardiache (6,0%) e diabete (3,2%). Il 35% dei pazienti ha presentato almeno una complicanza legata all’influenza e, tra questi, i pazienti con patologie croniche hanno avuto un rischio circa tre volte superiore di sviluppare complicazioni correlate all’influenza rispetto alla popolazione generale [Odds Ratio (OR) = 2,89; 95% IC: 2,44-3,41] [37].
Nell’ambito della popolazione adulta è inoltre interessante soffermarsi sulle donne in gravidanza, per cui è raccomandata la vaccinazione antinfluenzale; le donne gravide, infatti, hanno, in presenza di influenza, un rischio di ospedalizzazione maggiore (OR = 2,44; 95% IC: 1,22-4,87) rispetto alle donne non gravide [31].Una meta-analisi condotta nel 2021, inoltre, ha mostrato che l’infezione da virus dell’influenza è associata a un rischio più elevato di natimortalità (RR = 3,62; 95% IC: 1,60-8,20) [30].
Dai dati di FluNews è possibile apprezzare che oltre il 40% dei casi gravi ha un’età superiore a 65 anni. Anche i dati di HFA mostrano come, in entrambi i sessi, gli ultrasettantacinquenni abbiano tassi più alti di ospedalizzazione per polmonite e influenza (Figg. 3A, B), con un picco in corrispondenza dell’anno 2020, sia nella fascia degli ultrasettantacinquenni, che in quella relativa agli individui di età compresa tra 65 e 74 anni, aumento verosimilmente da imputare alle polmoniti da COVID-19.
Una recente revisione di letteratura ha messo in evidenza la particolare vulnerabilità della popolazione anziana all’influenza e il carico clinico che l’influenza comporta in questa fascia di età; si è evidenziato, infatti, che, dal 2011 al 2018, oltre il 60% dei ricoveri totali per influenza si verifica in persone di età maggiore a 60 anni [16]. A livello nazionale, dallo studio di Sessa et al. è possibile stimare che la frequenza di complicanze nei soggetti anziani è pari al 57,8% [37]. L’importante coinvolgimento della popolazione anziana è sicuramente legato al peculiare stato di salute di questa popolazione, caratterizzato in circa il 60% della popolazione over 65 da almeno una comorbosità [7]. Sempre a livello nazionale, lo studio di Manzoli et al. merita particolare menzione poiché ha visto il coinvolgimento di 414 MMG e due Aziende Sanitarie Locali (ASL), riuscendo a reclutare un campione di 32.457 anziani, con una copertura vaccinale del 66,2%; in questo campione il tasso di ospedalizzazione per influenza è risultato pari a 0,22 per 1.000 abitanti. Per quanto riguarda la polmonite i tassi di ospedalizzazione sono risultati pari a 4,2-6,5 per 1.000 abitanti [38].
I dati FluNews relativi ai decessi per influenza confermata in Italia mostrano un’ampia variabilità tra le differenti stagioni: 16 decessi nella stagione 2013/14, 163 nella 2014/15, 32 nella 2015/16, 68 nella 2016/17, 173 nella 2017/18, 205 nella 2018/19, e 35 nella 2019/20 [33], con una letalità tra i casi gravi che varia dal 17,20% della stagione 2013/14, al 35,95% della stagione 2015/16. Condizioni di rischio preesistenti (diabete, tumori, malattie cardiovascolari, malattie respiratorie croniche, obesità, ecc.) sono state riportate tra i casi deceduti in una percentuale variabile dall’83% nella stagione 2016/17 al 97% nella stagione 2019/20 [39]. Nelle stagioni dalla 2013/14 alla 2018/19 la maggior parte dei decessi sono stati determinati dal virus influenzale di tipo A, sottotipo H1N1, con eccezione della stagione 2016/17 in cui la maggior parte dei decessi è stata determinata dal virus influenzale di tipo A, ma sottotipo H3N2 [40].
Menzione a parte meritano le stagioni 2020/21 e 2021/22, in cui, nonostante una bassa incidenza dell’influenza, EuroMOMO ha evidenziato un aumento sostanziale dell’eccesso di mortalità, principalmente tra le persone di età ≥ 45 anni, in particolare al di sopra dei 65 anni. Questi dati sono verosimilmente da attribuire al COVID-19 che ha determinato un aumento della mortalità per tutte le cause [41, 42]. Anche nella stagione 2021/22 la circolazione dell’influenza continua ad essere sporadica [43] con una maggiore frequenza dell’influenza di tipo A rispetto al tipo B. Dal momento che le manifestazioni cliniche dell’influenza e dell’infezione da SARS-CoV-2 sono simili, la segnalazione delle cause dei decessi nel sistema di sorveglianza è stata modificata per le stagioni influenzali 2020/21 e 2021/22, creando una classificazione unica P.I.C. (polmonite, influenza e/o COVID-19). Nella settimana 1/2021 il sistema FluView Interactive ha registrato il valore più alto di decessi identificato per P.I.C., pari a 25.972 casi, di cui solo 32 dovuti ad influenza; di questi, 23 decessi sono avvenuti nella fascia over 65 anni [44]. In Italia, in linea con l’andamento globale dei decessi, la mortalità totale della stagione 2020/21 è stata molto superiore al dato atteso, mentre è stata lievemente superiore all’atteso la mortalità della stagione 2021/22 [33].
Dall’archivio HFA il tasso di mortalità standardizzato per età per polmonite ed influenza, in maschi e femmine, nella stagione 2018/19 è pari a 2,37/10.000, leggermente superiore rispetto al tasso del 2017/18 pari a 2,33/10.000 [45].
I flussi di dati che descrivono la mortalità in età pediatrica relativa all’influenza sono esigui: non ci sono, infatti, informazioni attualmente disponibili sui decessi tra i casi gravi nella popolazione pediatrica né sulla stratificazione per sottotipo virale per le stagioni 2020/21 e 2021/22 o per le stagioni precedenti. Dall’archivio HFA i dati relativi alla mortalità per 10.000 si attestano, all’ultimo anno disponibile, sullo 0,01 nei soggetti maschi tra 0 e 14 anni e sullo 0,02 nei soggetti di sesso femminile della stessa età (Fig. 4A, B).
A. Andamento del tasso di mortalità (per 10.000) per fasce di età nel genere maschile. B. Andamento del tasso di mortalità (per 10.000) per fasce di età nel genere femminile.
Nel 2018, la revisione di Wang. et al, già citata precedentemente, ha stimato che, tra 870.000 bambini ricoverati per influenza, 34.800 sono deceduti [29]. Le stime globali sulla mortalità pediatrica suggeriscono che il più alto tasso di decessi causati dall’influenza si riscontri nella fascia di età compresa tra un mese e 12 mesi, tanto che l’influenza è causa del 2,8% di tutti i decessi in questa fascia di età, in tutto il mondo [21]. Bisogna tuttavia considerare che nella fascia di età al di sotto dei 5 anni, ed in particolare sotto all’anno di età, i ricoveri per patologie respiratorie gravi sono dovuti anche ad altri virus, come l’RSV (Respiratory Syncytial Virus). Anche nella popolazione pediatrica, le comorbosità come asma, disturbi neurologici, malattie cardiovascolari e malattie renali, possono essere causa di aumentato rischio di morte correlata all’influenza. Oltre ai fattori di rischio clinici possono esistere fattori immunologici, genetici, demografici (età, sesso, provenienza sociale e geografica) che predispongono a forme gravi di infezione e relative complicanze, fino al decesso [46]. A livello nazionale, lo studio di Rosano et al. ha cercato di stimare il numero di decessi attribuibili all’influenza e i tassi di mortalità (per 100.000) in Italia nelle stagioni 2013/14, 2014/15, 2015/16 e 2016/17 anche per la popolazione pediatrica (Tab. III) [47].
Tasso di mortalità (per 100.000, 95% CI) in Italia nelle stagioni influenzali 2013/14-2016/17 (da: Rosano et al., 2019, mod.) 47.
| 0-4 anni | 5-14 anni | 15-64 anni | 65+ anni | Totale | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Stagione | Sottotipo circolante | N. | Tasso (per 100.000) | N. | Tasso (per 100.000) | N. | Tasso (per 100.000) | N. | Tasso (per 100.000) | N. | Tasso (per 100.000) |
| 2013/14 | A | 10 | 0,37 | 21 | 0,36 | 831 | 2,11 | 8.460 | 65,01 | 7.027 | 11,56 |
| B | 3-20 | 0,1-0,7 | 11-32 | 0,2-0,5 | 406-963 | 1,8-2,4 | 7.183-9.803 | 55,2-75,3 | 5.785-8.347 | 9,5-13,7 | |
| 2014/15 | A | 28 | 1,05 | 5 | 0,08 | 1364 | 3,48 | 19.475 | 147,32 | 20.259 | 33,32 |
| B | 19-39 | 0,-1,5 | 3-8 | 0-0,1 | 1138-1602 | 2,9-4,1 | 16.542-22.567 | 125,1-170,7 | 18.506-22.064 | 30,4-36,3 | |
| 2015/16 | A | 0 | 0 | 15 | 0,27 | 977 | 2,5 | 10.270 | 76,81 | 15.801 | 26,05 |
| B | 0-4 | 0-0,1 | 8-23 | 0,1-0,4 | 815-1148 | 2,1-2,9 | 8.723-11.900 | 65,2-89,0 | 14.434-17.293 | 23,8-28,4 | |
| 2016/17 | A | 38 | 1,54 | 13 | 0,23 | 675 | 1,74 | 19.404 | 143,43 | 24.981 | 41,23 |
| B | 26-53 | 1-2,1 | 7-20 | 0,1-0,4 | 563-793 | 1,4-2,0 | 17.599-21.267 | 130,1-157,7 | 23.001-27.014 | 38,0-44,6 | |
Dagli archivi FluNews Italia si evince che, nella stagione 2017/18, il 90% dei decessi, su un totale di 173, si è verificato in soggetti di età superiore ai 25 anni. In 13 (7,51%) casi i soggetti deceduti non presentavano condizioni di rischio preesistenti e due donne (1,15%) erano in stato di gravidanza. In 84 casi (49% dei decessi totali) è stato isolato il virus A/H1N1pdm09, in 76 casi (44% dei decessi totali) il virus B e in 13 casi (7% dei decessi totali) il virus A/non sottotipizzato. Nella stagione 2018/19 si sono verificati 205 decessi, l’89% dei quali in soggetti di età pari o superiore a 50 anni; il 90% dei soggetti deceduti era affetto da almeno una condizione di rischio preesistente. Per le stagioni 2019/20, 2020/21 e 2021/22 non sono disponibili dati specifici nei soggetti adulti-anziani; si è però riscontrato un aumento dei decessi totali, verosimilmente riconducibili alla diffusione dell’infezione da SARS-CoV-2 [48].
I dati HFA più aggiornati sul tasso di mortalità per polmonite ed influenza restituiscono valori di 1,87 su 10.000 nei soggetti di sesso maschile nella fascia di età 65-74 anni e pari a 20,56 su 10.000 nei soggetti di sesso maschile over 75 anni; nei soggetti di sesso femminile si registrano invece rispettivamente valori di 0,89 su 10.000 e 16,78. I tassi di mortalità risultano invece inferiori nelle fasce di età adulta (Fig. 4A, B).
Secondo i dati del CDC, nella stagione 2018/19, l’influenza ha interessato circa 29 milioni di persone negli Stati Uniti, con 28.000 decessi ed un tasso di mortalità, per 100.000 abitanti, di 1,1 nella fascia 0-4 anni, 0,3 nella fascia 5-17 anni, 1,2 nella fascia 18-49 anni, 7,0 nella fascia 50-64 anni, 40,5 nella fascia over 65 anni [5, 49-50]. Il progetto GBD stima che quasi 2 milioni dei 2,74 milioni di decessi associati a infezioni del tratto respiratorio inferiore interessino le popolazioni adulte con comorbosità e che il 10% possa essere attribuito all’influenza [51].
Studi condotti in Italia durante il periodo 1970-2001 hanno stimato tassi di mortalità in eccesso correlabili all’influenza ed alla polmonite pari a 1,9-2,2 per 100.000 abitanti e tassi di mortalità in eccesso per tutte le cause pari a 11,6-18,6 per 100.000 abitanti [52]. Durante lo stesso periodo, i tassi di mortalità in eccesso negli anziani sono risultati rispettivamente 13,3 su 100.000 abitanti per polmonite e influenza e 91,1 su 100.000 abitanti per tutte le cause [53]. Per le stagioni dal 2013/14 al 2016/17, il tasso di mortalità in eccesso correlato all’influenza, stimato utilizzando l’algoritmo FluMOMO, basato sull’attività influenzale settimanale e la temperatura ambientale, variava da 11,6 a 41,2 su 100.000 nella popolazione generale e da 65,0 a 147,3 per 100.000 negli anziani [47].
Dalle evidenze di letteratura emerge che in Italia, per i soggetti over 65, il rischio di morte per influenza e per complicanze respiratorie legate all’influenza è di 3,6-4,8 volte superiore a quello della restante popolazione contagiata con l’influenza stagionale [54]. Gli over 85, in particolar modo, hanno un rischio aumentato di decesso intraospedaliero in seguito ad infezione da virus influenzale con valori di circa il 14% [55]. Lo studio di Boattini ha analizzato 197 soggetti con polmonite e influenza A e 85 soggetti con polmonite e influenza B, entrambi con età media di 68 anni, ricoverati in tre ospedali del Portogallo, dell’Italia e di Cipro constatando nei due gruppi una letalità intraospedaliera rispettivamente del 17,3 e del 15,3% [32]. Questi dati sono inferiori rispetto a quelli relativi alla letalità dei casi gravi (variabile tra il 17,2 e il 36,0%) ma tale differenza è verosimilmente imputabile alla severità dei casi considerati. I soggetti a maggior rischio di decesso sono risultati quelli sottoposti a ventilazione non invasiva, indipendentemente dalla presenza di comorbosità [32].
La letteratura, inoltre, mette in relazione l’aumento della mortalità da influenza con il sopraggiungere di complicanze cardiologiche; si evidenzia infatti come il soggetto con influenza colpito da infarto acuto del miocardio (IMA) abbia un aumentato rischio di morte (OR = 1,30; 95% IC: 1,08-1,56) rispetto al soggetto non affetto da influenza; si è ipotizzato infatti che trigger comuni come freddo, stress, affollamento o inquinamento, tipici della stagione invernale, potrebbero facilitare l’infezione da virus influenzale che agirebbe da fattore di rischio per IMA, o, viceversa, che i soggetti con IMA siano maggiormente suscettibili ad influenza e a morte correlata all’infezione, in quanto soggetti fragili [24].
Infine, per quanto riguarda la popolazione in gravidanza, sebbene dalla letteratura emerga un aumentato rischio di ospedalizzazione, tuttavia il rischio di mortalità risulta sovrapponibile alle donne non gravide (OR = 1,04; IC: 95% 0,81-1,33) [31].
L’influenza si configura come una malattia prevenibile da vaccino ad alto impatto sulla salute di popolazione in tutte le fasce di età. Infatti, se da una parte emerge chiaramente come il maggior burden di malattia si rifletta sulla popolazione anziana, dall’altra è possibile sottolineare come l’influenza possa determinare in particolare complicanze ed ospedalizzazioni anche nella fascia pediatrica e adulta.
I casi gravi riportati nell’archivio FluNews riguardano per oltre il 40% soggetti anziani e per una quota minimale soggetti in età pediatrica. I casi gravi presentano comunemente comorbosità sottostanti e fanno registrare alti valori di letalità. Il rischio di decesso aumenta comunque in maniera rilevante nei soggetti anziani. Gli stessi dati disponibili dall’Istat mettono chiaramente in risalto questo aspetto, con valori di mortalità per polmonite e influenza pari a 0,01-0,02 per 10.000 nei soggetti di età pediatrica e a 16,78-20,56 su 10.000 nei soggetti al di sopra dei 75 anni.
Similmente nella fascia di età anziana si registrano i tassi maggiori di ospedalizzazione per influenza e polmonite sebbene immediatamente seguiti dai soggetti di età compresa tra 0 e 14 anni. Nella fascia di età pediatrica il maggior rischio di complicanze e ospedalizzazioni si registra al di sotto dei due anni, mentre quello di decesso al di sotto di un anno di età.
Per quanto riguarda la popolazione adulta, rilevanti risultano le condizioni di comorbosità, che aumentano significativamente il rischio di complicanze fino a tre volte, e lo status di gravidanza che si associa a un aumentato rischio di ospedalizzazione in caso di influenza.
Negli ultimi anni la ricerca in ambito di prevenzione dell’influenza ha portato allo sviluppo di numerosi vaccini con l’obiettivo di avere a disposizione prodotti sempre più sicuri ed efficaci, appositamente studiati per le diverse fasce di età al fine di massimizzare i risultati in termini di salute e qualità di vita, di risparmio economico e assicurare un’adeguata protezione per l’intera collettività [1-5].
Poiché il presente report di Health Technology Assessment (HTA) ha l’obiettivo di aggiornare un precedente report sul vaccino quadrivalente a dosaggio standard (15 μg) prodotto su coltura cellulare (cell culture-based Quadrivalent Influenza Vaccine, QIVc) per il cambiamento dell’indicazione terapeutica (abbassamento dell’età raccomandata - da ≥ 9 anni a ≥ 2 anni) [6] e per l’acquisizione di nuove evidenze, il presente capitolo ha lo scopo di fornire al lettore una overview sulle alternative al QIVc attualmente disponibili in Italia accennando al loro meccanismo d’azione, all’immunogenicità, all’efficacia, all’effectiveness e alla sicurezza.
Considerando i molteplici vaccini disponibili, un’accurata revisione sistematica sull’argomento risulterebbe insostenibile nell’ambito del presente report e non utile per lo scopo dello stesso; pertanto, è stato deciso di effettuare una valutazione critica delle revisioni sistematiche e/o meta-analisi per ottenere una panoramica dei numerosi studi sperimentali e osservazionali pubblicati per permettere un confronto circostanziato con il vaccino oggetto di studio (capitolo 4).
Nel 1933 fu isolato il primo virus influenzale A e nel 1936 fu realizzato il primo vaccino antinfluenzale con virus vivo attenuato.
Nel 1940, fu scoperto e isolato un nuovo virus influenzale denominato “influenza B” e, da quel momento, apparve evidente la necessità di un vaccino antinfluenzale bivalente per fornire un’adeguata protezione contro entrambi i ceppi virali [1-5].
Nel 1945 fu autorizzato negli Stati Uniti il primo vaccino antinfluenzale bivalente [7]. Successivamente, nel 1958 fu isolato il virus A/H2N2 e dieci anni dopo il ceppo A/H3N2. L’estrema variabilità dei virus influenzali fece comprendere ai ricercatori la necessità di un aggiornamento regolare della composizione dei vaccini antinfluenzali, selezionando i ceppi virali in base alla loro circolazione nell’uomo. Di conseguenza, il vaccino divenne trivalente dal 1968 e conteneva due ceppi del virus A (H1N1 e H3N2) e l’unico ceppo B a quel tempo conosciuto [1-5, 7].
Furono seguite due linee di sviluppo: una basata sull’utilizzo di virus vivi attenuati e l’altra basata su vaccini inattivati o uccisi. Successivamente, la manipolazione genetica dei ceppi influenzali permise la crescita relativamente rapida del virus in uova embrionate di pollo [1-5, 7, 8].
Dal 1971 la manipolazione genetica fu utilizzata per la produzione dei vaccini stagionali e, in seguito, furono utilizzate nuove tecnologiche come la centrifugazione zonale e la frammentazione del virus con etere al fine di concentrare il più possibile gli antigeni e limitare al minimo la presenza di sostanze estranee [1-5, 7].
Dal 1973 l’Organizzazione Mondiale della Sanità (OMS) pubblica annualmente le raccomandazioni contenenti la composizione dei vaccini influenzali per la stagione successiva, sulla base delle informazioni epidemiologiche e virologiche acquisite dalla rete dei laboratori accreditati a livello mondiale. Tale sistema permette di monitorare costantemente l’andamento epidemiologico globale dell’influenza e di individuare precocemente le varianti antigeniche che con maggiore probabilità domineranno nello scenario epidemiologico futuro. Il vaccino è, pertanto, allestito con una visione prospettica.
Dal 1999 l’OMS pubblica due raccomandazioni annuali, una per l’emisfero nord a febbraio e l’altra per l’emisfero sud a settembre; queste indicazioni sono fornite con sufficiente anticipo in modo da consentire alle aziende produttrici di allestire il vaccino in tempo utile per la stagione influenzale [7, 9]. È importante sottolineare che a causa dell’estrema variabilità dei virus influenzali, le mutazioni dei ceppi circolanti possono determinare una riduzione dell’efficacia vaccinale sul campo (effectiveness) dovuta alla mancata corrispondenza tra i ceppi circolanti e i ceppi contenuti nei vaccini. Questo fenomeno è definito “mismatch” ed è alla base del razionale che ha portato allo sviluppo dei vaccini quadrivalenti [1-5, 7] contenenti, oltre ai ceppi A/H1N1 e A/H3N2, i due lineages B attualmente conosciuti. Prima del 1985, circolava un unico lineage B; nel 1987 comparve nella scena epidemiologica il virus B/Victoria/2/87 che rimpiazzò il precedente virus B in tutto il mondo e dominò per diversi anni prima della comparsa, negli anni ’90, del ceppo B/Yamagata/16/88. Per un decennio, il ceppo Yamagata dominò in tutto il mondo, ma nel 2002 il ceppo Victoria ricomparve e, inaspettatamente, il nuovo virus non sostituì il precedente e i due ceppi iniziarono a co-circolare [1-5, 7]. Attualmente, il ceppo B dominante varia in base alla stagione e all’area geografica. Per questa ragione, è evidente come sia difficile prevedere quale ceppo B circolerà durante la stagione influenzale successiva e, di conseguenza, dal decennio 2000-2010 le aziende produttrici hanno iniziato a sviluppare vaccini quadrivalenti con l’obiettivo di superare il problema del mismatching dei lineages B, fenomeno osservato di frequente nel mondo [1-5, 10-14].
In Italia, il primo vaccino quadrivalente prodotto su uova (egg-based Quadrivalent Influenza Vaccine, QIVe) è stato commercializzato nella stagione ٢٠١٥/16 [15]. Di conseguenza, dalla stagione successiva 2016/2017 i vaccini trivalenti a dosaggio standard non adiuvanti (TIVe) non sono stati più utilizzati dalla Sanità Pubblica.
Sebbene l’influenza colpisca soggetti di tutte le fasce d’età, alcune categorie presentano un maggior rischio di infezione come i bambini e gli adolescenti (capitolo 1) e altre una probabilità maggiore di sviluppare complicanze (bambini di età ≥ 5 anni, soggetti con patologie croniche e anziani (capitolo 2). Pertanto, risulta evidente che per ottenere il massimo beneficio in termini di prevenzione occorra sviluppare vaccini tailor-made per ogni gruppo di popolazione in grado di offrire il risultato migliore in termini di immunogenicità, efficacia e sicurezza.
Relativamente alla popolazione pediatrica un vaccino vivo attenuato quadrivalente (Q/LAIV) a somministrazione spray nasale è attualmente disponibile per i soggetti d’età compresa tra 2 e 18 anni [16]. Il razionale alla base dello sviluppo dei vaccini LAIV è mimare la risposta immunitaria indotta dall’infezione naturale considerata il “gold standard” in termini di immunità, poiché può generare una protezione capace di persistere per tutta la vita [4, 17, 18]. Dopo la somministrazione, a seguito della replicazione virale, il vaccino genera una sensibilizzazione del tessuto linfoide associato alla mucosa nasale e tonsillare [4, 18]. Questi tessuti sono un importante reservoir di cellule B e T che una volta attivate, generano una potente risposta immunitaria sia locale che sistemica [4, 17, 18]. Le cellule B attivate eseguono lo switch isotipico a plasmacellule e sono in grado di produrre anticorpi. Gli anticorpi della classe IgA giocano un ruolo fondamentale per la protezione a livello delle mucose delle alte vie respiratorie, avendo capacità di bloccare il virus nei siti d’ingresso nell’organismo [4, 17-21]. L’induzione della risposta anticorpale IgA mucosale da parte del LAIV potrebbe essere un indicatore di immunogenicità superiore rispetto agli anticorpi sierici [4, 17].
Le plasmacellule secernono anche IgG ed IgM nella circolazione sistemica. Gli anticorpi di tali classi giocano un ruolo protettivo anche per le vie aeree inferiori.
La risposta umorale e cellulare B della memoria è rilevabile per un periodo dai 6 ai 12 mesi dal vaccino, indice di una protezione per l’intera stagione influenzale [4, 17].
A differenza dei vaccini antinfluenzali inattivati, il vaccino LAIV induce un’ampia risposta cellulare T CD4+, TCD8+ e γδTCR [4, 17, 22]. Tra le modalità con cui viene esplicata la protezione da parte delle cellule T, oltre all’attivazione delle cellule B, del complemento e all’azione citotossica, vi è anche l’azione di inibizione della replicazione virale indotta dall’IFN-γ [4, 17, 18]. I benefici della risposta T cellulare permettono di raggiungere l’immunità di gregge, la protezione contro lo shift antigenico e contro il drift antigenico nel caso di eventi pandemici grazie ad una azione di cross-protezione anche tra nuove varianti di ceppi simili non contenute nel vaccino, come avvenuto nella pandemia A/H1N1 del 2009 [4, 17, 18].
In Europa, il vaccino LAIV è stato autorizzato nel 2011e la formulazione quadrivalente è disponibile dalla stagione influenzale 2014/2015 ma, in Italia, solo dalla stagione 2021/22 il vaccino è disponibile sull’intero territorio nazionale [23].
Relativamente alla popolazione anziana, la causa principale associata ad un maggior rischio di malattia severa e ad una risposta non ottimale alla vaccinazione è l’immunoscenenza. In tale fenomeno sono implicate sia l’immunità innata che quella adattativa [24-26]. Al fine di migliorare l’immunogenicità e l’efficacia vaccinale in questo gruppo di popolazione, negli anni sono state investigate diverse linee di ricerca: lo sviluppo di sistemi adiuvanti, l’incremento della dose di antigene, la somministrazione di una dose booster, la somministrazione del vaccino per via intradermica e altre tecnologie come i vaccini virosomali. Le due linee di ricerca più promettenti hanno portato all’autorizzazione di vaccini appositamente studiati per la popolazione anziana: il vaccino adiuvato con MF-59, attualmente disponibile nella sua formulazione quadrivalente (aQIV) [5, 27, 28] e il vaccino ad alto dosaggio di antigene anch’esso disponibile in Italia nella formulazione quadrivalente (QIV-HD) [24, 29].
Il sistema adiuvante MF59® è stato sviluppato alla fine degli anni ’80 ed è stato il primo adiuvante, dopo l’alluminio, approvato per la sua potente azione immunostimolante e per il suo buon profilo di sicurezza e tollerabilità [3, 5, 28, 30, 31]. MF-59® è un’emulsione olio (squalene) in acqua, dove lo squalene è microfluidizzato nel tampone citrato, creando particelle di circa 160 nm di diametro. Le particelle sono in sospensione grazie all’azione di due surfattanti, Span 85 e Tween 80. Questi ultimi sono di origine vegetale e largamente utilizzati nell’industria cosmetica, farmaceutica e alimentare [3, 5, 32]. Lo squalene è un componente naturale delle membrane cellulari sia vegetali sia animali e, pertanto, è un composto totalmente biocompatibile e biodegradabile. Inoltre, il composto è introdotto nell’organismo umano con gli alimenti (50-200 mg al giorno) [3, 5, 28, 30, 31]. Il meccanismo d’azione di MF59® è molteplice e ampiamente studiato. L’effetto adiuvante si ottiene attraverso l’attivazione dei monociti, dei macrofagi e delle cellule dendritiche. Quest’ultime rispondono allo stimolo rilasciando diverse chemochine, le quali attraggono le cellule immunocompetenti (es. i monociti e granulociti) nel sito di iniezione. I monociti e granulociti producono a loro volta gli stessi fattori, amplificando la risposta immune. Inoltre, è stato dimostrato che MF59® incrementa e accelera la differenziazione cellulare verso le cellule dendritiche, alterando il loro fenotipo. Un maggior numero di cellule disponibili consente un trasporto più efficace ed efficiente dell’antigene ai linfonodi, dove si innesca la risposta immunitaria tramite l’attivazione dei linfociti B (produzione di anticorpi) e T (immunità cellulo-mediata) [3, 5]. Infine, MF59® incrementa il repertorio di anticorpi, inducendo una notevole immunogenicità crociata legata alla capacità di indurre più cloni di anticorpi contro la subunità 1 dell’emoagglutinina (HA1), la quale contiene la maggior parte degli epitopi neutralizzanti. Quindi, la presenza di anticorpi contro i diversi epitopi di HA1 correla con la neutralizzazione cross-clade e, di conseguenza determina una protezione più ampia, rispetto ai vaccini non adiuvati, verso ceppi antigenicamente diversi e/o driftati [3, 5]. Il vaccino aQIV è stato autorizzato in Europa nel 2020 ed è disponibile su larga scala in Italia dalla stagione 2021/22 [23].
Relativamente al vaccino QIV-HD l’incremento della dose di antigene si è dimostrata una strategia vincente. Infatti, numerosi studi hanno mostrato che l’aumento della quantità di emoagglutinina (HA) può innescare una risposta anticorpale più robusta [33-36]. Nello specifico, dosi di 60 μg di HA per singolo ceppo si sono dimostrate sicure nei soggetti anziani stimolando risposte sieriche anticorpali più alte [33-36]. Ci si attende che un incremento di anticorpi nel siero sia correlato ad una migliore efficacia. Sulla base dei risultati ottenuti con i Randomized Clinical Trials (RCTs) [37-40], nel 2009 la Federal Drug Admistration (FDA) statunitense ha autorizzato l’utilizzo del TIV-HD attraverso un processo accelerato di approvazione [21]. Al fine di offrire una più ampia protezione anche nei riguardi dei ceppi virali B è stato sviluppato il QIV-HD disponibile in Italia dalla stagione 2020/2021 [29].
Un altro aspetto importante da considerare, nell’ottica del miglioramento dei vaccini influenzali è cercare di superare le criticità legate alla crescita dei virus influenzali in uova embrionate di pollo associate principalmente al possibile sviluppo di mutazioni adattative del virus influenzale umano durante la crescita nelle uova (fenomeno egg-adaptive) [41-45], alla produzione relativamente lenta che richiede elevate quantità di uova embrionate, al tasso di produzione imprevedibile e altamente variabile da ceppo a ceppo [1, 41] e ai processi di manipolazione aperti che potrebbero aumentare il rischio di contaminazione ed esposizione pericolose ad aerosol. In risposta a queste esigenze, sono state studiate piattaforme alternative come raccomandato dall’OMS [46].
Nei primi anni 2000 la ricerca si è concentrata sulle piattaforme di coltura cellulare. La linea cellulare MDCK si è dimostrata idonea perché altamente selettiva per la crescita dei virus influenzali con proprietà ottimali anche per la replicazione dei virus A/H3N2. Inoltre, poiché la crescita delle cellule MDCK e la propagazione dei virus influenzali avvengono in bioreattori (o fermentatori chiusi) il rischio di contaminazione è minimo (vedi capitolo 4). QIVc è stato approvato nel 2016 negli Stati Uniti e nel 2018 nell’Unione Europea [1, 6] (capitolo 4).
Un ulteriore approccio per rispondere alle criticità legate all’utilizzo delle uova embrionate di pollo ha previsto il ricorso a proteine ricombinanti dell’emoagglutinina prodotte in cellule di insetti utilizzando l’espressione del baculovirus [44, 47-49]. I baculovirus si trovano in natura nelle verdure a foglia verde che sono consumate comunemente dalla popolazione tramite la dieta [49]. Nello specifico, la tecnologia a DNA ricombinante prevede la produzione di una proteina di un agente infettivo senza ricorrere all’impiego del microrganismo selvaggio, applicando tecniche di ingegneria genetica che frammentano il DNA corrispondente e lo esprimono in diversi vettori “in vitro”. Si producono in tal modo grandi quantità di emoagglutinina da un’unica proteina. In particolare, partendo dalla sequenza genica della proteina, si produce l’emoagglutinina ricombinante (rHA) espressa su baculovirus. I nuovi processi disponibili che consentono la produzione di vaccini ricombinanti, non solo eliminano la possibilità di insorgenza di mutazioni associate alla propagazione del virus nelle uova, ma offrono anche ulteriori vantaggi: una maggiore velocità di produzione con una maggiore resa complessiva e la capacità di annullare il potenziale rischio di allergie all’ovoalbumina nei soggetti atopici [50, 51]. Nel 2013, la FDA ha annunciato l’approvazione del primo vaccino influenzale trivalente sviluppato utilizzando come sistema di espressione il baculovirus e la tecnologia del DNA ricombinante. A seguire è stata approvata la formulazione quadrivalente disponibile per i soggetti da 18 a 49 anni di età e dal 2017 il vaccino è disponibile in U.S.A. Nel 2020 il vaccino ricombinante è stato approvato anche in Europa per i soggetti di età > 18 anni (QIVr) [52].
La Tabella I riporta i vaccini disponibili in Italia suddivisi per fasce d’età.
Vaccini antinfluenzali disponibili in Italia per gruppi di età.
| Età | Vaccini somministrabili | Opzioni per la scelta del vaccino |
|---|---|---|
| 6 mesi-9 anni |
|
Per la fascia d’età 6 mesi - 6 anni l’OMS raccomanda l’uso |
| di formulazioni specifiche per l’età pediatrica | ||
| 2-9 anni |
|
Per la fascia d’età 6 mesi - 6 anni l’OMS raccomanda l’uso |
| di formulazioni specifiche per l’età pediatrica | ||
| 10-9 anni |
|
Per la fascia d’età 6 mesi - 6 anni l’OMS raccomanda l’uso |
| di formulazioni specifiche per l’età pediatrica | ||
| 18-64 anni |
|
QIVe, QIVc e QIVr sono i prodotti utilizzabili |
| ≥ 65 anni |
|
aQIV e QIV-HD sono specificatamente indicati nella popolazione over 65 |
Il 25 febbraio 2022 l’OMS ha emanato le raccomandazioni per la composizione dei vaccini antinfluenzali per la stagione 2022/2023 riferiti all’emisfero settentrionale [53]. Nello specifico:
vaccini ottenuti in uova embrionate di pollo:
A/Victoria/2570/2019 (H1N1)pdm09-like virus,
A/Darwin/9/2021 (H3N2)-like virus,
B/Austria/1359417/2021-like virus (lineaggio B/Victoria),
B/Phuket/3073/2013-like virus (lineaggio B/Yamagata);
vaccini ottenuti su colture cellulari o vaccini ricombinanti:
A/Wisconsin/588/2019 (H1N1)pdm09-like virus,
A/Darwin/6/2021 (H3N2)-like virus,
B/Austria/1359417/2021-like virus (lineaggio B/Victoria),
B/Phuket/3073/2013-like virus (lineaggio B/Yamagata).
Attualmente, tre brand sono registrati, di cui due QIVe a virus frammentato e uno a subunità. Le loro caratteristiche principali sono riportate in Tabella II [54-56].
Caratteristiche dei vaccini quadrivalenti non adiuvati prodotti su uova a dosaggio standard disponibili in Italia.
| Caratteristica | Fluarix® Tetra [54] | Vaxigrip Tetra® [55] | Influvac® S Tetra [56] |
|---|---|---|---|
| Denominazione | Vaccino influenzale quadrivalente inattivato, virus split (frammentato) | Vaccino influenzale quadrivalente inattivato, antigene di superficie | |
| Composizione antigenica | Virus frammentati di quattro ceppi virali (coltivati in uova embrionate di pollo) appartenenti a A/H1N1pdm09, A/H3N2, B/Victoria e B/Yamagata (aggiornati di anno in anno a seconda delle raccomandazioni dell’OMS per l’Emisfero Nord) in quantità di 15 μg di emoagglutinina di ciascun ceppo | Antigeni di superficie (emoagglutinina e neuraminidasi) di quattro ceppi virali (coltivati in uova embrionate di pollo) appartenenti a A/H1N1pdm09, A/H3N2, B/Victoria e B/Yamagata (aggiornati di anno in anno a seconda delle raccomandazioni dell’OMS per l’Emisfero Nord) in quantità di 15 μg di emoagglutinina di ciascun ceppo | |
| Adiuvante | Nessuno | ||
| Eccipienti | Cloruro di sodio, sodio fosfato dibasico dodecaidrato, potassio fosfato monobasico, cloruro di potassio, cloruro di magnesio esaidrato, α-tocoferolo succinato acido, polisorbato 80, ottoxinolo 10 e acqua per preparazioni iniettabili | Cloruro di sodio, cloruro di potassio, sodio fosfato dibasico diidratato, potassio diidrogeno fosfato e acqua per preparazioni iniettabili | Cloruro di potassio, potassio diidrogeno fosfato, fosfato disodico diidrato, cloruro di sodio, calcio cloruro diidrato, magnesio cloruro esaidrato e acqua per preparazioni iniettabili |
| Forma farmaceutica | Sospensione iniettabile (incolore e lievemente opalescente) in siringa pre-riempita | Sospensione iniettabile (opalescente incolore dopo l’agitazione) in siringa pre-riempita | Sospensione iniettabile (chiaro incolore) in siringa pre-riempita |
| Indicazioni (età) | ≥ 6 mesi | ||
| Posologia e modo di somministrazione | Una dose da 0,5 ml per via
intramuscolare. Per i bambini d’età 6 mesi-9 anni non precedentemente vaccinati: 2 dosi a distanza di almeno 4 settimane |
Una dose da 0,5 ml per via
intramuscolare o sottocutanea. Per i bambini d’età 6 mesi - 9 anni non precedentemente vaccinati: 2 dosi a distanza di almeno 4 settimane |
Una dose da 0,5 ml per via
intramuscolare o sottocutanea profonda. Bambini dai 6 mesi ai 35 mesi: i dati clinici sono limitati. Possono essere somministrati dosaggi di 0,25 ml o 0,5 ml. La dose somministrata deve essere in conformità alle raccomandazioni nazionali vigenti. Per i bambini che non sono stati precedentemente vaccinati deve essere somministrata una seconda dose dopo un intervallo di almeno 4 settimane |
| Controindicazioni |
|
|
|
| Interazioni con altri medicinali | Fluarix® Tetra può essere somministrato contemporaneamente ad altri vaccini in arti differenti | Vaxigrip® Tetra può essere somministrato contemporaneamente ad altri vaccini in arti differenti | Influvac® S Tetra può essere somministrato contemporaneamente ad altri vaccini in arti differenti. |
| La risposta immunologica può diminuire in caso di trattamento immunosoppressivo, quale quello con corticosteroidi, farmaci citotossici o radioterapia | |||
Nel vaccino Q/LAIV i ceppi influenzali sono attenuati in modo da non causare influenza, sono adattati al freddo e sensibili alla temperatura, capaci di replicarsi nella mucosa nasale ma non nel tratto respiratorio inferiore.
Dalla stagione 2020/2021 il vaccino Q/LAIV è disponibile in Italia. In Tabella III sono riportate le principali caratteristiche del vaccino tratte dal riassunto delle caratteristiche del prodotto (RCP) [16].
Caratteristiche principali del vaccino vivo attenuato.
| Fluenz® Tetra [16] | |
|---|---|
| Denominazione | Virus dell’influenza, propagato in uova fertilizzate di gallina, ricombinante (vivo attenuato) di quattro ceppi prodotti in cellule VERO mediante ingegneria genetica inversa |
| Indicazioni per età | Bambini e adolescenti di età compresa tra 24 mesi e 18 anni |
| Composizione antigenica | Il vaccino contiene virus
frammentati di quattro ceppi virali appartenenti ai ceppi:
|
| Modo di somministrazione e posologia | Somministrazione per via intranasale. |
| Nei bambini e adolescenti di età superiore a 24 mesi è somministrato in singola dose da 0,2 ml suddivisa nelle due narici (0,1 ml somministrati per ogni narice). | |
| Nei bambini non precedentemente vaccinati è raccomandata una seconda dose ad almeno 4 settimane di intervallo dalla prima | |
| Forma farmaceutica | Sospensione incolore o giallo pallido, da limpida a opalescente con un pH approssimativamente di 7,2 |
| Eccipienti | Saccarosio, fosfato dipotassicoDiidrogenofosfato di potassio, gelatina (porcina, di tipo A), arginina cloridrato, glutammato monosodico monoidrato, acqua per preparazioni iniettabili |
| Avvertenze speciali e precauzioni di impiego | Fluenz® Tetra non deve essere somministrato a bambini e adolescenti affetti da asma severo o da dispnea attiva in quanto questi soggetti non sono stati oggetto di studio in studi clinici controllati. |
| Il soggetto vaccinato deve evitare, ove possibile, il contatto ravvicinato con persone immunocompromesse (ad es. soggetti che abbiano ricevuto un trapianto di midollo osseo) per 1-2 settimane dopo la vaccinazione | |
| Controindicazioni |
|
| Interazioni con altri medicinali | È stata studiata la co-somministrazione di Fluenz® trivalente con i vaccini vivi attenuati contro morbillo, parotite, rosolia, varicella e poliovirus somministrato per via orale. Non è stata osservata alcuna variazione clinicamente significativa nelle risposte immunitarie ai vaccini contro morbillo, parotite, varicella e poliovirus somministrato per via orale o a Fluenz® trivalente. La risposta immunitaria al vaccino contro la rosolia è risultata significativamente alterata. Questa alterazione, tuttavia, potrebbe non rivestire rilevanza clinica con il programma di immunizzazione in due dosi del vaccino contro la rosolia. Questa osservazione su Fluenz® trivalente è importante per l’uso di Fluenz® Tetra poiché quest’ultimo è identico alla formulazione trivalente ad eccezione dell’aggiunta del secondo ceppo di influenza B. |
| La co-somministrazione di Fluenz® Tetra con vaccini inattivati non è stata studiata. | |
| L’uso concomitante di Fluenz® Tetra e di farmaci antivirali attivi contro i virus dell’influenza non è stato valutato. Tuttavia, a causa delle possibili interferenze è raccomandata la somministrazione del vaccino dopo almeno 48 ore dalla cessazione della terapia antivirale. La somministrazione di farmaci antivirali contro l’influenza nelle due settimane successive alla vaccinazione può influenzare la risposta al vaccino | |
| Fertilità, gravidanza e allattamento | I dati relativi all’uso di Fluenz® Tetra in donne in gravidanza sono limitati. Sebbene gli studi sugli animali non indichino effetti dannosi diretti o indiretti di tossicità riproduttiva, e i dati post-commercializzazione offrano una certa rassicurazione, Fluenz® Tetra non è raccomandato durante la gravidanza. |
| Non è noto se Fluenz® Tetra sia escreto nel latte materno. Tuttavia, poiché alcuni virus sono presenti nel latte materno, Fluenz® Tetra non deve essere utilizzato durante l’allattamento. | |
| Non sono disponibili dati sui possibili effetti di Fluenz® Tetra sulla fertilità maschile e femminile |
Nel programma di vaccinazione stagionale occorre considerare la possibilità di somministrare una singola dose di vaccino anche ai bambini mai vaccinati. Evidenze scientifiche supportano tale strategia evidenziando una buona risposta immunitaria e una soddisfacente efficacia per l’intera stagione influenzale [4, 57, 58].
Il vaccino QIVc è oggetto di valutazione nel presente report HTA e, pertanto è analizzato nel dettaglio nel capitolo 4.
Nel 2020 il vaccino ricombinante è stato approvato in Europa per i soggetti di età > 8 anni (QIVr) [52]. In Tabella IV sono riportate le principali caratteristiche del vaccino.
Caratteristiche principali del vaccino ricombinante [52].
| Supemtek | |
|---|---|
| Denominazione | Vaccino antinfluenzale quadrivalente (ricombinante, preparato in coltura cellulare) |
| Indicazioni per età | Soggetti di età > 18 anni |
| Composizione antigenica | Proteine del virus dell’influenza emoagglutinina (HA) di quattro ceppi virali appartenenti a: A/H1N1, A/H3N2, B/Victoria e B/Yamagata in quantità di 45 μg di emoagglutinina di ciascun ceppo. |
| I ceppi contenuti nel vaccino sono aggiornati annualmente in base alle raccomandazioni dell’OMS per emisfero settentrionale. | |
| Il vaccino è prodotto tramite la tecnologia del DNA ricombinante utilizzando un sistema di espressione del baculovirus in una linea cellulare continua di insetto che deriva dalle cellule Sf9 della lafigma, Spodoptera frugiperda | |
| Modo di somministrazione e posologia | Una dose da 0,5 ml. |
| Il vaccino deve essere somministrato solo per iniezione intramuscolare. Il sito migliore per l’iniezione è il muscolo deltoide. | |
| Il vaccino non deve essere iniettato per via intravascolare e non deve essere miscelato con altri vaccini nella stessa siringa | |
| Forma farmaceutica | Soluzione per iniezione in siringa preriempita. Trasparente e incolore. |
| Eccipienti |
|
| Adiuvante | Nessuno |
| Avvertenze speciali e precauzioni di impiego | La vaccinazione deve essere posticipata nei pazienti con malattia febbrile acuta fino a risoluzione della febbre. |
| La risposta anticorpale nei pazienti con immunosoppressione endogena o iatrogena può essere insufficiente per prevenire l’influenza. | |
| Trombocitopenia e disturbi della coagulazione. | |
| Come per gli altri vaccini iniettabili, Supemtek deve essere somministrato con cautela ai soggetti affetti da trombocitopenia o da un disturbo emorragico, dal momento che in tali soggetti può verificarsi un sanguinamento dopo una somministrazione intramuscolare. | |
| Potrebbe manifestarsi una sincope dopo, o perfino prima di, qualsiasi vaccinazione come risposta psicogena all’iniezione con un ago. Devono essere adottate le corrette procedure per prevenire eventuali cadute e lesioni e per gestire una sincope | |
| Controindicazioni | Ipersensibilità ai principi attivi, a uno qualsiasi degli eccipienti o a qualsiasi residuo in traccia come l’ottilfenolo etossilato |
| Interazioni con altri medicinali | Non sono stati condotti studi di interazione, né ci sono dati per la valutazione della somministrazione concomitante di Supemtek con altri vaccini. Se Supemtek deve essere somministrato contemporaneamente a un altro vaccino iniettabile, i vaccini devono sempre essere somministrati in diversi siti di iniezione |
| Fertilità, gravidanza e allattamento | I dati sull’uso di Supemtek nelle donne in gravidanza sono limitati. Uno studio sugli animali eseguito con vaccino antinfluenzale ricombinante trivalente non ha evidenziato effetti dannosi diretti o indiretti in relazione alla gravidanza, allo sviluppo embrio-fetale o allo sviluppo post-natale precoce. Una valutazione dei rischi e dei benefici deve essere eseguita da un operatore sanitario prima di somministrare Supemtek a una donna in gravidanza. |
| Non è noto se il vaccino Supemtek sia escreto nel latte umano. Una valutazione dei rischi e dei benefici deve essere eseguita da un operatore sanitario prima di somministrare Supemtek a una donna in allattamento. | |
| Non sono disponibili dati sulla fertilità umana. Lo studio sugli animali con vaccino antinfluenzale trivalente ricombinante non ha indicato effetti nocivi sulla fertilità femminile |
Dalla stagione 2020/21, è autorizzato in Italia un vaccino quadrivalente ad alto dosaggio prodotto su uova nome commerciale Efluelda®. Le caratteristiche principali desunte dalla scheda tecnica del prodotto sono riportate in Tabella V [29].
Caratteristiche principali del vaccino QIV-HD.
| Efluelda® [29] | |
|---|---|
| Denominazione | Vaccino antinfluenzale quadrivalente (virione split, inattivato) |
| Indicazioni per età | ≥ 60 anni |
| Composizione antigenica | Virus frammentati di quattro ceppi virali (coltivati in uova embrionate di pollo) appartenenti a A/H1N1pdm09, A/H3N2, B/Victoria e B/Yamagata (aggiornati di anno in anno a seconda delle raccomandazioni dell’OMS per l’Emisfero Nord) in quantità di 60 μg di emoagglutinina di ciascun ceppo |
| Modo di somministrazione e posologia | Una dose da 0,7 ml |
| La somministrazione deve essere effettuata preferibilmente mediante iniezione intramuscolare sebbene possa essere somministrato anche per via sottocutanea | |
| Il sito raccomandato per l’iniezione intramuscolare è la regione del deltoide | |
| Forma farmaceutica | Sospensione iniettabile (incolore e lievemente opalescente) in siringa pre-riempita. Dopo essere stato delicatamente agitato, si presenta come un liquido opalescente incolore |
| Eccipienti |
|
| Adiuvante | Nessuno |
| Avvertenze speciali e precauzioni di impiego | Efluelda non deve in nessuna circostanza essere somministrato per via intravascolare |
| La vaccinazione deve essere posticipata nei pazienti con malattia febbrile acuta | |
| Nel caso si sia verificata la sindrome di Guillain-Barré (GBS) entro 6 settimane da qualsiasi precedente vaccinazione antinfluenzale, la decisione di somministrare Efluelda deve essere basata su un’attenta considerazione dei potenziali benefici e rischi | |
| Come per gli altri vaccini somministrati per via intramuscolare, il vaccino deve essere somministrato con cautela ai soggetti affetti da trombocitopenia o da un disturbo emorragico, poiché in questi soggetti può verificarsi sanguinamento a seguito della somministrazione intramuscolare | |
| Può manifestarsi una sincope in seguito, o anche prima, di qualsiasi vaccinazione, come risposta psicogena all’iniezione mediante ago. Devono essere adottate delle procedure per prevenire lesioni da svenimento e per gestire le reazioni sincopali | |
| Controindicazioni | Ipersensibilità ai principi attivi o ad uno qualsiasi degli eccipienti o a qualsiasi componente che possa essere presente come tracce come uova (ovalbumina, proteine del pollo) e formaldeide |
| Interazioni con altri medicinali | Non sono stati effettuati studi d’interazione, né sono presenti dati per valutare la somministrazione concomitante di Efluelda con altri vaccini |
| Se Efluelda deve essere somministrato contemporaneamente ad altro/i vaccino/i iniettabile/i, l’immunizzazione deve essere effettuata su arti separati | |
| Deve essere notato che le reazioni avverse possono essere intensificate da qualsiasi co-somministrazione | |
| Dopo la vaccinazione antinfluenzale, sono stati segnalati risultati falsi positivi nei test sierologici per rilevare anticorpi verso HIV1, virus dell’epatite C e, specialmente, verso HTLV1, quando condotti con il metodo ELISA. Un test Western Blot appropriato deve essere utilizzato per confermare o confutare i risultati del test ELISA. Le reazioni false positive transitorie possono essere dovute a una risposta IgM non specifica indotta dal vaccino antinfluenzale | |
| Fertilità, gravidanza e allattamento | Efluelda è indicato solo per l’uso in adulti di età pari o superiore a 60 anni. Efluelda non è stato clinicamente valutato in donne in gravidanza e in allattamento |
| Efluelda non è stato valutato per i possibili effetti sulla fertilità umana |
Dalla stagione 2020/2021 il vaccino aQIV è autorizzato in Europa e dalla stagione 2021/2022 è disponibile su larga scala in Italia. Le caratteristiche principali del preparato vaccinale sono descritte in Tabella VI [27].
Caratteristiche principali del vaccino quadrivalente prodotto su uova adiuvato con MF-59®.
| Fluad® Tetra [27] | |
|---|---|
| Denominazione | Vaccino influenzale inattivato, antigene di superficie, adiuvato con MF59C.1 |
| Indicazioni per età | ≥ 65 anni |
| Composizione antigenica | Antigeni di superficie del virus dell’influenza (emoagglutinina e neuraminidasi), inattivati, di quattro ceppi virali (coltivati in uova embrionate di pollo) appartenenti a A/H1N1pdm09, A/H3N2, B/ Washington e B/ Phuket (aggiornati di anno in anno a seconda delle raccomandazioni dell’OMS per l’Emisfero Nord) in quantità di 15 μg di emoagglutinina di ciascun ceppo |
| Modo di somministrazione e posologia | Una dose da 0,5 ml. |
| La somministrazione deve essere effettuata mediante iniezione intramuscolare. Il vaccino non deve essere iniettato per via endovenosa, sottocutanea o intradermica e non deve essere miscelato con altri vaccini nella stessa siringa. | |
| Il sito raccomandato per l’iniezione intramuscolare è la regione del deltoide | |
| Forma farmaceutica | Sospensione iniettabile in siringa preriempita (preparazione iniettabile). Sospensione bianca lattiginosa. |
| Eccipienti |
|
| Adiuvante | MF59C.1 |
| Avvertenze speciali e precauzioni di impiego | La vaccinazione deve essere rinviata in pazienti con malattia febbrile fino alla scomparsa della febbre. |
| Come tutti i vaccini iniettabili, Fluad Tetra deve essere somministrato con cautela ai soggetti affetti da trombocitopenia o disturbi della coagulazione, dal momento che dopo la somministrazione intramuscolare possono verificarsi emorragie. | |
| Una sincope (svenimento) può manifestarsi dopo o anche prima di qualsiasi vaccinazione, come risposta psicogena all’iniezione con l’ago. Questa può essere accompagnata da svariati segni neurologici quali disturbi visivi transitori, parestesia e movimenti tonico-clonici degli arti durante il recupero. È importante che siano disponibili misure idonee a evitare lesioni dovute allo svenimento. | |
| Controindicazioni | Ipersensibilità al principio attivo, ad uno qualsiasi dei componenti dell’adiuvante, ad uno qualsiasi degli eccipienti o a possibili residui in tracce, quali ovoalbumina, kanamicina e neomicina solfato, formaldeide, cetiltrimetilammonio bromuro (CTAB) e idrocortisone |
| Interazioni con altri medicinali | Non sono disponibili dati clinici sulla somministrazione concomitante di Fluad Tetra con altri vaccini. Se Fluad Tetra deve essere somministrato contemporaneamente ad un altro vaccino, l’iniezione deve essere effettuata in sedi diverse e preferibilmente in arti differenti. La somministrazione contemporanea può intensificare le reazioni avverse |
| Fertilità, gravidanza e allattamento | Il vaccino è autorizzato per i soggetti di età ≥ 65 anni |
L’obiettivo del presente capitolo è analizzare e sintetizzare le evidenze disponibili sui vaccini antinfluenzali commercializzati in Italia valutando criticamente le revisioni sistematiche e/o meta-analisi pubblicate al fine di fornire una overview sull’argomento. Questo metodo di lavoro è ampiamente usato nel campo dell’evidence-based medicine dato il numero sempre maggiore di revisioni sistematiche pubblicate e considerando che esse rappresentano il più alto livello di evidenza.
Al fine di reperire gli articoli di interesse su Pubmed sono state utilizzate stringhe di ricerca semplificate considerando 3 gruppi di popolazione: pediatrica (< 18 anni), adulta (18-64 anni) e anziana (> 65 anni):
((“influenza”[Title/Abstract] AND vaccine*[Title/Abstract] AND “systematic review”[Title/Abstract])) AND (children*[Title/Abstract] OR “pediatric population”);
((“influenza”[Title/Abstract] AND vaccine*[Title/Abstract] AND “systematic review”[Title/Abstract])) AND (“elderly”[Title/Abstract] OR “older”[Title/Abstract]));
((“influenza”[Title/Abstract] AND vaccine*[Title/Abstract] AND “systematic review”[Title/Abstract])) AND AND (adult*[Title/Abstract])).
Alla ricerca automatica è seguita una valutazione di idoneità dei prodotti individuati al fine di escludere quei manoscritti ritenuti non conformi con l’obiettivo del presente capitolo e, non in linea, con il report globale di HTA. La ricerca automatica è stata completata con quella manuale, esaminando le bibliografie dei lavori inclusi.
Poiché in Italia il primo vaccino QIVe è stato commercializzato nella stagione ٢٠١٥/16 e dalla stagione successiva i vaccini TIVe non sono stati più utilizzati dalla Sanità Pubblica, per le formulazioni trivalenti (disponibili dal 1968) sono state analizzate solo le revisioni Cochrane riferite alla popolazione pediatrica [59], adulta [60] e anziana [61].
È importante considerare che le formulazioni quadrivalenti del vaccino inattivato ad alto dosaggio, del vaccino inattivato adiuvato con MF-59, del vaccino vivo attenuato e del vaccino ricombinante sono state sviluppate come evoluzione dei preparati trivalenti e hanno ottenuto le autorizzazioni dagli enti regolatori tramite la conduzione di RCTs che hanno valutato la non inferiorità immunologica del preparato quadrivalente rispetto alla formulazione trivalente. Tale approccio è definito “immunobridging” ed è utilizzato quando si introducono nuovi ceppi in vaccini già autorizzati per trasferire i dati degli studi clinici e osservazionali condotti sulla formulazione trivalente al preparato tetravalente. Pertanto, la maggior parte delle revisioni sistematiche valutate per questi vaccini sono riferite alle formulazioni trivalenti.
Nel secolo scorso le evidenze scientifiche hanno portato a definire che titoli anticorpali determinati tramite il test di inibizione dell’emoagglutinazione (HemAgglutination Inhibition, HAI) ≥ 1:40 potessero essere associati ad una riduzione del 50% del tasso di infezione in adulti [1-5, 62]. Il test HAI è considerato il gold standard per i vaccini inattivati; infatti, tale metodica è quella richiesta dall’ente regolatorio statunitense per soddisfare i criteri CBER (Center for Biologics Evaluation and Research) relativi all’immunogenicità dei vaccini antinfluenzali [63] e solo pochi studi considerano test sierologici alternativi come la microneutralizzazione (NT) e l’emolisi singola radiale (Single Radial Hemolisis, SRH). Quest’ultimo test riconosce come correlato di protezione la zona di emolisi ≥ 25 mm2 [64]. Generalmente, la valutazione della risposta immunitaria è effettuata a distanza di 3-4 settimane dalla somministrazione del vaccino, tuttavia alcuni studi considerano tempi di osservazione più lunghi al fine di valutare la persistenza dei titoli anticorpali.
L’immunogenicità è suddivisa in assoluta e relativa.
L’immunogenicità assoluta è definita come la capacità del vaccino oggetto di studio di stimolare la risposta immunitaria rispetto alla non vaccinazione o ad un trattamento non attivo (placebo o vaccini non influenzali). Essa è quantificata considerando l’incremento dei titoli geometrici medi (GMT) post-/pre-vaccinazione (Mean-Fold Increase, MFI), i tassi di sieroconversione (SeroConversion Rate, SCR) e i tassi di sieroprotezione (SeroProtection Rate, SPR). Per l’analisi qualitativa degli outcomes di immunogenicità assoluta gli studi utilizzano i criteri europei predisposti da CHMP (Committee for Medicinal Products for Human Use) e i criteri statunitensi predisposti da CBER [63-65].
L’immunogenicità relativa è definita come la capacità del vaccino in studio di stimolare la risposta immunitaria rispetto a quella indotta da altri vaccini antinfluenzali. Relativamente a questo parametro gli studi considerano: il rapporto tra i GMT dei vaccini di interesse rispetto a quelli in comparazione e il rischio relativo (RR) di sieroconversione e di sieroprotezione in seguito alla vaccinazione con il prodotto vaccinale in studio rispetto ai vaccini in comparazione. Il RR significativamente maggiore di 1 indica una migliore performance del vaccino oggetto di studio rispetto al comparatore.
Relativamente al vaccino LAIV non è disponibile un correlato di protezione specifico, poiché i RCTs di efficacia hanno dimostrato che i titoli HI sottostimano la protezione del vaccino, probabilmente a causa della molteplice risposta immune stimolata dal vaccino stesso con l’induzione di risposte IgA locali e cellule T, le quali non sono misurate con il test HAI. Di conseguenza, i correlati di protezione usati per i vaccini inattivati potrebbero non correlare con la protezione dopo la vaccinazione con il vaccino LAIV [66]. Inoltre, sembrerebbe che il cut-off di 1:40, ritenuto il valore di riferimento associato ad una riduzione del 50% del tasso di infezione negli adulti, non sia appropriato quando si valutano i vaccini antinfluenzali nei bambini [67]. Sebbene un limite di 1:110 possa essere utilizzato per prevedere il tasso di protezione clinica convenzionale del 50%, un titolo di 1:330 potrebbe predire un livello di protezione dell’80%, che potrebbe essere più desiderabile dal punto di vista della salute pubblica [67].
L’efficacia teorica è definita come riduzione del rischio di eventi correlati all’influenza grazie alla vaccinazione in condizioni “ideali” come nel caso dei RCTs [1-5].
È stata considerata sia l’efficacia teorica assoluta che corrisponde alla riduzione degli eventi potenzialmente riconducibili all’influenza nei soggetti vaccinati rispetto a quelli non immunizzati sia quella relativa che valuta la riduzione degli eventi potenzialmente riconducibili all’influenza nei soggetti vaccinati con il vaccino di interesse rispetto ai soggetti immunizzati con un competitor. L’outcome “influenza confermata in laboratorio” è considerato il gold standard e considera l’efficacia sia verso i ceppi omologhi (suddivisi per i virus A e i suoi sottotipi e per virus B e i suoi lineage) sia verso i ceppi eterologhi.
È definita come riduzione del rischio di eventi correlati all’influenza grazie alla vaccinazione in condizioni “del mondo reale” come nel caso di studi osservazionali [1-5]. Come per l’efficacia teorica è stata considerata sia l’effectiveness (VE) assoluta che quella relativa. Sono stati considerati diversi esiti potenzialmente riconducibili all’influenza: influenza confermata in laboratorio, Influenza-Like Illness (ILI), visite ambulatoriali per influenza/ILI e/o polmonite, ospedalizzazione per patologie respiratorie, ospedalizzazione per sindrome simil-influenzale/influenza e/o polmonite, ospedalizzazione per eventi cardiovascolari acuti, mortalità per tutte le cause. L’outcome “influenza confermata in laboratorio mediante test molecolare” è considerato il gold standard; infatti, è stato dimostrato che quando l’effectiveness è valutata considerando sindromi cliniche meno specifiche, i benefici della vaccinazione risultano più bassi. Infine, nel calcolo dell’effectiveness altri bias devono essere considerati quali l’intensità della stagione influenzale e la similitudine dei ceppi circolanti con quelli vaccinali.
Negli RCTs sono valutati sia gli eventi avversi (AE) sollecitati (i.e. raccolti in modo “attivo”, tipicamente nella settimana successiva alla vaccinazione) sia quelli non sollecitati segnalati spontaneamente in un intervallo temporale più lungo e comprendono AE locali (arrossamento, gonfiore, indurimento, dolore/dolorabilità) e sistemici [febbre/febbricola, brividi, affaticamento/malessere generale, mal di testa, mialgia, artralgia, nausea, vomito, diarrea, inappetenza, insonnia/irritabilità/modifica del comportamento alimentare (per la popolazione pediatrica)]. Generalmente gli AE sono classificati in base alla gravità (da lieve a grave). Inoltre, sono monitorati, per l’intera durata dello studio, gli eventi avversi significativi dal punto di vista medico ed eventi avversi gravi (SAE). Infine, sono stati analizzati i risultati derivanti dagli studi di post-marketing.
Come precedentemente riportato solo la revisione Cochrane di Jefferson et al. [59] è stata considerata per le formulazioni trivalenti al fine di ottenere una base per valutare i benefici associati all’utilizzo delle formulazioni quadrivalenti in tutte le fasce d’età. Dalla revisione è emerso che rispetto al placebo o all’assenza di vaccinazione, nei bambini di età compresa tra 2 e 16 anni, i vaccini inattivati sono in grado di ridurre il rischio di influenza confermata in laboratorio [riduzione dal 30 all’11% (RR = 0,36; IC 95%: 0,28-0,48)] e di ILI [riduzione dal 28 al 20% (RR = 0,72; IC 95%: 0,65-0,79)]. Cinque bambini dovrebbero essere vaccinati per prevenire un caso di influenza confermata in laboratorio e 12 bambini dovrebbero essere immunizzati per evitare un caso di ILI. Gli studi osservazionali hanno confermato il buon livello di sicurezza evidenziato negli RCTs e riportati nelle schede tecniche dei prodotti. Non sono state evidenziate differenze statisticamente significative tra il gruppo vaccinato rispetto al placebo in riferimento alle reazioni sistemiche in tutte le fasce d’età. Differenze significative sono state riscontrate per le reazioni locali con una maggiore frequenza tra il 11 e i 15 anni.
Solo due revisioni sistematiche [1, 68] riportanti dati di immunogenicità dei QIVe sono state ritenute idonee per il presente report HTA tra cui una inclusa all’interno del report HTA del vaccino QIVc pubblicato nel 2019 [1].
Nella revisione sistematica di Panatto et al. [1], la popolazione pediatrica era suddivisa in 3 gruppi di età: 6-35 mesi, 3-8 anni e 9-17. Gli autori hanno riportato stime meta-analitiche di immunogenicità verso ceppi A/H1N1, A/H3N2, B/Victoria e B/Yamagata omologhi. Dei 56 studi inclusi nell’analisi, 17 hanno riportato dati di immunogenicità assoluta e le stime meta-analitiche riferite ai tassi di sieroconversione variavano tra il 49 e l’81% mentre quelle relative ai tassi di sieroprotezione ricadevano nell’intervallo 72-99%. Gli autori osservarono una relazione negativa tra la fascia di età e la sieroconversione, con una maggior propensione a sieroconvertire dei bambini più piccoli. Contrariamente, la valutazione di sieroprotezione ha evidenziato una tendenza opposta, poiché i bambini di età 9-17 anni presentavano valori più elevati. Relativamente ai dati di immunogenicità relativa, in tutti gli studi, i comparatori erano vaccini TIVe. Gli autori giunsero alla conclusione che i vaccini QIVe non erano statisticamente inferiori ai TIVe per i ceppi condivisi e sempre statisticamente superiori rispetto ai TIVe per i ceppi non condivisi indipendentemente dal lineage e parametro [1].
Nella revisione Huang et al. [68] la popolazione in studio comprendeva bambini e adolescenti sani di età compresa tra 6 mesi e 18 anni suddivisi in due gruppi (6 mesi - 3 anni; 3-18 anni) e l’obiettivo era quello di fornire dati di immunogenicità relativa QIVe vs TIVe. Nella revisione sono stati inclusi 17 articoli di cui 9 RCTs (numerosità = 14.819 bambini e adolescenti) sono stati considerati nella meta-analisi. Gli autori hanno riportato i seguenti risultati: i QIVe se confrontati con TIVe-B/Yamagata non evidenziavano differenze in SCR e SPR per A/H1N1, A/H3N2 e B/Yamagata mentre mostravano una maggiore immunogenicità per il lignaggio B/Victoria. Risultati simili sono stati trovati anche nel confronto tra QIVe e TIV-B/Victoria, indipendentemente dal gruppo di età considerato. In sintesi, gli autori sono giunti alla stessa conclusione di Panatto et al. sottolineando che, in entrambi i gruppi di studio, l’immunogenicità indotta dai QIVe per i ceppi influenzali condivisi era simile a quella stimolata dai TIVe e i titoli anticorpali verso il ceppo B non contenuto nella formulazione trivalente erano sempre significativamente maggiori.
I dati di immunogenicità relativa di QIVe vs QIVc e QIVr sono riportati nel capitolo 4.
La recentissima revisione sistematica di Gertosio et al. [69] non è stata considerata poiché ha valutato l’immunogenicità, l’efficacia e la sicurezza dei vaccini antinfluenzali solo in un gruppo di popolazione pediatrica speciale comprendente bambini con condizioni croniche trattati con farmaci biologici.
Attualmente, la revisione sistematica di Panatto et al. 2019 inclusa nel report HTA del vaccino QIVc [1], è la più aggiornata (arco temporale 1/1/2005-5/6/2019) e riporta i risultati di efficacia assoluta contro l’influenza confermata in laboratorio da 4 RCTs [70-73]. A nostra conoscenza, non risultano pubblicate revisioni più recenti. A causa della paucità degli studi inclusi nella revisione, gli autori non hanno potuto effettuare la meta-analisi. Di seguito sono riportati i dati più rilevanti dei 4 RCTs inclusi nella revisione. Lo studio di Pépin et al. [72] ha riportato, nella popolazione di età compresa tra 6 e 35 mesi, un’efficacia del 51% per influenza confermata in laboratorio per qualsiasi ceppo, del 68,4% per influenza confermata in laboratorio da ceppi simil-vaccinali, del 55,8% per influenza causata dal tipo A (75% per A/H1N1 e 48,5% per A/H3N2) e 45,2% per influenza causata dal tipo B (40% verso B/Victoria e 58,7% verso B/Yamagata). Nell’altro studio di Pépin et al. [73] l’efficacia è risultata del: 35,1 e del 43,6% nella fascia d’età 6-11 mesi; 63,1 e 50,5% nella fascia d’età 12-23 mesi; 54,8 e 74,5% nel gruppo 6-23 mesi; 46,9 e 59,8% nei bambini d’età 24-35 mesi considerando come outcome l’influenza confermata in laboratorio da qualsiasi ceppo e per ceppi simil-vaccinali, rispettivamente.
Nello studio di Claeys et al. [71] è stata valutata l’efficacia di QIVe nella fascia pediatrica 6-35 mesi considerando come outcome l’influenza confermata tramite RT-PCR da qualsiasi ceppo e l’influenza di entità media/severa confermata da qualsiasi ceppo. Sono stati riportati i seguenti valori di efficacia: 50% per l’influenza causata da qualsiasi ceppo, 63% per influenza di entità media/severa da qualsiasi ceppo, 50% per influenza causata dal tipo A (67% per A/H1N1 e 46% per A/H3N2), 58% per influenza di entità media/severa causata dal tipo A (72% per A/H1N1 e 53% per A/H3N2), 47% per influenza causata dal tipo B (24% per B/Victoria e 50% per B/Yamagata), 72% per influenza di entità media/severa causata dal tipo B (80% per B/Victoria e 70% per B/Yamagata).
Nello studio di Jain et al. [70] è stata valutata l’efficacia di QIVe in una popolazione pediatrica d’età 3-8 anni. Gli autori hanno osservato i seguenti dati di efficacia: 59,3% riferito a influenza confermata tramite RT-PCR; 74,2% per influenza di entità media/severa; 56,8% per influenza causata dal tipo A (55,6% per A/H1N1 e 57,6% per A/H3N2); 79,9% per influenza di entità media/severa causata dal tipo A (76,5% per A/H1N1 e 82,4% per A/H3N2); 49,5% riferito a influenza causata dal tipo B (47,2% per B/Victoria e 100% per B/Yamagata); 46,5% per influenza di entità media/severa causata dal tipo B (42,1% per B/Victoria e 100% per B/Yamagata). In sintesi, le stime di efficacia sono risultate buone/ottimali a seconda dell’outcome/metodologia considerati e variavano tra il 24 e il 100% con valori di efficacia più alti nel prevenire l’influenza confermata di media/severa entità clinica rispetto a quella di qualsiasi entità.
Relativamente all’efficacia sul campo (VE), 3 revisioni sistematiche sono state ritenute idonee per il presente report HTA tra cui una inclusa all’interno del report HTA del vaccino QIVc pubblicato nel 2019 [1]. Le pubblicazioni che riportano dati di effectiveness relativa (rVE) considerando come comparatori LAIV, QIVr e QIVc sono riportate in seguito.
La revisione sistematica di Panatto et al. [1] ha considerato un unico studio condotto sulla popolazione pediatrica nella stagione 2015/2016 in bambini di età compresa tra 2 e 17. Le stime di effectiveness assoluta (aVE) di QIVe sono risultate pari a: 59% (IC 95%: 35-75%) vs qualsiasi tipo di influenza; 56% (IC 95%: 18-76%) vs A/H1N1pdm09; 60% (IC 95%: 23-80%) vs influenza di tipo B; 70% (IC 95%: 29-87%) vs B/Victoria e 29% (IC 95%: -119-77%) vs B/Yamagata. Il dato relativo a A/H3N2 non è stato riportato.
La meta-analisi di Kalligeros et al. [74] ha considerato studi che riportavano stime di effectiveness nel prevenire l’ospedalizzazione per influenza confermata in laboratorio stratificata per tipo di influenza (qualsiasi tipo, A/H1N1, A/H3N2, influenza B) e per fascia di età (< 5 anni e età compresa tra 6-17 anni). Dei 2.615 studi identificati, 28 soddisfacevano i criteri di inclusione. Alcuni studi inclusi hanno calcolato l’effectiveness considerando “vaccinati” i bambini immunizzati con almeno una dose di vaccino (includendo anche i bambini parzialmente vaccinati). I risultati ottenuti hanno evidenziato una protezione significativa di QIVe contro qualsiasi tipo di ospedalizzazione correlata all’influenza (57,48%; IC 95%: 49,46-65,49). Stratificando per tipo e ceppo, l’effectiveness era soddisfacente vs A/H1N1 (74,07%; IC 95%: 54,85-93,30) e l’influenza di tipo B (50,87%; IC 95%: 41,75-59,98) e moderata vs A/H3N2 (40,77%; IC 95%: 25,65-55,89). Cinque studi hanno confrontato l’effectiveness della vaccinazione parziale rispetto al ciclo completo. In particolare, come atteso, la vaccinazione ha offerto una protezione maggiore nei bambini completamente vaccinati (61,79%; IC 95%: 54,45-69,13) rispetto a quelli parzialmente vaccinati (33,91%; IC 95%: 21,12-46,69). Inoltre, l’effectiveness è risultata soddisfacente sia nei bambini di età inferiore a 5 anni (61,71%; IC 95%: 49,29-74,12) sia nei bambini di età compresa tra 6 e 17 anni (54,37%; IC 95%: 35,14-73,60). In conclusione, i risultati di questa meta-analisi confermano che la vaccinazione antinfluenzale offre una protezione significativa contro l’ospedalizzazione correlata all’influenza ed evidenziano l’importanza della stessa nella popolazione pediatrica [73].
La revisione sistematica e meta-analisi di Boddington et al. del 2021 [75] ha analizzato i risultati di studi riportanti stime di effectiveness dei vaccini influenzali nel prevenire l’ospedalizzazione correlata all’influenza confermata in laboratorio, in bambini di età ≤17 anni. La meta-analisi ha considerato tutti gli studi pubblicati dal 2 maggio 2019 all’8 giugno 2020 con disegno di studio test-negative. Le analisi secondarie sono state effettuate stratificando i dati per tipo di influenza (influenza A e B), fascia di età (meno di 5 anni, 6-17 anni) e tipo di vaccino (QIVe, TIVe, LAIV). Ove possibile l’influenza di tipo A è stata ulteriormente suddivisa per sottotipo (A/H1N1pdm09 e A/H3N2). Dei 37 lavori inclusi (periodo dal 2005/2006 al 2018/2019), 34 hanno fornito stime di effectiveness nei bambini versus l’ospedalizzazione associata a qualunque tipo di influenza e qualsiasi tipo di vaccino e, dall’analisi, è risultata un’effectiveness del 53,3% (IC 95%: 47,2-58,8). Ventidue studi hanno fornito stime di effectiveness versus i ricoveri per l’influenza di tipo A e la stima metanalitica è risultata pari al 58,0% (IC 95%: 49,8-64,8). In particolare, 14 studi hanno effettuato una stratificazione per sottotipo riportando un’effectiveness del 68,7% (IC 95%: 56,9-77,2) per A/H1N1pdm09 e del 35,8% (IC 95%: 23,4-46,3) per A/H3N2. Le stime per tipo di vaccino hanno evidenziato un’effectiveness del 68,9% (IC 95%: I 53,6-79,2) per i QIVe. Le stime erano più elevate nelle stagioni in cui i ceppi influenzali circolanti erano concordanti antigenicamente ai ceppi vaccinali (59,3%, IC 95%: 48,3-68,0).
Nella revisione sistematica di Panatto et al. inclusa nel report HTA del vaccino QIVc [1] è stata valutata la sicurezza e la reattogenicità dei QIVe rispetto ai TIVe. La frequenza degli eventi avversi sollecitati variava notevolmente nelle diverse classi di età. L’evento avverso sollecitato locale più frequentemente segnalato era il dolore nel sito di iniezione con un’incidenza che variava tra il 17 e il 73%. Tra gli eventi avversi sistemici, la mialgia (7-51%) e il malessere/affaticamento (3-34%) erano i più frequenti. Il quadro osservato è in linea con le schede tecniche dei QIVe autorizzati in Italia. Nei RCTs esaminati il profilo di reattogenicità dei QIVe è risultato confrontabile con quello dei TIVe. Infatti, la meta-analisi non ha evidenziato alcun aumento del rischio nei soggetti vaccinati con i QIVe rispetto a quelli immunizzati con i TIVe per quel che riguarda l’eritema [RR = 1,19 (IC 95%: 0,99-1,41)], l’indurimento [RR = 1,21 (IC 95%: 0,99-1,48)], i brividi [RR = 1,18 (IC 95%: 0,82-1,71)], il malessere/affaticamento [RR = 1,00 (IC 95%: 0,95-1,06)], la mialgia [RR: 1,07 (IC 95%: 0,99-1,14)], l’artralgia [RR = 1,19 (IC 95%: 0,99-1,43)] e il mal di testa [RR = 0,77 (IC 95%: 0,45-1,32)]. Tuttavia, il rischio di dolore nel sito di iniezione [RR = 1,15 (IC 95%: 1,05-1,25)] e di febbre [RR = 1,15 (IC 95%: 1,01-1,30)] è risultato più elevato del 15% nei vaccinati con QIVe rispetto ai soggetti immunizzati con i TIVe.
Negli ultimi anni sono stati pubblicati i risultati ottenuti da studi di post-marketing e di sorveglianze passive condotte nella popolazione durante la vaccinazione di routine che hanno confermato il buon profilo di sicurezza dimostrato nei RCTs. Ad esempio, nella ricerca di Gandhi-Banga et al. [76] sono riportati i risultati di uno studio di sorveglianza EPSS sui QIVe durante la stagione influenzale 2017/2018. La popolazione studiata comprendeva soggetti di età ≥ 6 mesi. Delle 56 reazioni avverse riportate da 20 soggetti (2,1%), vaccinati con QIVe, nessuna ha riguardato la fascia di età compresa tra 3 e 17 anni confermando l’ottimo profilo di sicurezza del vaccino quadrivalente inattivato prodotto su uova.
L’obiettivo dello studio prospettico di Dos Santos et al. [77], è stato quello di stimare la percentuale cumulativa di eventi avversi entro 7 giorni dalla somministrazione di un QIVe in soggetti di età compresa tra i 6 mesi e i 65 anni nel periodo compreso tra il 1° ottobre 2018 e il 4 gennaio 2019. In questo studio sono stati arruolati 146 soggetti pediatrici. Non sono stati riportati esiti/decessi fatali e nessun evento avverso grave ritenuto correlato a QIVe. Inoltre, non sono stati segnalati eventi avversi d’interesse come convulsioni febbrili, reazione anafilattica, paralisi di Bell o sindrome di Guillain-Barre dopo qualsiasi dose. Per la fascia di età 6 mesi-17 anni dopo la prima dose, la percentuale cumulativa di soggetti che hanno riportato eventi avversi moderati è stata del ٤٥,٧٪.
Lo scopo dello studio di sorveglianza EPSS di Chabanon et al. [78] è stato valutare la sicurezza di QIVe durante l’immunizzazione di routine in Finlandia, nella stagione 2019/2020. Nello studio sono stati coinvolti 1000 individui di età ≥ 6 mesi vaccinati con QIVe. Il tasso di segnalazione di eventi avversi è stato del 12,5%. In particolare, 38 individui hanno riportato 117 reazioni avverse, ma nessuna segnalazione ha riguardato la fascia pediatrica (6 mesi-18 anni), confermando l’ottimo profilo di sicurezza di QIVe.
Dal momento che non è stato ancora individuato un correlato di protezione specifico per i vaccini LAIV, la quasi totalità degli studi si è focalizzata sulla valutazione dell’efficacia e solo pochi hanno analizzato l’immunogenicità inserendola come obiettivo secondario. Pertanto, non sono disponibili revisioni sistematiche di immunogenicità.
Il vaccino Q/LAIV ha ottenuto l’autorizzazione nel 2013 negli Stati Uniti e nel 2014 in Europa grazie ai risultati di due RCTs [79, 80] che hanno valutato la non inferiorità immunologica di Q/LAIV rispetto alla formulazione trivalente. Il Q/LAIV si è dimostrato immunogenico e non inferiore ai vaccini T/LAIV e, pertanto, è stato possibile trasferire i dati degli studi clinici e osservazionali condotti sulla formulazione trivalente al preparato tetravalente.
L’unico studio che ha valutato l’immunogenicità di Q/LAIV in una popolazione pediatrica (2-17 anni) è stato lo studio di Block [81]. Lo studio ha confrontato l’immunogenicità del vaccino Q/LAIV sperimentale (gruppo 1) rispetto a due diverse formulazioni di vaccino T/LAIV: uno contenente un ceppo B/Yamagata (gruppo 2) e uno contenente un ceppo B/Victoria (gruppo 3). Nei 3 gruppi di studio, i soggetti tra i 9 e i 17 anni hanno ricevuto 1 dose, mentre i soggetti tra i 2 e gli 8 anni hanno ricevuto 2 dosi a distanza di un mese. La risposta immunitaria è stata valutata un mese dopo la prima dose (seconda dose per i soggetti di età compresa tra i 2 e gli 8 anni). Lo studio ha dimostrato la non inferiorità di Q/LAIV rispetto ai 2 T/LAIV per tutti i ceppi. Inoltre, per il ceppo B/Yamagata, i rapporti di GMT e di GMFR (aumento dei GMT rispetto ai valori basali) sono risultati di 1,21 (IC 95%: 1,07-1,37) e 1,13 (IC 95%: 1,01-1,27), rispettivamente; il rapporto GMFR per il ceppo A/H1N1 era 1,07 (IC 95%: 1,01-1,13). Questi valori erano significativamente superiori a 1.
Attualmente, i dati pubblicati di efficacia del vaccino LAIV si riferiscono alla formulazione trivalente, nessuno studio ha valutato il Q/LAIV [4]. Al fine di fornire una panoramica esaustiva delle evidenze disponibili sono stati analizzati i risultati ottenuti dalle revisioni sistematiche e meta-analisi riferiti a T/LAIV.
Sette revisioni sistematiche sono state considerate idonee per il presente report di HTA, di seguito sono descritti i risultati principali.
La revisione sistematica e meta-analisi di Rhorer et al. [82] ha analizzato 9 studi multicentrici, includendo globalmente 25.000 bambini di età compresa tra 6-71 mesi e 2.000 soggetti di età compresa tra 6-17 anni, al fine di ottenere dati di efficacia assoluta e relativa. Ogni studio clinico ha osservato un numero considerevole di bambini almeno 1.000, ad eccezione di due studi che hanno arruolato soggetti con storia di infezioni respiratorie ricorrenti o con diagnosi di asma. Gli autori hanno calcolato una stima di efficacia assoluta nei bambini naïve immunizzati con due dosi del 77% (IC 95%: 72-80%; p < 0,001) contro ceppi antigenicamente simili e del 72% (p < 0,001) contro ceppi indipendentemente dal match antigenico. L’efficacia è risultata dell’85, 76 e 73% rispettivamente per ceppi antigenicamente simili di A/H1N1, A/H3N2 e B. Per quanto riguarda l’efficacia assoluta dopo una dose in bambini mai vaccinati l’analisi ha riportato una stima pari al 60% (p < 0,001) contro ceppi antigenicamente simili mentre la stima di efficacia combinata di una dose in bambini precedentemente vaccinati è risultata dell’87% (p < 0,001). Relativamente alle stime di efficacia relativa di T/LAIV vs TIVe, gli autori hanno osservato che i bambini naïve immunizzati con due dosi di LAIV presentavano il 46% di casi in meno di malattia influenzale causata da ceppi antigenicamente simili. Risultati simili sono stati osservati in bambini più grandi precedentemente vaccinati dove una dose di LAIV determinava il 35% di casi in meno di malattia influenzale rispetto a quelli vaccinati con una dose di TIVe. Complessivamente il vaccino LAIV ha mostrato una buona efficacia senza evidenza di differenza per età o per sottotipo circolante e si è rilevato più efficace di TIVe.
Nella meta-analisi di Ambrose et al. [79] sono stati analizzati nove RCTs, per un totale di circa 26.000 bambini di età compresa tra 6 mesi e 17 anni, con lo scopo di valutare l’efficacia del vaccino LAIV contro la malattia influenzale confermata rispetto al placebo o al vaccino TIVe. Rispetto al placebo, l’efficacia di 2 dosi di LAIV nell’anno 1 è stata dell’83% (IC 95%: 7-87) nei confronti di ceppi antigenicamente simili; dell’87% (IC 95%: 78-93) nei confronti di A/H1N1, 86% (IC 95%: 79-91) nei confronti di A/H3N2 e 76% (IC 95%: 63-84) nei confronti di B. L’efficacia nell’anno 2 è stata dell’87% (IC 95%: 82-91) contro ceppi simili. In coloro che hanno ricevuto il vaccino LAIV rispetto al TIVe si è osservato il 44% (IC 95%: 28-56) in meno di casi di influenza causati da ceppi simili e il 48% (IC 95%: 38-57) in meno da tutti i ceppi. Questa meta-analisi ha dimostrato un’elevata efficacia del vaccino LAIV nella popolazione pediatrica.
La revisione sistematica e metanalisi di Osterholm et al. [80] ha valutato l’efficacia del vaccino LAIV e dei TIVe negli USA nei confronti di influenza confermata in laboratorio. L’efficacia di LAIV è stata dimostrata in 9 (75%) delle 12 stagioni analizzate in 10 RCTs con efficacia aggregata 83% (IC 95%: 69-91) in bambini di età compresa tra 6 mesi e 7 anni. Gli autori hanno evidenziato che, nel caso del vaccino LAIV, l’efficacia è massima nei bambini di età compresa tra 6 mesi e 7 anni.
Nel 2013 è stata pubblicata una revisione sistematica e metanalisi da Lukšić et al. [83] che ha valutato l’efficacia e l’effectiveness del vaccino LAIV e del vaccino antinfluenzale inattivato in bambini sani fino a 18 anni contro ILI, influenza confermata in laboratorio ed ospedalizzazioni. Gli autori hanno riportato le seguenti stime di efficacia: 83,4% (IC 95%: 78,3-88,8) e 82,5% (IC 95%: 76,7-88,6) verso antigeni simili nella popolazione per-protocol e intention to treat, rispettivamente; 76,4% (IC 95%: 68,7-85,0) e 76,7% (IC 95%: 68,8-85,6) verso qualsiasi antigene nella popolazione per-protocol e intention to treat, rispettivamente. Il vaccino LAIV ha mostrato un’efficacia superiore rispetto al vaccino inattivato nei bambini.
Sempre nel 2013 è stata pubblicata la revisione sistematica e metanalisi di Tricco et al. [84] che ha esaminato l’efficacia del vaccino TIVe e LAIV in caso di assenza di match con i ceppi circolanti nei confronti di influenza confermata in laboratorio in soggetti sani. Sono stati valutati 34 RCTs, fornendo dati su 47 stagioni influenzali per una popolazione globale di 94.821 individui. Il vaccino LAIV ha mostrato una protezione significativa sia contro ceppi influenzali non matching [efficacia 54% (IC 95%: 28-71)] che verso ceppi matching [efficacia 83% (IC 95%: 75-88)] tra i bambini di età compresa tra 6 e 36 mesi. Sono state osservate differenze tra le stime per influenza A non match [efficacia 75% (IC 95%: 41-90] e le stime per influenza B non match [efficacia 42% (IC 95%: 22-56)]. I vaccini LAIV hanno mostrato di essere protettivi anche in stagioni dove i ceppi circolanti differivano dai ceppi vaccinali.
Nel 2015 è stata pubblicata una revisione da Coelingh et al. [85] con l’obiettivo di valutare l’efficacia e l’effectiveness del vaccino T/LAIV nella popolazione in età scolare (periodo dello studio: gennaio 1990-giugno 2014). Per quanto riguarda l’efficacia, poiché la maggior parte degli RCTs pubblicati nel periodo di osservazione considerava come popolazione di studio bambini di età inferiore a 6 anni, gli autori hanno analizzato nel dettaglio solo due RCTs. In particolare, lo studio di Klick B et al. [86] ha valutato l’efficacia assoluta di T/LAIV su 703 bambini di età 7-11 anni randomizzati in due gruppi riceventi o il vaccino monovalente H1N1pdm09 LAIV o il placebo. Successivamente, 685 bambini furono vaccinati dopo 3-10 settimane con il vaccino T/LAIV stagionale (2009/2010) o placebo. Lo studio ha dimostrato un’elevata efficacia assoluta di T/LAIV contro i virus B [96% (IC 95%: 67-99)] contrariamente, a causa della bassa circolazione e del mismatching dei ceppi A, l’efficacia assoluta contro i virus A non fu dimostrata.
Nel 2016 è stata pubblicata una revisione sistematica da Caspard et al. [87] con lo scopo di raccogliere i dati provenienti da RCTs, condotti nei bambini, al fine di valutare l’efficacia del vaccino T/LAIV sulla rivaccinazione e analizzare le stime di efficacia consolidate di T/LAIV in una seconda stagione influenzale. Sono stati considerati 4 studi con un arruolamento di almeno 1.000 pazienti. L’efficacia del LAIV nella stagione 2 (vaccinazione in 2 stagioni consecutive) è stata dell’86,7% (IC 95%: 76,8-92,4) contro ceppi antigenicamente simili a quelli contenuti nel vaccino. LAIV somministrato per 2 stagioni consecutive è risultato più efficace rispetto a LAIV somministrato solo nella stagione 2 [efficacia relativa: 53,9% (17,4-74,3)]. Questa revisione non ha trovato alcuna evidenza di diminuzione dell’efficacia del vaccino LAIV se somministrato per due stagioni consecutive, fornendo prova che l’efficacia del LAIV nei bambini non si riduce in caso di rivaccinazione.
Anche dalla recente revisione sistematica e network metanalisi di Minozzi et al. [88] emerge che il vaccino LAIV è efficace nei bambini nel prevenire l’influenza confermata in laboratorio e offre una protezione maggiore rispetto ai vaccini inattivati standard. Nello specifico, gli autori hanno calcolato il RR per ogni RCT con 95% credible interval (CrI). In sintesi, il vaccino LAIV, considerando come outcome l’influenza confermata in laboratorio, ha mostrato una significativa differenza rispetto al placebo corrispondente ad un RR di 0,28 (95%CrI: 0,19-0,41) ed è risultato più efficace rispetto ai vaccini inattivati standard con un RR di 0,52 (95 CrI: 0,32-0,82).
Infine, la revisione sistematica e metanalisi di Yin et al. del 2017 [89], ha valutato la protezione indiretta del vaccino LAIV in bambini in età scolare nei confronti dei propri familiari e ha evidenziato che rispetto alle scuole di controllo, i familiari dei bambini frequentanti le scuole sede di intervento avevano un tasso di malattia significativamente più basso (differenza assoluta: 3,7% per febbre/ILI; 10,8% per febbre più tosse/mal di gola). Gli autori sono giunti alla conclusione che vaccinare con LAIV i bambini, conferisce protezione indiretta.
Nel seguente paragrafo sono riportati dati di effectiveness diretta (esiti osservati nella popolazione vaccinata) ed indiretta (benefici osservati nella popolazione non target del programma di vaccinazione o nella popolazione non vaccinata).
Attualmente, la maggior parte delle revisioni sistematiche e meta-analisi hanno analizzato la formulazione trivalente. Per quanto riguarda i dati di effectiveness del vaccino Q/LAIV essi provengono essenzialmente da studi osservazionali condotti in Inghilterra, USA, Canada, Germania e Finlandia.
Cinque revisioni sistematiche sono state considerate idonee per il presente report di HTA, di seguito sono descritti i risultati principali.
La revisione di Coelingh et al. [85] ha analizzato l’effectiveness del vaccino T/LAIV nella popolazione in età scolare considerando il beneficio sia diretto che indiretto della vaccinazione. Gli autori hanno analizzato diversi tipi di studio: studi osservazionali caso-controllo, studi osservazionali con intervento di vaccinazione comunitario e studi osservazionali con programmi di vaccinazione in ambito scolastico. Considerando gli studi osservazionali, gli autori hanno riportato valori di effectiveness compresi in un range 60-82% per la prevenzione di casi di influenza confermata in laboratorio e un’effectiveness del 79% (IC 95%: 54-90) verso i casi diagnosticati clinicamente ma non confermati in laboratorio. Analizzando i dati provenienti da studi che hanno valutato programmi di vaccinazione in ambito comunitario il vaccino LAIV ha mostrato un’effectiveness compresa in un range tra il 37% (p = 0,006) durante una stagione dominata dal ceppo driftato A/H3N2 e il 79% (IC 95%: 51-91) in stagioni con buona corrispondenza del ceppo A/H1N1 e “mismatching” dei ceppi A/H3N2 e B. Inoltre, gli studi hanno dimostrato una protezione indiretta di gruppi di popolazione di età diverse non vaccinati. In sintesi, gli studi interventistici condotti a livello comunitario hanno dimostrato che la vaccinazione dei bambini in età scolare con LAIV determina una protezione diretta contro l’influenza e, in alcuni casi, protegge indirettamente anche gli altri individui della comunità. L’efficacia sul campo della vaccinazione con il vaccino LAIV è stata confermata dai dati acquisiti con gli studi che hanno valutato programmi di vaccinazione condotti in ambito scolastico. Nello specifico, gli autori hanno evidenziato che quando la copertura era di circa il 50% si osservava una riduzione significativa di casi di malattia nei vaccinati, una riduzione dell’assenteismo scolastico, un beneficio sulla popolazione pediatrica non vaccinata, sulla famiglia e sulla comunità riducendo anche l’assenteismo lavorativo e di conseguenza contribuendo a ridurre il carico economico della malattia.
La revisione sistematica e metanalisi di Lukšić et al. [83] ha valutato l’effectiveness del vaccino LAIV e del vaccino antinfluenzale inattivato in bambini sani fino a 18 anni contro ILI. Gli autori hanno riportato un’effectiveness del 31,4% (IC 95%: 4,8-39,6) utilizzando il Random effects model e una stima VE del 44,3% (IC 95%: 42,6-45,9) utilizzando il fixed effect model.
La revisione sistematica e metanalisi di Osterholm et al. [80] ha valutato l’effectiveness del vaccino LAIV e TIVe negli USA nei confronti di influenza confermata in laboratorio. Nove studi hanno mostrato una protezione significativa contro l’influenza che richiedeva assistenza in ambito ambulatoriale o ospedaliero sottolineando che il vaccino LAIV mostrava la massima efficacia nei bambini di età compresa tra 6 mesi e 7 anni.
La revisione sistematica e meta-analisi di Caspard et al. [90] ha descritto i risultati di studi che hanno valutato l’effectiveness del vaccino LAIV contro l’influenza confermata in laboratorio a partire dalla pandemia del 2009 fino al 30 novembre 2016. Le stime di effectiveness sono state classificate in base alla formulazione monovalente, trivalente e quadrivalente e al ceppo (qualsiasi ceppo influenzale, A/H1N1pdm09, A/H3N2 e B). Sono state analizzate per la meta-analisi 24 pubblicazioni riportanti 29 studi osservazionali. Poiché attualmente solo la formulazione quadrivalente è in commercio si riportano solo i dati ad essa relativi. Considerando tutte le stagioni e ogni ceppo Q/LAIV ha evidenziato un’effectiveness del 33% (IC 95%: 17-46). Relativamente al ceppo A/H1N1, le stime consolidate (tutte le stagioni) hanno mostrano un’effectiveness del 29% (IC 95%: 14-42). Relativamente al ceppo A/H3N2, Q/LAIV non è risultato efficace nel 2014-2015 quando i ceppi circolanti A erano altamente disallineati rispetto ai ceppi vaccinali (12%; IC 95%: -18-34) e nel 2015-2016 (47%; IC 95%: -50-82) quando la circolazione dei ceppi A/H3N2 era estremamente limitata. Per lo stesso motivo, nessuna stima di efficacia è stata calcolata nel 2013-2014. Relativamente al ceppo B, Q/LAIV si è dimostrato efficace nel 2014-2015 (80%; IC 95%: 32-94) e nel 2015-2016 (67%; IC 95%: 44-81). Dall’analisi dei dati emerge che l’effectiveness del LAIV non è stata dimostrata in modo coerente dalla pandemia del 2009 al 2016. Questi risultati sono chiaramente guidati dall’effectiveness non ottimale contro i ceppi di influenza A/H1N1. Contrariamente, l’effectiveness contro i ceppi di influenza B è stata osservata costantemente.
La revisione sistematica e metanalisi di Mallory et al. [91] è stata condotta per stimare l’effectiveness del Q/LAIV e QIVe nella stagione influenzale 2016-2017. Sono stati considerati 5 studi condotti in Canada, Finlandia, Germania, Regno Unito e Stati Uniti. I dati sono stati analizzati utilizzando un random effects model e test di eterogeneità. Le stime consolidate di efficacia del vaccino rispetto a tutti i ceppi erano del 69% (IC 95%: 46-82) per Q/LAIV e del 47% (IC 95%: 29-61) per QIVe. Le stime rispetto ad A/H3N2 erano del 51% (IC 95%: 33-64) per Q/LAIV e del 46% (IC 95%: 33-56) per QIVe. Le stime rispetto ai ceppi B variavano dal 66 al 79% per Q/LAIV e dal 37 al 73% per QIVe. I test di eterogeneità non erano statisticamente significativi, indicando la coerenza dei risultati dei singoli studi. In conclusione, in base all’analisi condotta dagli autori, Q/LAIV e QIVe hanno mostrato un’effectiveness moderata e comparabile contro l’influenza nei bambini durante la stagione influenzale 2016-2017.
La sicurezza e tollerabilità del vaccino LAIV è ampliamente documentata in letteratura.
La revisione sistematica e network meta-analisi di Minozzi et al. [88] pubblicata nel 2022, ha valutato gli effetti avversi della somministrazione di diversi vaccini antinfluenzali, tra cui il T/LAIV, in bambini di età > 5 anni e ≤ 5 anni. Nel primo caso, sono stati esaminati 59 RCTs per un totale di 77.208 partecipanti. Nessuno dei vaccini è stato associato ad una percentuale significativamente più alta di bambini che riportavano almeno un AE sistemico rispetto al gruppo placebo. Relativamente ai bambini di età ≤ 5 anni, sono stati analizzati 33 RCTs, per un totale di 54.146 partecipanti ed è emerso che solo LAIV era associato a una percentuale più elevata di bambini che riportavano almeno un AE sistemico rispetto al placebo con RR di 1,17 (95%CrI: 1,0-1,37). A causa della scarsità di dati, non è stato possibile valutare la percentuale di eventi avversi nei sottogruppi di bambini immunocompromessi e di bambini con cancro. Con riferimento agli eventi avversi locali, sono stati considerati 55 RCTs per un totale di 64.004 partecipanti. Solo il vaccino LAIV ha mostrato un numero significativamente maggiore di bambini che riportavano almeno un AE locale rispetto al placebo (RR = 1,22; 95%CrI: 1,08-1,38).
Nel 2021 è stata pubblicata la revisione di Gidengil et al. con lo scopo di valutare la sicurezza di diversi vaccini, tra cui anche quelli antinfluenzali e tra questi il Q/LAIV, in diverse fasce di età [92]. Nel caso specifico del vaccino LAIV somministrato nella popolazione pediatrica, non è stato possibile trarre conclusioni sull’aumento del rischio di eventi avversi a causa della scarsità dei dati.
Per completezza del dato, si riportano i risultati derivanti dallo studio pivotale condotto nella popolazione pediatrica [81]. Il profilo di sicurezza del vaccino Q/LAIV è risultato comparabile alle formulazioni trivalenti ad eccezione della febbre più comunemente riferita dopo la prima dose di Q/LAIV rispetto alle formulazioni trivalenti (5,1 vs 3,1%). La febbre alta ≥ 39,5°C è stata riportata infrequentemente. L’evento avverso più comunemente riferito è stato il vomito (2,6% nei vaccinati con Q/LAIV e 2,2% nei soggetti immunizzati con T/LAIV). La frequenza degli eventi avversi è risultata inferiore dopo la seconda dose rispetto alla prima (Q/LAIV 1° = 20% e 2° = 13%; T/LAIV 1° = 23% e 2° = 17%). Nel gruppo che ha ricevuto 2 dosi, i vaccinati con T/LAIV hanno riferito diarrea più frequentemente rispetto al gruppo immunizzato con Q/LAIV (p = 0,02). Relativamente agli AE gravi sono stati segnalati 6 (0,4%) e 5 (0,5%) casi nel gruppo dei vaccinati con Q/LAIV e nel gruppo degli immunizzati con T/LAIV ma nessuno correlato con la vaccinazione [81]. Non sono stati segnalati morti o eventi avversi potenzialmente letali.
Poiché alcuni studi hanno riportato un rischio maggiore di eventi avversi dopo vaccinazione in soggetti con asma e, nella scheda tecnica del prodotto, è riportato che Q/LAIV non deve essere somministrato a bambini e adolescenti affetti da asma severo o da dispnea attiva in quanto questi soggetti non sono stati valutati in specifici studi clinici controllati, alcuni gruppi di ricerca hanno progettato e condotto studi su questa categoria di soggetti per acquisire nuove evidenze scientifiche. Nel 2021 è stata pubblicata una revisione sistematica da Bandell et al. [93] con l’obiettivo di valutare e sintetizzare i dati disponibili sulla sicurezza del vaccino LAIV in individui di età compresa tra 2 e 49 anni con diagnosi di asma o respiro sibilante ricorrente. Il numero di soggetti con asma o respiro sibilante ricorrente variava da 48 a 166.174 nei 14 studi analizzati. La maggior parte degli studi (86%) ha valutato la sicurezza del vaccino LAIV nei bambini e negli adolescenti (età compresa tra 2 e 18 anni), mentre solo due studi hanno valutato la sicurezza del vaccino negli adulti di età compresa tra 18 e 49 anni. In sintesi, questa revisione ha fornito evidenze sul buon profilo di sicurezza del vaccino LAIV in individui con una diagnosi di asma o respiro sibilante ricorrente. Nello specifico, non è stato evidenziato nessun rischio maggiore nei soggetti vaccinati con LAIV rispetto ai controlli non vaccinati per eventi del tratto delle basse vie respiratorie, per respiro sibilante ed esacerbazioni acute dell’asma. Inoltre, nel gruppo vaccinato con LAIV rispetto al gruppo immunizzato con vaccini inattivati non è stato osservato nessun aumento del rischio per accessi al pronto soccorso e visite mediche, mentre, è stata evidenziata una maggiore incidenza di congestione nasale e rinorrea nei soggetti vaccinati con LAIV. Infine, non sono stati osservati cambiamenti nel controllo della malattia rispetto al periodo pre-vaccinazione.
Il profilo di sicurezza di T/LAIV negli Stati Uniti è stato valutato, in fase post-marketing, mediante revisioni periodiche, presentate alle autorità regolatorie, delle segnalazioni spontanee degli eventi avversi a seguito della distribuzione di oltre 60 milioni di dosi. I risultati hanno mostrato come l’incidenza di eventi medicalmente assistiti, in particolare asma e respiro sibilante, non fosse significativamente più alta nei riceventi T/LAIV. Non sono state osservate reazioni anafilattiche entro i 3 giorni post-vaccinazione. L’incidenza di reazioni avverse gravi è stata simile tra i riceventi T/LAIV e i gruppi di controllo e la loro frequenza era bassa nei vaccinati con LAIV [94-96]. In conclusione, questi dati evidenziano un buon profilo di sicurezza del vaccino.
Per quanto riguarda la formulazione quadrivalente uno studio di coorte osservazionale prospettico non randomizzato [97] ha valutato la sicurezza del Q/LAIV nei bambini e negli adulti di età compresa tra 2 e 49 anni durante la stagione influenzale 2013/2014. I tassi di incidenza degli eventi richiedenti assistenza medica e dei ricoveri ospedalieri che si sono verificati nel periodo considerato a rischio (0-3 giorni e 1-42 giorni) dopo la vaccinazione con Q/LAIV sono stati confrontati con i tassi di incidenza durante i periodi di riferimento nel follow-up (7-9 giorni e 43-84 giorni) e con i tassi riferiti al gruppo immunizzato con vaccini influenzali inattivati e al gruppo di controllo (soggetti non vaccinati). Il confronto non ha evidenziato alcun rischio significativamente più elevato di ricoveri o eventi a seguito della somministrazione di Q/LAIV rispetto ai due gruppi di riferimento. I confronti tra i tassi di incidenza dei ricoveri ospedalieri e degli eventi richiedenti assistenza medica non hanno mostrato alcun aumento significativo durante l’intervallo di rischio successivo alla somministrazione di Q/LAIV rispetto al periodo di follow-up. Non vi è stato un rischio significativamente maggiore di eventi che hanno richiesto assistenza medica tra vaccinati con Q/LAIV rispetto ai controlli non vaccinati.
Uno studio di coorte [98] non interventistico post-marketing è stato condotto in Inghilterra, nella stagione influenzale 2014/2015 per valutare la sicurezza di Q/LAIV tramite compilazione di un questionario. L’evento avverso più frequentemente segnalato è stato la congestione nasale (n = 167; 43,4%), seguito dal malessere (n = 87; 22,6%) e tosse (n = 80; 20,8%).
L’esperienza post-marketing italiana è particolarmente recente [99], essendo stato il Q/LAIV utilizzato per la prima volta nella stagione influenzale 2020-21 in bambini di età compresa tra 2 e 17 anni. I dati sono stati acquisiti mediante un questionario con intervista telefonica a 1 e 3 mesi dopo la vaccinazione. Sono stati presi in esame i dati relativi alla vaccinazione di 3.226 bambini. Gli eventi avversi sono stati riportati nel 24,8% dei bambini: 80,6% di entità lieve, 18,1% di livello moderato e 1,3% di entità significativa. I più comuni eventi avversi segnalati sono stati la rinite (52,5%) e la febbre (24,4%). Non sono stati rilevati tosse, distress respiratorio e nemmeno reazioni avverse immediate. L’analisi statistica eseguita con un modello di regressione multipla, ha mostrato che i bambini di età compresa tra 2-5 anni avevano un rischio di eventi avversi maggiore rispetto sia ai bambini di 6-10 anni (aRR = 1,7; IC 95%: 1,5-1,9; p < 0,001) sia agli adolescenti 11-17 anni (aRR = 1,5; IC 95%: 1-2,2; p = 0,051). La prematurità non è stata associata a una maggiore frequenza di effetti collaterali. La maggior parte dei genitori (83,3%) è stata molto soddisfatta e ha dichiarato la volontà di vaccinare nuovamente i propri figli con Q/LAIV (83,8%).
Come precedentemente riportato solo le revisioni Cochrane [60, 61] sono state considerate per le formulazioni trivalenti al fine di ottenere una base per valutare i benefici associati all’utilizzo delle formulazioni quadrivalenti nella popolazione adulta e anziana.
La prima revisione sistematica di Demicheli et al. [60] ha valutato l’efficacia dei vaccini antinfluenzali in adulti sani, utilizzando i dati provenienti da RCTs. Relativamente ai vaccini inattivati sono stati considerati i risultati di 25 studi che hanno confrontato i TIVe con il placebo o con gruppi di controllo. Gli studi erano condotti su singole stagioni influenzali tra il 1969 e il 2009. È emerso che i vaccini inattivati avevano un’efficacia del 59% nel prevenire l’influenza confermata in laboratorio (RR = 0,41; IC 95%: 0,36-0,47). Gli autori hanno riportato che i vaccini inattivati potrebbero ridurre il rischio di influenza negli adulti sani dal 2,3% (senza vaccinazione) allo 0,9% (RR = 0,41; IC 95%: 0,36-0,47) e probabilmente ridurre il rischio di ILI dal 21,5 al 18,1% (RR = 0,84; IC 95%: 0,75-0,95). La seconda revisione sistematica [61] ha valutato l’efficacia dei vaccini inattivati negli anziani, attraverso l’analisi di 8 RCTs (oltre 5.000 partecipanti) in Europa e negli Stati Uniti tra il 1965 e il 2000. È emerso che gli anziani vaccinati avevano una minore probabilità di sviluppare influenza in una singola stagione rispetto al placebo (dal 6 al 2,4%, RR = 0,42; IC 95%: 0,27-0,66). Relativamente alle ILI, gli anziani immunizzati mostravano una minore probabilità di sviluppare ILI rispetto ai non vaccinati (3,5 vs 6%; RR = 0,59; IC 95%: 0,47-0,73).
La prima revisione sistematica e meta-analisi è stata pubblicata nel 2016 da Moa et al. con l’obiettivo di valutare l’immunogenicità relativa dei QIVe vs TIVe nella popolazione adulta (> 18 anni) [100]. Gli autori hanno analizzato i risultati dei RCTs pubblicati fino al giugno 2015 considerando solo i vaccini inattivati a somministrazione intramuscolare. Dei 172 studi valutati, 5 sono stati inclusi nella revisione sistematica e meta-analisi. Nessuna differenza significativa era osservata tra i QIVe e i TIVe per i ceppi A/H1N1, A/H3N2 e il ceppo B in comune mentre era sempre dimostrata la superiorità dei QIVe verso il ceppo B non condiviso indipendentemente dal lineage [pooled seroprotetion RR di 1,14 (IC 95%: 1,03-1,25; p = 0,008) e pooled rate seroconversion RR di 1,78 (IC 95%: 1,24-2,55; p = 0,002) per B/Victoria e pooled seroprotetion RR di 1,12 (IC 95%: 1,02-1,22; p = 0,01) e pooled rate seroconversion di 2,11 (IC 95%: 1,51-2,95; p < 0,001) per B/Yamagata. In particolare, due studi hanno valutato l’immunogenicità in soggetti d’età > 60 anni. In questa classe d’età era osservata una risposta anticorpale simile tra i QIVe e i TIVe per gli strain A e una maggiore immunogenicità per il lineage B non compreso nei TIVe [100].
Nel 2019 il nostro gruppo di ricerca ha condotto una revisione sistematica e metanalisi sui QIVe [1] considerando diversi outcomes (immunogenicità, efficacia e sicurezza) e tutte le fasce d’età. Relativamente all’immunogenicità assoluta per la popolazione adulta in età lavorativa sono state considerate 21 stime e la maggior parte degli studi (71-100%) soddisfacevano i criteri regolatori proposti da CHMP e CBER. Le stime meta-analitiche di SCR (59,0-64,4%) e di SPR (97,2-98,7%) erano simili per tutti i quattro ceppi. L’eterogeneità osservata era elevata (I2 > 75%) in tutte le meta-analisi. Considerando la popolazione anziana, sono stati inclusi nell’analisi 13 studi. Tutti gli studi analizzarono solo la risposta immunitaria verso i ceppi A/H1N1, A/H3N2, B/Victoria e B/Yamagata omologhi. Nell’anziano la maggior parte degli studi soddisfaceva i criteri CHMP e CBER. L’unica eccezione ha riguardato il criterio di SCR di CBER nei confronti del lineage B/Victoria: tale parametro era soddisfatto solo nel 46% degli studi esaminati. Rispetto alla popolazione adulta, il range tra le stime pooled è risultato più ampio sia per SCR (41,5-55,4%) che per SPR (91,0-94,7%). Relativamente all’immunogenicità relativa, tutti gli studi inclusi analizzarono solo la risposta immune verso i ceppi A/H1N1, A/H3N2, B/Victoria e B/Yamagata omologhi. Negli adulti QIVe non era generalmente statisticamente inferiore a TIVe per tutti i ceppi condivisi. L’unica eccezione ha riguardato il parametro relativo a ΔGMT(QIVe - TIVe-Yam) verso il sottotipo A/H3N2, laddove la formulazione trivalente era associata a un GMT statisticamente più alto. Per quel che riguarda i ceppi non condivisi QIVe è stato sempre statisticamente superiore rispetto a TIVe, indipendentemente dal lineage e parametro considerato. L’eterogeneità osservata tra gli studi era alta (I2 > 75%.). Negli anziani i QIVe non erano generalmente statisticamente inferiori ai TIVe per tutti i ceppi condivisi tranne due eccezioni relative a: (i) ΔGMT(QIVe - TIVe-Yam) verso il sottotipo A/H3N2, laddove QIVe era associato a un GMT statisticamente più alto; (ii) gli anziani vaccinati con QIVe erano del 20% (IC 95%: 2-41%) più propensi a sierconvertire rispetto a quelli immunizzati con TIVe-Yam. Per quel che riguarda i ceppi non condivisi QIVe era sempre statisticamente superiore rispetto a TIVe, indipendentemente dal lineage e parametro considerato. L’eterogeneità osservata è risultata molto alta (I2 > 75%).
Nel 2020, Meng et al. hanno pubblicato una revisione sistematica e meta-analisi sull’immunogenicità dei QIVe nella popolazione anziana [101]. Gli autori hanno analizzato i RCTs pubblicati tra il 1/1/2008 e il 10/11/2018. L’immunogenicità per A/H1N1, A/H3N2, B/Victoria e B/Yamagata era misurata come SPR e SCR. L’outcome primario era la differente risposta anticorpale pooled (SPR e SCR) osservata nella popolazione adulta (18-60 anni) e negli anziani (≥ 60 anni). L’outcome secondario era l’associazione tra i valori di immunogenicità ed effectiveness. Dei 309 studi valutati, 6 studi furono inclusi nella meta-analisi (tutti condotti nell’emisfero settentrionale). Gli autori hanno riportato che negli anziani i SPR e i SCR erano inferiori rispetto a quelli osservati negli adulti per A/H1N1 e B/Victoria. Inoltre, hanno osservato un SCR più basso per B/Yamagata e risposte anticorpali per A/H3N2 simili nei due gruppi d’età. Infine, hanno evidenziato valori di RR di SPR e SCR variabili tra 0,77 e 0,94 indicando l’assenza di un’associazione significativa tra invecchiamento e risposte anticorpali. Nell’analisi di sensibilità, hanno evidenziato che le risposte anticorpali (SPR e SCR) verso A/H3N2 negli anziani avrebbero potuto aumentare nel tempo se fosse stata posticipata la valutazione dei titoli anticorpali dal giorno 21 al giorno 28, indicando questo slittamento temporale come suggerimento utile per la programmazione di studi clinici negli anziani. Relativamente all’outcome secondario, gli autori hanno riportato che le risposte anticorpali al vaccino non erano significativamente associate all’effectiveness; infatti, le risposte anticorpali per A/H3N2 non erano inferiori rispetto a quelle per A/H1N1 e per i due lineages B contrariamente al fatto che l’effectiveness verso A/H3N2 era generalmente più bassa. Alcuni studi hanno osservato, in soggetti anziani vaccinati che svilupparono malattia da A/H3N2 confermata in laboratorio, livelli di titoli anticorpali specifici simili rispetto a quelli rilevati in soggetti vaccinati che non svilupparono malattia [101].
Ad oggi non risultano pubblicati studi di efficacia teorica condotti su QIVe nella popolazione adulta e anziana. Gli studi pubblicati si riferiscono alla popolazione pediatrica.
Solo una revisione è stata identificata e ritenuta idonea per il presente report.
Nel 2017 Rondy et al. [102] hanno pubblicato una revisione sistematica e meta-analisi degli studi caso-controllo con disegno test negativo che avevano come obiettivo quello di valutare l’effectiveness assoluta nei confronti delle ospedalizzazioni per influenza confermata in laboratorio in adulti (18-64 anni) e anziani (≥ 65 anni). Gli autori hanno identificato 3411 pubblicazioni e 30 sono state considerate per l’analisi (periodo temporale considerato: 2010-2011-2014-2015). L’effectiveness assoluta pooled è risultata del 41% (IC 95%: 34-48) verso qualsiasi ceppo, del 51% (IC 95%: 44-58) nei soggetti d’età tra 18-64 anni e del 37% (IC 95%: 30-44) nella popolazione anziana. Considerando i diversi ceppi, l’effectiveness è risultata del 48% (IC 95%: 37-59) per A/H1N1, del 37% (IC 95%: 24-50) per A/H3N2 e del 38% (IC 95%: 23-53) per i ceppi B tra adulti di tutte le età. Nella popolazione anziana l’effectiveness contro A/H3N2 era del 43% (IC 95%: 33-53) nelle stagioni di machting antigenico mentre è risultata del 14% (IC 95%: -3-30) quando predominavano varianti A/H3N2 antigenicamente diverse dai ceppi vaccinali.
I dati riferiti all’effectiveness relativa dei QIVe vs QIVc sono riportati nel capitolo 4.
La revisione sistematica e meta-analisi di Moa et al. [100] ha valutato la sicurezza e la tollerabilità dei QIVe vs TIVe nella popolazione adulta (>18 anni). Non sono state evidenziate differenze significative tra i QIVe e i TIVe per eventi avversi locali e sistemici riferiti entro sette giorni dalla vaccinazione. Non sono stati riportati eventi avversi gravi correlati ai QIVe. Rispetto ai TIVe, il dolore al sito di iniezione era più comune per i QIVe, con un RR aggregato di 1,18 (IC 95%: 1,03-1,35; p = 0,02). La valutazione della sicurezza, considerando la segnalazione di eventi avversi non sollecitati a 21 giorni o 6 mesi dopo la vaccinazione, non ha mostrato alcuna differenza significativa tra i QIVe e i TIVe. In particolare, le naso-faringiti, la tosse e oro-faringiti erano gli eventi avversi maggiormente segnalati in entrambi i gruppi.
La revisione sistematica e metanalisi sui QIVe, condotta dal nostro gruppo di ricerca nel 2019 [1], ha valutato i dati relativi a sicurezza e tollerabilità derivanti dai RCTs. Negli studi esaminati la frequenza degli eventi avversi sollecitati variava notevolmente in base all’età. L’evento avverso sollecitato locale più frequente era il dolore nel sito di inoculo con un’incidenza variabile tra il 17 e il 73%. Tra gli eventi sistemici, i più frequenti erano la mialgia (range: 7-51%) e il malessere/affaticamento (range: 3-34%). La maggior parte degli eventi avversi era di entità lieve con spontanea risoluzione entro 3 giorni [1]. Nei RCTs esaminati il profilo di reattogenicità dei QIVe era generalmente confrontabile con quello dei TIVe. Infatti, la meta-analisi non ha evidenziato alcun aumento del rischio nei soggetti immunizzati con i QIVe rispetto a quelli vaccinati con i TIVe per quel che riguarda l’eritema [RR = 1,19 (IC 95%: 0,99-1,41)], l’indurimento [RR = 1,21 (IC 95%: 0,99-1,48)], i brividi [RR = 1,18 (IC 95%: 0,82-1,71)], il malessere/affaticamento [RR = 1,00 (IC 95%: 0,95-1,06)], la mialgia [RR = 1,07 (IC 95%: 0,99-1,14)], l’artralgia [RR = 1,19 (IC 95%: 0,99-1,43)] e il mal di testa [RR = 0,77 (IC 95%: 0,45-1,32)]. Tuttavia, il rischio di dolore nel sito di inoculo [RR = 1,15 (IC 95%: 1,05-1,25)] e di febbre [RR = 1,15 (IC 95%: 1,01-1,30)] era del 15% più elevato nei soggetti vaccinati con QIVe rispetto ai soggetti immunizzati con TIVe [1].
I dati descritti sono in linea con i RCP dei QIVe autorizzati in Italia [54-56].
In Europa, dalla stagione 2014/15 l’Agenzia europea per i medicinali (EMA) richiede ai produttori di vaccini influenzali di condurre annualmente Enhanced Safety Surveillances (ESS) sui vaccini commercializzati.
Nel 2018, de Lusignan et al. [103] hanno pubblicato i risultati della sorveglianza ESS del vaccino Fluarix Tetra per la stagione 2016/17. Lo studio è stato condotto Inghilterra e ha monitorato (sia in modalità attiva che passiva) gli eventi avversi verificatesi nei 7 giorni dopo la vaccinazione. La popolazione dello studio era composta da soggetti d’età > 6 mesi. L’ESS non ha rivelato alcuna valutazione nel profilo di sicurezza. In particolare, nel periodo dello studio i medici delle cure primarie vaccinarono il 13,1% (12.864/98.091) dei loro assistiti. Il 5,6% (IC 95%: 5,20-6,00) riportò almeno un evento avverso di interesse, nessuno dei quali fu classificato come serio. Gli eventi avversi riportati più frequentemente erano: eventi respiratori (2,60% IC 95%: 2,33-2,88), disordini muscoloscheletrici (1,82 IC 95%: 1,59-2,05) ed eventi neurologici (1,05 IC 95%: 0,88-1,23). Gli adulti hanno riportano un numero maggiore di eventi avversi rispetto bambini (5,9 vs 1,5%). Nei soggetti over 65 la frequenza di eventi avversi fu del 5,66% (IC 95%: 5,16-6,17).
Gandhi-Banga et al. hanno pubblicato [76] nel 2019 i risultati della sorveglianza EPSS 2017-18 condotta in Inghilterra e Irlanda per i vaccini commercializzati da Sanofi. L’obiettivo primario era valutare I tassi di reazioni avverse nei primi 7 giorni dopo la vaccinazione. Considerando il vaccino Vaxigrip Tetra, a 957 soggetti vaccinati è stata consegnata una carta di vaccinazione e 20 soggetti (2,1%) hanno riportato 56 eventi avversi. Le reazioni più frequenti erano mal di testa, febbre e infiammazione al sito d’iniezione. Nessun cambio nel profilo di sicurezza è stato osservato.
Dos Santos et al. hanno pubblicato nel 2020 i risultati relativi alla ESS condotta nella stagione 2018/19 sul QIVe di GSK. In totale 1035 soggetti (bambini e adulti) completarono lo studio. Il 43% dei soggetti riferirono almeno un evento avverso entro 7 giorni dalla vaccinazione. Gli eventi avversi più frequenti erano: il dolore e gonfiore al sito d’inoculo, eritema e sintomi respiratori (rinorrea, tosse, congestione nasale). Nessun evento avverso grave fu segnalato [77].
Nel 2021 sono stati pubblicati i risultati relativi a EPSS condotta in Danimarca e Finlandia sul vaccino Vaxigrip Tetra durante la stagione 2018/2019. 162 eventi avversi erano riportati da 53 partecipanti. Dolore e infiammazione al sito di vaccinazione, mialgia e mal di testa erano gli eventi più frequenti. I tassi di segnalazione sono stati più bassi rispetto a quelli riportati in RCP. In conclusione, EPSS non ha evidenziato nessun cambiamento nel profilo di sicurezza [104].
Come descritto precedentemente, al fine di migliorare l’efficacia dei vaccini influenzali sono stati sviluppati preparati innovativi con approcci diversi rispetto a quelli tradizionali. Attualmente in Italia è autorizzato un vaccino quadrivalente (QIVr). Le caratteristiche principali sono riportate in tabella 4. Occorre sottolineare che QIVr contiene un quantitativo di antigene per ogni ceppo più elevato (45 μg per antigene) rispetto ai QIVe standard (15 μg per antigene) attualmente autorizzati. Gli antigeni ricombinanti dell’emoagglutinina (rHA) sono glicoproteine a lunghezza intera con peso molecolare di circa 65kDa. L’rHA si assembla in trimeri con un peso molecolare approssimativo di 195 kDa. La struttura funzionale comprende complessi a rosetta e l’emoagglutinina ricombinante è espressa in cellule di insetto expressSF+ (derivate da cellule di Spodoptera frugiperda) utilizzando i baculovirus [Autographa californica Nuclear Polyhedrosi Virus (AcNPV)] come vettore per le proteine di espressione [52].
Attualmente, non sono disponibili in letteratura revisioni sistematiche riportanti dati di immunogenicità del vaccino ricombinate. Pertanto, sono stati analizzati i risultati degli RCTs riportati in RCP.
Lo studio di Baxter R et al. [105] ha investigato l’immunogenicità del vaccino ricombinante in adulti sani di età compresa tra i 50 e i 64 anni randomizzati per ricevere TIVr (300 soggetti) o TIVe (302 individui). Sono state misurate le risposte anticorpali utilizzando il test HAI al basale e 28 giorni dopo la vaccinazione. Lo studio ha dimostrato la non inferiorità di TIVr rispetto a TIVe. I tassi di sieroconversione (utilizzando i criteri CBER [63]) sono risultati del 72% per A/H1N1 e del 61% per A/H3N2 nel gruppo vaccinato con TIVr rispetto al 66 e al 44% negli immunizzati con TIVe. I tassi di sieroconversione per virus B erano 41% per entrambi i gruppi. TIVr ha soddisfatto i criteri prestabiliti per A/H1N1 e A/H3N2, ma non per B/Malaysia/2506/2004 (IC 95% inferiore = 35,2). Il gruppo immunizzato con TIVe ha rispettato il criterio CBER per A/H1N1 ma non per H3N2 (IC 95% inferiore = 38,0%) e per B/Malasya (IC 95% inferiore = 35,5). Il tasso di sieroprotezione per A/H3N2 era più alto nel gruppo TIVr (85%) rispetto al gruppo TIVe (75%). I GMT erano più alti nel gruppo vaccinato con TIVr per A/H1N1 (181 vs 140) e A/H3N2 (105 vs 61) mentre erano comparabili per virus B (111 vs 116).
L’RCT di Dunkle et al. [106] ha valutato l’immunogenicità del vaccino QIVr in comparazione con i vaccini inattivati in soggetti di età compresa 18-49 anni. 1350 soggetti sono stati randomizzati con un rapporto 3:1. I prelievi sono stati eseguiti al giorno 0 e al giorno 28 e il test utilizzato era HAI. Sono stati valutati i GMT e SCR. Il vaccino QIVr ha confermato la non inferiorità rispetto al QIVe. Inoltre, i titoli anticorpali nel gruppo vaccinato con QIVr erano più elevati per A/Texas/50/2012 rispetto al gruppo immunizzato con QIVe, mentre i livelli dei titoli anticorpali erano bassi verso B/Brisbane/60/2008 in entrambi i gruppi. In conclusione, il primo RCT condotto per comparare l’immunogenicità di QIVr vs QIVe ha dimostrato la non inferiorità del vaccino ricombinante rispetto al vaccino inattivato prodotto su uova.
In un altro studio [107], ottantanove adulti di età compresa tra 65 e 74 anni sono stati arruolati con l’obiettivo di valutare l’immunogenicità di QIVr, TIV-HD e aTIV verso ceppi A/H3N2 cresciuti in coltura cellulare. I partecipanti sono stati randomizzati 1:1:1 per ricevere TIV-HD, aTIV o QIVr. I ricercatori hanno raccolto anche l’informazione di vaccinazione della stagione precedente (2016-17) riportando che tutti i soggetti erano stati immunizzati con TIVe. Il prelievo è stato eseguito al basale (giorno 0) e 28 giorni dopo la vaccinazione e il siero è stato saggiato con il test di microneutralizzazione per valutare i titoli verso quattro virus A/H3N2 propagati nelle cellule: virus ceppo vaccinale 2017/2018 (clade 3C.2a), virus circolanti da clade 3C.2a1 e 3C.2a2 e ceppo “antigenicamente avanzato” clade 3C.3a (ceppo vaccinale 2019/20). Nel gruppo vaccinato con QIVr è stato osservato un aumento maggiore dei titoli (2,0; IC 95%: 1,7-2,5) rispetto al gruppo immunizzato con TIV-HD (1,6; IC 95%: 1,3-1,8). Inoltre, nel gruppo vaccinato con QIVr si sono osservati titoli post vaccinali più elevati contro i virus 3C.2a1 e 3C.2a2, e l’aumento medio era due volte più alto rispetto a TIV-HD e aTIV. Contro il virus 3C.3a antigenicamente avanzato, QIVr ha determinato un aumento medio superiore dei titoli anticorpali (2,9; IC 95%: 2,0-4,3) rispetto a TIV-HD (1,3; IC 95%: 1,1-1,6) e aTIV (1,7; IC 95%: 1,3-2,1). Gli sperimentatori sono giunti alla conclusione che i vaccini ad alto dosaggio, adiuvati e ricombinanti generavano risposte anticorpali neutralizzanti non ottimali per il ceppo vaccinale cresciuto in coltura cellulare, tuttavia, è stato osservato che QIVr suscitava una maggiore risposta cross-protettiva contro i virus circolanti e antigenicamente avanzati.
Durante la stagione 2018-2019 è stato condotto un RCT [108] in personale sanitario di età compresa tra 18 e 64 anni per comparare la risposta immunitaria umorale stimolata dalla vaccinazione con QIVr, QIVc e QIVe. I partecipanti sono stati suddivisi in due sottogruppi di età (18-44 e 45-64) e randomizzati per ricevere QIVr, QIVc e QIVe. Per ogni arruolato sono stati raccolti campioni di siero prima della vaccinazione e a 1 e 6 mesi dopo la vaccinazione. I campioni di siero sono stati testati mediante il test HAI per valutare SCR, GMT, MFR (mean fold rise) verso A/H1N1, B/Yamagata, B/Victoria e il test di microneutralizzazione per i ceppi A/H3N2 coltivati su cellule. In totale sono stati inclusi 727 partecipanti (283 vaccinati con QIVc, 202 immunizzati con QIVr e 242 vaccinati con QIVe). A 1 mese dalla vaccinazione la risposta immunitaria nel gruppo vaccinato con il QIVc era simile a quella del gruppo vaccinato con QIVe in termini di SCR, GMT, tasso di GMT e MFR mentre il tasso GMT dei vaccinati con QIVr era superiore rispetto al gruppo immunizzato con QIVe con valori pari a 1,5 (IC 95%: 1,2-1,9) per A/H1N1, 3,0 (IC 95%: 2,4-3,7) per A/H3N2, 1,1 (IC 95%: 0,9-1,4) per B/Yamagata e 1,1 (IC 95%: 0,9-1,3) per B/Victoria. A 6 mesi dalla vaccinazione, i vaccinati con QIVc avevano GMT simili a quelli immunizzati con QIVe mentre i vaccinati con QIVr avevano un GMT più alto per A/H3N2 e B/Yamagata. Dai risultati ottenuti è emerso un buon profilo di immunogenicità dei vaccini antinfluenzali quadrivalenti basati su colture cellulari e ricombinanti rispetto ai vaccini prodotti su uova. Il vaccino QIVr ha indotto risposte anticorpali più robuste rispetto ai vaccini prodotti su uova a dose standard per A/H1N1, A/H3N2 e B/Yamagata un mese dopo la vaccinazione mentre la risposta verso il virus B/Victoria è risultata simile [108].
Due revisioni sistematiche sono state individuate e incluse nel presente report.
Molto recentemente, è stata pubblicata una revisione sistematica sull’efficacia, effectiveness e sicurezza del vaccino ricombinante nel prevenire l’influenza confermata in laboratorio nei soggetti di età ≥18 anni [109].
I dati sono stati ricercati dagli autori consultando database elettronici e fonti di letteratura grigia fino al 7 febbraio 2020. Secondo i criteri di inclusione erano ammissibili gli RCTs, gli studi controllati non randomizzati, gli studi quasi sperimentali, gli studi prospettici e retrospettivi di coorte, gli studi caso-controllo e gli studi che applicano un disegno “test negative” e gli studi analitici trasversali. La popolazione della revisione sistematica era costituita da soggetti adulti (persone di età pari o superiore a 18 anni) e anziani che presentavano qualsiasi stato di salute e arruolati in diversi setting. I vaccini di interesse erano i vaccini ricombinanti trivalenti e quadrivalenti stagionali. La ricerca bibliografica ha individuato 28.846 record, di cui 10 studi sul vaccino ricombinante.
Per l’efficacia sono stati considerati due studi.
Lo studio randomizzato, in doppio cieco e multicentrico di Dunkle et al. [110] aveva l’obiettivo di valutare l’efficacia relativa del QIVr rispetto a QIVe contro l’influenza di qualsiasi ceppo confermata in laboratorio tramite test RT-PCR e coltura cellulare in una popolazione di età ≥ 50 anni nella stagione 2014/2015. La diagnosi di infezione influenzale era effettuata su tamponi nasofaringei ottenuti da partecipanti con sintomi di ILI. L’endpoint primario era la malattia simil-influenzale confermata da RT-PCR 14 giorni dopo la vaccinazione. In totale, sono stati arruolati 9.003 soggetti, sottoposti a randomizzazione; 8.855 (98,4%) sono stati vaccinati e sottoposti ad un follow-up di efficacia e di questi 8.604 (95,6%) hanno completato il follow-up. Tra i vaccinati con QIVr, il tasso di attacco influenzale confermato in laboratorio è risultato del 2,2%. Sono stati rilevati un totale di 181 casi di influenza A/H3N2, 47 casi di influenza B e 6 casi di influenza A non sottotipizzabile. La probabilità di malattia simil-influenzale è risultata inferiore del 30% nei vaccinati con QIVr rispetto a quelli immunizzati con il vaccino standard (IC 95%: 10-47; p = 0,006) e soddisfaceva i criteri di non inferiorità pre-specificati nell’analisi primaria e i criteri di superiorità nell’analisi esplorativa. Inoltre, in un’analisi dei sottogruppi per ceppo influenzale, l’efficacia relativa è risultata più elevata per l’influenza A (36%, IC 95%: 14-53); nessuna differenza è stata osservata per i ceppi B. In conclusione, QIVr ha mostrato una migliore protezione contro la malattia simil-influenzale confermata in laboratorio rispetto ai vaccini standard.
L’altro studio considerato nella revisione di O Murchu [109] è quello di Treanor et al. [111] che aveva come obiettivo quello di confrontare la vaccinazione con il vaccino TIVr con il placebo in adulti di età compresa tra 18 e 55 anni durante la stagione 2007/2008. Gli autori hanno riportato una maggiore efficacia per il TIVr rispetto al placebo con una VE = 44,6% (IC 95%: 18,8-62,6) per tutti ceppi, una VE = 54,4% per influenza A (IC 95%: 26,1-72,5) e una VE = 23,1% (IC 95%: -49-60,9) per influenza B. L’analisi dei sottogruppi per età ha riportato un effetto significativo per i soggetti di età compresa tra i 50 e i 64 anni con un’efficacia relativa del 42% (IC 95%: 15-61), ma non per gli individui di età superiore a 64 anni (VE = 17%, IC 95%: -20-43). Sulla base dei risultati ottenuti, Murchu et al. hanno concluso che i dati relativi all’efficacia del vaccino ricombinante sono limitati ma evidenziano che il vaccino fornisce una maggiore protezione contro l’influenza rispetto al placebo. Inoltre, hanno osservato che il vaccino ricombinante ha un’efficacia maggiore rispetto alla vaccinazione antinfluenzale tradizionale e ipotizzano che questo effetto possa essere attribuibile sia al nuovo processo di allestimento che riduce le mutazioni egg-adaptive sia alla superiore quantità di antigene rispetto al preparato standard.
Anche la revisione sistematica condotta dall’ECDC [112] ha valutato l’efficacia del vaccino ricombinante includendo i medesimi studi di O Murchu et al [109]. È riportato che il vaccino ricombinante fornisce un maggiore effetto protettivo contro l’influenza rispetto a nessuna vaccinazione e alla vaccinazione antinfluenzale tradizionale (evidenza di moderata certezza). In generale, i risultati di questi studi sembrano suggerire che i vaccini ricombinanti possano offrire anche una possibile protezione crociata verso varianti antigeniche.
La nostra revisione di letteratura non ha individuato nessuna revisione sistematica riportante dati di effectiveness assoluta del vaccino ricombinante. Anche le revisioni sistematiche di O Murchu et al. [109] e dell’ECDC [112] non riportano alcun dato di effectiveness. I pochi studi che riportano dati di effectiveness relativa vs vaccini inattivati e il vaccino prodotto su coltura cellulare sono riportati nel capitolo 4. In questo paragrafo si riporta solo il dato di effectiveness relativa derivante dallo studio di Izurieta et al. [113] riferito alla stagione 2019/2020. Lo studio di coorte retrospettivo è stato condotto in US nella popolazione over 65 assicurata con Medicare e ha considerato tutti i tipi di vaccini disponibili. Nell’analisi aggiustata, QIVr è risultato significativamente più efficace nel prevenire le ospedalizzazioni rispetto a QIVe con un’effectiveness relativa pari al 13,3% (IC 95%: 7,4-18,9). Gli autori sottolineano che la stagione è stata caratterizzata dalla circolazione del ceppo B/Victoria e di A/H1N1.
Relativamente al parametro di sicurezza e tollerabilità riferito ai RCTs, analizzando gli studi considerati nel paragrafo dell’immunogenicità [105-108], solo due studi hanno riportato dati sulla sicurezza.
Lo studio di Baxter et al. [105] includeva due gruppi di studio: il primo vaccinato con TIVr e il secondo con TIVe. Entrambi i vaccini sono risultati sicuri con un livello di reattogenicità sovrapponibile. Un evento serio è stato registrato nel gruppo vaccinato con TIVr corrispondente a una sincope vasovagale di gravità moderata. Il più frequente evento di reattogenicità riportato è stato il dolore al sito di iniezione (51% per TIVr vs 55% per TIVe) seguito da mal di testa (20% per TIVr vs 21% per TIVe). La maggior parte degli eventi sono stati segnalati il giorno della vaccinazione (giorno 0) e generalmente la gravità diminuiva nel corso dei giorni successivi. Sono stati registrati tre casi di febbre lieve nel gruppo vaccinato con TIVr rispetto al gruppo immunizzato con TIVe.
Lo studio di Dunkle et al. [106] ha riportato che il vaccino ricombinante aveva un profilo di sicurezza comparabile con quello del QIVe. Nello specifico, non sono stati segnalati decessi ed eventi avversi gravi associati al vaccino. Relativamente alla reattogenicità è stata osservata una frequenza simile per numerosità e gravità in entrambi i gruppi; il dolore e l’indolenzimento al sito di iniezione è stato riportato in circa il 50% dei soggetti. L’eritema nel sito di iniezione è risultato più frequente nel gruppo vaccinato con QIVr. La percentuale di eventi avversi spontanei riportati dopo 28 giorni era simile nei due gruppi di studio.
Analizzando gli studi considerati nel paragrafo dell’efficacia, lo studio di Dunkle et al. [110], riferito ad una popolazione di soggetti di età > 50 anni, ha riportato che il profilo di sicurezza era simile nei gruppi di studio. In particolare, nel periodo dello studio (6 mesi dalla vaccinazione) il 3,4 e il 3,0% dei vaccinati con QIVr e QIVe rispettivamente avevano segnalato almeno un evento avverso grave ma nessuno è stato considerato correlato con la vaccinazione. Eventi avversi non seri erano segnalati di lieve o moderata gravità e comunque non associati al vaccino.
Lo studio di Treanor [111] ha valutato la sicurezza del vaccino ricombinante rispetto al gruppo placebo. Gli autori hanno riportato che i tassi degli eventi avversi locali e sistemici erano bassi e simili nei due gruppi. Nei 7 giorni dopo la vaccinazione il dolore al sito di iniezione era significativamente più frequente nel gruppo vaccinato rispetto al gruppo placebo. Nessuna differenza significativa era evidenziata relativamente ai sintomi sistemici e i più frequenti erano mal di testa, fatica e spossatezza tutti di entità moderata.
Considerando la revisione sistematica di O Murchu [109], gli autori hanno analizzato 10 studi e hanno riportato quanto segue: la stima pooled ha evidenziato che per tutte le reazioni locali i vaccini ricombinanti mostravano una significativa minore frequenza rispetto ai vaccini tradizionali [RR = 0,94 (IC 95%: 0,90-0,98)] mentre per gli eventi sistemici il vaccino ricombinate era associato ad un maggiore rischio di brividi [RR = 1,33 (IC 95%: 1,03-1,72)].
La revisione sistematica condotta da ECDC [112] riporta gli stessi dati della revisione sistematica di O Murchu [109].
La sorveglianza post-marketing è fondamentale per comprendere i benefici e i rischi dei vaccini quando sono utilizzati nella campagna di vaccinazione di routine. Pertanto, abbiamo ritenuto opportuno includere studi osservazionali pubblicati recentemente.
Lo studio osservazionale di fase 4 post-marketing [114] condotto in California del Nord in soggetti di età ≥ 18 anni aveva come obiettivo quello monitorare il livello di sicurezza del vaccino TIVr e confrontarlo con i vaccini inattivati standard. Sono stati considerati i tassi di malattie di interesse (sindrome Guillain-Barré, pericardite, versamento pleurico, narcolessia/cataplessia, asma, reazioni acute di ipersensibilità e febbre) durante intervalli predefiniti post-vaccinazione, le ospedalizzazioni e la mortalità per tutte le cause nel periodo 0-180 giorni dopo la vaccinazione. Confrontando 21.976 persone che avevano ricevuto TIVr con 283.683 soggetti immunizzati con TIVe, sono state registrate differenze statisticamente significative tra i 2 gruppi. In particolare, è stata associata alla vaccinazione con TIVr una minore frequenza di febbre durante il periodo di 41 giorni dopo la vaccinazione (OR = 0,38; IC 95%: 0,14-0,86). Inoltre, TIVr era associato ad un minor numero di ricoveri per tutte le cause entro i 180 giorni dopo la vaccinazione (OR = 0,66; IC 95%: 0,61-0,73). Non sono stati registrati eventi avversi gravi o decessi correlati a TIVr. Lo studio non ha identificato alcun problema di sicurezza per quanto riguarda l’uso di TIVr negli adulti [114].
Il report Adverse Event Reporting System (VAERS) US [115] ha riportato che dall’approvazione della formulazione quadrivalente (ottobre 2016) fino al 30 giugno 2020 erano state notificate 849 segnalazioni dopo la vaccinazione con QIVr; il 95% (810) non era grave. Tra gli eventi gravi, si sono verificati 10 casi di sindrome di Guillain-Barré, di cui 5 persone hanno richiesto la ventilazione meccanica e 2 sono decedute. Molte reazioni allergiche sono state segnalate come non gravi, ma richiedenti trattamenti salvavita. Il verificarsi di anafilassi e altre reazioni allergiche riflette una predisposizione individuale e non suggerisce necessariamente che QIVr sia particolarmente allergenico.
Come descritto precedentemente il primo vaccino prodotto su uova ad alto dosaggio era trivalente. I primi RCTs sono stati condotti a partire dal 2002 e hanno portato all’approvazione del TIV-HD negli Stati Uniti nel 2009. Tutti i RCTs hanno dimostrato che TIV-HD era più immunogeno rispetto ai vaccini trivalenti tradizionali senza causare aumenti significativi del tasso o gravità di reazioni avverse [38-40].
Nell’ottica di un miglioramento, la formulazione trivalente è stata sostituita da quella quadrivalente ed è stato applicato il processo di “immunobridging” che consente di trasporre tutti i dati e le evidenze acquisite di immunogenicità, efficacia, effectiveness e sicurezza dalla formulazione trivalente a quella quadrivalente.
Le caratteristiche del vaccino sono riportate in Tabella 5.
La sicurezza e l’immunogenicità di QIV-HD sono state valutate in uno studio randomizzato in doppio cieco multicentrico dove soggetti d’età ≥65 anni hanno ricevuto il QIV-HD o il TIV-HD [116]. Gli obiettivi primari erano valutare la sicurezza e la tollerabilità del nuovo vaccino e dimostrarne la non inferiorità rispetto al TIV-HD per i ceppi virali in comune e la superiorità per il ceppo B non condiviso. I soggetti arruolati sono stati randomizzati in un rapporto 4:1:1 (gruppo 1: vaccinato con QIV-HD, gruppo 2: immunizzato con TIV-HD contenente un ceppo B incluso nel QIV-HD e gruppo 3: vaccinato con un TIV-HD contenente l’altro ceppo B incluso nel QIV-HD). Gli endpoints primari per la valutazione dell’immunogenicità erano i titoli anticorpali misurati con il test HAI al giorno 28 dopo la vaccinazione e il tasso di sieroconversione. Lo studio ha incluso 2670 soggetti ed è stata dimostrata la non inferiorità del QIV-HD rispetto ai due TIV-HD in comparazione per i ceppi virali in comune e la superiorità del QIV-HD per il ceppo B non condiviso [116].
Attualmente sono pubblicate 3 revisioni sistematiche e meta-analisi sull’immunogenicità di TIV-HD.
Nella revisione di Samson et al. [117] gli autori hanno revisionato sistematicamente gli studi clinici di immunogenicità (condotti nel periodo 2000-2018) che hanno confrontato la risposta immunitaria del TIV-HD rispetto ai TIVe con l’obiettivo di comprendere meglio il vantaggio del vaccino ad alto dosaggio nella prevenzione dell’influenza nella popolazione anziana (età ≥ 65 anni). Sono stati individuati 25 studi ma solo 7 sono stati considerati nell’analisi metanalitica che includevano più di 18.500 soggetti. I rapporti combinati dei GMT HAI rilevati dopo 1 mese dalla vaccinazione sono risultati pari a 1,74 (IC 95%: 1,65-1,83) per A/H1N1, 1,84 (IC 95%: 1,73-1,95) per A/H3N2 e 1,47 (IC 95%: 1,36-1,58) per l’influenza B. La media geometrica dei titoli di inibizione dell’emoagglutinazione osservata nei vaccinati con TIV-HD è risultata del 74% più alta per A/H1N1, dell’84% per A/H3N2 e del 47% per l’influenza B rispetto ai soggetti immunizzati con TIVe. La maggiore immunogenicità nei vaccinati con TIV-HD era indipendente dal sesso, dall’età, dalle condizioni cliniche ad alto rischio sottostanti e dalla fragilità. Inoltre, TIV-HD si è dimostrato più immunogenico di TIVe anche negli individui immunocompromessi e negli adulti di età compresa tra 50 e 64 anni. Gli autori hanno riportato che il loro risultato supporta una superiore efficacia del vaccino TIV-HD nel prevenire l’influenza confermata in laboratorio e una migliore effectiveness contro le malattie simil-influenzali e ospedalizzazione associata all’influenza.
La seconda revisione è stata pubblicata nel 2019 da Ng et al. [118] con l’obiettivo di valutare i miglioramenti nelle risposte anticorpali, misurate con il test HAI, a seguito di immunizzazione con vaccini potenziati quali il vaccino adiuvato con MF-59, il vaccino intradermico e il vaccino ad alto dosaggio. Utilizzando modelli a effetti casuali sono stati confrontati i vaccini potenziati tra di loro e con il vaccino a dose standard. L’immunogenicità è stata valutata misurando: a) l’aumento medio (MFR) in GMT dal giorno 0 al giorno 30 nei soggetti vaccinati; b) il rapporto tra le GMT post-vaccinazione (giorno 30) nel gruppo immunizzato con un vaccino potenziato rispetto al gruppo vaccinato con un vaccino standard; c) la differenza assoluta nella proporzione di partecipanti con titoli ≥ 40 1 mese dopo la vaccinazione confrontando i diversi gruppi di studio. I risultati sono stati valutati per A/H1N1, A/H3N2, B/Victoria e B/Yamagata. La ricerca bibliografica ha identificato 862 record e dopo il processo di screening 39 RCTs sono stati inclusi nella revisione sistematica. Sono stati inclusi sette studi per il vaccino ad alto dosaggio per un totale di 10.492 vaccinati. Gli studi hanno valutato le GMT post-vaccinazione per tutti i ceppi ed hanno effettuato il confronto con il vaccino standard. L’analisi ha evidenziato che i soggetti immunizzati con il vaccino ad alto dosaggio avevano titoli anticorpali post-vaccinazione significativamente più alti rispetto ai soggetti vaccinati con il vaccino a dosaggio standard per tutti i ceppi e il vaccino HD elicitava titoli post-vaccinazione per A/H3N2 del 82% (IC 95%: 73-91) più alti rispetto al vaccino standard. In particolare, nell’analisi pooled la differenza assoluta di soggetti con titoli ≥ 40 era del 10,4% tra il gruppo vaccinato con HD rispetto al gruppo immunizzato con un vaccino standard. Inoltre, sono stati osservati titoli anticorpali più alti nei soggetti vaccinati con vaccino ad alto dosaggio anche se confrontati con gli individui immunizzati con il vaccino adiuvato. Globalmente, i soggetti immunizzati con i vaccini potenziati mostravano titoli anticorpali più elevati e tale risultato dovrebbe essere correlato con una migliore efficacia ed effectiveness.
La terza revisione sistematica e metanalisi, pubblicata nel 2021 [119], focalizzata principalmente sulla valutazione dell’efficacia, aveva come obiettivo secondario valutare la risposta immunologica del vaccino ad alto dosaggio rispetto al vaccino a dosaggio standard. Per quanto riguarda gli outcomes immunologici Weissman Y et al. hanno riportato che la risposta immunologica era significativamente più alta nei vaccinati con TIV-HD rispetto al gruppo con TIVe. Nello specifico, i tassi di sieroprotezione per A/H1N1 erano significativamente più alti nel gruppo vaccinato con TIV-HD (RR = 1,13; IC 95%: 1,11-1,16; I2 = 88%, 6 studi, 1.681 pazienti) in comparazione a quello che aveva ricevuto TIVe. Anche i tassi di sieroprotezione per A/H3N2 e per i diversi lineaggi B nei soggetti immunizzati con TIV-HD erano significativamente più alti rispetto ai vaccinati con vaccino standard.
Quattro revisioni sistematiche sono state incluse nel presente capitolo. La revisione di Lee et al. del 2018 [120] non è stata inclusa poiché la revisione del 2021 dello stesso autore di ricerca riporta un update dei dati [121].
La revisione sistematica e meta-analisi di Wilkinson K et al. [122] pubblicata nel 2017 ha indagato l’efficacia e la sicurezza del vaccino ad alto dosaggio utilizzando la metodologia di ricerca Cochrane Handbook for Systematic Reviewers in accordo con i criteri di meta-analisi PRISMA e ha incluso come fonte di dati i RCTs. L’outcome principale era l’influenza confermata in laboratorio e gli outcomes secondari comprendevano le ospedalizzazioni per influenza, la mortalità per influenza e l’immunorisposta intesa come immunogenicità e sieroprotezione. Nello specifico, sono state identificate 2955 citazioni pubblicate tra il 2006 e 2014. Gli autori hanno incluso 7 RCTs con un numero di arruolati che variava da 101 a 31.803 soggetti (mediana 634; intervallo interquartile da 300 a 6.429). L’età media dei pazienti era compresa tra 72 e 87 anni. I RCTs inclusi erano condotti prevalentemente in Nord America e le popolazioni arruolate erano soggetti che accedevano a visite ambulatoriali con una condizione di salute stabile ad esclusione dello studio di Nace et al. [123] che ha esaminato una popolazione composta da anziani fragili residenti in strutture assistenziali a lungo termine. Gli autori sono giunti alla conclusione che i pazienti vaccinati con TIV-HD avevano un rischio relativo significativamente inferiore di sviluppare influenza confermata in laboratorio (RR = 0,76; IC 95%: 0,65-0,90; I2 = 0%) corrispondente ad un’efficacia vaccinale superiore del 24% nei soggetti vaccinati con il vaccino HD. Anche i titoli geometrici medi post-vaccinazione e i tassi di sieroprotezione erano più alti nei vaccinati con HD. Nelle stagioni con buona corrispondenza tra ceppi vaccinali e ceppi circolanti il RR di influenza confermata in laboratorio era 0,65 (IC 95%: 0,48-0,87), mentre nelle stagioni di mismatching il RR è risultato del 0,83 (IC 95%: 0,67-1,02).
Nella revisione di Leibovici Weissman et al. [119] gli autori hanno analizzato i RCTs per valutare l’efficacia del vaccino HD rispetto ai TIVe per la prevenzione dell’influenza stagionale in soggetti adulti e anziani. L’outcome primario era la prevenzione dell’influenza confermata in laboratorio. Ulteriori analisi si sono focalizzate su sottogruppi costituiti da soggetti anziani e pazienti immunocompromessi. La ricerca inziale ha identificato 1605 studi, di cui 59 sono stati ritenuti rilevanti dopo un primo screening. Dopo ulteriori analisi, gli autori hanno considerato 16 studi con 47.857 partecipanti; 10 studi erano rivolti a soggetti anziani, mentre tre studi erano incentrati su pazienti immunocompromessi. I RCTs considerati nella revisione sistematica erano stati condotti tra il 1988 e il 2017, principalmente in US. Gli autori hanno evidenziato che il rischio di sviluppare influenza confermata in laboratorio era più basso nei soggetti vaccinati con TIV-HD con un RR di 0,76 (IC 95%: 0,64-0,9, senza eterogeneità - I2 = 0%, 3 studi: 41.313 pazienti). Il vantaggio del vaccino TIV-HD è stato dimostrato specialmente per il sottogruppo degli anziani e il dato derivava principalmente dall’ampio studio di DiazGranados [124]. Quando il dato era analizzato nel dettagliato per i diversi ceppi di influenza il vantaggio del vaccino HD era evidente per A/H3N2 [RR = 0,77; IC 95%: 63-0,93), mentre non si osservava alcuna differenza per A/H1N1) e per influenza di tipo B. Non è stata dimostrata alcuna differenza per l’outcome relativo alla mortalità e ai ricoveri.
La revisione sistematica e metanalisi di Lee et al. del 2021 [121] riporta le valutazioni dell’efficacia/effectiveness del vaccino TIV-HD rispetto al vaccino TIVe negli adulti di età ≥ 65 anni dalla stagione 2009/10 alla stagione 2018/2019 (10 stagioni consecutive). Gli autori hanno considerato come outcome le ILI probabili/confermate in laboratorio, i ricoveri ospedalieri e la morte per influenza. Inoltre, hanno effettuato alcune sotto-analisi sull’efficacia relativa di TIV-HD in relazione ai diversi ceppi influenzali e alla corrispondenza antigenica o mancata corrispondenza dei ceppi vaccinali e i ceppi circolanti. A tal fine dagli studi inclusi sono stati estratti i risultati dell’efficacia per singola stagione influenzale e sono stati utilizzati i dati di sorveglianza virologica per determinare quali erano i ceppi circolanti predominanti e se vi era una corrispondenza antigenica (matching antigenico). I dati sono stati successivamente stratificati in base ai risultati clinici e alle caratteristiche dei virus stagionali. La metanalisi ha stimato l’efficacia/effectiveness relativa (rVE) aggregata di TIV-HD. Dopo aver effettuato lo screening di 1.293 record, i ricercatori hanno considerato 15 pubblicazioni con oltre 22 milioni di individui immunizzati con TIV-HD. In tutte le stagioni è stato osservato che TIV-HD forniva una migliore protezione contro le ILI rispetto al vaccino TIVe (rVE = 15,9%; IC 95%: 4,1-26,3). Inoltre, TIV-HD era più efficace nella prevenzione dell’ospedalizzazioni per tutte le cause (rVE = 8,4%; IC 95%: 5,7-11,0), così come per le ospedalizzazioni per influenza (rVE = 11,7%; IC 95%: 7,0-16,1), polmonite (rVE = 27,3%; IC 95%: 15,3-37,6), polmonite e influenza combinata (rVE = 13,4%; IC 95%: 7,3-19,2) ed eventi cardiorespiratori (rVE = 17,9%; IC 95%: 15,0-20,8). Per quanto riguarda la mortalità, sei studi hanno esaminato l’efficacia relativa di TIV-HD rispetto a TIVe per la morte a causa di influenza, polmonite e influenza combinata, per malattia cardiorespiratoria e per tutte le cause. I risultati ottenuti hanno indicato che il vaccino TIV-HD era più efficace nella prevenzione della mortalità per polmonite/influenza (rVE = 39,9%; IC 95%: 18,6-55,6; p < 0,001) e per malattia cardiorespiratoria (rVE = 27,7%; IC 95%: 13,2-32,0; p < 0,001). L’efficacia di TIV-HD nella prevenzione della mortalità correlata a malattia influenzale ha mostrato un trend positivo, ma non statisticamente significativo (rVE = 22,2%; IC 95%: 18,2-48,8; p = 0,240). Inoltre, è stato evidenziato un beneficio modesto per la mortalità per tutte le cause (rVE = 2,5%; IC 95%: 5,2-9,5; p = 0,514). Risultati simili sono stati osservati nelle stagioni con una predominanza di circolazione del virus A/H3N2 e nelle stagioni con buon “matching antigenico”. Inoltre, il vaccino ad alto dosaggio sembrerebbe avere un impatto maggiore sulla mortalità per tutte le cause nelle stagioni influenzali in cui è presente il mismatching (rVE = 17,3%; IC 95%: 0,2-31,5; p = 0,048). In conclusione, le evidenze su 10 stagioni influenzali consecutive suggeriscono che TIV-HD è costantemente più efficace rispetto a TIVe nel ridurre i casi di influenza e le complicanze cliniche associate, indipendentemente dal ceppo virale circolante e dalla corrispondenza antigenica.
Una recentissima revisione [125] ha valutato l’efficacia dei vaccini influenzali inattivati ad alto dosaggio considerando sia la formulazione trivalente che quadrivalente nella prevenzione dell’influenza confermata in laboratorio negli individui di età ≥ 18 anni. È stata condotta una revisione sistematica della letteratura in database elettronici e fonti di letteratura grigia dal 26/9/2019 al 7/2/2020. Sono stati inclusi RCTs e studi interventistici non randomizzati. La ricerca ha restituito 28.846 record, di cui 36 studi sono stati inclusi nell’analisi. Considerando solo l’efficacia due sono stati gli studi valutati. Il primo [124] ha investigato l’efficacia relativa del TIV-HD vs TIVe in soggetti di età ≥ 65 anni e ha riportato un’efficacia relativa del 24,2% (IC 95%: 9,7-36,5) per influenza confermata in laboratorio e un’efficacia relativa del 18,8% (IC 95%: 5,0-29,8) verso infezione respiratoria. Inoltre, il vaccino ad alto dosaggio si è dimostrato più efficace nel prevenire le polmoniti (rVE = 39,8%; IC 95%: 19,3-55,1), gli eventi cardio-respiratori (rVE = 17,7%; IC 95%: 6,6-27,4) e l’ospedalizzazione per tutte le cause (rVE = 6,9%; IC 95%: 0,5-12,8). Il secondo studio [126] ha valutato efficacia in soggetti anziani residenti in strutture assistenziali a lunga degenza negli Stati Uniti e ha dimostrato una migliore efficacia del vaccino ad alto dosaggio nella riduzione delle ospedalizzazioni per cause respiratorie (12,7%) e polmonite (20,9%) in soggetti vaccinati con il vaccino HD rispetto ad individui immunizzati con il vaccino a dosaggio standard.
Alcuni dati di effectiveness relativa che hanno comparato il vaccino ad alto dosaggio con vaccino prodotto su coltura cellulare sono riportati nel dettaglio nel capitolo 4.
I risultati della revisione sistematica di Lee et al. [121] sono riportati nel paragrafo dell’efficacia.
Comber et al. [125] relativamente all’effectiveness hanno analizzato i dati derivanti da 9 studi (1 studio caso-controllo test-negative e 8 studi coorte). Solo uno studio ha riportato dati rilevanti sulla prevenzione dell’influenza confermata in laboratorio; questa ricerca ha confrontato i vaccinati con vaccino HD con soggetti non vaccinati nella stagione 2014-15 e ha evidenziato un’effectiveness assoluta del 22% (IC 95%: -82-66) e 89% (IC 95%: 47-100) per A/H3N2 e influenza B, rispettivamente. Otto studi hanno valutato altri outcomes correlati ad influenza (ospedalizzazione per influenza, ospedalizzazione per influenza/polmonite, accessi al pronto soccorso per influenza, visite ambulatoriali per influenza e ILI). Gli autori hanno riportato i seguenti risultati di effectiveness relativa (HD-IIV3 vs SD-IIV3): per l’ospedalizzazione per influenza (2 studi) è stata evidenziata una significativa superiorità del vaccino HD con una VE pari a 11,8% (IC 95%: -6,4-17,0); per l’ospedalizzazione per influenza/polmonite (4 studi) è stata riportata una VE pari a 13,7% (IC 95%: 9,5-17,7); per gli accessi al pronto soccorso per influenza (5 studi) è stata osservata una significativa differenza a favore del vaccino HD con una VE pari a 13,1% (IC 95%: 8,4-17,7); infine due studi hanno riportato dati riferiti alle visite ambulatori per influenza/ILI confermando la superiorità del vaccino HD con VE pari a 3,5% (IC 95%: 1,5-5,5).
Lo studio pivotale [39] ha evidenziato che i soggetti vaccinati con il vaccino ad alto dosaggio riportavano una frequenza più elevata di reazioni locali nei primi 7 giorni dopo la somministrazione del vaccino rispetto al gruppo immunizzato con il vaccino a dosaggio standard. Il dolore era il sintomo più frequentemente (36% nei soggetti vaccinati con TIV-HD vs il 24% nei soggetti immunizzati con il TIVe), seguito da eritema e gonfiore. Riguardo alle reazioni sistemiche non sono state registrate differenze significative tra i due gruppi (34 vs 29%). Tutti gli eventi avversi locali e sistemici erano di moderata entità con risoluzione in 3-4 giorni. La frequenza delle reazioni avverse non sollecitate entro 28 giorni era comparabile nei due gruppi di studio.
Successivamente il TIV-HD è stato largamente utilizzato negli Stati Uniti confermando il suo buon profilo di sicurezza.
La sicurezza di QIV-HD è stata valutata in uno studio randomizzato in doppio cieco multicentrico dove soggetti d’età ≥ 65 anni ricevettero il QIV-HD o il TIV-HD. Lo studio ha dimostrato che, nonostante l’incremento del contenuto antigenico totale, il QIV-HD era ben tollerato e il profilo di sicurezza era simile al TIV-HD. Come atteso nel gruppo vaccinato con il QIV-HD era osservata una proporzione leggermente più elevata di soggetti che riportavano eventi avversi sollecitati sistemici e nel sito di inoculo senza però differenze nel grado di severità. Il dolore al sito d’iniezione, mal di testa e mialgia erano riferiti più frequentemente dai soggetti vaccinati con QIV-HD rispetto agli individui immunizzati con TIV-HD. Riguardo le reazioni non sollecitate i due vaccini hanno mostrato un profilo di sicurezza comparabile [116].
La revisione sistematica e meta-analisi di Wilkinson [122] relativamente alla sicurezza ha riportato che il vaccino ad alto dosaggio era sicuro e ben tollerato. Nessuno dei RCTs inclusi ha registrato casi di morte, di sindrome Guillain-Barrè o di reazioni anafilattiche associate al vaccino.
La revisione sistematica di Leibovici Weissman et al. [119] del 2021 ha valutato la sicurezza del vaccino HD rispetto al vaccino antinfluenzale a dose standard attraverso l’analisi di 16 RCTs condotti tra il 1988 e il 2017 negli Stati Uniti, Paesi Bassi, Francia, Israele e Canada con un totale di 47.857 pazienti. Gli eventi avversi gravi erano significativamente più bassi nel gruppo HD (RR = 0,93; IC 95%: 0,87-0,99, 14 studi, 46.628 pazienti). Gli eventi avversi correlati al vaccino non differivano nella prevalenza nei diversi gruppi di studio ad (RR = 1; IC 95%: 0,4-2,5, 3 studi, 41.786 pazienti). Eventuali eventi avversi sistemici non differivano tra i gruppi di studio (RR = 1,14; IC 95%: 0,94-1,38, 6 studi, 5213 pazienti). Tuttavia, sono state dimostrate differenze significative a favore dei vaccini a dosaggio standard per quanto riguarda la febbre (RR = 1,62; IC 95%: 1,13-2,33, 12 studi, 5.229 pazienti), mialgia/artralgia (RR = 1,18; IC 95%: 1,02-1,35, 2 studi, 4.005 pazienti) e affaticamento/malessere (RR = 1,28; IC 95%: 1,13-1,45, 13 studi, 5.429 pazienti). Le reazioni avverse locali nel sito di iniezione sono risultate significativamente meno frequenti nel gruppo vaccinato con il vaccino standard (RR = 1,45; IC 95%: 1,3-1,62, 6 studi, 1.681 pazienti).
La revisione sistematica di Comber et al. [125] relativamente all’outcome di sicurezza ha considerato ventiquattro studi, di cui 19 RCTs e 5 studi non randomizzati. Quattro studi hanno riportato alcuni eventi avversi seri potenzialmente correlati alla vaccinazione (neuropatia, paralisi del sesto nervo cranico, shock ipovolemico associato a diarrea, encefalomielite acuta disseminata, malattia di Crohn). Sette gli studi avevano dati sufficientemente comparabili per consentire la valutazione delle reazioni locali confrontando il vaccino TIV-HD con TIVe/QIVe. Il vaccino HD è risultato associato ad una frequenza significativamente più elevata di reazioni locali combinate (RR = 1,40; IC 95%: 1,20-1,64), dolore (RR =,56; IC 95% 1,26-1,93), gonfiore (RR = 2,20, IC 95%: 1,12-4,32) indurimento nel sito di iniezione (RR = 1,63%; IC 95%: 1,10-2,39). Sette studi hanno valutato le reazioni sistemiche confrontando TIV-HD/QIV-HD con TIVe/QIVe. Il vaccino QIV-HD è risultato associato ad una frequenza significativamente più elevata di cefalea (RR = 1,35; IC 95%: 1,02-1,77), di brividi (RR = 1,73; IC 95%: 1,07-2,81) e di malessere (RR = 1,28; IC 95%: 1,08-1,51).
Il report ECDC [112] ha incluso ventiquattro studi che hanno investigato la sicurezza dei vaccini antinfluenzali ad alto dosaggio; 19 erano RCTs e 5 studi non randomizzati. Quattro studi hanno riportato eventi avversi gravi, ritenuti potenzialmente correlati a TIV-HD. Gli studi erano gli stessi rispetto a quelli inclusi nella revisione sistematica di Comber et al. [125]. Sette studi possedevano dati sufficientemente comparabili per consentire la sintesi quantitativa per le reazioni locali; tutti gli studi hanno confrontato TIV-HD con TIVe e QIVe per le reazioni locali combinate, il dolore, l’arrossamento, il gonfiore, l’indurimento ed ecchimosi. Le stime combinate hanno evidenziato che TIV-HD era associato ad una frequenza significativamente più alta di reazioni locali combinate (RR = 1,40; IC 95%: 1,20-1,64), dolore (RR = 1,56; IC 95%: 1,26-1,93), gonfiore (RR = 2,20; IC 95%: 1,12-4,32) e indurimento (RR = 1,63; IC 95%: 1,10-2,39). Al contrario, non era osservata alcuna differenza significativa tra i vaccini per gli altri esiti. Sette studi hanno riportato dati sufficientemente comparabili per consentire la sintesi quantitativa per quanto riguardava le reazioni sistemiche; tutte le ricerche avevano confrontato TIV-HD o QIV-HD con TIVe e QIVe per i seguenti esiti: reazioni sistemiche combinate, febbre, cefalea, malessere, mialgia, brividi, diarrea e stanchezza. I risultati hanno dimostrato che TIV-HD era associato ad una frequenza significativamente più alta di cefalea (RR = 1,35; IC 95%: 1,02-1,77), brividi (RR = 1,73; IC 95%: 1,07-2,81) e malessere (RR = 1,28; IC 95%: 1,08-1,51). Nessuna differenza significativa è stata notata per gli altri outcomes.
Come descritto precedentemente le sorveglianze post-marketing di sicurezza sono di estrema importanza per rilevare qualsiasi potenziale aumento della reattogenicità correlata alla somministrazione dei vaccini. In tale contesto nel 2020 è stato pubblicato uno studio di Moro et al. [127] che ha analizzato le segnalazioni di eventi avversi dopo immunizzazione con vaccino ad alto dosaggio al VAERS US nel periodo 01/01/2011-30/06/2019 in soggetti ≥ 65 anni. Nell’ambito dello studio sono stati analizzati tutti i report con decesso e con condizioni cliniche gravi come la sindrome di Guillain Barré e l’anafilassi. Gli autori hanno investigato anche alcuni gruppi di soggetti che avevano ricevuto erroneamente il vaccino ad alto dosaggio come le donne in gravidanza e i bambini. In totale sono state raccolte 12.320 segnalazioni; 723 (5,9%) erano gravi. Tra gli eventi avversi: piressia (30,2%), astenia (28,9%) e dispnea (24,9%) erano quelli più comuni e tra le segnalazioni non gravi erano osservati eritema al sito di iniezione (16,8%), dolore alle estremità (15,8%) e dolore al sito di inoculo (14,2%). Sulla base delle revisioni delle cartelle cliniche, sono state riportate 61 segnalazioni di sindrome di Guillain Barré e 13 reazioni di anafilassi. Sono state registrate 13 segnalazioni di donne in gravidanza che avevano ricevuto inavvertitamente TIV-HD (3 rapporti descrivevano dolore al braccio o reazioni locali e 10 non riportavano alcun evento avverso) e 59 segnalazioni di bambini che anch’essi vaccinati per errore con TIV-HD (31 hanno segnalato solo reazioni al sito di iniezione e 28 non hanno riportato alcun evento avverso). Questi dati sulla sicurezza confermano il buon profilo di sicurezza del vaccino.
Lo stesso gruppo di ricerca [128] ha pubblicato nel 2022 i dati di sicurezza post-marketing del QIV-HD. Sono state esaminate e revisionate le segnalazioni di eventi avversi pervenute al sistema VAERS dal 30 luglio 2020 al 30 giugno 2021. In totale, il sistema ha ricevuto 2122 segnalazioni relative al vaccino QIV-HD; la maggior parte degli eventi avversi (2.018; 95,1%) non era grave e includeva eventi osservati negli studi clinici pre-licenza, come le reazioni al sito di iniezione, febbre, mal di testa e nausea. Gli eventi gravi più comuni includevano la sindrome di Guillain-Barré, la cellulite o altre reazioni locali, febbre ed eventi cardiovascolari. In sintesi, la revisione non ha rivelato nuovi problemi relativi alla sicurezza della formulazione quadrivalente [128].
Come precedentemente descritto, il vaccino adiuvato con MF-59®, appositamente sviluppato per la popolazione anziana, è stato autorizzato in Italia nel 1997 (formulazione trivalente) e il 20 maggio 2020 è stata autorizzata in Europa la formulazione quadrivalente. In Italia, aQIV è utilizzato su larga scala dalla stagione 2021/22 [23].
Le caratteristiche del vaccino sono riportate in tabella 6.
È importante considerare che la formulazione quadrivalente è stata sviluppata come evoluzione del vaccino trivalente e ha ottenuto l’autorizzazione dagli enti regolatori tramite la conduzione di RCTs che hanno dimostrato la non inferiorità immunologica del preparato quadrivalente rispetto alla formulazione trivalente per i ceppi condivisi e la superiorità per il ceppo B non presente nel aTIV di confronto. Di conseguenza, le revisioni sistematiche pubblicate sul vaccino adiuvato si riferiscono a aTIV.
La sicurezza, l’immunogenicità di aQIV e la non inferiorità della formulazione quadrivalente vs il preparato trivalente nei confronti dei ceppi condivisi e la superiorità per il ceppo B non condiviso sono state valutate in uno studio multicentrico randomizzato in doppio cieco (stagione 2017-2018) [129] dove i soggetti d’età ≥ 65 anni erano randomizzati 2:1:1 per ricevere aQIV (n = 889), aTIV-1 (aTIV contenente il ceppo B/Victoria), (n = 445) o aTIV-2 (aTIV contenente il ceppo B/Yamagata) (n = 444). La popolazione in studio ha incluso sia individui sani sia soggetti affetti da comorbidità in grado di aumentare il rischio di complicanze dell’influenza. Al fine di valutare il rischio di complicanze associate all’influenza, gli autori hanno utilizzato un sistema di classificazione validato (comorbidity risk score) dove un rischio elevato di ricovero per polmonite o influenza o di decesso per qualsiasi causa corrisponde ad un punteggio ≥ 50. Il 35% (n = 608) della popolazione in studio (popolazione per protocollo) era ad alto rischio di ospedalizzazione e/o morte per influenza. L’immunogenicità verso i ceppi influenzali omologhi è stata valutata mediante il test HAI su campioni di siero raccolti al giorno 0 e al giorno 21. aQIV ha soddisfatto i criteri di non inferiorità rispetto ad aTIV-1 e aTIV-2, sia per i rapporti GMT (limite superiore dell’IC 95% < 1,5 dei rapporti dei GMT) sia per le differenze del tasso di SCR (< 10% di SCR aTIV - aQIV). Infatti, sono stati riportati i seguenti risultati: rapporti GMT: A/H1N1 = 1,27, A/H3N2 = 1,09; B-Yamagata = 1,08 e B-Victoria = 1,08; differenze del tasso di SCR: A/H1N1 = 7,76%, A/H3N2 = 4,96%, B-Yamagata = 3,27% e B-Victoria = 2,55%. La superiorità immunologica è stata dimostrata per il ceppo B alternativo, ovvero incluso solo in aQIV e non rispettivamente in aTIV-1 e aTIV-2. Tale superiorità era considerata dimostrata quando il rapporto GMT (aTIV/aQIV) era < 1 e il limite superiore dell’IC 95% della differenza nei tassi di SCR < 0%. Sono stati riportati i seguenti risultati: B/Yamagata: rapporto di GMT = 0,70, differenza nel SCR = - 8,81%; B/Victoria: rapporto di GMT = 0,78, differenza nel SCR = -8,11%]. Sono state osservate risposte immunologiche simili nei diversi sottogruppi di età e all’interno dei diversi sottogruppi di rischio [129].
I dati di immunogenicità riferiti a aTIV sono stati acquisiti tramite l’analisi critica di 3 revisioni sistematiche ritenute idonee per l’obiettivo del presente report HTA [5, 13 130].
Il nostro gruppo di ricerca ha condotto diverse revisioni sistematiche su aTIV e la più recente è stata pubblicata nel 2021 all’interno del report HTA su aQIV [5]. Relativamente al dato di immunogenicità assoluta verso i ceppi simil-vaccinali è stato osservato che: a) il criterio CBER [63] per SCR era soddisfatto nell’82,9, 89,2 e 50,0% dei casi, rispettivamente, per A/H1N1, A/H3N2 e B; b) per SPR (criterio CBER) la percentuale degli studi che soddisfacevano tale parametro è risultata del 74,2, 100 e 68,8%, rispettivamente, per A/H1N1, A/H3N2 e influenza B. Alcuni studi inclusi nella revisione hanno anche valutato la risposta immunitaria verso ceppi eterovarianti (il sottotipo A/H3N2 è stato quello maggiormente studiato) e si sono osservati SCR per A/H1N1, A/H3N2 e B che variavano, rispettivamente, dal 6,3 al 68,1%, dal 25,0 al 84,0% e dal 12,0 al 52,8%. I corrispettivi SPR rientravano nell’intervallo del 31,9-87,5% per A/H1N1, 47,5-100% per A/H3N2 e 52,7-96,7% per influenza di tipo B. In riferimento all’immunogenicità relativa sono stati meta-analizzati i dati provenienti da RCTs che avevano effettuato il confronto diretto aTIV vs TIVe. In sintesi, aTIV è risultato più immunogeno di TIVe, indipendentemente dal parametro di immunogenicità considerato. In particolare, a seconda del (sotto)tipo simil-vaccinale, il RR di sieroconversione è risultato del 17-28% più alto (p < 0,05) nei vaccinati con aTIV. È interessante notare che il vantaggio di aTIV su TIVe è risultato maggiore (+35%) per quel che riguarda il SCR verso i ceppi A/H3N2 “driftati”. La potenza della risposta anticorpale è risultata del 26-51% più alta nei soggetti immunizzati con aTIV. Un quadro simile è stato osservato per il SPR [5].
Nel 2019 è stata pubblicata una meta-analisi da Nicolay et al. [130]. Nello specifico, gli autori hanno incluso 23 RCTs di cui 16 hanno riportato dati di immunogenicità dopo una dose e 7 hanno considerato la rivaccinazione al fine di valutare l’immunogenicità dopo la seconda o la terza vaccinazione stagionale. L’intero set di analisi era composto da 11.105 soggetti (5.869 immunizzati con aTIV e 5.236 con TIVe). Negli studi di rivaccinazione, 822 individui avevano ricevuto 2 vaccinazioni consecutive (492: aTIV e 330: TIVe) e 237 erano stati sottoposti a 3 vaccinazioni (150: aTIV e 87: TIVe). Complessivamente, gli autori hanno riportato stime meta-analitiche puntuali per il rapporto di sieroconversione e i GMT significativamente più elevate per aTIV rispetto a TIVe. Nella metanalisi, le differenze percentuali dei tassi di sieroconversione erano di 9,5% (IC 95%: 5,2-13,9), 10,5% (IC 95%: 6,6-14,5) e 12,7% (IC 95%: 8.6-16.8) rispettivamente per i ceppi A/H1N1, A/H3N2 e B. I rapporti GMT erano 1,15 (IC 95%: 1,01-1,31) per A/H1N1, 1,30 (IC 95%: 1,18-1,44) per A/H3N2 e 1,23 (IC 95%: 1,15-1,31) per B. Sono stati rispettati i criteri di non inferiorità e di significatività statistica. Risultati simili erano ottenuti anche quando erano valutate le differenze in percentuale dei soggetti vaccinati con aTIV che raggiungevano titoli HI > 40 rispetto a quelli immunizzati con TIVe; gli autori hanno riportato i seguenti risultati: 2,7% (IC 95%: 0,9-4,5) per A/ H3N2, 2,4% (IC 95%: 0,8-4,0) per A/H1N1 e 4,5% (IC 95%: 1,8-7,1) per B. Relativamente alla persistenza dell’immunorisposta al giorno 181, i limiti inferiori dell’IC 95% del rapporto GMT hanno indicato la non inferiorità del vaccino adiuvato rispetto ai preparati tradizionali per tutti e tre i ceppi: A/H3N2: 1,11 (IC 95%: 1,02-1,21); A/H1N1: 1,00 (IC 95%: 0,89-1,12); virus B: 1,08 (IC 95%: 1,01-1,16). Inoltre, anche le risposte anticorpali verso ceppi influenzali eterologhi sono risultate significativamente più elevate nei soggetti vaccinati con aTIV rispetto a quelli che avevano ricevuto TIVe. Gli studi di rivaccinazione hanno mostrato una risposta immunitaria persistente e robusta nei soggetti immunizzati con aTIV con vaccinazioni ripetute. In sintesi, gli autori hanno riportato che il vaccino adiuvato stimola risposte immunitarie significativamente maggiori rispetto ai vaccini convenzionali, aumentando l’ampiezza e la durata della risposta immunitaria. La maggiore immunogenicità è stata osservata per tutti i ceppi influenzali, in particolare per il ceppo A/H3N2, associato con malattia clinica più grave nella popolazione adulta anziana.
Nel 2020 è stata pubblicata una revisione sistematica e meta-analisi da Yang et al. [131] con l’obiettivo di valutare l’immunogenicità del vaccino aTIV in soggetti sani suddivisi in differenti gruppi di età. In totale sono state valutate 1.021 pubblicazioni, selezionati 31 studi per la revisione completa, inclusi 17 studi per la meta-analisi e 6 studi per la sintesi qualitativa. L’immunogenicità è stata valutata attraverso i GMT, i tassi di sieroconversione e sieroprotezione. Per quanto riguarda il confronto dell’immunogenicità tra aTIV e TIVe gli autori hanno valutato i tassi di sieroconversione e sieroprotezione per i diversi ceppi influenzali considerando tutta la popolazione compresa nei 17 RCTs. Sono stati osservati tassi di sieroconversione per A/H1N1, A/H3N2 e influenza B rispettivamente del 78,9, 69,9 e 61,0%. I tassi di sieroprotezione per A/H1N1, A/H3N2 e B erano rispettivamente dell'88,6, 92,3 e 61,9%. Gli autori hanno anche condotto una meta-analisi per sottogruppi età. I partecipanti inclusi sono stati divisi in 3 sottogruppi: bambini sani (6-72 mesi), adulti sani (7-64 anni) e anziani sani (≥ 64 anni). Utilizzando i valori dei tassi di sieroconversione gli autori hanno calcolato i rischi relativi per gruppo di età evidenziando che gli adulti sani erano quelli che beneficiavano maggiormente dalla vaccinazione con il vaccino adiuvato (RR = 2,10; IC 95%: 1,28-3,44), seguiti dagli anziani sani (RR = 1,26; IC 95%: 1,10-1,44).
L’efficacia di aQIV è stata valutata in uno studio clinico controllato, randomizzato, stratificato, in singolo cieco, multicentrico, di fase 3, condotto in 89 siti in 12 differenti Paesi (V118_18). I risultati sono stati pubblicati da Beran et al. nel 2021 [132]. Lo studio è stato condotto nella stagione 2016-17 nell’emisfero Nord e nel 2017 nell’emisfero Sud e ha incluso un totale di 6.761 soggetti, di cui 3.381 sono stati selezionati per ricevere aQIV e 3.380 per ricevere il vaccino antidifterite-tetano-pertosse. Essendo il comparatore un vaccino non antinfluenzale, l’obiettivo dello studio era dimostrare l’efficacia assoluta di aQIV nella prevenzione dell’influenza confermata in laboratorio tramite RT-PCR, causata da qualsiasi tipo o sottotipo di virus, negli adulti di età ≥ 65 anni. La raccolta dei tamponi nasofaringei dai soggetti con ILI è stata effettuata a partire dal 22° giorno dalla vaccinazione e fino ai 6 mesi successivi o, in alternativa, fino alla fine della stagione influenzale. Per tutti i partecipanti è stata effettuata una sorveglianza attiva settimanale per ILI. In caso di ILI era effettuato un tampone nasofaringeo, preferibilmente entro 3 giorni o, in alternativa, entro un massimo di 6 giorni dall’esordio dei sintomi di malattia simil-influenzale. Ogni campione era testato per influenza tramite RT-PCR e contemporaneamente era analizzato in coltura cellulare. In caso di positività alla RT-PCR l’analisi in coltura cellulare era eseguita per la valutazione del match antigenico. Considerati i criteri stabiliti nello studio, non è stato possibile dimostrare l’efficacia di aQIV nei confronti dell’endpoint primario. L’efficacia di aQIV nel prevenire l’influenza da qualsiasi ceppo è risultata pari al 19,8% (multiplicity-adjusted IC 95%: -5,3%; 38,9%). Tuttavia, utilizzando in un’analisi post-hoc la definizione di ILI modificata da CDC, ovvero febbre > 37,2°C + tosse o mal di gola, e dell’OMS, ovvero febbre > 38°C + tosse, l’efficacia di aQIV è risultata pari al 32,1% (IC 95%: 10,2; 48,7) e al 51,1% (IC 95%: 28,2; 66,7), rispettivamente, implicando un’efficacia aumentata nei confronti dei casi confermati. Tale valutazione implica una riflessione su quale definizione di ILI considerare poiché l’adozione di criteri più stringenti per la definizione di ILI potrebbe essere rilevate dal punto di vista clinico in quanto la febbre, soprattutto se elevata, si associa generalmente ad una risoluzione più complessa e ad una maggiore probabilità di insorgenza di complicazioni. In tale contesto si può affermare che aQIV è in grado di ridurre la gravità della malattia [133]. Inoltre, è importante evidenziare che il virus A/H3N2, responsabile della maggior parte di casi di influenza registrati nel RCTs era dissimile dal ceppo vaccinale (mismatch: 88%) [132]. L’efficacia di aQIV nella prevenzione dei casi di influenza causati da ceppi omologhi è risultata pari al 49,9% (IC 95%: -24,0%; 79,8%) utilizzando la definizione di ILI per protocollo e, rispettivamente, al 61,5% (IC 95%: -8,0%; 86,3%) e 75,0% (IC 95%: -17,9%; 94,7%) utilizzando la definizione di ILI del CDC e dell’OMS. Il basso numero di casi di ceppi influenzali omologhi (ovvero antigenicamente simili al ceppo incluso nel vaccino) riportati nello studio non ha consentito il raggiungimento della significatività statistica in relazione a questo parametro. In conclusione, sebbene lo studio non abbia raggiunto l’obiettivo di efficacia primaria, a causa probabilmente del mismatch osservato tra i virus influenzali circolanti e i ceppi vaccinali, si può affermare che aQIV abbia riportato una protezione ragionevole nella popolazione dello studio.
In relazione all’immunogenicità, nello studio V118_18 [132] è stata effettuata un’analisi dei titoli anticorpali tramite test HAI a 21 giorni post-vaccinazione in un sottogruppo di 1.656 pazienti. aQIV ha soddisfatto sia i criteri CBER sia quelli CHMP.
Attualmente non sono disponibili revisioni sistematiche riportanti dati di efficacia clinica da RCTs riferiti a aTIV.
Sono state considerate idonee per il presente report HTA 6 revisioni sistematiche.
La prima è stata pubblicata nel 2017 da Dominch et al. [134] con l’obiettivo di valutare l’effectiveness del vaccino stagionale aTIV nella prevenzione di alcuni esiti correlati all’influenza negli anziani. La revisione sistematica, riferita al periodo 01/01/1990-26/04/2016 (senza restrizioni linguistiche), ha incluso studi osservazionali volti a valutare l’efficacia sul campo. L’endpoint primario era l’effectiveness assoluta. Gli esiti correlati all’influenza includevano: l’influenza confermata in laboratorio attraverso la metodica RT-PCR o coltura, le ILI, le visite ambulatoriali per influenza e polmonite, i ricoveri per tutte le patologie respiratorie, le ospedalizzazioni per influenza e polmonite, per eventi cardiovascolari e cerebrovascolari e la mortalità a seguito di ricovero per influenza e polmonite. L’endpoint secondario era l’effectiveness relativa, valutata confrontando gli esiti correlati all’influenza in soggetti vaccinati con aTIV rispetto i soggetti immunizzati con altri vaccini influenzali. Dei 1.993 record esaminati, 9 articoli, corrispondenti a 11 studi (corrispondenti a 546.015 stagioni-persona) sono stati inclusi (6 studi caso-controllo retrospettivi, 3 di coorte e 2 prospettici caso-controllo). La maggior parte degli studi erano condotti in ambito comunitario. Il ricovero per polmonite/influenza e influenza confermata in laboratorio erano riportati in più di uno studio, mentre altri esiti (malattia simil-influenzale, incidenti cardiovascolari e cerebrovascolari) sono stati esaminati in un unico studio. L’analisi aggregata di quattro studi caso-controllo ha evidenziato un’effectiveness aggiustata di aTIV del 51% (IC 95%: 39-61%) nel prevenire i ricoveri per polmonite/influenza tra gli anziani residenti in comunità. L’effectiveness aggiustata verso l’influenza confermata in laboratorio è risultata elevata (60,1%), sebbene l’IC 95% fosse compreso tra -1,3 e 84,3. Altri studi condotti in ambito comunitario hanno mostrato un’effectiveness molto elevata nel prevenire le ospedalizzazioni per coronaropatia [87% (IC 95%: 35-97%)] ed eventi cerebrovascolari [93% (IC 95%: 52-99%)]. aTIV si è dimostrato altamente efficace [94% (IC 95%: 47-100%] nel ridurre la malattia simil-influenzale tra gli anziani istituzionalizzati. Inoltre, aTIV ha mostrato una maggiore efficacia rispetto a vaccini non adiuvati nella prevenzione dei ricoveri per polmonite/influenza [rapporto di rischio aggiustato 0,75 (IC 95%: 0,57-0,98)] e per influenza confermata in laboratorio [OR aggiustato 0,37 (IC 95%: 0,14-0,96)]. L’analisi di sensitività ha evidenziato risultati robusti, ciò significa che la stima aggregata non è stata guidata da un singolo studio. I risultati della revisione sistematica e metanalisi suggeriscono che aTIV è efficace nel ridurre diversi esiti correlati all’influenza tra gli anziani, in particolare i ricoveri dovuti a complicanze legate all’influenza.
Successivamente il nostro gruppo di ricerca ha condotto una nuova revisione sistematica pubblicata all’interno del report HTA su aQIV [5]. Relativamente all’effectiveness assoluta, gli autori hanno analizzato 24 stime considerando diversi parametri che variavano notevolmente a seconda del setting, della stagione e soprattutto del (sotto)tipo preso in esame. L’effectiveness assoluta pooled (n = 6 studi) di aTIV contro l’influenza di tipo A o B è stata del 44% (IC 95%: 21-60%) con un importante livello di eterogeneità (I2 = 55%). Per quanto riguarda l’analisi di sensibilità, quando lo studio di Mira-Iglesias et al. [135] non era considerato, l’eterogeneità si annullava (I2 = 0%) e l’effectiveness pooled incrementava al 53% (IC 95%: 42-62%). La stratificazione della stima meta-analitica per setting ha evidenziato un’effectiveness del 64% (IC 95%: 17-84%); I2 = 0%] nell’ambito delle cure primarie (n = 2), dato più elevato rispetto a quello riferito al setting ospedaliero (n = 4) [40% (IC 95%: 11-60%); I2 = 71%]. Analizzando altri outcomes, considerati come misure proxy dell’influenza (i.e. eventi che correlano con influenza confermata in laboratorio), aTIV si è dimostrato efficace contro l’ospedalizzazione per influenza e/o polmonite verosimilmente attribuibile al virus influenzale e le stime variavano dal 20 all’87,8%. La stima meta-analitica (n = 6 studi) era del 42% (IC 95%: 24-55%). Per quanto riguarda l’effectiveness relativa, aTIV si è dimostrato più efficace rispetto ai comparatori (vaccini a dosaggio standard tri/quadrivalenti) indipendentemente dall’outcome considerato. Nella meta-analisi, che ha considerato come outcome l’influenza confermata/ILI, la stima pooled è risultata del 41,9% (IC 95%: 29,7-52,1%). Sono state, inoltre, eseguite stime metanalitiche per i seguenti esiti: ospedalizzazione per influenza e/o polmonite, ospedalizzazione o visita al pronto soccorso per influenza, ospedalizzazione per influenza e visita medica per influenza. La stima metanalitica relativa a “ospedalizzazione per influenza e/o polmonite” ha evidenziato un vantaggio significativo di aTIV vs TIVe e/o QIVe del 31,7% (IC 95%: 23,8-38,8%). Per l’esito relativo all’ospedalizzazione/visita al pronto soccorso per influenza, è stato possibile ottenere le stime pooled separate per TIVe (n = 2 studi, I2 = 0%) e QIVe (n = 4 studi, I2 = 43%), rispettivamente, del 3,5% (IC 95%: 0,9-6,0%) e del 9,4% (IC 95%: 9,1-9,6%). Considerando, invece, solo le ospedalizzazioni per influenza (n = 3 studi), aTIV è risultato più efficace di QIVe del 4,6% (IC 95%: 1,6-7,6%). Non è stata osservata una differenza significativa tra aTIV e TIVe [8,1% (IC 95%: -36,0-37,9%)] e tra aTIV e QIVe [17,5% (IC 95%: -36,7-50,2%)] per quanto concerne le visite mediche per influenza; tuttavia, queste due meta-analisi erano associate a un’eterogeneità elevatissima (I2 > 98%). Sono stati individuati anche 5 studi di coorte retrospettiva riportanti un confronto diretto tra aTIV e TIV-HD contro una varietà di esiti relativi all’influenza. Tutti i 5 studi sono stati condotti negli Stati Uniti nelle stagioni 2016/17, 2017/18, 2018/19 e 2019/20. In particolare, i tre studi condotti da Izurieta et al. nelle stagioni 2017/18 [136], 2018/19 [137] e 2019/20 [113], relativamente all’esito “ospedalizzazione o visita al pronto soccorso per influenza”, hanno dimostrato un’efficacia finale opposta e generalmente non significativa [2017/18: effectiveness relativa TIV-HD vs aTIV: 5,3% (IC 95%: 3,3-7,3%); 2018/19: effectiveness relativa TIV-HD vs aTIV: -3,0% (IC 95%: -6,1-0,0%); 2019/20: effectiveness relativa TIV-HD vs aTIV: -1,6% (IC 95%: -4,8-1,6%)]. Lo studio di van Aalst et al. [138] ha, invece, analizzato esiti meno specifici (ospedalizzazione per tutte le cause respiratorie o cardiorespiratorie) ed ha stabilito un’effectiveness relativa di TIV-HD vs aTIV del 6-13% (a seconda dell’outcome e della stagione). Infine, il recente studio di Pelton et al. [139] ha dimostrato un vantaggio di aTIV rispetto a hdTIV del 16,6% (IC 95%: 10,8-22,0%) nel prevenire le visite mediche per influenza e del 2,4% (IC 95%: 0,7-4,0%) nel diminuire l’ospedalizzazione/visita al pronto soccorso per altre cause respiratorie. L’analisi pooled di 4 studi di effectiveness relativa contro l’ospedalizzazione/visita al pronto soccorso per influenza non ha evidenziato alcuna differenza tra aTIV e TIV-HD [0,3% (IC 95%: -4,6-5,1%)]. Analogamente non è stata osservata alcuna differenza significativa relativamente all’outcome “visite mediche dovute all’influenza” [aTIV vs TIV-HD: 5,2% (IC 95%: -21,3-25,9%)] e all’esito “ospedalizzazioni per influenza” [aTIV vs TIV-HD: -2,4% (IC 95%: -9,1-3,9%)]. Tuttavia, in tutti i tre modelli RE l’eterogeneità era particolarmente alta (I2 > 89%).
Una recente revisione sistematica e metanalisi [140] ha investigato l’effectiveness di aTIV/aQIV rispetto a nessuna vaccinazione o rispetto ai vaccini standard su uova o al vaccino alto dosaggio nei soggetti di età ≥65 anni. La ricerca ha incluso studi osservazionali pubblicati su riviste sottoposte a revisione paritaria e letteratura grigia dal 1997 al 15 luglio 2020. I criteri di ricerca applicati hanno prodotto un totale di 6153 records potenzialmente di interesse, dopo un primo screening un totale di 4367 record sono stati sottoposti a valutazione per la potenziale ammissibilità. A seguito dell’esclusione di 4287 record, 87 sono stati valutati per l’ammissibilità. In sintesi, 26 record di 21 studi sono stati ritenuti idonei per l’inclusione. 7 studi condotti tra il 2011/2012 e il 2019/2020 in UK, Canada e Italia hanno utilizzato la metodologia del “test negative design” relativamente all’influenza confermata in laboratorio. In quattro studi l’effectiveness aggiustata per aTIV nella prevenzione delle visite ambulatoriali non ospedaliere per influenza di qualsiasi ceppo era compresa in un intervallo tra il 16,2 e il 58,1%, con una stima di effectiveness combinata del 40,7% (IC 95%: 21,9-54,9). Inoltre, tre studi hanno riportato stime di effectiveness aggiustata per aTIV in pazienti ospedalizzati da 48,3 a 87,8%, con una stima aggregata del 58,5% (IC 95%: 40,7-70,9). Dai risultati ottenuti è emerso che aTIV era efficace nella prevenzione dell’influenza confermata in laboratorio sia in ambito clinico che ospedaliero. Relativamente al gruppo di studi caso-controllo senza conferma di laboratorio sono state identificate cinque ricerche, condotte in Italia e in Spagna nel setting ospedaliero durante il periodo 2002/03-2016/17. Le stime di effectiveness per aTIV variavano dal 48 all’87,8%, con una stima aggregata del 51,3% (IC 95%: 39,1-61,1) nella prevenzione del ricovero per influenza o polmonite. Per quanto riguarda gli studi di coorte senza conferma di laboratorio otto studi hanno utilizzato fonti di dati amministrativi per l’assistenza medica (prestazione di tipo clinico-ambulatoriale, accesso al PS e visite ospedaliere). La stima di effectiveness relativa per la prevenzione delle visite mediche per influenza (ospedalizzazioni, visite al pronto soccorso o visite dal MMG) di aTIV rispetto a TIVe variava da -11,9 a 33%. La stima aggregata ha mostrato il beneficio di aTIV rispetto al TIVe riportando valori del 13,9%, tuttavia gli autori hanno indicato un livello alto di eterogeneità (I2 = 95,9%). La stima relativa di effectiveness di aTIV rispetto a QIVe variava da -6,6 a 36,3% con una stima aggregata del 13,7% (IC 95%: 3,1-4,2), indicando un beneficio di aTIV su QIVe. Infatti, se si considera l’effectiveness relativa di aTIV vs QIVe nel prevenire influenza con o senza polmonite, 6 studi hanno evidenziato un beneficio di aTIV e solo uno [136] ha mostrato benefici a favore di QIVe. Il confronto delI’effectiveness nel ridurre le visite mediche per influenza e/o polmonite tra aTIV e il vaccino ad alto dosaggio TIV-HD variava da -14,9 a 16,6%; le stime aggregate degli studi non erano diverse per aTIV rispetto a TIV-HD, sebbene fosse riscontrata una notevole eterogeneità tra gli studi (I2 = 94,5%).
Il report dell’ECDC [112] ha considerato ventidue studi di effectiveness di cui 11 studi caso-controllo con disegno test negativo che hanno riportato risultati rilevanti per l’outcome primario ovvero “influenza confermata in laboratorio”. I vaccini adiuvati si sono rivelati efficaci nella prevenzione dell’influenza negli anziani rispetto a nessuna vaccinazione. In relazione all’influenza causata da A/H3N2 non si è osservata differenza statisticamente significativa, sebbene esistesse una notevole eterogeneità tra gli studi per quanto riguardava la corrispondenza dei ceppi vaccinali con quelli circolanti. Prove limitate erano presenti relativamente all’effectiveness dei vaccini adiuvati con MF59® rispetto ai loro equivalenti non adiuvati. Alcuni studi caso-controllo e di coorte hanno riportato dati relativi a casi non confermati in laboratorio e, pertanto, sono stati classificati come risultati aggiuntivi. I vaccini adiuvati con MF59® sono risultati più efficaci rispetto a nessuna vaccinazione nel ridurre il rischio di ricoveri per influenza o polmonite e di influenza confermata in laboratorio, mentre la loro efficacia rispetto ai vaccini tradizionali è incerta e basata su dati limitati.
Nel 2022 sono state pubblicate due revisioni sistematiche la prima da O Murchu et al. [141] e la seconda da Gärtner et al. [142].
La revisione sistematica e metanalisi di O Murchu et al. [141] ha investigato l’efficacia e l’effectiveness del vaccino adiuvato in comparazione all’assenza di vaccinazione o immunizzazione con TIVe. Relativamente all’efficacia nessuno studio soddisfaceva i criteri. La strategia di ricerca scelta dagli autori ha identificato 26.844 record, con altri 2 record da fonti aggiuntive. A seguito della rimozione dei duplicati, 19.822 record sono stati sottoposti a screening. Di 868 studi meritevoli di revisione, 48 hanno fornito risultati riguardanti il vaccino antinfluenzale adiuvato e di questi, 22 relativi all’effectiveness (17 studi caso-controllo e cinque studi di coorte) e 26 relativi alla sicurezza del vaccino. Successivamente gli autori hanno analizzato i dati relativi all’effectiveness contro qualsiasi tipo di influenza focalizzando la valutazione su sei studi e trovando che negli anziani (di età ≥ 65 anni) i vaccini adiuvati con MF59® erano significativamente più efficaci rispetto a nessuna vaccinazione (VE = 44,9%; IC 95%:22,7-60,8%). Inoltre, il lavoro di O Murchu et al. ha riportato anche il dato di effectiveness per i diversi tipi e sottotipi di influenza. In particolare, quattro studi hanno presentato dati sull’efficacia di aTIV contro l’influenza A/H1N1 rispetto a nessuna vaccinazione e i risultati hanno evidenziato che i vaccini adiuvati MF59® erano significativamente più efficaci (VE = 61,2%; IC 95%: 43,7-73,3%). Sette studi hanno presentato dati sull’efficacia di aTIV contro A/H3N2 non trovando una differenza significativa tra i vaccini adiuvati con MF59® e nessuna vaccinazione (VE = 10,6%; IC 95%: -24,5-35,7) in cinque stagioni influenzali caratterizzate da una notevole eterogeneità in termini di corrispondenza tra ceppi vaccinali e ceppi circolanti. Per l’effectiveness di aTIV contro l’influenza B è stato rilevato un effetto significativo a favore dei vaccini adiuvati MF59® rispetto a nessuna vaccinazione (VE = 28,5%; IC 95%: 5,4-46,0). In termini di effectiveness relativa contro ogni tipo di influenza, non si è osservata alcuna differenza significativa tra i vaccini trivalenti adiuvati con MF59® e i vaccini trivalenti tradizionali o i preparati quadrivalenti non adiuvati. Per quanto riguarda le ospedalizzazioni correlate all’influenza, tre studi di coorte hanno presentato dati sull’effectiveness di aTIV di cui uno studio ha riportato che i vaccini adiuvati erano significativamente più efficaci rispetto a nessuna vaccinazione in tre stagioni influenzali mentre due studi hanno confrontato aTIV con i vaccini non adiuvati e non hanno rilevato differenze significative. Relativamente agli altri outcomes, tre studi hanno presentato dati relativi all’effectiveness di aTIV nella prevenzione delle ospedalizzazioni per influenza/polmonite rispetto a nessuna vaccinazione o ai vaccini trivalenti non adiuvati. Indipendentemente dal comparatore, tutti gli studi inclusi hanno mostrato un effetto significativo a favore di aTIV. Due studi hanno presentato dati riguardanti l’effectiveness di aTIV nel prevenire i ricoveri per polmonite rispetto a nessuna vaccinazione; i risultati dell’analisi hanno messo in luce un effetto significativo a favore di aTIV. Per quanto riguarda gli accessi ospedalieri per influenza o le visite ambulatoriali per influenza, uno studio di coorte ha presentato dati sull’effectiveness di aTIV rispetto a TIVe ed è stata evidenziata una differenza significativa a favore di aTIV per gli accessi e le visite specialistiche in ospedale (VE = 4%; IC 95%: 1-6%), ma non per le visite ambulatoriali (VE = -7%; IC 95%: -10 - -4%). In conclusione, aTIV è risultato più efficace rispetto a “nessuna vaccinazione”. Tuttavia, per i dati limitati, non è stata trovata alcuna differenza significativa di effectiveness nel confronto tra aTIV e i vaccini a dose standard.
Il razionale della revisione sistematica di Gärtner et al. [142] era confrontare i vaccini antinfluenzali adiuvati con MF-59 con i vaccini antinfluenzali tradizionali (TIVe/QIVe) o con il vaccino ad alto dosaggio (TIV-HD/QIV-HD) in termini di efficacia ed effectiveness considerando gli esiti correlati all’influenza negli anziani, a completamento/prosecuzione dei risultati della revisione sistematica dell’ECDC pubblicata a febbraio 2020 [112]. La ricerca sistematica è stata condotta per identificare gli RCTs, gli studi osservazionali e le revisioni sistematiche, pubblicati dopo la revisione sistematica dell’ECDC [112] (periodo di studio: 7 febbraio 2020-6 settembre 2021). In totale sono state considerate 11 analisi derivanti da 9 studi di effectiveness che comprendevano 53 milioni di partecipanti e hanno valutato l’effectiveness relativa nelle stagioni influenzali 2006/07-2008/09 e 2011/12-2019/20. Nove analisi hanno riportato che aTIV era significativamente più efficace di TIVe e QIVe nel ridurre l’influenza con esiti di tipo clinico e sospetti focolai influenzali (rVE = 7,5-25,6% per aTIV rispetto a TIVe e 7,1-36,3% per aTIV rispetto a QIVe). Sette analisi hanno riscontrato un’efficacia simile di aTIV rispetto a TIV-HD nel ridurre le visite mediche, le degenze ospedaliere e i ricoveri/accessi al pronto soccorso correlati all’influenza. In tre analisi, aTIV è risultato significativamente più efficace di TIV-HD nel ridurre le visite mediche e visite ambulatoriali correlate all’influenza (rVE compresa tra 6,6 e 16,6%). Lo studio ha definito i vaccini adiuvati e quelli ad alto dosaggio alternative efficaci per i programmi di vaccinazione negli anziani e preferibili rispetto ai vaccini convenzionali a dose standard.
Nel RCT di Essink [129] per la valutazione degli eventi avversi a breve termine è stato consegnato a tutti i soggetti arruolati un diario per la registrazione degli eventi avversi locali e sistemici dal giorno 1 al giorno 7 post-vaccinazione. Tra gli eventi avversi locali sono stati riportati dolore nel sito di iniezione, indurimento, eritema ed ecchimosi, mentre tra i sistemici febbre, perdita di appetito, nausea, affaticamento, mialgia generalizzata, artralgia generalizzata, mal di testa, brividi, vomito e diarrea. Inoltre, sono stati raccolte eventuali segnalazioni di eventi avversi non sollecitati nel corso dei 21 giorni successivi alla vaccinazione. La maggior parte degli eventi avversi locali e sistemici sono risultati di entità da lieve a moderata e di breve durata (2-4 giorni) e si sono verificati entro i primi 2 giorni dalla vaccinazione. L’evento avverso locale più comune è stato il dolore nel sito di iniezione, riportato rispettivamente dal 31,9, 29,1 e 25,7% dei soggetti che hanno ricevuto aQIV, aTIV-1 e aTIV-2 senza differenze significative tra i tre gruppi. Tra gli eventi avversi sistemici verificatesi più di frequente sono stati segnalati l’astenia (16,0% dei soggetti del gruppo aQIV, 15,4% nel gruppo aTIV-1 e 11,5% nel gruppo aTIV-2) e la cefalea (12,0, 10,6 e 11,3%, rispettivamente, nei gruppi a cui è stato somministrato aQIV, aTIV-1 e aTIV-2). La febbre è stata segnalata dallo 0,5, 0,2 e 0,2% dei soggetti, rispettivamente nel gruppo aQIV, aTIV-1 e aTIV-2. Nel complesso, non sono state osservate differenze significative nelle frequenze dei singoli eventi avversi locali o sistemici tra i gruppi aQIV e aTIV. Focalizzandosi sui diversi sottogruppi per età, il gruppo 65-74 anni ha riportato un numero di eventi avversi maggiore, in percentuale, rispetto a quello 75-84 anni, mentre non sono state riportate differenze distinguendo per sesso e razza. È stato segnalato almeno un evento avverso non sollecitato dal 15,3, dall’11,3 e dal 15,3% dei soggetti che hanno ricevuto, rispettivamente, aQIV, aTIV -1 e aTIV-2. Solo nel 4,4, 3,8 e 4,3% dei soggetti, rispettivamente, l’evento è stato correlato alla vaccinazione. 83 soggetti (4,7%) hanno registrato almeno un evento avverso serio entro 6 mesi dalla somministrazione del vaccino, in proporzione simile tra i tre gruppi (4,2, 6,3 e 4,1%, rispettivamente, nei gruppi aQIV, aTIV-1 e aTIV-2). Da notare che nessun evento avverso serio è stato giudicato correlato al vaccino. Due decessi sono stati monitorati nel gruppo aQIV, entrambi considerati non riconducibili al vaccino in studio. Eventi avversi di speciale interesse si sono verificati nel gruppo aTIV-1 (n = 1) e aQIV (n = 1), che però sono risultati non correlabili ai vaccini. 53 soggetti (3,0%) hanno, infine, riportato malattie croniche di nuova insorgenza non correlabili al vaccino, le quali si sono verificate in percentuale paragonabile nei diversi gruppi analizzati (2,6, 3,6 e 3,2% nei vaccinati, rispettivamente, con aQIV, aTIV-1 e aTIV-2).
Nel RCT pubblicato da Beran et al. nel 2021 [132] la sicurezza e la reattogenicità sono state valutate in termini di proporzione di partecipanti che hanno riportato reazioni avverse sollecitate a livello del sito di iniezione o sistemiche, eventi avversi segnalati spontaneamente 21 giorni dopo la vaccinazione ed eventi avversi gravi riportati nel corso dell’intero periodo in studio. A tale scopo 1355 dei partecipanti esposti a vaccinazione sono stati muniti di diario-scheda per la valutazione della reattogenicità. La prevalenza di ogni evento avverso sollecitato è stata simile nei 2 sottogruppi analizzati (rispettivamente, 34,3 e 32,2% nel gruppo aQIV e nel gruppo vaccinato con comparatore non influenzale). L’evento avverso locale più comune è risultato il dolore nel sito di iniezione, segnalato dal 16,3% dei soggetti che ha ricevuto aQIV e in una percentuale leggermente inferiore da coloro a cui è stato somministrato il vaccino difterite-tetano-pertosse (11,2%). Per entrambe i gruppi in analisi, lo 0,3% dei soggetti ha riportato dolore severo nel sito di iniezione. La frequenza degli eventi avversi sistemici sollecitati è risultata leggermente superiore nel gruppo aQIV rispetto al gruppo di confronto, ma non sono state osservate differenze tra i due gruppi in termini di eventi avversi sistemici sollecitati gravi. Gli eventi avversi sistemici più comuni sono stati cefalea e affaticamento, riportati rispettivamente dal 10,8 e dal 10,5% dei soggetti vaccinati con aQIV e dall’8,3 e dall’8,8% dei soggetti che hanno ricevuto il vaccino difterite-tetano-pertosse. Eventi avversi non sollecitati, eventi avversi correlabili ai vaccini in studio, eventi avversi gravi, eventi avversi che hanno portato all’abbandono dello studio, malattie croniche di nuova insorgenza ed eventi avversi di particolare interesse, sono stati riportati in proporzione simile dai partecipanti appartenenti ai due gruppi di studio. La maggior parte degli eventi avversi sollecitati segnalati è risultato di gravità lieve o moderata. I decessi si sono verificati in maniera uniforme, ovvero nell’1,0% dei soggetti vaccinati in entrambi i gruppi. Di questi, nessuno è stato considerato correlato ai vaccini somministrati. Complessivamente, il 7,0% degli eventi avversi gravi si sono verificati nel gruppo aQIV e nel 6,9% nel gruppo di confronto. Due partecipanti (uno per ciascun gruppo) hanno presentato eventi avversi gravi che sono stati considerati correlati al vaccino in studio. Infine, quattro soggetti del gruppo aQIV e 6 del braccio di confronto hanno segnalato eventi avversi di particolare interesse (2 casi di artrite reumatoide, 1 di polimialgia e 1 di pemfigo nel gruppo aQIV, 2 casi di tiroidite autoimmune, 1 di artrite reumatoide, 1 di paralisi flaccida, 1 di psoriasi e 1 di paralisi del IV nervo cranico nel gruppo del vaccino difterite-tetano-pertosse). In particolare, un evento tra i quattro registrati nel gruppo vaccinato con aQIV è stato considerato verosimilmente riconducibile alla vaccinazione.
Relativamente alla formulazione trivalente 3 revisioni sistematiche sono state ritenute idonee per il presente report.
La revisione sistematica e meta-analisi condotta da Panatto et al. all’interno del report HTA su aQIV [5] ha evidenziato una maggiore reattogenicità di aTIV rispetto a TIVe a livello del sito di iniezione (dell’89, del 54 e del 58% rispettivamente per il dolore, l’eritema e l’indurimento). Considerando le reazioni sistemiche, è stato osservato un aumento significativo dei brividi (RR = 1,48) e della mialgia (RR = 1,39). L’incremento della frequenza di febbre, malessere generale, artralgia e cefalea non è risultato, invece, statisticamente significativo.
La revisioni sistematica di O Murchu et al. [141] ha considerato ventisei studi; di questi, 21 erano RCTs, e 5 erano studi non randomizzati interventistici (NRSIs). Dalla valutazione degli studi è emerso che 3 RCTs e 2 NRSIs riportavano eventi avversi gravi. Nel dettaglio Frey et al. [143] hanno segnalato quattro SAE: uno nel gruppo vaccinato con aTIV (bronchite) e tre nel gruppo immunizzato con TIVe (crisi asmatica, BPCO e sindrome di Guillain-Barré). Inoltre, nel gruppo vaccinato con aTIV è stato considerato correlato al vaccino un decesso per crisi respiratoria secondaria a seguito della sindrome di Guillain-Barré. Li et al. [144] hanno evidenziato che un soggetto a cui era stato somministrato il vaccino adiuvato ha riportato un SAE corrispondente a febbre alta. Un terzo studio ha rilevato un caso di herpes zoster facciale, ritenuto dallo sperimentatore correlato al vaccino. Tsai et al. [145] hanno descritto casi di narcolessia in entrambi i gruppi vaccinati e non hanno riscontrato alcun aumento di eventi avversi correlati al sonno nei soggetti che avevano ricevuto il vaccino adiuvato con MF59®. Infine, Villa et al. [146] non hanno rilevato differenze nel tasso di ospedalizzazione per eventi avversi correlati alla vaccinazione con aTIV rispetto ai vaccini antinfluenzali trivalenti non adiuvati. Globalmente, per le reazioni sistemiche è stato riportato un RR = 1,18 (IC 95%: 1,02-1,38, evidenza di certezza moderata) per aTIV. Specificatamente, per la mialgia è stato osservato un RR = 1,71 (IC 95%: 1,09-2,69, 10 RCTs, evidenza di certezza moderata), per la febbre un RR = 1,97 (IC 95%: 1,07-3,61, evidenza di certezza bassa) e per i brividi un RR = 1,70 (IC 95%: 1,20-2,40, 7 RCTs, certezza moderata). Relativamente alle reazioni locali aTIV era associato ad un maggior numero di eventi avversi locali come il dolore (RR = 1,90; IC 95%: 1,50-2,39). Da sottolineare che nessuna differenza era osservata per le reazioni locali come arrossamento, gonfiore o indurimento (certezza bassa-moderata).
Il report ECDC [112] ha riportato risultati in linea con quelli presenti nella revisione di O Murchu et al. [141]. In generale, gli studi inclusi nella revisione sistematica hanno dimostrato che i vaccini antinfluenzali adiuvati con MF59® sono associati ad una maggiore frequenza di eventi locali e reazioni sistemiche. Questo risultato non è sorprendente data la potente azione infiammatoria associata all’uso dell’adiuvante; tuttavia, questi eventi avversi sono noti per essere nella maggior parte dei casi lievi e moderati.
Come precedentemente riportato i risultati derivanti dalle sorveglianze sul campo sono importanti per confermare il profilo di sicurezza e tollerabilità osservato nei RCTs.
Uno studio italiano [147] condotto nell’ambito dell’EPSS durante tre stagioni consecutive (2015/16-2017/18) ha registrato una bassa frequenza di eventi avversi spontaneamente riportati. Infatti, su un totale di circa 1,000 dosi di aTIV somministrate in ogni stagione erano segnalati 0,5, 0,7 e 0,5% case safety report individuali corrispondenti a 9, 18 e 12 eventi avversi. La maggior parte degli eventi avversi riportati erano di gravità lieve/moderata ed erano al di sotto della frequenza attesa come da RCP.
Haber et al. [148] hanno condotto un’analisi dei dati di sorveglianza post-marketing di aTIV in US, raccogliendo le segnalazioni notificate dal VAERS dal 1° luglio 2016 al 30 giugno 2018. Gli autori hanno esaminato le cartelle cliniche dei soggetti che avevano riportato eventi avversi. Sono state condotte analisi di data mining per identificare se gli eventi avversi per aTIV si sono verificati in modo sproporzionato rispetto a tutti i vaccini antinfluenzali. Il sistema VAERS ha ricevuto in totale 630 segnalazioni. Gli eventi avversi più comuni erano il dolore al sito di iniezione (21%) e l’eritema (18%), con proporzioni simili rispetto a quelle relative a TIV-HD (17 e 19%, rispettivamente), TIVe e QIVe (15% ciascuno). Da notare che nel 48% dei casi aTIV era stato co-somministrato con un altro vaccino, come il vaccino antipneumococcico polisaccaridico 23-valente o il vaccino pneumococcico coniugato 13-valente. Circa il 3% (n = 21) degli eventi avversi erano classificati come seri ed è stato concluso che la frequenza dei report era simile tra aTIV e gli altri vaccini antinfluenzali disponibili.
Il presente capitolo fornisce una visione generale e aggiornata sui vaccini influenzali disponibili in Italia per la popolazione pediatrica, adulta e anziana.
Relativamente all’immunogenicità la valutazione critica delle revisioni sistematiche ha evidenziato che i vaccini QIVe non sono statisticamente inferiori ai TIVe per i ceppi condivisi e sempre statisticamente superiori per i ceppi non condivisi indipendentemente dal lineage.
Un livello di efficacia ed effectiveness soddisfacente è stato dimostrato nei RCTs e negli studi osservazionali.
Il profilo di sicurezza e tollerabilità è risultato sovrapponibile con quello dei TIVe. Gli studi osservazionali e le sorveglianze post-marketing hanno confermato i dati riportati in RCP.
Nei bambini immunizzati con il vaccino Q/LAIV si sono osservate risposte immunitarie capaci di mimare l’infezione naturale offrendo una risposta immunitaria più ampia rispetto a quella stimolata dai vaccini inattivati evocando risposte umorali e cellulo-mediate nelle vie aeree superiori verso virus influenzali sia omologhi che eterologhi.
Q/LAIV si è dimostrato immunogeno nei bambini e negli adolescenti ed è risultato non inferiore rispetto alla formulazione trivalente per i ceppi in comune e superiore per il ceppo B non incluso indipendentemente dal lineage.
Tutti gli studi hanno evidenziato un minor rischio di contrarre influenza nei bambini vaccinati con il vaccino vivo attenuato rispetto a quelli immunizzati con i vaccini inattivati per i ceppi antigenicamente simili e per i ceppi indipendentemente dalla concordanza antigenica. Inoltre, Q/LAIV ha mostrato un effetto diretto sulla popolazione vaccinata riducendo i casi di influenza confermati in laboratorio, i casi di influenza richiedenti visite mediche ambulatoriali, gli accessi al pronto soccorso e le ospedalizzazioni, l’utilizzo di farmaci e l’assenteismo scolastico. Inoltre, si è osservato un impatto positivo anche in altri gruppi di età (riduzione di casi di influenza confermata, di accessi al pronto soccorso, di ospedalizzazione, di assenteismo scolastico e lavorativo) quando il tasso di copertura vaccinale raggiungeva almeno il 40-50% di bambini/adolescenti in età scolare.
I risultati delle revisioni sistematiche, degli studi post-marketing e delle sorveglianze passive hanno confermato il buon profilo di sicurezza di Q/LAIV osservato negli RCTs. Le reazioni avverse più comuni dopo la somministrazione erano rinorrea, tosse e mal di gola, riferite con maggiore frequenza dopo la prima dose rispetto alla seconda.
Q/LAIV è risultato sicuro e ben tollerato anche nei soggetti con asma ed infezioni respiratorie ricorrenti.
QIVe si sono dimostrati generalmente non inferiori a TIVe per i ceppi in comune e statisticamente superiori per il ceppo B non condiviso, indipendentemente dal lineage considerato.
Ad oggi non risultano pubblicati studi di efficacia teorica nella popolazione adulta e anziana (gli studi disponibili si riferiscono esclusivamente alla popolazione pediatrica).
Gli studi di effectiveness hanno dimostrato protezioni variabili a seconda della stagione valutata, della tipologia di ceppo circolante ed età dei soggetti. Nelle stagioni in cui il vaccino e i ceppi circolanti A/H3N2 erano antigenicamente distanti Il livello di protezione è risultato basso negli anziani. Gli studi di effectiveness relativa hanno evidenziato una minore efficacia dei QIVe rispetto al vaccino adiuvato con MF-59 e al vaccino ad alto dosaggio antigenico nella popolazione anziana indipendentemente dall’outcome considerato.
QIVe si sono dimostrati sicuri e ben tollerati. La conferma del buon profilo di sicurezza è emersa anche nelle sorveglianze post-marketing.
Nei RCTs il vaccino QIVr ha confermato la non inferiorità rispetto ai QIVe. Sono state osservate nei soggetti immunizzati con QIVr risposte anticorpali più robuste rispetto a quelle rilevate negli individui vaccinati con vaccini prodotti su uova a dose standard. Tale risultato è probabilmente da attribuire sia al nuovo processo di allestimento che riduce le mutazioni egg-adaptive sia alla superiore quantità di antigene rispetto al preparato standard.
QIVr ha mostrato una migliore protezione contro l’influenza confermata in laboratorio rispetto ai vaccini standard. Inoltre, i risultati sembrano suggerire che i vaccini ricombinanti possano offrire anche una protezione crociata verso le varianti.
Attualmente sono pochi i dati di effectiveness disponibili.
Il profilo di sicurezza è risultato comparabile con quello dei QIVe.
QIV-HD si è dimostrato non inferiore alla formulazione trivalente per i ceppi virali in comune e superiore per il ceppo B non condiviso.
I vaccini ad alto dosaggio antigenico sono risultati più immunogeni rispetto ai vaccini trivalenti, supportando un’efficacia superiore del vaccino TIV/QIV-HD nel prevenire l’influenza confermata in laboratorio e una migliore effectiveness contro le malattie simil-influenzali e ospedalizzazione associata all’influenza nella popolazione anziana.
Gli studi di efficacia e di effectiveness hanno mostrato un’efficacia significativamente maggiore di QIV-HD rispetto ai vaccini a dosaggio standard non adiuvati (TIVe e QIVe) nel ridurre diversi outcomes clinici associati all’influenza.
Relativamente alla sicurezza, è emerso che i vaccini ad alto dosaggio sono probabilmente associati ad una maggiore frequenza di reazioni locali e sistemiche; l’incrementato numero di reazioni avverse è probabilmente legato al quantitativo quadruplo di ogni singolo antigene rispetto ai vaccini standard. Da evidenziare, tuttavia, che i sintomi segnalati sono tipicamente di natura mite e transitoria.
La formulazione quadrivalente si è dimostrata non inferiore al preparato trivalente.
La formulazione trivalente si è dimostrata altamente immunogena e generalmente superiore rispetto alle formulazioni trivalenti non adiuvate. Negli anziani il vaccino adiuvato stimola risposte immunitarie significativamente maggiori rispetto ai vaccini tradizionali, aumentando l’ampiezza e la durata della risposta immunitaria. La maggiore immunogenicità è stata osservata per tutti i ceppi influenzali, in particolare per il ceppo A/H3N2, associato con malattia clinica più grave nella popolazione adulta/anziana.
I dati di effectiveness di aTIV rispetto a nessuna vaccinazione o rispetto ai vaccini standard suggeriscono che aTIV è più efficace nella prevenzione dell’influenza confermata in laboratorio di diversa gravità (malattia che richiede visita ambulatoriale e patologia grave associata a ricovero ospedaliero).
Il profilo di sicurezza del vaccino adiuvato è accettabile. La maggiore frequenza di eventi locali e reazioni sistemiche osservata è da attribuirsi alla potente azione infiammatoria associata all’uso dell’adiuvante che innesca un’iperattivazione immunologica spesso mediata dal rilascio di citochine pro-infiammatorie; tuttavia, questi eventi avversi sono lievi e moderati nella maggior parte dei casi.
In seguito all’isolamento del virus influenzale nel 1933, furono sviluppati i primi vaccini antinfluenzali. Questi vaccini erano monovalenti, vivi attenuati e prodotti utilizzando le uova embrionate di pollo. Lo sviluppo successivo dei vaccini antinfluenzali fu focalizzato sull’aumento della copertura dei ceppi circolanti (passando dai vaccini monovalenti a quelli bi-, tri- e più recentemente quadrivalenti), sulla diminuzione della reattogenicità (e.g., l’aumento della purificazione dei vaccini inattivati, passando dalla formulazione a virione intero a quelle frammentate e a subunità) e sull’ottimizzazione dei processi della produzione [1, 2]. Ancora oggi, circa 90 anni dopo, la maggior parte dei vaccini disponibili sono prodotti utilizzando uova embrionate di pollo [3].
Sebbene la tecnologia tradizionale della produzione dei vaccini antinfluenzali sia consolidata e ben standardizzata, presenta alcuni limiti intrinseci. Innanzitutto, la tecnologia dipende dall’approvvigionamento tempestivo di enormi quantità di uova. Alcuni eventi eccezionali, come ad esempio una vasta epidemia di influenza aviaria nel pollame, possono compromettere la disponibilità della materia prima. Inoltre, la scalabilità del processo è subottimale e non permette di aumentare drasticamente la produzione in caso di aumento del fabbisogno dei vaccini [4]. Il secondo limite è legato al fatto che alcuni ceppi influenzali potenzialmente candidabili per la formulazione del vaccino (Candidate Vaccine Virus, CVV) non possono essere isolati nelle uova. Un recente studio [5] ha dimostrato che solo il 40,6% dei ceppi circolanti nel periodo 2008-2020 poteva essere isolato in uova embrionate. Al contrario, il tasso di isolamento del virus nella coltura cellulare MDCK (Madin-Darby Canine Kidney) era di circa 2 volte maggiore (81,0%). Infine, è ben noto che l’efficacia dei vaccini antinfluenzali è ancora subottimale specialmente nei confronti del sottotipo A(H3N2) [6]. Una delle principali cause dell’efficacia subottimale è rappresentata dal cosiddetto mismatch antigenico. A sua volta, le cause principali del mismatch sono la deriva antigenica (antigenic drift) e la comparsa delle mutazioni egg-adaptive, i.e. le mutazioni insorte durante i passaggi seriali del virus nelle uova [7]. Mentre il fenomeno naturale della deriva antigenica è relativamente imprevedibile, l’emergere delle mutazioni adattative può essere attenuato o del tutto eliminato, utilizzando piattaforme alternative. Infatti, nell’uomo, le cellule epiteliali del tratto respiratorio superiore possiedono i ricettori α-2,6Gal. I virus dell’influenza umani hanno una maggiore selettività per questa tipologia di ricettori. Contrariamente, le cellule aviarie possiedono i ricettori α-2,3Gal. La crescita dei virus umani nelle uova determina quindi l’acquisizione da parte del virus di singole mutazioni amminoacidiche volte ad incrementare la specificità di legame con i ricettori α-2,3Gal [8].
L’impatto negativo delle mutazioni egg-adaptive sull’efficacia vaccinale è stato dimostrato in diversi studi condotti durante diverse stagioni influenzali. Ad esempio, Skowronski et al. [9] hanno dimostrato che la bassa efficacia dei vaccini nei confronti del virus A(H3N2) durante la stagione 2012/13 in Canada è stata verosimilmente legata alla comparsa delle mutazioni H156Q, G186V e S219Y nei ceppi vaccinali propagati nelle uova che ne ha alterato l’antigenicità. Analogamente, l’efficacia ridotta dei vaccini antinfluenzali durante la stagione 2016/17 dominata dal sottotipo A(H3N2) è stata probabilmente legata all’utilizzo dei CVV propagati nelle uova. Infatti, nel periodo 2014-2015 i ceppi A(H3N2) hanno acquisito la mutazione K160T che determina la glicosilazione del sito antigenico dominante B. Sebbene la composizione vaccinale per la stagione 2016/17 sia stata aggiornata, il CVV utilizzato nei vaccini prodotti su uova mancava del sito B di glicosilazione e questo ha determinato una ridotta affinità degli anticorpi neutralizzanti [10]. Inoltre, la mutazione egg-adaptive L194P altera la conformazione del sito di legame al recettore modificandone le proprietà antigeniche [11]. Un’analisi retrospettiva [12] dei ceppi circolanti durante 16 stagioni consecutive (dalla stagione 2002/03 alla stagione 2017/18) ha dimostrato una maggiore somiglianza antigenica dei ceppi vaccinali di riferimento propagati su coltura cellulare rispetto a quelli propagati su uova. In particolare, tale somiglianza è risultata significativamente maggiore nei confronti dei virus A(H3N2) e B/Victoria. Anche in Italia è stato dimostrato [13] che i ceppi A(H3N2) circolanti durante la stagione 2016/17 erano significativamente più simili ai CVV propagati nella coltura cellulare rispetto ai CVV propagati nelle uova. Infine, una recente analisi [5] ha evidenziato che i passaggi seriali dei ceppi circolanti tra il 2008 e il 2020 hanno determinato la comparsa di mutazioni non sinonime nell’86, 100 e 93% delle sequenze di emoagglutinina rispettivamente dei ceppi A(H1N1), A(H3N2) e B. Tale tasso è stato solo del 3-16% nei ceppi propagati nella coltura cellulare MDCK. Una situazione analoga è stata osservata per la neuraminidasi [5].
L’utilizzo delle piattaforme alternative rispetto a quella tradizionale su uova può annullare il rischio di insorgenza delle mutazioni egg-adaptive. Attualmente in Italia sono autorizzati due vaccini antinfluenzali che utilizzano piattaforme alternative [14]: il vaccino quadrivalente ricombinante (ricombinant Quadrivalent Influenza Vaccine, QIVr) e il vaccino quadrivalente a dosaggio standard (15 μg) su coltura cellulare (cell culture-based Quadrivalent Influenza Vaccine, QIVc).
QIVr contiene 45 μg di emoagglutinina ricombinante, non contiene la neuraminidasi ed è attualmente indicato per i soggetti di età ≥ 18 anni [14, 15]. La sequenza genica di emoagglutinina deriva dalle raccomandazioni dell’Organizzazione Mondiale della Sanità (OMS) [16] per la composizione dei vaccini ed è prodotta nella coltura cellulare di insetti expresSF+. L’espressione della sequenza di emoagglutinina nella coltura cellulare è ottenuta tramite un vettore di baculovirus [17].
QIVc, oggetto di questo report, utilizza invece la coltura cellulare mammifera MDCK per la produzione sia di emoagglutinina sia di neuraminidasi, ed è attualmente indicato per i soggetti di età ≥ 2 anni [14, 18].
Il vaccino trivalente su coltura cellulare (cell culture-based Trivalent Influenza Vaccine, TIVc) è il precursore di QIVc ed è stato per la prima volta autorizzato in Europa nel 2007. Tuttavia, in quel periodo, i CVV derivavano ancora dalla propagazione nelle uova embrionate di pollo [19]. Diversi aspetti relativi all’immunogenicità, efficacia e sicurezza di TIVc sono stati descritti approfonditamente in una revisione di letteratura da Manini et al. [19]. Analizzando nove Randomized Clinical Trial (RCT) di fase I-III [20-28], è emerso che la risposta immune in seguito alla vaccinazione con TIVc era simile a quella evocata dal vaccino trivalente standard prodotto su uova (egg-based Trivalent Influenza Vaccine, TIVe) in tutte le fasce di età principali. Il profilo di reattogenicità di TIVc era paragonabile a quello di TIVe. L’efficacia clinica di TIVc è stata confermata negli adulti sani [21]. In particolare, in un RCT di fase III (n = 11.404 adulti di età 18-49 anni) [21] l’efficacia di TIVc è risultata pari al 69,5, 89,3, 75,6 e 49,9% rispettivamente nei confronti di qualsiasi ceppo, A(H1N1), A(H3N2) e B. Le corrispettive stime nel braccio vaccinato con TIVe erano del 63,0, 81,5, 49,3 e 53,2%. L’efficacia di TIVc contro i ceppi antigenicamente simili era dell’83,8%, mentre quella verso ceppi dissimili era del 58,7%.
QIVc è stato approvato nel ٢٠١٦ negli Stati Uniti e successivamente (nel ٢٠١٨) nell’Unione Europea [٢٩].
La valutazione della tecnologia rappresenta il dominio cardine di un report completo di Health Technology Assessment (HTA) [30]. I risultati di questa valutazione sono stati successivamente utilizzati per informare altri domini della valutazione HTA (e.g., la valutazione economica e gli aspetti organizzativi). Successivamente alla prima valutazione HTA di QIVc condotta in Italia nel 2019 [29], nuove evidenze sull’utilizzo di QIVc nei diversi Paesi si sono rese disponibili. Inoltre, l’indicazione terapeutica del vaccino è cambiata, è passata dall’età ≥ 9 anni all’età ≥ 2 anni [18]. Pertanto, l’obiettivo di questo Capitolo HTA è di raccogliere e di analizzare in maniera sistematica gli studi sull’immunogenicità, efficacia e sicurezza di QIVc in diverse popolazioni target. In particolare, in seguito alla breve descrizione della tecnologia, come da riassunto delle caratteristiche tecniche del prodotto (RCP) [18], sono riportati i risultati delle analisi relativi ai suddetti aspetti clinici di QIVc. Laddove opportuno, l’approccio meta-analitico è stato preferito.
Come menzionato sopra, invece di utilizzare le uova embrionate di pollo, QIVc è prodotto a partire da ceppi virali propagati nella coltura cellulare MDCK. Inoltre, anche i CVV sono isolati nelle cellule MDCK, annullando quindi l’insorgenza delle mutazioni egg-adaptive [31]. La coltura cellulare MDCK è ben caratterizzata, non oncogena e grazie alla sua particolare suscettibilità ai virus influenzali è una delle colture cellulari più utilizzate nella ricerca sull’influenza [19, 32]. Durante i diversi passaggi di purificazione, ogni eventuale residuo cellulare è rimosso e il virus è inattivato con β-propiolattone [31]. La Tabella I riassume le principali caratteristiche di QIVc [18].
Le principali caratteristiche tecniche del vaccino quadrivalente su coltura cellulare [18].
| Denominazione | Vaccino antinfluenzale (antigene di superficie, inattivato, prodotto in colture cellulari) |
| Nome commerciale | Flucelvax Tetra® |
| Composizione antigenica | Antigeni di superficie (emoagglutinina e neuraminidasi) di quattro ceppi virali (propagati in cellule Madin-Darby Canine Kidney) equivalenti (come dalle raccomandazioni dell’Organizzazione Mondiale della Sanità) |
| Tipologia | A subunità, dose standard, non adiuvato |
| Eccipienti | Sodio cloruro, potassio cloruro, magnesio cloruro esaidrato, sodio fosfato bibasico biidrato, potassio fosfato monobasico, acqua per preparazioni iniettabili |
| Forma farmaceutica | Sospensione iniettabile in siringa pre-riempita |
| Indicazioni terapeutiche | Profilassi dell’influenza negli adulti e nei bambini a partire dall’età di 2 anni |
| Posologia e modo di somministrazione | Nei soggetti di età ≥ 9 anni una singola dose da 0,5 ml deve essere somministrata mediante iniezione intramuscolare al livello del muscolo deltoide. I bambini di età inferiore a 9 anni che non sono stati vaccinati in precedenza contro l’influenza devono ricevere una seconda dose a distanza di almeno 4 settimane |
| Controindicazioni | Ipersensibilità al principio attivo, agli eccipienti o a possibili residui in tracce di β-propiolattone, cetiltrimetilammonio bromuro e polisorbato 80 |
| Effetti indesiderati |
Reazioni avverse osservate
durante gli studi clinici Adulti ≥ 18 anni
Le reazioni avverse rilevate dalla sorveglianza post-marketing, in aggiunta alle reazioni osservate durante gli studi clinici, sono le seguenti (frequenza non nota):
|
Per la stesura del presente capitolo HTA sono state adottate le linee guida PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) [33].
I criteri di inclusione sono stati definiti utilizzando l’algoritmo PICOS (Population, Intervention, Comparison, Outcome, Study design). La popolazione comprendeva tutti i soggetti di età ≥ 6 mesi (0,5 anni). La popolazione dello studio è stata successivamente suddivisa in tre fasce di età principali: bambini (< 18 anni), adulti in età lavorativa (18-64 anni) e anziani (≥ 65 anni). L’intervento di interesse era la vaccinazione con una (soggetti di età ≥ 9 anni o bambini di età 0,5-8 anni precedentemente esposti al virus e/o alla vaccinazione) o due (bambini di età < 9 anni mai esposti al virus e/o alla vaccinazione) dosi di QIVc. Il comparatore poteva includere sia (i) la non vaccinazione o il trattamento non attivo (placebo o vaccini non influenzali) sia (ii) qualsiasi vaccino antinfluenzale diverso da QIVc [14]. Per quel che riguarda il dominio di outcome, sono stati considerati numerosi esiti relativi all’immunogenicità, efficacia e sicurezza e la loro descrizione dettagliata è fornita nei paragrafi successivi. Analogamente, data la moltitudine degli esiti eleggibili, a seconda dell’outcome considerato, sono stati inclusi sia gli studi sperimentali (Randomized Controlled Trial, RCT) sia quegli osservazionali.
I criteri di esclusione sono stati i seguenti: (i) manoscritti ritenuti ridondanti; (ii) utilizzo di TIVc; (iii) utilizzo di altri vaccini su coltura cellulare non disponibili in Italia (e.g., SKYCellflu Quadrivalent; SK bioscience, Corea del Sud); (iv) utilizzo delle formulazioni sperimentali di QIVc (e.g., studi sperimentali dose-finding) e (v) studi osservazionali che hanno riportato solo le stime di efficacia sul campo non corrette statisticamente [34].
L’immunogenicità assoluta è stata definita come la capacità di QIVc di stimolare la risposta immune umorale e/o cellulare rispetto alla non vaccinazione o al trattamento non attivo (placebo o vaccini non influenzali). L’immunogenicità relativa è stata definita come la capacità di QIVc di stimolare la risposta immune umorale e/o cellulare rispetto a quella di altri vaccini antinfluenzali. La risposta immune umorale poteva essere quantificata mediante il test di inibizione dell’emoagglutinazione (Hemagglutination Inhibition, HAI), l’emolisi singola radiale (Single Radial Hemolisis, SRH), il test di neutralizzazione (NT) o qualsiasi altro saggio immunologico. Di questi saggi, solo HAI e SRH hanno un correlato di protezione riconosciuto e che corrisponde rispettivamente a un titolo anticorpale ≥ 1:40 e la zona di emolisi ≥ 25 mm2 [35]. Sono stati considerati i seguenti parametri relativi all’immunogenicità assoluta: l’incremento (Mean-Fold Increase, MFI) nei titoli medi geometrici (Geometric Mean Titer, GMT) dal t0 (prevaccinazione) al t1 (tipicamente a distanza di 3-4 settimane dalla vaccinazione), il tasso di sieroconversione (SeroConversion Rate, SCR) e il tasso di sieroprotezione (SeroProtection Rate, SPR). SCR è stato definito come la proporzione dei soggetti con l’incremento dei titoli HAI o della zona di emolisi SRH dal t0 al t1 di almeno 4 volte (ovvero il raggiungimento del titolo ≥ 1:40/zona di emolisi ≥ 25 mm2 nei soggetti sieronegativi). SPR è stato definito come la proporzione dei soggetti con titoli HAI o zona di emolisi rispettivamente ≥ 1:40 e ≥ 25 mm2 [35]. Infine, sono stati applicati i seguenti criteri di immunogenicità [37]: (ii) MFI > 2,0 e > 2,5 rispettivamente per i soggetti di età ≥ 61 e 18-60 anni; (ii) proporzione dei soggetti sieroconvertiti ≥ 30% e ≥ 40% rispettivamente per i soggetti di età ≥ 61 e 18-60 anni; (iii) proporzione dei soggetti sieroprotetti ≥ 60% e ≥ 70% rispettivamente per i soggetti di età ≥ 61 e 18-60 anni.
Per l’outcome di immunogenicità relativa sono stati considerati: (i) rapporto tra i GMT in seguito alla vaccinazione con QIVc e comparatore attivo (Geometric Mean Ratio, GMR); (ii) differenza tra i SCR (ΔSCR) nei soggetti vaccinati con QIVc e comparatore attivo; (iii) differenza tra i SPR (ΔSPR) nei soggetti vaccinati con QIVc e comparatore attivo. QIVc è stato definito non inferiore al comparatore, utilizzando i seguenti criteri proposti dal Center for Biologics Evaluation and Research (CBER) [38]: (i) il limite superiore dell’intervallo di confidenza (IC) al 95% a due code del GMR Comparatore/QIVc < 1,5; (ii) il limite superiore dell’IC al 95% a due code del ΔSCR comparatore attivo e QIVc < 10%.
Per quel che riguarda la risposta immune cellulare, data l’assenza di un correlato di protezione [35], è stato valutato qualsiasi saggio immunologico.
Per tutti i parametri di immunogenicità sono stati valutati i dati separatamente per i ceppi A(H1N1), A(H3N2), B/Victoria e B/Yamagata. Sono stati inclusi sia i RCT sia gli studi osservazionali di qualsiasi disegno.
È stata definita come riduzione degli esiti clinici correlati all’influenza nei soggetti vaccinati con QIVc rispetto ai non vaccinati/somministrazione di placebo/vaccino non influenzale (efficacy assoluta) o rispetto a un comparatore attivo (efficacy relativa) e stabilita nei RCT [39]. Come esito clinico relativo all’influenza è stata considerata la diagnosi di infezione influenzale confermata tramite qualsiasi test di laboratorio [reazione a catena della polimerasi inversa (Reverse Transcriptase Polymerase Chain Reaction, RT-PCR), coltura, test sierologici o rapidi antigenici] [40]. Le misure di efficacy di interesse comprendevano qualsiasi ceppo influenzale, il virus sia del tipo A e dei suoi sottotipi sia del tipo B e dei suoi lignaggi.
È stata definita come riduzione degli esiti clinici correlati all’influenza nei soggetti vaccinati con QIVc rispetto ai non vaccinati (effectiveness assoluta) o rispetto a un comparatore attivo (effectiveness relativa) e quantificata negli studi osservazionali [39]. Oltre all’influenza confermata in laboratorio (dato il suo sottoutilizzo nella pratica clinica di routine) sono stati valutati i seguenti outcomes: (i) sindrome simil-influenzale (Influenza-Like Illness, ILI); (ii) cartelle cliniche/schede di dimissione ospedaliera (SDO) per influenza e/o polmonite; (iii) infezione respiratoria acuta grave (Severe Acute Respiratory Infection, SARI) con o senza la conferma laboratoristica; (iv) visite ambulatoriali per influenza/ILI; (v) ospedalizzazione o mortalità per influenza e/o polmonite; (vi) ospedalizzazione o mortalità per cause respiratorie e/o cardiovascolari; (vii) ospedalizzazione o mortalità per tutte le cause. Sebbene tali outcomes siano meno specifici rispetto all’infezione confermata in laboratorio, risultano più sensibili [39, 40]. Sono state considerate eleggibili le seguenti tipologie di studi osservazionali: (i) coorte prospettica o retrospettiva; (ii) caso-controllo e le relative modifiche (e.g., a test negativo); (ii) caso-controllo innestato nella coorte (nested case-control).
Per i RCT sono stati esaminati sia gli eventi avversi sollecitati (tipicamente durante i primi sette giorni dalla vaccinazione) sia quelli riportati spontaneamente/non sollecitati (fino a un anno dalla vaccinazione). Sono stati considerati a priori i seguenti eventi avversi locali: arrossamento, gonfiore, indurimento, dolore/dolorabilità, ecchimosi. Per gli eventi avversi sistemici sono stati analizzati: febbre/febbricola, brividi, affaticamento/malessere generale, mal di testa, mialgia, artralgia, nausea, vomito, diarrea, inappetenza, insonnia/irritabilità/modifica del comportamento alimentare (per i bambini piccoli). Sono state registrate le frequenze di ciascun evento avverso. Sono state anche valutate le frequenze di eventi avversi seri (e.g., eventi che esitano nella morte o nell’ospedalizzazione, determinano invalidità o incapacità gravi o prolungate) e nuove insorgenze di malattie croniche. La frequenza relativa (QIVc vs comparatore attivo) di eventi avversi è stata espressa come il rischio relativo (RR). Gli studi post-marketing di farmacovigilanza sono stati riassunti narrativamente. I tassi di reportistica degli eventi avversi sono stati eventualmente confrontati con il RCP [18].
La ricerca della letteratura è stata eseguita abbinando la modalità automatica con quella manuale. La ricerca automatica è stata compiuta da AD il 15/02/2022 nelle seguenti banche dati: (i) MEDLINE via Ovid; (ii) Biological Abstract via Ovid; (iii) Global Health via Ovid and (iv) Web of Science. Lo script è stato elaborato, utilizzando una combinazione dei termini MeSH (Medical Subject Headings) e delle parole chiave testuali [((flucelvax* OR qivc* OR iiv4c* OR ciiv4* OR cciiv4*).mp) OR (influenza vaccin* adj3 (mdck* OR cell* OR cultur*).mp.)]. Considerando che il primo studio utile è stato pubblicato nel 2015 [29], la ricerca automatica è stata ristretta al periodo “01/01/2015-Presente”. I record ridondanti sono stati eliminati, utilizzando il commando deduplicate. Al fine di aumentare la sensibilità della strategia di ricerca, non è stato applicato alcun altro filtro.
La ricerca semi-automatica e manuale è stata condotta come segue. Innanzitutto, sono stati esplorati: (i) principali registri degli studi clinici (https://clinicaltrials.gov e https://www.clinicaltrialsregister.eu); (ii) fonti della letteratura “grigia” /studi in fase di pubblicazione/revisione paritaria (https://www.preprints.org); (iii) abstract books dei principali congressi/conferenze (European Scientific Working group on Influenza Conferences, ISIRV Congresses Options for the Control of Influenza). In seguito, è stata revisionata la bibliografia di manoscritti individuati (ricerca backward). Per la ricerca forward è stata invece utilizzata la banca dati Google Scholar (https://scholar.google.com/) al fine di individuare gli articoli scientifici che hanno citato i manoscritti inclusi. Infine, il produttore di QIVc (Seqirus) è stato contattato con lo scopo di suggerire ulteriori studi non identificati.
I fogli di lavoro con i risultati della ricerca automatica, prodotti dalle banche dati, sono stati uniti e i record duplicati (quelli non identificati, applicando il commando “deduplicate”) sono stati rimossi. In seguito, i titoli e/o riassunti dei record sono stati sottoposti allo screening ed i manoscritti chiaramente non idonei sono stati esclusi. Infine, i manoscritti potenzialmente rilevanti sono stati scaricati e valutati in extenso, applicando i criteri di inclusione e di esclusione riportati sopra. La selezione degli studi è stata condotta in doppio cieco da AD e CST. Ogni discordanza è stata risolta consensualmente.
Le variabili di interesse sono state estratte in un foglio di lavoro ad hoc da PLL e successivamente ricontrollati da AD. Ogni discordanza è stata risolta consensualmente. Sono stati estratti i seguenti parametri:
record bibliografico completo;
principali caratteristiche del disegno dello studio;
setting dello studio (e.g., community-dwelling, soggetti ospedalizzati, istituzionalizzati);
principali caratteristiche della popolazione dello studio (classi di età e la loro distribuzione, fattori di rischio);
paese/emisfero nel quale lo studio è stato condotto;
periodo dello studio (stagione influenzale);
comparatore;
dimensione campionaria per tipo di intervento;
misure di effetto degli outcomes di interesse con qualsiasi misura di dispersione riportata [e.g., IC, deviazione standard (DS), errore standard (ES)];
altre informazioni ritenute rilevanti.
I dati mancanti, non chiari o presenti solo in forma grafica sono stati reperiti, incrociando eventualmente diverse fonti disponibili (e.g., lo studio pubblicato con la sua registrazione su https://clinicaltrials.gov) e/o contattando l’autore per corrispondenza. Le informazioni quantitative presenti solo in forma grafica potevano essere anche approssimate tramite il software WebPlotDigitizer (https://apps.automeris.io/wpd/).
Il rischio di bias è stato verificato, applicando lo strumento Cochrane RoB (Risk of Bias) 2 [42] e ROBINS-I (Risk Of Bias In Non-randomized Studies of Interventions) [43]. Tali strumenti sono stati utilizzati da AD e DA in maniera indipendente. Eventuali disaccordi di giudizio sono stati risolti coinvolgendo un terzo ricercatore (DP).
I risultati di tutti gli studi inclusi sono stati sintetizzati qualitativamente. L’analisi quantitativa (meta-analisi) è stata intrapresa laddove il disegno e l’outcome di almeno due studi erano simili. In particolare, la meta-analisi delle proporzioni singole è stata utilizzata per gli outcomes di SCR e SPR. Per quel che concerne i parametri dell’efficacia, i RR e gli Odds Ratios (OR) potevano essere combinati a condizione della rarità (< 5%) dell’evento [44].
Assumendo una significativa eterogeneità tra le stime dei singoli studi, sono stati considerati a priori i modelli a effetti casuali (Random Effects) stimati con il metodo di DerSimonian e Laird. Il metodo di massima verosimiglianza ristretta è stato utilizzato per stimare il τ2. L’eterogeneità è stata quantificata tramite la statistica di I2 e interpretata come segue: i valori di I2 pari a < 40%, 30-60%, 50-90% e ≥ 75% rappresentavano rispettivamente un’eterogeneità nulla/non importante, moderata, sostanziale e critica [45].
Infine, per individuare le fonti dell’eterogeneità osservata, è stata effettuata un’analisi di meta-regressione a effetti misti e/o l’analisi per sottogruppi. Sono state considerate le seguenti variabili: stagione influenzale, specificità dell’esito clinico (influenza confermata, influenza diagnosticata clinicamente, outcomes meno specifici), fascia di età (bambini, adulti o anziani), setting (ambito delle cure primarie vs ambito ospedaliero) e tipo di comparatore.
Tutte le elaborazioni statistiche sono state eseguite tramite il pacchetto R metafor (versione 3.0-2) [46].
La ricerca automatica iniziale nei 4 database ha prodotto un totale di 648 risultati deduplicati automaticamente. Ulteriori 39 record duplicati sono stati rimossi manualmente. In seguito allo screening di 609 titoli/riassunti, 578 record sono stati eliminati come chiaramente non pertinenti. Di 30 studi esaminati in extenso, 29 manoscritti [47-54, 56-64, 66-70, 72-74, 76-79] hanno soddisfatto i criteri di inclusione. Ulteriori 4 studi [55, 65, 71, 75] sono stati individuati tramite la ricerca manuale. Sono invece stati scartati 2 studi di immunogenicità [80, 81] in quanto hanno analizzato i soggetti vaccinati con TIVc. La Figura 1 riporta l’intero processo di selezione degli studi.
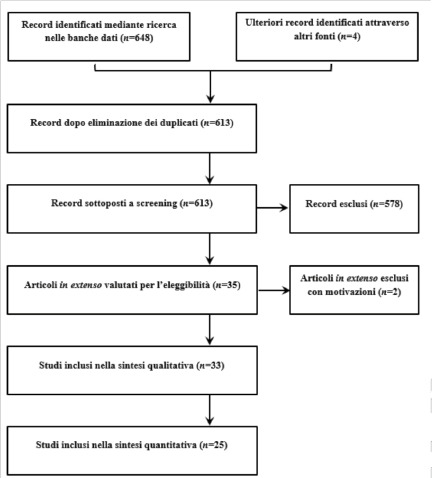
Processo di selezione degli studi.
L’outcome primario degli studi è stato suddiviso come segue: 12 [47-58], 1 [56], 17 [59-75] e 10 [47, 48, 55-58, 76-79] studi hanno analizzato rispettivamente almeno un aspetto relativo all’immunogenicità, efficacy, effectiveness e sicurezza.
L’immunogenicità di QIVc è stata riportata in 10 studi [47-56]. Inoltre, due RCT [57, 58] hanno valutato la risposta immune nei soggetti vaccinati con QIVc con o senza la concomitante vaccinazione anti-COVID-19. Il saggio HAI è stato il più frequentemente utilizzato, gli anticorpi neutralizzanti sono stati quantificati in 4 studi [50, 53-55], mentre il saggio ELISA (Enzyme-Linked ImmunoSorbent Assay) è stata impiegato in soli 2 studi [52, 54]. Gli studi di Richards et al. [52] e Yu et al. [51] hanno esaminato la risposta cellulare. Come comparatori attivi, sono stati utilizzati i vaccini quadrivalenti prodotti su uova (egg-based Quadrivalent Influenza Vaccine, QIVe), QIVr e il vaccino quadrivalente vivo attenuato (Quadrivalent Live Attenuated Influenza Vaccine, QLAIV). Le caratteristiche principali di 12 studi [47-58] sono riportati nella Tabella II.
Le principali caratteristiche degli studi sull’immunogenicità di QIVc.
| Studio [Rif] | Stagione | Età dei partecipanti | Disegno dello studio | Paese | Saggio | Dimensione campionaria | |
|---|---|---|---|---|---|---|---|
| QIVc | Comparatore attivo | ||||||
| Hartvickson et al. [47] | 2013/14 | 4–17 anni | Di fase III, randomizzato, controllato, in doppio cieco, stratificato, multicentrico | Stati Uniti | HAI | 1.159 | TIVc-1: 593 TIVc-2: 581 |
| Bart et al. [48] | 2013/14 | ≥ 18 anni | Di fase III, randomizzato, controllato, in doppio cieco, multicentrico | Stati Uniti | HAI | 1.335 | TIVc-1: 676 TIVc-2: 669 |
| Richards et al. [52] | 2015/16, 2016/17, 2017/18 | 18-49 anni | Randomizzato | Stati Uniti | HAI, ELISA, risposta cellulare | 51a | QIVe: 49 TIVr/QIVr: 50 hdTIV: 21 |
| Nolan et al. [56]b | 2017/18, 2018/19 | 2–8 anni | Di fase III-IV, randomizzato, controllato, in doppio cieco, multicentrico | Estonia, Finlandia, Lituania, Polonia, Spagna | HAI | 721 | NA |
| Gouma et al. [54] | 2017/18 | 18-49 anni | Trasversale | Stati Uniti | NT, ELISA | 23 | QIVe: 23 hdTIV: 16 QIVr: 23 |
| Moehling et al. [53] | 2018/19 | 4-20 anni | Di fase IV, randomizzato, in parallelo | Stati Uniti | HAI, NT | 85 | QIVe: 83 |
| Dawood et al. [50] | 2018/19 | 18-64 anni | Di fase IV, randomizzato, in aperto | Stati Uniti | HAI, NT | 283 | QIVe: 242 QIVr: 202 |
| Williams et al. [49] | 2018/19 | 4-21 anni | Di fase IV, randomizzato, in aperto | Stati Uniti | HAI | 110 | QLAIV: 108 |
| Yu et al. [51] | 2018/19 | 18-49 anni | Longitudinale | Stati Uniti | Risposta T cellulare | 10 | NA |
| NCT04074928 [55] | 2019/20 | 6-47 mesi | Di fase III, randomizzato, controllato, in doppio cieco, multicentrico, di non inferiorità | Stati Uniti | HAI, NT | 1.605 | QIVe: 809 |
| Lazarus et al. [58] | 2020/21 | 18-64 anni | Di fase III-IV, randomizzato, controllato, in singolo cieco, multicentrico | Regno Unito | HAI | 268 | NAc |
| Toback et al. [57] | 2020/21 | 18-64 anni | Di fase III, randomizzato, controllato, in doppio cieco, multicentrico | Regno Unito | HAI | 402 | NAc |
a Durante la stagione 2015/16, solo TIVc era somministrato (n = 11).
b L’outcome primario dello studio era l’efficacy assoluta di QIVc nei soggetti di età 2-17 anni, solo una quota dei bambini arruolati durante le stagioni 2017/18 e 2018/19 è stata sottoposta all’analisi di immunogenicità.
c Studio sulla co-somministrazione dei vaccini antinfluenzali e i vaccini anti-COVID-19; solo l’immunogenicità assoluta di QIVc è stata considerata.
Due RCT di fase III [47, 48] registrativi hanno confrontato l’immunogenicità di QIVc e le formulazioni di TIVc al fine di stabilire la non inferiorità di QIVc verso i ceppi condivisi e la superiorità di QIVc per il ceppo B alternante rispettivamente nei bambini (4-17 anni) e negli adulti (≥ 18 anni). Sia nei bambini [47] sia negli adulti [48], l’obiettivo di non inferiorità in termini di GMR e ΔSCR è stato raggiunto per tutti i ceppi in comune. Analogamente, QIVc è stato superiore per il ceppo B alternante sia nei bambini [47] sia negli adulti [48].
La Tabella III riassume le stime di MFI in seguito alla vaccinazione con QIVc. In particolare, si evince che il valore soglia di MFI è stato generalmente superato indipendentemente dal ceppo virale analizzato, specialmente nei soggetti più giovani.
Incremento dei titoli medi geometrici in seguito alla vaccinazione con QIVc, per classe di età e ceppo.
| Età | A(H1N1) | A(H3N2) | B/Victoria | B/Yamagata | Rif |
|---|---|---|---|---|---|
| 6-47 mesi | 6,6 | 3,4 | 2,2 | 3,4 | 55 |
| 2-17 anni | 11,4 | 3,7 | 8,2 | 6,2 | 47 |
| 2-8 anni | 5,8 | 1,7 | 3,8 | 4,6 | 56 |
| 2-8 anni | 9,7 | 4,1 | 7,0 | 5,3 | 56 |
| 4-20 anni | 2,5 | 1,6a/2,6b | 2,1 | 1,5 | 53 |
| 4-21 anni | 11,1 | 7,3a/6,2b | 6,6 | 19,6 | 49 |
| 18-60 anni | 9,2 | 4,2 | 4,3 | 4,5 | 48 |
| 18-49 anni | 3,5 | 2,0a/2,0b | NA | NA | 54 |
| 18-64 anni | 1,8 | 1,5 | 1,3 | 1,3 | 50 |
| 18-64 anni | 17,0c/13,2d | 7,2c/6,1d | 2,9c/2,9d | 4,8c/4,4d | 57 |
| 18-64 anni | 1,4e/1,6f | 1,3e/1,4f | 1,2e/1,2f | 1,3e/1,2f | 58 |
| 18-64 anni | 1,4g/1,5h | 1,4g/1,4h | 1,1g/1,2h | 1,3g/1,2h | 58 |
| ≥ 61 anni | 3,0 | 2,3 | 2,2 | 2,1 | 48 |
a Ceppo propagato nelle uova.
b Ceppo propagato nella coltura cellulare.
c Soggetti che hanno ricevuto NVX-CoV2373 + QIVc.
d Soggetti che hanno ricevuto QIVc + placebo.
e Durante la co-somministrazione QIVc + ChAdOx1, i soggetti hanno ricevuto prima ChAdOx1 + placebo e QIVc un mese dopo.
f I soggetti hanno ricevuto QIVc + ChAdOx1 nella stessa seduta.
g Durante la co-somministrazione QIVc + BNT162b2, i soggetti hanno ricevuto prima BNT162b2+ placebo e QIVc un mese dopo.
h I soggetti hanno ricevuto QIVc + BNT162b2 nella stessa seduta.
Sulla base dei dati disponibili, è stato possibile eseguire una sintesi quantitativa di SCR e SPR nella popolazione pediatrica e adulta. Per quel che riguarda l’anziano, solo il RCT di Bart et al. [48] ha riportato i parametri di immunogenicità assoluta di QIVc. Come dimostra la Tabella IV, le stime pooled di SPR hanno superato il criterio CHMP per tutti i 4 ceppi e in tutte le fasce di età. Il criterio CHMP per il SCR è stato raggiunto per tutti i ceppi nella popolazione pediatrica e per i ceppi A negli adulti in età lavorativa. Nell’anziano invece tale criterio è stato raggiunto solo per il ceppo A(H1N1), il fatto dovuto verosimilmente a un’alta percentuale di soggetti sieropositivi prima della vaccinazione. Tuttavia, in tutte le meta-analisi, l’eterogeneità è stata critica (Tab. IV).
Modelli a effetti casuali sui tassi di sieroconversione e di sieroprotezione (test di inibizione dell’emoagglutinazione, utilizzando ceppi di riferimento propagati nelle uova) di QIVc, per classe di età e ceppo.
| Classe di età | Ceppo | Tasso di sieroconversione | Tasso di sieroprotezione | ||||
|---|---|---|---|---|---|---|---|
| N. stime | % (IC 95%) | I2, % | N. stime | % (IC 95%) | I2, % | ||
| Bambini e adolescenti | A(H1N1) | 5 | 60,7 (43,2-78,2) | 97,0 | 5 | 95,2 (91,8-98,7) | 85,7 |
| A(H3N2) | 5 | 40,0 (19,7-60,3) | 98,0 | 5 | 92,2 (83,2-100) | 98,9 | |
| B/Victoria | 5 | 53,7 (39,0-68,5) | 95,4 | 5 | 79,8 (64,7-95,0) | 98,0 | |
| B/Yamagata | 5 | 57,0 (30,8-83,3) | 98,9 | 5 | 86,1 (73,5-98,6) | 99,1 | |
| Adulti in età lavorativa | A(H1N1) | 4 | 46,1 (19,9-72,2) | 99,3 | 2 | 89,1 (70,5-100) | 98,3 |
| A(H3N2) | 4 | 40,3 (19,5-61,1) | 98,8 | 2 | 92,2 (79,4-100) | 97,3 | |
| B/Victoria | 4 | 20,1 (0-41,5) | 99,4 | 2 | 94,4 (84,9-100) | 96,3 | |
| B/Yamagata | 4 | 27,2 (8,4-46,1) | 98,9 | 2 | 89,7 (77,7-100) | 96,3 | |
| Anziani | A(H1N1) | 1 | 34,5 (30,8-38,3) | - | 1 | 94,3 (92,2-96,0) | – |
| A(H3N2) | 1 | 27,2 (23,8-30,8) | - | 1 | 98,3 (97,0-99,2) | – | |
| B/Victoria | 1 | 26,3 (23,0-29,9) | - | 1 | 96,2 (94,4-97,5) | – | |
| B/Yamagata | 1 | 20,9 (17,9-24,2) | - | 1 | 92,2 (89,8-94,1) | – | |
Per quel che concerne l’immunogenicità relativa, Gouma et al. [54] hanno confrontato la risposta immune in seguito alla vaccinazione con QIVc, QIVe, QIVr e il vaccino trivalente ad alto dosaggio (high-dose Trivalent Influenza Vaccine, hdTIV) nei confronti dei virus wild-type A/Hong Kong/4801/2014 (H3N2, clade 3c2.A), A/Pennsylvania/49/2018 (H3N2, clade 3c2.A), il ceppo A/Hong Kong/4801/2014 propagato nelle uova, il ceppo H3N2 A/Singapore/GP2050/2015 propagato in coltura cellulare e il ceppo A/Michigan/45/2015 del sottotipo H1N1. In ELISA, il titolo IgG H3 post-vaccinale elicitato da QIVc era simile a QIVe (p > 0,99), hdTIV (p > 0,99) e QIVr (p = 0,076). I titoli neutralizzanti (misurati tramite saggio FRNT (Foci Reduction Neutralization Test) verso quattro ceppi A(H3N2) e il ceppo A(H1N1) in seguito alla vaccinazione con QIVc sono risultati simili (p > 0,05) a quelli dei gruppi hdTIV e QIVe. Al contrario, i titoli neutralizzanti dei soggetti immunizzati con QIVc erano significativamente (p < 0,05) inferiori a quelli dei soggetti vaccinati con QIVr nei confronti di quattro ceppi A(H3N2), ma erano simili (p > 0,99) nei confronti del virus A(H1N1) [54]. Moehling et al. [53] non hanno osservato alcuna differenza nella risposta immune nei bambini e adolescenti vaccinati con QIVc o QIVe sia nei confronti dei virus coltivati nelle uova sia del virus A(H3N2) propagato in coltura cellulare. Analogamente, il RCT di Dawood et al. [50] non ha evidenziato una differenza significativa tra la risposta immune HAI [per i ceppi A(H1N1), B/Victoria e B/Yamagata] e NT [per il ceppo A(H3N2)] negli operatori sanitari immunizzati con QIVc o QIVe, mentre essa era più alta nei soggetti che hanno ricevuto una dose di QIVr.
L’immunogenicità umorale di QIVc è stata confrontata con quella di QLAIV nei bambini e adolescenti di età 4-21 anni [49]. La risposta immune misurata tramite HAI è stata significativamente maggiore nei soggetti vaccinati con QIVc indipendentemente dal ceppo testato: (i) A(H1N1) propagato nelle uova (GMR: 2.49; ΔSCR: 28%; ΔSPR: 11%); (ii) A(H3N2) propagato nelle uova (GMR: 2.14; ΔSCR: 33%; ΔSPR: 9%); (iii) A(H3N2) propagato nelle cellule (GMR: 2.16; ΔSCR: 39%; ΔSPR: 13%); (iv) B/Victoria propagato nelle uova (GMR: 2.03; ΔSCR: 19%; ΔSPR: 17%); (v) B/Yamagata propagato nelle uova (GMR: 2.01; ΔSCR: 25%; ΔSPR: 11%) [49].
È stato recentemente concluso un RCT di fase III sulla non inferiorità della risposta immune in seguito alla vaccinazione con QIVc rispetto a QIVe nei bambini piccoli di età 6-47 mesi [55]. L’immunogenicità è stata misurata nei confronti di ceppi di riferimento propagati nelle cellule sia tramite HAI [per i ceppi A(H1N1), B/Victoria e B/Yamagata] sia tramite NT [per il ceppo A(H3N2)]. La non inferiorità di QIVc è stata dimostrata sia in termini di GMR [A(H1N1): 0,73 (IC 95%: 0,65-0,84); A(H3N2): 1,04 (IC 95%: 0,93-1,16); B/Victoria: 0,88 (IC 95%: 0,79-0,97); B/Yamagata: 0,73 (IC 95%: 0,66-0,81)] sia in termini di ΔSCR A(H1N1): -11,5% (IC 95%: -16,4 – -6,4%); A(H3N2): 3,1% (IC 95%: -1,4-7,8%); B/Victoria: -6,0 (IC 95%: -10,3 – -1,4%); B/Yamagata: -14,9 (IC 95%: -19,6 – -10,0%) [55].
Yu et al. [51] hanno dimostrato che due settimane dopo una dose di QIVc la risposta CD4+ incrementava (p = 0,021) di 1,5 ± 0,2 volte, mentre la risposta CD8+ aumentava di 2,2 ± 0,3 (p = 0,008). Inoltre, sia la risposta CD4+ sia CD8+ erano conservate anche a distanza di 3 mesi nella maggior parte dei soggetti. Per quel che riguarda i ceppi del virus A, la reattività CD4+ era principalmente diretta verso le proteine del core, mentre per i ceppi B verso l’emoagglutinina e la neuraminidasi. La risposta citotossica CD8+ era diretta verso le più stabili proteine del core. Inoltre, non è stata rilevata alcuna interferenza immunologica in quanto la risposta cellulare era bilanciata per i quattro ceppi vaccinali [51].
Infine, è stato recentemente provato che QIVc può essere co-somministrato con i vaccini anti-COVID-19 a mRNA (BNT162b2) e ricombinante (ChAdOx1) rispettivamente nella popolazione adulta e anziana senza una significativa interferenza immunologica [58]. In particolare, i GMT nei gruppi di co-somministrazione non differivano significativamente dai GMT nei gruppi ai quali i vaccini erano somministrati separatamente per tutti i 4 ceppi influenzali con i GMR di 0,98-1,08. Analogamente, i GMR IgG anti-Spike di SARS-CoV-2 non erano significativamente diversi da 1 sia nel gruppo QIVc + BNT162b2 [0,90 (IC 95%: 0,80-1,01)] sia nel gruppo QIVc + ChAdOx1 [0,92 (0,81-1,04)] [58]. In un altro RCT [57] i soggetti adulti sono stati randomizzati a ricevere una prima dose del vaccino anti-COVID-19 adiuvato (NVX-CoV2373) contemporaneamente a QIVc o a ricevere unicamente QIVc e placebo. Nessuna significativa differenza è stata riscontrata nei titoli HAI verso i 4 ceppi influenzali tra i due gruppi (GMR di 0,99-1,09). Nel gruppo di co-somministrazione è stata osservata una certa riduzione (GMR di 0,66) dei titoli IgG anti-Spike neutralizzanti. Tuttavia, tale riduzione della risposta umorale non si è tradotta nella corrispettiva riduzione dell’efficacia vaccinale nei confronti della malattia da SARS-CoV-2 sintomatica [57].
Data l’eterogeneità dei disegni e della popolazione dei singoli studi, la meta-analisi dell’immunogenicità relativa di QIVc non è stata condotta. Tutti i RCT inclusi sono stati considerati a basso rischio di bias.
L’efficacia teorica assoluta di QIVc nei bambini e adolescenti di età 2-17 anni (n = 4.514) è stata recentemente riportata in un RCT di fase III/IV [56]. Lo studio è stato condotto durante tre stagioni influenzali (la stagione 2017 nell’emisfero sud e le stagioni 2017/18 e 2018/19 nell’emisfero nord) e ha confrontato l’incidenza di influenza confermata in laboratorio nei bambini immunizzati con QIVc rispetto ai bambini vaccinati con vaccino antimeningococcico ACWY. L’obiettivo primario dello studio (il limite inferiore dell’IC 95% della stima dell’efficacia > 20%) è stato raggiunto. In particolare, l’efficacy assoluta contro l’influenza da qualsiasi ceppo confermata tramite RT-PCR è risultata pari al 54,6% (IC 95%: 45,7-62,1%). L’efficacy contro i ceppi A(H1N1), A(H3N2) e B è stata rispettivamente dell’80,7% (IC 95%: 69,2-87,9%), del 42,1% (IC 95%: 20,3-57,9%) e del 47,6 (IC 95%: 31,4-60,0%). Per quel che riguarda la conferma in coltura, l’efficacia è aumentata al 60,8% (IC 95%: 51,3-68,5%) (Fig. 2). L’analisi per sottofasce di età ha evidenziato un pattern simile: l’efficacy nei bambini/adolescenti di età 2-8 e 9-17 anni è stata rispettivamente del 50,5% (IC 95%: 38,4-60,2%) e del 61,9% (IC 95%: 47,4-72,3%) [56]. Come dimostra la Figura 2, le stime di efficacy erano abbastanza omogenee per le sottofasce di età, lo stato della vaccinazione dell’anno precedente e metodo laboratoristico. Lo studio [56] è stato giudicato essere a basso rischio di bias.
Efficacy assoluta di QIVc, per ceppo, stato di vaccinazione precedente, sottofascia di età e metodo laboratoristico [56].
L’efficacia sul campo è stata valutata in 17 report [59-75] corrispondenti a 18 studi (l’abstract congressuale di Eick-Cost et al. [65] ha riportato i risultati di uno studio di coorte e di uno studio caso-controllo a test negativo). La maggior parte degli studi è stata condotta negli Stati Uniti [59-73], mentre solo due studi [74, 75] sono stati eseguiti nell’Unione Europea e/o nel Regno Unito. Un totale di 14 studi [59-64, 66-70, 72-74] sono stati pubblicati nelle riviste a revisione paritaria, tre studi sono disponibili come abstract congressuali [65, 71], mentre il restante studio [75] è un report delle autorità di Sanità Pubblica inglese. La stagione 2017/18 è stata quella più rappresentativa (n = 9 studi [59-66]). L’effectiveness di QIVc nelle stagioni 2018/19 e 2019/20 è stata riportata rispettivamente da 5 [67-71] e 4 [72-75] studi. Per quel che riguarda l’esito principale, l’influenza confermata in laboratorio è stata considerata in 8 studi [62-66, 71, 74, 75]. Il restante degli studi ha utilizzato outcomes meno specifici. La Tabella V riassume le caratteristiche principali degli studi analizzati. Tutti gli studi sono stati giudicati a rischio moderato di bias.
Le principali caratteristiche degli studi sull’effectiveness di QIVc.
| Studio [Rif] | Stagione | Fascia di età | Disegno dello studio | Paese | Outcome | Esito | Dimensione campionaria | ||
|---|---|---|---|---|---|---|---|---|---|
| QIVc | Comparatore attivo | Non vaccinati | |||||||
| Izurieta et al [59] | 2017/18 | ≥ 65 anni | Coorte retrospettiva | Stati Uniti | rVE | Ospedalizzazione e/o visita al PS per influenza (ICD-10: J09.xx, J10.xx, J11.xx, and J129); Visita ambulatoriale per influenza | 659.249 | QIVe: 1.863.654; hdTIV: 8.489.159; aTIV: 1.473.536; TIVe: 1.018.494 |
NA |
| Boikos et al [60] | 2017/18 | ≥ 4 anni | Coorte retrospettiva | Stati Uniti | rVE | Ospedalizzazione o visita ambulatoriale per ILI (2 diverse definizioni) | 92.187 | QIVe: 1.261.675 | NA |
| Divino et al [61] | 2017/18 | 4–64 anni | Coorte retrospettiva | Stati Uniti | rVE | Ospedalizzazione o visita al PS per influenza (ICD-9: 487x-488x or ICD-10: J09x-J11x), polmonite, asma/BPCO/patologie bronchiali; ospedalizzazione per tutte le cause | 555.538 | QIVe: 2.528.524 | NA |
| Bruxvoort et al [62] | 2017/18 | ≥ 4 anni | Caso-controllo a test negativo | Stati Uniti | rVE, aVE | Ospedalizzazione per influenza confermata tramite RT-PCR | 232 | QIVe: 5.239 | 2.661 |
| DeMarcus et al [63] | 2017/18 | ≥ 6 mesi | Caso-controllo a test negativo | Stati Uniti | rVE, aVE | Influenza confermata tramite RT-PCR e/o coltura | 506 | QIVe: 1.002 | 2.529 |
| Martin et al [64] | 2017/18 | ≥ 18 mesi | Caso-controllo a test negativo | Stati Uniti | rVE, aVE | SARI con influenza confermata tramite RT-PCR | 66 | QIVe: 1.676 | 1.174 |
| Eick-Cost et al [65] | 2017/18 | ≥ 18 anni | Caso-controllo a test negativo | Stati Uniti | rVE | Influenza confermata tramite RT-PCR | 2.467 | QIVe: 3.239 | NA |
| Eick-Cost et al [65] | 2017/18 | ≥ 18 anni | Di coorte | Stati Uniti | rVE | ILI; ILI con ospedalizzazione; ospedalizzazione e/o visita ambulatoriale per influenza (ICD-10: J09x-J11x) | ≈400.000a | QIVe: ≈400.000a | NA |
| Klein et al [66] | 2017/18 | 4–64 anni | Coorte retrospettivab | Stati Uniti | rVE, aVE | Influenza confermata tramite RT-PCR | 84.420 | QIVe: 128.732c | 2.036.283 |
| Izurieta et al [67] | 2018/19 | ≥ 65 anni | Coorte retrospettiva | Stati Uniti | rVE | Ospedalizzazione e/o visita al PS per influenza (ICD-10: J09.xx, J10.xx, J11.xx, and J129) | 752.613 | QIVe: 1.455.254; hdTIV:
7.904.821; aTIV: 2.101.606 |
NA |
| Boikos et al [68] | 2018/19 | ≥ 4 anni | Coorte retrospettiva | Stati Uniti | rVE | Ospedalizzazione o visita ambulatoriale per ILI (2 diverse definizioni) | 2.125.430 | QIVe: 8.000.903 | NA |
| Boikos et al [69] | 2018/19 | ≥ 4 anni ad alto rischio | Coorte retrospettiva | Stati Uniti | rVE | Ospedalizzazione o visita ambulatoriale per ILI (2 diverse definizioni) | 471.301 | QIVe: 1.641.915 | NA |
| Krishnarajah et al [70] | 2018/19 | 4–64 anni | Coorte retrospettiva | Stati Uniti | rVE | Ospedalizzazione o visita al PS per influenza (ICD-9: 487x-488x or ICD-10: J09x-J11x), polmonite, asma/BPCO/patologie bronchiali e tutte le cause respiratorie; ospedalizzazione per tutte le cause | 665.047 | QIVe: 3.062.843 | NA |
| Tseng et al [71] | 2018/19 | ≥ 4 anni | Caso–controllo a test negativo | Stati Uniti | rVE, aVE | SARI con influenza confermata | NA | NA | NA |
| Izurieta et al [72] | 2019/20 | ≥ 65 anni | Coorte retrospettiva | Stati Uniti | rVE | Ospedalizzazione e/o visita al PS per influenza (ICD-10: J09.xx, J10.xx, J11.xx, and J129) | 824.264 | QIVe: 1.584.451; hdTIV:
7.173.433; aTIV: 2.565.513; QIVr: 608.433 |
NA |
| Divino et al [73] | 2019/20 | 4–64 anni | Coorte retrospettiva | Stati Uniti | rVE | Ospedalizzazione o visita al PS per influenza (ICD-9: 487x-488x or ICD-10: J09x-J11x), polmonite, asma/BPCO/patologie bronchiali, qualsiasi causa respiratoria | 1.138.969 | QIVe: 3.926.357 | NA |
| Stuurman et al [74] | 2019/20 | ≥ 9 anni | Caso–controllo a test negativo | EU | aVE | Influenza confermata | NA | NA | NA |
| Public Health England [75] | 2019/20 | 18-64 anni | Caso–controllo a test negativo | Regno Unito | aVE | Influenza confermata | NA | NA | NA |
a A seconda dell’outcome, la dimensione delle coorti era tra 796.691 to 822.001; circa il 50% dei soggetti è stato immunizzato con QIVc.
b Il disegno di caso-controllo a test negativo è stato applicato nell’analisi secondaria.
c Nell’analisi riportata, i soggetti vaccinati con TIVe (n = 803.813) sono stati raggruppati con quelli vaccinati con QIVe.
L’effectiveness assoluta di QIVc è stata riportata in 7 studi [62-64, 66, 71, 74, 75], dei quali 6 hanno seguito il disegno caso-controllo a test negativo [62-64, 71, 74, 75], mentre lo studio principale di Klein et al. [66] era una coorte retrospettiva. È stato possibile estrarre un totale di 44 stime di efficacia che variavano dal -11% (IC 95%: -115-43%) negli anziani [71] al 63,9% (IC 95%: 26,9-82,2%) negli adulti in età lavorativa [75] (Tab. VI). Al fine di stabile le principali fonti di tale eterogeneità, è stata condotta una analisi di meta-regressione. L’unico fattore statisticamente significativo è stato l’età dei vaccinati: gli studi che comprendevano i soggetti anziani riportavano dati di effectiveness più bassa (p = 0,019). Altri fattori come stagione influenzale, ceppo virale e setting (ambito delle cure primarie vs ambito ospedaliero) non erano associati all’effetto osservato. Pertanto, tutte le analisi pooled sono state eseguite per fasce di età.
Effectiveness assoluta di QIVc nel prevenire influenza confermata, per fascia di età, stagione, ceppo e studio.
| Ceppo | Stagione | Fascia di età, anni | Effectiveness assoluta, % (IC 95%) | Rif |
|---|---|---|---|---|
| Qualsiasi | 2017/18 | ≥ 4 | 14 (-31-43) | [62] |
| 2017/18 | ≥ 0,5 | 46 (33-56) | [63] | |
| 2017/18 | < 18 | 36 (12-54) | [63] | |
| 2017/18 | 4-64 | 36 (-65-76) | [62] | |
| 2017/18 | ≥ 18 | 52 (36-64) | [63] | |
| 2017/18 | ≥ 18 | 40,1 (-15,2-68,8) | [64] | |
| 2017/18 | ≥ 65 | 10 (-44-44) | [62] | |
| 2018/19 | 4-64 | 46 (-28-77) | [71] | |
| 2018/19 | ≥ 65 | -11 (-115-43) | [71] | |
| 2019/20 | 9-17a | 72 (-100-96) | [74] | |
| 2019/20 | 18-64a | 35 (-141-83) | [74] | |
| 2019/20 | 18-64b | 59 (-53-89) | [74] | |
| 2019/20 | ≥ 65b | 43 (-40-76) | [74] | |
| 2019/20 | 18-64 | 63,9 (26,9-82,2) | [75] | |
| A | 2017/18 | ≥ 4 | 18 (-32-49) | [62] |
| 2017/18 | ≥ 0,5 | 50 (37-61) | [63] | |
| 2017/18 | 4-17 | 46,8 (32,6-58,1) | [66] | |
| 2017/18 | < 18 | 51 (26-67) | [63] | |
| 2017/18 | 4-64 | 46 (-81-84) | [62] | |
| 2017/18 | 4-64 | 31,7 (18,7-42,6) | [66] | |
| 2017/18 | 18-64 | -0,7 (-29,8-21,9) | [66] | |
| 2017/18 | ≥ 18 | 54 (37-67) | [63] | |
| 2017/18 | ≥ 65 | 14 (-46-49) | [62] | |
| A(H1N1)pdm09 | 2017/18 | ≥ 0,5 | 61 (38-76) | [63] |
| 2017/18 | < 18 | 56 (15-77) | [63] | |
| 2017/18 | ≥ 18 | 71 (44-85) | [63] | |
| A(H3N2) | 2017/18 | ≥ 4 | 6 (-54-42) | [62] |
| 2017/18 | ≥ 0,5 | 48 (30-61) | [63] | |
| 2017/18 | < 18 | 47 (14-67) | [63] | |
| 2017/18 | 4-64 | 47 (-131-88) | [62] | |
| 2017/18 | ≥ 18 | 47 (25-63) | [63] | |
| 2017/18 | ≥ 18 | 43,0 (-36,3-76,1) | [64] | |
| 2017/18 | ≥ 65 | 2 (-67-42) | [62] | |
| 2019/20 | 18-64 | 64,8 (12,4-85,8) | [75] | |
| B | 2017/18 | ≥ 4 | 1 (-113-54) | [62] |
| 2017/18 | ≥ 0,5 | 40 (21-55) | [63] | |
| 2017/18 | 4-17 | 45,8 (33,7-55,8) | [66] | |
| 2017/18 | < 18 | 22 (-17-47) | [63] | |
| 2017/18 | 4-64 | 16 (-277-81) | [62] | |
| 2017/18 | 4-64 | 40,9 (30,0-50,1) | [66] | |
| 2017/18 | 18-64 | 27,8 (1,2-47,2) | [66] | |
| 2017/18 | ≥ 18 | 54 (31-69) | [63] | |
| 2017/18 | ≥ 18 | 51,5 (-77,0-86,7) | [64] | |
| 2017/18 | ≥ 65 | -6 (-163-57) | [62] |
Le stime statisticamente significative sono evidenziate in corsivo.
a Ambito delle cure primarie.
b Ambito ospedaliero.
Le stime meta-analitiche per sottogruppi di età hanno confermato i risultati della meta-regressione: l’effectiveness è risultata significativamente più alta nelle fasce di età giovanili (Tab. VII). È tuttavia da notare che le stime pooled erano altamente influenzate dalla stagione 2017/18 caratterizzata da una bassa efficacia di tutti i vaccini influenzali. Al contrario, nella stagione 2019/20 l’effectiveness assoluta di QIVc nella popolazione adulta è risultata pari al 64% (IC 95%: 27-82%) [75].
Modelli a effetti casuali sull’effectiveness assoluta di QIVc nel prevenire influenza confermata, per classe di età e ceppo.
| Fascia di età, anni | Ceppo | N. stime | Stima pooled, % (IC 95%) | I2, % |
|---|---|---|---|---|
| ≥ 4 | Qualsiasi | 2 | 34 (-3-58) | 73,9 |
| A | 2 | 39 (1-62) | 69,8 | |
| A(H3N2) | 2 | 34 (-20-62) | 75,9 | |
| B | 2 | 32 (-2-55) | 30,8 | |
| 4–64 | Qualsiasi | 2 | 42 (-11-69) | 0 |
| < 18 | Qualsiasi | 4 | 38 (18-54) | 0 |
| A | 4 | 41 (28-52) | 39,6 | |
| A(H3N2) | 2 | 47 (16-66) | 0 | |
| B | 4 | 41 (33-48) | 0 | |
| ≥ 18 | Qualsiasi | 2 | 50 (35-62) | 0 |
| A(H3N2) | 2 | 46 (26–61) | 0 | |
| B | 2 | 54 (32-68) | 0 | |
| ≥ 65 | Qualsiasi | 3 | 11 (-26-38) | 0 |
Le stime statisticamente significative sono evidenziate in corsivo.
Almeno una stima di effectiveness relativa di QIVc è stata riportata in 16 studi [59-73]. È stato possibile estrapolare un totale di 122 stime di efficacia sul campo relativa (Tab. VIII). Il comparatore più frequente è stato QIVe (84,4%; 103/122), mentre il confronto con hdTIV (5,7% delle stime), QIVr (1,6% delle stime), TIVe (2,5% delle stime) e il vaccino trivalente adiuvato con MF59 (adjuvanted Trivalent Influenza Vaccine, aTIV) (5,7% delle stime) era molto meno frequente. Le stime puntuali di effectiveness relativa hanno dimostrato un’ampia variabilità (dal -190 al 61%). Tra le 103 stime relative al confronto di QIVc con QIVe, 52 (50,5%) stime favorivano QIVc, 3 (2,9%) stime favorivano QIVe, mentre le restanti 48 (46,6%) non sono risultate statisticamente significative. Il confronto di QIVc con i cosiddetti vaccini “potenziati” (aTIV, hdTIV o QIVr) è stato eseguito in 3 studi di Izurieta et al. [59, 67, 72]. Nella stagione 2017/18 [59], QIVc è risultato più efficace di hdTIV [del 5,1% (IC 95%: 1,6-8,4%)] nel prevenire le visite ambulatoriali per influenza e più efficace di aTIV nel prevenire le visite ambulatoriali [dell’11,5% (IC 95%: 7,9-15,0%)] e le ospedalizzazioni/visite al pronto soccorso per influenza (PS) [del 7,5% (IC 95%: 4,1-10,7%)]. Al contrario, durante le stagioni 2018/19 [67] e 2019/20 [72] QIVc è risultato efficace di aTIV nel prevenire le visite ambulatoriali e le ospedalizzazioni/visite al PS per influenza [rispettivamente del -7,5% (IC 95%: -13,1 – -2,2%) e del -5,8% (IC 95%: -11,7 – -0,3%)]. Infine, nella stagione 2019/20 [72] QIVc è risultato meno efficace di QIVr nel prevenire le ospedalizzazioni/visite al PS per influenza [del -12,1% (IC 95%: -20,6 – -4,2%)] tra gli anziani statunitensi (Tab. VIII).
Effectiveness relativa QIVc vs altri vaccini influenzali, per fascia di età, stagione, comparatore, esito e studio.
| Fascia di età, anni | Stagione | Comparatore | Esito | Effectiveness QIVc vs comparatore, % (IC 95%) | Rif |
|---|---|---|---|---|---|
| < 18 | 2017/18 | QIVe | Influenza confermata (qualsiasi ceppo) | -20 (-70-20) | [63] |
| 2017/18 | QIVe | Influenza confermata di tipo A | 0 (-60-40) | [63] | |
| 2017/18 | QIVe | Influenza confermata A(H1N1) | -190 (-530 – -30) | [63] | |
| 2017/18 | QIVe | Influenza confermata A(H3N2) | 30 (-20-60) | [63] | |
| 2017/18 | QIVe | Influenza confermata di tipo B | -30 (-100-20) | [63] | |
| 2017/18 | QIVe | Influenza confermata di tipo A | 17,8 (-6,2-36,4) | [66] | |
| 2017/18 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ba | 18,8 (-53,9-57,2) | [60] | |
| 2017/18 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ab | 54,6 (43,1-63,8) | [60] | |
| 2017/18 | QIVe | Ospedalizzazione/visita al PS per influenza | 13,1 (-3,8-27,0) | [61] | |
| 2017/18 | QIVe | Ospedalizzazione/visita al PS per polmonite | 33,0 (13,5-47,9) | [61] | |
| 2017/18 | QIVe | Ospedalizzazione/visita al PS per asma/BPCO/bronchiti | 13,4 (4,3-21,5) | [61] | |
| 2017/18 | QIVe | Ospedalizzazione per tutte le cause | 5,7 (-3,8-14,1) | [61] | |
| 2018/19 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ba | 3,9 (0,9-7,0) | [68] | |
| 2018/19 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ab | 19,0 (17,6-20,3) | [68] | |
| 2018/19 | QIVe | Ospedalizzazione/visita al PS per influenza | 8,5 (-7,1-21,8) | [70] | |
| 2018/19 | QIVe | Ospedalizzazione/visita al PS per polmonite | 21,5 (4,3-35,6) | [70] | |
| 2018/19 | QIVe | Ospedalizzazione/visita al PS per asma/BPCO/bronchiti | 13,0 (4,7-20,5) | [70] | |
| 2018/19 | QIVe | Ospedalizzazione per cause respiratorie | 13,8 (8,6-18,6) | [70] | |
| 2018/19 | QIVe | Ospedalizzazione per tutte le cause | 16,1 (8,3-23,2) | [70] | |
| < 65 | 2017/18 | QIVe | Ospedalizzazione per influenza confermata (qualsiasi ceppo) | 43 (-45-77) | [62] |
| 2017/18 | QIVe | Influenza confermata di tipo A | 8,0 (-10-23) | [66] | |
| 2017/18 | QIVe | Ospedalizzazione per influenza confermata A(H3N2) | 61 (-63-91) | [62] | |
| 2017/18 | QIVe | Ospedalizzazione/visita al PS per influenza | 14,4 (8,8-19,6) | [61] | |
| 2017/18 | QIVe | Ospedalizzazione/visita al PS per polmonite | 4,2 (-0,6-9,0) | [61] | |
| 2017/18 | QIVe | Ospedalizzazione/visita al PS per asma/BPCO/bronchiti | 8,3 (5,9-10,6) | [61] | |
| 2017/18 | QIVe | Ospedalizzazione per tutte le cause | 11,8 (10,4-13,1) | [61] | |
| 2018/19 | QIVe | Ospedalizzazione per influenza confermata (qualsiasi ceppo) | 24 (-76-67) | [71] | |
| 2018/19 | QIVe | Ospedalizzazione/visita al PS per influenza | 6,5 (0,1-12,5) | [70] | |
| 2018/19 | QIVe | Ospedalizzazione/visita al PS per polmonite | 5,2 (0,8-9,5) | [70] | |
| 2018/19 | QIVe | Ospedalizzazione/visita al PS per asma/BPCO/bronchiti | 9,5 (7,3-11,6) | [70] | |
| 2018/19 | QIVe | Ospedalizzazione per cause respiratorie | 7,7 (6,1-9,4) | [70] | |
| 2018/19 | QIVe | Ospedalizzazione per tutte le cause | 7,9 (6,6-9,1) | [70] | |
| 2019/20 | QIVe | Ospedalizzazione/visita al PS per influenza | 5,3 (0,5-9,9) | [73] | |
| 2019/20 | QIVe | Ospedalizzazione/visita al PS per polmonite | 6,7 (2,1-11,1) | [73] | |
| 2019/20 | QIVe | Ospedalizzazione/visita al PS per asma/BPCO/bronchiti | 7,6 (5,2-9,9) | [73] | |
| 2019/20 | QIVe | Ospedalizzazione per cause respiratorie | 8,2 (6,5-9,8) | [73] | |
| < 65 ad alto rischio | 2017/18 | QIVe | Ospedalizzazione/visita al PS per influenza | 10,1 (1,1-18,2) | [61] |
| 2017/18 | QIVe | Ospedalizzazione/visita al PS per polmonite | -2,1 (-8,8-4,1) | [61] | |
| 2017/18 | QIVe | Ospedalizzazione/visita al PS per asma/BPCO/bronchiti | 6,9 (3,9-9,8) | [61] | |
| 2017/18 | QIVe | Ospedalizzazione per tutte le cause | 7,4 (5,6-9,2) | [61] | |
| 2018/19 | QIVe | Ospedalizzazione/visita al PS per influenza | 0,9 (-9,8-10,5) | [70] | |
| 2018/19 | QIVe | Ospedalizzazione/visita al PS per polmonite | 2,8 (-3,2-8,4) | [70] | |
| 2018/19 | QIVe | Ospedalizzazione/visita al PS per asma/BPCO/bronchiti | 5,7 (2,8-8,4) | [70] | |
| 2018/19 | QIVe | Ospedalizzazione per cause respiratorie | 4,0 (2,1-5,7) | [70] | |
| 2018/19 | QIVe | Ospedalizzazione per tutte le cause | 4,0 (2,2-5,7) | [70] | |
| 2019/20 | QIVe | Ospedalizzazione/visita al PS per influenza | 10,5 (2,9-17,5) | [73] | |
| 2019/20 | QIVe | Ospedalizzazione/visita al PS per polmonite | 8,0 (2,1-13,6) | [73] | |
| 2019/20 | QIVe | Ospedalizzazione/visita al PS per asma/BPCO/bronchiti | 8,6 (5,7-11,4) | [73] | |
| 2019/20 | QIVe | Ospedalizzazione per cause respiratorie | 9,7 (7,4-12,0) | [73] | |
| 18-64 | 2017/18 | QIVe | Influenza confermata di tipo A | -5,8 (-36,1-17,7) | [66] |
| 2017/18 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ba | 26,8 (14,1-37,6) | [60] | |
| 2017/18 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ab | 33,2 (29,9-36,4) | [60] | |
| 2017/18 | QIVe | Ospedalizzazione/visita al PS per influenza | 13,1 (6,8-19,0) | [61] | |
| 2017/18 | QIVe | Ospedalizzazione/visita al PS per polmonite | 0,2 (-4,9-5,0) | [61] | |
| 2017/18 | QIVe | Ospedalizzazione/visita al PS per asma/BPCO/bronchiti | 8,3 (5,8-10,6) | [61] | |
| 2017/18 | QIVe | Ospedalizzazione per tutte le cause | 13,0 (11,7-14,2) | [61] | |
| 2018/19 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ba | 6,5 (5,2-7,9) | [68] | |
| 2018/19 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ab | 6,4 (6,0-6,8) | [68] | |
| 2018/19 | QIVe | Ospedalizzazione/visita al PS per influenza | 4,9 (-2,7-12,1) | [70] | |
| 2018/19 | QIVe | Ospedalizzazione/visita al PS per polmonite | 2,6 (-1,9-7,0) | [70] | |
| 2018/19 | QIVe | Ospedalizzazione/visita al PS per asma/BPCO/bronchiti | 8,8 (6,5-10,1) | [70] | |
| 2018/19 | QIVe | Ospedalizzazione per cause respiratorie | 6,3 (4,6-8,1) | [70] | |
| 2018/19 | QIVe | Ospedalizzazione per tutte le cause | 6,4 (5,1-7,6) | [70] | |
| ≥ 65 | 2017/18 | QIVe | Ospedalizzazione per influenza confermata (qualsiasi ceppo) | 6 (-46-39) | [62] |
| 2017/18 | QIVe | Ospedalizzazione per influenza confermata A(H3N2) | 4 (-70-37) | [62] | |
| 2017/18 | QIVe | Ospedalizzazione/visita al PS per influenza | 11,0 (7,9-14,0) | [59] | |
| 2017/18 | QIVe | Ospedalizzazione per influenza | 9,5 (5,3-13,4) | [59] | |
| 2017/18 | QIVe | Visita ambulatoriale per influenza | 5,7 (1,9-9,4) | [59] | |
| 2017/18 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ba | -7,3 (-51,6-24,0) | [60] | |
| 2017/18 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ab | 8,8 (-1,0-17,6) | [60] | |
| 2017/18 | TIVe | Ospedalizzazione/visita al PS per influenza | 10,8 (7,4-14,1) | [59] | |
| 2017/18 | TIVe | Ospedalizzazione per influenza | 11,4 (7,0-15,7) | [59] | |
| 2017/18 | TIVe | Visita ambulatoriale per influenza | 1,0 (-3,5-5,3) | [59] | |
| 2017/18 | HdTIV | Ospedalizzazione/visita al PS per influenza | 2,3 (-0,8-5,3) | [59] | |
| 2017/18 | HdTIV | Ospedalizzazione per influenza | -0,7 (-4,8-3,4) | [59] | |
| 2017/18 | HdTIV | Visita ambulatoriale per influenza | 5,1 (1,6-8,4) | [59] | |
| 2017/18 | Ativ | Ospedalizzazione/visita al PS per influenza | 7,5 (4,1-10,7) | [59] | |
| 2017/18 | Ativ | Ospedalizzazione per influenza | 7,1 (2,7-11,3) | [59] | |
| 2017/18 | aTIV | Visita ambulatoriale per influenza | 11,5 (7,9-15,0) | [59] | |
| 2018/19 | QIVe | Ospedalizzazione per influenza confermata (qualsiasi ceppo) | -4 (-83-40) | [71] | |
| 2018/19 | QIVe | Ospedalizzazione/visita al PS per influenza | 0,8 (-4,6-5,9) | [67] | |
| 2018/19 | QIVe | Ospedalizzazione per influenza | 3,4 (-3,6-9,8) | [67] | |
| 2018/19 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ba | -2,2 (-5,4-0,9) | [68] | |
| 2018/19 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ab | -6,8 (-7,6 – -6,0) | [68] | |
| 2018/19 | HdTIV | Ospedalizzazione/visita al PS per influenza | -4,4 (-9,2-0,2) | [67] | |
| 2018/19 | HdTIV | Ospedalizzazione per influenza | -2,0 (-8,2-3,9) | [67] | |
| 2018/19 | Ativ | Ospedalizzazione/visita al PS per influenza | -7,5 (-13,1 – -2,2) | [67] | |
| 2018/19 | Ativ | Ospedalizzazione per influenza | -3,4 (-10,5-3,2) | [67] | |
| 2019/20 | QIVe | Ospedalizzazione per influenza confermata (qualsiasi ceppo) | 2,8 (-2,8-8,2) | [72] | |
| 2019/20 | QIVe | Ospedalizzazione/visita al PS per influenza | 3,7 (-3,9-10,7) | [72] | |
| 2019/20 | HdTIV | Ospedalizzazione/visita al PS per influenza | -4,2 (-9,4-0,8) | [72] | |
| 2019/20 | HdTIV | Ospedalizzazione per influenza | -3,5 (-9,4-0,8) | [72] | |
| 2019/20 | Ativ | Ospedalizzazione/visita al PS per influenza | -5,8 (-11,7--0,3) | [72] | |
| 2019/20 | Ativ | Ospedalizzazione per influenza | -3,4 (-11,0-3,8) | [72] | |
| 2019/20 | QIVr | Ospedalizzazione per influenza confermata (qualsiasi ceppo) | -12,1 (-20,6 – -4,2) | [72] | |
| 2019/20 | QIVr | Ospedalizzazione/visita al PS per influenza | -15,7 (-27,7 – -4,8) | [72] | |
| ≥ 18 | 2017/18 | QIVe | Influenza confermata (qualsiasi ceppo) | 10 (-30-40) | [63] |
| 2017/18 | QIVe | Influenza confermata di tipo A | 20 (-10-50) | [63] | |
| 2017/18 | QIVe | Influenza confermata A(H1N1) | -60 (-340-40) | [63] | |
| 2017/18 | QIVe | Influenza confermata A(H3N2) | 30 (0-50) | [63] | |
| 2017/18 | QIVe | Influenza confermata di tipo B | -10 (-90-30) | [63] | |
| 2017/18 | QIVe | Ospedalizzazione per influenza confermata (qualsiasi ceppo) | 8,5 (-75,9-52,3) | [64] | |
| 2017/18 | QIVe | Ospedalizzazione per influenza confermata A(H3N2) | 24,9 (-78,8-68,5) | [64] | |
| 2017/18 | QIVe | Ospedalizzazione per influenza confermata di tipo B | 1,8 (-254-72,8) | [64] | |
| 2017/18 | QIVe | Influenza confermata (qualsiasi ceppo) | 5 (-10-17) | [65] | |
| 2017/18 | QIVe | Ospedalizzazione/visita ambulatoriale per influenza | 16 (11-20) | [65] | |
| 2017/18 | QIVe | Ospedalizzazione per influenza | 46 (-18-76) | [65] | |
| 2017/18 | QIVe | Qualsiasi ILI | 2 (1-4) | [65] | |
| 2017/18 | QIVe | Ospedalizzazione per ILI | 16 (-9-35) | [65] | |
| ≥ 4 | 2017/18 | QIVe | Ospedalizzazione per influenza confermata (qualsiasi ceppo) | 15 (-26-43) | [62] |
| 2017/18 | QIVe | Ospedalizzazione per influenza confermata (qualsiasi ceppo) | 15 (-34-47) | [62] | |
| 2017/18 | QIVe | Influenza confermata (qualsiasi ceppo) | 0 (-30-20) | [63] | |
| 2017/18 | QIVe | Influenza confermata di tipo A | 10 (-20-40) | [63] | |
| 2017/18 | QIVe | Influenza confermata A(H1N1) | -100 (-260 – -10) | [63] | |
| 2017/18 | QIVe | Influenza confermata A(H3N2) | 30 (0-50) | [63] | |
| 2017/18 | QIVe | Influenza confermata di tipo B | -20 (-70-10) | [63] | |
| 2017/18 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ba | 36,2 (26,1-44,9) | [60] | |
| 2017/18 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ab | 46,1 (42,9-49,1) | [60] | |
| 2018/19 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ba | 7,6 (6,5-8,6) | [68] | |
| 2018/19 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ab | 7,6 (7,2-7,9) | [68] | |
| ≥ 4 ad alto rischio | 2018/19 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ba | 13,4 (11,4-15,4) | [69] |
| 2018/19 | QIVe | Ospedalizzazione/visita ambulatoriale per ILI-Ab | 6,5 (5,8-7,2) | [69] |
Le stime statisticamente significative sono evidenziate in corsivo.
a Definizione più specifica e meno sensibile.
b Definizione più sensibile e meno specifica.
La Tabella IX riporta i risultati delle meta-analisi a effetti casuali suddivisi per fascia di età, esito correlato all’influenza e comparatore. Per quel che riguarda influenza confermata tramite RT-PCR si evince che in tutte le fasce di età (≥ 4 anni) QIVc è risultato più efficace (p < 0,05) di QIVe del 25% (IC 95%: 2-42%) nel prevenire l’infezione da A(H3N2); l’eterogeneità è stata nulla (I2 = 0%). Considerando solo la popolazione adulta (≥ 4 anni), l’effectiveness relativa QIVc vs QIVe nei confronti di A(H3N2) saliva al 29% (IC 95%: 2-49%; I2 = 0%). D’altronde, l’efficacia sul campo relativa nei confronti di altri ceppi virali non era statisticamente significativa indipendentemente dalla fascia di età considerata. Per quel che riguarda invece altri esiti meno specifici e considerando tutte le fasce di età (≥ 4 anni), QIVc è stato significativamente più efficace di QIVe nel prevenire le ospedalizzazioni/visite al PS/visite ambulatoriali per influenza/ILI [11% (IC 95%: 4-17%); I2 = 95,9%], le ospedalizzazioni/visite al PS per polmonite [5% (IC 95%: 3-8%); I2 = 0%], asma/BPCO/bronchiti [9% (IC 95%: 7-10%); I2 = 0%], qualsiasi causa respiratoria [8% (IC 95%: 7-9%); I2 = 0%] e per tutte le cause [10% (IC 95%: 6-14%); I2 = 94,2%]. Va tuttavia sottolineato che le stime pooled relative agli esiti di ospedalizzazioni/visite al PS/visite ambulatoriali per influenza/ILI e ospedalizzazioni per tutte le cause devono essere interpretate con cautela vista la loro eterogeneità critica. Un quadro analogo si è osservato nella popolazione di età ≥ 4 anni con almeno una patologia cronica. L’analisi per sottofasce di età ha evidenziato una età dipendenza dell’effectiveness relativa di QIVc. In particolare, nella popolazione pediatrica e in quella adulta, le stime meta-analitiche degli outcomes clinici erano simili a quelle riportate per la popolazione generale. Nell’anziano invece non si è osservato alcun vantaggio di QIVc indipendentemente dall’esito o dal comparatore (Tab. IX).
Modelli a effetti casuali sull’effectiveness relativa di QIVc, per fascia di età, stagione, comparatore ed esito.
| Fascia di età, anni | Esito | Comparatore | N. stime | Stima pooled, % (IC 95%) | I2, % |
|---|---|---|---|---|---|
| ≥ 4 | Influenza confermata (qualsiasi ceppo) | QIVe | 7 | 6 (-4-14) | 0 |
| Influenza confermata di tipo A | QIVe | 2 | 8 (-7-22) | 0 | |
| Influenza confermata A(H3N2) | QIVe | 3 | 25 (2-42) | 0 | |
| Influenza confermata di tipo B | QIVe | 2 | -19 (-62-13) | 0 | |
| Ospedalizzazioni, visite al PS e/o ambulatoriali per influenza/ILI | QIVe | 9 | 11 (4-17) | 95,9 | |
| Ospedalizzazioni/visite al PS per influenza/ILI | QIVe | 7 | 7 (3-11) | 73,1 | |
| Ospedalizzazione/visita al PS per polmonite | QIVe | 3 | 5 (3-8) | 0 | |
| Ospedalizzazione/visita al PS per asma/BPCO/bronchiti | QIVe | 3 | 9 (7-10) | 0 | |
| Ospedalizzazione per cause respiratorie | QIVe | 2 | 8 (7-9) | 0 | |
| Ospedalizzazione per tutte le cause | QIVe | 2 | 10 (6-14) | 94,2 | |
| ≥ 4 ad alto rischio | Ospedalizzazioni, visite al PS e/o ambulatoriali per influenza/ILI | QIVe | 4 | 10 (5-15) | 56,9 |
| Ospedalizzazioni/visite al PS per influenza/ILI | QIVe | 3 | 8 (2-13) | 21,9 | |
| Ospedalizzazione/visita al PS per polmonite | QIVe | 3 | 3 (-3-8) | 62,5 | |
| Ospedalizzazione/visita al PS per asma/BPCO/bronchiti | QIVe | 3 | 7 (5-9) | 3,8 | |
| Ospedalizzazione per cause respiratorie | QIVe | 2 | 7 (1-12) | 93,1 | |
| Ospedalizzazione per tutte le cause | QIVe | 2 | 6 (2-9) | 85,8 | |
| ≥ 18 | Influenza confermata (qualsiasi ceppo) | QIVe | 3 | 6 (-7-17) | 0 |
| Influenza confermata di tipo A | QIVe | 2 | 4 (-25-26) | 27,1 | |
| Influenza confermata A(H3N2) | QIVe | 2 | 29 (2-49) | 0 | |
| Influenza confermata di tipo B | QIVe | 2 | -8 (-73-72) | 0 | |
| Ospedalizzazioni, visite al PS e/o ambulatoriali per influenza/ILI | QIVe | 10 | 8 (3-13) | 92,4 | |
| Ospedalizzazioni/visite al PS per influenza/ILI | QIVe | 6 | 7 (2-12) | 72,2 | |
| Ospedalizzazione/visita al PS per polmonite | QIVe | 2 | 2 (-2-5) | 0 | |
| Ospedalizzazione/visita al PS per asma/BPCO/bronchiti | QIVe | 2 | 9 (7-10) | 0 | |
| Ospedalizzazione per cause respiratorie | QIVe | 2 | 8 (7-9) | 0 | |
| Ospedalizzazione per tutte le cause | QIVe | 2 | 10 (3-16) | 98,1 | |
| < 18 | Influenza confermata (qualsiasi ceppo) | QIVe | 2 | 3 (-40-33) | 62,2 |
| Influenza confermata di tipo A | QIVe | 2 | 14 (-8-32) | 0 | |
| Ospedalizzazioni, visite al PS e/o ambulatoriali per influenza/ILI | QIVe | 4 | 5 (1-8) | 3,5 | |
| Ospedalizzazioni/visite al PS per influenza/ILI | QIVe | 2 | 11 (-1-20) | 0 | |
| Ospedalizzazione/visita al PS per polmonite | QIVe | 2 | 26 (14-37) | 0 | |
| Ospedalizzazione/visita al PS per asma/BPCO/bronchiti | QIVe | 2 | 13 (7-19) | 0 | |
| Ospedalizzazione per tutte le cause | QIVe | 2 | 11 (0,4-21) | 67,9 | |
| 4–64 | Influenza confermata (qualsiasi ceppo) | QIVe | 3 | 10 (-7-24) | 0 |
| Ospedalizzazioni, visite al PS e/o ambulatoriali per influenza/ILI | QIVe | 8 | 10 (5-15) | 88,8 | |
| Ospedalizzazioni/visite al PS per influenza/ILI | QIVe | 4 | 9 (3-14) | 60,8 | |
| Ospedalizzazione/visita al PS per polmonite | QIVe | 3 | 5 (3-8) | 0 | |
| Ospedalizzazione/visita al PS per asma/BPCO/bronchiti | QIVe | 3 | 9 (7-10) | 0 | |
| Ospedalizzazione per cause respiratorie | QIVe | 2 | 8 (7-9) | 0 | |
| Ospedalizzazione per tutte le cause | QIVe | 2 | 10 (6-14) | 94,2 | |
| 18–64 | Influenza confermata (qualsiasi ceppo) | QIVe | 2 | 3 (-10-14) | 0 |
| Ospedalizzazioni, visite al PS e/o ambulatoriali per influenza/ILI | QIVe | 5 | 12 (6-18) | 87,0 | |
| Ospedalizzazioni/visite al PS per influenza/ILI | QIVe | 3 | 10 (1-17) | 48,8 | |
| Ospedalizzazione/visita al PS per polmonite | QIVe | 2 | 2 (-2-5) | 0 | |
| Ospedalizzazione/visita al PS per asma/BPCO/bronchiti | QIVe | 2 | 9 (7-10) | 0 | |
| Ospedalizzazione per cause respiratorie | QIVe | 2 | 8 (7-9) | 0 | |
| Ospedalizzazione per tutte le cause | QIVe | 2 | 10 (3-16) | ||
| ≥ 65 | Influenza confermata (qualsiasi ceppo) | QIVe | 2 | 2 (-38-31) | 0 |
| Ospedalizzazioni, visite al PS e/o ambulatoriali per influenza/ILI | QIVe | 5 | 3 (-3-9) | 85,1 | |
| Ospedalizzazioni/visite al PS per influenza/ILI | QIVe | 3 | 5 (-1-11) | 83,8 | |
| Ospedalizzazioni/visite al PS per influenza/ILI | hdTIV | 3 | 2 (-6-3) | 72,4 | |
| Ospedalizzazioni/visite al PS per influenza/ILI | aTIV | 3 | 2 (-12-8) | 92,1 |
Le stime statisticamente significative sono evidenziate in corsivo.
La Tabella X riporta la frequenza degli eventi avversi sollecitati, registrati nei primi 7 giorni dopo la vaccinazione con QIVc e osservati nei RCT registrativi [47, 48, 55]. In sintesi, la maggior parte degli eventi avversi era nel sito di iniezione e di entità lieve. La frequenza era generalmente più alta nella popolazione pediatrica rispetto a quella adulta. Per quel che concerne gli eventi avversi sistemici, negli adulti e nei bambini di età ≥6 anni il mal di testa e la mialgia sono stati di più frequente riscontro. Nei bambini più piccoli invece la sonnolenza e l’irritabilità erano preponderanti. Nei bambini al di sotto di 9 anni di età, le reazioni avverse sono state riscontrate più frequentemente dopo la prima dose rispetto alla seconda (Tab. X). Lo studio di Nolan et al. [56], che aveva come obiettivo primario quello di valutare l’efficacy assoluta di QIVc nei bambini e adolescenti di età 2-17 anni, ha riportato una frequenza di eventi avversi sollecitati locali e sistemici rispettivamente nel 9,0% e nello 0,8% dei soggetti.
Frequenza (%) degli eventi avversi sollecitati nei soggetti immunizzati con QIVc, per fascia di età ed evento avverso.
| Evento avverso | Classe di età, anni [Rif] | ||||
|---|---|---|---|---|---|
| < 4 [55] | 4–5 [47]a | 6–8 [47]a | 9–17 [47] | ≥ 18 [48] | |
| Qualsiasi locale | 41,9 | 56,6/53,1 | 63,7/49,8 | 65,1 | 41,8 |
| Dolore/indolenzimento | 27,9 | 45,6/50,0 | 54,0/46,3 | 57,7 | 33,6 |
| Eritema | 25,8 | 17,6/17,3 | 22,3/14,1 | 19,0 | 12,7 |
| Indurimento | 17,3 | 13,2/11,2 | 15,9/12,2 | 15,2 | 10,2 |
| Ecchimosi | 10,7 | 8,8/6,1 | 9,4/4,4 | 4,1 | 4,2 |
| Qualsiasi sistemico | 43,5 | 28,0/30,6 | 31,5/22,4 | 40,1 | 28,5 |
| Malessere generale/affaticamento | NA | NA | 12,6/8,8 | 18,0 | 13,5 |
| Sonnolenza | 26,9 | 18,7/13,3 | NA | NA | NA |
| Irritabilità | 27,9 | 15,9/15,3 | NA | NA | NA |
| Inappetenza/ modifica del comportamento alimentare | 17,4 | NA | 8,9/2,9 | 8,8 | 6,1 |
| Febbre/febbricola | 6,8 | 3,8/4,1 | 4,3/2,9 | 1,2 | 0,5 |
| Brividi | NA | 5,5/4,1 | 4,3/1,0 | 7,4 | 5,3 |
| Mal di testa | NA | NA | 14,0/4,4 | 21,9 | 14,0 |
| Mialgia | NA | NA | 11,6/8,8 | 16,2 | 11,8 |
| Artralgia | NA | NA | 3,5/2,9 | 6,2 | 6,8 |
| Nausea | NA | NA | 7,8/3,4 | 9,5 | 6,7 |
| Vomito | 6,8 | 4,4/3,1 | 3,2/3,4 | 1,7 | 1,7 |
| Diarrea | 17,9 | 4,4/3,1 | 3,5/2,0 | 3,8 | 5,8 |
a Le percentuali si riferiscono a dopo la prima dose/dopo la seconda dose.
Come riporta la Tabella XI, la frequenza relativa degli eventi avversi non sollecitati è stata sostanzialmente minore. Ad esempio, qualsiasi evento avverso serio è stato segnalato mediamente nell’1% dei vaccinati.
Frequenza (%) degli eventi avversi spontanei nei soggetti immunizzati con QIVc, per fascia di età ed evento avverso.
| Evento avverso | Classe di età, anni [Rif] | |||
|---|---|---|---|---|
| < 4 [55] | 4–17 [47] | 2–17 [56] | ≥ 18 [48] | |
| Qualsiasi evento | 26,2 | 24,1 | 28,0 | 31,9 |
| Qualsiasi evento possibilmente o probabilmente correlato a QIVc | 4,4 | 4,8 | 4,3 | 4,2 |
| Qualsiasi evento serio | 0,9 | 0,5 | 1,1 | 1,7 |
| Qualsiasi evento serio possibilmente/probabilmente correlato a QIVc | 0 | 0 | 0 | 0 |
| Nuova insorgenza delle malattie croniche | 1,4 | 1,7 | 0,4 | 3,6 |
| Morte | 0,1 | 0 | 0 | 0 |
Nei bambini piccoli di età 6-47 mesi, la frequenza degli eventi avversi sollecitati totali [60,1% vs 62,6%; RR 0,96 (IC 95%: 0,90-1,03)], locali [41,9% vs 44,6%; RR 0,94 (IC 95%: 0,85-1,04)], sistemici [43,5% vs 45,7%; RR 0,95 (IC 95%: 0,87-1,05)] o spontanei non sollecitati sistemici [26,2% vs 25,7%; RR 1,02 (IC 95%: 0,88-1,18)] in seguito alla vaccinazione rispettivamente con QIVc o QIVe è risultata simile [55].
Sono stati identificati 4 studi di sorveglianza post-marketing [76-79]. In una coorte retrospettiva inglese (n = 1.108.632) [76] l’incidenza degli eventi avversi nei soggetti vaccinati con QIVc era simile a quella osservata nei soggetti vaccinati con QIVe, mentre l’uso di QLAIV e aTIV era associato a una significativa riduzione rispettivamente del 43% e del 26% nel riportare un evento avverso. Nell’analisi per sottogruppi è emerso che l’incidenza degli eventi avversi negli adulti di età 18-64 anni vaccinati con QIVc era maggiore del 16% (IC 95%: 9-22%) rispetto a quelli vaccinati con QIVe [76]. Una sorveglianza attiva degli eventi avversi in seguito a una dose di QIVc è stata condotta tra gli operatori sanitari del Policlinico di Bari durante la stagione 2019/20 [77]. Nei primi 7 giorni dopo la vaccinazione, un totale di 58,0% (n = 741) dei soggetti ha riportato almeno una reazione avversa (430 eventi avversi in totale). Il 99,8% degli eventi avversi è stato classificato come non serio, mentre solo un evento avverso (0,2%)è stato classificato come serio. Per questo evento avverso serio, non è stato stabilito il nesso causale con la vaccinazione. La maggior parte degli eventi avversi, riportati dal 51,1% (IC 95%: 47,3-54,7%) degli intervistati, erano nel sito di iniezione. Tra questi, il dolore, l’indurimento, il gonfiore e l’eritema sono stati segnalati rispettivamente dal 48,2% (IC 95%: 44,5-51,8%), 10,9% (IC 95%: 8,8-13,4%), 5,1% (IC 95%: 2,5-5,4%) e 2,8% (IC 95%: 1,8-4,3%). Tra gli eventi sistemici le reazioni avverse più frequenti erano: malessere generale/mialgia/insonnia [15,4% (IC 95%: 12,9-18,2%)], febbre/febbricola [2,8% (IC 95%: 1,8-4,3%)], mal di testa/irritabilità [4,9% (IC 95%: 3,4-6,7%)] e sintomi gastrointestinali [1,2% (IC 95%: 0,6-2,3%)]. Gli eventi avversi sono stati riportati più frequentemente (p < 0,001) da soggetti più giovani e dalle femmine. Il profilo di sicurezza di QIVc è stato giudicato buono e conforme al RCP [77].
L’incidenza della sindrome di Guillain-Barré riportata nel sistema statunitense VAERS (Vaccine Adverse Event Reporting System) in seguito alla vaccinazione antinfluenzale (stagione 2018/19) è stata quantificata da Fujimori et al. [78]. Di 36.227 report analizzati, 119 riportavano la sindrome di Guillain-Barré. Di questi, 64 casi (di cui 27 dopo la vaccinazione con QIVc) sono insorti in seguito alla vaccinazione antinfluenzale, mentre i restanti 55 in seguito ad altri vaccini. Gli ORs corretti sono stati pari a 3,44 (IC 95%: 2,40-4,95) e 15,00 (IC 95%: 9,27-24,20) rispettivamente per qualsiasi vaccino antinfluenzale e QIVc. Tuttavia, la durata mediana della sindrome di Guillain-Barré è stata inferiore nei soggetti immunizzati con QIVc rispetto ai soggetti vaccinati con i vaccini su uova hdTIV, TIVe, aTIV e QIVe (5,0 vs 12,5 giorni) [78].
La sicurezza dei vaccini su coltura cellulare (TIVc e QIVc) nella gravidanza è stata confermata dal sistema VAERS [79]. La revisione dei report disponibili non ha evidenziato alcuna differenza tra QIVc e altri vaccini somministrati durante la gravidanza. In particolare, nel periodo 01/07/2013-31/05/2020 sono stati individuati rispettivamente 386 e 5 report riguardanti QIVc e TIVc. Mediamente, la vaccinazione è stata somministrata alla 20° settimana della gravidanza (range: 1a-39a settimana). Le più frequenti segnalazioni relative alla gravidanza erano: parto prematuro (21,7%), distacco intempestivo di placenta (3,3%), (pre-)eclampsia (2,6%), anemia (2,6%) e aborto spontaneo (2,0%). La maggior parte degli eventi non direttamente attribuibili alla gravidanza erano le infezioni (8,2%) come vaginosi batterica, infezioni del tratto genitourinario o quelle da streptococco del gruppo B. La più comune (15,9%) condizione relativa al neonato era il basso peso alla nascita (< 2.500 g) [79].
Infine, QIVc può essere co-somministrato con i vaccini anti-COVID-19 BNT162b2 [58], ChAdOx1 [58] e NVX-CoV2373 [57] senza un significativo aumento di reattogenicità (Tab. XII).
Frequenza (%) degli eventi avversi sollecitati nei soggetti immunizzati con QIVc con o senza il vaccino anti-COVID-19, per combinazione dei vaccini ed evento avverso.
Nel presente capitolo è stata condotta una revisione sistematica e meta-analisi relativa ai diversi aspetti clinici di QIVc. Dall’analisi qualitativa e quantitativa di 33 report [47-79] è emerso quanto segue:
nei bambini, adolescenti e adulti in età lavorativa, la risposta immune umorale in seguito alla vaccinazione con QIVc soddisfa i criteri regolatori [37, 38] per l’immunogenicità dei vaccini antinfluenzali e non è inferiore ai vaccini convenzionali prodotti su uova. Per quel che concerne l’immunità cellulo-mediata, le prime evidenze disponibili suggeriscono che QIVc elicita una robusta e bilanciata risposta CD4+ e CD8+, la quale è particolarmente importante per la memoria immunologica specialmente nel caso dei virus respiratori [82]. D’altronde, nel soggetto anziano l’immunogenicità di QIVc può essere inferiore rispetto ai vaccini “potenziati”. Per questo motivo, nei soggetti di età ≥ 65 anni le formulazioni adiuvate [83] o a più alto contenuto di antigene [84, 85] sono considerate di elezione;
l’evidenza sperimentale e multi-stagione suggerisce che QIVc è efficace nei bambini e negli adolescenti contro l’infezione da diversi ceppi influenzali. I risultati di questo RCT [56] sono in linea con un RCT [21] sull’efficacy di TIVc negli adulti condotto durante la stagione 2007/08. Mancano tuttavia i dati relativi all’efficacia teorica assoluta dei vaccini su coltura cellulare nella popolazione anziana nonché i RCT sul confronto diretto tra QIVc e altri vaccini antinfluenzali;
numerose evidenze real-world suggeriscono il vantaggio di QIVc rispetto a QIVe nella popolazione di età < 65 anni. In particolare, rispetto a QIVe, l’utilizzo di QIVc è associato a una significativa riduzione del 25-29% dei casi di influenza da sottotipo A(H3N2). Rispetto ad altri ceppi del virus influenzali, l’efficacia dei vaccini convenzionali contro il sottotipo A(H3N2) è più bassa [6]. Diversi studi disponibili [9-11, 13] hanno individuato le mutazioni egg-adaptive come la più plausibile spiegazione di tale riduzione. Questo fatto può anche spiegare l’assenza di vantaggio di QIVc nei confronti di altri virus come A(H1N1) e B. Inoltre, nei soggetti di età < 65 anni QIVc è risultato in media più efficace sul campo di QIVe nel prevenire le ospedalizzazioni e/o visite mediche per influenza diagnosticata clinicamente, polmoniti e altri outcomes meno specifici. Tuttavia, essendo per l’appunto esiti meno specifici, le misure di effetto erano tendenzialmente più basse. Nel soggetto anziano invece non è stato dimostrato alcun vantaggio significativo di QIVc. Tale osservazione è in linea con i dati di immunogenicità riassunti sopra;
il profilo di reattogenicità e di sicurezza di QIVc è del tutto simile ai vaccini convenzionali prodotti su uova. Gli studi di sorveglianza e di farmacovigilanza non hanno evidenziato alcun safety signal in seguito all’utilizzo massiccio di QIVc. Inoltre, sono stati pubblicati i primi dati sull’utilizzo di QIVc nelle donne in gravidanza che hanno confermato l’ottimo profilo di sicurezza di QIVc anche in questo gruppo di soggetti [79]. È auspicabile che questi dati vengano recepiti nel RCP di QIVc;
QIVc può essere co-somministrato con diversi vaccini anti-COVID-19 (BNT162b2, ChAdOx1 e NVX-CoV2373) senza una significativa interferenza sia in termini di immunogenicità sia in termini di reattogenicità e sicurezza. Tale aspetto è di particolare importanza vista l’incertezza sulla futura circolazione di SARS-CoV-2, l’ipotesi che quest’ultimo diventi un virus stagionale è sempre più probabile [86]. In tali circostanze, la strategia di co-somministrazione dei due vaccini comporta diversi vantaggi come, ad esempio, maggiore convenienza sia per il paziente sia per l’operatore sanitario, maggiore opportunità di vaccinare e vantaggi logistici [87];
un recente RCT [55] ha dimostrato che QIVc è altamente immunogeno e sicuro nei bambini piccoli di età 6-47 mesi. Negli Stati Uniti, la Food and Drug Administration (FDA) ha recentemente approvato l’estensione dell’indicazione terapeutica di QIVc ai soggetti di età 6 mesi [88].
La sorveglianza dell’influenza in Italia e in Europa è basata su un sistema di sorveglianza integrato che raccoglie dati da più fonti: i casi di sindrome simil-influenzale (Influenza-Like Illness, ILI) settimanali per fascia di età che si presentano all’attenzione dei medici di medicina generale che partecipano alla sorveglianza InfluNet; i casi confermati di influenza, su un sottocampione di casi di ILI, che vengono inviati ai laboratori di riferimento regionale che afferiscono al Centro Nazionale Influenza dell’Istituto Superiore di Sanità (ISS); i casi gravi e decessi da influenza confermata ricoverati in Terapia Intensiva; i decessi per tutte le cause nei soggetti di età ≥ ai 65 anni attraverso una sorveglianza su un campione di comuni italiani che riporta settimanalmente al Dipartimento di Epidemiologia (DEP) Regione Lazio i decessi per tutte le cause registrati; e i casi che si verificano nella popolazione generale e che non si rivolgono al loro medico di medicina generale segnalati attraverso il sistema Influweb [1].
Tutti queste fonti di dati permettono di descrivere l’epidemiologia dell’influenza stagionale durante le stagioni invernali stimando che ogni anno, in media, il 10% circa della popolazione italiana si presenti al suo medico curante con un episodio di ILI, con il maggior numero di casi concentrati nelle fasce di età 0-4 e 5-14 anni e con un elevato numero di decessi in eccesso osservati in soggetti di età ≥ 65 anni di età [2].
Inoltre, ogni anno, il Ministero della Salute pubblica, sulla base delle indicazioni dell’Organizzazione Mondiale della Sanità (OMS) e del Centro Europeo per il Controllo delle Malattie (ECDC) la Circolare con le raccomandazioni per la Prevenzione ed il Controllo dell’Influenza dove indica le categorie di rischio per le quali la vaccinazione è raccomandata ed i vaccini disponibili per la prevenzione della malattia e delle forme gravi di influenza [3].
Per la stagione 2022/23, in Europa ed in Italia, sono stati autorizzati all’immissione in commercio le seguenti tipologie di vaccini antinfluenzali: il vaccino quadrivalente adiuvato con MF59® (MF59-adjuvanted Quadrivalent Influenza Vaccine, aQIV), i vaccini quadrivalenti non adiuvati prodotti su uova (egg-based Quadrivalent Influenza Vaccine, QIVe), il vaccino vivo attenuato (live attenuated quadrivalent influenza vaccine, LAIV), il vaccino ad alto dosaggio, (high-dose Quadrivalent Influenza Vaccine, QIVhd), il vaccino ricombinante (recombinant Quadrivalent Influenza Vaccine, QIVr) ed il vaccino quadrivalente prodotto su colture cellulari (cell-cultured Quadrivalent Influenza Vaccine, QIVc) [4]. Quest’ultimo, introdotto in Italia nella stagione 2019/20, ed indicato per la prevenzione dell’influenza a partire dai 9 anni di età [5], dal 22 ottobre 2020 ha ricevuto dall’EMA un’estensione dell’indicazione a partire dai 2 anni di età [6].
Gli studi per effettuare la valutazione economica delle campagne vaccinali sono una parte fondamentale della valutazione completa di Health Technology Assessment (full HTA) in quanto rappresentano un’informazione cruciale per aiutare i decisori politici a valutare costi e benefici delle diverse strategie vaccinali potenzialmente applicabili nella popolazione generale così come in alcune particolari categorie [7].
Precedenti valutazioni HTA, effettuate in Italia, hanno mostrato un buon profilo economico di QIVc rispetto a TIVe e QIVe [8-11] in tutte le età.
È stata quindi effettuata un’analisi di costo-efficacia per valutare il profilo economico dell’introduzione del vaccino antinfluenzale QIVc in Italia a partire dai 2 anni di età, secondo le nuove indicazioni, rispetto agli altri vaccini disponibili in commercio.
Obiettivo principale dello studio è valutare il profilo economico dell’introduzione del vaccino antinfluenzale QIVc a partire dai 2 anni di età nella popolazione italiana, rispetto ai vaccini quadrivalenti disponibili sul mercato. L’analisi non ha riguardato il confronto con il vaccino QIVr (indicato a partire dai 18 anni di età) non essendo ancora distribuito in Italia.
La principale popolazione target per questa analisi economica è costituita, quindi, da individui di età compresa tra 2 e 64 anni in Italia per i quali la vaccinazione antinfluenzale è raccomandata secondo le indicazioni contenute nella Circolare per la Prevenzione ed il Controllo dell’influenza del Ministero della Salute [3]. In passato, in Italia la vaccinazione antinfluenzale in questa fascia di età era raccomandata solo per coloro considerati a più alto rischio di contrarre una forma più grave di influenza a causa della presenza di patologie sottostanti. Nella stagione influenzale 2020/21, tuttavia, il Ministero della Salute ha espresso una raccomandazione temporanea per estendere la vaccinazione a tutti gli individui di età compresa tra 60 e 64 anni al fine di ridurre il carico di malattia dovuta al ricovero durante una stagione in cui l’influenza e la malattia da coronavirus 2019 (COVID-19) erano in potenziale co-circolazione [3]. Per tale motivo i dati relativi alle ultime due stagioni (2020/21 e 2021/22) sono stati esclusi dall’analisi.
Per questo studio, abbiamo previsto il numero di infezioni influenzali, utilizzando come orizzonte temporale una stagione media, utilizzando un modello di trasmissione compartimentale con una struttura SEIR (Suscettibile-Esposto-Infetto-Rimosso). La struttura del modello e la calibrazione degli input per il modello di trasmissione sono state descritte in dettaglio in precedenza [12]. In breve, nei modelli SEIR, gli individui si spostano dai compartimenti suscettibili a quelli esposti in base alla forza dell’infezione, che è una funzione dei tassi di contatti effettivi tra individui suscettibili e non suscettibili nella popolazione. Il contatto efficace è una funzione della matrice di contatto specifica per età e della trasmissibilità del virus per contatto. Il tempo trascorso nei compartimenti esposti e infetti è una funzione della durata dei periodi di latenza e infettivi associati all’influenza. Ciascuno dei compartimenti è stratificato in 85 gruppi di età e per rischio di complicanze da infezione (basso o a rischio). Ogni stagione influenzale viene trattata in modo indipendente, così come le infezioni da diversi sottotipi di virus influenzali A/H1N1; A/H3N2 e B. Gli input del modello per la trasmissibilità, la suscettibilità e la percentuale di casi infetti con sintomi clinici sono stati derivati attraverso un processo di calibrazione che ha prodotto una stagione influenzale di media intensità.
Data la sua struttura, che consente la trasmissione attraverso i gruppi di età, il modello ha incluso l’intera popolazione in Italia e pertanto ha richiesto che la strategia vaccinale raccomandata fosse modellata per tutti i gruppi di età. Il vaccino quadrivalente coltivato su uova (QIVe) è stato utilizzato per i soggetti di età compresa tra 6 e 23 mesi, per i soggetti di età compresa fra 2 e 17 anni è stato considerato l’uso del QIVe e del vaccino influenzale vivo attenuato quadrivalente (QLAIV), il quadrivalente adiuvato (QIV-MF59) insieme al quadrivalente high dose (QIVhd) per quelli di età ≥ 65 anni. Per condurre la nostra analisi QIVc è stato sostituito con QIVe nel gruppo di età da 2 a 64 anni. Non è stato effettuato il confronto con il vaccino LAIV non essendo disponibili dati di efficacia relativa con il QIVc, è stata quindi assunta una VE sovrapponibile per QIVe e LAIV per condurre l’analisi.
La prospettiva utilizzata per lo studio è stata quella del Sistema Sanitario Nazionale (SSN) e della Società come raccomandato dall’Istituto Nazionale per l’Eccellenza Sanitaria e Assistenziale (NICE) [13]. è stato inoltre, applicato un tasso di sconto del 3% sia per i costi che per i risultati, in linea con la letteratura internazionale (NICE).
I costi e le conseguenze di ciascuna infezione sono stati stimati utilizzando un albero decisionale come descritto nella nostra precedente analisi (Fig. 1) [11]. In breve, tutti i dati utilizzati sono stati stimati utilizzando i dati Italiani, laddove disponibili; se non disponibili sono stati utilizzati dati derivati da pubblicazioni scientifiche internazionali come già precedentemente mostrato [11]. Le risorse per il trattamento ambulatoriale dell’influenza si basavano su precedenti analisi condotte in Italia. L’impatto dell’influenza sulla qualità della vita è stato catturato come un decremento dell’anno di vita aggiustato per la qualità (QALY) derivato da studi precedenti. L’impatto di una morte dovuta all’influenza è stato catturato come QALY scontati persi, calcolati utilizzando la sopravvivenza attesa e i valori di utilità medi specifici per età.
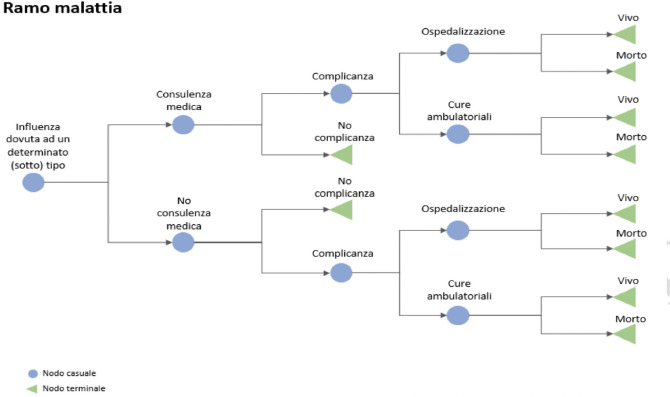
Rappresentazione semplificata del modulo di burden.
Tenendo conto che fino ad oggi non esiste un valore soglia della disponibilità a pagare (Willingness-To-Pay, WTP) della popolazione italiana, abbiamo assunto una soglia di 30,000 €/QALY guadagnato che risulta la più frequentemente utilizzata nella letteratura scientifica italiana ed europea [11]. Tutti gli input del modello sono gli stessi di quelli precedentemente descritti [11], ad eccezione dei dati di popolazione aggiornati agli ultimi dati disponibili, dei prezzi unitari dei vaccini, coperture vaccinali, e efficacia del vaccino, come descritto di seguito.
Per l’analisi del caso base, i costi unitari dei vaccini sono stati basati sui prezzi medi di gara attuali (Tab. I). La presente analisi ha adottato le linee guida per il reporting di valutazioni economiche CHEERS (Consolidated Health Economic Evaluation Reporting Standards statement) [14].
Gli scenari valutati nella presente analisi, per fascia di età
| Classe di età, anni | Scenario attuale (senza QIVc) | Scenario alternativo (con QIVc) |
|---|---|---|
| 0,5–1 | QIVe | QIVe |
| 2–17 | QIVe - LAIV | QIVc |
| 18–64 | QIVe | QIVc |
| ≥65 | QIV-MF59; HD-QIV | QIV-MF59; HD-QIV |
Il punto di partenza per avviare la valutazione della VE è stata la revisione sistematica e meta-analisi di Belongia et al. [15], che ad oggi rappresenta lo studio più aggiornato per quel che riguarda i vaccini non adiuvati prodotti su uova. In particolare, per stabilire la VE di QIVe sono state utilizzate le stime disponibili verso i ceppi A(H1N1)pdm09 e A(H3N2). Per il virus B non sono state utilizzate le stime di VE di Belongia et al. [15] in quanto le loro stime si basavano essenzialmente su TIVe e non distinguevano i due lineage B che hanno circolato nelle ultime stagioni. Le stime relative all’efficacia di QIVe verso il tipo B sono state estrapolate dalla revisione sistematica/meta-analisi di Tricco et al. [16] per quel che riguarda la popolazione adulta e dalla revisione sistematica/meta-regressione di Beyer et al. [17] per quel che concerne la popolazione pediatrica e anziana.
Per quel che riguarda QIVc, è stata valutata la presenza di una VE relativa (relative Vaccine Effectiveness, rVE) vs QIVe solo nei confronti del sottotipo A(H3N2).
Per la rVE di QIVc vs QIVe è stata usata la stima riportata nel capitolo 3 del presente report di HTA, tuttavia essendo la stima sottoposta ad una elevata eterogeneità, si è deciso di effettuare l’analisi anche con un valore più basso di rVE, precisamente del 6% anziché il 14% stimato, in modo da valutare se QIVc sarebbe comunque conveniente rispetto a QIVe anche con una minore rVE, nonostante il suo prezzo più elevato.
La Tabella II riassume i parametri relativi alla VE utilizzati nel modulo epidemiologico.
Parametri utilizzati nel modello relativi ai singoli vaccini considerati, per (sotto)tipo e fascia di età
| Parametro | (Sotto)tipo | Classe di età, anni | |||
|---|---|---|---|---|---|
| 0,5-1 | 2-17 | 18-64 | ≥ 65 | ||
| VE di QIVe % | A(H1N1)pdm09 | 69,0 | 69,0 | 73,0 | NA |
| A(H3N2) | 43,0 | 43,0 | 35,0 | NA | |
| B | 66,5 | 66,5 | 77,0 | NA | |
| VE di QIVc, % | A(H1N1)pdm09 | NA | 69,0 | 73,0 | NA |
| A(H3N2) | NA | 51,0 | 44,1 | NA | |
| B | NA | 66,5 | 77,0 | NA | |
| VE di aQIV % | A(H1N1)pdm09 | NA | NA | NA | 75,0 |
| A(H3N2) | NA | NA | NA | 50,1 | |
| B | NA | NA | NA | 68,58 | |
Il caso base è stato sottoposto sia all’analisi deterministica (univariata), volta a individuare i principali determinanti dell’ICER, sia a quella probabilistica (multivariata), volta alla quantificazione percentuale delle simulazioni ritenute costo-efficaci nel presente modello (i.e. ICER < 30.000€/QALY). Come detto sopra, la sensibilità dei risultati alla rVE è stata analizzata in modo separato. Per l’analisi probabilistica (Probabilistic Sensitivity Analysis, PSA) i parametri relativi alle probabilità seguivano la distribuzione beta, mentre i parametri relativi ai costi e alle utilità/disutilità seguivano le distribuzioni gamma. La PSA è stata eseguita tramite l’algoritmo Monte-Carlo con 10.000 simulazioni.
L’introduzione di QIVc in Italia potrebbe evitare da 78.284 a 329.920 episodi di influenza (sia sintomatica che asintomatica) dovuta al sottotipo A(H3N2) nelle stagioni in cui esso circoli. La Figura 2 riporta il numero medio di casi di influenza A(H3N2) evitati grazie all’introduzione di QIVc in Italia per fascia di età, tenendo conto anche delle stagioni in cui il sottotipo A(H3N2) potrebbe non circolare.
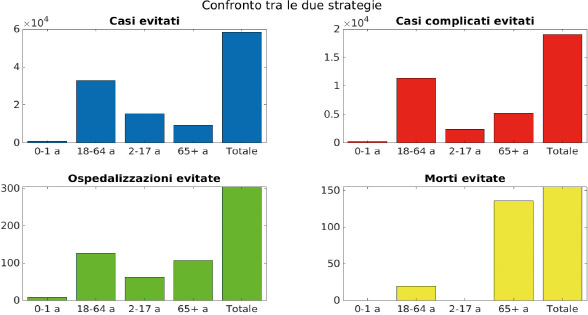
Confronto tra le due strategie adottate.
È interessante notare che il programma vaccinale con QIVc è stato associato a una significativa protezione di gregge anche nelle coorti dove QIVe (< 1 anno) e QIVMF59, QIVhd (≥ 65 anni) sono stati utilizzati. In particolare, nei bambini di età < 1 anno si potrebbero ulteriormente evitare circa 1.502-3.755 casi di influenza, mentre nei soggetti di età ≥ 65 anni tale cifra ammonta a 11.142-51.341circa (Fig. 2).
Dalla prospettiva del SSN la strategia con QIVc risulta altamente costo-efficace (ICER: 1533,25 €/QALY) e dominante nei bambini di età 0,5-1 e 2-17 anni e negli anziani di età ≥ 65 anni, mentre negli adulti è stata altamente costo-efficace (6138,70 €/QALY).
Dalla prospettiva della società, il programma alternativo prevede di guadagnare in totale 2012,99 QALY e risulta dominante in quanto associato ad un’efficacia maggiore e costi minori. L’analisi per i sottogruppi di età ha dimostrato che la strategia è stata dominante in tutte le fasce di età.
Riducendo la rVE di QIVc rispetto alla QIVe al 6%, i risultati non cambiano molto. Dalla prospettiva del SSN la strategia con QIVc risulterebbe sempre altamente costo-efficace (ICER: 4790,25 €/QALY). Dalla prospettiva della società, il programma alternativo prevede di guadagnare in totale 887,99 QALY e risulta dominante in quanto associato ad un’efficacia maggiore e costi minori.
La Figura 3 rappresenta i diagrammi a tornado volte a identificare i maggiori driver dell’ICER. In tutte le simulazioni univariate sono state identificate quattro variabili responsabili della variazione significativa dell’ICER: il prezzo di acquisto di QIVc, il tasso di attacco (numero di infezioni), il prezzo di acquisto di QIVe/QIV-MF59; QIVhd e la probabilità di sviluppare un’infezione sintomatica.
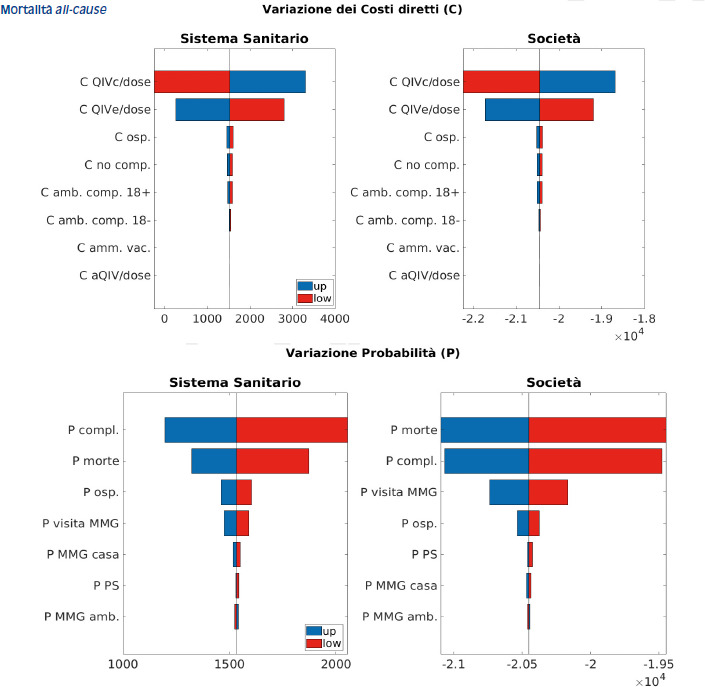
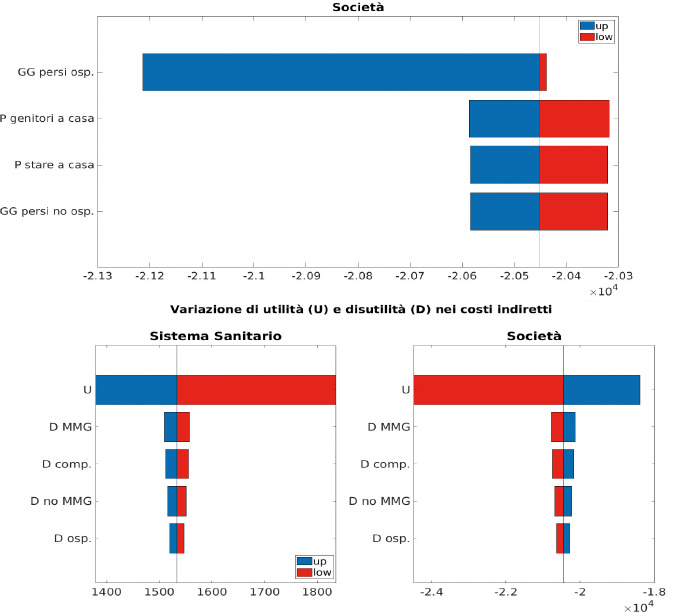
Caso base: l’analisi di sensibilità univariata, per prospettiva dello studio (SSN: a sinistra; Società: a destra).
La Figura 4 riporta i risultati della PSA per prospettiva dello studio (Servizio Sanitario o società). L’analisi considera solo stagioni in cui circoli l’A(H3N2), e quindi i valori non sono direttamente confrontabili con quelli mostrati nella Tabella IV; infatti, poiché nello studio si assume che QIVc non abbia una maggiore efficacia di QIVe rispetto ai ceppi A(H1N1) e B, non si otterrebbe alcun beneficio nelle stagioni in cui non circoli A(H3N2), producendo formalmente un valore infinito dell’ICER/QALY. Restringendosi quindi alle stagioni con A(H3N2), la Figura 4 mostra che il valore massimo dell’ICER/QALY è pari a 5.164 euro nella prospettiva del Sistema Sanitario; nella prospettiva della società, il 100% delle simulazioni risultano in un vantaggio (ICER/QALY sempre negativo).
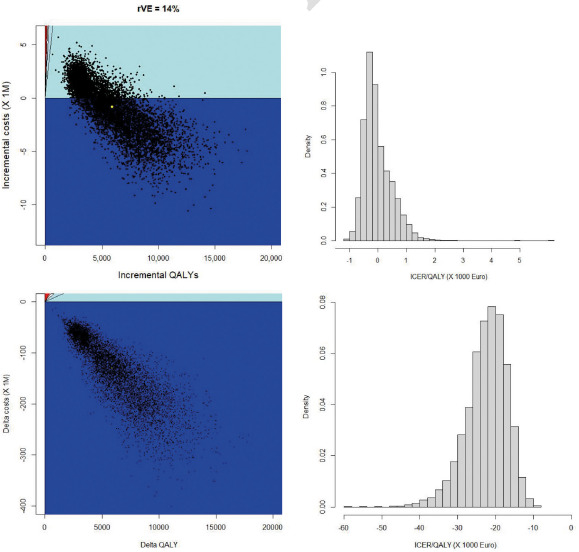
Analisi di sensibilità probabilistica (PSA), per prospettiva dello studio.
Caso base: confronto in termini di costo-efficacia tra lo scenario attuale (senza QIVc) e lo scenario alternativo (con QIVc), per prospettiva dello studio e fascia di età.
| Classe di età, anni | Costo totale, € | Costo incrementale, € | Efficacia, QALY persi | Efficacia. Incrementale, QALY | ICER, €/QALY | ||
|---|---|---|---|---|---|---|---|
| Scenario senza QIVc | Scenario con QIVc | Scenario senza QIVc | Scenario con QIVc | ||||
| Prospettiva del SSN | |||||||
| 0,5–1 | 7,644,296.02 | 7,598,069.81 | -46,226.21 | 1,101.37 | 1,095.77 | 5.61 | Dominante |
| 2–17 | 79,279,232.27 | 79,129,412.56 | -149,819.71 | 14,799.08 | 14,708.35 | 90.73 | Dominante |
| 18–64 | 141,818,853.90 | 145,614,016.71 | 3,795,162.81 | 72,869.73 | 72,251.50 | 618.24 | 6,138.70 |
| ≥ 65 | 213,248,865.48 | 212,736,169.14 | -512,696.34 | 128,461.77 | 127,163.35 | 1,298.42 | Dominante |
| Totale | 441,991,247.67 | 445,077,668.22 | 3,086,420.56 | 217,231.95 | 215,218.97 | 2,012.99 | 1,533.25 |
| Prospettiva della società | |||||||
| 0,5–1 | 27,744,195.02 | 27,590,266.99 | -153,928.03 | 1,101.37 | 1,095.77 | 5.61 | Dominante |
| 2–17 | 290,741,684.82 | 289,349,508.16 | -1,392,176.66 | 14,799.08 | 14,708.35 | 90.73 | Dominante |
| 18–64 | 1,493,627,290.54 | 1,485,864,086.35 | -7,763,204.19 | 72,869.73 | 72,251.50 | 618.24 | Dominante |
| ≥ 65 | 3,314,425,824.85 | 3,282,564,825.67 | -31,860,999.18 | 128,461.77 | 127,163.35 | 1,298.42 | Dominante |
| Totale | 5,126,538,995.23 | 5,085,368,687.16 | -41,170,308.06 | 217,231.95 | 215,218.97 | 2,012.99 | Dominante |
Rispetto al tradizionale vaccino a base di uova, il vaccino antinfluenzale a base di cellule utilizza virus influenzali cresciuti nelle cellule dei mammiferi anziché nelle uova. Ciò è vantaggioso poiché la produzione di vaccini a base cellulare non si basa sulla fornitura di uova consentendo un processo di produzione più rapido e migliorato, particolarmente utile in caso di pandemia influenzale. Inoltre, il vaccino coltivato su cellule potrebbe evitare le mutazioni causate dall’adattamento alle uova offrendo una maggiore efficacia del vaccino e molti studi indicano che i virus prodotti in un processo basato sulle cellule corrispondono più da vicino al virus circolante, soprattutto per il virus A(H3N2) rispetto a quelli prodotti in un processo basato su uova [18, 19].
Pertanto, i nostri risultati mostrano che l’ampliamento delle indicazioni del vaccino QIVc a partire dai 2 anni di età è una strategia altamente conveniente.
Come con qualsiasi analisi decisionale, ci sono diverse limitazioni associate alla nostra analisi che confronta QIVc e QIVe. Abbiamo discusso i limiti associati alla struttura del modello e agli input nelle nostre precedenti analisi [11]. Il limite principale è che, sebbene abbiamo utilizzato i dati di distribuzione di sottotipi virali di 10 diverse stagioni, abbiamo calibrato il modello solo su due tipi generali di stagioni: uno che era principalmente di tipo A e uno che era un mix di tipi A e B, non considerando che più sottotipi virali insieme possono circolare e contribuire al burden della malattia. Il nostro modello potrebbe quindi sottostimare la variabilità associata all’influenza da stagione a stagione. Inoltre, non sappiamo quanto gravi diventeranno le stagioni dell’influenza nelle stagioni future dopo la fine della pandemia di COVID-19. Inoltre, non essendo disponibili dati di rVE con il vaccino LAIV non abbiamo potuto effettuare analisi specifiche, ma abbiamo assunto che la VE del QIVe fosse sovrapponibile a quella del LAIV.
Tuttavia, i nostri risultati sono coerenti con le precedenti analisi economico-sanitarie di QIVc in Europa (Regno Unito, Spagna, Italia, Germania) [20-22] e Stati Uniti [23], dove QIVc ha dimostrato di essere conveniente o costo-efficace.
In tutti i paesi, gli ICER ottenuti per QIVc rispetto a QIVe sono stati molto al di sotto della soglia WTP dal punto di vista del Sistema Sanitario e QIVc è una strategia di vaccinazione dominante dal punto di vista della società. Rispetto al nostro studio, negli studi nel Regno Unito e in Spagna è stato utilizzato un rVE diverso a causa delle raccomandazioni di utilizzo per età del QIVc in questi due paesi. Nell’analisi condotta nella popolazione del Regno Unito, è stato utilizzato un rVE (26,8%) poiché l’uso di QIVc è raccomandato solo nei soggetti di età inferiore a 65 anni nel Regno Unito [24,25]. Nell’analisi condotta in Spagna, si presumeva che rVE fosse del 26,8% a causa di una raccomandazione simile a quella del Regno Unito. L’ICER riportato (QIVc vs. QIVe) era di € 12.852 dal punto di vista del Sistema Sanitario e QIVc era dominante dal punto di vista della società [20]. Lo studio condotto negli Stati Uniti mostra, invece, che l’uso di QIVc invece di QIVe può ridurre le visite ambulatoriali annuali e i ricoveri ospedalieri rispettivamente di tre milioni e 84.185.
Rispetto al nostro studio precedente [11], dove si presumeva che rVE fosse del 36,2% nel caso base e del 19,3% nelle analisi di scenario, in questa analisi abbiamo abbassato la rVE fino al 6% ed ampliato la platea della popolazione ricevente il vaccino QIVc dai 9 ai 2 ani di età, ottenendo comunque un ottimo profilo di costo efficacia per le prospettive considerate e un buon risultato in termini di herd immunity nei confronti del sottotipo virale A(H3N2).
Infatti, la strategia alternativa con l’introduzione in Italia di QIVc (nei soggetti di età compresa fra 2–64 anni) risulta altamente costo-efficace o cost-saving (dominante) a seconda della prospettiva utilizzata per l’analisi (SSN o società) e/o della fascia di età. La strategia vaccinale con QIVc è rimasta altamente costo-efficace persino negli scenari peggiori e considerando una efficacia relativa fra QIVc e QIVe del 6%. Le analisi di sensibilità hanno inoltre confermato la solidità del caso base.
L’introduzione di QIVc in Italia nei soggetti di età 2-64 anni è un “good value for money”. Abbassando l’efficacia relativa di QIVc rispetto a QIVe fino al 6% nei confronti del sottotipo A(H3N2) il modello ha mostrato che l’introduzione di QIVc a partire dai 2 anni di età è risultato altamente costo-efficace o cost-saving (dominante) a seconda della prospettiva utilizzata per l’analisi (SSN o società) e/o della fascia di età. Il presente modello suggerisce che l’introduzione di QIVc in Italia a partire dai 2 anni di età è consigliabile.
Costi relativi alla campagna vaccinale.
| Vaccino | Prezzo d’acquisto, € | Costo di somministrazione, € | ||
|---|---|---|---|---|
| Caso base | Range | Caso base | Range | |
| QIVe | 5,70 | Sensitivity +-20% | 6,16 | – |
| aQIV | 15,00 | 6,16 | – | |
| QIVc | 8,00 | 6,16 | – | |
La vaccinazione rappresenta una delle più importanti scoperte scientifiche nella storia della medicina e ha contribuito in modo fondamentale ad incrementare la speranza di vita delle popolazioni di tutto il mondo. È uno degli interventi più efficaci, costo-efficaci e sicuri, in Sanità Pubblica, per la prevenzione primaria delle malattie infettive. Negli ultimi cinquant’anni, a livello mondiale, i vaccini hanno permesso di eradicare molte malattie, riducendo drasticamente il tasso di mortalità e le complicanze associate a tali patologie. Secondo gli ultimi dati dell’Organizzazione Mondiale della Sanità (OMS), a livello globale, i vaccini ogni anno permettono di salvare oltre 3 milioni di persone [1]. Il valore della vaccinazione ha assunto un ruolo fondamentale e centrale anche negli ultimi anni a causa della pandemia da SARS-CoV-2, determinando non solo una riduzione della mortalità in seguito a complicanze gravi, soprattutto nella popolazione più fragile, ma anche una riduzione della diffusione del virus a livello comunitario [2].
Il fenomeno della protezione comunitaria ottenibile per molti vaccini, a seguito del raggiungimento di un’elevata copertura immunitaria nella popolazione bersaglio, più comunemente nota come “immunità di gregge”, ha rappresentato da sempre il valore aggiunto della vaccinazione a livello sociale. Un’elevata copertura vaccinale è in grado di fornire un’immunità di gruppo, proteggendo in questo modo le comunità dai rischi di diffusione delle malattie. L’immunità di gregge protegge indirettamente gli individui con minore accesso ai programmi di assistenza sanitaria o di vaccinazione nonché coloro che non possono beneficiare direttamente delle vaccinazioni (es. i neonati troppo piccoli per essere vaccinati, i soggetti immunocompromessi, i soggetti immunosenescenti) [3].
Il valore sociale delle vaccinazioni, pertanto, si riflette sia sul singolo individuo sia sulla collettività. Per la maggior parte delle malattie, ottenere elevate coperture vaccinali permette infatti di contenere la circolazione del microrganismo responsabile e, conseguentemente, garantisce una protezione alla comunità, cioè anche ai non vaccinati. L’impatto sulla salute della popolazione risulta, dunque, notevole in termini di contenimento dei danni della malattia o delle sue complicanze (morbosità, mortalità, ricorso a cure mediche, ospedalizzazioni) e di riduzione dei costi sia diretti che indiretti [4].
Obiettivi dei programmi di prevenzione vaccinale, pertanto, sono, da un lato, il conferimento di uno stato di protezione a soggetti che, per ragioni legate alle loro condizioni di salute, o di natura epidemiologica, comportamentale, occupazionale, siano a rischio di contrarre determinate infezioni; dall’altro, l’eradicazione o la riduzione del burden di alcune malattie infettive per le quali non si disponga di terapie efficaci o che possano determinare complicanze gravi [5].
Tra le malattie infettive prevenibili da vaccino maggiormente rilevanti per la Sanità Pubblica ritroviamo l’influenza, alla luce del suo importante burden clinico-epidemiologico e del suo considerevole impatto sia economico che sociale.
La vaccinazione è la forma più efficace di prevenzione dell’influenza. Principali obiettivi della campagna vaccinale stagionale sono, pertanto: la riduzione del rischio individuale di malattia, delle ospedalizzazioni e dei decessi per influenza; la riduzione della probabilità di trasmissione a soggetti ad elevato rischio di complicanze o di ospedalizzazione; la riduzione dei costi sociali correlati alla morbosità e alla mortalità correlate all’infezione [6, 7].
L’OMS e il Piano Nazionale Prevenzione Vaccinale (PNPV) 2017-19 riportano, tra gli obiettivi di copertura per la vaccinazione antinfluenzale, il 75% come obiettivo minimo perseguibile e il 95% come obiettivo ottimale negli ultrasessantacinquenni e nei gruppi a rischio [6, 7].
Nonostante tali raccomandazioni, l’alta incidenza dell’influenza nella popolazione, l’elevato impatto sanitario e socio-economico della malattia e delle sue complicanze e la disponibilità di un ampio spettro di vaccini efficaci, sicuri e costo-efficaci, le coperture vaccinali restano ancora ben al di sotto del valore raccomandato [5, 8]. Risulta, quindi, indispensabile proporre interventi di Sanità Pubblica che possano essere in grado di determinare una svolta migliorativa nella lotta all’influenza ed implementare strategie preventive mirate ed efficaci, volte a migliorare la gestione dei diversi presidi antinfluenzali, assegnando ad ogni fascia di popolazione il vaccino più appropriato.
Il vaccino antinfluenzale è raccomandato per tutti i soggetti a partire dai 6 mesi di età che non hanno controindicazioni al vaccino. Nei bambini di età inferiore ai 6 mesi, il vaccino antinfluenzale non è sufficientemente immunogenico e pertanto non conferisce una protezione sufficiente. Pertanto, l’immunizzazione con i vaccini influenzali attualmente disponibili non è autorizzata per l’uso o raccomandata per i bambini di età inferiore a 6 mesi [7].
Nell’ultima Circolare Ministeriale disponibile e relativa alle raccomandazioni per la stagione 2022-2023 [7] si raccomanda, sulla base delle indicazioni dell’OMS, di riconsiderare la priorità dei gruppi a rischio per la vaccinazione antinfluenzale durante la pandemia COVID-19 al fine di: assicurare un controllo ottimale dell’influenza tra i gruppi ad alto rischio di forme gravi di malattia COVID-19 e di influenza; diminuire gli accessi al pronto soccorso e i ricoveri per influenza; ridurre l’assenteismo tra gli operatori sanitari e di altri servizi essenziali per la risposta a COVID-19; e assicurare la gestione e l’uso ottimale dei vaccini contro l’influenza stagionale potenzialmente limitati in tutto il mondo.
Sempre nella Circolare Ministeriale del 7 luglio 2022 [7] vengono indicati i “Gruppi a rischio con la massima priorità” per la vaccinazione antinfluenzale.
Tra i Gruppi a rischio con la massima priorità rientrano gli operatori sanitari e gli adulti anziani. Gli operatori sanitari, compresi gli operatori sanitari ospedalieri e quelli delle strutture di assistenza a lungo termine (ad esempio, case di cura, strutture residenziali sociosanitarie e socioassistenziali, ecc.), sono considerati uno dei gruppi di massima priorità a cui somministrare il vaccino antinfluenzale, soprattutto durante la pandemia COVID-19, per ridurre al minimo: l’assenteismo dovuto all’influenza, la trasmissione dell’influenza a pazienti vulnerabili e l’impatto sul sistema sanitario in generale. La vaccinazione antinfluenzale, inoltre, sulla base della disponibilità dei vaccini, dovrebbe essere estesa a tutti i lavoratori delle strutture sanitarie, compreso il personale ambulatoriale e il personale di supporto (per esempio, il personale di pulizia e di sicurezza). In caso di scorte di vaccino insufficienti per tale personale, gli operatori sanitari dovrebbero avere la priorità in base al rischio di infezione tra di loro e tra coloro di cui si prendono cura.
Come per la malattia COVID-19, la gravità dell’influenza è fortemente associata all’età avanzata, e gli adulti più anziani sono a maggior rischio di forme gravi di malattia e di decesso rispetto agli adulti più giovani. L’OMS raccomanda di dare la priorità agli adulti anziani ricoverati in strutture assistenziali a lungo termine o assistiti a domicilio. Inoltre, si dovrebbe considerare di estendere questo gruppo a rischio includendo gli adulti oltre i 60 anni di età che sono a più alto rischio di COVID-19 grave.
Altri gruppi a rischio, da sottoporre a vaccinazione antinfluenzale, sono:
le donne in gravidanza: esse appartengono alla popolazione con la massima priorità per l’offerta vaccinale e, se le scorte lo permettono, dovrebbero ricevere il vaccino in via prioritaria. L’importanza della vaccinazione antinfluenzale in questa popolazione target è stata sottolineata anche nel Calendario per la Vita del 2019 (IV edizione, ultima attualmente disponibile) [9]. Questa vaccinazione, infatti, può rappresentare un presidio salva-vita sia per la madre, sia per il neonato, vista la pericolosità della malattia se contratta nelle prime fasi di vita o in gravidanza. Purtroppo, le conoscenze circa la rilevanza di questa tematica anche nel mondo medico e infermieristico del nostro Paese appaiono molto deficitarie. È pertanto indispensabile creare momenti di condivisione delle conoscenze e delle raccomandazioni con le società dei ginecologi, dei neonatologi e delle ostetriche, affinché le donne in gravidanza siano correttamente informate sui rischi dell’influenza in gravidanza e sulla possibilità di prevenirla efficacemente.
Da tempo “Il Board del Calendario per la vita” promuove la cruciale importanza di diffondere la pratica vaccinale tra le donne in gravidanza. Le evidenze scientifiche dimostrano infatti la grande pericolosità dell’influenza contratta durante la gravidanza per la madre, che può esser colpita da complicanze serie, in primis polmonite, ma anche per il feto quando l’infezione sia contratta nelle prime settimane di gravidanza. In effetti, una serie di malformazioni, tra cui quelle a carico di cuore, valvole cardiache, tubo neurale, tratto digestivo, palato, oltre a idrocefalo sono associate in modo statisticamente significativo con l’acquisizione dell’influenza nel primo trimestre di gravidanza [9].
I vaccini influenzali inattivati possono essere impiegati in tutte le fasi della gravidanza. Dati più estesi sulla sicurezza sono disponibili per il secondo e terzo trimestre, rispetto al primo; comunque, i dati derivanti dall’impiego su scala mondiale dei vaccini antinfluenzali non indicano alcun evento avverso fetale e materno significativo attribuibile al vaccino [9].
Pertanto, il Board del Calendario per la Vita raccomanda che la vaccinazione contro l’influenza sia sempre più proposta ed effettuata durante la gravidanza, non soltanto durante il secondo e terzo trimestre ma anche nel primo trimestre, epoca particolarmente critica nel caso si verifichi un’infezione;
persone con patologie di base: le persone con patologie che aumentano il rischio di complicanze da influenza, quali diabete, ipertensione, HIV/AIDS, asma e altre malattie croniche cardiache o polmonari sono probabilmente a più alto rischio di malattia COVID19 grave. Tali popolazioni dovrebbero continuare ad avere priorità per la vaccinazione antinfluenzale, per proteggerli dall’influenza ma anche per minimizzare il rischio di infezione da SARS-CoV-2 e quindi ridurre i ricoveri ospedalieri per influenza, che potrebbero stressare ulteriormente il sistema sanitario [7];
bambini: i bambini, in particolare quelli di età inferiore ai 5 anni, rappresentano un gruppo prioritario per l’offerta della vaccinazione antinfluenzale a causa del loro rischio di forme gravi di influenza, in particolare quelli di età compresa tra i 6 mesi e i due anni [7]. Anche il Board del Calendario per la vita sostiene da anni di considerare la fascia di età pediatrica come ulteriore target prioritario per la vaccinazione antinfluenzale [9].
Nonostante i soggetti sani con età compresa tra i 5 e i 18 anni rappresentino una delle fasce d’età con i più alti tassi d’incidenza di malattia influenzale, il loro rischio di complicanze per influenza risulta uguale a quello della popolazione generale; i bambini che hanno un rischio maggiore di complicanze associate all’influenza sono quelli di età inferiore ai 5 anni e, in particolare, i bambini hanno un notevole impatto di malattia associato all’influenza, con tassi più alti di visite mediche, ospedalizzazioni e decessi rispetto agli adulti non anziani [9-11]. Tra questi, i bambini con età inferiore ai 2 anni sono considerati un target prioritario per la vaccinazione, in quanto hanno un elevato rischio di sviluppare un’influenza severa (con maggiori complicanze e ospedalizzazioni). I bambini con età compresa tra i 2 e i 5 anni hanno un elevato carico di malattia associato all’influenza, ma inferiore a quello dei bambini più piccoli [9-11]. I bambini con età inferiore ai 6 mesi, invece, pur rappresentando una classe a rischio, non sono eleggibili per la vaccinazione, ma possono essere protetti anzitutto e primariamente con l’immunizzazione materna e con la vaccinazione dei contatti stretti [9]. Secondo quanto riportato nella Circolare Ministeriale per la stagione influenzale 2022-2023 [7], allo stato attuale esistono sul territorio nazionale più Regioni che offrono gratuitamente, su richiesta, la vaccinazione a bambini e adolescenti sani a partire dai 6 mesi di età, in collaborazione con i medici di medicina generale (MMG) e pediatri di libera scelta (PLS). Alla luce della situazione pandemica COVID-19, è stata rappresentata l’opportunità di raccomandare la vaccinazione antinfluenzale nella fascia di età 6 mesi - 6 anni, anche al fine di ridurre la circolazione del virus influenzale fra gli adulti e gli anziani.
In Italia, in accordo con gli obiettivi della pianificazione sanitaria nazionale e con il perseguimento degli obiettivi specifici del programma di immunizzazione contro l’influenza, la vaccinazione antinfluenzale viene offerta attivamente e gratuitamente ai soggetti che per le loro condizioni personali corrono un maggior rischio di complicanze nel caso contraggano l’influenza [7]. In Tabella I sono riportate tutte le categorie per le quali la vaccinazione è raccomandata ed offerta attivamente e gratuitamente.
Categorie per le quali la vaccinazione stagionale è raccomandata e offerta attivamente e gratuitamente (da: Ministero della Salute. Prevenzione e controllo dell’influenza: raccomandazioni per la stagione 2022-2023, mod.) [7].
| Persone ad alto rischio di complicanze o ricoveri correlati all’influenza |
|
| Soggetti addetti a servizi pubblici di primario interesse collettivo e categorie di lavoratori |
|
| Personale che, per motivi di lavoro, è a contatto con animali che potrebbero costituire fonte di infezione da virus influenzali non umani |
|
| Altre categorie cui la vaccinazione è fortemente raccomandata |
|
** Anche per la stagione 2022-2023, vista l’attuale circolazione del virus SARS-CoV-2, al fine di ridurre la probabilità che l’eziologia della malattia sia il virus influenzale e quindi di facilitare la diagnosi differenziale nelle fasce d’età di maggiore rischio di malattia grave, la vaccinazione antinfluenzale è fortemente raccomandata e può essere offerta gratuitamente nella fascia d’età 60-64 anni. Per quanto riguarda gli esercenti le professioni sanitarie e socio-sanitarie che operano a contatto con i pazienti, e gli anziani istituzionalizzati in strutture residenziali o di lungo degenza, la vaccinazione è fortemente raccomandata.
Tutti i vaccini antinfluenzali disponibili in Italia sono stati autorizzati dall’Agenzia Europea del Farmaco (EMA) e/o dall’Agenzia italiana del Farmaco (AIFA).
Le Regioni decidono annualmente, tramite delle gare per la fornitura di vaccini, tra i prodotti disponibili in commercio, quelli che saranno utilizzati durante le campagne vaccinali.
Le caratteristiche antigeniche dei ceppi virali influenzali che hanno circolato nell’ultima stagione influenzale forniscono la base per selezionare i ceppi da includere nel vaccino dell’anno successivo e l’OMS emana le raccomandazioni sulla composizione vaccinale generalmente nel mese di febbraio per consentire alle aziende di produrre la quantità di vaccino richiesta.
Il 25 febbraio 2022 l’OMS ha pubblicato le raccomandazioni per la composizione dei vaccini per la stagione influenzale 2022-2023 nell’emisfero settentrionale.
La composizione dei vaccini quadrivalenti raccomandata è la seguente [12]:
vaccini ottenuti in uova embrionate di pollo:
A/Victoria/2570/2019 (H1N1)pdm09-like virus,
A/Darwin/9/2021 (H3N2)-like virus,
B/Austria/1359417/2021-like virus (lineaggio B/Victoria),
B/Phuket/3073/2013-like virus (lineaggio B/Yamagata);
vaccini ottenuti su colture cellulari o vaccini ricombinanti:
A/Wisconsin/588/2019 (H1N1)pdm09-like virus,
A/Darwin/6/2021 (H3N2)-like virus,
B/Austria/1359417/2021-like virus (lineaggio B/Victoria),
B/Phuket/3073/2013-like virus (lineaggio B/Yamagata).
La composizione dei vaccini trivalenti è la seguente:
vaccini ottenuti in uova embrionate di pollo:
A/Victoria/2570/2019 (H1N1)pdm09-like virus,
A/Darwin/9/2021 (H3N2)-like virus,
B/Austria/1359417/2021-like virus (lineaggio B/Victoria);
vaccini ottenuti su colture cellulari o vaccini ricombinanti:
A/Wisconsin/588/2019 (H1N1)pdm09-like virus,
A/Darwin/6/2021 (H3N2)-like virus,
B/Austria/1359417/2021-like virus (lineaggio B/Victoria).
I vaccini attualmente disponibili in Italia sono stati descritti in dettaglio nel capitolo 3 del presente report.
Nell’ultima Circolare Ministeriale ad oggi disponibile e relativa alla stagione influenzale 2022-2023 [7] vengono riportati i vaccini antinfluenzali stagionali in uso in Italia e vengono fornite indicazioni sulla scelta dei vaccini (Tab. II).
Raccomandazioni sulla scelta dei vaccini per età e gruppi di rischio specifici [7].
| Età | Vaccini somministrabili | Dosi e modalità di somministrazione | Opzioni per la scelta del vaccino |
|---|---|---|---|
| 6 mesi - 9 anni | Sub-unità, split quadrivalente (QIV) |
|
Per la fascia d’età 6 mesi-6 anni l’OMS raccomanda l’uso di formulazioni specifiche per l’età pediatrica |
| 2 anni - 9 anni |
|
|
|
| 10-17 anni |
|
|
|
| 18-64 anni |
|
1 dose (0,50 ml) | QIV, VIQr e VIQcc sono i prodotti utilizzabili |
| Dopo i 60 anni anche VIQhd | |||
| ≥ 65 anni |
|
|
QIV, VIQr, VIQcc, VIQa e VIQhd sono i prodotti utilizzabili per gli adulti di età≥ 65 anni |
| VIQa e VIQhd sono specificatamente indicati nella popolazione ultra 65enne |
Il Board del Calendario per la Vita, ha proposto nel 2019 come ideali le seguenti strategie di immunizzazione anti-influenzale: vaccinazione di tutte le categorie a rischio presenti in Circolare Ministeriale, con particolare sottolineatura dell’importanza di incrementare in modo determinante le coperture per soggetti con patologie croniche, donne in gravidanza ed operatori sanitari, oltre alla moltiplicazione degli sforzi per l’incremento nei soggetti coinvolti per fascia di età. A tale proposito, è stato fortemente sostenuto l’allargamento delle raccomandazioni per includere progressivamente prima i soggetti di età > 60 anni, poi la popolazione > 50 anni, ed i bambini di età 6 mesi - 6 anni [9].
Un elemento fondamentale fortemente promosso e sostenuto dalle Società Scientifiche che elaborano il Calendario per la Vita è quello dell’appropriatezza vaccinale. L’attuale offerta vaccinale antinfluenzale offre un ampio ventaglio di possibilità, consentendo una personalizzazione dell’assistenza anche in ambito di prevenzione primaria e rispondendo a criteri di appropriatezza, sia clinica che organizzativa [5]. Si specifica, inoltre, che nella stagione influenzale 2021-2022 sono stati introdotti due nuovi vaccini specifici per la popolazione anziana (≥ 65 anni), ossia il Vaccino quadrivalente adiuvato con MF59 [13, 14] e il Vaccino quadrivalente ad alto dosaggio [15], e il Vaccino vivo attenuato (LAIV) quadrivalente, (spray nasale), autorizzato per l’uso in persone di età compresa tra 2 e 18 anni [10]. Quest’ultimo, già nella Circolare Ministeriale del 2021 [7], veniva indicato come vaccino disponibile per la fascia di età 2-9 anni insieme al Vaccino quadrivalente su colture cellulari (VIQcc).
Oggi in Italia sono disponibili, quindi, diversi tipi di vaccini antinfluenzali ognuno con specifiche indicazioni di utilizzo in funzione dell’età, come riportato nel Riassunto delle Caratteristiche del Prodotto (RCP). È necessario capire se i vaccini disponibili possono essere considerati tutti equivalenti e interscambiabili nella somministrazione o se è necessario un loro utilizzo appropriato in funzione del soggetto da vaccinare. Questo aspetto diventa particolarmente importante se la persona da vaccinare è a maggior rischio di complicanze in caso di influenza, come nel caso degli anziani e dei bambini al di sotto dei 5 anni di età.
Secondo il Ministero della Salute “l’appropriatezza definisce un intervento sanitario (preventivo, diagnostico, terapeutico, riabilitativo) correlato al bisogno del paziente (o della collettività), fornito nei modi e nei tempi adeguati, sulla base di standard riconosciuti, con un bilancio positivo tra benefici, rischi e costi. In altre parole, dunque, l’appropriatezza riguarda l’effettuazione di una procedura corretta sul paziente giusto al momento opportuno e nel setting più adatto” [15].
Anche la scelta del vaccino deve necessariamente rispondere a criteri di appropriatezza, che devono guidare l’utilizzo dei vaccini disponibili in base alle caratteristiche e alle esigenze delle diverse fasce d’età e gruppi specifici della popolazione [5]. A tal fine, relativamente alla vaccinazione antinfluenzale, ogni anno il Ministero della Salute pubblica una Circolare ad hoc che, sulla base delle migliori evidenze scientifiche disponibili, fornisce indicazioni specifiche. La Circolare del Ministero della Salute “Prevenzione e controllo dell’influenza: raccomandazioni per la stagione 2022-2023” riporta, infatti, le indicazioni su dosaggio e modalità di somministrazione e riassume le raccomandazioni per la scelta del vaccino antinfluenzale per età e gruppi di rischio specifici (Tab. II) [7].
In sanità l’attenzione ai miglioramenti in termini di qualità e sicurezza continua ad essere imprescindibile e il processo decisionale basato sulle migliori evidenze in termini di benefici, rischi e costi, continua ad essere importante. Tuttavia, è sempre più auspicabile che i decision makers prendano maggiore coscienza del valore dell’appropriatezza vaccinale affinché le campagne di vaccinazione antinfluenzale diventino sempre più “personalizzate” e adattate alle caratteristiche individuali del soggetto da vaccinare.
Nel nostro Paese, le coperture non hanno ancora raggiunto le soglie del 75% e del 95% indicate dall’OMS e dal PNPV 2017-2019. I dati relativi alla popolazione generale per la stagione 2021/2022 mostrano una diminuzione delle coperture vaccinali che passano dal 23,7% della stagione precedente al 20,5% dell’ultima stagione disponibile (dati aggiornati 5 luglio 2022) (Fig. 1). Negli anziani si osserva, a partire dalla stagione 2015-2016, un costante aumento della copertura, che si attesta al 65,3% nella stagione 2021/2022. Nell’ultima stagione, la copertura negli anziani è diminuita di 7 punti percentuali rispetto alla stagione precedente (58,1%). È importante sottolineare, quindi, che proprio negli anziani (categoria di persone a rischio), il valore di copertura (58,1%) si discosta ancora sia dai livelli di copertura ottimali (95%) sia da quelli minimi (75%) [7].
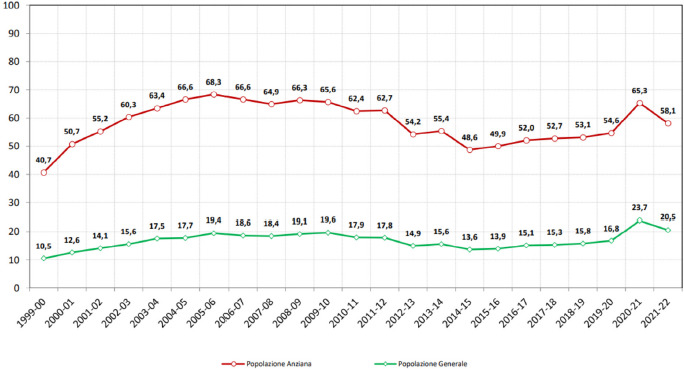
Vaccinazione antinfluenzale nella popolazione italiana. Stagioni: 1999/00-2021/22 [8].
Da sottolineare, inoltre, in generale, le differenze interregionali nei dati di copertura vaccinale, sia per la popolazione generale che per quella anziana, così come riportato nelle Tabelle III e IV rispettivamente.
Vaccinazione antinfluenzale - Confronti coperture nella Popolazione generale al 2021-2022 [8].
| Regione | 1999-00 | 2000-01 | 2001-02 | 2002-03 | 2003-04 | 2004-05 | 2005-06 | 2006-07 | 2007-08 | 2008-09 | 2009-10 | 2010-11 | 2011-12 | 2012-13 | 2013-14 | 2014-15 | 2015-16 | 2016-17 | 2017-18 | 2018-19 | 2019-20 | 2020-21 | 2021-22 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Piemonte | 8,7 | 11,3 | 12,4 | 13,9 | 15,5 | 15,4 | 17,2 | 17,2 | 17,2 | 17,9 | 17,8 | 16,4 | 15,7 | 14,8 | 14,7 | 13,5 | 13,6 | 14,6 | 14,5 | 15,3 | 16,4 | 21,9 | 18,8 |
| Valle d’Aosta | 9,0 | 13,1 | 13,3 | 13,8 | 13,9 | 13,9 | 18,0 | 13,4 | 15,3 | 14,8 | 16,2 | 15,0 | 14,8 | 12,3 | 12,7 | 11,9 | 11,7 | 12,7 | 12,6 | 13,3 | 13,8 | 18,8 | 16,5 |
| Lombardia | 9,1 | 10,4 | 12,2 | 13,5 | 14,7 | 15,7 | 16,2 | 15,3 | 14,7 | 15,5 | 13,2 | 12,6 | 13,4 | 11,4 | 11,7 | 11,4 | 11,6 | 12,1 | 12,1 | 12,9 | 13,7 | 19,4 | 18,5 |
| P.A. Bolzano | 8,7 | 8,2 | 9,6 | 10,9 | 9,5 | 12,4 | 10,7 | 11,2 | 11,7 | 11,5 | 10,5 | 9,6 | 8,1 | 7,9 | 8,3 | 8,8 | 9,0 | 8,6 | 9,6 | 8,2 | 11,7 | 9,7 | |
| P. A. Trento | 9,3 | 10,4 | 10,8 | 12,4 | 13,4 | 15,8 | 15,8 | 15,1 | 16,3 | 16,8 | 15,2 | 14,9 | 13,7 | 13,8 | 12,9 | 12,5 | 13,9 | 14,0 | 15,0 | 16,0 | 26,9 | 15,8 | |
| Veneto | 11,3 | 12,1 | 14,8 | 17,4 | 19,4 | 17,4 | 18,5 | 19,3 | 20,1 | 18,2 | 17,8 | 15,6 | 15,7 | 14,5 | 14,6 | 15,8 | 15,7 | 16,0 | 16,3 | 21,6 | 17,7 | ||
| Friuli Venezia Giulia | 17,4 | 18,2 | 18,8 | 19,3 | 23,6 | 19,7 | 21,0 | 0,0 | 17,9 | 20,7 | 15,6 | 18,7 | 18,4 | 16,3 | 16,9 | 15,0 | 15,6 | 18,1 | 17,6 | 18,9 | 20,3 | 25,8 | 20,4 |
| Liguria | 11,7 | 13,0 | 17,5 | 20,0 | 22,0 | 22,4 | 24,1 | 23,8 | 22,5 | 23,2 | 24,1 | 22,1 | 21,0 | 15,8 | 18,5 | 15,3 | 16,1 | 16,3 | 18,3 | 18,5 | 19,9 | 31,3 | 24,8 |
| Emilia Romagna | 13,8 | 16,8 | 18,0 | 20,2 | 21,8 | 22,3 | 24,8 | 24,6 | 23,4 | 23,9 | 22,6 | 19,2 | 19,2 | 16,4 | 17,0 | 14,9 | 15,5 | 16,2 | 16,5 | 17,5 | 18,9 | 26,1 | 22,9 |
| Toscana | 10,2 | 14,6 | 14,4 | 16,6 | 19,4 | 19,3 | 22,9 | 22,9 | 22,3 | 22,8 | 24,9 | 22,5 | 22,2 | 18,5 | 19,4 | 16,3 | 16,5 | 18,1 | 18,4 | 19,1 | 20,1 | 28,2 | 21,8 |
| Umbria | 13,1 | 14,4 | 15,6 | 17,2 | 18,6 | 18,5 | 21,2 | 20,3 | 20,5 | 21,8 | 22,0 | 21,1 | 20,9 | 18,9 | 19,5 | 17,8 | 17,9 | 18,5 | 18,8 | 19,4 | 19,8 | 26,9 | 23,6 |
| Marche | 15,0 | 16,4 | 17,4 | 18,5 | 19,6 | 19,7 | 20,8 | 20,3 | 19,7 | 20,8 | 21,1 | 18,7 | 18,4 | 15,9 | 16,5 | 13,5 | 14,5 | 15,4 | 15,3 | 16,5 | 18,1 | 26,1 | 21,6 |
| Lazio | 5,3 | 10 1 | 13,9 | 16,4 | 17,9 | 18,3 | 20,7 | 20,6 | 19,4 | 19,9 | 20,7 | 18,9 | 18,1 | 16,1 | 16,5 | 14,0 | 14,3 | 14,9 | 15,0 | 15,5 | 16,2 | 27,5 | 22,0 |
| Abruzzo | 11,4 | 12,6 | 13,8 | 16,3 | 18,7 | 18,5 | 20,0 | 20,7 | 20,4 | 19,7 | 19,4 | 16,5 | 16,5 | 13,2 | 14,7 | 11,1 | 12,3 | 13,7 | 13,9 | 15,2 | 16,4 | 17,9 | 21,2 |
| Molise | 14,4 | 17,2 | 17,9 | 20,2 | 22,7 | 22,4 | 24,0 | 23,8 | 23,3 | 23,4 | 24,2 | 22,6 | 21,2 | 14,6 | 18,1 | 15,7 | 13,5 | 16,4 | 18,8 | 18,9 | 20,0 | 22,4 | 19,2 |
| Campania | 7,5 | 10,8 | 16,6 | 17,0 | 16,9 | 18,9 | 18,8 | 17,4 | 18,8 | 19,5 | 17,5 | 18,5 | 15,2 | 16,4 | 13,9 | 14,0 | 15,3 | 15,4 | 15,9 | 16,7 | 21,9 | 19,4 | |
| Puglia | 8,7 | 13,0 | 14,6 | 16,7 | 17,5 | 21,3 | 21,0 | 21,0 | 22,7 | 24,7 | 22,5 | 21,9 | 17,2 | 17,8 | 14,6 | 14,9 | 18,1 | 18,9 | 17,0 | 17,8 | 25,6 | 24,9 | |
| Basilicata | 14,3 | 14,2 | 15,4 | 18,3 | 17,8 | 19,9 | 19,5 | 20,6 | 19,4 | 21,8 | 19,4 | 19,4 | 17,1 | 16,6 | 13,5 | 14,2 | 15,9 | 16,2 | 18,8 | 17,3 | 19,0 | 22,4 | |
| Calabria | 5,7 | 6,7 | 10,4 | 13,8 | 13,5 | 16,4 | 16,7 | 16,5 | 17,7 | 18,1 | 20,8 | 24,2 | 12,7 | 14,9 | 13,4 | 13,7 | 15,2 | 15,6 | 15,1 | 16,3 | 23,5 | 21,5 | |
| Sicilia | 10,7 | 14,5 | 16,4 | 16,7 | 18,9 | 16,0 | 17,7 | 19,6 | 17,2 | 17,1 | 13,9 | 15,9 | 12,8 | 13,3 | 15,7 | 15,8 | 16,0 | 18,1 | 26,5 | 22,4 | |||
| Sardegna | 7,7 | 8,9 | 10,8 | 12,4 | 11,8 | 23,7 | 15,1 | 13,3 | 11,9 | 14,2 | 18,5 | 17,5 | 16,2 | 13,4 | 13,8 | 12,0 | 11,1 | 12,5 | 13,2 | 14,2 | 15,2 | 23,7 | 15,4 |
| Italia | 10,5 | 12,6 | 14,1 | 15,6 | 17,5 | 17,7 | 19,4 | 18,6 | 18,4 | 19,1 | 19,6 | 17,9 | 17,8 | 14,9 | 15,6 | 13,6 | 13,9 | 15,1 | 15,3 | 15,8 | 16,8 | 23,7 | 20,5 |
Vaccinazione antinfluenzale - Confronti coperture nella Popolazione anziana al 2021-2022 [8].
| Regione | 1999-00 | 2000-01 | 2001-02 | 2002-03 | 2003-04 | 2004-05 | 2005-06 | 2006-07 | 2007-08 | 2008-09 | 2009-10 | 2010-11 | 2011-12 | 2012-13 | 2013-14 | 2014-15 | 2015-16 | 2016-17 | 2017-18 | 2018-19 | 2019-20 | 2020-21 | 2021-22 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Piemonte | 33,8 | 44,7 | 48,3 | 51,5 | 55,7 | 55,9 | 58,8 | 59,3 | 58,9 | 60,7 | 60,6 | 57,3 | 55,0 | 51,6 | 51,1 | 46,3 | 46,9 | 48,2 | 47,9 | 49,0 | 51,0 | 62,4 | 55,4 |
| Valle d’Aosta | 35,8 | 56,6 | 54,5 | 56,0 | 55,3 | 54,4 | 63,1 | 54,2 | 61,0 | 54,5 | 58,9 | 55,6 | 56,2 | 47,0 | 48,2 | 43,5 | 42,2 | 44,4 | 44,1 | 45,2 | 45,4 | 52,6 | 49,3 |
| Lombardia | 39,6 | 46,7 | 53,3 | 58,7 | 60,9 | 65,3 | 64,0 | 63,1 | 58,6 | 61,7 | 63,1 | 54,2 | 57,9 | 48,2 | 48,6 | 46,3 | 47,7 | 47,5 | 47,7 | 48,2 | 49,9 | 60,6 | 56,0 |
| P.A. Bolzano | 43,3 | 38,8 | 46,8 | 51,1 | 52,0 | 55,2 | 48,0 | 50,5 | 50,8 | 47,7 | 44,5 | 42,5 | 35,8 | 33,9 | 36,6 | 37,8 | 37,3 | 35,3 | 38,3 | 32,5 | 41,1 | 36,1 | |
| P. A.Trento | 42,4 | 48,3 | 50,5 | 54,6 | 57,8 | 60,0 | 67,6 | 69,2 | 64,6 | 68,0 | 67,0 | 61,8 | 62,2 | 56,3 | 55,8 | 51,9 | 50,2 | 53,2 | 53,5 | 54,8 | 55,2 | 46,5 | |
| Veneto | 47,3 | 60,7 | 63,5 | 70,9 | 73,2 | 74,1 | 70,3 | 71,6 | 71,2 | 67,8 | 67,1 | 58,9 | 58,5 | 53,4 | 54,0 | 55,8 | 55,1 | 55,6 | 53,9 | 59,6 | 51,8 | ||
| Friuli Venezia Giulia | 63,5 | 70,0 | 71,1 | 72,2 | 72,4 | 72,5 | 72,1 | 64,4 | 68,1 | 49,7 | 62,4 | 61,8 | 55,2 | 56,1 | 49,0 | 51,1 | 54,1 | 55,7 | 57,7 | 60,7 | 66,5 | 60,3 | |
| Liguria | 37,7 | 42,3 | 54,2 | 59,6 | 62,5 | 66,1 | 65,3 | 67,5 | 65,6 | 65,7 | 65,7 | 58,0 | 55,6 | 41,6 | 50,4 | 46,6 | 45,7 | 47,3 | 50,1 | 50,1 | 53,0 | 68,4 | 55,8 |
| Emilia Romagna | 46,2 | 58,4 | 61,9 | 66,5 | 70,3 | 73,0 | 75,1 | 76,1 | 73,6 | 73,7 | 73,8 | 63,4 | 64,7 | 56,3 | 57,2 | 50,0 | 51,9 | 52,7 | 53,3 | 54,7 | 57,4 | 70,1 | 65,1 |
| Toscana | 36,0 | 51,9 | 51,7 | 56,7 | 61,5 | 62,2 | 67,6 | 70,3 | 68,5 | 69,5 | 71,1 | 68,8 | 67,8 | 58,9 | 60,2 | 49,9 | 52,2 | 54,8 | 55,3 | 56,0 | 56,4 | 65,5 | 58,4 |
| Umbria | 45,5 | 51,7 | 58,1 | 59,3 | 62,2 | 61,9 | 65,9 | 69,0 | 70,5 | 74,7 | 77,5 | 75,2 | 74,0 | 67,9 | 68,8 | 61,8 | 62,8 | 63,1 | 63,4 | 64,8 | 64,3 | 77,4 | 68,8 |
| Marche | 53,5 | 60,8 | 62,9 | 65,3 | 67,1 | 68,0 | 68,0 | 67,1 | 65,4 | 66,9 | 66,5 | 63,9 | 62,2 | 54,9 | 57,5 | 46,2 | 50,1 | 51,0 | 50,0 | 51,6 | 56,9 | 65,0 | 62,8 |
| Lazio | 26,7 | 46,5 | 60,5 | 67,5 | 69,5 | 71,5 | 73,3 | 74,1 | 68,0 | 67,9 | 67,7 | 64,1 | 62,2 | 56,8 | 56,8 | 49,5 | 51,0 | 51,5 | 51,8 | 52,3 | 52,7 | 67,7 | 61,2 |
| Abruzzo | 42,5 | 50,2 | 53,7 | 64,0 | 67,9 | 70,0 | 69,9 | 78,1 | 72,8 | 68,4 | 67,1 | 60,9 | 59,7 | 50,3 | 54,6 | 38,5 | 45,7 | 48,6 | 49,1 | 52,4 | 55,3 | 64,1 | 64,2 |
| Molise | 46,7 | 61,4 | 61,4 | 66,9 | 73,7 | 72,3 | 71,4 | 72,6 | 73,3 | 72,3 | 73,7 | 65,6 | 60,5 | 49,4 | 59,5 | 49,0 | 43,8 | 52,4 | 61,0 | 61,7 | 65,4 | 62,3 | 50,7 |
| Campania | 38,1 | 62,3 | 75,6 | 72,3 | 71,9 | 72,9 | 73,2 | 68,2 | 72,2 | 63,4 | 68,8 | 73,1 | 61,4 | 61,3 | 52,9 | 52,8 | 56,7 | 57,4 | 60,3 | 62,1 | 66,1 | 58,1 | |
| Puglia | 38,0 | 49,0 | 62,9 | 64,8 | 68,4 | 70,5 | 75,4 | 71,5 | 68,7 | 73,8 | 73,0 | 71,7 | 69,0 | 57,2 | 61,0 | 48,6 | 50,8 | 57,4 | 59,4 | 51,4 | 51,4 | 61,1 | 58,2 |
| Basilicata | 45,5 | 42,3 | 46,7 | 61,8 | 69,9 | 66,4 | 64,5 | 71,2 | 70,7 | 72,2 | 72,6 | 63,6 | 63,1 | 58,6 | 58,0 | 45,6 | 47,9 | 49,8 | 53,2 | 66,6 | 60,7 | 56,4 | 68,5 |
| Calabria | 23,6 | 29,7 | 43,9 | 55,1 | 59,9 | 66,3 | 68,4 | 65,6 | 69,8 | 63,0 | 55,8 | 65,6 | 49,8 | 56,5 | 53,3 | 51,7 | 57,9 | 61,2 | 59,8 | 61,8 | 79,0 | 62,9 | |
| Sicilia | 41,4 | 47,8 | 47,4 | 61,2 | 63,8 | 69,7 | 67,5 | 56,4 | 61,0 | 64,1 | 61,3 | 60,2 | 54,0 | 56,5 | 47,4 | 49,5 | 52,9 | 54,3 | 53,0 | 59,4 | 75,3 | 63,7 | |
| Sardegna | 30,0 | 39,4 | 46,9 | 52,4 | 43,9 | 59,2 | 56,1 | 49,3 | 39,8 | 49,6 | 60,9 | 59,6 | 57,0 | 47,3 | 46,0 | 40,6 | 40,0 | 41,6 | 44,0 | 46,5 | 46,2 | 61,0 | 41,2 |
| Italia | 40,7 | 50,7 | 55,2 | 60,3 | 63,4 | 66,6 | 68,3 | 66,6 | 64,9 | 66,3 | 65,6 | 62,4 | 62,7 | 54,2 | 55,4 | 48,6 | 49,9 | 52,0 | 52,7 | 53,1 | 54,6 | 65,3 | 58,1 |
Il quadro descritto mostra come il livello di immunizzazione non risulti ancora sufficiente a garantire la protezione della popolazione, in particolar modo delle fasce più deboli e più suscettibili, determinando un incremento considerevole del burden di malattia.
È, quindi, necessario aumentare le coperture vaccinali contro l’influenza non solo negli ultrasessantacinquenni, ma anche nelle fasce di età più basse. Purtroppo, l’obiettivo di copertura vaccinale per l’antinfluenzale sia negli ultra-sessantacinquenni, sia nelle categorie a rischio – soggetti con patologie croniche, polmonari, cardiache, immunocompromessi, ma anche operatori sanitari – non è stato ancora raggiunto, tuttavia dovremo fare tesoro dell’esperienza del COVID-19 per fare comprendere come anche la vaccinazione antinfluenzale rappresenti un’offerta di salute imprescindibile per l’intera popolazione.
Sarà, pertanto, necessario, in funzione della prossima stagione influenzale, mettere in atto adeguate campagne di informazione/educazione della popolazione e degli operatori sanitari [7]. In particolare, sarà fondamentale avviare un tempestivo avvio di campagne di comunicazione che includano il più ampio spettro di destinatari (tutto il personale sanitario, con particolare attenzione agli operatori impegnati in contesti assistenziali a lungo termine; soggetti anziani; nuovi gruppi individuati nella campagna 2020/2021, tutti i gruppi a più elevato rischio di complicanze conseguenti a contagio influenzale) prevedendo messaggi rivolti alla popolazione generale e altri, più specifici, per gruppi omogenei. Inoltre, sarà necessario che la campagna affronti prioritariamente i pregiudizi sulla vaccinazione, evidenziandone i benefici e i vantaggi che una copertura vaccinale ottimale può ottenere per la popolazione generale, anche in relazione alla circolazione del SARS-CoV-2 e delle sue varianti; sarà necessario il monitoraggio della efficacia della campagna di comunicazione, in termini di target raggiunto e modificazioni di attitudini e comportamenti, diversificando il messaggio in relazione ai destinatari, così come sarà fondamentale una specifica attenzione al superamento delle disuguaglianze di accesso legate a fattori culturali, linguistici, socio-economici e logistici. A tal fine dovranno essere adottate modalità di condivisione e partnership con organizzazioni/associazioni di utenti e stakeholders, coinvolgendo testimonials e opinion makers noti ai diversi gruppi target. Infine, sarà essenziale porre particolare attenzione anche alla scelta degli strumenti di comunicazione utilizzati in funzione del target (social media per adolescenti/giovani; consultori/servizi maternità per donne in puerperio ecc.) [7].
È importante sottolineare come già l’influenza sia tornata a circolare nell’emisfero sud. Dalla metà di aprile 2022 le segnalazioni settimanali di influenza, confermate nell’Emisfero Sud in laboratorio, sono aumentate superando la media delle segnalazioni dei 5 anni precedenti (Fig. 2) [16]. Il sistema di sorveglianza delle malattie trasmissibili australiano (National Notifiable Diseases Surveillance System, NNDSS) raccoglie dati attraverso un network a cui afferiscono ospedali, case di cure, laboratori ed ambulatori di medicina generale. Ogni 15 giorni viene pubblicato un report basato su questi dati che permette di valutare in tempo reale l’andamento delle malattie trasmissibili. Tale sistema è utilizzato anche per il monitoraggio dell’influenza, i cui dati, aggiornati al 5 giugno 2022 dimostrano come il virus abbia ripreso a circolare con caratteristiche simili a quelle precedenti alla pandemia COVID. A partire da marzo i casi di sindrome simil-influenzale (influenza like illness - ILI) sono aumentati. Al 5 giugno 2022, erano stati notificati 87.989 casi di influenza confermata in laboratorio, di cui 47.860 relativi agli ultimi 15 giorni, e 27 decessi correlati all’influenza. Dall’inizio della sorveglianza stagionale in aprile, 733 ospedalizzazioni sono state registrate negli ospedali che afferiscono al network. Il 6,1% è stato ricoverato nel reparto di terapia intensiva. Il virus A è stato isolato nel 90% dei campioni, di cui nel 94,3% non è stato possibile procedere al sottotipizzazione, nello 0,9% erano virus A(H1N1), e nel 4,6% influenza A(H3N2).
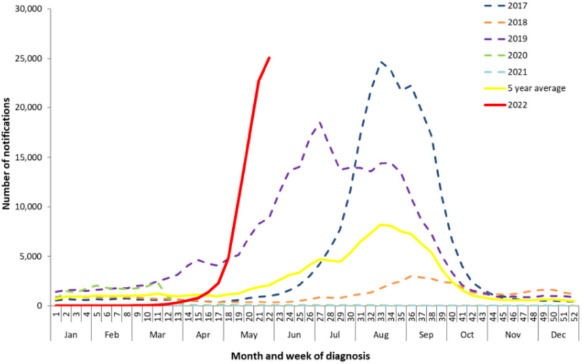
Notifica dei casi di influenza confermati in laboratorio. Australia: 1 gennaio 2017-5 giugno 2022.
Tali dati, seppure limitati ad un arco di tempo limitato e raccolti nell’emisfero sud, dovrebbero essere presi in considerazione in vista della prossima stagione influenzale nell’emisfero nord.
Verosimilmente, la prossima stagione influenzale vedrà, anche nel nostro Paese, un incremento dei casi di influenza, rispetto alle ultime due stagioni sulle quali ha impattato la circolazione del SARS-CoV-2. Anche per questo motivo, sarà indispensabile mettere in atto tutte le azioni necessarie per contenere la circolazione dei virus influenzali e, soprattutto, per aumentare le coperture vaccinali contro l’influenza in tutta la popolazione italiana.
L’influenza stagionale è un’infezione respiratoria acuta, che è causata da virus influenzali e che può colpire - in proporzioni diverse - soggetti di tutte le età, a seconda dei virus dominanti nella stagione e del livello di immunità della popolazione [1].
I virus influenzali colpiscono – ogni anno – il 5-10% della popolazione adulta e il 20-30% di quella in età pediatrica, anche se l’incidenza di sindromi simil-influenzali (ILI) può variare a seconda delle stagioni. Dall’analisi, effettuata nel Capitolo 1 del Report [Epidemiologia dell’influenza stagionale in Italia], dell’andamento delle dieci stagioni influenzali che vanno dal 2010-2011 al 2019-2020, risulta che circa il 10,4% della popolazione italiana è stata colpita da ILI. Allo stesso modo, il valore medio di incidenza settimanale massima di ILI, calcolato nelle medesime stagioni influenzali, è risultato essere di 10,53 casi per 1.000 assistiti. Nelle stesse stagioni influenzali esaminate, è emerso che la popolazione infantile (0-4 anni) è stata colpita da ILI nel 26,8% dei casi e che il valore medio di incidenza settimanale massima era, per la stessa popolazione, pari a 29,87 casi per 1000 assistiti.
Le stagioni influenzali possono sia essere a bassa incidenza (come nelle ultime due stagioni influenzali), sia avere picchi di incidenza superiori ai 14 casi per 1.000 assistiti (2017/2018; 2018/2019) (cfr. capitolo 1). Nella stagione 2020/2021, l’incidenza di ILI è stata al di sotto del valore soglia di 3,16 casi per 1000 assistiti per la stagione, con una incidenza molto bassa anche nelle fasce di età pediatrica. Secondo Greco et al., le possibili spiegazioni di questo fenomeno – verificatosi in piena pandemia – potrebbero essere non solo la copertura vaccinale antinfluenzale raggiunta dalla popolazione, la memoria immunitaria, la competizione virale, ma anche le importanti misure di protezione individuale per la prevenzione del contagio da COVID-19 (mascherine; distanziamento sociale; lavaggio frequente delle mani; chiusura delle scuole, esercizi commerciali e luoghi di aggregazione [2]. L’allentamento delle misure di prevenzione potrebbe essere responsabile dell’aumento dell’incidenza di ILI nella stagione 2021/2022. I dati relativi alle prime dieci settimane del 2022 evidenziano un’incidenza totale di ILI pari a 2,83 casi per mille assistiti. Per l’età pediatrica su 1.000 assistiti l’incidenza è pari a 9,03 (0-4 anni) e 3,93 (5-14 anni). Per l’ultima stagione influenzale 2021-2022 si evidenziano due picchi epidemici con una incidenza settimanale massima di 5,16 casi per 1.000 assistiti alla settimana 52 e di 5,29 casi per 1.000 assistiti alla settimana 13 (cfr. capitolo 1, paragrafo 3.1) [3].
L’infezione influenzale può causare malattie di entità da lieve a grave, fino all’ospedalizzazione e/o alla morte, ad esempio, per insorgenza di polmonite batterica secondaria o esacerbazione di patologie croniche sottostanti in particolare tra i gruppi ad alto rischio, ovvero bambini, donne in gravidanza, anziani, soggetti con patologie croniche preesistenti o immunodepressi. Il tasso di ospedalizzazione è, infatti, più alto negli ultrasessantacinquenni e nei bambini con età inferiore o pari a cinque anni rispetto alla popolazione adulta. A livello mondiale, ogni anno il numero di casi di malattia severa varia dai 3 ai 5 milioni, con 290.000-650.000 morti all’anno per complicanze respiratorie [1]. In Italia, il numero di casi gravi ha grande variabilità da una stagione all’altra. Nelle stagioni che vanno dal 2013-2014 al 2019-2020, i casi gravi variano da un minimo di 93 nella stagione influenzale 2013-2014 ad un valore massimo di 812 nella stagione 2018-2019; ugualmente, la letalità nelle stesse stagioni considerate è variata da un minimo di 17,0% nella stagione 2013-2014 ad un massimo del 36,0% nella stagione 2015-2016. In termini di valori assoluti, la stagione che ha causato un numero assoluto di decessi più elevato rimane la stagione influenzale 2018-2019, con 205 decessi (cfr. capitolo 2).
Sono stati individuati quattro tipi di virus influenzali: A, B, C e D. Negli esseri umani, l’influenza A e l’influenza B sono responsabili della maggior parte dei casi clinici. I ceppi del virus dell’influenza A vengono suddivisi in sottotipi in base agli antigeni di superficie [emoagglutinina (H) e neuraminidasi (N)], che presentano piccole variazioni di anno in anno (drift antigenico) o occasionali grandi cambiamenti (shift antigenico), mentre l’influenza B ha due lineage, Victoria e Yamagata [4]. La distribuzione dei quattro tipi di virus influenzale più frequenti [A (H1N1; H3N2) e B (Victoria e Yamagata)] può variare a seconda della stagione. È stata registrata, in particolare, una predominanza del tipo A in otto delle ultime dodici stagioni influenzali considerate nel capitolo 1 del Report (2010/11; 2011/12; 2013/14; 2014/15; 2016/17; 2018/19; 2021/2022) e del tipo B in tre stagioni influenzali (2012/13; 2015/16 e 2017/18).
Il migliore intervento disponibile per prevenire la morbilità e la mortalità legate all’influenza è la vaccinazione di tutta la popolazione, anche in età pediatrica. Una maggiore copertura vaccinale porterebbe, infatti, alla riduzione non solo dell’incidenza di infezioni e relative complicanze, ma anche dell’impatto economico e produttivo sulla società a seguito di assenteismo scolastico o lavorativo e della pressione sui servizi sanitari con i relativi costi, con il miglioramento complessivo delle condizioni di salute e della qualità vita.
Il primo vaccino antinfluenzale prodotto è stato un vaccino monovalente, che conteneva un ceppo virale appartenente al tipo A; dopo la scoperta del virus B, nel 1945 fu autorizzato negli Stati Uniti il vaccino bivalente. Dal 1970 in poi, i vaccini antinfluenzali sono divenuti trivalenti (Trivalent Inactivated Vaccines - TIV), contenendo un ceppo di virus dell’influenza A(H1N1), un ceppo di virus dell’influenza A(H3N2) e un ceppo di virus dell’influenza B (appartenente a uno dei due lineage). Le iniziali linee di sviluppo furono quella basata sull’utilizzo di virus vivi attenuati e quella basata su vaccini inattivati o uccisi. Successivamente, la manipolazione genetica dei ceppi influenzali permise la crescita relativamente rapida del virus in uova embrionate di pollo [5] (cfr. capitolo 3).
La coltura su uova embrionate di pollo è un habitat che potrebbe selezionare mutazioni capaci di ridurre la correlazione antigenica con i virus circolanti ed essere in parte responsabile di una più bassa efficacia del vaccino e della comparsa di reazioni allergiche legate alle proteine delle uova [6, 7]. A questo si aggiunga la difficoltà di soddisfare il volume di dosi richieste in caso di epidemie e pandemie diffuse a causa della necessità di una grande quantità di uova embrionate di pollo (circa un uovo per ogni dose di vaccino antinfluenzale). Questa situazione, su raccomandazione dell’Organizzazione Mondiale della sanità (OMS), ha portato ad implementare la ricerca sull’uso di sistemi alternativi per la produzione di vaccini, tra cui i vaccini basati su cellule o vaccini ricombinanti a base di proteine [8].
Nei primi anni 2000 la ricerca si è concentrata, quindi, sulle piattaforme di coltura cellulare, trovando idonea la linea cellulare Madin-Darby Canine Kidney (MDCK) alla produzione su coltura cellulare di vaccini antinfluenzali.
Un’altra tecnologia sviluppata per rispondere alle criticità legate all’utilizzo delle uova embrionate di pollo ha previsto il ricorso a proteine ricombinanti dell’emoagglutinina, prodotte in cellule di insetti utilizzando l’espressione del baculovirus, e che ha portato allo sviluppo di vaccini a DNA ricombinante.
A causa dell’immunosenescenza tipica della popolazione anziana ultrassessantacinquenne, sono stati studiati vaccini appositi, che ottimizzassero la risposta immunitaria: vaccini adiuvati, in particolare con MF-59®, e vaccini ad alto dosaggio di antigene [5] (cfr. capitolo 3).
L’onere della malattia causata da ceppi di virus dell’influenza B di entrambi lineage, la difficoltà nel prevedere il lineage circolante e un livello relativamente basso di protezione crociata tra i lineage sono le ragioni per cui – nelle più recenti formulazioni quadrivalenti – sono stati inseriti ceppi appartenenti a tutti e due i lineage del virus B (QIVc) [9, 10]. Come si evince dall’analisi del capitolo 3 del Report, i vaccini oggi disponibili in Italia sono: QIVe in forma di sub-unità o split per la fascia d’età 6 mesi - 9 anni; QIVc e Q/LAIV per la fascia d’età 2-9 anni; QIVe in forma di sub-unità o split, QIVc e Q/LAIV per la fascia d’età 10-17 anni; QIVe in forma di sub-unità o split, QIVc e QIVr per gli adulti con età 18-64 anni; QIVe in forma di sub-unità o split, QIVc, QIV-HD, aQIVe e QIVr per gli anziani ultrassessantacinquenni.
In generale, tutti questi vaccini presentano buoni profili di immunogenicità nelle categorie per le quali sono indicati, oltre a buone efficacia e sicurezza (cfr. capitolo 3).
Flucelvax Tetra®, oggetto di questa valutazione etica in un processo di reassesment_HTA alla luce delle nuove evidenze acquisite, è un vaccino quadrivalente prodotto con l’uso di cellule di mammifero (QIVc). Si tratta della linea cellulare 33016PF Madin-Darby Canine Kidney (MDCK), proveniente da rene di cane.
Obiettivo dei programmi di HTA è valutare se una nuova tecnologia può essere introdotta in un sistema sanitario o rivalutare – come in questo caso – una tecnologia già esistente e per la quale si sono rese disponibili nel tempo ulteriori evidenze. Accanto ai dati di efficacia, sicurezza, impatto economico e organizzativo, il processo di HTA deve tenere in considerazione anche le questioni etiche: che ricadute avrà la tecnologia sulla vita, sulla salute e sulla qualità di vita del paziente? Come rispettare l’esercizio dell’autonomia da parte del paziente? È possibile rendere tale tecnologia disponibile per tutti [11]?
La valutazione etica in HTA è, infatti, uno degli elementi chiave già a partire dagli anni ’70. È quanto emerge anche dal modello di valutazione EUnetHTA che prevede 9 domain (Health problem and current use of technology; Description and technical characteristics of technology; Safety; Clinical effectiveness; Costs and economic evaluation; Ethical analysis; Organisational aspects; Patients and Social aspects; Legal aspects). Per quanto concerne il domain dell’etica, sono stati previsti 6 topic e 19 domande, con riferimento, tra le altre, al bilanciamento rischi/benefici, al rispetto della persona e del suo esercizio dell’autonomia, alla giustizia ed equità [12].
Si tratta di domande proprie della riflessione etica che – nel caso specifico della valutazione di Flucelvax Tetra® – investono anche il tema della prevenzione vaccinale e della tutela delle popolazioni più vulnerabili. In generale, la possibilità di usufruire di un vaccino immunogenico, efficace e sicuro offre, infatti, una serie di vantaggi in termini di: vita, salute e qualità della vita; economici [riduzione dei costi diretti sanitari (assistenza sanitaria, trattamenti farmacologici, eventuale ricovero ospedaliero) e indiretti (perdita di giornate lavorative o di scuola) nel caso di insorgenza della patologia]; sociali (attraverso il meccanismo di herd immunity, si persegue il duplice obiettivo di salvaguardia di chi si sottopone alla vaccinazione e “tutela” della restante popolazione). Perché, allora, una domanda etica sul ricorso ad un vaccino? Non solo per la necessità di immettere sul mercato un prodotto immunogenico, efficace, sicuro, tollerato, frutto di una adeguata sperimentazione clinica sulla popolazione target, ma anche per richiamare l’attenzione sulla importanza della prevenzione vaccinale come esercizio di una duplice responsabilità – verso se stessi e verso gli altri [13] – in un’epoca in cui vi è tendenza al rifiuto o all’esitazione vaccinale [14].
La presente valutazione etica si avvale di una metodologia che prevede tre step:
raccolta e analisi dei dati di efficacia e sicurezza della tecnologia (step 1: raccolta e analisi dei dati);
valutazione – alla luce dei principi di beneficialità/non maleficenza, rispetto dell’autonomia e giustizia – dell’impatto della tecnologia sulla vita, salute, ambiente, qualità della vita ed equità di accesso (step 2: valutazione etica);
l’elaborazione di un parere etico conclusivo alla luce delle evidenze raccolte, evidenziando le eventuali problematicità etiche che dovranno essere prese in considerazione nel momento in cui si dovrà valutare l’opportunità di impiegare la tecnologia in studio (step 3: elaborazione del parere) [15].
Flucelvax Tetra® è stato inizialmente concesso in licenza nel 2012 a Novartis Vaccines & Diagnostics, Inc., come vaccino inattivato trivalente da coltura di cellule (TIVc) provenienti da una linea cellulare di mammifero [33016PF Madin-Darby Canine Kidney (MDCK)]. Il vaccino ha ottenuto un’ampia approvazione regolamentare ed è stato implementato in diversi Paesi, dopo che studi non clinici hanno dissipato ipotetiche preoccupazioni riguardanti l’oncogenicità e l’uso in soggetti allergici ai cani [16]. Il vaccino trivalente è stato, successivamente, trasformato in vaccino quadrivalente [QIVc (Flucelvax Quadrivalent®)] e autorizzato dalla Food and Drug Administration (FDA) nel 2016. Entrambi questi vaccini sono stati, tuttavia, prodotti a partire da capostipiti virali ottenuti su uova embrionate di pollo, il che non escludeva del tutto – nell’antigene del vaccino – la possibilità di mutazioni associate all’adattamento all’ambiente di coltura e la sua conseguente ridotta efficacia [8].
Nell’agosto 2016, FDA ha dato un’approvazione supplementare a Seqirus per l’uso di CVV (Canditate Vaccive Virus) isolati e propagati esclusivamente su cellule MDCK con la produzione di un vaccino inattivato quadrivalente (QIVc) [8]. Questo ha permesso la produzione – dall’isolamento iniziale del virus fino alla produzione completa del vaccino – di un vaccino contro il virus dell’influenza A(H3N2) completamente cellulare. Nell’autunno del 2017, per la prima volta, è stato utilizzato un vaccino stagionale per influenza (Flucelvax Quadrivalent®) contenente il virus dell’influenza A(H3N2) derivato da colture cellulari di mammifero, quale uno dei suoi quattro componenti [8].
Ad ottobre 2018, il vaccino ha ottenuto il parere positivo per l’uso a partire dai 9 anni di età dal Comitato che valuta i farmaci per l’uso umano (CHMP) dell’Agenzia Europea del Farmaco (EMA). In modo subordinato all’approvazione definitiva da parte della Commissione Europea, la casa farmaceutica ha lanciato il vaccino in Europa a partire dalla stagione influenzale 2019/20, commercializzandolo come Flucelvax ® Tetra. Flucelvax Tetra® è un vaccino che protegge da quattro ceppi di virus dell’influenza: A(H3N2), A(H1N1) e i due lineages del virus di tipo B. In Italia è stato introdotto dalla stagione 2019/20, indicato per la prevenzione dell’influenza a partire dai 9 anni di età.
Il 3 marzo 2021, la FDA ha approvato l’estensione dell’utilizzo del vaccino a partire dai due anni di età, dopo EMA nel 2020. Nell’ottobre 2021, la FDA ha approvato l’estensione dell’utilizzo di Flucelvax Tetra® a partire dai sei mesi di vita (cfr. capitolo 4).
I vantaggi ricercati con il ricorso a Flucelvax® Tetra, che è disponibile come sospensione per iniezione intramuscolo (0,5 ml) da inoculare nella parte alta del braccio, sono legati, innanzitutto, alla sua modalità di produzione che consente di:
migliorare la protezione vaccinale contro i 4 ceppi stagionali rispetto ai vaccini ottenuti da uova embrionate di pollo in quanto più simili ai virus dell’influenza in corso, con l’obiettivo di ridurre il numero di casi di influenza e delle sue complicanze;
evitare le possibili reazioni allergiche dovute alle proteine delle uova embrionate di pollo utilizzate per produrre gli altri vaccini;
avere a disposizione grandi quantità di dosi vaccinali, non essendo richieste uova embrionate di pollo per la produzione [16].
Nella fase valutativa, verranno analizzati: il rapporto rischi/benefici del ricorso a Flucelvax® Tetra; i vantaggi in termini di miglioramento della qualità della vita; il rispetto dell’esercizio dell’autonomia da parte del soggetto interessato alla vaccinazione; la possibilità di assicurare l’accesso alla vaccinazione a tutta la popolazione target.
Nell’analisi etica, il primo dato da analizzare è il rapporto rischi/benefici della tecnologia in esame. L’obiettivo principale di un intervento deve, infatti, essere quello di non causare danno, nella prospettiva di ottenere un beneficio. Il termine “rischio” si riferisce alla possibilità che il danno possa verificarsi, mentre il termine “beneficio” si riferisce a qualcosa di valore positivo relativo alla salute o al benessere del singolo o della società. È, quindi, eticamente accettabile tutto ciò che evita un male e che crea le premesse per garantire benessere.
La protezione offerta da un vaccino viene valutata in base all’immunogenicità, l’efficacia teorica (efficacy) e l’efficacia sul campo o “reale” (effectiveness) [17]. L’immunogenicità è la capacità dei vaccini di stimolare la risposta immune, mentre efficacy ed effectiveness fanno riferimento alla riduzione proporzionale dei casi di malattia rispettivamente nelle condizioni ideali (i.e., trial clinico) e quelle della “vita reale”. Inoltre, ciascuno di questi parametri può essere quantificato su scala assoluta (i.e. confronto con la non vaccinazione o con il placebo) o relativa (i.e. confronto con un altro vaccino).
I dati di immunogenicità, efficacy, effectiveness, reattogenicità e sicurezza riportati nel capitolo 4 del Report mostrano un ottimo profilo di efficacia e sicurezza del vaccino in esame. In modo particolare, è stato evidenziato quanto segue:
immunogenicità: la risposta immune umorale ha soddisfatto – nei bambini, adolescenti e adulti in età lavorativa – i criteri regolatori per l’immunogenicità dei vaccini antinfluenzali e si è dimostrata non inferiore ai vaccini convenzionali prodotti su uova. Lo stesso dicasi per l’immunità cellulo-mediata;
efficacy: il vaccino risulta essere efficace nei bambini e negli adolescenti contro l’infezione da diversi ceppi influenzali, così come sugli adulti;
effectiveness: il vaccino si è dimostrato vantaggioso rispetto ai vaccini convenzionali prodotti su uova nella popolazione di età < 65 anni, con una significativa riduzione del 25-29% dei casi di influenza da sottotipo A(H3N2). Nei soggetti di età < 65 anni il vaccino si è, inoltre, risultato in media più efficace sul campo rispetto ai vaccini convenzionali prodotti su uova nel prevenire le ospedalizzazioni e/o visite mediche per influenza diagnosticata clinicamente, polmoniti e altri outcomes meno specifici;
reattogenicità e sicurezza: il profilo di sicurezza del vaccino è del tutto simile ai vaccini convenzionali prodotti su uova su tutte le popolazioni studiate, ivi comprese le donne in gravidanza. Il vaccino può essere anche co-somministrato con diversi vaccini anti-COVID-19 (BNT162b2, ChAdOx1 e NVX-CoV2373) senza una significativa interferenza sia in termini di immunogenicità sia in termini di reattogenicità e sicurezza.
Un profilo positivo di immunogenicità e sicurezza è stato evidenziato anche nella fascia di età 6-47 mesi, tanto che la FDA ha, di recente, approvato l’estensione dell’indicazione terapeutica di Flucelvax Tetra® ai soggetti di età 6 mesi (cfr. capitolo 4).
Premesso che l’analisi delle evidenze scientifiche mette in evidenza che Flucelvax Tetra® presenta un rapporto benefici attesi (immunogenicità, efficacy e effectiveness) e rischi prevedibili (reattogenicità/sicurezza) positivo, è necessario, ora, valutare l’impatto sulla qualità di vita dei soggetti vaccinati in termini di riduzione del carico di malattia e sofferenza, della non autosufficienza, della sospensione/perdita di vita di relazione e di attività lavorativa o scolastica.
La prevedibile riduzione dei casi di influenza sia nella popolazione pediatrica, sia nella popolazione adulta, e delle possibili complicanze, che possono richiedere interventi ambulatoriali od ospedalizzazione, depone senza dubbio per un miglioramento della qualità della vita. È quanto viene confermato da studi specifici che hanno messo in evidenza che, in generale, il passaggio da TIV a QIV determina un incremento degli anni di vita ponderati per la qualità (Quality Adjusted Life Years - QALY), con riduzione del numero delle ospedalizzazioni [18]. Ulteriori valutazioni originano da valutazioni economiche come quella descritta nel capitolo 5 del Report. Come ivi descritto, emerge che nello scenario con adozione del QIVc nella fascia d’età 2-64 anni, rispetto ad un identico scenario con utilizzo, però, di LAIV e QIVe fino ai 17 anni e del solo QIVe dai 18 ai 64 anni, si avrebbe un guadagno totale di QALY pari a 2012,99, supponendo l’effectiveness vaccinale relativa del QIVc rispetto al QIVe pari al 145, grazie alla migliore risposta nei confronti del ceppo A (H3N2); tuttavia, anche riducendo dal 14 al 6% l’effectiveness vaccinale relativa, il guadagno di QALY sarebbe importante, pari a 887,99 QALY. L’utilizzo di un vaccino quadrivalente prodotto su coltura cellulare, quale Flucelvax Tetra®, riuscirebbe ad apportare, pertanto, benefici alla qualità di vita, anche rispetto all’utilizzo di altri vaccini quadrivalenti.
L’impiego preventivo, diagnostico o terapeutico di una tecnologia sanitaria va sempre subordinato all’adesione libera e responsabile da parte del soggetto interessato. Dopo un’informazione completa e comprensibile, va, infatti, rilevato il consenso o l’assenso in caso di minore in grado di esprimere la propria adesione al trattamento. Un consenso legalmente valido e moralmente accettabile deve essere specifico, libero e consapevole. Il soggetto interessato deve conoscere il trattamento, i benefici ricercati, i rischi prevedibili e le eventuali alternative.
Nel caso delle vaccinazioni, la problematica del consenso informato è riconducibile a quella generale degli altri trattamenti sanitari, anche se vanno tenuti presenti alcuni elementi specifici. Innanzitutto, la dimensione di massa che accompagna la somministrazione dei vaccini non deve indurre ad acquisire il consenso o l’assenso in modo approssimativo, né a somministrare i vaccini in modo disattento senza valutare con estrema attenzione tutte le implicazioni, incluse quelle conseguenti a particolari condizioni fisiche, mentali e anche ambientali che possono determinare risposte differenti da quelle prevedibile.
È, pertanto, quanto mai opportuno che la somministrazione di Flucelvax Tetra® sia sempre preceduta da un colloquio personalizzato, che prenda in esame tutte le variabili legate alla condizione clinica del momento. Trattandosi, inoltre, di un intervento di tipo preventivo, i medici dovranno chiarire i benefici relativi all’impiego del vaccino rispetto alla possibilità di contrarre la patologia e sottolineare l’importanza della vaccinazione per se stessi e i minori, di cui si è i rappresentanti legali, per proteggere sé stessi e i soggetti più vulnerabili [14].
La possibilità di disporre di un vaccino con un profilo di efficacia/tollerabilità/sicurezza favorevole e in grado di assicurare una buona qualità di vita a fronte di una patologia come l’influenza e alle sue possibili complicanze, dovrebbe comportare come logica conseguenza la possibilità di fornirlo a tutti coloro che rispondono ai criteri stabiliti negli studi clinici. La limitatezza delle risorse disponibili in sanità potrebbe, però, porre il problema se sia possibile garantire questo trattamento a tutti. Quali sono i criteri, che dovrebbero guidare la scelta?
Assicurare giustizia significa sia rispettare l’uguaglianza tra tutti gli esseri umani (principio di equità), sia rispondere alle necessità specifiche di ciascuno in relazione al proprio stato di salute/malattia (principio della differenza). In tal modo, il paziente diviene l’unità di misura nella prassi clinica, la protezione della salute e della vita il valore fondamentale, la giustizia lo strumento di tutela di questo valore. La valutazione del rapporto rischi/benefici deve, allora, precedere sempre quella del rapporto costi/benefici nella scelta di un trattamento. Nella valutazione dell’impatto economico dell’influenza, vanno presi in considerazione non solo i costi diretti (ospedalizzazione, procedure diagnostiche, trattamenti terapeutici ecc.) e indiretti (perdita di giorni di lavoro per i pazienti e per i caregivers), ma anche i costi intangibili (dolore e sofferenza, generati dalla condizione di malattia), che già di per sé potrebbero giustificare il ricorso tra vaccinazione e non vaccinazione, ma anche tra vaccinazione e malattia prevenuta.
Per quanto riguarda nello specifico la valutazione economica, i dati riportati nel capitolo 5 del Report mettono in evidenza che l’introduzione di QIVc in Italia nei soggetti di età 2-64 anni è un good value for money, una politica di intervento non solo costo-efficace, ma addirittura cost-saving. Si evidenzia, infatti, dal punto di vista del SSN, un ICER (Incremental Cost Effectiveness Ratio) totale elevato, pari a 1533,25 €/QALY, che diventa pari a 6138,70 €/QALY per la fascia d’età 18-64 anni, ed è dominante, cioè cost-saving, per tutte le alte fasce d’età. Ugualmente, dal punto di vista della società, si ottiene un ICER totale dominante, come del resto per ogni fascia d’età considerata.
Dalla valutazione fin qui svolta emerge che il vaccino Flucelvax Tetra® è immunogenico, efficace e sicuro nella protezione contro l’infezione da virus dell’influenza nei soggetti di età 2-64 anni in cui induce una ottima risposta anticorpale contro i 4 ceppi dell’influenza. I vantaggi in termini di guadagno di salute, miglioramento della qualità di vita e riduzione dei livelli di morbilità/mortalità in caso di ILI dovrebbero spingere a estendere la vaccinazione a tutta la popolazione italiana, consentendo l’accesso gratuito su tutto il territorio nazionale.
Sulla base dei dati a disposizione, il giudizio etico è, quindi, positivo. Si suggerisce, comunque, di porre particolare attenzione alla predisposizione di counseling personalizzati prima della somministrazione del vaccino, alla farmacovigilanza e all’organizzazione di campagne di informazione e educazione vaccinale.
Nel corso degli ultimi cinquant’anni, a livello mondiale, i vaccini hanno permesso di contrastare molte malattie, riducendo drasticamente il tasso di mortalità e le complicanze ad esse associate [1]. Secondo gli ultimi dati dell’Organizzazione Mondiale della Sanità (OMS), a livello globale i vaccini ogni anno permettono di salvare la vita di oltre 3 milioni di persone [2]. Oltre a ridurre i tassi di mortalità e morbosità e a limitare la diffusione di agenti patogeni, i vaccini svolgono anche un ruolo importante nella lotta alla resistenza antimicrobica. Le vaccinazioni possono essere una delle soluzioni più efficaci per contrastare la diffusione di batteri resistenti agli antibiotici in quanto aiutano a ridurre l’uso improprio di antibiotici e prevengono lo sviluppo e la trasmissione di batteri resistenti [3]. Tutto ciò ha un impatto importante anche da un punto di vista economico: ogni anno in Europa, ad esempio, vengono spesi 1,5 miliardi di euro a causa della resistenza antimicrobica [4].
Le patologie prevenibili con vaccino, inoltre, hanno impatti molto importanti non solo sul sistema sanitario e socio-assistenziale, ma anche sul sistema produttivo ed economico [5]. Infatti, i benefici derivanti dalle vaccinazioni non sono limitati al miglioramento di situazioni cliniche o epidemiologiche, come la prevenzione di malattie e dei loro esiti, con le conseguenze economiche a questo connesse, ma si estendono anche alla crescita economica dei Paesi e alla riduzione della povertà [6].
La vaccinazione, come quella antinfluenzale ad esempio, contribuisce alla sostenibilità della spesa sanitaria pubblica grazie ai possibili risparmi generati in termini di riduzione di numero di ricoveri, spese per le cure mediche per la malattia e per le eventuali complicanze, assenteismo del personale nonché costi derivanti dalla perdita di produttività [7]. Un lavoro italiano ha valutato l’impatto economico e fiscale dei vaccini contro l’influenza, lo pneumococco e l’Herpes-Zoster in Italia e nell’analisi costi-benefici condotta gli autori hanno riportato che investire nella vaccinazione antinfluenzale comporta benefici che equivalgono a 1,8 volte il valore dell’investimento in termini di impatto fiscale e 11,1 volte in termini di perdita di produttività [8].
Pertanto, il valore economico delle vaccinazioni, in aggiunta a quello scientifico, è un aspetto che dovrebbe favorirne la massima diffusione. Inoltre, ai valori clinico-epidemiologico ed economico delle vaccinazioni dovrebbero essere aggiunti anche il valore personale e il valore sociale della pratica vaccinale.
Il fenomeno della protezione della collettività che si può ottenere con le vaccinazioni, mediante il raggiungimento di un’elevata copertura vaccinale, più comunemente nota come “immunità di gregge”, ha rappresentato da sempre il valore sociale della vaccinazione [9]. Un’elevata copertura vaccinale, infatti, è in grado di fornire un’immunità di gruppo, proteggendo in questo modo le comunità dai rischi di diffusione delle malattie. Proprio per tale motivo non è pensabile che i benefici della vaccinazione non siano disponibili in modo equo per tutta la popolazione. L’immunità di gregge protegge indirettamente gli individui con minore accesso ai programmi di assistenza sanitaria o di vaccinazione nonché coloro che non possono beneficiare direttamente delle vaccinazioni (es. i neonati troppo piccoli per essere vaccinati, i soggetti immunocompromessi). Il valore sociale delle vaccinazioni si riflette, quindi, sia sul singolo individuo sia sulla collettività [9]. Per la maggior parte delle malattie, ottenere elevate coperture vaccinali permette, infatti, di contenere la circolazione del microrganismo responsabile e, conseguentemente, garantisce una protezione alla comunità e, quindi, anche ai non vaccinati. L’impatto sulla salute della popolazione risulta, dunque, notevole in termini di contenimento dei danni della malattia o delle sue complicanze (morbosità, mortalità, ricorso a cure mediche, ospedalizzazioni) e di riduzione dei costi sia diretti che indiretti [10].
La vaccinazione è uno degli interventi di Sanità Pubblica più costo-efficaci e lo strumento principale per la prevenzione primaria delle malattie trasmissibili. Tuttavia, il valore complessivo delle vaccinazioni, ivi compresa quella antinfluenzale, ad oggi non risulta essere del tutto riconosciuto.
Nel 2019 l’Expert Panel on Effective Ways of Investing in Health (EXPH) istituito dalla Commissione Europea (CE) [11] ha proposto l’assistenza sanitaria basata sul valore come un concetto completo fondato su quattro “pilastri del valore”: un’assistenza adeguata per raggiungere gli obiettivi personali dei pazienti (valore personale), il conseguimento dei migliori risultati possibili con le risorse disponibili (valore tecnico), un’equa distribuzione delle risorse tra tutti i gruppi di pazienti (valore allocativo) e il contributo dell’assistenza sanitaria alla partecipazione e alla connessione sociale (valore sociale). Queste quattro dimensioni del “valore” rappresentano i pilastri fondamentali dei sistemi sanitari basati sulla solidarietà: il principio di equità può essere assicurato da un’equa allocazione delle risorse; un’equa distribuzione può essere assicurata dal contributo dell’assistenza sanitaria alla coesione sociale; l’efficienza può essere garantita da un’ottimale allocazione delle risorse; la centralità del paziente e la qualità dell’assistenza possono essere garantite da un’interazione, imperniata sul profilo rischio/beneficio, tra medici e pazienti [11]. Una riallocazione delle risorse da interventi sanitari di basso valore ad interventi di alto valore è percepita dall’EXPH come la principale necessità per la sostenibilità e la resilienza dei sistemi sanitari europei. E questi principi si applicano anche alle vaccinazioni. Per cui risulta evidente l’esigenza di prendere in esame una strategia value-based anche nel campo delle vaccinazioni, con l’obiettivo di mettere concretamente il cittadino/paziente al “centro”. Questa esigenza è strettamente collegata all’evidente impatto sociale delle vaccinazioni e alle difficoltà crescenti di sistemi sanitari che, seppur attraversati da profonde trasformazioni organizzative e stretti nella morsa di una crescita esponenziale dei bisogni di salute, sono chiamati ad assicurare una gestione unitaria e integrata delle patologie prevenibili da vaccino. Questo approccio value-based si sposa perfettamente con l’agenda promossa nel settembre 2019 dalla CE e dall’OMS che hanno pubblicato il documento “Dieci azioni verso la vaccinazione per tutti” [12], definendo un vero e proprio decalogo per garantire la vaccinazione per tutti e contrastare, e laddove possibile eliminare, le malattie prevenibili con vaccino.
Il successo delle vaccinazioni, quindi, dipende non solo dalle scelte del Paese ma anche dall’impegno di tutti gli stakeholders per le rispettive competenze. Per promuovere il benessere dei cittadini e migliorare il proprio stato di salute è necessario utilizzare un approccio olistico e definire una visione strategica intersettoriale e multisettoriale. In questa ottica occorre armonizzare il sistema della prevenzione in ogni Paese al fine di ridurre le disuguaglianze e i costi sanitari e sociali, e garantire uno sviluppo sostenibile così come previsto dall’Agenda 2030 delle Nazioni Unite [13]. L’attuale quadro epidemiologico, caratterizzato dall’invecchiamento della popolazione, dalla elevata prevalenza di malattie croniche non trasmissibili, dall’emergenza e ri-emergenza di malattie infettive, dai numerosi rischi per la salute correlati a fattori ed esposizioni ambientali, richiede una forte focalizzazione della programmazione strategica sulla prevenzione e sulla promozione della salute. È necessario, pertanto, che i professionisti sanitari, l’intera comunità scientifica e le istituzioni si impegnino in collaborazioni con i più importanti soggetti della società civile interessati, e coinvolti ciascuno per le proprie possibilità, competenze e responsabilità, per favorire il corretto utilizzo dei vaccini e nel salvaguardare l’indiscusso valore delle vaccinazioni.
Nel marzo 2022 è stato pubblicato uno studio [14] che aveva l’obiettivo di sistematizzare le evidenze scientifiche disponibili sui valori della vaccinazione e che potessero supportare la definizione di un nuovo approccio di immunizzazione basato sul valore [15]. È stata condotta una revisione sistematica della letteratura, applicando, per la prima volta, i quattro pilastri del valore proposti dall’EXPH (personale, allocativo, tecnico e sociale) [11] all’ambito delle vaccinazioni.
Sulla base della metodologia applicata nel nostro precedente lavoro [14], è stata condotta una nuova revisione sistematica di letteratura applicando i quattro pilastri del valore proposti dall’EXPH alla vaccinazione antinfluenzale, e considerando le seguenti dimensioni per ciascun pilastro:
valore personale: outcomes clinici, outcomes riportati direttamente dai pazienti (Patients Reported Outcome, PRO), misure di esperienza riportate dai pazienti (Patient-Reported Experience Measures, PREMs), coinvolgimento ed empowerment dei cittadini;
valore allocativo: accesso alla vaccinazione, equità nell’offerta, appropriateness, variazioni ingiustificate, innovazione;
valore tecnico: valutazione delle tecnologie sanitarie e modelli per la valutazione economica di vaccini/vaccinazioni;
valore sociale: impatto sul benessere della popolazione e sulla produttività; protezione indiretta e comunitaria; processo decisionale condiviso.
La revisione sistematica è stata condotta secondo le Linee Guida PRISMA [16].
È stata condotta una revisione sistematica di letteratura, consultando due differenti database elettronici (Pubmed e Web of Science), per ciascuno dei quali è stata elaborata una stringa di ricerca, come riportato in Tabella I.
Stringhe di ricerca.
| Database | Stringa di ricerca (23.03.2022) | Filtri |
|---|---|---|
| PubMed | ((“value”[All Fields] OR “values”[All Fields]) AND (“vaccin”[Supplementary Concept] OR “vaccin”[All Fields] OR “vaccination”[MeSH Terms] OR “vaccination”[All Fields] OR “vaccinations”[All Fields] OR “vaccines”[MeSH Terms] OR “vaccines”[All Fields] OR “vaccine”[All Fields]) AND (“influenza, human”[MeSH Terms] OR (“influenza”[All Fields] AND “human”[All Fields]) OR “human influenza”[All Fields] OR “influenza”[All Fields] OR “influenzas”[All Fields] OR “influenzae”[All Fields] OR “flu”[All Fields])) | from 2010/12/24 to 2022/03/23, Humans, English |
| Web of Science | (ALL=(value)) AND ALL=((influenza OR flu) AND vaccination) | 2010-2022, English |
I record trovati sono stati inseriti in un foglio di lavoro Excel dedicato per essere, successivamente, valutati secondo specifici criteri di inclusione/esclusione. Dopo la rimozione dei duplicati, si è proceduto con uno screening per titolo e abstract e, successivamente, con la lettura dei full text degli articoli ritenuti eleggibili. Gli articoli sono stati, inoltre, sottoposti a un processo di snowballing, esaminando i riferimenti bibliografici e le citazioni presenti, al fine di identificare ulteriori articoli rispondenti ai criteri di inclusione.
Sono stati definiti eleggibili tutti gli studi contenenti dati sul concetto di valore associato alla vaccinazione antinfluenzale, condotti a livello internazionale, scritti in lingua inglese e pubblicati dal 24 dicembre 2010 (data successiva alla pubblicazione del primo articolo sul valore in Sanità, scritto ma M. Porter) [17] al 23 marzo 2022, data di lancio delle stringhe di ricerca.
Sono stati, invece, esclusi studi di cui non era possibile reperire il full text o privi di informazioni pertinenti o sufficienti per le finalità della ricerca, commentary, editoriali, presentazioni a conferenze/convegni e studi condotti su animali o in vitro.
Due ricercatori (F.D.A., G.E.C.) hanno esaminato, in modo indipendente, gli articoli esitati dalla ricerca bibliografica. In caso di dubbi riguardanti l’inclusione/esclusione di un lavoro, gli stessi sono stati risolti mediante discussione e confronto tra i due ricercatori.
Da tutti gli articoli inclusi sono stati estratti i seguenti dati: autore, anno di pubblicazione, prospettiva dello studio (distinta in europea, extra-europea, mondiale), obiettivo dello studio, tipo di studio, popolazione target della vaccinazione antinfluenzale. Inoltre, per tutti gli studi inclusi sono state raccolte e sistematizzate informazioni sulle principali dimensioni dei quattro pilastri del valore considerati (personale, allocativo, tecnico e sociale) e su altri aspetti del valore della vaccinazione antinfluenzale eventualmente affrontati negli studi. Infine, per ogni articolo sono state sintetizzate le principali riflessioni/azioni emerse sulla vaccinazione antinfluenzale.
Dalla revisione di letteratura condotta sono stati selezionati un totale di 1.745 articoli rispondenti all’obiettivo della ricerca e focalizzati sul contesto internazionale. Dopo la rimozione dei duplicati, la selezione per titolo ed abstract, e la lettura dei full text, sono stati inclusi nella nostra revisione 38 articoli. La Figura 1 riporta il processo di selezione degli studi, secondo il PRISMA statement [16].
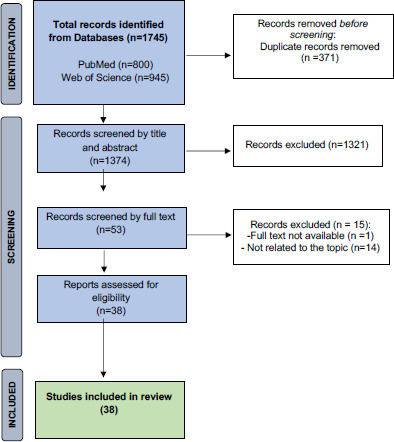
Processo di selezione degli studi secondo il PRISMA statement.
Dei 38 articoli inclusi [8, 18-54], sette (18,4%) hanno una prospettiva extra-europea e sono stati condotti in Canada (n = 1) [18], USA (n = 3) [19, 21, 47], Cina (n = 1) [41], Iran (n = 1) [54] e nei Paesi a basso reddito (n = 1) [35]; dieci (26,4%) hanno una prospettiva globale [20, 22, 24, 26, 33, 34, 37, 42, 45, 53]; venti (52,6%) hanno una prospettiva europea [8, 23, 25, 27-29, 31, 32, 36, 38-40, 43, 44, 46, 48-52] ed uno studio (2,6%), invece, ha una prospettiva sia europea che statunitense [30]. Tra gli studi europei quelli condotti specificatamente in Italia sono stati sei (30%). Dei 38 articoli inclusi, inoltre, sette (18,4%) sono revisioni sistematiche di letteratura [22, 24, 29, 30, 33, 34, 42], nove (23,7%) revisioni di letteratura [26, 31, 32, 35, 37, 38, 46, 52, 53], dieci (26,4%) sono valutazioni economiche [8, 19, 21, 23, 25, 27, 28, 39, 49, 50], sette (18,4%) studi trasversali [18, 40, 41, 43, 47, 48, 54], uno studio (2,6%) è una valutazione HTA [44], un altro (2,6%) è un modello di regressione non lineare [36] e tre studi (7,9%) sono Expert Opinion [20, 45, 51]. Le principali caratteristiche degli studi sono riportati in Tabella II.
Studi inclusi nella revisione sistematica.
| Primo autore, anno di pubblicazione [ref] | Prospettiva europea/extra-europea/globale (Nazione) | Obiettivo dello studio | Tipo di studio | Popolazione target della vaccinazione antinfluenzale |
|---|---|---|---|---|
| Bailey TM, 2011 [18] | Prospettiva extra-europea (Canada) | Indagare le opinioni di studenti, personale ausiliare e personale accademico dell’Università di Alberta, a Edmonton (Canada), sull’allocazione delle risorse durante una pandemia influenzale | Studio trasversale basato su survey online | Popolazione generale |
| Lee BL, 2011 [19] | Prospettiva extra-europea (USA) | Stimare il valore economico di un vaccino antinfluenzale “universale” rispetto al vaccino annuale antinfluenzale standard, avviando la vaccinazione nella popolazione pediatrica | Valutazione economica secondo una prospettiva sociale | Popolazione pediatrica (2-18 anni) |
| Luyten J, 2011 [20] | Prospettiva globale | Rispondere alle seguenti tre
domande di policy:
|
Expert opinion | Popolazione generale |
| Lee BY, 2012 [21] | Prospettiva extra-europea (USA) | Determinare il valore economico di un vaccino antinfluenzale stagionale QIV rispetto al vaccino antinfluenzale trivalente TIV per dieci stagioni influenzali (1999-2009) negli USA | Valutazione economica secondo una prospettiva sociale e del terzo pagante | Popolazione 6 mesi - 85 anni |
| de Waure, 2012 [22] | Prospettiva globale | Valutare il valore economico della vaccinazione antinfluenzale negli anziani e nei gruppi ad alto rischio | Revisione sistematica | Anziani e soggetti ad alto rischio |
| Mamma M, 2013 [23] | Prospettiva europea (Grecia) | Stimare l’impatto economico del programma di vaccinazione antinfluenzale per i funzionari di dogana in Grecia nel periodo 2009/2010 | Modello di simulazione computazionale | Funzionari di dogana |
| Nagata JM, 2013 [24] | Prospettiva globale | Valutare i determinanti di salute sociali che impediscono agli adulti ≥ 65 anni di accedere e accettare la vaccinazione antinfluenzale stagionale | Revisione sistematica | Adulti e anziani ≥ 65 anni |
| Preaud E, 2014 [25] | Prospettiva europea | Creare un modello per valutare i benefici per la salute pubblica e il valore economico della vaccinazione antinfluenzale nei 5 gruppi target per i quali l’OMS raccomanda la vaccinazione, nei 27 paesi dell’Unione Europea | Valutazione economica secondo una prospettiva sociale e del terzo pagante | Gruppi target per la vaccinazione antinfluenzale indicati dall’OMS (bambini 6-23 mesi; persone con patologie croniche; donne in gravidanza; operatori sanitari; anziani over 65) |
| (27 Paesi europei: Austria, Belgio, Bulgaria, Cipro, Repubblica Ceca, Danimarca, Estonia, Francia, Finlandia, Germania, Grecia, Ungheria, Irlanda, Italia, Lettonia, Lituania, Lussemburgo, Malta, Paesi Bassi, Polonia, Portogallo, Romania, Slovacchia, Slovenia, Spagna, Svezia, UK) | ||||
| Rappuoli R, 2014 [26] | Prospettiva globale | Analizzare la storia dei vaccini, compresi i vaccini antinfluenzali, i progressi raggiunti dai vaccini e le potenzialità che i vaccini possono avere nel prevenire e curare le malattie infettive, in tutte le fasce d’età e in tutti i paesi | Revisione di letteratura | Popolazione generale |
| Kristensen M, 2016 [27] | Prospettiva europea (Paesi Bassi) | Stimare il carico di malattia, nei Paesi Bassi, per influenza, pertosse, malattia da pneumococco e herpes zoster, negli adulti di età ≥ 50 anni | Modello di burden di malattia mediante utilizzo dei DALYs | Adulti ≥ 50 anni |
| Uhart M, 2016 [28] | Prospettiva europea (Francia, Germania, Italia, Spagna e UK) | Stimare l’impatto di sanità pubblica ed economico della vaccinazione contro l’influenza stagionale con QIV rispetto ai TIV in Europa | Valutazione economica secondo una prospettiva sociale e del terzo pagante | Popolazione 6 mesi-over 65 anni |
| Barbieri M, 2016 [29] | Prospettiva europea (Belgio, Francia, Germania, Italia, Spagna, Svezia, Paesi Bassi, UK) | Esaminare le analisi di costo-utilità pubblicate sulle strategie di vaccinazione antinfluenzale in otto paesi europei e valutare eventuali differenze in termini di costo-efficacia tra i diversi paesi | Revisione sistematica | Popolazione 6 mesi-over 65 anni |
| Gibson E, 2016 [30] | Prospettiva europea ed extra-europea (Europa e USA) | Confrontare il valore economico dei programmi di immunizzazione pediatrica per l’influenza con quelli per rotavirus (RV), malattia da meningococco (MD), malattia da pneumococco (PD), papillomavirus umano (HPV), epatite B (Hep B) e varicella riportati in recenti studi di costo-efficacia (dal 2000 in poi) | Revisione sistematica | Popolazione pediatrica |
| McElhaney JE, 2016 [31] | Prospettiva europea | Esaminare il ruolo della vaccinazione negli anziani | Revisione di letteratura | Anziani |
| Poscia A, 2016 [32] | Prospettiva europea (Italia) | Sistematizzare gli elementi chiave della sostenibilità della vaccinazione antinfluenzale in Italia e formulare raccomandazioni per migliorare gli aspetti organizzativi dei programmi vaccinali | Revisione di letteratura | Anziani |
| Ting EEK, 2017 [33] | Prospettiva globale | Valutare il rapporto di costo-efficacia dei programmi di immunizzazione contro l’influenza, a supporto dei decisori | Revisione sistematica | Popolazione generale |
| Lorenc T, 2017 [34] | Prospettiva globale | Sintetizzare le evidenze sulle percezioni e sulle esperienze del personale sanitario in merito alla vaccinazione antinfluenzale | Revisione sistematica | Operatori sanitari |
| Ortiz JR, 2017 [35] | Prospettiva extra-europea (Paesi a basso reddito) | Valutare le strategie di immunizzazione contro l’influenza, nelle donne in gravidanza, al fine di implementare la vaccinazione nei paesi in via di sviluppo | Revisione di letteratura | Donne in gravidanza |
| Wagner M, 2017 [36] | Prospettiva europea (Inghilterra) | Valutare l’impatto dei programmi vaccinali promossi dall’Inghilterra durante le stagioni influenzali 2013/2014 e 2014/2015 | Modello di regressione non lineare per valutare i tassi di malattie simil-influenzali (ILI), dai post di Twitter, per la stagione influenzale del 2014/2015 | Popolazione pediatrica |
| Wilder-Smith A, 2017 [37] | Prospettiva globale | Analizzare metodologie, misure e risultati per valutare l’efficacia e l’impatto dei vaccini per la sanità pubblica, e da prendere in considerazione per i processi decisionali evidence-based | Revisione di letteratura | Popolazione generale |
| Esposito S, 2018 [38] | Prospettiva europea | Stimare il carico delle malattie prevenibili da vaccino (influenza, malattie da pneumococco, herpes zoster) nella popolazione anziana europea, e riassumere i potenziali benefici di salute pubblica delle strategie di vaccinazione per questa popolazione target | Revisione di letteratura | Anziani |
| Meijboom MJ, 2018 [39] | Prospettiva europea (Paesi Bassi) | Valutare il valore economico dell’attuazione di un programma di immunizzazione contro l’influenza tra gli operatori sanitari, in un Centro Medico Universitario nei Paesi Passi | Modello economico costo-benefici, secondo una prospettiva sociale | Operazione sanitari |
| Boey L, 2018 [40] | Prospettiva europea (Belgio) | Determinare i fattori demografici, comportamentali e organizzativi associati alla pratica vaccinale degli operatori sanitari sia negli ospedali che nelle case di cura delle Fiandre, in Belgio | Studio trasversale | Operazione sanitari |
| Li KK, 2019 [41] | Prospettiva extra-europea (Cina) | Esaminare se e in che modo la dimensione “sociale”, in termini di benefici sociali (protezione di sé e della famiglia e protezione della comunità) e raccomandazioni istituzionali (da parte delle autorità, della famiglia e di esperti), potrebbe influenzare la vaccinazione antinfluenzale tra gli infermieri | Studio trasversale basato su survey online | Infermieri |
| Hollingsworth R., 2020 [42] | Prospettiva globale | Definire un framework valutativo, che includa elementi specifici (risultati e impostazione dello studio, disegno di studio, fattori confondenti) per garantire che i limiti delle stime di effectiveness del vaccino influenzale, come indicatore di beneficio per la salute pubblica, siano pienamente apprezzati ed efficacemente comunicati | Revisione sistematica | Popolazione generale |
| Domnich A, 2020 [43] | Prospettiva europea (Italia) | Valutare e descrivere le convinzioni, gli atteggiamenti e le pratiche di un campione rappresentativo di adulti italiani in merito alla vaccinazione antinfluenzale | Studio trasversale basato su survey | Adulti (≥ 18 anni) |
| Calabrò GE, 2020 [44] | Prospettiva europea (Italia) | Descrivere come l’HTA sia stato considerato uno strumento basato sull’evidenza per supportare la definizione delle strategie vaccinali in Italia | Health Technology Assessment (HTA) | Popolazione generale |
| Ruscio B, 2020 [45] | Prospettiva globale | Determinare il valore, i ruoli e la struttura di un’alleanza di stakeholders, che sostenga e promuova l’utilizzo di programmi sostenibili di vaccinazione contro l’influenza stagionale, come strumento per creare programmi di vaccinazione pandemica affidabili ed applicabili a livello globale | Expert opinion | Popolazione generale |
| Aidoud A, 2020 [46] | Prospettiva europea | Rivedere i dati della letteratura sui meccanismi cellulari che associano la vaccinazione antinfluenzale alla prevenzione delle complicanze aterosclerotiche | Revisione di letteratura | Anziani |
| Valentino S, 2020 [47] | Prospettiva extra-europea (USA) | Valutare se un intervento evidence-based di formazione sull’influenza e sulla vaccinazione, possa condizionare la propensione degli studenti di infermieristica verso la vaccinazione antinfluenzale, aumentandone le conoscenze | Studio trasversale basato su survey | Studenti di infermieristica |
| Cella P, 2020 [48] | Prospettiva europea (Italia) | Esplorare il comportamento e le convinzioni vaccinali degli studenti delle professioni sanitarie al fine di identificare una possibile associazione tra l’adesione alla vaccinazione negli ultimi 5 anni e la futura accettazione della vaccinazione stessa | Studio trasversale multicentrico | Studenti delle professioni sanitarie |
| Ruggeri M, 2020 [8] | Prospettiva europea (Italia) | Testare un framework analitico sviluppato per la stima degli impatti fiscali dei programmi di vaccinazione contro l’influenza, lo pneumococco e l’herpes zoster, in Italia | Valutazione economica (modello di fiscal impact) | Lavoratori (15-64 anni) |
| Grieco L, 2020 [49] | Prospettiva europea (UK) | Identificare i vari scenari pandemici e politici in base ai quali si prevede di immunizzare la popolazione generale del Regno Unito | Modelli epidemiologici e analisi di economia sanitaria | Popolazione generale |
| Scholz SM, 2021 [50] | Prospettiva europea (Germania) | Esaminare il rapporto di costo-efficacia di una possibile estensione della vaccinazione antinfluenzale in età pediatrica utilizzando i QIV | Valutazione economica (modello di trasmissione dinamica, secondo una prospettiva sociale e di terzo pagante) | Popolazione pediatrica |
| Annemans L, 2021 [51] | Prospettiva europea (Belgio) | Evidenziare quali particolari elementi relativi al valore della vaccinazione vengono trascurati nelle valutazioni economiche | Expert opinion | Popolazione generale |
| Antonelli-Incalzi R, 2021 [52] | Prospettiva europea (Italia) | Fornire una visione generale delle evidenze esistenti sul valore della vaccinazione negli adulti, nel contesto italiano | Revisione di letteratura | Adulti/anziani |
| Macias AE, 2021 [53] | Prospettiva globale | Delineare le principali complicanze dell’influenza e gli impatti sulla società oltre ai classici sintomi respiratori della malattia | Revisione di letteratura | Popolazione generale |
| Aznab M, 2021 [54] | Prospettiva extra-europea (Iran) | Valutare il valore della vaccinazione antinfluenzale nella popolazione oncologica | Studio trasversale | Popolazione oncologica |
TIV: vaccino antinfluenzale trivalente; QIV: vaccino antinfluenzale tetravalente.
Per quanto concerne la popolazione target della vaccinazione antinfluenzale indagata negli studi inclusi nella nostra revisione sistematica, undici studi (29%) si sono concentrati sulla vaccinazione nella popolazione generale [18, 20, 26, 33, 37, 42, 44, 45, 49, 51, 53], quattro (10,5%) sulla vaccinazione nella popolazione pediatrica [19, 30, 36, 50], tre (8%) sulla vaccinazione nella popolazione dai 6 mesi di vita agli over85 [21, 28, 29], sei (15,8%) sulla vaccinazione negli anziani (over 65) [24, 31, 32, 38, 46, 52], due (5,3%) specificatamente sugli adulti over 18 [43] e over 50 [27], uno studio (2,6%) specifico sulla vaccinazione antinfluenzale negli anziani e nei gruppi a rischio [22], uno (2,6%) sulle popolazione target per cui l’OMS raccomanda la vaccinazione [25], uno (2,6%) sugli ufficiali doganali [23], quattro (10,5%) sugli operatori sanitari [34, 39-41], uno (2,6%) sui lavoratori in generale [8], due (5,3%) sugli studenti in ambito sanitario [47, 48], uno (2,6%) sulla vaccinazione nelle donne in gravidanza [35] e un altro studio (2,6%) sulla vaccinazione antinfluenzale nella popolazione oncologica [54].
Per quanto concerne il focus sul valore della vaccinazione antinfluenzale, il 65,8% (n = 25) degli studi inclusi ha indagato aspetti relativi ai quattro pilastri del valore (personale, allocativo, tecnico e sociale), e nello specifico: il 32% (n = 8) ha affrontato il tema del valore personale, con particolare riferimento agli outcomes clinici e al coinvolgimento/ empowerment dei cittadini [20, 25, 31, 35, 37, 40, 51, 54]; il 20% (n = 5) ha affrontato il tema del valore allocativo, in termini di accessibilità ed equità di accesso alla vaccinazione antinfluenzale [18, 20, 35, 37, 51]; il 68% (n = 17) ha indagato il valote tecnico delle vaccinazione antinfluenzale, soprattutto in termini di modelli economici e driver di costo da considerare per le valutazioni economiche dei vaccini antinfluenzali [8, 19, 21-23, 25, 28-30, 32, 33, 37, 39, 49-51, 53]; il 60% (n = 15) degli studi ha affrontato il tema del valore sociale della vaccinazione antinfluenzale legato, soprattutto, al benessere della popolazione e alla protezione indiretta della collettività [20, 25, 31-35, 37, 39-41, 50, 51, 53]. Solo uno studio ha affrontato il tema del valore sociale legato alla dimensione del processo decisionale condiviso [18]. Su 25 articoli, due (8%) hanno affrontato tutti i pilastri del valore applicati alla vaccinazione antinfluenzale [37, 51]. Su un totale di 38 articoli inclusi, il 39,5% (n = 15) ha affrontato anche altri aspetti più generali del valore della vaccinazione antinfluenzale [24, 26, 27, 36, 38, 41-48, 52, 54].
È interessante notare come nella valutazione generale del valore della vaccinazione antinfluenzale siano state affrontate tematiche quali: il valore culturale e i benefici sociali della vaccinazione sia dalla prospettiva della popolazione [24], sia da quella degli operatori sanitari [41]; il valore della vaccinazione antinfluenzale in determinate popolazioni target quali gli anziani [27, 38, 46], gli adulti [52], i gruppi a rischio, come i pazienti con patologie cardiovascolari [52] e oncologiche [54], e anche gli studenti delle professioni sanitarie [48]. Inoltre, negli studi che hanno affrontato più in generale il tema del valore della vaccinazione antinfluenzale è stata posta particolare attenzione anche all’importanza del valore complessivo di questa vaccinazione [26] e della necessità di una metodologia appropriata per valutarne il pieno valore e supportare un processo decisionale basato sull’evidenza [42], anche grazie a strumenti evidence-based come l’Health Technology Assessment (HTA) [44]. È stato, inoltre, sottolineato il valore della sorveglianza delle infezioni da influenza e la necessità di valutare metodi innovativi di sorveglianza anche attraverso i social media [36]. Altro aspetto del valore proposto dalla letteratura scientifica è il valore degli interventi educativi in ambito di vaccinazione antinfluenzale per gli studenti in infermieristica [47] ma anche di literacy per i cittadini [43]. Infine, in un articolo di Ruscio et al. [45] è stato sottolineato come sia necessaria una pianficazione coordinata a livello globale per implementare la vaccinazione antinfluenzale in tutto il mondo, guidata da un’alleanza di stakeholders internazionali, che includa, tra gli altri, rappresentanti di organizzazioni governative e non governative, rappresentanti della società civile, produttori di vaccini, organizzazioni internazionali ed esperti di sicurezza sanitaria e influenza.
La Tabella III riporta i principali risultati, in termini di studi sui valori della vaccinazione antinfluenzale, condotti a livello internazionale, nonché le principali riflessioni/azioni emerse dagli studi inclusi nella nostra revisione sistematica.
Principali informazioni sui valori della vaccinazione antinfluenzale emerse dagli studi inclusi nella revisione sistematica.
| Primo autore, Anno di pubblicazione [ref] | Prospettiva europea/ extra-europea/globale (Nazione) | Valore personale (outcomes clinici, outcomes riportati direttamente dai pazienti, misure di esperienza riportate dai pazienti, coinvolgimento ed empowerment dei cittadini sulla vaccinazione) | Valore allocativo (accesso alla vaccinazione, equità nell’offerta, appropriateness, variazioni ingiustificate, innovazione) | Valore tecnico (valutazione delle tecnologie sanitarie e modelli per la valutazione economica di vaccini/vaccinazioni) | Valore sociale (impatto sul benessere della popolazione e sulla produttività; protezione indiretta e comunitaria; processo decisionale condiviso) | Altri aspetti del valore della vaccinazione | Principali riflessioni/azioni |
|---|---|---|---|---|---|---|---|
| Bailey TM, 2011 [18] | Prospettiva extra-europea (Canada) | X (Equità) | X (Processo decisionale condiviso) | È fondamentale formulare piani di immunizzazione basati su processi equi. Inoltre, è necessario condurre ricerche prima di una pandemia al fine di coinvolgere adeguatamente la popolazione, educarla e sollecitarne una maggiore partecipazione. I piani basati su valori condivisi e processi equi sono quelli con maggiore probabilità di successo durante un’emergenza | |||
| Lee BL, 2011 [19] | Prospettiva extra-europea (USA) | X (Modello economico) | Un vaccino universale potrebbe fornire un valore economico sostanziale superando gli attuali limiti della vaccinazione stagionale. Ciò favorirebbe investimenti nello sviluppo di vaccini universali, aiuterebbe a valutare l’efficacia e la durata degli obiettivi di protezione dei vaccini e supporterebbe i responsabili politici nei processi decisionali | ||||
| Luyten J, 2011 [20] | Prospettiva globale | X (Outcomes clinici) | X (Accesso alla vaccinazione, equità) | X (Benessere della popolazione/protezione indiretta della collettività) | La politica vaccinale è un ambito eticamente impegnativo della politica pubblica. È un ambito che si focalizza sulla collettività e non sul singolo cittadino | ||
| Lee BY, 2012 [21] | Prospettiva extra-europea (USA) | X (Modello economico) | L’aggiunta del ceppo dell’influenza B per convertire il vaccino TIV in QIV potrebbe comportare notevoli risparmi sui costi per la società e per il terzo pagante, anche quando il costo del QIV risulta significativamente più alto | ||||
| de Waure, 2012 [22] | Prospettiva globale | X (Tipo di studio/modello economico) | La vaccinazione antinfluenzale negli anziani e nei gruppi ad alto rischio è un intervento costo-efficace. Tuttavia, è necessaria una standardizzazione della metodologia da utilizzare per la costruzione dei modelli economici, al fine di garantire la comparabilità e la trasferibilità dei risultati | ||||
| Mamma M, 2013 [23] | Prospettiva europea (Grecia) | X (Modello economico) | Fornire un programma di vaccinazione contro l’influenza stagionale e pandemica A/H1N1 può comportare un sostanziale vantaggio per i funzionari di dogana. Tuttavia, l’entità del beneficio dipende fortemente dal tasso di attacco dell’influenza, dai sintomi e dal tasso di adesione alla vaccinazione da parte dei funzionari al programma vaccinale | ||||
| Nagata JM, 2013 [24] | Prospettiva globale | X (Valori sociali e culturali e opinioni sanitarie sulla vaccinazione antinfluenzale) | Prevedere un framework che tenga conto dei determinanti sociali nella programmazione e attuazione delle politiche vaccinali contro l’influenza stagionale, potrebbe favorire l’equità dell’immunizzazione tra le popolazioni più vulnerabili | ||||
| Preaud E., 2014 [25] | Prospettiva europea (27 Paesi europei: Austria, Belgio, Bulgaria, Cipro, Repubblica Ceca, Danimarca, Estonia, Francia, Finlandia, Germania, Grecia, Ungheria, Irlanda, Italia, Lituania, Lettonia, Lussemburgo, Malta, Paesi Bassi, Polonia, Portogallo, Romania, Slovacchia, Slovenia, Spagna, Svezia, UK) | X (Outcomes clinici) | X (Modello economico) | X (Benessere della popolazione) |
|
||
| Rappuoli R, 2014 [26] | Prospettiva globale | X (Importanza del pieno valore della vaccinazione) | È necessario lo sviluppo di nuove tecnologie sanitarie e di modelli economici in grado di cogliere non solo il mero rapporto costo-beneficio della vaccinazione, ma anche il valore della salute di per sé | ||||
| Kristensen M, 2016 [27] | Prospettiva europea (Paesi Bassi) | X (Valore della vaccinazione negli anziani) | Conoscere il burden delle malattie infettive come l’influenza ci permette di considerare il valore aggiunto della vaccinazione anche negli anziani e supporterebbe la definizione delle priorità da includere nei programmi di immunizzazione | ||||
| Uhart M, 2016 [28] | Prospettiva europea (Francia, Germania, Italia, Spagna e UK) | X (Tipo di studio/modello economico) | Si stima che, rispetto al TIV, il vaccino QIV possa comportare una sostanziale diminuzione del carico epidemiologico e dei costi legati all’influenza | ||||
| Barbieri M, 2016 [29] | Prospettiva europea (Belgio, Francia, Germania, Italia, Spagna, Svezia, Paesi Bassi, UK) | X (Tipo di studio/modello economico) | La vaccinazione è risultata essere conveniente in tutti i Paesi considerati (l’unica eccezione è uno studio del Regno Unito) con risultati migliori considerando la prospettiva sociale | ||||
| Gibson E, 2016 [30] | Prospettiva europea ed extra-europea (Europa e USA) | X (Modello economico) |
|
||||
| McElhaney JE, 2016 [31] | Prospettiva europea | X (Outcomes clinici) | X (Benessere della popolazione/protezione indiretta della collettività) |
|
|||
| Poscia A, 2016 [32] | Prospettiva europea (Italia) | X (Driver di costo) | X (Benessere della popolazione/protezione indiretta della collettività) |
|
|||
| Ting EEK, 2017 [33] | Prospettiva globale | X (Tipo di studio/modello economico) | X (Benessere della popolazione/protezione indiretta della collettività) |
|
|||
| Lorenc T, 2017 [34] | Prospettiva globale | X (Protezione indiretta della collettività) |
|
||||
| Ortiz JR, 2017 [35] | Prospettiva extra-europea (Paesi a basso reddito) | X (Outcomes clinici) | X (Accesso alla vaccinazione, equità) | X (Protezione indiretta della collettività) |
|
||
| Wagner M, 2017 [36] | Prospettiva europea (Inghilterra) | X (Evoluzione di metodi innovativi di sorveglianza influenzale anche attraverso i social media) | È possibile sostenere l’attuazione in corso del programma per i bambini in età scolare e fornire la prova del valore della vaccinazione utilizzando i social media come un ulteriore strumento di sorveglianza | ||||
| Wilder-Smith A, 2017 [37] | Prospettiva globale | X (Outcomes clinici) | X (Equità) | X (Modello economico) | X (Benessere della popolazione/protezione indiretta della collettività) |
|
|
| Esposito S, 2018 [38] | Prospettiva europea | X (Valore della vaccinazione antinfluenzale negli anziani) |
|
||||
| Meijboom MJ, 2018 [39] | Prospettiva europea (Paesi Bassi) | X (Modello economico) | X (Protezione indiretta della collettività) | Oltre alla riduzione del carico di morbilità nei pazienti ospedalizzati, gli effetti del programma di immunizzazione in setting ospedaliero superano anche gli investimenti economici. Questi risultati possono supportare le raccomandazioni dei decisori politici in ambito sanitario sul programma di vaccinazione contro l’influenza per gli operatori sanitari | |||
| Boey L, 2018 [40] | Prospettiva europea (Belgio) | X (Coinvolgimento ed empowerment dei cittadini, in particolare operatori sanitari, sulla vaccinazione) | X (Protezione indiretta della collettività) |
|
|||
| Li KK, 2019 [41] | Prospettiva extra-europea (Cina) | X (Protezione indiretta della collettività) | X (Valori culturali, benefici sociali e influenza sociale della vaccinazione antinfluenzale secondo la prospettiva degli infermieri) | La protezione della collettività potrebbe guidare il modo in cui gli infermieri gestiscono le informazioni sulla vaccinazione e sui suoi benefici sociali, influenzando anche i loro comportamenti circa la pratica vaccinale | |||
| Hollingsworth R., 2020 [42] | Prospettiva globale | X (Necessità di una metodologia appropriata per valutare il pieno valore della vaccinazione antinfluenzale e supportare il processo decisionale basato sull’evidenza) |
|
||||
| Domnich A, 2020 [43] | Prospettiva europea (Italia) | X (Valore dei vaccini secondo la prospettiva dei cittadini) |
|
||||
| Calabrò GE, 2020 [44] | Prospettiva europea (Italia) | X (HTA come strumento basato sull’evidenza per valutare il valore dei vaccini per l’influenza) | Il valore dei vaccini può essere valutato nell’ambito di framework strutturati ed evidence-based come l’HTA | ||||
| Ruscio B, 2020 [45] | Prospettiva globale | X (Valore di un piano di lavoro coordinato per la preparedness vaccinale contro l’influenza epidemica e pandemica) |
|
||||
| Aidoud A, 2020 [46] | Prospettiva europea | X (Valore della vaccinazione antinfluenzale negli anziani ad alto rischio di infezione influenzale e di complicanze da malattia coronarica) |
|
||||
| Valentino S, 2020 [47] | Prospettiva extra europea (USA) | X (Valore di interventi educativi per studenti di professioni sanitarie) | Interventi educativi specifici rivolti agli studenti in infermieristica possono portare ad un miglioramento delle conoscenze sull’influenza e ad un aumento della copertura vaccinale in questa popolazione target | ||||
| Cella P, 2020 [48] | Prospettiva europea (Italia) | X (Valore della vaccinazione per gli studenti delle professioni sanitarie) | Gli studenti del settore sanitario rappresentano un gruppo speciale per il ruolo che rivestono, facendo da ponte tra le conoscenze accademiche, le competenze tecniche e la compliance per il counselling dei pazienti. Di conseguenza, dovrebbero essere considerati come un gruppo prioritario da coinvolgere attivamente nelle campagne vaccinali | ||||
| Ruggeri M, 2020 [8] | Prospettiva europea (Italia) | X (Tipo di studio/modello economico/driver di costi, vaccinazione innovativa/driver di costi correlati al vaccino) | Nel valutare il valore economico dei vaccini, i decisori dovrebbero adottare una prospettiva sociale completa che tenga anche conto dell’impatto fiscale dei programmi vaccinali | ||||
| Grieco L, 2020 [49] | Prospettiva europea (UK) | X (Tipo di studio/modello economico) | I programmi basati sull’acquisto reattivo dei vaccini presentano benefici maggiori rispetto a quelli che dipendono dall’acquisto e dal mantenimento di scorte, nei casi in cui l’immunizzazione possa avviarsi senza eccessivi ritardi. Ciò dipende dal fatto che il vaccino acquistato in modo reattivo consente di evitare i costi di stoccaggio e di rifornimento scorte | ||||
| Scholz SM, 2021 [50] | Prospettiva europea (Germania) | X (Modello economico) | X (Protezione indiretta della collettività) |
|
|||
| Annemans L, 2021 [51] | Prospettiva europea (Belgio) | X (Outcomes clinici) | X (Equità) | X (Tipo di studio/modello economico/driver di costi, vaccinazione innovativa/driver di costi correlati al vaccino) | X (Benessere della popolazione/protezione indiretta della collettività) |
|
|
| Antonell-Incalzi R, 2021 [52] | Prospettiva europea (Italia) | X (Valore della immunizzazione degli adulti) |
|
||||
| Macias AE, 2021 [53] | Prospettiva globale | X (Tipo di studio/modello economico) | X (Benessere della popolazione/protezione indiretta della collettività) | Riconoscere le conseguenze legate all’influenza è essenziale per determinare il burden clinico della malattia nelle diverse sottopopolazioni e il valore dei diversi interventi di prevenzione | |||
| Aznab M, 2021 [54] | Prospettiva extra-europea (Iran) | X (Outcomes clinici) | X (Valore della vaccinazione antinfluenzale nella popolazione oncologica) | La vaccinazione antinfluenzale è fortemente raccomandata nei pazienti oncologici, al fine di ridurne la mortalità |
Anche se i benefici reali e tangibili della vaccinazione antinfluenzale sono riconosciuti a livello globale, in molti Paesi, inclusa l’Italia, non si registrano ancora coperture vaccinali adeguate. Inoltre, come si evince dalla nostra revisione di letteratura, il valore complessivo della vaccinazione antinfluenzale, ad oggi, non è ancora del tutto riconosciuto.
La nostra revisione sistematica ha dimostrato, infatti, che i valori personale, tecnico, allocativo e sociale, della vaccinazione antinfluenzale sono stati affrontati, negli ultimi anni, da un numero limitato di articoli scientifici e solo il 5% di quelli inclusi nella revisione hanno affrontato il valore complessivo della vaccinazione antinfluenzale [37, 52].
Il tema del valore della vaccinazione antinfluenzale è stato affrontato dalla comunità scientifica soprattutto a livello europeo, con un contributo da parte dei ricercatori italiani pari al 30%. Questo dato sottolinea l’importanza del tema del valore della vaccinazione antinfluenzale a livello nazionale.
Per quanto concerne la popolazione target della vaccinazione antinfluenzale indagata negli articoli inclusi nella nostra revisione sistematica, la maggior parte degli studi (29%) si è concentrata sulla vaccinazione nella popolazione generale e il 15,8% sulla vaccinazione negli anziani, sottolineando il valore della vaccinazione antinfluenzale in questa fascia di età.
Se consideriamo il focus della nostra revisione e, quindi, l’approfondimento sul valore della vaccinazione antinfluenzale, dai risultati del nostro studio emerge che il 65,8% degli studi inclusi ha indagato aspetti relativi ai quattro pilastri del valore (personale, allocativo, tecnico e sociale), mentre il 39,5% ha affrontato il tema del valore della vaccinazione antinfluenzale in modo più generale.
Il pilastro del valore maggiormente indagato (68%) è quello tecnico e questo risultato è in linea con quanto documentato anche nel nostro precedente lavoro sul valore delle vaccinazioni [14]. Gli studi che hanno indagato questo pilastro del valore sono soprattutto modelli economici sui vaccini antinfluenzali, sviluppati sia secondo la prospettiva del sistema sanitario sia dalla prospettiva sociale. Diversi studi sottolineano l’importanza di includere nelle valutazioni economiche sui vaccini antinfluenzali anche la prospettiva sociale [32, 33, 37, 49, 52, 54], proprio alla luce del valore sociale di questa vaccinazione. Secondo de Waure et al. [22] la vaccinazione antinfluenzale negli anziani e nei gruppi ad alto rischio è un intervento costo-efficace dal punto di vista farmacoeconomico, tuttavia è auspicabile una standardizzazione della metodologia applicata nelle valutazioni economiche dei vaccini antinfluenzali al fine di garantire la comparabilità e la trasferibilità dei risultati. Ting et al. [33], invece, riportano nel loro studio che, dal punto di vista sociale, la vaccinazione antinfluenzale risulta essere costo-efficace per bambini, donne in gravidanza e dopo il parto, gruppi ad alto rischio e, in alcuni casi, per gli adulti sani in età lavorativa. Inoltre, secondo gli autori, per la valutazione economica dei vaccini antinfluenzali è necessario tener conto anche del beneficio dell’immunità di gregge legata all’aumento delle coperture vaccinali. Dati interessanti emergono dallo studio di Wilder-Smith et al. [37] in cui, secondo gli autori, l’impatto economico della vaccinazione antinfluenzale dovrebbe incorporare i benefici sanitari e non sanitari della vaccinazione, sia nella popolazione vaccinata che in quella non vaccinata, consentendo così di stimare anche il valore sociale della vaccinazione. I benefici completi della vaccinazione, secondo gli autori, vanno oltre la prevenzione diretta delle malattie confermate eziologicamente e spesso si estendono per tutto il corso della vita di una persona vaccinata, prevengono gli esiti nella comunità, stabilizzano i sistemi sanitari, promuovono l’equità sanitaria e determinano benefici anche per le economie locali e nazionali. Gli autori, inoltre, sottolineano che per la valutazione economica dei vaccini antinfluenzali, così come degli altri vaccini, i modelli economici di tipo dinamico dovrebbero avere la priorità rispetto ai modelli statici poiché questi ultimi solitamente sottostimano l’efficacia e il rapporto di costo-efficacia dei programmi di immunizzazione, in quanto ne sottovalutano gli effetti indiretti.
Secondo Annemans et al. [51] i decisori sanitari e i responsabili politici dovrebbero essere informati dei limiti delle valutazioni economiche classiche per valutare il valore dei vaccini. Le future valutazioni economiche, inoltre, dovrebbero prestare maggiore attenzione all’effetto della vaccinazione sulla prevenzione delle complicanze, sulla generazione di vantaggi per la salute degli operatori sanitari e sui benefici per la comunità al di là della protezione individuale. Sempre secondo gli autori, sono necessarie linee guida per la valutazione economica del pieno valore delle vaccinazioni e le valutazioni economiche dovranno essere condotte tenendo anche conto della prospettiva sociale oltre che di quella del sistema sanitario, al fine di sottolineare e documentare il pieno valore dei vaccini. Le valutazioni economiche, inoltre, dovrebbero considerare in che modo i costi e gli esiti sanitari associati alla vaccinazione, contribuiscano a obiettivi più ampi di equità sociale e garanzia di un guadagno in salute per l’intera popolazione.
Secondo Rappuoli et al. [26] è necessario lo sviluppo di nuovi modelli economici in grado di catturare non solo il mero rapporto costo-beneficio della vaccinazione antinfluenzale, ma il valore completo della vaccinazione come investimento in salute.
Ruggeri et al. [8], sottolineano che nel valutare il valore economico dei vaccini, i decisori dovrebbero adottare una prospettiva sociale completa che tenga anche conto dell’impatto fiscale della malattia infettiva prevenibile da vaccino. I metodi tradizionali volti a stimare il costo della malattia da una prospettiva sociale possono essere migliorati considerando anche l’impatto fiscale, che spiega la diminuzione delle entrate fiscali dovute alla malattia. La potenziale riduzione dell’impatto fiscale associata alle strategie di immunizzazione dovrebbe essere inclusa nella valutazione degli effetti dei nuovi vaccini, aggiungendo questa nuova dimensione alla loro valorizzazione. Gli autori, inoltre, hanno valutato l’impatto economico e fiscale dei vaccini antinfluenzali in Italia e nell’analisi costi-benefici condotta hanno riportato che investire nella vaccinazione antinfluenzale comporta benefici che equivalgono a 1,8 volte il valore dell’investimento in termini di impatto fiscale e 11,1 volte in termini di perdita di produttività [8].
Un altro dato interessante è emerso dalla nostra revisione sitematica, ossia che ben il 60% degli studi inclusi ha affrontato il tema del valore sociale della vaccinazione antinfluenzale. Il valore sociale è stato indagato, soprattutto, come benessere per la popolazione e come protezione indiretta della collettività. Solo uno studio ha affrontato il tema del valore sociale legato alla dimensione del processo decisionale condiviso [18]. In particolare, gli autori hanno sottolineato l’importanza di formulare piani di immunizzazione basati su un processo equo e condiviso. Inoltre, sempre secondo gli autori, è essenziale condurre ricerche prima di una pandemia al fine di coinvolgere maggiormenre anche la popolazione, educarla e sollecitare il feedback dei cittadini in modo significativo. I piani di immunizzazione basati su valori condivisi e su un processo equo sono quelli che hanno maggiori probabilità di avere successo soprattutto durante un’emergenza sanitaria [18].
Rispetto alla nostra precedente revisione sistematica [14], in cui era emerso che il valore sociale delle vaccinazioni era ancora poco indagato dalla comunità scientifica, in questa attuale revisione, invece, è uno dei principali valori riconosciuti e associati alla vaccinazione antinfluenzale.
Secondo Macias et al. [53] riconoscere le conseguenze più ampie dell’infezione influenzale, anche tendendo conto delle conseguenze per la società e per la popolazione generale, è essenziale per determinare l’intero burden dell’influenza nelle diverse sottopopolazioni e per valutare il valore complessivo degli interventi di prevenzione, ivi compresa la vaccinazione.
Secondo la prospettiva del valore sociale della vaccinazione antinfluenzale particolare attenzione è stata posta alla protezione dei più fragili. McElhaney et al. [31], ad esempio, hanno sottolineato l’importanza della vaccinazione dei soggetti più giovani e in salute, prima che diventino fragili, e anche per la protezione dei più fragili. Inoltre, anche l’implementazione della vaccinazione antinfluenzale degli operatori sanitari e delle persone che sono in contatto con gli anziani è stata indicata come azione fondamentale per migliorare la protezione della collettività. Infatti, secondo gli autori, gli operatori sanitari e i decisori in materia di salute pubblica dovrebbero comprendere più a fondo il valore della vaccinazione antinfluenzale e considerarla un importante strumento preventivo per la promozione di un invecchiamento in salute. Anche secondo Poscia et al. [32] l’influenza costituisce una seria minaccia per la salute pubblica, soprattutto per le popolazioni vulnerabili come gli anziani. Pertanto, è necessario sottolineare il valore sociale ed economico di questa vaccinazione. La comunicazione e la consapevolezza del valore delle prevenzione delle malattie prevenibili con i vaccini nella popolazione generale è un punto di partenza importante e tutti gli operatori sanitari e sociali possono svolgere un ruolo chiave in tal senso. Allo stesso modo per Boey et al. [40] è necessario pianificare adeguatamente campagne contro l’influenza stagionale, nelle quali vengano promosse l’educazione alla vaccinazione, la comunicazione dei benefici dei vaccini e del valore della vaccinazione e l’implementazione di una vaccinazione facilmente accessibile. È importante, inoltre, non solo concentrarsi sul valore per i pazienti ma anche sui vantaggi personali per gli stessi operatori sanitari.
Per Lorenc et al. [34], il valore sociale della vaccinazione antinfluenzale, si correla soprattutto alla proteziene degli altri da parte degli operatori sanitari vaccinati, anche se, purtroppo, anche in questa categoria non vengono riportate coperture vaccinali adeguate. Invece, secondo Ortiz et al. 2017 [35] il valore sociale della vaccinazione si correla perfettamente con la prevenzione vaccinale dell’influenza nelle donne in gravidanza, in quanto l’immunizzazione materna previene la malattia in due gruppi ad alto rischio: le madri e i loro bambini durante i primi mesi di vita. Fondamentale, secondo gli autori, è il rafforzamento dell’immunizzazione materna nei paesi in via di sviluppo in quanto questo intervento di prevenzione potrebbe migliorare i sistemi sanitari per l’assistenza prenatale, potrebbe favorire la costruzione di una piattaforma per la produzione di altri vaccini da utilizzare durante la gravidanza, e potrebbe rafforzare, aumentando la distribuzione dei vaccini antinfluenzali, i sistemi sanitari nella risposta ad eventuali future pandemie.
Altro valore fondamentale della vaccinazione antinfluenzale è quello personale, affrontato solo nel 32% degli studi inclusi nella nostra revisione sistematica. Il valore personale è stato sottolineato, soprattutto, in rapporto ai benefici individuali sugli outcomes clinici legati alla vaccinazione e al coinvolgimento/ empowerment dei cittadini [20, 25, 31, 35, 37, 40, 51, 54].
Infine, solo il 20% degli studi inclusi ha affrontato il tema del valore allocativo, in termini di accessibilità ed equità di accesso alla vaccinazione antinfluenzale [18, 20, 35, 37, 51]. Questo risultato è in linea con quanto documentato anche nel nostro precedente lavoro sul valore delle vaccinazioni [14] e richiama l’attenzione sulla necessità di sviluppare ulteriori ricerche su questa dimensione del valore, rilevante sia per i sistemi sanitari che per i cittadini.
È interessante notare come nella valutazione del valore generale della vaccinazione antinfluenzale, non direttamente indagato secondo i quattro pilastri del valori proposti dall’EXPH, siano state affrontate tematiche come il valore culturale e i benefici sociali della vaccinazione sia dalla prospettiva dei cittadini [24], sia da quella dei professionisti sanitari [41], così come il valore della vaccinazione in popolazioni “speciali” come gli anziani [27, 38, 46], gli adulti [52], i pazienti con patologie cardiovascolari [52] e quelli oncologici [54], e anche gli studenti delle professioni sanitarie [48]. Inoltre, negli studi che hanno affrontato più in generale il tema del valore della vaccinazione antinfluenzale è stata posta particolare attenzione all’importanza del valore complessivo di questa vaccinazione [26] e della necessità di una metodologia appropriata per valutarne il pieno valore e supportare un processo decisionale basato sull’evidenza [42], anche grazie a strumenti evidence-based come l’HTA [44]. È stato, inoltre, sottolineato il valore della sorveglianza dell’influenza e la necessità di applicare metodi innovativi di sorveglianza anche attraverso i social media [36]. Altro aspetto del valore proposto dalla letteratura scientifica è quello del valore degli interventi educativi in ambito di vaccinazione antinfluenzale per gli studenti in infermieristica [47] ma anche di literacy per i cittadini [43]. Infine, è stato sottolineato come sia necessaria una pianficazione coordinata a livello globale per implementare la vaccinazione antinfluenzale in tutto il mondo, e guidata da un’alleanza di stakeholders internazionali, che includa rappresentanti di organizzazioni governative e non governative, cittadini, industria, organizzazioni internazionali ed esperti in sicurezza sanitaria e influenza [45].
Sulla base di quanto descritto e di quanto emerso dalla nostra revisione sistematica è evidente come la conoscenza e la comunicazione del valore complessivo della vaccinazione antinfluenzale sia fondamentale e necessario per guidare politiche sanitarie in ambito di immunizzazione evidence-based e value-based. Tuttavia, diverse sono le barriere da superare per aumentare le coperture vaccinali contro l’influenza a livello internazionale.
Un documento dell’EXPH della CE, pubblicato nel 2018 [55], identifica i principali fattori (barriere e fattori abilitanti) che influenzano l’adozione della vaccinazione nell’Unione Europea e valuta le misure necessarie per migliorare le coperture vaccinali. Secondo gli esperti, le barriere per il raggiungimento di una copertura vaccinale universale includono le preoccupazioni o le paure degli individui sulla sicurezza dei vaccini e sui loro eventi avversi, la mancanza di fiducia nelle vaccinazioni, le norme sociali, l’esposizione a falsi miti che minano la fiducia nei vaccini, l’incapacità di alcuni operatori sanitari di contrastare questi miti e fornire prove ed una adeguata consulenza informata, barriere all’accesso (ad es. scarsa disponibilità, copayments) e incapacità di comprendere i meccanismi sottostanti che riducono la fiducia nelle vaccinazioni. I fattori abilitanti includono, invece, fonti di informazioni affidabili sulla vaccinazione, esposizione a messaggi mediatici positivi, creazione di fiducia nelle istituzioni e nei fornitori, creazione di fiducia nella vaccinazione, facile accesso e disponibilità ai servizi sanitari, facilità di somministrazione, coinvolgimento attivo e impegno da parte degli operatori sanitari e gruppi ad alto rischio [55]. Pertanto, le azioni da implementare per aumentare le coperture vaccinali dovrebbero focalizzarsi su strategie di comunicazione inerenti i benefici della vaccinazione e su un maggior dialogo – con un approccio partecipativo – con i gruppi più esitanti su vaccini e vaccinazioni [55]. Inoltre, le politiche sanitarie dovrebbero essere guidate dal raggiungimento dell’immunità di gregge. La vaccinazione può essere obbligatoria o raccomandata purché si ottengano tassi di copertura elevati per ottenere l’immunità di gregge [55]. È necessario un maggior coinvolgimento dei medici di prossimità (medici di medicina generale e pediatri di libera scelta) per migliorare i tassi di copertura vaccinale in tutte le fasce di età. Tuttavia, un migliore accesso alle vaccinazioni potrebbe essere ottenuto con il coinvolgimento di altri operatori sanitari adeguatamente formati (ad esempio infermieri, farmacisti ecc.), garantendo, in tale modo, maggiore equità di accesso. Ovviamente, gli operatori sanitari dovrebbero essere adeguatamente formati anche sulle migliori modalità di comunicazione e dovrebbero avere una formazione specifica per affrontare le preoccupazioni sui vaccini da parte dei cittadini esitanti, in particolare in relazione alla sicurezza e agli effetti collaterali dei vaccini. Un’altra priorità di azione consiste nel rafforzare i sistemi di monitoraggio e sorveglianza a livello internazionale, nazionale e locale, al fine di garantire dati aggiornati per guidare la politica e la pianificazione sanitaria e implementare, in tal modo, le coperture vaccinali [55].
Inoltre, così come evidenziato nel paper di de Waure et al. [15], la comprensione del valore complessivo delle vaccinazioni e la traduzione effettiva di questa conoscenza in tutte le parti interessate è fondamentale per rafforzare le politiche sanitarie e le strategie di immunizzazione a livello globale, nonché per contrastare la disinformazione sui vaccini e l’esitazione vaccinale. De Waure et al. [15], inoltre, propongono delle raccomandazioni relative alla ricerca, al processo decisionale e all’engagement dei cittadini per rafforzare l’utilizzo delle evidenze sul valore nel processo decisionale sulle vaccinazioni.
Nello specifico, le raccomandazioni per l’area della ricerca [15] sono:
sviluppare un consenso multi-stakeholder sui quattro pilastri del valore applicati/da applicare ai vaccini e alle vaccinazioni;
analizzare le barriere esistenti per la valutazione del valore complessivo delle vaccinazioni;
estendere la ricerca scientifica al valore complessivo dei vaccini e delle vaccinazioni con l’obiettivo di quantificare meglio il loro ampio impatto sociale;
rafforzare le prove scientifiche e la generazione di dati al fine di implementare strategie vaccinali basate sull’evidenza e garantire la valutazione del loro impatto a posteriori;
implementare e sviluppare modelli/strumenti per supportare l’HTA o altri frameworks di valutazione, al fine di riconoscere il valore complessivo della vaccinazione;
sviluppare partenariati pubblico-privati positivi e collaborativi per garantire incentivi sostenibili per lo sviluppo di innovazioni di alto valore nell’ecosistema dei vaccini.
Per l’area relativa all’engagement dei cittadini vengono proposte, invece, le seguenti raccomandazioni [15]:
identificare le leve per migliorare la conoscenza e la comprensione degli individui e della comunità sul valore complessivo dei vaccini e delle vaccinazioni;
ottenere una migliore alfabetizzazione sul valore della vaccinazione per gli operatori sanitari e per i cittadini;
sviluppare strategie efficaci per coinvolgere attivamente le comunità nella vaccinazione.
Infine, per il processo decisionale si raccomanda di [15]:
sviluppare iniziative di capacity building sul valore complessivo delle vaccinazioni, sia per i ricercatori che per i decisori;
avviare iniziative per incorporare i quattro pilastri del valore nel processo decisionale su vaccini e vaccinazioni a livello sovranazionale, nazionale e regionale;
migliorare la governance del processo decisionale relativo ai vaccini costruendo una collaborazione efficace e aperta tra autorità, operatori sanitari, scienziati, cittadini e industria;
incoraggiare processi decisionali condivisi sulla vaccinazione tra le diverse parti interessate.
La raccolta e la sintesi delle evidenze scientifiche sul valore delle vaccinazioni rappresenta un primo e fondamentale tassello per promuovere un nuovo approccio di immunizzazione basato sul valore. Aumentare la consapevolezza sul valore delle vaccinazioni è inoltre di grande importanza fintanto che l’esitazione e il sottoutilizzo dei vaccini potranno portare al rischio di gravi epidemie.
Nell’ambito della prevenzione vaccinale, particolare attenzione deve essere rivolta alla vaccinazione antinfluenzale, poiché l’influenza rappresenta un problema di sanità pubblica con un considerevole impatto dal punto di vista epidemiologico, clinico, economico e sociale. Le malattie infettive non riconoscono confini geografici e/o politici e tutte, ma in particolare quelle prevenibili da vaccino come l’influenza, richiedono un approccio globale e non localistico per la loro prevenzione ed il loro controllo. Tali strategie richiedono necessariamente l’abbattimento di barriere ideologiche e politiche, ma anche di ostacoli economici e culturali, a favore di un approccio collettivo e globale a difesa della salute delle popolazioni.
Sulla base di quanto descritto e di quanto emerso dalla nostra revisione, risulta evidente l’esigenza di prendere in esame una strategia value-based di immunizzazione contro l’influenza, con l’obiettivo di mettere concretamente il cittadino/paziente al “centro”. Per fare ciò è necessario conoscere e divulgare le evidenze scientifiche sul valore complessivo della vaccinazione antinfluenzale, nonché promuovere ed implementare strategie di immunizzazione che tengano conto del valore più ampio e, quindi, personale, tecnico, allocativo e sociale, di questa vaccinazione.
I professionisti sanitari, ed in particolare i medici di Sanità Pubblica, i pediatri e i MMG, l’intera comunità scientifica, le Istituzioni e i decisori si dovranno impegnare, ciascuno per le proprie competenze, per favorire il corretto utilizzo dei vaccini antinfluenzali e nel salvaguardare l’indiscusso valore complessivo della vaccinazione contro l’influenza, patrimonio di tutti i cittadini, indipendentemente dallo stato sociale e dal luogo di residenza.
Questo capitolo sintetizza gli aspetti più rilevanti emersi dalla valutazione HTA del vaccino antinfluenzale quadrivalente a coltura cellulare Flucelvax Tetra®.
La sorveglianza epidemiologica evidenzia una notevole variabilità delle curve epidemiche (sia nel livello di intensità che nelle tempistiche), ulteriormente accentuata dalla diffusione del SARS-CoV-2.
La popolazione anziana è caratterizzata dai più bassi tassi di incidenza di ILI (cumulativa e massima) e da una durata epidemica più ridotta e a inizio più tardivo. Nel periodo pre-COVID-19 si sono avuti 377.000-1,03 milioni di casi di ILI a stagione tra gli anziani, da curare e assistere in un breve arco temporale (25.000-120.000 casi nella settimana di massimo picco epidemico). Va ricordato che i soggetti di questa fascia di età sono ad aumentato rischio di complicanze da influenza.
La popolazione pediatrica ha i valori di incidenza di ILI più elevati e una durata epidemica maggiore con inizio anticipato. Nel periodo pre-COVID-19 si sono avuti 456.000-833.000 bambini con ILI a stagione (41.000-92.000 casi nella settimana di massima incidenza). Sebbene l’influenza nelle fasce più giovanili abbia generalmente un decorso benigno, può essere responsabile di ricoveri ospedalieri (nei bambini più piccoli) e di un numero rilevante di giorni di scuola persi, di giornate di lavoro perse da parte dei genitori e di un aumentato consumo di risorse sanitarie dovute a visite mediche, utilizzo di farmaci antipiretici e uso di antibiotici. Inoltre, la popolazione più giovane rappresenta la principale fonte di infezione per la popolazione generale e, in particolar modo, per i soggetti maggiormente a rischio di morbosità e mortalità correlate all’influenza.
Nel periodo pre-COVID-19 vi è stata una predominate circolazione del virus A rispetto al B (che comunque non ha superato il 60% nelle stagioni a maggiore diffusione). Fra i virus A, ha circolato maggiormente il sottotipo H3N2, mentre nelle stagioni in cui i virus B sono stati tipizzati, si è avuto una maggior circolazione del lineage Yamagata.
Le ultime settimane della stagione influenzale 2019-2020 sono state interessate dalla circolazione di SARS-CoV-2, i cui interventi di controllo hanno influito anche sull’epidemiologia dell’influenza e sulla raccolta dei dati del sistema di sorveglianza.
La stagione 2020-2021 ha avuto tassi di incidenza di ILI estremamente bassi e una totale assenza di virus influenzali isolati nei campioni respiratori analizzati.
Nella stagione 2021-2022 si è osservata una ripresa dell’intensità (anche se a bassi valori) delle ILI (in termini di incidenza cumulativa e settimanale massima) rispetto alla stagione 2020-2021. In particolare, la stagione influenzale 2021-2022 è stata caratterizzata da due picchi epidemici. Tuttavia, il tasso di positività dei campioni biologici analizzati dal sistema di sorveglianza virologica risulta piuttosto basso (14%), quasi la metà del valore medio calcolato per le stagioni precedenti, indicando la co-circolazione di altri patogeni, tra cui il SARS-CoV-2 (identificato nel 29% dei campioni).
Nell’ultimo decennio l’influenza ha rappresentato, e in futuro continuerà a rappresentare, un rilevante problema di Sanità Pubblica per l’elevata incidenza. Infatti, dopo la notevole riduzione dell’incidenza di ILI nel periodo di emergenza pandemica (2020-2021), determinata dagli interventi di controllo e prevenzione dell’infezione da SARS-CoV-2, i dati delle ultime stagioni influenzali mostrano che i virus influenzali continuano a circolare e la loro diffusione è pronta ad aumentare. La sorveglianza epidemiologica e virologica risulta uno strumento fondamentale per comprendere e prevedere meglio l’epidemiologia dell’influenza e le sue fluttuazioni nel tempo.
L’influenza si configura come una malattia prevenibile da vaccino ad alto impatto sulla salute di popolazione in tutte le fasce di età. Infatti, se da una parte il maggior burden di malattia si riflette sulla popolazione anziana, dall’altra è possibile sottolineare come l’influenza possa determinare complicanze ed ospedalizzazioni anche nella fascia pediatrica e adulta.
I casi gravi riportati nell’archivio FluNews riguardano per oltre il 40% soggetti anziani e per una quota minimale soggetti in età pediatrica. I casi gravi presentano comunemente comorbosità sottostanti e fanno registrare alti valori di letalità. Il rischio di decesso aumenta in maniera rilevante nei soggetti anziani. Gli stessi dati disponibili dall’Istat mettono chiaramente in risalto questo aspetto, con valori di mortalità per polmonite e influenza pari a 0,01-0,02 per 10.000 nei soggetti di età pediatrica e a 16,78-20,56 su 10.000 nei soggetti al di sopra dei 75 anni.
Similmente nella fascia di età anziana si registrano i tassi maggiori di ospedalizzazione per influenza e polmonite sebbene immediatamente seguiti dai soggetti di età compresa tra 0 e 14 anni. Nella fascia di età pediatrica il maggior rischio di complicanze e ospedalizzazioni si registra al di sotto dei due anni, mentre quello di decesso al di sotto di un anno di età.
Per quanto riguarda la popolazione adulta, rilevanti risultano le condizioni di comorbosità, che aumentano significativamente il rischio di complicanze fino a tre volte, e lo status di gravidanza che si associa a un aumentato rischio di ospedalizzazione in caso di influenza.
Per quanto concerne la popolazione pediatrica e adolescenziale, i risultati emersi nella presente valutazione di HTA sottolineano quanto segue:
vaccini quadrivalenti prodotti su uova (QIVe). Relativamente all’immunogenicità la valutazione critica delle revisioni sistematiche disponibili ha evidenziato che i vaccini QIVe non sono significativamente inferiori ai TIVe per i ceppi condivisi e sempre superiori per i ceppi non condivisi indipendentemente dal lineage. Un livello di efficacia ed effectiveness soddisfacente è stato dimostrato nei RCTs e negli studi osservazionali. Il profilo di sicurezza e tollerabilità è risultato sovrapponibile con quello dei TIVe. Gli studi osservazionali e le sorveglianze post-marketing hanno confermato i dati riportati in RCP;
vaccino vivo attenuato (Q/LAIV). Nei bambini immunizzati con il vaccino Q/LAIV si sono osservate risposte immunitarie capaci di mimare l’infezione naturale offrendo una risposta immunitaria più ampia rispetto a quella stimolata dai vaccini inattivati evocando risposte umorali e cellulo-mediate nelle vie aeree superiori verso virus influenzali sia omologhi che eterologhi. Q/LAIV si è dimostrato immunogeno nei bambini e negli adolescenti ed è risultato non inferiore rispetto alla formulazione trivalente per i ceppi in comune e superiore per il ceppo B non incluso, indipendentemente dal lineage. Tutti gli studi hanno evidenziato un minor rischio di contrarre influenza nei bambini vaccinati con il vaccino vivo attenuato rispetto a quelli immunizzati con i vaccini inattivati per i ceppi antigenicamente simili ma anche indipendentemente dalla concordanza antigenica. Inoltre, Q/LAIV ha mostrato un effetto diretto sulla popolazione vaccinata riducendo i casi di influenza confermati in laboratorio, i casi di influenza richiedenti visite mediche ambulatoriali, gli accessi al pronto soccorso e le ospedalizzazioni, l’utilizzo di farmaci e l’assenteismo scolastico. Inoltre, si è osservato un impatto positivo anche in altri gruppi di età (in termini di riduzione di casi di influenza confermata, di accessi al pronto soccorso, di ospedalizzazione, di assenteismo scolastico e lavorativo) quando il tasso di copertura vaccinale raggiungeva almeno il 40-50% di bambini/adolescenti in età scolare. I risultati delle revisioni sistematiche, degli studi post-marketing e delle sorveglianze passive hanno confermato il buon profilo di sicurezza di Q/LAIV osservato negli RCTs. Le reazioni avverse più comuni dopo la somministrazione sono rinorrea, tosse e mal di gola, riferite con maggiore frequenza dopo la prima dose rispetto alla seconda. Q/LAIV è risultato sicuro e ben tollerato anche nei soggetti con asma ed infezioni respiratorie ricorrenti.
Per quanto riguarda, invece, la popolazione adulta e anziana è emerso quanto segue:
vaccini quadrivalenti prodotti su uova (QIVe). I QIVe si sono dimostrati generalmente non inferiori a TIVe per i ceppi in comune e significativamente superiori per il ceppo B non condiviso, indipendentemente dal lineage considerato. Alla data di chiusura del presente report, non risultavano pubblicati studi di efficacia teorica nella popolazione adulta e anziana (gli studi disponibili si riferiscono esclusivamente alla popolazione pediatrica).
Gli studi di effectiveness hanno dimostrato protezioni variabili a seconda della stagione valutata, della tipologia di ceppo circolante e dell’età dei soggetti. Nelle stagioni in cui il vaccino e i ceppi circolanti A/H3N2 erano antigenicamente distanti, il livello di protezione è risultato basso negli anziani. Gli studi di effectiveness relativa hanno evidenziato una minore efficacia dei QIVe rispetto al vaccino adiuvato con MF-59 e al vaccino ad alto dosaggio antigenico nella popolazione anziana indipendentemente dall’outcome considerato. I QIVe si sono dimostrati sicuri e ben tollerati. La conferma del buon profilo di sicurezza è emersa anche nelle sorveglianze post-marketing;
vaccino ricombinante (QIVr). Nei RCTs il vaccino QIVr ha confermato la non inferiorità rispetto ai QIVe. Sono state osservate nei soggetti immunizzati con QIVr risposte anticorpali più robuste rispetto a quelle rilevate negli individui vaccinati con vaccini prodotti su uova a dose standard. Tale risultato è probabilmente da attribuire sia al nuovo processo di allestimento che riduce le mutazioni egg-adaptive sia alla superiore quantità di antigene rispetto al preparato standard. QIVr ha mostrato una migliore protezione contro l’influenza confermata in laboratorio rispetto ai vaccini standard. Inoltre, i risultati sembrano suggerire che i vaccini ricombinanti possano offrire anche una protezione crociata verso le varianti. Attualmente sono pochi i dati di effectiveness disponibili. Il profilo di sicurezza è risultato comparabile con quello dei QIVe;
vaccino antinfluenzale ad alto dosaggio prodotto su uova (QIV-HD). QIV-HD si è dimostrato non inferiore alla formulazione trivalente per i ceppi virali in comune e superiore per il ceppo B non condiviso. I vaccini ad alto dosaggio antigenico sono risultati più immunogeni rispetto ai vaccini trivalenti, supportando un’efficacia superiore del vaccino TIV/QIV-HD nel prevenire l’influenza confermata in laboratorio e una migliore effectiveness contro le malattie simil-influenzali e l’ospedalizzazione associata all’influenza nella popolazione anziana.
Gli studi di efficacia e di effectiveness hanno mostrato un’efficacia significativamente maggiore di QIV-HD rispetto ai vaccini a dosaggio standard non adiuvati (TIVe e QIVe) nel ridurre diversi outcome clinici associati all’influenza.
Relativamente alla sicurezza, è emerso che i vaccini ad alto dosaggio sono probabilmente associati ad una maggiore frequenza di reazioni locali e sistemiche; l’incrementato numero di reazioni avverse è probabilmente legato al quantitativo quadruplo di ogni singolo antigene rispetto ai vaccini standard. Da evidenziare, tuttavia, che i sintomi segnalati sono tipicamente di natura mite e transitoria;
vaccino adiuvato con MF-59. La formulazione quadrivalente si è dimostrata non inferiore al preparato trivalente. La formulazione trivalente si è dimostrata altamente immunogena e generalmente superiore rispetto alle formulazioni trivalenti non adiuvate. Negli anziani il vaccino adiuvato stimola risposte immunitarie significativamente maggiori rispetto ai vaccini tradizionali, aumentando l’ampiezza e la durata della risposta immunitaria. La maggiore immunogenicità è stata osservata per tutti i ceppi influenzali, in particolare per il ceppo A/H3N2, associato con malattia clinica più grave nella popolazione adulta/anziana. I dati di effectiveness di aTIV rispetto a nessuna vaccinazione o rispetto ai vaccini standard suggeriscono che aTIV è più efficace nella prevenzione dell’influenza confermata in laboratorio di diversa gravità (malattia che richiede visita ambulatoriale e patologia grave associata a ricovero ospedaliero). Il profilo di sicurezza del vaccino adiuvato è accettabile. La maggiore frequenza di eventi locali e reazioni sistemiche osservata è da attribuirsi alla potente azione infiammatoria associata all’uso dell’adiuvante che innesca un’iperattivazione immunologica spesso mediata dal rilascio di citochine pro-infiammatorie; tuttavia, questi eventi avversi sono lievi e moderati nella maggior parte dei casi.
Dall’analisi della letteratura effettuata è emerso quanto segue:
nei bambini, adolescenti e adulti in età lavorativa, la risposta anticorpale in seguito alla vaccinazione con il vaccino quadrivalente da coltura cellulare (QIVc) soddisfa i criteri regolatori per l’immunogenicità dei vaccini antinfluenzali e non è inferiore ai vaccini convenzionali prodotti su uova. Per quel che concerne l’immunità cellulo-mediata, le prime evidenze disponibili suggeriscono che QIVc elicita una robusta e bilanciata risposta CD4+ e CD8+, la quale è particolarmente importante per la memoria immunologica specialmente nel caso dei virus respiratori. D’altronde, nel soggetto anziano l’immunogenicità di QIVc può essere inferiore rispetto ai vaccini “potenziati”. Per questo motivo, nei soggetti di età ≥ 65 anni le formulazioni adiuvate o a più alto contenuto di antigene sono considerate di elezione;
l’evidenza sperimentale e multi-stagione suggerisce che QIVc è efficace nei bambini e negli adolescenti contro l’infezione da diversi ceppi influenzali. Mancano tuttavia i dati relativi all’efficacia teorica assoluta nella popolazione anziana nonché RCTs sul confronto diretto tra QIVc e altri vaccini antinfluenzali;
numerose evidenze real-world suggeriscono il vantaggio di QIVc rispetto a QIVe nella popolazione di età < 65 anni. In particolare, rispetto a QIVe, l’utilizzo di QIVc è associato a una significativa riduzione del 25-29% dei casi di influenza dal sottotipo A(H3N2). Inoltre, nei soggetti di età < 65 anni QIVc è risultato in media più efficace sul campo di QIVe nel prevenire le ospedalizzazioni e/o visite mediche per influenza diagnosticata clinicamente, polmoniti e alcuni altri outcomes meno specifici;
il profilo di reattogenicità e di sicurezza di QIVc è del tutto simile ai vaccini convenzionali prodotti su uova. Gli studi di sorveglianza e di farmacovigilanza non hanno evidenziato alcun safety signal in seguito all’utilizzo massiccio di QIVc. Inoltre, sono stati pubblicati i primi dati sull’utilizzo di QIVc nelle donne in gravidanza che hanno confermato l’ottimo profilo di sicurezza di QIVc anche in questo gruppo target. È auspicabile che questi dati vengano recepiti nel RCP di QIVc;
QIVc può essere co-somministrato con i vaccini anti-COVID-19. Tale aspetto è di particolare importanza vista l’incertezza sulla futura circolazione di SARS-CoV-2 e l’ipotesi che quest’ultimo diventi un virus stagionale è sempre più probabile. In tali circostanze, la strategia di co-somministrazione dei due vaccini comporta diversi vantaggi come, ad esempio, maggiore convenienza sia per il paziente sia per l’operatore sanitario, maggiore opportunità di vaccinare e vantaggi logistici.
È stato valutato il profilo economico dell’introduzione del vaccino antinfluenzale QIVc a partire dai 2 anni di età nella popolazione italiana, rispetto ai vaccini quadrivalenti disponibili sul mercato. L’analisi non ha riguardato il confronto con il vaccino QIVr (indicato a partire dai 18 anni di età) non essendo ancora distribuito in Italia al momento della stesura del presente report. Inoltre, non essendo disponibili dati di efficacia relativa con il QIVc, per il vaccino quadrivalente vivo attenuato (LAIV), è stata assunta una efficacia vaccinale sovrapponibile per QIVe e LAIV. La principale popolazione target per questa analisi economica è costituita da individui di età compresa tra 2 e 64 anni in Italia per i quali la vaccinazione antinfluenzale è raccomandata secondo le indicazioni contenute nella Circolare per la Prevenzione ed il Controllo dell’influenza del Ministero della Salute. Per l’analisi abbiamo previsto il numero di infezioni influenzali utilizzando come orizzonte temporale una stagione media e un modello di trasmissione compartimentale con una struttura SEIR (Suscettibile-Esposto-Infetto-Rimosso). Gli input del modello per la trasmissibilità, la suscettibilità e la percentuale di casi infetti con sintomi clinici sono stati derivati attraverso un processo di calibrazione che ha prodotto una stagione influenzale di media intensità.
Data la sua struttura, che consente la trasmissione attraverso i gruppi di età, il modello ha incluso l’intera popolazione italiana e, pertanto, ha richiesto che la strategia vaccinale raccomandata fosse modellata per tutti i gruppi di età. QIVe è stato considerato in uso per i soggetti di età compresa tra 6 e 17 anni, mentre per quelli di età pari o superiore a 65 anni sono stati considerati il QIV-MF59 o il QIVhd. Per condurre l’analisi QIVc è stato sostituito con QIVe nel gruppo di età da 2 a 64 anni.
La prospettiva utilizzata per lo studio è stata quella del SSN e della società come raccomandato dall’Istituto Nazionale per l’Eccellenza Sanitaria e Assistenziale (NICE). È stato inoltre, applicato un tasso di sconto del 3% sia per i costi che per i risultati, in linea con la letteratura internazionale.
Tenendo conto che fino ad oggi non esiste un valore soglia della disponibilità a pagare (Willingness-To-Pay, WTP) della popolazione italiana, abbiamo utilizzato il valore di 30,000 €/QALY che risulta il più frequentemente utilizzato nella letteratura scientifica italiana ed europea.
Rispetto alla anostra precedente valutazione economica, pubblicata nel 2019, dove si presumeva che la rVE di QIVc rispetto a QIVe fosse del 36,2% nel caso base e del 19,3% nelle analisi di scenario, in questa nuova analisi abbiamo abbassato la rVE fino al 6% nei confronti del sottotipo A(H3N2) ed ampliato la platea della popolazione ricevente il vaccino QIVc dai 9 ai 2 anni di età, ottenendo comunque un ottimo profilo di costo efficacia per le prospettive considerate e un buon risultato in termini di herd immunity nei confronti del sottotipo virale A(H3N2).
Infatti, l’introduzione in Italia di QIVc (nei soggetti di età compresa fra 2-64 anni) risulta altamente costo-efficace o cost-saving (dominante) in entrambe le prospettive utilizzate per l’analisi (SSN o società) e/o della fascia di età. La strategia vaccinale con QIVc è rimasta altamente costo-efficace persino negli scenari peggiori e considerando, nel caso base, una efficacia relativa fra QIVc e QIVe del 6%. Le analisi di sensibilità hanno inoltre confermato la solidità del caso base.
Pertanto, l’introduzione di QIVc in Italia nei soggetti di età 2-64 anni è un “good value for money”.
Il vaccino antinfluenzale è raccomandato per tutti i soggetti a partire dai 6 mesi di età che non hanno controindicazioni. Nell’ultima Circolare Ministeriale disponibile e relativa alle raccomandazioni per la stagione 2022-2023 vengono indicati i “Gruppi a rischio con la massima priorità” per la vaccinazione antinfluenzale. Tra questi rientrano gli operatori sanitari, gli adulti anziani, le donne in gravidanza, le persone con patologie che aumentano il rischio di complicanze da influenza, quali diabete, ipertensione, HIV/AIDS, asma e altre malattie croniche cardiache o polmonari. Inoltre, anche i bambini, in particolare quelli di età inferiore ai 5 anni, rappresentano un gruppo prioritario per l’offerta della vaccinazione antinfluenzale a causa del loro rischio di forme gravi di influenza, in particolare quelli di età compresa tra i 6 mesi e i 2 anni. Alla luce della situazione pandemica COVID-19, è stata rappresentata l’opportunità di raccomandare la vaccinazione antinfluenzale nella fascia di età 6 mesi - 6 anni, anche al fine di ridurre la circolazione del virus influenzale fra gli adulti e gli anziani.
In Italia la vaccinazione antinfluenzale viene offerta attivamente e gratuitamente ai soggetti che per le loro condizioni personali corrono un maggior rischio di complicanze nel caso contraggano l’influenza.
I principali obiettivi della campagna vaccinale stagionale sono: la riduzione del rischio individuale di malattia, delle ospedalizzazioni e dei decessi per influenza; la riduzione della probabilità di trasmissione a soggetti ad elevato rischio di complicanze o di ospedalizzazione; la riduzione dei costi sociali correlati alla morbosità e alla mortalità correlate all’infezione.
L’attuale offerta vaccinale antinfluenzale offre un ampio ventaglio di possibilità, consentendo una personalizzazione dell’assistenza anche in ambito di prevenzione primaria e rispondendo a criteri di appropriatezza, sia clinica che organizzativa. Anche la scelta del vaccino, quindi, deve necessariamente rispondere a criteri di appropriatezza, che devono guidare l’utilizzo dei vaccini disponibili in base alle caratteristiche e alle esigenze delle diverse fasce d’età e dei gruppi specifici della popolazione.
Il Piano Nazionale Prevenzione Vaccinale (PNPV) 2017-19 riporta, tra gli obiettivi di copertura per la vaccinazione antinfluenzale, il 75% come obiettivo minimo perseguibile e il 95% come obiettivo ottimale negli ultrasessantacinquenni e nei gruppi a rischio.
Nonostante tali raccomandazioni, l’alta incidenza dell’influenza nella popolazione, l’elevato impatto sanitario e socio-economico della malattia e delle sue complicanze e la disponibilità di un ampio spettro di vaccini efficaci, sicuri e costo-efficaci, le coperture vaccinali restano ancora ben al di sotto del valore raccomandato.
È, quindi, necessario aumentare le coperture vaccinali attraverso diverse azioni, tra le quali adeguate campagne di informazione/educazione della popolazione e degli operatori sanitari, che affrontino prioritariamente i pregiudizi sulla vaccinazione, evidenziandone benefici e i vantaggi che una copertura vaccinale ottimale può dare a livello di popolazione, anche in relazione alla circolazione del SARS-CoV-2 e delle sue varianti. È, inoltre, essenziale porre particolare attenzione anche alla scelta degli strumenti di comunicazione utilizzati in funzione del target (social media per adolescenti/giovani; consultori/servizi maternità per donne in puerperio, ecc.).
Risulta, infine, indispensabile proporre interventi di Sanità Pubblica che possano essere in grado di determinare una svolta migliorativa nella lotta all’influenza ed implementare strategie preventive mirate ed efficaci, volte a migliorare la gestione dei diversi presidi antinfluenzali, assegnando ad ogni fascia di popolazione il vaccino più appropriato.
Dalla valutazione etica svolta nell’ambito del presente HTA emerge che il vaccino Flucelvax Tetra® è immunogenico, efficace e sicuro nei soggetti di età 2–64 anni in cui induce una ottima risposta anticorpale contro i 4 ceppi dell’influenza. I vantaggi in termini di guadagno di salute, miglioramento della qualità di vita e riduzione dei livelli di morbilità/mortalità in caso di ILI dovrebbero spingere a estendere la vaccinazione a tutta la popolazione italiana, consentendo l’accesso gratuito su tutto il territorio nazionale.
Sulla base dei dati a disposizione, il giudizio etico è, quindi, positivo. Si suggerisce, comunque, di porre particolare attenzione alla predisposizione di counseling personalizzati prima della somministrazione del vaccino, alla farmacovigilanza e all’organizzazione di campagne di informazione e di educazione vaccinale.
Anche se i benefici reali e tangibili della vaccinazione antinfluenzale sono riconosciuti a livello globale, in molti Paesi, inclusa l’Italia, non si registrano ancora coperture vaccinali adeguate. Inoltre, come si evince dalla revisione di letteratura condotta, il valore complessivo della vaccinazione antinfluenzale, ad oggi, non è ancora del tutto riconosciuto.
La revisione sistematica condotta nell’ambito di questo report di HTA ha dimostrato, infatti, che i valori personale, tecnico, allocativo e sociale, della vaccinazione antinfluenzale sono stati affrontati, negli ultimi anni, da un numero limitato di articoli scientifici e solo il 5% di quelli inclusi nella revisione hanno disaminato il valore complessivo della vaccinazione antinfluenzale.
Il pilastro del valore maggiormente indagato è quello tecnico e gli studi inclusi sono soprattutto modelli economici sui vaccini antinfluenzali. Diversi studi hanno sottolineato che l’impatto economico della vaccinazione antinfluenzale dovrebbe incorporare i benefici sanitari e non sanitari della vaccinazione, sia nella popolazione vaccinata che in quella non vaccinata, consentendo così di stimare anche il valore sociale della stessa. Per la valutazione economica dei vaccini antinfluenzali, così come degli altri vaccini, i modelli economici di tipo dinamico dovrebbero avere la priorità rispetto ai modelli statici poiché questi ultimi solitamente sottostimano l’efficacia e il rapporto di costo-efficacia dei programmi di immunizzazione, in quanto ne sottovalutano gli effetti indiretti. Pertanto, i decisori sanitari e i responsabili politici dovrebbero essere informati dei limiti delle valutazioni economiche classiche per valutare il valore dei vaccini, e le future valutazioni economiche dovrebbero prestare maggiore attenzione all’effetto della vaccinazione sulla prevenzione delle complicanze, sulla generazione di vantaggi per la salute degli operatori sanitari e sui benefici per la comunità al di là della protezione individuale. Sono necessarie, quindi, linee guida per la valutazione economica del pieno valore delle vaccinazioni e le valutazioni economiche dovranno essere condotte tenendo anche conto della prospettiva sociale oltre che di quella del sistema sanitario, al fine di sottolineare e documentare il pieno valore dei vaccini. Inoltre, nel valutare il valore economico dei vaccini, i decisori dovrebbero adottare una prospettiva sociale completa che tenga anche conto dell’impatto fiscale della malattia infettiva prevenibile da vaccino.
Un altro pilastro molto rilevante è stato quello del valore sociale della vaccinazione antinfluenzale, indagato, soprattutto, come benessere per la popolazione e come protezione indiretta della collettività. Riconoscere le conseguenze più ampie dell’infezione influenzale, anche tendendo conto delle conseguenze per la società e per la popolazione generale, è essenziale per determinare l’intero burden dell’influenza nelle diverse sottopopolazioni e per valutare il valore complessivo degli interventi di prevenzione, ivi compresa la vaccinazione. Secondo la prospettiva del valore sociale della vaccinazione antinfluenzale particolare attenzione è stata posta alla protezione degli anziani e dei più fragili. Inoltre, anche l’implementazione della vaccinazione antinfluenzale degli operatori sanitari e delle persone che sono in contatto con gli anziani è stata indicata come azione fondamentale per migliorare la protezione della collettività.
Altro valore fondamentale della vaccinazione antinfluenzale è quello personale, affrontato solo nel 32% degli studi inclusi nella nostra revisione sistematica. Il valore personale è stato sottolineato, soprattutto, in rapporto ai benefici individuali sugli outcome clinici legati alla vaccinazione e al coinvolgimento/empowerment dei cittadini. Infine, solo il 20% degli studi inclusi ha affrontato il tema del valore allocativo, in termini di accessibilità ed equità di accesso alla vaccinazione antinfluenzale. Questo risultato richiama l’attenzione sulla necessità di sviluppare ulteriori ricerche su questa dimensione del valore, rilevante sia per i sistemi sanitari che per i cittadini.
Sulla base di quanto emerso dalla nostra revisione, risulta evidente l’esigenza di prendere in esame una strategia value-based di immunizzazione che si avvalga della divulgazione delle evidenze scientifiche sul valore complessivo della vaccinazione antinfluenzale, nonché della disamina del valore più ampio e, quindi, personale, tecnico, allocativo e sociale, di questa vaccinazione.
Rispetto al tradizionale vaccino prodotto su uova, il vaccino antinfluenzale ottenuto da colture cellulari utilizza virus influenzali cresciuti nelle cellule dei mammiferi anziché nelle uova. Ciò è vantaggioso poiché la produzione non si basa sulla fornitura di uova, consentendo un processo più rapido, particolarmente utile in caso di pandemia influenzale. Inoltre, il vaccino coltivato su cellule potrebbe evitare le mutazioni causate dall’adattamento alle uova offrendo una maggiore efficacia del vaccino.
Dal reassessment condotto nell’ambito del presente report di HTA, emerge che il vaccino Flucelvax Tetra® è immunogenico, efficace e sicuro nei soggetti di età 2-64 anni in cui induce una ottima risposta anticorpale contro i 4 ceppi dell’influenza.
Inoltre, l’introduzione in Italia di QIVc nei soggetti di età compresa fra 2-64 anni risulta altamente costo-efficace o cost-saving (dominante) in entrambe le prospettive utilizzate per l’analisi (SSN o società) e/o della fascia di età.
Dal punto di vista etico, i vantaggi in termini di guadagno di salute, miglioramento della qualità di vita e riduzione dei livelli di morbilità/mortalità suggeriscono l’utilizzo di questa tecnologia sanitaria a partire dai 2 anni di età e fino ai 64 anni di età, consentendone l’accesso gratuito su tutto il territorio nazionale.
Questo lavoro di reassessment dimostra, quindi, come Flucelvax Tetra® possa rappresentare una scelta evidence-based e value-based per la vaccinazione antinfluenzale nella popolazione pediatrica, adolescenziale e adulta italiana.