Abstract
探讨胸部SMARCA4缺失性未分化肿瘤(SMARCA4-deficient undifferentiated tumor,SMARCA4-UT)的临床病理特点和治疗策略。SMARCA4-UT是2021版《世界卫生组织胸部肿瘤分类》中的新类型,各科医生对其诊断、治疗、预后等问题均较为陌生。本次多学科研讨会以北京大学第一医院收治的1例胸部SMARCA4-UT为例,集中研讨了该类肿瘤的病理诊断、分子检测、治疗相关分子靶点、免疫检验点抑制剂治疗以及新辅助治疗反应的病理学评估等问题。患者为老年男性,有长期吸烟史,以右肺下叶实性肿瘤快速进展入院。病理学检测,肿瘤细胞上皮样,组织结构上无任何分化特点;免疫组织化学染色显示,CD34弥漫阳性,SALL4部分细胞阳性,SMARCA4基因编码的蛋白BRG1表达缺失;二代测序证实,肿瘤存在SMARCA4基因突变(c.2196T>G,p.Y732Ter)。综上,病理诊断符合胸部SMARCA4-UT。术前TNM分期为T1N2M0(ⅢA)。程序性细胞死亡1-配体1(programmed cell death 1-ligand 1, PD-L1,克隆号SP263)抗体免疫组化染色显示,阳性肿瘤细胞比例评分(tumor proportion score,TPS)为2%。肿瘤突变负荷(tumor mutation burden, TMB)检测结果为16.3/Mb, 微卫星检测结果为微卫星稳定型(microsatellite stability, MSS)。经化疗联合免疫检测点抑制剂新辅助治疗两周后,行胸腔镜下右肺下叶切除术。术后新辅助治疗反应的病理学评估结果为病理学完全缓解(complete pathologic response,CPR),新辅助治疗后病理学分期为ypT0N0M0。术后完成了5周期化疗联合免疫检测点抑制剂辅助治疗。随访截止2022年10月,肿瘤无复发、转移,微小残留病灶(minimal residual disease,MRD)检测阴性。目前认为, 只要BRG1免疫组织化学染色阴性,无论是否检测到SMARCA4基因突变,均可归入SMARCA4缺失性肿瘤,SMARCA4缺失性肿瘤包括多种癌和肉瘤。SMARCA4-UT的诊断,除了BRG1表达缺失以外,还必须具备相应的组织形态,并排除其他伴有BRG1表达缺失的鳞癌、腺癌、大细胞癌等胸部常见恶性肿瘤。SMARCA4-UT恶性度高、总体预后差,几乎没有靶向治疗驱动基因突变,化疗效果差,而免疫检测点抑制剂是目前唯一显示疗效的药物。本病例是SMARCA4-UT病理诊断、分子检测和免疫检测点抑制剂治疗的一个成功案例,对于所有SMARCA4缺失性肿瘤的诊治都有启发意义。
Keywords: 胸部SMARCA4缺失性未分化肿瘤, 程序性细胞死亡1-配体1, 肿瘤突变负荷, 免疫检验点抑制剂, 新辅助治疗, 病理学评估
Abstract
We explored clinicopathological features and treatment strategies for thoracic SMARCA4-deficient undifferentiated tumor (SMARCA4-UT). Thoracic SMARCA4-UT is a new entity recently acknowledged in the 2021 edition of World Health Organization Classification of Thoracic Tumors, and doctors are relatively unfamiliar with its diagnosis, treatment, and prognosis. Taking a case of SMARCA4-UT treated in Peking University First Hospital as an example, this multi-disciplinary discussion covered several hot issues on diagnosing and treating thoracic SMARCA4-UT, including histological features, immu- nohistochemical and molecular phenotype, immune checkpoint inhibitor (ICI) therapy, and pathological assessment of neoadjuvant therapy response. The patient was an older man with a long history of smoking and was admitted due to a rapidly progressing solid tumor in the lower lobe of the right lung. Histologically, tumor cells were epithelioid, undifferentiated, diffusely positive for CD34, and partially positive for SALL4.The expression of BRG1 protein encoded by SMARCA4 gene was lost in all of tumor cells, and next-generation sequencing(NGS)confirmed SMARCA4 gene mutation (c.2196T>G, p.Y732Ter). The pathological diagnosis reached as thoracic SMARCA4-UT, and the preoperative TNM stage was T1N2M0 (ⅢA). Tumor proportion score (TPS) detected by immunohistochemistry of programmed cell death 1-ligand 1 (PD-L1, clone SP263) was 2%. Tumor mutation burden (TMB) detected by NGS of 1 021 genes was 16. 3/Mb. Microsatellite detection showed the tumor was microsatellite stable (MSS). Neo-adjuvant therapy was implemented with the combined regimen of chemotherapy and ICI. Right lower lobectomy was performed through thoracoscopy after the two weeks' neoadjuvant. The pathologic assessment of lung tumor specimens after neoadjuvant therapy revealed a complete pathological response (CPR). The post-neoadjuvant tumor TNM stage was ypT0N0M0. Then, five cycles of adjuvant therapy were completed. Until October 2022, neither tumor recurrence nor metastasis was detected, and minimal residual disease (MRD) detection was negative. At present, it is believed that if BRG1 immunohistochemical staining is negative, regardless of whether SMARCA4 gene mutation is detected, it should be classified as SMARCA4-deficient tumors. SMARCA4-deficient tumors include a variety of carcinomas and sarcomas. The essential criteria for diagnosing SMARCA4-UT includes loss of BRG1 expression, speci-fic histological morphology, and exclude other common thoracic malignant tumors with SMARCA4-deficiency, such as squamous cell carcinoma, adenocarcinoma and large cell carcinoma. SMARCA4-UT is a very aggressive malignant tumor with a poor prognosis. It has almost no targeted therapy mutations, and little response to chemotherapy, but ICI is currently the only effective drug. The successful diagnosis and treatment for this case of SMARCA4-UT should enlighten significance for various kinds of SMARCA4-deficient tumors.
Keywords: Thoracic SMARCA4-deficient undifferentiated tumor, Programmed cell death 1-ligand 1, Tumor mutation burden, Immune checkpoint inhibitor, Neoadjuvant therapy, Pathological assessment
胸部SMARCA4缺失性未分化肿瘤(thoracic SMARCA4-deficient undifferentiated tumor,SMARCA4-UT)是2021版《世界卫生组织胸部肿瘤分类》中的新类型,定义为一种高级别恶性肿瘤,累及成人胸部,肿瘤组织形态呈未分化或横纹肌细胞样,特征性的免疫表型为BAF染色体调节复合物的关键成员SMARCA4表达缺失[1]。由于该肿瘤罕见,又是新的类型,不仅病理医生容易误诊,临床医生对其生物学行为和处理原则也很陌生。本文通过1例胸部SMARCA4-UT的临床病理讨论,分享北京大学第一医院胸部肿瘤多学科团队在SMARCA4-UT的病理诊断、新辅助治疗策略选择、新辅助治疗后标本的病理学评估、预测免疫检测点抑制剂疗效的生物标记物的临床应用、实验室检测等领域中的实践经验,以期提高各学科医生对该类肿瘤的认识。
1. 病例诊疗经过
患者男性,64岁,半年前无明显诱因间断出现咳嗽、咳痰、痰中带血。2022年1月10日胸部CT:右肺下叶背段条状高密度,与血管分界不清,与邻近下叶背段支气管关系密切,周围见小片状高密度。右肺门见肿大淋巴结,增强可见低强化,纵隔未见肿大淋巴结(图 1)。2022年1月10日行PET-CT: 右肺上叶后段近右肺门处软组织密度肿块,葡萄糖代谢增高,考虑恶性肿瘤;纵隔7区及右肺门多个淋巴结考虑转移。2022年1月10日气管镜检查:于右肺B6支气管内见菜花样新生物阻塞管腔,遂取材一块送病理检查;纵隔淋巴结4站、7站、11站分别经超声支气管镜取活检送病理。
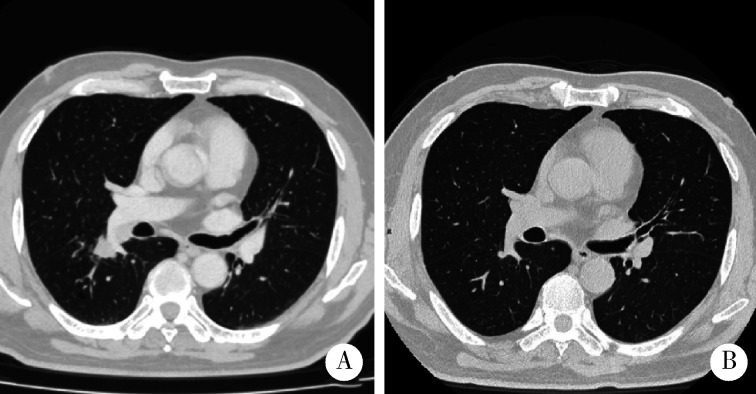
图 1.
新辅助治疗前后胸部CT对比
Comparison of chest CT before and after neoadjuvant therapy
A, chest CT before neoadjuvant therapy: mass in the lower lobe of the right lung was closely related to the bronchi and enlarged lymph nodes were seen in the right hilar; B, chest CT after neoadjuvant therapy: the primary tumor and lymph nodes significantly reduced.
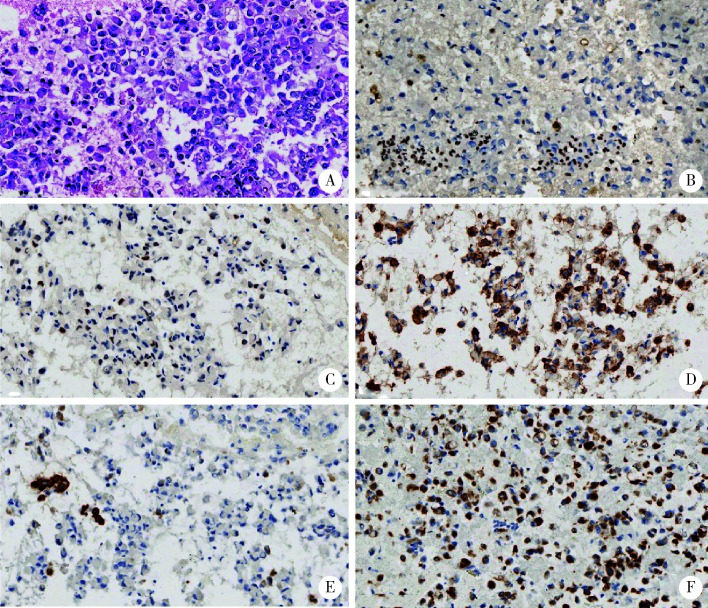
肿瘤活检病理:肿瘤组织片状,细胞黏附性差,上皮样,形态相对单一,胞浆红染,核偏位,呈横纹肌样,核空泡状,核仁明显,大量核分裂象。免疫组织化学检测结果:标记物CK(AE1/AE3)、CK19、CK7、CK5/6、P40、TTF-1、CD56、CgA、Syn、NUT、α-inhibin、Desmin、MyoD1、Myogenin、SOX10、S-100、Melan-A、HMB45、CD31、LCA、CD68、CD1α、Langerin均为阴性;标记物Vimentin、CD34、SALL4、INI-1均为阳性;标记物BRG1阴性(图 2)。病理诊断:胸部SMARCA4-UT。淋巴结超声支气管镜活检病理:4站未见肿瘤,7站可见肿瘤,11站可见肿瘤。术前TNM分期为T1N2M0(ⅢA)。1 021个基因二代测序(next-generation sequencing,NGS)结果:SMARCA4突变(c.2196T>G,p.Y732Ter),无其他驱动基因突变,肿瘤突变负荷(tumor mutation burden, TMB)为16.3/Mb,微卫星状态为微卫星稳定型(microsatellite stability, MSS)。单克隆抗体程序性细胞死亡1-配体1(programmed cell death 1-ligand 1, PD-L1,克隆号SP263)免疫组织化学检测,阳性肿瘤细胞评分(tumor proportion score,TPS)为2%。
图 2.
活检标本组织形态和免疫表型
Histological morphology and immunophenotype of biopsy
A, tumor consist of diffuse sheets of variably discohesive, large round to epithelioid cells with vesicular chromatin and prominent nucleoli(HE ×200);B, tumor cells are completely negative for BRG1(IHC ×200); C, tumor cells are partially positive for SALL4 (IHC ×200); D, tumor cells are diffusely positive for CD34 (IHC ×200); E, tumor cells are completely negative for CK (AE1/AE3) (IHC ×200); F, tumor cells are diffusely positive for Vimentin (IHC ×200).
术前新辅助及手术治疗:2022年1月17日开始化疗联合免疫检测点抑制剂治疗(帕博利珠单抗200 mg+卡铂注射液500 mg+依托泊苷注射液190 mg),第1、第2周期后,于2022年2月23日复查胸部CT:右肺下叶原发病灶、淋巴结均明显缩小(图 1)。于2022年3月4日行胸腔镜下右肺下叶切除术。
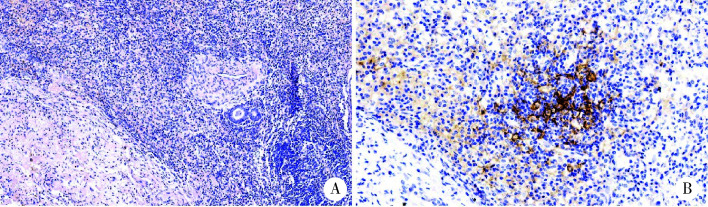
术后病理:右肺下叶切除标本,新辅助治疗反应的病理学评估结果为,健活肿瘤细胞占比0%,间质成分占比100%(可见大量淋巴细胞浸润,淋巴滤泡形成,泡沫细胞聚集),坏死成分占比0%,提示为新辅助治疗后病理学完全缓解(complete pathologic response,CPR),瘤床最大径10 mm;PD-L1免疫组化染色,阳性炎细胞数占全部瘤床内炎细胞数的百分比为30%(图 3)。淋巴结病理检查结果:叶支气管周0/1及另送(第11组)0/1、(中叶支气管旁)0/4、(第7组)0/3、(左侧第10组)0/1、(上腔静脉旁)0/1、(3A)0/2、(第2、4组)0/6均未见肿瘤转移。新辅助治疗后病理学分期为ypT0N0M0。
图 3.
新辅助治疗后切除标本组织形态及免疫细胞PD-L1免疫组织化学染色
Histological morphology of resected sample after neoadjuvant and PD-L1 immunostaining of immune cells in the resected sample
A, pathological assessment after neoadjuvant therapy is complete pathologic response(HE ×200);B, percentage of PD-L1 positive immune cells was 30% (IHC ×200). PD-L1, programmed cell death 1-ligand 1.
术后治疗经过:2022年4月2日开始,完成了第3、4、5、6、7周期化疗联合免疫检测点抑制剂辅助治疗,具体方案同前。
随访:截止2022年10月,肿瘤无复发、转移,分别于2022年6月14日及10月21日行微小残留病灶(minimal residual disease,MRD)检测,均为阴性。
2. 多学科讨论
病理科熊焰主任医师:本例患者为老年男性,有长期吸烟史,肺内实性肿瘤,进展快;肿瘤细胞上皮样,黏附性差,组织结构上无任何分化特点;免疫组化检测显示,BRG1表达缺失,CD34弥漫阳性,SALL4部分细胞阳性,胸部常见癌、肉瘤、恶性黑色素瘤及淋巴造血系统肿瘤的标记均为阴性,符合胸部SMARCA4-UT的病理诊断标准。BRG1表达缺失可见于多种肺内原发性恶性肿瘤,其发生率在SMARCA4-UT为100%,而在小细胞癌、腺癌、鳞状细胞癌、大细胞癌和大细胞神经内分泌癌的发生率则为5%~15%[2]。SMARCA4-UT的诊断除了BRG1的表达缺失以外,还必须具备组织形态和其他免疫标记的特点,不可将伴有BRG1缺失的其他非小细胞肺癌,尤其是大细胞癌,误诊为SMARCA4-UT。本病例的肿瘤细胞呈上皮样,形态大小相对一致,黏附性差,无特定排列,具备SMARCA4-UT的组织形态特点;免疫标记P40和TTF-1均阴性,排除鳞癌和腺癌;一系列CK标记均为阴性,排除大细胞癌;神经内分泌标记均为阴性,排除神经内分泌癌;横纹肌细胞、黑色素细胞、血管内皮细胞、神经鞘细胞分化的标记均阴性,排除横纹肌肉瘤、恶性黑色素瘤、血管肉瘤和恶性外周神经鞘瘤等常见上皮样形态的肉瘤;免疫标记INI-1无表达缺失,排除上皮样肉瘤;一系列淋巴造血系统细胞分化的标记阴性,则排除了淋巴瘤和组织细胞肉瘤;BRG1表达缺失、CD34和SALL4阳性,则完全符合SMARCA4-UT特征性的免疫表型。综上,SMARCA4-UT的诊断成立。
病理科张波教授:胸部SMARCA4-UT是2021版《世界卫生组织胸部肿瘤分类》的新类型。SMARCA4基因位于19p13.2,编码蛋白BRG1,具有ATP酶活性,属于BAF染色体调节复合物的重要成员,从而在DNA复制和修复、细胞分裂和分化等重要细胞生物学功能中发挥调节作用。SMARCA4基因突变导致的蛋白BRG1活性改变可使BAF复合物功能障碍,从而改变染色质表观遗传学修饰、DNA损伤修复缺陷以及代谢改变。SMARCA4基因无义、移码突变,以及缺失均可导致肿瘤细胞BRG1表达缺失[3]。目前认为只要BRG1免疫组化染色阴性,无论是否检测到SMARCA4基因突变,均可归入SMARCA4缺失性肿瘤。SMARCA4缺失性肿瘤包括多种癌和肉瘤,其中有些肿瘤的基因突变发生在体细胞,有些则发生在生殖细胞。胸部SMARCA4-UT的基因改变均发生在体细胞,检测手段有免疫组织化学及分子生物学技术。本例患者为SMARCA4无义突变和BRG1蛋白表达缺失,为典型的失活改变。SMARCA4基因突变为这类肿瘤的治疗提供了多种策略的可能,其中部分SMARCA4基因突变肿瘤显示高的PD-L1表达或高TMB指数,为免疫检验点抑制剂治疗提供了依据,其他治疗策略还包括SMARCA2抑制剂、表观遗传学基因抑制剂,以及代谢相关抑制剂的应用,都在研究和积累之中[4]。
呼吸科聂立功主任医师: SMARCA4-UT的总体预后差,完全中位生存期仅4~7个月,几乎没有靶基因突变,化疗效果差,其治疗策略尚处于探索阶段。文献报道[5],部分病例免疫检验点抑制剂治疗有效,获益的病例既有PD-L1高表达/高TMB者, 也有PD-L1低表达/低TMB者,本病例PD-L1低表达/高TMB,化疗联合免疫检测点抑制剂治疗获得CPR的疗效,治疗效果令人鼓舞。结合本病例的经验和文献报道[5]推测,免疫检测点抑制剂有望成为SMARCA4-UT的标准治疗策略,但现有病例数太少,形成共识还有待积累更多病例开展严谨科学的临床研究。除了免疫检验点抑制剂外,还有其他治疗策略尚处于探索阶段,文献报道[6], 将BET抑制剂用于SMARCA4缺失性食管癌动物模型,获得了可靠的疗效;向活跃增殖的胸部SMARCA4-UT肿瘤细胞系注入EZH2抑制剂,可导致增生细胞大面积死亡;将HDAC抑制剂作用于SMARCA4缺失性卵巢高血钙性小细胞癌,可有效抑制肿瘤细胞的生长, 这些研究虽然都还处于临床前的阶段,但对我们探索胸部SMARCA4-UT的治疗仍有一定的启发。
病理科邸吉廷医师:新辅助治疗后手术切除肺部标本的病理学评估,是病理科医生面临的新问题。2020年世界肺癌研究协会推荐的《新辅助治疗肺癌手术切除标本病理学评估指南》,对该类标本从取材到组织形态学观察、病理诊断和报告书写给出了详细而全面的规范,不仅在世界范围内统一了病理医生的医疗行为,也为临床试验和临床实践中评估药物疗效提供了客观的依据,一经在临床中应用,即受到广大临床医生的欢迎。该指南的核心为计算残留健活肿瘤细胞面积占瘤床面积的百分比(residual viable tumor, RVT), 将RVT等于0%定义为CPR,RVT大于0%小于等于10%定义为主要病理反应(major pathological response,MPR),CPR和MPR统称为治疗有效。在该评估体系中,肿瘤床特指治疗前肿瘤占据的空间。该指南在新辅助化疗和靶向治疗患者的评估中均显示出很好的临床参考价值,但在新辅助免疫治疗的评估中则面临着几个问题:(1) 部分新辅助免疫治疗后的患者出现假进展,导致术后标本中肿瘤床的面积比治疗前影像测量的肿瘤体积还大,计算RVT时,分母采用哪个值?(2)在RVT数值处于同一数量级的情况下,间质内淋巴细胞密集浸润,淋巴滤泡形成,是否具有预后意义,这一组织形态学因素是否需要纳入新辅助免疫治疗反应的评估体系?这些都有待进一步的研究[7]。
胸外科赵虎副主任医师:新辅助免疫治疗胸部恶性肿瘤是近年来肺癌治疗领域的主要进展之一。新辅助治疗一方面能评估药物的治疗反应,另一方面,如果治疗有效,不仅可缩小原发灶和转移淋巴结,降低肿瘤期别,提高原发肿瘤的可切除性,还能治疗微转移灶,因此,可使这部分患者在获得手术切除机会的基础上,进而有望获得更长的生存期。化疗联合免疫检测点抑制剂新辅助治疗与既往单纯化疗新辅助治疗相比,有更高的CPR和MPR率,患者更有可能获得更长的生存期[8]。目前,美国《国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南》推荐,部分ⅡB~Ⅲ期的肺癌患者是接受新辅助治疗的适应人群,作为胸外科医生,更倾向于对ⅢA及部分ⅢB期患者采用新辅助免疫治疗。在临床应用中,应该注意到,除了药物的直接毒副作用、增加手术并发症外,新辅助免疫治疗还可能产生明显的免疫相关副反应,从而影响到患者的后续治疗;另外,由于新辅助治疗为术前实施,对于未能从治疗中获益的患者,可能面临更为困难的治疗局面和预后,因此,在治疗前准确且充分的组织病理和分子病理诊断、临床分期等,对于制定合适的新辅助治疗方案是非常重要的也是必需的。本病例患者通过一个标准的临床、组织病理、分子病理诊断过程获得准确而且充分的术前评估,并以此为依据确定化疗联合免疫检测点抑制剂的新辅助治疗方案,治疗后达到影像学部分缓解(partial response, PR);之后完成完全手术切除,术后病理证实为CPR;手术后继续完成辅助治疗疗程,至今无复发、转移, MRD检测阴性。这个病例是胸部恶性肿瘤新辅助治疗的成功案例,经验值得学习总结。
肿瘤科吴世凯主任医师:目前较为确定的预测免疫检测点抑制剂疗效的生物标志物为PD-L1、TMB和MSI,其中获得美国食品药品监督局批准用于泛肿瘤免疫检测点抑制剂治疗筛选患者的则只有高度MSI,但高度MSI在NSCLC患者中发生率极低,作用有限,而PD-L1表达和高TMB在预测NSCLC新辅助免疫治疗中的价值存在较大争议,不同的研究得到了不同的结果。究其原因,除了所选药物种类不同、联合化疗方案不同、治疗窗口期的选择不同等因素可能导致结果不同外,PD-L1和TMB检测中的问题也是原因之一,如不同实验室、不同抗体、不同平台PD-L1检测结果的一致性如何,是否可以互认?高TMB的临界值定义始终存在争议等,因此,PD-L1表达和高TMB目前均未成为NSCLC新辅助免疫治疗中广泛选择的预测标志物。具体到本病例,高TMB预测到了SMARCA4-UT对免疫检测点抑制剂良好的反应,这与其他SMARCA4缺失性肿瘤的研究结果一致,可能与肿瘤基因组高度突变有关[9]。
病理科李东技师:免疫组织化学染色是检测肿瘤细胞PD-L1表达的唯一手段。目前国家药品监督管理局批准,作为非小细胞肺癌患者PD-1/PD-L1抑制剂治疗的伴随诊断的抗体共有五种,进口的有美国安捷伦公司的22C3、28-8和罗氏诊断公司的SP263;国产的有厦门艾德公司的E1L3N和苏州迈杰公司的E1L3N。基于文献[10]和我们的实践经验,22C3、SP263、E1L3N三者的一致性好,E1L3N和SP263两者的一致性非常好。本病例行PD-L1免疫组织化学染色,一抗采用的是SP263,用罗氏Ventana Benchmark GX平台完成,细胞系阴性和阳性对照、试剂阴性对照和胎盘组织阳性对照均合格;术前活检标本的染色切片内,肿瘤细胞数大于200个,背景干净,阳性信号定位于细胞膜,中等强度。综上,该病例PD-L1免疫组化染色质控合格,检测结果可信。
3. 体会与思考
SMARCA4-UT诊断:目前认为只要BRG1免疫组织化学染色阴性,无论是否检测到SMARCA4基因突变,均可归入SMARCA4缺失性肿瘤。SMARCA4缺失性肿瘤包括多种癌和肉瘤。SMARCA4-UT的诊断除了BRG1表达缺失以外,还必须具备相应的组织形态,并排除其他伴有BRG1表达缺失的鳞癌、腺癌、大细胞癌等胸部常见恶性肿瘤。
SMARCA4-UT治疗:SMARCA4-UT的总体预后差,具有治疗作用的靶基因突变少,化疗效果差,免疫检测点抑制剂是目前唯一在有限病例中显示疗效的药物,其有效性在新辅助治疗和晚期非手术治疗的患者中均有报道。我们这1例患者经新辅助化疗联合免疫治疗获得了CPR,令我们对免疫治疗在SMARCA4-UT新辅助治疗中的应用充满信心。由于新辅助治疗为术前实施,不可避免地会推迟手术治疗的时间,对患者手术的疗效产生影响,因此,明确新辅助治疗的获益人群是临床实施中需要重点考量的问题。现有证据显示,PD-L1高表达或高TMB均具有提示免疫治疗反应好的意义[11],期待未来的研究成果能为SMARCA4-UT新辅助免疫治疗筛选患者提供更有效的生物标记物。
新辅助治疗后评估:新辅助治疗后手术切除肺部标本的病理学评估,是病理科医生面临的新问题。2020年世界肺癌研究协会推荐的《新辅助治疗肺癌手术切除标本病理学评估指南》,在世界范围内统一了病理医生的医疗行为,也为临床试验和临床实践中评估药物疗效提供了客观的依据。该指南在新辅助化疗和靶向治疗患者的评估中均显示出很好的临床参考价值,但在新辅助免疫治疗的评估中却面临着新的问题,该指南推荐的新辅助免疫治疗反应的评估还有待进一步完善。
Funding Statement
中央高水平医院临床科研业务费-北京大学第一医院院内交叉临床研究专项(2022CR35)
Supported by the National High-Level Hospital Clinical Research Funding-Interdepartmental Clinical Research Project of Peking University First Hospital (2022CR35)
References
- 1.Travis WD, Bubendorf L, Chung JH, et al. Thoracic SMARCA4-deficient undifferentiated tumor. Lyon Cedex, France: International Agency for Research on Cancer (IARC); 2021. pp. 111–114. [Google Scholar]
- 2.Nambirajan A, Jain D. Recent updates in thoracic SMARCA4-deficient undifferentiated tumor. Semin Diagn Pathol. 2021;38(5):83–89. doi: 10.1053/j.semdp.2021.06.001. [DOI] [PubMed] [Google Scholar]
- 3.Mittal P, Roberts CWM. The SWI/SNF complex in cancer: Biology, biomarkers and therapy. Nat Rev Clin Oncol. 2020;17(7):435–448. doi: 10.1038/s41571-020-0357-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Mardinian K, Adashek JJ, Botta GP, et al. SMARCA4: Implications of an altered chromatin-remodeling gene for cancer development and therapy. Mol Cancer Ther. 2021;20(12):2341–2351. doi: 10.1158/1535-7163.MCT-21-0433. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Alessi JV, Ricciuti B, Spurr LF, et al. SMARCA4 and other SWItch/Sucrose NonFermentable family genomic alterations in NSCLC: Clinicopathologic characteristics and outcomes to immune checkpoint inhibition. J Thorac Oncol. 2021;16(7):1176–1187. doi: 10.1016/j.jtho.2021.03.024. [DOI] [PubMed] [Google Scholar]
- 6.Sasaki M, Ogiwara H. Synthetic lethal therapy based on targeting the vulnerability of SWI/SNF chromatin remodeling complex-deficient cancers. Cancer Sci. 2020;111(3):774–782. doi: 10.1111/cas.14311. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Travis WD, Dacic S, Wistuba I, et al. IASLC multidisciplinary recommendations for pathologic assessment of lung cancer resection specimens after neoadjuvant therapy. J Thorac Oncol. 2020;15(5):709–740. doi: 10.1016/j.jtho.2020.01.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Provencio M, Nadal E, Insa A, et al. Neoadjuvant chemotherapy and nivolumab in resectable non small cell lung cancer (NADIM): An open-label, multicentre, single-arm, phase 2 trial. Lancet Oncol. 2020;21(11):1413–1422. doi: 10.1016/S1470-2045(20)30453-8. [DOI] [PubMed] [Google Scholar]
- 9.Liang W, Cai K, Chen C, et al. Expert consensus on neoadjuvant immunotherapy for non small cell lung cancer. Transl Lung Cancer Res. 2020;9(6):2696–2715. doi: 10.21037/tlcr-2020-63. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Downes MR, Slodkowska E, Katabi N, et al. Inter-and intra-observer agreement of programmed death ligand 1 scoring in head and neck squamous cell carcinoma, urothelial carcinoma and breast carcinoma. Histopathology. 2020;76(2):191–200. doi: 10.1111/his.13946. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Brueckl WM, Ficker JH, Zeitler G. Clinically relevant prognostic and predictive markers for immune-checkpoint-inhibitor (ICI) therapy in non-small cell lung cancer (NSCLC) BMC Can-cer. 2020;20(1):1185. doi: 10.1186/s12885-020-07690-8. [DOI] [PMC free article] [PubMed] [Google Scholar]