Abstract
Die Begutachtung von Long-/Post-COVID (PCS) nach einer Infektion mit dem Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) stellt angesichts der vielfältigen und komplexen Beschwerdebilder eine interdisziplinäre Herausforderung dar. Neben der fachspezifischen Beurteilung infektionsbedingter Organschäden liegt die wesentliche Problematik in der gutachtlichen Objektivierung und Kausalitätsbewertung hinsichtlich der vielgestaltigen subjektiven Beschwerdebilder. Die Folgen von Post-COVID werfen versicherungsrechtliche Fragen auf allen Rechtsgebieten auf. Bei anhaltender Einschränkung der Leistungsfähigkeit geht es für die Betroffenen zum einen um die Frage der Erwerbsminderung. Zum anderen spielen bei Beschäftigten im Gesundheitsdienst und in der Wohlfahrtspflege die Fragen der Anerkennung als Berufskrankheit (BK Nr. 3101) bzw. in anderen Branchen oder Arbeitsbereichen die Anerkennung als Arbeitsunfall, einschließlich der jeweiligen Krankheitsfolgen und der Einschätzung der Minderung der Erwerbsfähigkeit (MdE), bedeutsame Rollen. Hierfür sind auf allen Rechtsgebieten gutachtliche Beurteilungen der Erkrankungsfolgen und (insbesondere in der gesetzlichen Unfallversicherung) ihrer Abgrenzung gegenüber Vorerkrankungen oder Schadensanlagen notwendig. Es sollte individuell gemäß den entsprechenden Organmanifestationen in den jeweils betroffenen medizinischen Fachgebieten und bei den häufig komplexen Spätfolgen interdisziplinär begutachtet werden – d. h. beispielhaft bei pulmonaler oder kardialer Manifestation auf internistischem Fachgebiet mit entsprechender Qualifikation, bei neurologisch-psychiatrischer Manifestationen auf neurologischen, psychiatrischen und psychologischen Fachgebiet usw.
Schlüsselwörter: Fatigue, Arbeitsunfälle, Berufskrankheit, Unfallversicherung, Minderung der Erwerbsfähigkeit
Abstract
Assessing long/post-COVID syndrome (PCS) following an infection with severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) is a multidisciplinary challenge due to the diverse and complex symptoms. Besides discipline-specific evaluation of infection-related organ damage, the main issue is expert objectivity and causality assessment regarding subjective symptoms. The consequences of long/PCS raise questions of insurance rights in all fields of law. In cases of persistent impairment of performance, determining reduction in earning capacity is crucial for those affected. Recognition as an occupational disease (BK no. 3101) is vital for employees in healthcare and welfare sectors, along with occupational accident recognition and assessing the illness’s consequences, including the reduction in earning capacity (MdE) in other sectors or work areas. Therefore, expert assessments of illness consequences and differentiation from previous illnesses or damage disposition are necessary in all areas of law, individually based on corresponding organ manifestations in medical fields and interdisciplinarily for complex late sequelae, for instance, by internists with appropriate qualifications for pulmonary or cardiac manifestations and neurologists, psychiatrists, and neuropsychologists for neurological and psychiatric manifestations, etc.
Keywords: Fatigue, Occupational accidents, Occupational disease, Accident insurance, Impairment of earning capacity
Einleitung
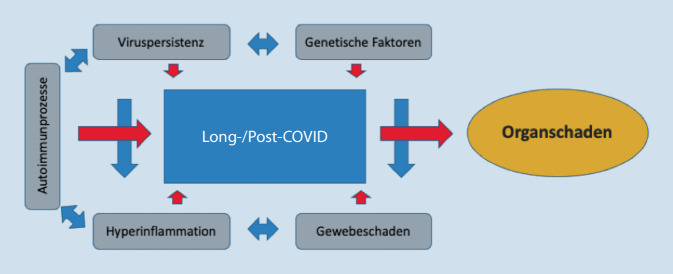
Die weltweite COVID-19-Pandemie, ausgelöst durch das Severe Acute Respiratory Syndrome Coronavirus Type 2 (SARS-CoV-2), verursacht seit dem Frühjahr 2020 erhebliche gesundheitliche, gesundheitspolitische und volkswirtschaftliche Belastungen. Es wurde schnell erkannt, dass es sich nicht nur um eine schwere Atemwegsinfektion handelt. Vielmehr führt das Virus mit seinen multiplen Varianten zu teils ausgeprägten Multiorganerkrankungen mit sehr facettenreichen klinischen Manifestationen, Symptomen und Verläufen ([1–3]; Abb. 1).
Hinsichtlich der postviralen Folgen gibt es auch andere Viruserkrankungen, die mit zeitlicher Verzögerung Einschränkungen wie beispielsweise Fatigue, wie beim Epstein-Barr- oder Ebola-Virus bekannt, verursachen. Diese gehen mit protrahierten, lang dauernden klinischen Symptomen und subjektiven Beschwerden nach der akuten Infektionsphase bzw. auch erst Wochen bis Monate nach der primären Erkrankung einher. Infolge von COVID-19 weisen ca. 10–15 % der Erkrankten eine schwere Krankheitssymptomatik auf; von diesen entwickelt wiederum etwa ein Drittel lebensbedrohliche Komplikationen.
Obwohl die meisten der Betroffenen rasch vollständig genesen, verbleibt bei einem prozentual ähnlich großen Kollektiv eine anhaltende und umfangreiche Beschwerdesymptomatik, die unter dem Begriff des „Long-COVID“- bzw. „Post-COVID“-Syndroms subsumiert wird. Die genauen Ursachen für Long/Post-COVID sind bislang nicht bekannt und Gegenstand weltweiter Forschung [1].
Die Experten der AWMF bezeichnen ab einem Zeitraum von 4 Wochen nach einer Infektion in der „S1-Leitlinie Long/Post-COVID“ (Stand 17.08.2022) Long-COVID (LCS) oder postakute Folgen von COVID-19 („post-acute sequelae of COVID-19“), und mit einer Persistenz über 12 Wochen hinaus als PCS. Dies wird in Abb. 2 dargestellt.
Zwischen einem Long-COVID- und einem Post-COVID-Syndrom besteht in der Begrifflichkeit ein fließender Übergang, d. h., dass Post-COVID als über 3 Monate bestehende Problematik unter dem Dachbegriff Long COVID zu verstehen ist. Häufig findet sich eine synonyme Begriffsverwendung, besonders umgangssprachlich.
Als über 3 Monate bestehende Problematik ist Post-COVID unter den Dachbegriff Long COVID einzuordnen
Somatische oder psychosomatische Vorerkrankungen in der Anamnese, aber auch hohe psychosoziale Belastungen begünstigen die Manifestation eines PCS. Die Betroffenen lassen sich grob in 4 Kategorien unterteilen, in diejenigen, die
nach einer notwendigen intensivmedizinischen Behandlung an einem „post-intensive care syndrome“ (PICS) erkranken [5];
erst mit zeitlicher Latenz an teils auch kombinierten Symptomen wie z. B. kardiovaskulären/-pulmonalen Beschwerden, neurokognitiven Beeinträchtigungen bzw. einer posttraumatischen Belastungsstörung leiden,
wegen einer fortdauernden Erschöpfungssymptomatik und Belastungsminderung mit oder ohne Dyspnoe in ihrer Teilhabe am Privat- und am Berufsleben nachhaltig beeinträchtigt sind,
von residualen Beschwerden berichten, die sie in der Lebensführung nicht wesentlich beeinträchtigen.
In der Wertung der Erkrankung bestehen die Herausforderung und Schwierigkeit zugleich, zwischen SARS-CoV-2-bedingten, unmittelbar auftretenden somatischen und psychischen Störungen gegenüber Verstärkungen von Vorerkrankungen sowie pandemiebedingten psychosozialen Belastungsfolgen zu differenzieren. Die zunehmende Erfahrung der Behandler und die Erkenntnisse der weltweit umfangreichen Forschung zu Post-COVID bieten die einzigartige Möglichkeit, sowohl exemplarisch die Langzeitfolgen biopsychosozial umfangreich zu erfassen als auch Behandlungsstrategien zu entwickeln und Begutachtungskriterien festzulegen [6, 7].
Epidemiologie
Weit mehr als 500.000 Anzeigen über den Verdacht auf eine COVID-19 als meldepflichtige Berufskrankheit (BK) Nr. 3101 oder als Arbeitsunfall sind den Trägern der gesetzlichen Unfallversicherung (GUV) seit dem Pandemiebeginn im Jahr 2020 zugegangen. Etwa zwei Drittel davon erfolgten von Versicherten der Berufsgenossenschaft für Wohlfahrtspflege (BGW) und Unfallkassen (bedingt durch die versicherte Klientel). Arbeitsunfälle oder BK sind meldepflichtig, wenn Versicherte länger als 3 Tage arbeitsunfähig werden. Die Meldezahlen sind in den Jahren 2021 und 2022 noch einmal erheblich gestiegen [8, 9].
Sehr häufig berichten PCS-Betroffene von einer krankhaften Erschöpfung, die durch Schlaf und Entspannung nicht zu beheben ist, gleichbedeutend mit „Fatigue“. Diese postinfektiöse Fatigue-Symptomatik tritt gehäuft allerdings auch nach einer Vielzahl anderer Viruserkrankungen wie bei der infektiösen Mononukleose durch das Epstein-Barr-Virus (EBV) sowie nach Infektionen mit dem humanen Herpesvirus (HHV), mit Influenzaviren oder Rickettsien auf [10–12]. Diskutiert wird ursächlich bereits über eine schon nachgewiesene Persistenz des Virus bzw. seiner Virusbestandteile über Wochen und Monate bzw. postinfektiöse Pathomechanismen und fortdauernde strukturelle Endothel- und Gewebeschäden. In diesem Zusammenhang deuten Studienergebnisse auf Läsionen und Veränderungen des Metabolismus entsprechender Hirngebiete als Ursachen sowie infolgedessen behandlungsbedürftige neurokognitive Einschränkungen der Alltagsfunktion und Lebensqualität mit ihrem negativen Einfluss auf die Teilhabe am Sozial- und/oder am Arbeitsleben beim PCS hin [13–16].
Die Inzidenz des PCS schwankt in den Veröffentlichungen erheblich. Begründen lässt sich dies am ehesten mit den häufig nicht miteinander vergleichbaren Studienparametern der Patientenpopulationen und der ermittelten Ergebnisse. Offensichtlich tritt ein PCS unabhängig vom Erkrankungsverlauf sowohl nach schweren als auch nach leichten bzw. sogar bei asymptomatischen klinischen Verläufen, teils mit zeitlicher Verzögerung, auf [1, 17–19].
Die sehr große und vielfältige Bandbreite des PCS betrifft zahlreiche medizinische Fachgebiete
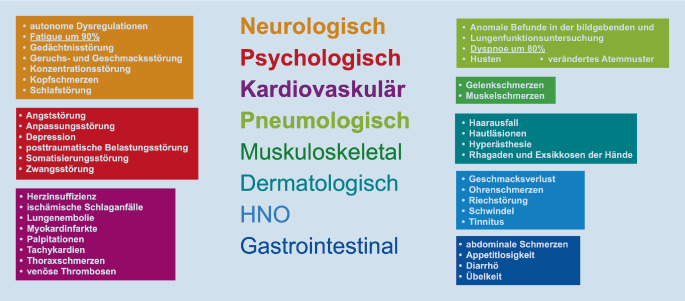
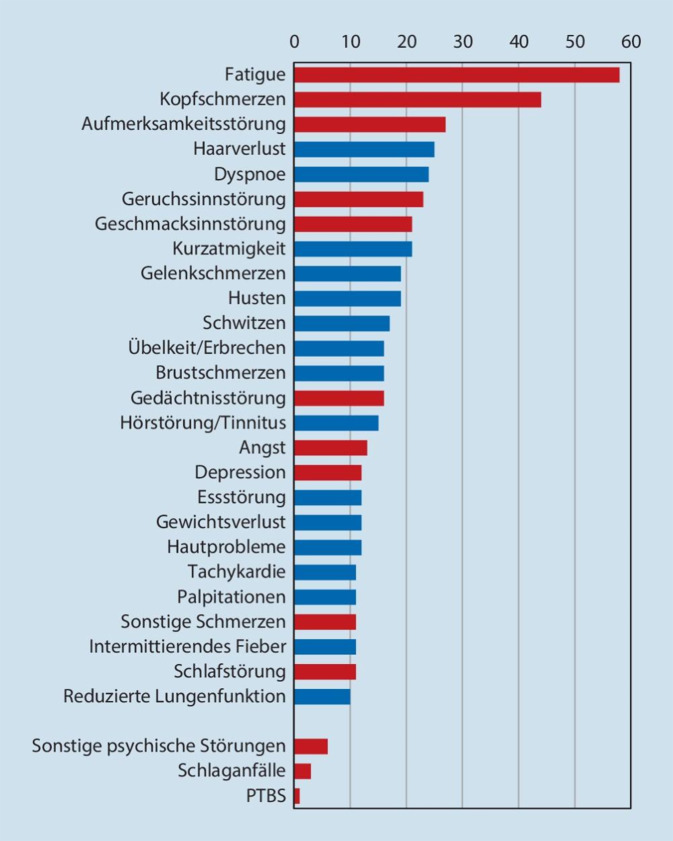
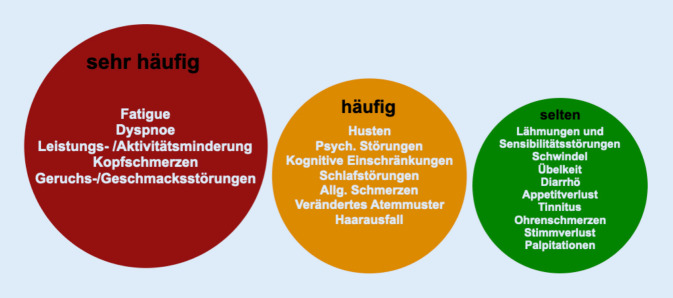
Betrachtet man die gesamte Gruppe der SARS-CoV-2-infizierten Patienten, findet sich bei der überwiegenden Mehrzahl ein milder unkomplizierter Akutverlauf mit vollständiger Ausheilung ohne ein PCS. Soweit ein solches auftritt, ist die Bandbreite der subjektiv beklagten Beschwerden und der klinischen Symptome sehr groß und vielfältig und betrifft letztendlich zahlreiche Fachgebiete der Medizin (Abb. 3 und 4).
Die beispielhafte und keineswegs vollständige Aufzählung der Beschwerden und Symptome lässt erkennen, dass es sich beim PCS für den Gutachter um eine fachübergreifende, interdisziplinäre Herausforderung handelt, bei der dem neurologisch-psychiatrischen und neuropsychologischen Fachgebiet wesentliche Bedeutung zukommt. Trotz facettenreicher subjektiver kardiopulmonaler und neurologischer bzw. neurokognitiver Beschwerden lassen sich im Rahmen der fachspezifischen Diagnostik eher selten und nur nach längerfristigen intensivpflichtigen Verläufen manifeste Organschäden objektivieren.
Bedeutsam ist dies für die Sozialversicherungsträger als Auftraggeber von medizinischen Gutachten zur Feststellung der Folgen einer Infektion, z. B. bei therapieresistenten offensichtlichen Langzeitfolgen im Fall drohender Erwerbsminderung nach Abbruch der beruflichen Wiedereingliederung, der Kürzung der Arbeitszeit oder der Umsetzung auf eine andere Arbeitsstelle. Spätestens mit Auslaufen des Verletztengeldes ist die gutachtliche Beurteilung der haftungsausfüllenden Kausalität offener Fragen hinsichtlich des Gesundheitsfolgeschadens der COVID-19 bzw. des PCS, die eine rentenberechtigende Minderung der Erwerbsfähigkeit (MdE; einschließlich Rehamaßnahmen) begründen können, angezeigt. Im Einzelfall kann es auch notwendig sein, bereits die SARS-CoV-2-Infektion bzw. die haftungsbegründende Kausalität durch ein Gutachten zu klären, u. a., wenn kein positiver PCR-Nachweis im zeitlichen Zusammenhang dokumentiert ist und kein sonstiger Erregernachweis oder keine spezifische „Durchseuchung“ des Arbeitsbereichs beim Betroffenen vorliegt.
Eine Begutachtung ist auch dann begründet, wenn Zweifel am Ursachenzusammenhang zwischen der akuten COVID-19 und dem geltend gemachten Folgeschaden bestehen. Die haftungsausfüllende Kausalität ist regelmäßig zu hinterfragen, wenn nach dem Ausschöpfen aller therapeutischen und rehabilitativen Maßnahmen Beschwerden fortbestehen, sogar im Verlauf zunehmen oder Symptome neu hinzutreten (Abb. 5). Am Ursachenzusammenhang können auch Zweifel bestehen, wenn ein PCS erstmals mit großem zeitlichen Abstand zur akuten COVID-19 auftritt und/oder bedeutsame Vorerkrankungen im Vorerkrankungsverzeichnis der GKV ersichtlich sind ([20–22]; Tab. 1).
| Organbezug | Symptomatik | Differenzialdiagnosen |
|---|---|---|
| Pneumologisch |
Husten Dyspnoe Schlafstörung |
Interstitielle Lungenerkrankung COPD Exazerbiertes/neu aufgetretenes Asthma bronchiale |
| Kardiologisch |
Palpation Hypertonie Tachykardie Belastungsminderung Angina pectoris |
Koronare Herzkrankheit Perimyokarditis Supraventrikuläre Tachykardie Arterielle Hypertonie mit Entgleisung |
| Neurologisch |
Geschmacks‑/Geruchsverlust Kopfschmerz Myoarthralgien Sensibilitätsstörungen Paresen |
Myositiden Guillain-Barré-Syndrom Enzephalitis Apoplex Polyneuropathie |
| Psychiatrisch/neurokognitiv psychosomatisch |
Fatigue Kognitive Defizite Konzentrationsschwäche Angst Panikattacken Depression |
Depression Somatisierungsstörung Angststörung Anpassungsstörung Posttraumatische Belastungsstörung |
COPD „chronic obstructive pulmonary disease“
Welche Prognosen gibt es für die Zukunft? Aus aktuellen Studienergebnissen aus Großbritannien lässt sich ableiten, dass die Wahrscheinlichkeit für die Entwicklung eines PCS nach einer Infektion mit der Omikron-Variante nur etwa halb so hoch ist wie nach derjenigen mit der Delta-Variante (4,5 % vs. 10,8 %). Kumulativ steigt aber auch nach Omikron-Infektionen die Zahl der von Long-COVID betroffenen Patienten [23].
Grundlegende Aspekte der Begutachtung relevanter Symptome und Beschwerden
Eine im Vollbeweis gesicherte SARS-CoV-2-Infektion (mithilfe des PCR-Virus- oder Antikörpernachweises, durch eine infizierte „Indexperson“ oder einer besonders erhöhten Infektionsgefahr im Tätigkeitsumfeld) ist eine Grundvoraussetzung für jede gutachtliche Beurteilung im Rechtsgebiet der GUV. Diese ist grundsätzlich vom Auftraggeber festzustellen. Im zweiten Schritt folgt eine abgeschlossene symptomorientierte Organdiagnostik zur Sicherung bzw. zum weitestgehenden Ausschluss infektionsbedingter Organschäden [24]. Eine vollständige Dokumentation des Krankheitsverlaufs und ein Vorerkrankungsverzeichnis sind für die Bewertung essenziell. Auch dies muss die Verwaltung vorher selbst ermitteln. Im gutachtlichen Kontext muss auch beim PCS die Diagnose im sog. Vollbeweis (fest‑)gestellt werden und sich anschließend die Kausalitätsbeurteilung auf den aktuellen wissenschaftlichen Kenntnisstand stützen. Das ist die originäre Aufgabe der Gutachter. Auch wenn die Folgen einer SARS-CoV-2-Infektion noch nicht vollständig verstanden sind, haben sich grundlegende pathophysiologische Erkenntnisse/Abläufe nicht geändert. Da die klinische Beschwerdesymptomatik auch der COVID-19 in der überwiegenden Mehrzahl der Fälle einen Decrescendo-Verlauf zeigt, muss im gutachtlichen Kontext bei einer anderen Verlaufsdynamik diese diskutiert und kritisch bewertet werden.
Kausalitätsbeurteilungen müssen sich auf den aktuellen wissenschaftlichen Erkenntnisstand stützen
Da Erfahrungen hinsichtlich des PCS-Langzeitverlaufs bislang nicht vorliegen, sollte bei der Feststellung manifester Funktionsstörungen eine Nachbegutachtung in geeignetem Abstand (nach etwa einem Jahr bis 2 Jahren) empfohlen werden. Der stetig wachsende wissenschaftliche Erkenntnisgewinn anhand valider neuerer Studienergebnisse zu den Folgen der SARS-CoV-2-lnfektion und des PCS verlangt die fortwährende Anpassung der dargestellten Eckpunkte als Stellräder der gutachtlichen Bewertung des PCS. Dies stellt den von der Rechtsprechung geforderten „aktuellen wissenschaftlichen Erkenntnisstand“ dar.
Auch wenn nicht alle Erkrankungen schwere oder lang anhaltende Verläufe verursachen, hat die Deutsche Gesetzliche Unfallversicherung (DGUV) über die BGW Handlungsempfehlungen zur Prozesssteuerung 2021 entwickelt, um eine Orientierung in Fällen, die die Sachbearbeitung keiner Fachdisziplin zuordnen kann oder in denen mehrere Symptome leitend sind, zu erreichen. Im Rahmen der ambulanten Post-COVID-Sprechstunden und des stationären Post-COVID-Checks der BG-Kliniken ergeben sich bei vielen anerkannten Versicherten aufgrund von Post-COVID erhebliche Schwierigkeiten, die vor dem Erkrankungsbeginn ausgeübte Tätigkeit wieder wettbewerbsfähig mit einer Arbeitsfähigkeit vor Ablauf der 78. Woche und Wegfall des Verletztengeldes aufzunehmen. In vielen Fällen stehen Rentenbegutachtungen nach den Kriterien der DGUV zum Zusammenhang oder auch zur Erfassung der Folgen der Erkrankungen und deren Einschätzung hinsichtlich der (vorübergehenden?) MdE an. Erfahrungswerte für die teils komplexen Fälle fehlen noch vollständig [21, 22].
Eine Begutachtung ist bei einer COVID-19-Infektion zur Beurteilung der Folgeschäden des PCS und der haftungsausfüllenden Kausalität angezeigt. Aufgrund der großen Zahl an COVID-19-Betroffenen ist auch bei vorsichtiger Schätzung der Häufigkeit des PCS ein hoher Prozentsatz an Betroffenen mit gravierenden medizinischen Folgen zu erwarten, insbesondere im Bereich der Berufstätigen im Gesundheitsdienst, in der Wohlfahrtspflege oder in Laboren, die einer erhöhten Infektionsgefahr ausgesetzt sind. Aus diesem Grund werden auf alle Rechtsgebiete, insbesondere die GUV, aber auch die gesetzliche Rentenversicherung, in zunehmender Häufigkeit gutachtliche Anforderungen zukommen. Grundsätzlich gilt, dass der Antragsteller die Tatsachen (Erkrankung und ihre Folgen) nachweisen muss (objektive Beweislast), um einen Anspruch auf Versicherungsleistungen zu haben [20].
Post-COVID-Syndrome als Versicherungsfälle in der gesetzlichen Unfallversicherung
Je nach Art der beruflichen Tätigkeit, die unter den Versicherungsschutz der GUV fällt, kann COVID-19 infolge einer Infektion mit SARS-CoV‑2 entweder als BK oder als Arbeitsunfall anerkannt werden. Eine BK „Infektionskrankheit“ nach § 9 Abs. 1 Siebtes Buch Sozialgesetzbuch (SGB VII) in Verbindung mit Nr. 3101 der Anlage 1 zur Berufskrankheitenverordnung (BK-Nr. 3101) kommt in Betracht, wenn die betroffene Person im Gesundheitsdienst, in der Wohlfahrtspflege oder in einem Laboratorium tätig ist oder durch eine andere Tätigkeit der Infektionsgefahr „in ähnlichem Maße besonders ausgesetzt war“ und bei ihr eine Erkrankung durch eine „SARS-CoV-2-lnfektion“ im Vollbeweis während der beruflichen Tätigkeit nachgewiesen ist [20–22]. In etwa einem Viertel der Fälle kann eine COVID-19 auch einen Arbeitsunfall darstellen, wobei dieser definitionsgemäß den Nachweis eines Erregerkontakts („Unfallereignis“) während einer Arbeitsschicht voraussetzt. Hier wird die konkrete Übertragung des Virus im Rahmen der beruflichen Tätigkeit derzeit durch eine infizierte „Indexperson“ gefordert. Ist die SARS-CoV-2-lnfektion als beruflicher Gesundheits(erst)schaden nachgewiesen, ist auch die nachfolgende Symptomatik als Gesundheitsfolgeschaden im „Vollbeweis“ zu sichern. Das heißt, die Folgen müssen medizinisch als „Diagnosen“ (ICD-10 oder DSM-5) tatsächlich feststellbar sein. Für den ursächlichen Zusammenhang zwischen der Infektion und den Folgeerkrankungen genügt im Bereich der GUV die hinreichende Wahrscheinlichkeit. Dies bedeutet, dass unter Berücksichtigung von Vorerkrankungen oder anderer konkurrierender Ursachen bei der medizinischen Abwägung mehr für einen Zusammenhang sprechen muss als dagegen, den versicherten Umständen also ein deutliches Übergewicht zukommt. Im Einzelfall kann es für den Versicherungsträger notwendig sein, die SARS-CoV-2-Infektion bzw. die haftungsbegründende Kausalität durch ein Gutachten zu klären, wenn z. B kein positiver PCR-Nachweis vorliegt und kein sonstiger Erregernachweis erhoben werden konnte.
Der Zeitpunkt der Rentenbegutachtung zur Feststellung des Folgeschadens und zur MdE-Einschätzung wird auch nach der Ausschöpfung aller geeigneten therapeutischen und rehabilitativen Maßnahmen im häufig prolongierten und sehr schwierigen Heilverfahren nicht zwangsläufig mit Ablauf der 78. Woche ausgelöst. Eine Rentenbegutachtung erfolgt erst, wenn sich medizinische Hinweise darauf ergeben, dass mit einem Eintritt der Arbeitsfähigkeit der versicherten Person aufgrund der besonderen Schwere des PCS nicht zu mehr rechnen ist und Leistungen zur Teilhabe am Arbeitsleben nicht mehr zu erbringen sind [10].
Gutachtliche direkte und indirekte Objektivierung des Zusammenhangs
In Zweifelsfällen an der beruflichen Verursachung und den geltend gemachten Erkrankungsfolgen bedarf es im Bereich der GUV der Klärung der Kausalitätsfragen über eine gutachtliche direkt bzw. indirekte Objektivierung der Sachverhalte bzw. Indizien.
Als direkte Objektivierung wird aufgefasst, dass der dokumentierte klinische Verlauf mit seinen bildgebenden und messtechnischen Befunden (z. B. elektrophysiologische und Laboruntersuchungen) gemäß allgemeiner medizinischer Erfahrung und aktueller Literatur klare Rückschlüsse und damit den Zusammenhang auf bestehende Funktionsstörungen zulässt.
Die indirekte Objektivierung erfasst die geklagten Beeinträchtigungen, die vorwiegend subjektiven Angaben der Probanden (z. B. Fatigue). Ergibt sich hieraus ein schlüssiges Bild, können diese im Sinne eines „Indizienbeweises“ (Anknüpfungstatsache) als tatsächlich bestehende Funktionsbeeinträchtigungen nach der ärztlichen Erfahrung bewertet und eingeordnet werden. Dieser Nachweis erfordert stets eine umfassende Beschwerdenvalidierung im Abgleich von Aktenlage, Untersuchung, Beobachtung und feststellbaren klinischen Befunden, ergänzt durch Auszüge aus dem Vorerkrankungsverzeichnis [9, 20–22].
Auswahl der Fachgebiete zur Begutachtung
Das PCS erfordert aufgrund der Bandbreite der klinischen Symptome eine fachübergreifende, interdisziplinäre Begutachtung, die wegen der Häufigkeitsverteilung in erster Linie dem neurologisch-psychiatrischen und neuropsychologischen sowie in zweiter Linie dem pneumologischen bzw. kardiologischen Fachgebiet (und anderen medizinischen Fachgebieten) in Abgrenzung zu konkurrierenden Ursachenfaktoren zuzuordnen ist. Im Vordergrund stehen das Fatigue-Syndrom, neurokognitive und psychische Störungen, Dyspnoe und Herzrhythmusstörungen. Besondere Bedeutung kommt den Fällen mit schwerem akuten Verlauf, z. B. mit Langzeitbeatmung, thrombembolischen und kardialen Komplikationen sowie spezifischen organischen Folgen nach der intensivmedizinischen Versorgung, zu. Je nach diskutierten Symptomen und Folgen des PCS sind neben den Fachbereichen der Neurologie, Psychiatrie und Neuropsychologie/Psychologie, Pneumologie und Kardiologie auch die diejenigen der Dermatologie, HNO, Ophthalmologie, Gastroenterologie sowie in Einzelfällen die Orthopädie und Unfallchirurgie (heterotope Ossifikationen, Myositis ossificans infolge Langzeitbeatmung) gefordert.
Die Beurteilung der haftungsausfüllenden Kausalität orientiert sich an den vom Auftraggeber zur Verfügung gestellten Begutachtungsunterlagen. Bei der Zusammenhangsbegutachtung sind insbesondere konkurrierende Ursachenfaktoren, wie Vorschädigungen (Vorerkrankungen oder Schadensanlagen), abzugrenzen. Nach den bisherigen Erfahrungen haben beim PCS insbesondere Vorerkrankungen auf pneumologischem, kardiologischem und neurologisch-psychiatrischem Fachgebiet eine hohe Bedeutung [11, 18, 25, 26].
Pneumologisches Fachgebiet
Die klinischen Manifestationen von COVID-19 reichen von asymptomatischen/milden Symptomen bis hin zu schweren Erkrankungen mit Hospitalisierung und Todesfällen [27]. Die meisten Patienten erholen sich nach der Erkrankung unabhängig vom Schweregrad recht gut. Ein Teil von ihnen weist nach der akuten Erkrankungsphase jedoch weiterhin Symptome auf [28]. Die häufigsten Befunde in der bildgebenden Diagnostik sind Milchglastrübungen, während Retikulationen, Konsolidierungen sowie Traktionsbronchiektasen in der chronischen Phase seltener zu beobachten sind [29–32].
Bei der Zusammenhangsbegutachtung sind konkurrierende Ursachenfaktoren zu beachten
Bei anhaltender oder schwerer bzw. zunehmender Dyspnoe im Rahmen eines PCS sollten zunächst die Lungenfunktion und die Diffusionskapazität gemessen sowie ggf. eine konventionelle Röntgenuntersuchung durchgeführt werden. Werden pathologische Befunde erhoben, sollte eine CT des Thorax mit Kontrastmittelgabe zur Beurteilung des Lungengerüstes und zum Ausschluss einer embolischen Komplikation mit Veränderungen im Stromgebiet angeschlossen werden. Die aktuelle Datenlage zeigt, dass die Spiroergometrie bei Patientinnen mit PCS insbesondere eine Dekonditionierung nach der Erkrankung belegt [33–36]. Sie kann hilfreich für die Erstellung eines Trainingsprogramms sein und Trainingserfolge erfassen.
Dyspnoe und unspezifische thorakale Beschwerden.
Diese häufig aufgeführten Symptome im Rahmen des PCS 3 bis 6 Monate nach der Erkrankung bedürfen der Abklärung mithilfe von Funktionstests in Ruhe (insbesondere Diffusionskapazität, Blutgasanalyse) und unter Belastung (6-min-Gehtest, ggf. Ergospirometrie) sowie ggf. einer kardialen Diagnostik. Findet sich kein pulmonale Genese der Dyspnoe können kardiorespiratorische, neuromuskuläre oder psychische Faktoren verursachend sein. Unter Berücksichtigung möglicher Vorerkrankungen und je nach Befunden schließt sich die entsprechende bildgebende Untersuchung an [28, 33–39].
Schlafmedizinische Störungen.
Ein‑, Durchschlaf‑ und Konzentrationsstörungen werden als langfristige Folgen einer SARS-CoV-2-Infektion als dysregulierter Schlaf-Wach-Zyklus, kognitive Beeinträchtigung, Anhedonie, Disstress und Anergie beobachtet [40]. In den bislang vorliegenden schlafmedizinischen Untersuchungen zeigen sich insbesondere Insomnien [41]. Des Weiteren gibt es Hinweise auf mit Rapid-Eye-Movement(REM)-Phasen assoziierte Schlafstörungen [42] als Ausdruck einer zerebralen infektionsassoziierten pathologischen Störung [43]. Allerdings treten Insomnien auch als Kollateralschaden der Pandemie in der nicht von COVID-19 betroffenen Bevölkerung gehäuft auf. Als Ursachen werden u. a. Reizüberflutung, Bildschirmarbeit und Beunruhigung durch die pandemische Situation diskutiert [44]. Zur schlafmedizinischen Diagnostik ist je nach Ausprägung und spezifischer Symptomatik (Schnarchen, beobachtete Atemaussetzer, imperative Einschlafneigung tagsüber als Hinweise auf eine schlafbezogene Atmungsstörung, die einen abwendbar gefährlichen Verlauf darstellt) eine Screeningpolygraphie (PG) zu erwägen, und ggf. sollte eine (Video-)Polysomnographie angeschlossen werden.
Vorerkrankung Asthma.
Menschen mit Asthma, die ihre Therapie auch während der Infektion anwenden/anpassen, haben kein erhöhtes Risiko für einen schweren Verlauf oder die Entwicklung eines PCS. Allerdings ist bis zu einem Jahr mit einer schlechteren Asthmakontrolle und erhöhtem Bedarf an inhalativer Therapie zu rechnen. Die Kontrollintervalle nach der SARS-CoV-2-lnfektion sollten an klinische Beschwerden angepasst und die Symptome der Asthmaexazerbation vom PCS abgegrenzt werden [45, 46].
Begutachtung.
Im Rahmen einer pneumologischen Begutachtung kann und sollte gemäß den erhobenen Befunden eine MdE-Einschätzung für die Einschränkungen der Lungenfunktion vorgenommen werden, die sich an den MdE-Tabellen der BK-Begutachtungsempfehlungen der Lunge orientiert. Dabei ist zu berücksichtigen, dass ein PCS als Folgeschaden auf pneumologischem Fachgebiet eine Vielzahl von unterschiedlichen Symptomen und Einschränkungen mit sich bringen kann, die in ihrer Gesamtheit in die Begutachtung einfließen sollten [47–49].
Kardiologisches Fachgebiet
Die Rate kardiovaskulärer Komplikationen ist in den ersten 12 Monaten nach COVID-19 und im Rahmen eines PCS signifikant erhöht [50]. Aufzuzählen sind insbesondere venöse Thrombosen, ischämische Schlaganfälle, Lungenarterienembolien (LAE), Myokardinfarkte und Herzinsuffizienz [1, 51]. Im Vergleich zu überstandenen Influenzapneumonien weisen Betroffene ein um ca. 30–50 % erhöhtes Risiko für Myokardinfarkte und Schlaganfälle in der postakuten Phase auf [52]. Die Inzidenz neu auftretender kardiovaskulärer Komplikationen in den ersten 6 Monaten nach COVID-19 ist direkt mit dem Schweregrad der Akuterkrankung assoziiert. Bei Erkrankten, die während der Akutphase hospitalisiert wurden, verdoppeln sich die in der Folgezeit auftretenden kardiovaskulären Komplikation annähernd, im Vergleich zu denjenigen, die während der akuten COVID-19-Phase ambulant behandelt wurden [53]. Die häufig genannten kardiologischen Symptome des PCS sind Dyspnoe, insbesondere unter Belastung mit Thoraxschmerzen, seltener Palpitationen und Tachykardien. Pathophysiologisch werden mehrere Mechanismen angeschuldigt, zu den kardialen Symptomen in der PCS-Phase beizutragen. Hierzu gehören neben der direkten Virusinfektion des Herzens mit potenzieller Viruspersistenz insbesondere Folgen der generalisierten Inflammation sowie andere immunologische Mechanismen. Diese können über eine Schädigung der Kardiomyozyten und einen fibrös-fettigen Umbau des Herzens zu einer reduzierten Pumpfunktion, zum Auftreten von Arrhythmien sowie zur autonomen Dysfunktion mit resultierenden Tachykardien unter vermehrter adrenerger Stimulation beitragen [54]. Eine echokardiographisch messbare Einschränkung der linksventrikulären Pumpfunktion findet sich bei ca. 10 % der Patienten 4 bis 6 Monate nach COVID-19 und eine Konzentrationserhöhung des „N-terminal prohormone of brain natriuretic peptide“ (NT-proBNP) als Ausdruck der kardialen Belastung bei ca. 9 % der Patienten [55].
Mehrere Studien zur Wertigkeit des kardialen MRT in der PCS-Phase berichten über pathologische Befunde bei bis zu 70 % aller untersuchten Patienten, allerdings unter Einschluss bereits vorbestehender kardiovaskulärer Erkrankungen [56, 57]. Die häufigsten pathologischen MRT-Befunde beziehen sich auf den Nachweis inflammatorischer Veränderungen im Myokard, während bei lediglich ca. 10 % eine messbare Einschränkung der linksventrikulären Pumpfunktion zu finden ist [58]. Derzeit ist unklar, inwieweit die gemessenen MRT-Parameter der myokardialen Entzündung sich im Langzeitverlauf in strukturelle Veränderungen des Herzens umwandeln. Dazu werden derzeit mehrere Studien durchgeführt, mit dem Ziel, den Übergang einer chronischen Entzündungsreaktion im Myokard in einen fibrotischen Umbau potenziell zu erfassen. Aus diesen Gründen kann zum jetzigen Zeitpunkt keine Empfehlung für die routinemäßige Durchführung eines kardialen MRT in der PCS-Phase gegeben werden. Dies sollte Patienten mit in der Akut-COVID-19-Phase durchgemachten kardiovaskulären Komplikationen vorbehalten bleiben.
Erfahrungsgemäß nehmen sowohl orthostatische Tachykardien als auch inadäquate Sinustachykardien unter Belastung mit zunehmender Zeit nach der Akut-COVID-19-Phase ab. Bei unkomplizierten Akutverläufen ist die Indikation zur Thromboseprophylaxe in der PCS-Phase bei Hochrisikopatienten (Adipositas, bekannte Thrombophilie, Immobilisation etc.) großzügig zu stellen und für ca. 3 Monate zu erwägen. Die Ausbildung einer arteriellen Hypertonie nach durchgemachter akuter COVID-19 ist geringfügig häufiger auf als nach durchgemachter Influenzapneumonie [59]. In der Regel normalisieren sich die Blutdruckwerte nach Wiederaufnahme eines regelmäßigen körperlichen Ausdauertrainingsprogrammes bei Patienten, die zuvor keine arterielle Hypertonie hatten.
Begutachtung.
Eine Begutachtung auf kardiologischem Fachgebiet mit entsprechender Funktionsdiagnostik ist im Fall von PCS-assoziierten kardiovaskulären Komplikationen, wie z. B. venösen Thrombosen, ischämischen Schlaganfällen, Myokardinfarkten, LAE und Herzinsuffizienz etc., bei fortbestehenden Beschwerden zur Ermittlung der funktionellen Erkrankungsfolgen in Abgrenzung zu etwaigen Vorerkrankungen angezeigt.
Neurologisch-psychiatrisches Fachgebiet
Das bevorzugte Kollektiv für PCS findet sich im neurologisch-psychiatrischen Fachgebiet und weist typische Verläufe auf. Nach mittelschweren bis schweren, teilweise lebensbedrohlichen Akutverläufen mit häufiger Notwendigkeit einer intensivmedizinischen Behandlung, einschließlich einer möglichen ECMO-Therapie, finden sich typische organbezogene pathologische Störungen. Dazu zählen beispielsweise Lungengerüstschäden, Myokardläsionen, Thromboembolien, Enzephalo-/Myelitiden oder objektivierbare neuromuskuläre Läsionen mit begleitenden typischen Veränderungen in der kardiopulmonalen und/oder neurologischen Funktionsdiagnostik. Die Erkrankungsfolgen lassen sich relativ klar zuordnen und weisen neben organischen Psychosyndromen bei einer Enzephalopathie auch psychoreaktive Störungen bis hin zur posttraumatischen Belastungsstörung (PTBS) auf.
Schwieriger ist die Diagnose bei Erkrankungsfällen mit primär asymptomatischem oder leichtem bis mittelschwerem Akutverlauf, die nach ambulanter oder nur kurzstationärer Behandlung auftreten. Es finden sich teils anhaltende oder zeitlich verzögert auftretende unspezifische Symptome (nach wiedererlangter Arbeitsfähigkeit), die über Monate oder sogar länger als ein Jahr ohne zuordenbare Organpathologie persistieren.
Im Vordergrund der Beschwerden stehen überwiegend körperliche und/oder neurokognitive Leistungsbeeinträchtigungen. Häufig werden folgende Symptome in Kombination geklagt: Fatigue, Wortfindungsstörungen, Konzentrations- und Aufmerksamkeitsstörungen, „brain fog“, Parästhesien und Sensibilitätsstörungen, Koordinationsprobleme, Muskel- und Gelenkschmerzen, Haarausfall, gelegentlich Schluckstörungen, belastungsabhängige Dyspnoe, thorakales Beklemmungsgefühl, Tachykardien und Hypertonie sowie verschiedenste weitere psychische Beeinträchtigungen von Depression über Angst- und Panikattacken bis hin zu dissoziativen Störungen.
Intensivmedizinische Komplikationen.
Bedeutsam für die Erfassung der SARS-CoV-2-assozierten Folgen sind das gehäufte Auftreten einer „critical illness polyneuropathy“ (CIP) und einer „critical illness myopathy“ (CIM). Diese beiden Komplikationen entwickeln sich bei schweren Verläufen einer COVID-19 typischerweise im Rahmen einer intensivmedizinischen Behandlung mit zum Teil wochen- bis monatelanger invasiver Beatmung. Es resultieren hochgradige funktionelle sensomotorische Beeinträchtigungen, die in der Mehrzahl der Fälle kausal der Infektionsbehandlung zugeordnet werden können [2, 11, 13]. Im Kontext stehen inaktivitätsbedingte Muskelatrophien, denen rein funktionell eine gleichartige Bedeutung zukommen kann. Infolgedessen werden über Monate fortdauernde Myalgien mit oder ohne neuralgiforme Beschwerden bzw. Parästhesien angegeben. Aufgrund der aktuell noch begrenzten Kenntnisse der Folgen einer SARS-CoV-2-Infektion sollten diese Fälle einer umfassenden neuromuskulären Abklärung, ergänzt durch eine neuropsychiatrische und neuropsychologische Diagnostik, zugeführt werden, um erkrankungsbedingte Folgen nicht zu übersehen.
Fatigue.
Fatigue stellt, unabhängig von der Schwere der akuten COVID-19, das häufigste subjektive Symptom im Rahmen eines PCS dar [1, 2, 19, 53]. Die Störung zeichnet sich durch eine oft stark einschränkende, zu den vorausgegangenen Anstrengungen unverhältnismäßige, sich durch Schlaf oder Erholung nicht ausreichend bessernde subjektive Erschöpfung und Belastungsintoleranz auf physischer (somatischer), kognitiver und/oder psychischer Ebene aus. Die Symptome sind bekanntermaßen nach anderen Viruserkrankungen sowie Infektionen durch Bakterien, Pilze und Protozoen, nach Tumorerkrankungen bzw. Autoimmunerkrankungen, z. B. der multiplen Sklerose, bekannt sind [60–63]. Zu beachten ist, dass oft eine Komorbidität mit dem Fibromyalgiesyndrom besteht. Die PCS-Fatigue wird überwiegend bei Patientinnen im postpubertären Alter beobachtet [64–66]. Ursächlich wird gemäß der Studienlage vermutet, dass „Low-grade“-Inflammation, autoimmunologische Prozesse, verminderte Durchblutung/Hypoperfusion/Mikrothromben, autonome Dysfunktion, Hyperkapnie und Persistenz von Virusbestandteilen das Krankheitsbild unterhalten [67, 68].
Auf der Grundlage der UK-Kohorte des COVID Infection Survey, Stand April 2022, leiden bereits 2,7 % der britischen Gesamtbevölkerung an einem PCS, davon 45 % länger als ein Jahr – die Hälfte berichtet über anhaltende Fatigue (www.ons.gov.uk). Hält dieser Symptomenkomplex über 6 Monate an, sollte das Vorliegen eines chronischen Fatigue-Syndroms (myalgische Enzephalomyelitis [ME]/CFS, ICD-10 G93.3) in Erwägung gezogen werden [30, 69].
Begutachtung. Es wird eine Unterscheidung zwischen Fatigue, das anamnestisch oder mithilfe geeigneter Fragebogen erfasst wird, und kognitiver und motorischer Fatigability als einer objektiv mess- bzw. nachweisbaren Minderung der motorischen und/oder kognitiven Performance vorgeschlagen [9, 70]. Eine messbare Fatigability korreliert offensichtlich mit relevanten Funktionsbeeinträchtigungen [16]. Lässt sich eine Fatigability nicht durch organmedizinische Befunde mit hinreichender Wahrscheinlichkeit objektivieren, ist im Verlauf des gutachtlichen Verfahrens auf neurologisch-psychiatrischem Fachgebiet im Rahmen der dort vorzunehmenden Konsistenz- und Plausibilitätsprüfung eine genaue Analyse der Diagnose und der Alternativdiagnosen vorzunehmen. Insbesondere sollten Zielkonflikte (mit sekundärem Krankheitsgewinn), bedarfsweise ein- oder mehrtägig, ggf. im stationären Setting, sorgfältig abgeklärt werden.
Mögliche Zielkonflikte mit sekundärem Krankheitsgewinn sollten sorgfältig abgeklärt werden
Eine kognitive Fatigability kann durch differenzierte neuropsychologische Testverfahren auch hinsichtlich der Daueraufmerksamkeit, ggf. mithilfe einer, allerdings zeitintensiven neuropsychologischen Ergänzungsbegutachtung validiert werden. Für die Erfassung der motorischen Fatigability stehen die Etablierung und Validierung standardisiert anwendbarer Messverfahren aktuell noch aus [71]. Zurzeit finden vorwiegend repetitive Handkrafttests sowie die Erfassung von Veränderungen des Gangmusters, der Gehgeschwindigkeit und Gehstrecke im Verlauf eines körperlichen Belastungstests Anwendung [15, 16, 26, 70].
Geruchs- und Geschmacksstörungen.
Geruchs- und Geschmacksstörungen treten im Rahmen der Erkrankung häufig als Erstsymptom auf und können bis zum vollständigen Verlust führen. Sie können auch isoliert infolge einer direkten Schädigung des Riechepithels auftreten. Nach einem Jahr haben ca. 95% der Betroffenen eine vollständige Restitutio der Geruchs- und Geschmacksfunktion. In Einzelfällen wird von einer anhaltenden Parosmie berichtet [2].
Begutachtung. Zur Erfassung von Geruchs- und Geschmacksstörungen sollten neben der subjektiven Beschreibung standardisierte Riechtests (z. B. „sniffin’ sticks“) zur Anwendung kommen. Auch ist die Objektivierung mittels olfaktorisch und gustatorisch evozierter Potenziale zu erwägen [72].
Neurokognitive Störungen und ihre Begutachtung.
Beklagte kognitive Beeinträchtigungen müssen in einer umfangreichen neuropsychologischen Begutachtung erfasst werden, wobei im Rahmen der dortigen Konsistenz- und Plausibilitätsprüfung Beschwerdenvalidierungsverfahren eine zentrale Rolle spielen. Die aktuellen Veröffentlichungen [9] weisen darauf hin, dass die Beurteilung der Authentizität der beklagten Beschwerden eine wesentliche Voraussetzung ist, um diese Defizite als objektiviert anzusehen. Erst im zweiten Schritt fließen die so objektivierten kognitiven Defizite in eine Kausalitätsüberlegung mit ein.
Wesentlich für die Begutachtung ist der „Decrescendo-Charakter“ der kognitiven Beeinträchtigungen
Apparativ lassen sich noch keine infektionsspezifischen Schädigungsmuster des Gehirns nachweisen, sodass eine magnetresonanztomographische Bildgebung keine Option zur Befunderfassung darstellt [12, 73]. Gleiches gilt für die Positronen-Emissions-Tomographie (PET) in der Betrachtung von Langzeitfolgen. Wesentlich für die gutachtliche Bewertung ist der „Decrescendo-Charakter“ der kognitiven Beeinträchtigungen, der ggf. durch Verlaufsuntersuchungen reevaluiert werden muss.
Psychische Gesundheitsstörungen.
Erwartungsgemäß lassen sich bei intensivmedizinisch behandelten COVID-19-Patienten infolge der lebensbedrohlichen Umstände im Einzelfall PTBS oder Anpassungsstörungen evaluieren [14]. Es kann bisher kein sicherer ursächlicher Zusammenhang zwischen der Erkrankungsschwere in der Initialphase und solchen psychischen Störungen belegt werden. Häufig finden sich auch unspezifisch wirkende subsyndromale Symptombilder, die als Anpassungsstörung beschrieben werden.
Begutachtung. Die Bewertung möglicher psychischer PCS-Symptome muss in Abgrenzung z. B. zu einer vermehrten Selbstbeobachtung/-attribution bei primär angstagitierten Persönlichkeiten erfolgen [9]. Häufiger werden Angststörungen und depressive Störungsbilder, einschließlich einer Anpassungsstörung, berichtet. Die beruflichen und sozialen Rahmenbedingungen spielen oft eine wichtige Rolle; dies kann/können z. B. eine Schuldzuweisung gegenüber dem Arbeitgeber, mangelnde Schutzmaßnahmen am Arbeitsplatz oder eine fehlende Wertschätzung sein. In der Folge ist es wichtig zu klären, ob diese Rahmenbedingungen die psychische Situation kausal bedingen oder ob sie diese lediglich modulieren. Bei schwerwiegenden COVID-19-bedingten Organveränderungen entstehen selten gutachtliche Schwierigkeiten, da unabhängig von den Rahmenbedingungen häufig auch Anpassungsschwierigkeiten an diese schweren Verläufe anzunehmen sind. Schwieriger ist dies in Fällen, in denen initial kein schwerer Verlauf vorhanden war und organmedizinische Folgen der Erkrankung fehlen. Grundlage für die Begutachtung psychischer Unfallfolgen sind die „Leitlinien zur Begutachtung psychischer und psychosomatischer Störungen“. Diese beschreiben eine sorgfältige Konsistenz- und Plausibilitätsprüfung, die differenzialdiagnostische Überlegungen, die Abklärung von psychosozialen und ökonomischem Zielkonflikten sowie die Abklärung der Authentizität enthält [74].
Neuromuskuläre Beteiligung.
Im Zuge der akuten Infektion oder mit einer geringen zeitlichen Latenz finden sich gelegentliche Manifestationen einer Myositis, assoziiert mit einer entsprechenden klinischen Symptomatik in Verbindung mit Paresen, einer Konzentrationserhöhung der Kreatinkinase und den magnetresonanztomographisch fassbaren Signalsteigerungen in der betroffenen Muskulatur. Die immunologische Genese ist wahrscheinlich, und die Störung spricht auf die Gabe von Steroiden oder Immunglobulinen gut an. Im Kontext mit der Erkrankung kann es mitunter zu einer Verschlechterung vorbestehender neuromuskulärer Erkrankungen wie z. B. einer Myasthenia gravis oder einer chronisch-inflammatorisch demyelinisierenden Polyneuropathie (CIDP) kommen.
Begutachtung. Es gelten wiederum die mehrfach dargestellten Kausalitätsgesichtspunkte. Hinsichtlich des beschriebenen gehäuften Auftretens eines Guillain-Barré-Syndroms (GBS) in Assoziation mit einer SARS-CoV-2-Infektion wird am ehesten von einer unspezifischen postinfektiösen Genese auszugehen sein, was durchaus naheliegt, weil das Intervall zwischen der Erkrankung und der Manifestation als relativ kurz bewertet wird. Ein GBS, das Wochen nach dem akuten Infektionsgeschehen auftrat, konnte bisher in keinen spezifischen Zusammenhang mit einer COVID-19 gebracht werden [75, 76].
Die derzeitige gutachtliche Beurteilung dieses Kausalzusammenhangs wird sehr kontrovers diskutiert. Keine Zweifel gibt es daran, dass Polyneuritiden infektionsbedingt durch SARS-CoV‑2 ausgelöst werden können, aktuell kann jedoch keine Verbindung zur langfristigen Entwicklung von Polyneuropathien hergestellt werden [2, 77].
Schmerzsyndrome.
Die häufig, in unterschiedlicher Ausprägung geklagten muskuloskeletal, myalgisch oder neuropathisch erscheinenden oder auch unspezifischen Ganzkörper- oder extremitätengebundenen Schmerzen lassen sich organisch am ehesten einer CIP zuordnen, ansonsten fehlt es bisher an der notwendigen wissenschaftlichen Evidenz [78]. Das ist auch der Grund, warum fortdauernde Schmerzsyndrome gutachtlich nur mit einer organassoziierten pathologischen Veränderung im Sinne des PCS anerkannt werden können. Hinsichtlich Kopfschmerzen erscheint eine vorübergehende infektionsbedingte Symptomatik auch über mehrere Monate nachvollziehbar, wohingegen für die Neuentstehung eines lang anhaltenden Kopfschmerzsyndroms durch eine SARS-CoV-2-lnfektion aktuell wissenschaftlich keine Kausalität zu belegen ist [79–83].
Meningoenzephalitiden/Myelitiden.
Nach infektionsassoziierten Meningoenzephalitiden oder Myelitiden, wobei Letztere z. T. immunvermittelt mit einer zeitlichen Latenz auftreten können, lassen sich diese und ggf. deren Residuen und eine Enzephalopathie aufgrund der typischen pathologischen Organveränderungen auch diagnostisch hinreichend objektivieren und gutachtlich einer resultierenden Funktionsstörungen zuordnen. Erregerspezifische Schädigungsmuster gibt es allerdings nicht. Delirante Symptomverläufe in der Akutphase der Virusinfektion können ein klinisches Zeichen für eine Enzephalopathie mit schlechter Prognose darstellen, und sind gutachtlich gemäß der Verlaufsdokumentation eingehend zu prüfen [84].
Ischämische Hirninfarkte.
Infolge einer Endothelschädigung bzw. einer immunassoziierten Aktivierung des Gerinnungssystems durch das SARS-CoV-2-Virus wurden vaskuläre Komplikationen, Gefäßthrombosen und ischämische Hirninfarkte bei jüngeren Erkrankten mit einer leicht erhöhten Häufigkeit vornehmlich in den ersten Wochen nach der Infektion beobachtet. Vereinzelt waren auch Schlaganfälle mit einer Häufung großer Gefäßverschlüsse zu verzeichnen. Erhöhte kardiovaskuläre Risikofaktoren sind mit einem erhöhten Manifestationsrisiko assoziiert. Intrakranielle Blutungen finden sich eher selten [26, 85].
Begutachtung. Es ist die übliche Kausalitätsbetrachtung, bezogen auf den Einzelfall, mit kritischer Würdigung der Vorschädigungen und Schadensanlagen erforderlich. Bei den häufig komplexen Spätfolgen sollte die Begutachtung möglicherweise interdisziplinär erfolgen. Insbesondere bei beklagten Beschwerden ohne nachweisbares organisches Korrelat wie Fatigue, ME/CFS, neurokognitive Defizite, Schmerzen, affektive Störungen etc. ist eine dem jeweiligen Beschwerdebild angepasste Begutachtung auf neurologisch-neuropsychologischem, psychiatrischem bzw. psychosomatischem Gebiet nach den Standards der Diagnostik, Funktionsbeurteilung und Beschwerdevalidierung notwendig. Diese sind in den entsprechenden AWMF-Leitlinien zur Begutachtung beschrieben [1].
Dermatologisches Fachgebiet
Hauteffloreszenzen nach SARS-CoV-2-lnfektionen treten gehäuft in einem relativ geringen Prozentsatz vornehmlich bei Patientinnen mit PCS (bis 25 %, [85–89]) in unterschiedlichen Erscheinungsformen auf. Diese reichen von makulopapulös und morbilliform (flach bis kleinknotig-erhaben), Livedo-reticularis-/racemosaartig (netzartig, bläulich) über urtikariell (flüchtig, quaddelförmig) und Erythema-multiforme-artig (vielgestaltig bis großblasig auf rotem Grund) bis hin zu varizelliform (klare Bläschen auf gerötetem, oft juckendem Grund). Mit einer längeren Latenz nach der Infektion können alle Altersgruppen betroffen sein. Eine besondere Entität sind die sog. COVID-Zehen, eine bläuliche, kissenartige Auftreibung an den kleinen Zehen und gelegentlich auch Fingergelenken bei jüngeren Patienten mit leichten Verläufen, häufig ohne lokalen Nachweis des SARS-CoV-2-Virus [90]. Allen Symptomen ist gemeinsam, dass sie keine gutachtliche Relevanz haben [86–91].
Hals-Nasen-Ohren-Fachgebiet
Häufige Erstsymptome einer akuten Infektion mit dem SARS-CoV-2-Virus sind COVID-19-assoziierte Störungen bis zum völligen Verlust der Geruchs- und Geschmackswahrnehmung (Anosmie/Ageusie). Bei ca. 80–95 % der Betroffenen stellt sich innerhalb von einem bis 2 Monaten, gelegentlich auch erst innerhalb eines Jahres. eine Restitutio ad integrum ein [92, 93].
Riechstörungen können sich hinsichtlich der Gefahrerkennung und -abwehr im Alltag nachhaltig auswirken und beispielhaft zu vermehrten Lebensmittelvergiftungen führen. Sie sind bedeutsam für die Geschmacks- und Aromawahrnehmung von Nahrungsmitteln [1, 2]. Die Kommunikation über Düfte geht verloren, was z. B. zu verminderter emotionaler Bindung zu Familienmitgliedern oder veränderter Sexualität führen kann [6, 51, 94]. Geruchsstörungen lassen sich in quantitativ und qualitativ einordnen in:
Normosmie mit regelhafter Wahrnehmung,
Hyposmie mit verminderter und
(funktionelle) Anosmie mit erheblicher Minderung bzw. Verlust des Riechvermögens,
Parosmie mit veränderter Wahrnehmung von Gerüchen in Gegenwart einer Reizquelle sowie
Phantosmie: die Wahrnehmung von Gerüchen in Abwesenheit einer Reizquelle.
Dem dauerhaften und vollständigen Geruchs- und Geschmacksverlust folgt eine rentenberechtigende MdE
Eine Hyposmie liegt bei etwa 15 % und eine funktionelle Anosmie bei ca. 4 % in der Bevölkerung vor [92]. Als Ursache von Parosmien und Phantosmien werden neurophysiologische Überleitungsstörungen zu und in den übergeordneten Verarbeitungszentren diskutiert. Beide Wahrnehmungsstörungen treten häufig gleichzeitig auf und sind diagnostisch schwer voneinander zu unterscheiden.
Begutachtung.
Die gutachtliche Relevanz muss im Einzelfall in Berufsfeldern der Gastronomie (Köche), Kosmetik etc. auch im Hinblick auf die Kausalität geprüft werden, da eine Berufsunfähigkeit drohen kann und Maßnahmen zur beruflichen Teilhabe ergriffen werden müssen. Ein dauerhafter und vollständiger Verlust des Geruchs- und Geschmackssinns hat eine rentenberechtigende MdE zur Folge.
Ophthalmologisches Fachgebiet
Akute ophthalmologische Komplikationen durch eine SARS-CoV2-lnfektion sind vielfach beschrieben, aber im Zusammenhang mit dem PCS nicht Gegenstand der Forschung. Eine okuläre Störung kann im Rahmen einer Konjunktivitis (follikulär, hämorrhagisch, pesudomembranös) sowohl begleitend als auch als erstes oder einziges Symptom einer SARS-CoV-2-lnfektion auftreten [95–98]. Begleitend kann sich auch eine Keratokonjunktivitis entwickeln [99]. Reaktivierungen von bereits vorbestehenden Infektionen (z. B. Herpes) können alle okulären Strukturen betreffen [100, 101]. Tiefere Augenstrukturschäden entstehen zumeist als Folge eines inflammatorischen, vaskulären oder neuronalen Pathomechanismus. Darüber hinaus wird von Beteiligungen der neurosensorischen Netzhaut und Uvea in Form von speziellen Sehstörungen und einer Assoziation mit einem erhöhten intraokularen Druck (IOD) im Gefolge eines PCS über einen autoimmun vermittelten Prozess berichtet.
Begutachtung.
Die gutachtliche Bedeutung muss im Einzelfall nach den Vorgaben der Zusammenhangsbegutachtung geprüft werden.
Weitere betroffene Fachgebiete
Hierzu zählen Endokrinologie, Hämatologie mit blutbildendem System und Gerinnung, Gastroenterologie, Nephrologie und Pädiatrie. Gutachterliche Fragestellungen und Kausalitätsbetrachtungen können resultieren und müssen im empfohlenen Kontext bewertet werden.
MdE-Bewertung des Folgeschadens und Gesamt-MdE
Nach Vorgaben und Anforderung der GUV muss der beauftragte Gutachter das PCS im Versicherungsfall als Folgeschaden einer BK 3101 bzw. eines Arbeitsunfalls nach Art und Ausprägung (Schweregrad) konkretisieren und als BK bzw. als Unfallfolge als Grundlage für die MdE-Einschätzung genau beschreiben und feststellen.
Aufgrund fehlender konsentierter MdE-Empfehlungen zu Post-COVID-Symptomen orientiert sich die MdE-Einschätzung für den jeweiligen Folgeschaden an den Empfehlungen der betroffenen medizinischen Fachgebiete und den jeweiligen Standardwerken zur Begutachtung. Zum Beispiel kann für das PCS als Folgeschaden auf pneumologischen Fachgebiet auf die MdE-Einschätzung für die Einschränkungen der Lungenfunktion auf die MdE-Tabellen der BK-Begutachtungsempfehlungen der Lunge zurückgegriffen werden [102]. Im übertragenen Sinne gilt dies im Kontext auch für die Einschätzung objektivierter neurokognitiver Störungen zu den Folgen von Schädel-Hirn-Verletzungen bzw. zu hirnorganischen Psychosyndromen.
Für die MdE-Bewertung der Fatigue sind ggf. über mehrtägige Begutachtungen, auch unter stationären Bedingungen, die Art der festgestellten mehrdimensionalen (psychisch-emotional, sozial-kommunikativ, körperlich-funktionell) Funktionsbeeinträchtigungen, deren Ausprägung und Schweregrad festzustellen und zu berücksichtigen [103]. Vergleichbares gilt für die Erfassung von psychischen Beeinträchtigungen als Folgeschaden [74].
Nach diagnostisch gesichertem dauerhaftem und vollständigem Verlust des Geruchs- und Geschmackssinns als singuläre Folge eines PCS kann für die MdE-Einschätzung u. U. auf die Einholung eines HNO-ärztlichen oder neurologischen Gutachtens verzichtet werden, weil spätestens nach einem Jahr keine Erholung mehr zu erwarten ist. Gemäß den fachspezifischen Erfahrungswerten wäre dann eine vorläufige MdE von 20 v. H. ohne Begutachtung zu rechtfertigen. Wenn weitere Behandlungsoptionen bestehen, sollte eine abschließende Beurteilung der dauerhaften MdE nach weiteren 6 Monaten stattfinden. Der gesicherte Teilverlust von Geruchssinn (Hyposmie) und/oder Geschmackssinn ist nur gemeinsam mit anderen Funktionsstörungen rentenrelevant, es sei denn, es liegt bereits ein anderer Stützrententatbestand vor.
Da sich Folgeschäden beim PCS auf verschiedenen Fachgebieten häufig überschneiden, empfiehlt die DGUV idealerweise eine interdisziplinäre Begutachtung der Sachverständigen sowie ein fachübergreifendes Begutachtungskonsil für die Einschätzung der Gesamt-MdE, das sinnvollerweise im Rahmen einer stationären Begutachtung in einer geeigneten BG-Klinik angestrebt werden sollte. Sofern dies in der Praxis nicht möglich ist, sollten die Sachverständigen in deren Fachgebiet, in dem der Folgeschaden mit der stärksten Funktionsbeeinträchtigung liegt (häufig als „Hauptgutachter“ bezeichnet), mit der Einschätzung der Gesamt-MdE beauftragt werden. Diese sollte infolge einer sog. integrierenden Gesamtschau erfolgen, die in der Publikation „Grundlagen der Begutachtung von Arbeitsunfällen – Erläuterungen für Sachverständige“ [104] näher erläutert wird. Bei Bedarf kann die Empfehlung zur Gesamt-MdE über beratende Ärzte plausibilisiert werden.
Zusammenfassung und Fazit für die Praxis
Das Post-COVID-Syndrom (PCS) ist als über 3 Monate bestehende Problematik definiert und unter dem Dachbegriff Long-COVID zu verstehen.
Die Begutachtung des PCS nach einer Infektion mit dem Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) stellt angesichts der vielfältigen und komplexen Beschwerdebilder eine interdisziplinäre Herausforderung dar. Neben der fachspezifischen Beurteilung infektionsbedingter Organschäden liegt die wesentliche Problematik in der gutachtlichen Objektivierung und Kausalitätsbewertung der vielgestaltigen subjektiven Beschwerdebilder. Diese gilt es zu validieren.
Grundvoraussetzung für jede gutachtliche Beurteilung im Rechtsgebiet der gesetzlichen Unfallversicherung ist die im Vollbeweis gesicherte SARS-CoV-2-lnfektion (mithilfe eines PCR-Virus- oder Antikörpernachweises). Im zweiten Schritt hat eine abgeschlossene symptomorientierte Organdiagnostik zur Sicherung bzw. zum weitestgehenden Ausschluss infektionsbedingter Organschäden zu erfolgen [24]. Eine vollständige Dokumentation des Krankheitsverlaufs und ein Vorerkrankungsverzeichnis sind für die Bewertung essenziell.
Im gutachtlichen Kontext muss auch beim PCS die Diagnose im Vollbeweis gesichert werden und sich die Kausalitätsbeurteilung auf den aktuellen wissenschaftlichen Erkenntnisstand stützen. Dieser ist in Bezug auf „Corona“ ständig im „Fluss“, sodass Sachverständige jeweils „aktuell“ bleiben müssen. Auch wenn die Folgen einer SARS-CoV-2-lnfektion noch nicht vollständig verstanden sind, haben sich grundlegende pathophysiologische Erkenntnisse/Abläufe nicht geändert. Da die klinische Beschwerdesymptomatik auch bei COVID-19 in der überwiegenden Mehrzahl der Fälle einen Decrescendo-Verlauf zeigt, muss bei einem anderen Verlauf im gutachtlichen Kontext eine Diskussion und Begründung erfolgen.
Da Erfahrungen hinsichtlich des PCS-Langzeitverlaufs bislang nicht vorliegen, sollte bei Feststellung manifester Funktionsstörungen eine Nachbegutachtung in geeignetem Abstand (nach etwa einem Jahr bis 2 Jahren) empfohlen werden.
Der stetig wachsende wissenschaftliche Erkenntnisgewinn anhand gesicherter Studienergebnisse zu den Folgen der SARS-CoV-2-lnfektion und des PCS verlangt die fortwährende Anpassung der dargestellten Eckpunkte als Stellräder der gutachtlichen Bewertung des PCS.
Einhaltung ethischer Richtlinien
Interessenkonflikt
T. Eyfferth, A.R. Koczulla, H.W. Freytag, G. Krahl, C. Ackermann, S. Bultmann, R. Reimertz, K. Dresing und Sektion Begutachtung der DGOU geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autor/-innen keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes
Der Ort in der redaktionellen Angabe von Klaus Dresing wurde zu Göttingen korrigiert.

QR-Code scannen & Beitrag online lesen
Change history
5/3/2023
Der Ort in der redaktionellen Angabe von Klaus Dresing wurde zu Göttingen korrigiert.
Literatur
- 1. AWMF S1-Leitlinie Long/ Post-COVID (Reg. Nr. 020-027). https://www.awmf.org/leitlinien/detail/ll/020-027.html. Zugegriffen: 20. Okt. 2022
- 2. AWMF-Leitlinie (Reg.Nr. 030-144) Neurologische Manifestationen bei COVID-19. https://www.awmf.org/uploads/tx_szleitlinien/030-144l_S1_Neurologische_Manifestationen_bei_COVID-19_2021-12.pdf (Erstellt: 20. Dez. 2021). Zugegriffen: 20. Okt. 2022
- 3.Townsend L, et al. Persistent fatigue following SARS-CoV-2 infection is common and independent of severity of initial infection. PLoS ONE. 2020;15(11):e0240784. doi: 10.1371/journal.pone.0240784. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.National Institute for Health and Care Excellence . COVID-19 rapid guideline: managing the long-term effects of COVID-19. 2020. [PubMed] [Google Scholar]
- 5.Schwab K, Schwitzer E, Qadir N. Postacute sequelae of COVID-19 critical illness. Crit Care Clin. 2022;38(3):455–472. doi: 10.1016/j.ccc.2022.01.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Förster C, Colombo MG, Wetzel AJ, Martus P, Joos S. Persisting symptoms after COVID-19. Prevalence and risk factors in a population-based cohort. Dtsch Arztebl Int. 2022;119:167–174. doi: 10.3238/arztebl.m2022.0147. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Nguyen NN, et al. Clinical patterns of somatic symptoms in patients suffering from post-acute long COVID: a systematic review. Eur J Clin Microbiol Infect Dis. 2022;41(4):515–545. doi: 10.1007/s10096-022-04417-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Sudre CH, Murray B, Varsavsky T, Graham MS, Penfold RS, Bowyer RC, Pujol JC, Klaser K, Antonelli M, Canas LS, Molteni E, Modat M, Cardoso JM, May A, Ganesh S, Davies R, Nguyen LH, Drew DA, Astley CM, Joshi AD, Merino J, Tsereteli N, Fall T, Gomez MF, Duncan EL, Menni C, Williams FMK, Franks PW, Chan AT, Wolf J, Ourselin S, Spector T, Steves C. Attributes and predictors of long COVID. Nat Med. 2021;27(4):626–631. doi: 10.1038/s41591-021-01292-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Tegenthoff M, Drechsel-Schlund C, Widder BB. Neurologisch-psychiatrische Begutachtung des Post-COVID-Syndroms. Nervenarzt. 2021 doi: 10.1007/s00115-022-01292-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Drechsel-Schlund C. Funktionseinschränkungen bei psychischen Unfallfolgen und MdE-Bewertung – aus Sicht der gesetzlichen Unfallversicherung. Med Sachverstand. 2020;116:125–129. [Google Scholar]
- 11.Dreßing H, Meyer-Lindenberg A. „Long-Covid“ und „Post-Covid“ in der psychiatrischen Begutachtung. Med Sachverstand. 2021;1(17):228–234. [Google Scholar]
- 12.Hosp JA, Dressing A, Blazhenets G, Bormann T, Rau A, Schwabenland M, Thurow J, Wagner D, Waller C, Niesen WD, Frings L, Urbach H, Prinz M, Weiller C, Schroeter N, Meyer PT. Cognitive Impairmentandaltered cerebral glucose metabolism in the subacute stage of COVID-19. Brain. 2021;144:1263–1276. doi: 10.1093/brain/awab009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Cabanes-Martinez L, Villadniga M, Gonzlez-Rodrguez L, Araque L, Daz-Cid A, Ruz-Caracuel I, Pian H, Sänchez-Alonso S, Fanjul S, Del lamo M, Regidor I. Neuromuscular involvement in COVID-19 critically ill patients. Clin Neurophysiol. 2020;131(12):2809–2816. doi: 10.1016/j.clinph.2020.09.017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Deng J, Zhou F, Hou W, Silver Z, Wong CY, Chang O, Huang E, Zuo QK. The prevalence of depression, anxiety, and sleep disturbances in COVID-19 patients: a meta-analysis. Ann NY Acad Sci. 2021;1486:90–111. doi: 10.1111/nyas.14506. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Dettmers C, Broscheid KC, Peters A, Hoogerbeets O, Sailer S, Wolff W, Vieten M, Jögbes M. Motorische Fatigue und Fatigability bei MS. In: Penner IK, editor. Fatigue bei Multipler Sklerose. Bad Honnef: Hippocampus; 2021. pp. 51–61. [Google Scholar]
- 16.Dettmers C, Marchione S, Weimer-Jaekel A, Godde B, Joebges M. Cognitive fatigability, not fatigue predicts employment status inpatients with MS three months after rehabilitation. Mult Scler Relat Disord. 2021;56:10321. doi: 10.1016/j.msard.2021.103215. [DOI] [PubMed] [Google Scholar]
- 17.Blomberg B, Mohn KG, Brokstad KA, Zhou F, Linchausen DW, Hansen BA, Lartey S, Onyango TB, Kuwelker K, Svik M, Bartsch H, Tondel C, Kittang BR, Cox RJ, Langeland NN, Bergen COVID-1 9 Research Group Long COVID in a prospective cohort of home-isolated patients. Nat Med. 2021;27:1607–1613. doi: 10.1038/s41591-021-01433-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Bungenberg J, Humkamp K, Hohenfeld C, Rust MI, Ermis U, Dreher M, Hartmann NK, Marx G, Binkofski F, Finke C, Schulz JB, Costa AS, Reetz K. Long COVID-19: Objectifying most selfreported neurological symptoms. Ann Clin Transl Neurol. 2022 doi: 10.1002/acn3.51496. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Lopez-Leon S, Wegman-Ostrosky T, Perelman C, Sepulveda R, Rebolledo PA, Cuapio A, Villapol S. More than 50 long-term effects of COVID-19: a systematic review and meta-analysis. Sci Rep. 2021;11:16144. doi: 10.1038/s41598-021-95565-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Brandenburg S, Woltjen M. COVID-19 als Berufskrankheit oder Arbeitsunfall. Med Sachverstand. 2021;117:113–118. doi: 10.1055/a-1341-7867. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Struve N, Maier N. Handlungsempfehlung Fallsteuerung COVID-19-Krankheitsfolgen, Handlungsempfehlung Fallsteuerung COVID-19-Krankheitsfolgen Stand 05/2021. Berufsgenossenschaft für Gesundheitsdienst und Wohlfahrtspflege (BGW); 2021. [Google Scholar]
- 22.https://intranet.bgw-online.de/SharedDocs/Downloads/DE/Reha-Handbuch/Berufskrankheiten/H/Handlungsempfehlung_Coronavirus_Beschaeftigte.pdf?blob=publicationFile&v=1. Zugegriffen: 20. Okt. 2022
- 23.Antonelli M, et al. Risk of long COVID associated with delta versus omicron variants of SARS-CoV-2. Lancet. 2022;399(10343):2263–2264. doi: 10.1016/S0140-6736(22)00941-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Kersten J, Baumhardt M, Hartveg P, Hoyo L, Hüll E, Imhof A, Kropf-Sanchen C, Nita N, Mörike J, Rattka M, Andreß S, Scharnbeck D, Schmidtke-Schrezenmeier G, Tadic M, Wolf A, Rottbauer W, Buckert D. Long COVID: distinction between organ damage and deconditioning. J Clin Med. 2021;10:3782. doi: 10.3390/jcm10173782. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Matta J, Wiernik E, Robineau O, Carrat F, Touvier M, Severi G, de Lamballerie X, Blanch H, Deleuze JF, Gouraud C, Hoertel N, Ranque B, Goldberg M, Zins M, Lemogne C, Pratiques S, Relations et Ingalits Sociales en Population Gnrale Pendant la Crise COVID-19-Serologie (SAPRIS-SERO) Study Group Association of self reported COVID-19 infection and SARS-CoV-2 serology test results with persistent physical symptomsamong french adults during the COVID-19 pandemic. AMA Intern Med. 2022;182:19–25. doi: 10.1001/jamainternmed.2021.6454. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Widder B, Gaidzik P, editors. Neurowissenschaftliche Begutachtung. 3. Stuttgart: Thieme; 2018. [Google Scholar]
- 27.Guan WJ, et al. Clinical characteristics of Coronavirus disease 2019 in China. N Engl J Med. 2020;382(18):1708–1720. doi: 10.1056/NEJMoa2002032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Office for National Statistics (2021) Statistical bulletin, 2021. https://www.ons.gov.uk/peoplepopulationandcommunity/healthandsocialcare/conditionsanddiseases/bulletins/prevalenceofongoingsymptomsfollowingcoronaviruscovid19infectionintheuk/4june2021 (Erstellt: 9. Juni 2021). Zugegriffen: 20. Okt. 2022
- 29.Zhao YM, et al. Follow-up study of the pulmonary function and related physiological characteristics of COVID-19 survivors three months after recovery. EClinicalMedicine. 2020 doi: 10.1016/j.eclinm.2020.100463. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Huang C, et al. 6-month consequences of COVID-19 in patients discharged from hospital: a cohort study. Lancet. 2021;397(10270):220–232. doi: 10.1016/S0140-6736(20)32656-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Zimmermann P, Pittet LF, Curtis N. How common is long COVID in children and adolescents? Pediatr Infect Dis J. 2021;40(12):e482. doi: 10.1097/INF.0000000000003328. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Izquierdo-Pujol J, et al. Post COVID-19 condition in children and adolescents: an emerging problem. Front Pediatr. 2022;10:894204. doi: 10.3389/fped.2022.894204. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Motiejunaite J, et al. Hyperventilation as one of the mechanisms of persistent dyspnoea in SARS-CoV-2 survivors. Eur Respir J. 2021;58(2):2101578. doi: 10.1183/13993003.01578-2021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Naeije R, Caravita S. Phenotyping long COVID. Eur Respir J. 2021 doi: 10.1183/13993003.01763-2021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Rinaldo RF, et al. Deconditioning as main mechanism of impaired exercise response in COVID-19 survivors. Eur Respir J. 2021;58(2):2100870. doi: 10.1183/13993003.00870-2021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Skjørten I, et al. Cardiopulmonary exercise capacity and limitations 3 months after COVID-19 hospitalisation. Eur Respir J. 2021;58(2):2100996. doi: 10.1183/13993003.00996-2021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Townsend L, et al. Persistent poor health post-COVID-19 is not associated with respiratory complications or initial disease severity. Annals ATS. 2021 doi: 10.1513/AnnalsATS.202009-1175OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Laviolette L, Laveneziana P, ERS Research Seminar Faculty Dyspnoea: a multidimensional and multidisciplinary approach. Eur Respir J. 2014;43(6):1750–1762. doi: 10.1183/09031936.00092613. [DOI] [PubMed] [Google Scholar]
- 39.Luger AK, et al. Chest CT of lung injury 1 year after COVID-19 pneumonia: the CovILD study. Radiology. 2022 doi: 10.1148/radiol.211670. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Mardani M. Post COVID syndrome. Arch Clin Infect Dis. 2020;15:e108819. doi: 10.5812/archcid.108819. [DOI] [Google Scholar]
- 41.Yi Y, et al. COVID-19: what has been learned and to be learned about the novel coronavirus disease. Int J Biol Sci. 2020;16(10):1753. doi: 10.7150/ijbs.45134. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Heidbreder A, et al. Video-polysomnographic findings after acute COVID-19: REM sleep without atonia as sign of CNS pathology? Sleep Med. 2021;80:92–95. doi: 10.1016/j.sleep.2021.01.051. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Yong SJ. Persistent brainstem dysfunction in long-COVID: a hypothesis. ACS Chem Neurosci. 2021;12(4):573–580. doi: 10.1021/acschemneuro.0c00793. [DOI] [PubMed] [Google Scholar]
- 44.Vitti-Ruela BV, et al. Possible sequelae in post-SARS-CoV-2 patients: effects on sleep and general health condition. Sleep Breath. 2021;25(2):963–964. doi: 10.1007/s11325-020-02152-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Palmon PA, Jackson DJ, Denlinger LC. COVID-19 infections and asthma. J Allergy Clin Immunol Pract. 2022;10(3):658–663. doi: 10.1016/j.jaip.2021.10.072. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Philip KEJ, et al. Impact of COVID-19 on people with asthma: a mixed methods analysis from a UK wide survey. BMJ Open Respir Res. 2022;9(1):e001056. doi: 10.1136/bmjresp-2021-001056. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.DGUV (2011) Empfehlung für die Begutachtung asbestbedingter Berufskrankheiten – Falkensteiner Empfehlung – Gesetzliche Unfallversicherung e. V. (DGUV). Referat Berufskrankheiten. www.dguv.de/publikationen
- 48.DGUV. Empfehlung für die Begutachtung von Quarzstaublungenerkrankungen (Silikosen) – Bochumer Empfehlung Update 2019. Deutsche Gesetzliche Unfallversicherung e. V. (DGUV). Referat Berufskrankheiten. www.dguv.de/publikationen Webcode: p010767
- 49.DGUV (2012) Empfehlung für die Begutachtung der Berufskrankheiten der Nummern 1315 (ohne Alveolitis), 4301 und 4302 der Anlage zur Berufskrankheiten-Verordnung (BKV) – Reichenhaller Empfehlung – Deutsche Gesetzliche Unfallversicherung (DGUV). www.dguv.de/publikationen
- 50.Xie Y, et al. Long-term cardiovascular outcomes of COVID-19. Nat Med. 2022;28(3):583–590. doi: 10.1038/s41591-022-01689-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Nalbandian A, et al. Post-acute COVID-19 syndrome. Nat Med. 2021;27(4):601–615. doi: 10.1038/s41591-021-01283-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Tazare J, et al. Rates of serious clinical outcomes in survivors of hospitalisation with COVID-19: a descriptive cohort study within the OpenSAFELY platform. 2021. p. 2021.01.22.21250304. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Al-Aly Z, Xie Y, Bowe B. High-dimensional characterization of post-acute sequelae of COVID-19. Nature. 2021;594(7862):259–264. doi: 10.1038/s41586-021-03553-9. [DOI] [PubMed] [Google Scholar]
- 54.Siddiq MM, et al. Physiology of cardiomyocyte injury in COVID-19. 2020. [Google Scholar]
- 55.Vijayakumar B, Tonkin J, Shah PL. Persistent abnormalities on echocardiography post hospitalization for COVID-19. Eur Respir J. 2021 doi: 10.1183/13993003.congress-2021.OA86. [DOI] [Google Scholar]
- 56.Puntmann VO, et al. Outcomes of cardiovascular magnetic resonance imaging in patients recently recovered from Coronavirus disease 2019 (COVID-19) JAMA Cardiol. 2020;5(11):1265–1273. doi: 10.1001/jamacardio.2020.3557. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Kotecha T, et al. Patterns of myocardial injury in recovered troponin-positive COVID-19 patients assessed by cardiovascular magnetic resonance. Eur Heart J. 2021;42(19):1866–1878. doi: 10.1093/eurheartj/ehab075. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Petersen EL, et al. Multiorgan assessment in mainly non-hospitalized individuals after SARS-CoV-2 infection: the Hamburg City Health Study COVID programme. Eur Heart J. 2022;43(11):1124–1137. doi: 10.1093/eurheartj/ehab914. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Hummel T, et al. „Sniffin’ sticks“: olfactory performance assessed by the combined testing of odor identification, odor discrimination and olfactory threshold. Chem Senses. 1997;22(1):39–52. doi: 10.1093/chemse/22.1.39. [DOI] [PubMed] [Google Scholar]
- 60.Basta F, et al. Is fatigue a cause of work disability in systemic lupus erythematosus? Results from a systematic literature review. Eur Rev Med Pharmacol Sci. 2018;22(14):4589–4597. doi: 10.26355/eurrev_201807_15516. [DOI] [PubMed] [Google Scholar]
- 61.Arnaud L, et al. Predictors of fatigue and severe fatigue in a large international cohort of patients with systemic lupus erythematosus and a systematic review of the literature. Rheumatology (Oxford) 2019;58(6):987–996. doi: 10.1093/rheumatology/key398. [DOI] [PubMed] [Google Scholar]
- 62.Unger ER, et al. CDC grand rounds: Chronic fatigue syndrome—Advancing research and clinical education. MMWR Morb Mortal Wkly Rep. 2016;65(50–51):1434–1438. doi: 10.15585/mmwr.mm655051a4. [DOI] [PubMed] [Google Scholar]
- 63.Komaroff AL, Bateman L. Will COVID-19 lead to myalgic encephalomyelitis/chronic fatigue syndrome? Front Med (Lausanne) 2020;7:606824. doi: 10.3389/fmed.2020.606824. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Raman B, et al. Medium-term effects of SARS-CoV-2 infection on multiple vital organs, exercise capacity, cognition, quality of life and mental health, post-hospital discharge. EClinicalMedicine. 2021;31:100683. doi: 10.1016/j.eclinm.2020.100683. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.Stussman B, et al. Characterization of post-exertional malaise in patients with myalgic encephalomyelitis/chronic fatigue syndrome. Front Neurol. 2020;11:1025. doi: 10.3389/fneur.2020.01025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Nath A. Long-Haul COVID. Neurology. 2020;95(13):559–560. doi: 10.1212/WNL.0000000000010640. [DOI] [PubMed] [Google Scholar]
- 67.Rudroff T, et al. Post-COVID-19 fatigue: Potential contributing factors. Brain Sci. 2020;10(12):1012. doi: 10.3390/brainsci10121012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.Merad M, et al. The immunology and immunopathology of COVID-19. Science. 2022;375(6585):1122–1127. doi: 10.1126/science.abm8108. [DOI] [PubMed] [Google Scholar]
- 69.Stavem K, et al. Prevalence and determinants of fatigue after COVID-19 in non-hospitalized subjects: a population-based study. Int J Environ Res Public Health. 2021 doi: 10.3390/ijerph18042030. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.Kluger BM, Krupp LB, Enoka RM. Fatigue and fatigability in neurologic illnesses: proposalfor a unified taxonomy. Neurology. 2013;80:409–416. doi: 10.1212/WNL.0b013e31827f07be. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71.Widder B. Begutachtung und sozialmedizinische Beurteilung. In: Penner IK, editor. Fatigue bei MultiplerSklerose. Bad Honnef: Hippocampus; 2021. pp. 131–151. [Google Scholar]
- 72.Whitcroft KL, Hummel T. Clinical diagnosis and current management strategies for olfactory dysfunction: a review. JAMA Otolaryngol Head Neck Surg. 2019;145:846–853. doi: 10.1001/jamaoto.2019.1728. [DOI] [PubMed] [Google Scholar]
- 73.Blazhenets G, Schroeter N, Bormann T, Thurow J, Wagner D, Frings L, Weiller C, Meyer PT, Dressing A, Hosp JA. Slow but evident recovery from neocortical dysfunction and cognitive impairment in a series of chronic COVID-19 patients. J Nucl Med. 2021;62(7):910–915. doi: 10.2967/jnumed.121.262128. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 74.AWMF-Leitlinie (Reg.Nr. 051-029) Begutachtung psychischer und psychosomatischer Störungen. https://www.awmf.org/leitlinien/detail/ll/051-029.html. Zugegriffen: 20. Okt. 2022
- 75.Keddie S, Pakpoor J, Mousele C, Pipis M, Machado PM, Foster M, Record C, Keh RYS, Fehmi J, Paterson RW, Bharambe V, Clayton LM, Allen C, Price O, Wall J, Kiss-Csenki A, Rathnasabapathi DP, Geraldes R, Yermakova T, King-Robson J, Zosmer M, Rajakulendran S, Sumaria S, Farmer SF, Nortley R, Marshall CR, Newman EJ, Nirmalananthan N, Kumar G, Pinto AA, Holt J, Lavin TM, Brennan KM, Zandi MS, Jayaseelan DL, Pritchard J, Hadden RDM, Manji H, Willison HJ, Rinaldi S, Carr AS, Lunn MP. Epidemiological and cohort study finds no association between COVID-19 and Guillain-Barre syndrome. Brain. 2021;144:682–693. doi: 10.1093/brain/awaa433. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 76.Luijten LWG, Leonhard SE, van der Eijk AA, Doets AY, Appeltshauser L, Arends S, Attarian S, Benedetti L, Briani C, Casasnovas C, Castellani F, Dardiotis E, Echaniz-Laguna A, Garssen MPJ, Harbo T, Huizinga R, Humm AM, Jellema K, van der Kooi AJ, Kuitwaard K, Kuntzer T, Kusunoki S, Lascano AM, Martinez-Hernandez E, Rinaldi S, Samijn JPA, Scheidegger O, Tsouni P, Vicino A, Visser LH, Walgaard C, Wang Y, Wirtz PW, Ripellino P, Jacobs BC, IGOS consortium Guillain-Barr syndrome after SARS-CoV-2 infection in an international prospective cohort study. Brain. 2021;144:3392–3404. doi: 10.1093/brain/awab279. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77.Saud A, Naveen R, Aggarwal R, Gupta L. COVID-19 and myositis: what we know so far. Curr Rheumatol Rep. 2021;23:63. doi: 10.1007/s11926-021-01023-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.Meyer-Frießem CH, Gierthmühlen J, Baron R, Sommer C, Üeyler N, Enax-Krumova EK. Pain during and after COVID-19 in Germany and worldwide: a narrative review of current knowledge. Pain Rep. 2021;6:893. doi: 10.1097/PR9.0000000000000893. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.AWMF-Leitlinie (Reg.Nr. 094-003) Ärztliche Begutachtung von Menschen mit chronischen Schmerzen. https://www.awmf.org/leitlinien/detail/ll/094-003.html. Zugegriffen: 20. Okt. 2022
- 80.Clauw DJ, et al. Considering the potential for an increase in chronic pain after the COVID-19 pandemic. Pain. 2020;161(8):1694–1697. doi: 10.1097/j.pain.0000000000001950. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Derksen V, et al. Onset of rheumatoid arthritis after COVID-19: coincidence or connected? Ann Rheum Dis. 2021 doi: 10.1136/annrheumdis-2021-219859. [DOI] [PubMed] [Google Scholar]
- 82.Uygun O, et al. Headache characteristics in COVID-19 pandemic—A survey study. J Headache Pain. 2020;21(1):121. doi: 10.1186/s10194-020-01188-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 83.Lobo R, Wang M, Lobo S, Bahra A. Time to retire ‘new daily persistent headache’: mode of onset of chronic migraine and tension-type headache. Cephalalgia. 2021;27:3331024211044440. doi: 10.1177/03331024211044440. [DOI] [PubMed] [Google Scholar]
- 84.Misra S, Kolappa K, Prasad M, Radhakrishnan D, Thakur KT, Solomon T, Michael BD, Winkler AS, Beghi E, Guekht A, Pardo CA, Wood GK, Hsiang-Yi Chou S, Fink EL, Schmutzhard E, Kheradmand A, Hoo FK, Kumar A, Das A, Srivastava AK, Agarwal A, Dua T, Prasad K. Frequency of neurologic manifestations in COVID-19: a systematic review and meta-analysis. Neurology. 2021;97:e2269–e2281. doi: 10.1212/WNL.0000000000012930. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 85.Nannoni S, de Groot R, Bell S, Markus HS. Stroke in COVID-19. A systematic review and metaanalysis. Int J Stroke. 2020;16:137–149. doi: 10.1177/1747493020972922. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 86.Baeck M, Herman A. COVID toes: where do we stand with the current evidence? Int J Infect Dis. 2021;102:53–55. doi: 10.1016/j.ijid.2020.10.021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 87.Criado PR, et al. Are the cutaneous manifestations during or due to SARS-CoV-2 infection/COVID-19 frequent or not? Revision of possible pathophysiologic mechanisms. Inflamm Res. 2020;69(8):745–756. doi: 10.1007/s00011-020-01370-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 88.Silva Andrade B, et al. Long-COVID and post-COVID health complications: an up-to-date review on clinical conditions and their possible molecular mechanisms. Viruses. 2021;13(4):700. doi: 10.3390/v13040700. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 89.Peiris S, et al. Pathological findings in organs and tissues of patients with COVID-19: A systematic review. PLoS ONE. 2021;16(4):e0250708. doi: 10.1371/journal.pone.0250708. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 90.Reinhart M, Metze D, Braun SA. Skin manifestations of COVID-19 and after COVID-19 vaccination. Hautarzt. 2022 doi: 10.1007/s00105-022-04991-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 91.Esen-Salman K, et al. Public interest in dermatologic symptoms, conditions, treatments, and procedures during the COVID-19 pandemic: Insights from Google Trends. Dermatol Ther. 2021;34(2):e14895. doi: 10.1111/dth.14895. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 92.Damm M, et al. Diagnostik und Therapie von Riechstörungen. HNO. 2019;67:274–281. doi: 10.1007/s00106-019-0614-x. [DOI] [PubMed] [Google Scholar]
- 93.Isenmann S, Haehner A, Hummel T. Chemosensory disorders in Covid-19: Pathomechanisms and clinical relevance. Fortschr Neurol Psychiatr. 2021;89(6):281–288. doi: 10.1055/a-1375-0761. [DOI] [PubMed] [Google Scholar]
- 94.Hansen T, et al. Covid-fatigued? A longitudinal study of Norwegian older adults’ psychosocial well-being before and during early and later stages of the COVID-19 pandemic. Eur J Ageing. 2021 doi: 10.1007/s10433-021-00648-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 95.Scalinci SZ, Trovato Battagliola E. Conjunctivitis can be the only presenting sign and symptom of COVID-19. IDCases. 2020;20:e00774. doi: 10.1016/j.idcr.2020.e00774. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 96.Loffredo L, et al. Conjunctivitis and COVID-19: A meta-analysis. J Med Virol. 2020;92(9):1413–1414. doi: 10.1002/jmv.25938. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 97.Wu P, et al. Characteristics of ocular findings of patients with Coronavirus disease 2019 (COVID-19) in Hubei province, China. JAMA Ophthalmol. 2020;138(5):575–578. doi: 10.1001/jamaophthalmol.2020.1291. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 98.Danthuluri V, Grant MB. Update and recommendations for ocular manifestations of COVID-19 in adults and children: a narrative review. Ophthalmol Ther. 2020;9(4):853–875. doi: 10.1007/s40123-020-00310-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 99.Cheema M, et al. Keratoconjunctivitis as the initial medical presentation of the novel coronavirus disease 2019 (COVID-19) Can J Ophthalmol. 2020;55(4):e125–e129. doi: 10.1016/j.jcjo.2020.03.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 100.Sanjay S, et al. Post Coronavirus disease (COVID-19) reactivation of a quiescent unilateral anterior uveitis. Sn Compr Clin Med. 2021;3(9):1843–1847. doi: 10.1007/s42399-021-00985-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 101.Soni A, et al. Acute retinal necrosis as a presenting ophthalmic manifestation in COVID 19 recovered patients. Ocul Immunol Inflamm. 2021;29(4):722–725. doi: 10.1080/09273948.2021.1938135. [DOI] [PubMed] [Google Scholar]
- 102.Deutschen Gesellschaft für Neurologie zur Diagnostik und Therapie in der Neurologie (2021) Falkensteiner, Bochumer, Bad Reichenhaller Empfehlungen zur Begutachtung von Lungenkrankheiten. Leitlinien der Deutschen Gesellschaft für Neurologie zur Diagnostik und Therapie in der Neurologie
- 103.Philipp M. Vorschlag zur diagnoseunabhängigen Ermittlung der MdE bei unfallbedingten psychischen bzw. psychosomatischen Störungen. Med Sachverstand. 2015;111:255–262. [Google Scholar]
- 104.DGUV (2021) Grundlagen der Begutachtungvon Arbeitsunfällen – Erläuterungen für Sachverständige. Deutsche Gesetzliche Unfallversicherung e.V., Berlin