Abstract
目的
观察鼻黏膜瓣在鼻咽癌放疗后鼻咽颅底骨质裸露修复中的效果, 为鼻黏膜瓣在放疗后颅底骨质裸露中的修复提供依据。
方法
回顾性分析8例行鼻内镜下鼻黏膜瓣修复鼻咽颅底骨质缺损或裸露的患者资料, 术后随访黏膜瓣存活情况、骨质缺损或裸露处黏膜上皮化情况, 以及患者主要临床症状改善和并发症情况。
结果
除1例患者术后出现较严重的黏膜瓣坏死、骨质裸露, 余7例患者黏膜瓣存活且鼻咽部黏膜上皮恢复良好。术后大部分患者头痛、鼻臭等临床症状较术前改善。
结论
鼻黏膜瓣是一种安全和微创的自体材料, 具有较好的生物相容性, 在修复放疗后鼻咽颅底骨质缺损或裸露中具有良好的应用前景, 值得临床推广。
Keywords: 鼻咽肿瘤, 鼻黏膜瓣, 修复外科手术
Abstract
Objective
To observe the effect of nasal mucosa flap in the repair of nasopharyngeal skull base bone exposure after radiotherapy for nasopharyngeal carcinoma, and to provide a basis for the repair with nasal mucosa flap in skull base bone exposure after radiotherapy.
Methods
The clinical data of 8 patients who underwent nasal endoscopic surgery were analyzed retrospectively. The survival of mucosal flap, the mucosal epithelialization of bone defect or exposed site, the improvement of main clinical symptoms and complications were followed up after operation.
Results
Severe mucosal flap necrosis and bone exposure occurred in 1 case after operation, in the other 7 cases, the mucosal flap survived and the mucosal epithelium of nasopharynx recovered well. After operation, most of the patients' clinical symptoms such as headache and nasal odor were improved compared with those before operation.
Conclusion
Nasal mucosal flap is a safe and minimally invasive autogenous material with good biocompatibility. It has a good application prospect in repairing bone defect or exposure of nasopharyngeal skull base after radiotherapy and is worth popularizing in clinic.
Keywords: nasopharyngeal neoplasms, nasal mucosal flap, reconstructive surgical procedures
鼻咽癌是指起源于鼻咽黏膜上皮的恶性肿瘤[1], 有明显的区域聚集性, 在中国广东、广西等华南地区发病率>20/100 000。鼻咽癌以放疗为主, 放疗给患者带来了一系列并发症, 如放射性皮炎、放射性骨坏死、放射性脑组织损伤等。鼻咽部颅底组织坏死是放疗后的严重不良反应, 可全身麻醉下经鼻内镜清除坏死组织。手术后出现的鼻咽颅底创面修复, 是值得临床医生考虑的问题。目前用于颅底修复的材料有多种, 而鼻黏膜以其自体组织、便于取材、符合鼻腔生理功能等优势, 成为鼻内镜手术中常用的修复材料。本研究回顾性分析8例行鼻内镜下鼻黏膜瓣修复鼻咽颅底骨质缺损或裸露的患者资料, 分析鼻黏膜瓣修复的手术效果, 为鼻黏膜瓣在放疗后颅底骨质裸露中的修复提供依据。
1. 资料与方法
1.1. 一般资料
2017年11月—2021年3月在我院行鼻内镜下鼻黏膜修复鼻咽颅底骨质缺损或裸露的患者8例, 男7例, 女1例; 年龄43~71岁, 平均57.1岁。其中鼻咽癌放疗后局部复发4例(未分化型非角化性癌2例, 分化型非角化性癌1例, 鳞状细胞癌1例), 坏死4例。出现头痛、鼻臭、痰中带血、颈部疼痛、吞咽困难等并发症就诊或是定期复查时发现鼻咽肿物。放疗后发病时间为0.5~36年, 平均9.9年; 随访2.5~40个月。均完善术前检查, 并经鼻咽部影像学检查, 肿瘤或坏死边缘在内镜手术可切除范围内, 排除淋巴结转移或远处转移。按手术日期将患者分为1~8号, 2、3、6、7、8号患者采用带蒂鼻中隔黏膜瓣修复, 1、4、5号患者采用游离下鼻甲黏膜瓣修复。
1.2. 方法
1.2.1. 术前准备
① 完善术前常规检查、相关影像学检查, 排除远处转移、心肺肾等重要脏器不能耐受手术的患者; ②根据鼻咽部CT或MRI平扫+增强评估肿瘤或者坏死组织侵犯范围, 筛选出肿瘤或坏死边缘在内镜手术可切除范围内的患者, 如怀疑颈内动脉受累或范围临近颈内动脉, 术中可能损伤颈内动脉, 需在术前行颈内动脉闭塞试验并告知患者及家属相关风险; ③如有颈部淋巴结肿大, 可行针刺细胞学检查以辅助鉴别诊断鼻咽癌放疗后复发或坏死; ④通过鼻内镜观察鼻腔黏膜状态和鼻腔分泌物情况, 脓涕或痂皮较多时予以清理并在术前予0.9%生理盐水250 mL冲洗双侧鼻腔, 早晚各1次, 以保持鼻腔黏膜在一个较好的状态。
1.2.2. 手术方法
① 插管全身麻醉, 常规消毒铺巾后, 鼻内镜下用浸润有0.01%肾上腺素的利多卡因棉片收缩双侧鼻腔黏膜。②根据鼻腔情况及操作需要进行扩大术腔处理, 包括: 骨折外移双侧下鼻甲; 根据需要用低温等离子消融鼻腔或后鼻孔粘连带, 咬除鼻中隔后段骨质扩大后鼻孔; 用剥离子分离鼻中隔棘突表面黏膜并凿除棘突, 复位黏膜。③考虑鼻咽癌放疗后坏死者, 活检钳钳取坏死边缘正常组织送术中冷冻, 根据坏死范围继续清除坏死组织, 沿坏死黏膜边缘做切除边界, 并切除2 mm正常黏膜, 由边缘向中心方向逐步清除坏死物, 磨除颅底斜坡坏死直至创面新鲜, 在切缘周边及创面深部取部分组织进行活检。术中注意保护颈内动脉。冷冻病理检查如为肿瘤复发, 在保证手术安全的情况下予以扩大切除范围并送检切缘, 直至切缘病理结果呈阴性。④鼻咽癌放疗后复发者, 用低温等离子沿肿瘤边缘0.5 cm进行切除, 根据病变范围决定切除深度, 术中避开颈内动脉, 将累及的咽隐窝、咽鼓管圆枕、腭帆张肌、腭帆提肌、头长肌等组织切除并送检切缘, 磨钻磨除累及的颅底斜坡骨质、蝶骨底壁、翼突内外侧板的骨质, 术中注意保护颈内动脉。⑤选取非主要病变侧黏膜。带蒂鼻中隔黏膜瓣的制备: 用针尖单极烧灼将鼻中隔黏膜分离出来。上方切口距离筛板1~2 cm处, 始于蝶窦开口, 向前延伸直达鼻阈处, 蒂部下方切口始于后鼻孔的上边缘, 向后延伸至犁骨后缘, 并越过上颌嵴直达鼻中隔和鼻底的交界处或根据需要伸到鼻底或下鼻道外侧壁[2]。接着在鼻中隔黏膜与鼻阈皮肤交界处做垂直切口连接上下两切口形成完整的带蒂鼻中隔黏膜瓣, 在黏骨膜下剥离黏膜, 向后翻转形成根蒂部在蝶窦口下方的黏膜瓣。下鼻甲黏膜瓣的制备: 鼻甲剪剪除一侧下鼻甲, 用剥离子仔细将鼻甲骨与下鼻甲黏膜剥离, 用生理盐水方纱保护游离的下鼻甲黏膜瓣。⑥黏膜瓣的选择: 根据颅底缺损大小、患者情况及术者经验选择。一般优先选取鼻中隔黏膜瓣, 鼻中隔有肿瘤侵犯者、鼻中隔手术者或者术中需咬除鼻中隔后端扩大手术操作范围者, 则不考虑带蒂鼻中隔黏膜瓣, 而选用下鼻甲黏膜瓣替代, 对于鼻咽颅底骨质缺损或裸露范围较小者, 采取游离下鼻甲黏膜瓣。将制备好的带蒂鼻中隔黏膜瓣或游离下鼻甲黏膜瓣紧贴骨质缺损或裸露处, 重点覆盖近咽鼓管、破裂孔处缺损部位。用明胶海绵填塞, 使黏膜瓣紧贴创面, 依次用碘仿纱条及膨胀海绵加固。两种黏膜瓣各有优缺点: 带蒂鼻中隔黏膜瓣具有足够的血供来源, 确保了组织具有很高的成活性和再生性, 另外带蒂黏膜瓣本身具有分泌功能, 能够起到局部湿化的作用, 黏膜瓣面积较大, 可以向鼻底延伸甚至到下鼻甲; 但取材相对游离黏膜瓣损伤较大, 操作较繁琐, 因要预计好充足的血供, 并且翻转时要确保蒂部无扭转, 既往有鼻中隔手术史或鼻中隔肿瘤侵犯者无法使用。下鼻甲游离黏膜瓣组织厚且有较强的张力, 修补时不易撕破, 能够保证黏膜瓣的完整性, 且铺设位置相对自由, 同时取材及操作较方便、经济; 但由于缺乏足够的血供来源, 血运依靠缺损区域底部供给, 有缺血坏死及脱落的风险, 对于放疗后患者不易存活, 同时游离黏膜瓣面积较小, 铺设范围有限, 在未完全稳定生长前易移位。
1.2.3. 术后处理
术后观察患者的生命体征、常规抗炎处理, 术后48 h取出鼻腔填塞的膨胀海绵, 术后1周取出碘仿纱条, 术后2周行鼻内镜检查及鼻腔清理。后续根据复查情况个性化定期复查鼻内镜, 观察局部复发或坏死情况、黏膜瓣存活及鼻咽结痂情况, 并根据术前主要症状, 电话随访针对性询问头痛和鼻痂、鼻臭、鼻干、鼻出血等鼻部症状, 以及睡眠、饮食等一般生活质量情况。
1.3. 疗效评价
愈合良好: 移植黏膜瓣颜色红润, 手术创面表面黏膜覆盖完全; 愈合一般: 移植黏膜瓣部分存活, 但有小部分骨质或组织覆盖不全, 创面未能完全上皮化; 愈合不佳: 移植黏膜瓣坏死或出现大面积骨质裸露或出现严重并发症。
头痛程度评估参考主诉疼痛分级法(VRS法)。0级: 无疼痛; Ⅰ级: 轻度, 有疼痛但可忍受, 生活正常, 睡眠无干扰; Ⅱ级: 中度, 疼痛明显, 不能忍受, 要求服用镇痛药物, 睡眠受干扰; Ⅲ级: 重度, 疼痛剧烈, 不能忍受, 需用镇痛药物或常规镇痛药物不能缓解, 睡眠受到严重干扰, 可伴自主神经紊乱或被动体位。
鼻臭的判断主要为患者的主观感受, 如患者术前已有嗅觉丧失, 则依据其家属的反馈。
2. 结果
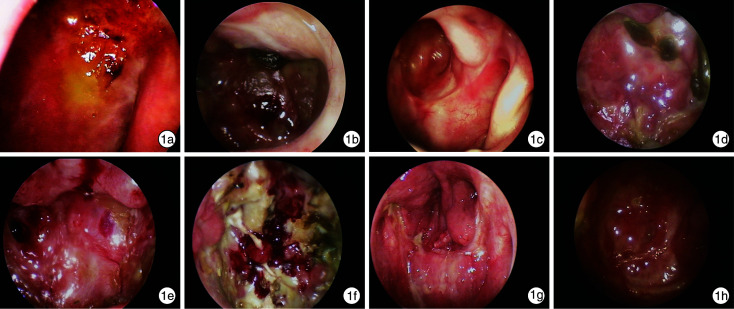
5例术中采用带蒂鼻中隔黏膜瓣修复的患者中, 1例患者(编号6)因术中血红蛋白过低不能耐受手术而终止手术, 未能做到保护性切缘阴性, 术后出现黏膜瓣坏死, 创面愈合不佳, 患者拒绝再次手术, 后因复发肿瘤侵犯颈内动脉致大出血死亡; 余4例患者及3例采用游离下鼻甲黏膜瓣修复的患者随访期间黏膜瓣血运良好, 鼻咽颅底创面愈合良好, 均无颈内动脉破裂的并发症。术后大部分患者头痛、鼻臭等临床症状较术前改善。所有患者术后均无脑脊液漏的严重并发症。8例患者的资料见表 1; 鼻咽颅底部创面恢复情况见图 1。
表 1.
8例患者的资料
| 编号 | 诊断 | 术后病理 | 头痛 | 鼻臭 | 黏膜瓣 血运 |
创面愈合 情况 |
|||
| 术前 | 术后 | 术前 | 术后 | ||||||
| 1 | 鼻咽癌放疗后复发(rT1N0M0) | 未分化型非角化性癌 | 0级 | 0级 | 无 | 无 | 存活 | 良好 | |
| 2 | 鼻咽癌放疗后鼻咽、颅骨坏死 | 坏死组织 | Ⅱ级 | Ⅰ级 | 有 | 无 | 存活 | 良好 | |
| 3 | 鼻咽癌放疗后鼻咽部坏死 | 坏死组织 | 0级 | 0级 | 有 | 无 | 存活 | 良好 | |
| 4 | 鼻咽癌放疗后复发(rT2bN0M0) | 分化型非角化性癌 | 0级 | 0级 | 无 | 无 | 存活 | 良好 | |
| 5 | 鼻咽癌放疗后坏死 | 坏死组织 | Ⅲ级 | 0级 | 有 | 无 | 存活 | 良好 | |
| 6 | 鼻咽癌放疗后复发(rT3N0M0) | 未分化型非角化性癌 | Ⅱ级 | Ⅱ级 | 有 | 有 | 坏死 | 不佳 | |
| 7 | 鼻咽癌放疗后颅骨坏死 | 坏死组织 | Ⅱ级 | 0级 | 无 | 无 | 存活 | 良好 | |
| 8 | 鼻咽癌放疗后复发(rT3N0M0) | 鳞状细胞癌 | Ⅱ级 | Ⅰ级 | 无 | 无 | 存活 | 良好 | |
图 1.
术后鼻咽颅底部创面恢复情况
1a、1b、1c、1 d、1e、1f、1g、1h: 分别为1~8号患者。
3. 典型病例报告
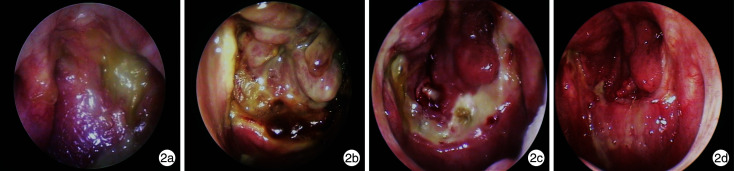
编号7患者, 男, 71岁, 因“鼻咽癌放化疗后36年, 前额、右侧颞部、枕部、项部疼痛2个月余”于2020年12月17日入院。MRI提示: 鼻咽顶后壁-咽隐窝黏膜稍增厚, 双侧咽隐窝稍变浅, 双侧头长肌、腭帆提张肌及咽旁、咽后、椎前软组织斑片状异常信号灶, 并累及斜坡、蝶骨右侧、岩尖骨质右侧及双侧海绵窦区。排除手术禁忌证后行鼻内镜手术, 术中送检组织未见癌, 予以带蒂鼻中隔黏膜瓣修复。术后诊断: 鼻咽癌放疗后鼻咽颅底坏死。术后48 h取出膨胀海绵。术前及术后鼻内镜检查结果见图 2。患者术前鼻咽顶部见隆起, 表面黄色分泌物附着, 取鼻咽部病理活检提示坏死组织; 术后2周见鼻中隔带蒂黏膜瓣存活, 可见黏膜瓣水肿苍白, 移植瓣与创面贴合良好, 未见移位; 术后4周移植瓣消肿回缩, 移植瓣与鼻咽部黏膜之间小部分骨质裸露, 少许黄色痂皮附着; 术后10周, 鼻咽部黏膜完全愈合, 未见脓痂附着。随访3个月, 术后头痛程度从Ⅱ级降至0级, 项部疼痛稍有减轻, 未见局部复发或坏死。
图 2.
鼻内镜检查
2a: 术前; 2b: 术后2周; 2c: 术后4周; 2 d: 术后10周。
4. 讨论
鼻咽癌好发于鼻咽两侧咽隐窝, 向深部生长, 可破坏颅底达蝶窦, 并进入颅内, 或向两侧发展, 侵入咽旁间隙, 再往上经破裂孔和卵圆孔进入海绵窦和颅内; 向后进展可累及咽后间隙和颈椎。鼻咽癌放疗后残留复发或残留的肿瘤可通过相同路径浸润生长, 对周围的垂体、脑干、脑神经、颈静脉球、颈内动脉及海绵窦等重要结构造成威胁。
放疗后复发肿瘤的治疗对临床医生仍是一项挑战, 即使调强放疗也出现了不容忽视的复发率和放射性损伤。放疗后失败的原因可能与范围不够或是放射剂量不足有关。如果复发的肿瘤范围具备完全切除的可行性, 建议手术治疗[3]。调强放疗通过加大对鼻咽部的放射剂量来控制局部复发肿瘤, 但放疗后导致鼻咽部坏死等放射性损伤的概率增高。而鼻咽部的严重坏死可能导致鼻咽部出血甚至死亡[4]。韩非等报道了239例鼻咽癌局部复发患者经调强治疗的远期疗效, 97例(40.6%)出现鼻咽黏膜坏死, 118例(49.4%)死于肿瘤进展或放射性损伤[4]。一项荟萃分析显示, 调强再照射治疗局部复发的鼻咽癌可以获得长期的疾病控制和生存, 但与显著的死亡率相关[5]。随着鼻内镜技术的发展, 鼻内镜治疗复发性鼻咽癌也使生存率显著提高, 具有较高的局部控制率和总体生存率[6-7]。鼻内镜手术方式既符合微创理念, 又能避免再程放疗带来的放射性损伤, 对于部分鼻咽癌放疗后局部复发者, 鼻内镜入路的挽救性手术较调强放疗在延长生存期、提高生活质量方面更有优势, 特别是在最大限度地减少治疗相关并发症和医疗费用方面[6, 8-9]。有文献报道, 对rT1、rT2及部分rT3患者, 手术可彻底切除肿瘤, 并避免发生放疗后骨坏死、大出血等远期并发症, 可考虑手术治疗[7, 10]。
首发鼻咽癌首选放疗, 但是放疗在杀死肿瘤细胞的同时, 也对鼻咽部一些正常组织造成损伤, 导致鼻咽癌患者在放疗后的一系列近期和远期并发症。颅底放射性骨坏死是远期并发症之一, 有文献提出放疗后骨坏死的原因, 可能是辐射对与血管病变相关的成骨细胞和破骨细胞所造成的影响, 导致了细胞和代谢的失衡, 从而引发明显的骨溶解[11]。鼻咽癌放疗后鼻咽部出现坏死常伴发感染, 因为受辐射而坏死的黏膜容易遭细菌破坏, 被分解并溃烂, 进一步使坏死的骨骼也受到感染[12]。本研究鼻咽癌放疗后坏死的患者, 有头痛、鼻臭、鼻出血甚至头面部麻木的临床症状, 如果不进行有效处理, 坏死部位可能继发感染或骨髓炎, 病情继续进展可能致颅内感染或临近的颈内动脉破裂大出血, 可能出现危及生命的严重并发症。目前鼻咽癌放疗后坏死的治疗方式有多种, 包括抗感染、鼻咽部药物冲洗等保守治疗, 或者在内镜下予局部清理、鼻内镜手术切除鼻咽部坏死组织等方法。药物保守治疗缓解临床症状的效果一般, 本研究1例鼻咽癌放疗后颅底骨坏死患者(编号5), 右侧颞部、枕部及乳突部疼痛伴麻木, 疼痛程度为Ⅲ级(重度), 并伴有鼻臭, 术前曾在外院就诊, 遵医嘱服用止痛药并多次用生理盐水冲洗鼻咽部, 症状不能缓解, 患者自行服用过量的止痛药引发恶性心律失常, 经鼻内镜手术彻底清创后, 患者头痛症状有效缓解。而内镜下局部清理鼻咽癌放疗后坏死组织因清理频繁, 且效果不理想, 治愈率仅13.4%~28.6%[13-15]。相比之下, 鼻内镜手术切除鼻咽部坏死组织, 清除更加彻底, 能减少抗生素的使用, 患者身体菌群失调、肝肾功能损害、细菌耐药性增加、二重感染等风险相对减少。有文献指出, 颅底放射性骨髓炎常合并其他放疗后相关并发症, 确诊后应早期行扩大性的颅底清创术, 可明显缓解症状, 提高生活质量, 降低致死性并发症的发生率[16]。随着临床医生对鼻内镜下颅底组织结构的学习和掌握, 鼻内镜手术应成为放疗后鼻咽颅底坏死的首选治疗方式[17]。
值得关注的是, 随之出现的鼻咽颅底骨质缺损和重要组织裸露的重建问题, 至今没有一致的处理方法[18]。但对于脑膜和颈动脉暴露, 学者们普遍认为应该进行重建以预防脑脊液漏及颈内动脉破裂等严重并发症的发生。对于较小的鼻咽部缺损, 可以待其二次愈合; 而对于较大的缺损, 尤其对于放疗后的患者, 鼻咽部及周边组织受到辐射, 发生了组织纤维化及血管结构受损等一系列变化, 使得缺损的愈合不能得到有效保障, 愈合速度较正常黏膜慢, 只能靠周边的黏膜缓慢纤维瘢痕化, 缺损面暴露于有菌的鼻咽腔时间较长, 感染概率相应较高[19-20]。鼻内镜下鼻咽颅底部坏死组织清创术可以最大限度地减轻骨质坏死病理过程, 但通常不会完全治愈, 且暴露的骨骼在污染的环境中容易感染[21]。本研究对鼻咽颅底骨质出现裸露和缺损的患者采用鼻黏膜瓣进行修复, 即时覆盖了缺损, 迅速将术腔与有菌的鼻腔隔离, 即使黏膜瓣有所回缩, 但由于黏膜瓣存活, 鼻咽颅底部的创面需要靠周围组织上皮化的面积相应减少, 加快了鼻咽颅底创面的愈合, 缩短了创面在有菌鼻腔环境中的暴露时间, 对于预防上行颅内感染和保护裸露的颈内动脉有着重要意义。大部分患者在鼻咽颅底创面愈合期间头痛、鼻臭及鼻咽结痂都有不同程度缓解, 并且无脑脊液漏或鼻咽大出血等并发症发生。
对于放疗后鼻咽颅底骨质裸露或缺损的修复, 国内外有报道用带蒂鼻中隔黏膜瓣、鼻甲黏膜瓣或前臂肌皮瓣作为修复材料, 取得了良好的效果[22-24]。本研究报道的病例其骨质缺损或裸露在矢状面的范围约为蝶骨平面到斜坡上的2/3, 这是带蒂鼻中隔黏膜瓣所能覆盖的范围[25], 且相较前臂肌皮瓣等组织瓣, 这种鼻黏膜瓣在鼻腔内就地取材, 减少了其他部位医源性创伤、缩短了手术时间和恢复时间, 减轻了患者的医疗负担, 是理想的修复材料。本研究中7例患者的黏膜瓣在鼻咽颅底裸露骨面上生长良好, 说明鼻黏膜瓣具有良好的组织相容性。经鼻黏膜瓣修复后的创面, 随访发现鼻咽部未见明显鼻痂, 这可能是因为鼻黏膜瓣上皮通过纤毛摆动, 发挥了排污的功效。
通过回顾性分析, 我们总结了鼻黏膜瓣在修复放疗后鼻咽颅底骨质裸露的几点体会: ①术前通过前鼻镜、鼻内镜及影像学检查对鼻腔通畅情况、鼻中隔及下鼻甲结构是否异常进行评估, 如果患者有严重的鼻中隔偏曲或者鼻中隔棘突, 可能导致制备带蒂鼻中隔黏膜瓣的过程中分离黏膜时出现黏膜瓣破裂, 不利于创面修复, 此时可选用对侧鼻中隔黏膜瓣或游离下鼻甲黏膜瓣替代。本组1例患者因有鼻中隔棘突而采用对侧带蒂鼻中隔黏膜瓣, 术后修复效果良好。对于有鼻中隔手术史或肿瘤累及鼻中隔的患者, 可选用下鼻甲黏膜瓣或中鼻甲黏膜瓣替代。对术前总鼻道脓涕过多及脓痂紧贴鼻腔黏膜, 自行用生理盐水冲鼻无效者, 可在门诊内镜下进行简单的清除, 以改善供区黏膜状态, 这也可能是黏膜瓣存活率高的原因之一。②在切除病变或坏死组织前, 对一些患者进行了扩大手术操作空间的处理, 不仅是为了有足够的空间切除病变或清理坏死组织, 也是为了降低手术器械进出鼻腔时对鼻中隔黏膜的损伤概率。③为防止黏膜瓣过短或过窄不足以覆盖骨质缺损或裸露部位, 应考虑活体黏膜瓣可能会出现回缩或皱缩的情况, 切取的黏膜瓣面积应稍大于创面, 有学者提出可稍大于受区面积20%。④在保证手术安全的情况下, 尽量清除干净复发肿瘤或坏死组织, 再贴附移植瓣。本组1例带蒂鼻中隔黏膜瓣出现坏死、愈合不良的情况, 该患者切缘病理回报仍见癌组织, 说明即使是血运较好的带蒂鼻中隔黏膜瓣, 病灶清除不彻底也可能影响黏膜瓣的存活。⑤黏膜瓣的移位是修复失败的原因之一, 因此, 黏膜瓣在贴附创面时应平铺, 确保黏膜与创面无空隙, 并确认好黏膜面再将瓣膜贴附于创面, 特别是游离的黏膜瓣, 并用填塞物将其固定。我们术中将黏膜贴附后外用明胶海绵保护, 并用膨胀海绵及碘仿纱条外固定, 术后无一例出现移植瓣移位。⑥感染是放射性骨坏死的可能原因之一, 也是影响黏膜瓣存活的重要因素。对于黏膜瓣修复后的鼻咽颅底创面, 应尽量保持鼻腔清洁, 可在鼻腔填塞物取出之后根据需要对鼻咽部的鼻痂进行处理, 清理过程中注意动作轻柔, 避免将未完全稳定的黏膜瓣吸附移位。有鼻窦炎的患者, 做完鼻腔冲洗后, 可以辅助口服黏液促排药物及激素喷鼻, 改善鼻窦炎症状, 降低创面感染风险。对变应性鼻炎患者辅以抗过敏药物, 避免因患者频繁打喷嚏而致黏膜瓣移位。
总之, 鼻腔黏膜瓣是自体材料, 具有良好的生物相容性, 术中根据骨质缺损或者裸露情况设计鼻腔黏膜瓣, 能够在鼻咽癌放疗后颅底骨质缺损或裸露中起到良好的修复效果, 是一种安全有效和微创的材料, 值得临床推广应用。
Funding Statement
广东省社会发展项目(No: 21101k01101)
References
- 1.Zhang LF, Li YH, Xie SH, et al. Incidence trend of nasopharyngeal carcinoma from 1987 to 2011 in Sihui County, Guangdong Province, South China: an age-period-cohort analysis. Chin J Cancer. 2015;34(8):350–357. doi: 10.1186/s40880-015-0018-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.夏 海龙, 郭 贵军, 杨 刚. 经鼻内镜术后颅底重建材料与方法研究进展. 检验医学与临床. 2020;17(21):3220–3224. doi: 10.3969/j.issn.1672-9455.2020.21.044. [DOI] [Google Scholar]
- 3.Mlk C, Jts W, Ep H, et al. Nasopharyngeal Carcinoma. Lancet(london, England) 2016;10022:1012–1024. doi: 10.1016/S0140-6736(15)00055-0. [DOI] [PubMed] [Google Scholar]
- 4.Han F, Zhao C, Huang SM, et al. Long-term outcomes and prognostic factors of re-irradiation for locally recurrent nasopharyngeal carcinoma using intensity-modulated radiotherapy. Clin Oncol(R Coll Radiol) 2012;24(8):569–576. doi: 10.1016/j.clon.2011.11.010. [DOI] [PubMed] [Google Scholar]
- 5.Leong YH, Soon YY, Lee KM, et al. Long-term outcomes after reirradiation in nasopharyngeal carcinoma with intensity-modulated radiotherapy: A meta-analysis. Head Neck. 2018;40(3):622–631. doi: 10.1002/hed.24993. [DOI] [PubMed] [Google Scholar]
- 6.You R, Zou X, Hua YJ, et al. Salvage endoscopic nasopharyngectomy is superior to intensity-modulated radiation therapy for local recurrence of selected T1-T3 nasopharyngeal carcinoma-A case-matched comparison. Radiother Oncol. 2015;115(3):399–406. doi: 10.1016/j.radonc.2015.04.024. [DOI] [PubMed] [Google Scholar]
- 7.徐文瑞. 侵袭转移相关标志物ELMO1、ROCK1和ROCK2在鼻咽癌组织中的表达及临床意义[D]. 青岛大学, 2020.
- 8.Lee A, Ng WT, Chan J, et al. Management of locally recurrent nasopharyngeal carcinoma. Cancer Treat Rev. 2019;79:101890. doi: 10.1016/j.ctrv.2019.101890. [DOI] [PubMed] [Google Scholar]
- 9.Hao CY, Hao SP. The Management of rNPC: Salvage Surgery vs.Re-irradiation. Curr Oncol Rep. 2020;22(9):86. doi: 10.1007/s11912-020-00949-0. [DOI] [PubMed] [Google Scholar]
- 10.徐 文瑞, 姜 彦. 复发鼻咽癌挽救性手术方法研究进展. 山东大学耳鼻喉眼学报. 2019;33(2):35–38. [Google Scholar]
- 11.Kouyoumdjian P, Gille O, Aurouer N, et al. Cervical vertebral osteoradionecrosis: surgical management, complications and flap coverage--a case report and brief review of the literature. Eur Spine J. 2009;18 Suppl 2:258–264. doi: 10.1007/s00586-009-0950-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Vlantis AC, Wong E, Chiu TW, et al. Vastus Lateralis Muscle Free Flap for Skull Base Osteoradionecrosis in Nasopharyngeal Carcinoma. J Neurol Surg B Skull Base. 2018;79(4):349–352. doi: 10.1055/s-0037-1608714. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Zou X, Wang SL, Liu YP, et al. A curative-intent endoscopic surgery for postradiation nasopharyngeal necrosis in patients with nasopharyngeal carcinoma. Cancer Commun(Lond) 2018;38(1):74. doi: 10.1186/s40880-018-0338-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Hua YJ, Chen MY, Qian CN, et al. Postradiation nasopharyngeal necrosis in the patients with nasopharyngeal carcinoma. Head Neck. 2009;31(6):807–812. doi: 10.1002/hed.21036. [DOI] [PubMed] [Google Scholar]
- 15.Chen MY, Mai HQ, Sun R, et al. Clinical findings and imaging features of 67 nasopharyngeal carcinoma patients with postradiation nasopharyngeal necrosis. Chin J Cancer. 2013;32(10):533–538. doi: 10.5732/cjc.012.10252. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.赵 天峰, 石 照辉, 许 敏, et al. 鼻咽颅底放射性骨髓炎临床分析. 临床耳鼻咽喉头颈外科杂志. 2020;34(5):436–440. doi: 10.13201/j.issn.2096-7993.2020.05.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.陈 卓, 邱 前辉, 粘 家斌, et al. 鼻咽癌放疗后大范围颅底骨坏死的内镜手术处理及颅底重建原则. 中华耳鼻咽喉头颈外科杂志. 2016;51(12):881–886. doi: 10.3760/cma.j.issn.1673-0860.2016.12.001. [DOI] [PubMed] [Google Scholar]
- 18.高 俊潇, 邱 前辉. 黏膜瓣在鼻咽癌放疗后鼻内镜手术修复颅底组织缺损中的应用. 山东大学耳鼻喉眼学报. 2019;33(2):46–50. [Google Scholar]
- 19.Jang JW, Chan AW. Prevention and management of complications after radiotherapy for skull base tumors: a multidisciplinary approach. Adv Otorhinolaryngol. 2013;74:163–173. doi: 10.1159/000342293. [DOI] [PubMed] [Google Scholar]
- 20.Chang KP, Tsang NM, Chen CY, et al. Endoscopic management of skull base osteoradionecrosis. Laryngoscope. 2000;110(7):1162–1165. doi: 10.1097/00005537-200007000-00018. [DOI] [PubMed] [Google Scholar]
- 21.Chapchay K, Weinberger J, Eliashar R, et al. Anterior Skull Base Reconstruction following Ablative Surgery for Osteoradionecrosis: Case Report and Review of Literature. Ann Otol Rhinol Laryngol. 2019;128(12):1134–1140. doi: 10.1177/0003489419865558. [DOI] [PubMed] [Google Scholar]
- 22.Wei WI, Lam KH, Sham JS. New approach to the nasopharynx: the maxillary swing approach. Head Neck. 1991;13(3):200–207. doi: 10.1002/hed.2880130306. [DOI] [PubMed] [Google Scholar]
- 23.Fee WE Jr, Gilmer PA, Goffinet DR. Surgical management of recurrent nasopharyngeal carcinoma after radiation failure at the primary site. Laryngoscope. 1988;98(11):1220–1226. doi: 10.1288/00005537-198811000-00013. [DOI] [PubMed] [Google Scholar]
- 24.Khoo ML, Soo KC, Gullane PJ, et al. Resurfacing of the nasopharynx after nasopharyngectomy using a free radial forearm flap. Head Neck. 2001;23(10):916–922. doi: 10.1002/hed.1132. [DOI] [PubMed] [Google Scholar]
- 25.Chakravarthi S, Gonen L, Monroy-Sosa A, et al. Endoscopic Endonasal Reconstructive Methodsto the Anterior Skull Base. Semin Plast Surg. 2017;31(4):203–213. doi: 10.1055/s-0037-1607274. [DOI] [PMC free article] [PubMed] [Google Scholar]