Abstract
目的
针对重度-极重度感音神经性听力损失患者口语交流困难设计改良版简易精神状态评估量表(MMSE),并比较改良方法和常规方法所测得的患者认知功能状态差异。
方法
2019年4—6月因听力损失就诊的重度-极重度感音神经性听力损失患者共24例作为研究对象,分别采用常规评估方法和改良评估方法进行MMSE评估,比较两种指导方式下MMSE总分及各认知域亚项得分差异,比较相应分值下认知功能障碍程度的差异。
结果
24例患者中,常规评估方法和改良方法下MMSE平均得分分别为10.88±9.70和25.29±3.70(P<0.01)。常规评估方法和改良评估方法下MMSE不同认知域亚项的平均得分:定向力分别为3.21±4.03和8.71±1.92、记忆力分别为1.04±1.33和2.79±0.51、注意力和计算力分别为1.63±2.02和4.00±1.41、回忆能力分别为0.79±1.14和2.50±0.72、语言能力分别为4.21±2.11和7.29±1.33。常规评估方法和改良评估方法下不同认知功能障碍程度的例数:正常认知功能分别为1例和11例,轻度认知功能障碍分别为5例和11例,中度认知功能障碍分别为4例和2例,重度认知功能障碍分别为14例和0例。改良评估方法与常规评估方法相比,83.3%的患者的认知功能障碍程度得到改善,16.7%的患者保持不变。
结论
在评估重度-极重度聋患者的认知功能水平时,使用改良版MMSE测得患者的认知功能状态更为准确。
Keywords: 重度-极重度聋, 老年性聋, 认知功能, 简易精神状态评估量表
Abstract
Objective
To evaluate the efficacy of modified mini-mental state examination(MMSE) in elderly patients with severe to profound hearing loss.
Methods
A total of 24 elderly patients with severe to profound hearing loss from April to June 2019 were involved. Severe to profound hearing loss was defined by a pure-tone average of hearing thresholds at 0.5, 1, 2, and 4 kHz in the better-hearing ear. Modified and original MMSE was completed for the patients at first visit. Two weeks later, they all return hospital and MMSE were carried out by the other method. The aggregate score and subitem score of MMSE by modified and original instrument were analyzed. The degree of cognitive impairment evaluated by two methods were compared.
Results
Among the 24 patients, the mean MMSE score by routine method and improved method were 10.88±9.70 and 25.29±3.70(P<0.01). The average score of sub-items of MMSE with routine method and improved method are as follows: orientation 3.21±4.03 vs 8.71±1.92(P<0.01), registration 1.04±1.33 vs 2.79±0.51(P<0.01), attention and calculation 1.63±2.02 vs 4.00±1.41(P<0.01), recall 0.79±1.14 vs 2.50±0.72(P<0.01), language 4.21±2.11 vs 7.29±1.33(P<0.01). Compared with the routine method, the degree of cognitive impairment getting better in 83.3% patients with improved method, meanwhile, 16.7% of the patients remain the same and no deterioration.
Conclusion
The routine method of MMSE should be improved to seek the real cognitive state of the patients with severe to profound hearing loss.
Keywords: severe to profound hearing loss, presbycusis, cognitive function, mini-mental state examination
听力损失是最常见的感官功能障碍之一,年龄越大罹患听力损失的概率越高[1-2]。WHO报告全球65岁以上人群中有1/3存在听力损失,80~85岁人群听力损失比例高达80%[3]。同时,听力损失还增加老年人认知能力下降甚至发展为痴呆的风险[4],有研究表明60岁以上重度听力损失患者老年痴呆的患病率是听力正常老年人的5倍[5]。Livingston等[6]研究报道,在导致老年性痴呆患病率增加的9个可控高危因素中,听力损失位列第一。大量研究关注于听力损失和认知功能的因果关系[7-9],主要的假说是外周听觉剥夺可能导致社会孤立[10],进而导致认知功能障碍[11];另一种假说认为听力损失造成了大脑皮层神经重组[12],导致听觉加工占据大量认知资源[13],致认知资源枯竭;另有理论认为,由于外周听觉刺激的减少,大脑结构发生改变[14],因此,临床工作中,对听力损失患者的认知功能评估越来越受到重视。临床上比较常用的认知功能筛查量表为简易精神状态评估量表(mini-mental state examination,MMSE)[15-16]。用MMSE对重度-极重度听力损失患者进行认知状态评估时,我们发现常规评估方式因听力损失患者本身存在听觉-言语沟通交流障碍,往往由于未听清和未理解测试意图,导致最终评估结果未能真实反映受试者的认知功能状态[16-17]。鉴于此,我们对比了常规评估方法和针对听力损失患者改良的评估方法对MMSE评估结果的影响,现报告如下。
1. 资料与方法
1.1. 研究对象
本研究纳入2019年4月—2019年6月在我院听力中心确诊为重度或极重度听力损失的患者24例,其中男8例,女16例;重度聋8例[平均听阈(PTA)>60~80 dB HL],极重度聋16例(PTA>80 dB HL);年龄57~83岁,平均(66.5±6.24)岁;发现听力损失2~50年,平均(18.8±14.97)年。纳入标准:①双侧重度或极重度感音神经性聋,较好耳0.5、1、2、4 kHzPTA≥60 dB HL;②年龄≥18周岁;③既往未被诊断过认知功能障碍、痴呆、帕金森等疾病;④具有言语和读写能力,无严重视力障碍。排除标准:主观或客观无法配合检查。文化程度:小学至大学。
1.2. 研究方法
MMSE评估方法:①常规方法:按照神经科常规评估方法进行;②改良方法:除常规口述讲解题目、指导评估以外,还包括为患者提供手势、文字、卡片及图画等方式进行评估指导,见图 1。图 1中考察记忆力时,常规方法为告知患者皮球、国旗和树木3个名词,患者需要复述,且在数分钟后再次回忆。而采用改良方法时,医生提供纸质文字提示语让患者了解记忆力测试规则,在正式测试时给患者提供皮球、国旗和树木的卡片,使患者充分理解测试的方法、过程和意图。为排除两种评估方法的顺序及抽样误差给结果带来的影响,我们将首次进行MMSE评估的患者随机分成甲、乙两组各12例,甲组患者采用常规评估方法,乙组患者采用改良评估方法分别实施MMSE测试,2周后患者复诊并进行第2次MMSE测试。第2次MMSE测试甲、乙两组患者评估方法互换,即甲组采用改良评估方法,乙组采用常规评估方法。具体评估测试流程见图 2。
图 1.
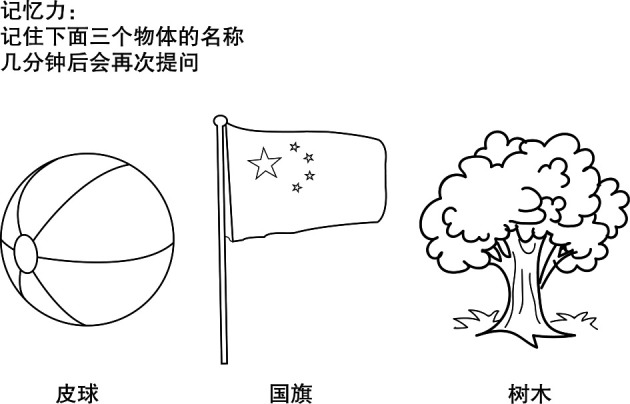
改良评估方法图例
图 2.
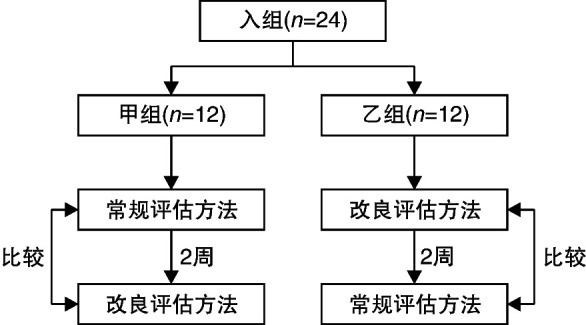
临床研究方案流程图
MMSE评估内容包括定向力、记忆力、注意力及计算力、回忆能力和语言能力5个认知域亚项[18-19],总共30个项目,总分为30分。其中定向力10分,记忆力3分,注意力及计算力5分,回忆能力3分,语言能力9分。27~30分为正常, < 27分提示认知功能障碍。具体标准:21~26分为轻度认知功能障碍,10~20分为中度认知功能障碍,≤9分为重度认知功能障碍[20]。
1.3. 统计学方法
使用SPSS 21.0统计软件进行数据分析,两种评估方法的MMSE得分比较使用配对样本t检验,P<0.05为差异有统计学意义。
2. 结果
2.1. 两组评估得分结果
采用独立样本t检验对甲、乙两组患者的常规评估方法得分和改良评估方法得分进行统计学分析,甲、乙两组常规评估方法得分分别为12.92±10.27、8.83±9.06(P=0.31),改良评估方法得分分别为25.25±3.98、25.33±3.58(P=0.96),结果显示两组患者在常规评估方法和改良评估方法中的得分比较差异均无统计学意义。
2.2. 两种评估方法得分结果
采用配对样本t检验,MMSE常规评估方法和改良评估方法平均得分分别为10.88±9.70、25.29±3.70(P<0.01),与常规评估方法比较,改良评估方法对认知功能评估的得分明显提高。
2.3. 两种评估方法下总分和认知域亚项得分
两种评估方法下总分和认知域亚项得分及统计学分析结果见表 1。
表 1.
两种评估方法下MMSE总分和认知域亚项的比较 x±s
| 项目 | 常规法 | 改良法 | P |
| 总得分 | 10.88±9.70 | 25.29±3.70 | 0.00 |
| 定向力 | 3.21±4.03 | 8.71±1.92 | 0.00 |
| 记忆力 | 1.04±1.33 | 2.79±0.51 | 0.00 |
| 注意力和计算力 | 1.63±2.02 | 4.00±1.41 | 0.00 |
| 回忆能力 | 0.79±1.14 | 2.50±0.72 | 0.00 |
| 语言能力 | 4.21±2.11 | 7.29±1.33 | 0.00 |
2.4. 两种评估方法对患者认知功能障碍的评估结果
两种评估方法对患者认知功能障碍的评估结果见表 2。
表 2.
两种评估方法对患者认知功能障碍的评估结果 例
| 程度分级 | 常规方法 | 改良方法 |
| 正常 | 1 | 11 |
| 轻度认知功能障碍 | 5 | 11 |
| 中度认知功能障碍 | 4 | 2 |
| 重度认知功能障碍 | 14 | 0 |
改良评估方法与常规评估方法相比,83.3%的患者认知功能评估结果得到改善,16.7%的患者认知功能评估结果保持不变(图 3)。
图 3.
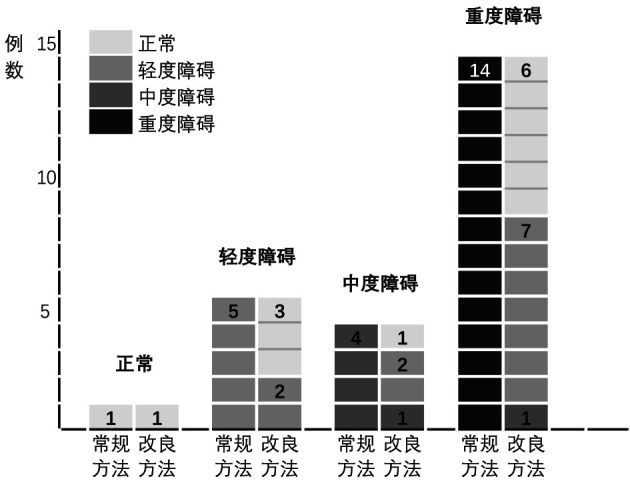
常规评估方法和改良评估方法下MMSE评估认知功能状态的变化
3. 讨论
本研究针对重度或极重度听力损失人群的听觉交流特点,改良了MMSE评估的指导方式,采用改良方法对重度-极重度听力损失患者进行MMSE评估,与常规的以口述为主的指导方式进行评估结果的比较。结果发现采用改良评估方法进行MMSE评估时的得分比常规评估方法明显提高,且各认知域亚项的评分均有提高,两者间差异有统计学意义(P<0.05)。
本研究中,改良评估方法下有83.3%的患者认知功能得分较常规评估方法提升,16.7%的患者认知功能状态保持不变,没有得分减少的患者,说明采用改良评估方法可使重度-极重度听力损失患者更加理解测试方法和意图,降低了听力损失对测试结果的影响[21],更真实地反映了听力损失受试者的实际认知功能,而常规评估方法往往会导致过度判断认知功能障碍。分析可能原因如下:①常规评估方法时,患者缺乏有效的听觉信息,准确理解题意困难[22];②部分听力损失患者本身就已经对日常口语交流丧失信心,存在抑郁、焦虑、抵触、消极情绪,不主动积极配合测试,导致得分偏低[23]。相反地,采用改良评估方法进行MMSE评估时,患者能通过手势、口型、文字卡片及图画等知晓题意,充分了解测试过程,积极性主动性被调动,使得测试得分提高;③MMSE测试中语言能力相关评估题目对受试者听觉功能要求较高,且占总分比重较大(占比30%),因此,导致听力损失患者在测试该类亚项时受影响较听力正常者更大。意外的是,本研究中有1例长达20多年的重度听力损失患者,曾接受过专业唇读训练,能较好地理解各项评估题意,其常规评估得分为25分,其中语言能力8分,改良评估方法为28分,其中语言能力9分,提示只要能准确理解题意和评估指导说明,对于听力损失患者而言两种评估指导方式对MMSE的评估结果影响不大。以上原因都可能导致常规评估方法下MMSE的最终得分低于患者真实水平。
而采用改良评估方法进行MMSE评估时得分比常规评估方法明显提高,且定向力、记忆力、注意力及计算力、回忆能力和语言能力各认知域亚项的评分均提高。以记忆力为例,评估者给受试者的指导语为“现在我告诉你三样东西的名称,我说完后你重复一遍”。听力及记忆力正常者可听清并复述关键词,但对于重度-极重度听力损失但记忆力正常患者而言则较困难,可能出现无法准确复述的情况[24]。然而,真实情况却是因为没有听清楚的原因,而不是记忆力存在问题。这和认知功能障碍存在的记忆能力下降是两回事,但评估结果却不能准确反映该受试者的真实认知功能[25]。如果采用改良评估方法,在进行记忆能力评估时,会出示三样具体物品(比如手表、钢笔、笔记本),然后收掉具体物品,请受试者复述,这时重度-极重度听力损失但记忆力正常患者能够准确复述而得分,真正有记忆力障碍者则不能得分,从而达到真正筛查出有认知功能障碍者的目的。
通过本研究,说明MMSE在临床评估上,为了达到更准确的评估结果,在常规评估方法的细节上尚需改进和完善,从而能真实地反映受试者的认知功能水平。当然,本研究也有不足之处:首先,仍无法确定本改良评估方式能精确反应重度-极重度听力损失患者的认知状态,因为在提供手势、口型、文字卡片及图画的过程中,受试者的中枢信息整合很可能较常规评估方式有所差异;其次,MMSE原评估方法存在由测试者主观因素导致的评估结果误差,本改良评估方法仍然未能消除误差;最后,本研究中改良评估方法所需的检查时间较长,能否在临床应用中推广有待进一步明确。
综上所述,对于重度-极重度听力损失患者而言,改良评估方法与常规评估方法相比,在5个认知域亚项得分及总得分均显著提高。改良评估方法下的MMSE评分更接近患者真实认知状态,其准确性优于常规评估方法。另外,不仅仅针对MMSE量表,本研究也为重度-极重度听力损失患者进行其他量表评估的指导方式提供了思路与启发。
Funding Statement
国家重点研发计划项目(No:2020YFC2005200);上海申康医院发展中心临床三年行动计划资助(No:SHDC2020CR1044B);上海交通大学医学院附属第九人民医院科技创新基金(No:CK2019011);上海市“医苑新星”青年医学人才培养资助计划
References
- 1.马 雅军, 刘 惠, 胡 志灏, et al. 听力下降预警老年人群3年后认知障碍的发生情况分析. 中国全科医学. 2020;23(11):1349–1354. doi: 10.12114/j.issn.1007-9572.2019.00.667. [DOI] [Google Scholar]
- 2.龚 琳, 徐 露璐, 李 霞, et al. 大样本体检人群年龄相关性听力障碍的观察. 临床耳鼻咽喉头颈外科杂志. 2020;34(3):227–230. doi: 10.13201/j.issn.2096-7993.2020.03.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Fortunato S, Forli F, Guglielmi V, et al. A review of new insights on the association between hearing loss and cognitive decline in ageing. Acta Otorhinolaryngol Ital. 2016;36(3):155–166. doi: 10.14639/0392-100X-993. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.任 燕, 周 嵌, 李 海峰, et al. 老年人听觉功能与认知功能的关联性初探. 临床耳鼻咽喉头颈外科杂志. 2020;34(7):582–587. doi: 10.13201/j.issn.2096-7993.2020.07.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Lin FR, Metter EJ, O'Brien RJ, et al. Hearing loss and incident dementia. Arch Neurol. 2011;68(2):214–220. doi: 10.1001/archneurol.2010.362. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Livingston G, Sommerlad A, Orgeta V, et al. Dementia prevention, intervention, and care. Lancet. 2017;390(10113):2673–2734. doi: 10.1016/S0140-6736(17)31363-6. [DOI] [PubMed] [Google Scholar]
- 7.Slade K, Plack CJ, Nuttall HE. The Effects of AgeRelated Hearing Loss on the Brain and Cognitive Function. Trends Neurosci. 2020;43(10):810–821. doi: 10.1016/j.tins.2020.07.005. [DOI] [PubMed] [Google Scholar]
- 8.Ralli M, Gilardi A, Stadio AD, et al. Hearing loss and Alzheimer's disease: A Review. Int Tinnitus J. 2019;23(2):79–85. doi: 10.5935/0946-5448.20190014. [DOI] [PubMed] [Google Scholar]
- 9.Uchida Y, Sugiura S, Nishita Y, et al. Age-related hearing loss and cognitive decline-The potential mechanisms linking the two. Auris Nasus Larynx. 2019;46(1):1–9. doi: 10.1016/j.anl.2018.08.010. [DOI] [PubMed] [Google Scholar]
- 10.Rutherford BR, Brewster K, Golub JS, et al. Sensation and Psychiatry: Linking Age-Related Hearing Loss to Late-Life Depression and Cognitive Decline. Am J Psychiatry. 2018;175(3):215–224. doi: 10.1176/appi.ajp.2017.17040423. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Whitson HE, Cronin-Golomb A, Cruickshanks KJ, et al. American Geriatrics Society and National Institute on Aging Bench-to-Bedside Conference: Sensory Impairment and Cognitive Decline in Older Adults. J Am Geriatr Soc. 2018;66(11):2052–2058. doi: 10.1111/jgs.15506. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Puschmann S, Thiel CM. Changed crossmodal functional connectivity in older adults with hearing loss. Cortex. 2017;86:109–122. doi: 10.1016/j.cortex.2016.10.014. [DOI] [PubMed] [Google Scholar]
- 13.CampbellJ, Sharma A. Cross-modalre-organization in adults with early stage hearing loss. PLoS One. 2014;9(2):e90594. doi: 10.1371/journal.pone.0090594. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Ren F, Ma W, Li M, et al. Gray Matter Atrophy Is Associated With Cognitive Impairment in Patients With Presbycusis: A Comprehensive Morphometric Study. Front Neurosci. 2018;12:744. doi: 10.3389/fnins.2018.00744. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Li H, Ji aJ, Yang Z. Mini-Mental State Examination in Elderly Chinese: A Population-Based NormativeStudy. J Alzheimers Dis. 2016;53(2):487–496. doi: 10.3233/JAD-160119. [DOI] [PubMed] [Google Scholar]
- 16.Fleurion D, Verdun S, Ridoux I, et al. Transposition and Normalization of the Mini-Mental State Examination in French Sign Language. Arch Clin Neuropsychol. 2020 doi: 10.1093/arclin/acaa125. [DOI] [PubMed] [Google Scholar]
- 17.Füllgrabe C. Onthe Possible Overestimation of Cognitive Decline: The Impact of Age-Related Hearing Loss on Cognitive-Test Performance. Front Neurosci. 2020;14:454. doi: 10.3389/fnins.2020.00454. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.孙 伟铭, 董 香丽, 张 军, et al. MoCA与MMSE在脑外伤患者认知功能障碍评估中的效果比较. 现代预防医学. 2019;46(5):939–943. [Google Scholar]
- 19.Folstein MF, Folstein SE, McHugh PR ." Mini-mental state". A practical method for grading the cognitive state of patients for the clinician .J Psychiatr Res. 1975;12(3):189–198. doi: 10.1016/0022-3956(75)90026-6. [DOI] [PubMed] [Google Scholar]
- 20.Jorgensen LE, Palmer CV, Pratt S, et al. The Effectof Decreased Audibility on MMSE Performance: A Measure Commonly Used for Diagnosing Dementia. J Am Acad Audiol. 2016;27(4):311–323. doi: 10.3766/jaaa.15006. [DOI] [PubMed] [Google Scholar]
- 21.Raymond M, Barrett D, Lee DJ, et al. Cognitive Screening of Adults With Postlingual Hearing Loss: A Systematic Review. Otolaryngol Head Neck Surg. 2021;164(1):49–56. doi: 10.1177/0194599820933255. [DOI] [PubMed] [Google Scholar]
- 22.Hopper T, Slaughter SE, Hodgetts B, et al. Hearing Loss and Cognitive-Communication Test Performance of Long-Term Care Residents With Dementia: Effects of Amplification. J Speech Lang Hear Res. 2016;59(6):1533–1542. doi: 10.1044/2016_JSLHR-H-15-0135. [DOI] [PubMed] [Google Scholar]
- 23.Rutherford BR, Brewster K, Golub JS, et al. Sensation and Psychiatry: Linking Age-Related Hearing Loss to Late-Life Depression and Cognitive Decline. Am J Psychiatry. 2018;175(3):215–224. doi: 10.1176/appi.ajp.2017.17040423. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Gaeta L, Azzarello J, Baldwin J, et al. Effect of Reduced Audibility on Mini-Mental State Examination Scores. J Am Acad Audiol. 2019;30(10):845–855. doi: 10.3766/jaaa.17139. [DOI] [PubMed] [Google Scholar]
- 25.Trivedi D. Cochrane Review Summary: Mini-Mental State Examination (MMSE)for the detection of dementia in clinically unevaluated people aged 65 and over in community and primary care populations. Prim Health Care Res Dev. 2017;18(6):527–528. doi: 10.1017/S1463423617000202. [DOI] [PubMed] [Google Scholar]


