Abstract
目的
探讨预测鼻腔鼻窦内翻性乳头状瘤(SNIP)恶变的相关危险因素, 提高术前诊断肿瘤恶变的准确性。
方法
回顾性分析89例SNIP及内翻性乳头状瘤恶变(IP-SCC)患者的临床资料, 其中SNIP组60例, IP-SCC组29例。选取长期吸烟史和长期感染史、内镜检查所见肿瘤特征、鼻窦CT和MRI示肿瘤特征等多种临床指标, 对两组患者进行比较, 进一步选择两组间有显著性差异的指标进行多因素Logistic回归分析, 通过建立回归模型分析预测SNIP恶变的相关危险因素和模型的预测能力。
结果
SNIP组与IP-SCC组患者相关症状(涕中带血)、长期吸烟史, 内镜下见肿瘤附着脓涕, 鼻窦CT示眶壁骨质破坏、颅底骨质破坏, 鼻窦MRI示脑回征、眶内受累、颅底硬脑膜强化等指标差异有统计学意义。进一步行多因素Logistic回归分析, 结果示涕中带血、长期吸烟史、内镜下见肿瘤附着脓涕、CT示眶壁骨质破坏、MRI示脑回征消失、眶内受累6个因素是提示SNIP恶变的危险因素。这一模型对SNIP恶变的预测准确率为75.0%, 对SNIP的预测准确率为96.7%, 模型总体预测准确率为89.8%。
结论
预测SNIP恶变的相关危险因素是涕中带血、长期吸烟史、内镜下见肿瘤附着脓涕、CT示眶壁骨质破坏、MRI示脑回征消失、眶内受累6个因素。综合分析临床多项指标可提高术前对SNIP恶变诊断的准确性。
Keywords: 鼻肿瘤, 内翻性乳头状瘤, 危险因素, 恶变
Abstract
Objective
To explore the risk factors of malignant transformation of sinonasal inverted papilloma (SNIP), and to improve the accuracy of preoperative diagnosis of tumor.
Methods
The clinical data of 89 patients with sinonasal inverted papilloma (SNIP group, n = 60) and malignant transformation of sinonasal inverted papilloma (IP-SCC, n = 29) were analyzed retrospectively. Clinical symptoms, medical history, endoscopic examination, characteristic of sinonasal CT scan and MR imaging were collected and compared between two groups. Then the indicators with significant differences between the two groups were used for binary logistic regression analysis. The logistic regression model was established to predict the malignant transformation risk factors of inverted papilloma and the prediction ability of the regression model was estimated.
Results
The significant differences between the two groups were: symptoms, including nasal obstruction, purulent mucus, blood in the nasal discharge; long-term smoking history; tumor attached with purulent mucus; CT scan showing bone destruction of the orbital wall and skull base; MR Imaging showing convoluted cerebriform pattern (CCP) sign, intraorbital involvement, and dural enhancement of the skull base. The results of logistic regression analysis showed that the risk factors of malignant transformation of SNIP were blood in the nasal discharge, long-term smoking history, tumor with purulent discharge, orbital wall destruction on CT scan, disappearance of CCP and orbital involvement on MRI. The accuracy rate of regression model for predicting malignant transformation of IP is 75.0%, and the accuracy rate for benign inverted papilloma is 96.7%, and the overall accuracy of the model is 89.8%.
Conclusion
The risk factors for predicting malignant transformation of SNIP are blood in the nasal discharge, long-term smoking history, tumor with purulent discharge, orbital wall destruction on CT scan, and disappearance of CCP sign and orbital involvement on MRI. It′s necessary to analyze all of clinical factors in order to improve the accuracy of preoperative diagnosis of sinonasal inverted papilloma.
Keywords: nasal neoplasms, inverted papilloma, risk factors, malignant transformation
鼻腔鼻窦内翻性乳头状瘤(sinonasal inverted papilloma,SNIP)是临床中常见的鼻腔鼻窦良性肿瘤,属于鼻腔Schneiderian上皮来源的乳头状瘤的一种,其发病率约占乳头状瘤的70%,占鼻腔鼻窦肿瘤的0.5%~4%,每年发病率为0.2~0.7/10万[1-3]。有学者认为部分SNIP增殖活性较高,具有局部侵袭、复发和恶变倾向,因此称之为“交界性肿瘤”,有文献报道SNIP恶变为鳞状细胞癌(squamous cell carcinoma,SCC)的发生率为7%~10%[4-5]。SNIP以手术治疗为主,若肿瘤发生恶变时,则手术切除范围更具破坏性,严重影响患者生活质量,但术前往往很难发现SNIP的恶变,因此给手术方案的制定带来困难。另外,内翻性乳头状瘤恶变为鳞状细胞癌(inverted papillomas malignant transformation to squamous cell carcinoma, IP-SCC)往往仅存在于部分肿瘤组织,术前活检也通常不能准确诊断,因此临床中亟需提高术前诊断SNIP是否恶变的能力。本研究回顾性总结SNIP及SNIP恶变患者的各项临床资料,并进行统计学分析,寻找预测SNIP恶变的危险因素,以提高术前诊断SNIP恶变的准确性,制定更精准的手术治疗方案,改善治疗效果。
1. 资料与方法
1.1. 一般资料
本研究选取2016年1月—2019年12月入我院治疗患者89例,依据术后病理结果分为SNIP组60例和IP-SCC组29例。SNIP组患者纳入标准:①经术后病理证实明确诊断为SNIP;②均随访1年以上;③随访过程中均未出现术后肿瘤复发且转变为恶性肿瘤;④均排除病理诊断为内翻性乳头状瘤伴轻、中-重度不典型增生。IP-SCC组患者纳入标准:①经术后病理证实明确诊断为IP-SCC(包括原位癌)的患者;②既往无手术史;③既往有手术史,术后病理结果未提示肿瘤恶变;④排除鳞状细胞癌患者。
所有患者入院后均行常规术前检查,包括鼻内镜检查、血清学检查、影像学检查(鼻窦CT及增强MRI)等,检查完善无手术禁忌证后,SNIP患者行全身麻醉鼻内镜下鼻腔鼻窦肿瘤切除术;IP-SCC患者按照恶性肿瘤的手术治疗原则行鼻侧切、上颌骨次全切及修补,双冠入路颅内肿瘤切除等相应手术,并行术后放、化疗等综合治疗。
1.2. 研究方法
回顾性分析患者各种临床资料,包括吸烟史,反复鼻腔感染病史,临床症状,尤其是鼻塞、流脓涕、涕中带血、嗅觉减退等,内镜检查结果,鼻窦CT和增强MRI检查,术后病理结果等。鼻窦CT主要观察病变范围及骨质变化,增强MRI主要观察病变范围和肿瘤增强后的特征,是否存在“脑回征”。通过统计分析两组间有显著差异的各种指标,寻找在SNIP肿瘤恶变中有重要鉴别诊断意义的指标。
1.3. 鼻窦CT及MRI检查方法
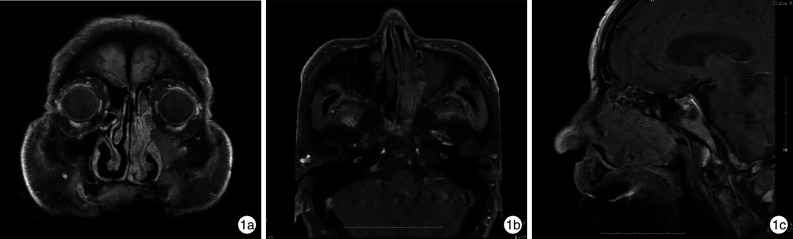
本研究中所有患者术前均行HRCT扫描,采用Siemens Somatom plus 4、GE HiSpeed NX/iCT及Philips Brilliance 64 CT扫描仪,矩阵512×512,扫描(重建)层厚2 mm,层间距5 mm,骨算法重建,窗位为200或700 HU,窗宽为2000或4000 HU。鼻窦CT主要进行鼻窦病变范围及骨质增生或受累情况的评估。进行MRI检查时,患者采用GE SignaHDxt 3.0 TMRI扫描仪和8通道相控阵头线圈。除SNIP组1例患者和IP-SCC组2例患者外,其余患者均行常规和增强MRI扫描。MRI评估指标包括:肿瘤边界、形态、T1和T2信号强度及均匀度、“脑回征”、眼眶、颅底受累情况。“脑回征”指肿瘤内部由平行排列、高低信号相间的条状影构成(图 1),也称“栅栏征”。眼眶受累为眶壁骨质破坏或病变侵犯入眶内。
图 1.
左侧鼻腔內翻性乳头状瘤在MRI增强T1WI相(抑脂序列)中所见
1a:冠状位扫描示肿瘤呈明暗相间的“脑回征”表现;1b:轴位扫描示肿瘤局部呈“脑回征”表现;1c:矢状位扫描示肿瘤中心向周围呈放射状“脑回征”样改变,呈现放射状“脑回征”的中心为肿瘤的根蒂部。
1.4. 统计学方法
本研究采用SPSS 21.0软件进行统计分析。符合正态分布的数据采用x±s表示,不符合正态分布的数据采用中位数(上、下四分位数)表示。计数资料采用卡方检验和Fisher精确概率检验。不符合正态分布的计量资料进行非参数检验Mann-Whitney U检验。多因素相关性分析采用二分类Logistic回归分析。以P < 0.05为差异有统计学意义。
2. 结果
2.1. 一般情况
SNIP组60例患者中男39例,女21例,男:女为1.86:1,中位年龄54岁(28~85岁);IP-SCC组29例患者中男19例,女10例,男:女为1.9:1,中位年龄58岁(25~88岁)。两组间性别无显著差异;IP-SCC组患者年龄较大,但两组间年龄无显著差异。SNIP组患者均行全鼻内镜下肿瘤切除术,术中磨除肿瘤根蒂部及受累骨质并电凝供血血管以减少肿瘤复发。IP-SCC组患者因肿瘤累及范围和部位不同而采用不同的手术方式。其中,鼻内镜下肿瘤切除术14例Draf Ⅲ/DrafⅡb型额窦开放联合眉弓切口入路肿瘤切除术4例,泪前隐窝入路肿瘤切除术1例;鼻侧切开术15例(包括联合双冠入路颅内肿瘤切除术2例,上颌骨次全切3例,上颌骨全切2例)。SNIP组患者均随访1年以上,平均随访17.3个月(14~27个月),未出现术后肿瘤复发及恶变;IP-SCC组患者行术后放化疗等综合治疗。
2.2. 两组间临床特征的比较
两组患者的主要症状均为鼻腔肿物引起的鼻塞,SNIP组中鼻塞39例(65.0%),流脓涕21例(35.0%),流清涕16例(26.7%),嗅觉减退15例(25.0%),涕中带血10例(16.7%),头痛等其他症状5例(8.3%);IP-SCC组患者主要症状除鼻塞外,还有脓涕、涕中带血,其中鼻塞24例(82.8%),流脓涕16例(55.2%),涕中带血12例(41.4%),嗅觉减退9例(31.0%,),头痛、耳闷等其他症状3例(10.3%)。两组间有显著差异的症状为涕中带血,IP-SCC组患者发生率明显升高(P = 0.002),而其余症状两组间无显著差异。
有吸烟史的患者中,SNIP组19例,IP-SCC组16例,两组比较差异有统计学意义(P = 0.033),提示长期吸烟史是肿瘤恶变的危险因素之一。长期鼻腔感染史和既往手术史,两组患者间均无显著性差异。内镜检查鼻腔所见,肿物呈半透明息肉样改变者两组间无显著性差异,肿物呈分叶状改变者,两组比较差异有统计学意义(P = 0.004),提示肿瘤组织呈分叶状表现时肿瘤恶变的可能性较小。肿物伴有脓性分泌物附着,两组比较差异有统计学意义(P = 0.006),提示肿物伴有脓涕是肿瘤恶变的危险因素之一。各项临床指标的统计结果详见表 1。
表 1.
两组间各项临床特征的比较
| 指标 | SNIP组(n=60) | IP-SCC组(n=29) | χ 2 | P |
| 注a) 为非参数检验Mann-Whitney U检验的统计量U值。 | ||||
| 年龄/岁 | 54 (28~85) | 58 (25~88) | 677.50a) | 0.145 |
| 性别 | 0.002 | 0.962 | ||
| 男 | 39 | 19 | ||
| 女 | 21 | 10 | ||
| 症状 | ||||
| 鼻塞 | 39 | 24 | 2.982 | 0.084 |
| 脓涕 | 21 | 16 | 3.275 | 0.070 |
| 涕中带血 | 10 | 14 | 9.918 | 0.002 |
| 嗅觉减退 | 15 | 9 | 0.361 | 0.548 |
| 吸烟史 | 19 | 16 | 4.257 | 0.033 |
| 鼻部感染史 | 30 | 18 | 1.146 | 0.284 |
| 既往手术史 | 16 | 4 | 1.860 | 0.173 |
| 内镜检查 | ||||
| 息肉样新生物 | 12 | 2 | 2.532 | 0.112 |
| 分叶状新生物 | 42 | 11 | 8.347 | 0.004 |
| 伴脓性分泌物 | 12 | 14 | 7.559 | 0.006 |
2.3. 两组间的肿瘤侵犯范围的比较
术前影像学检查及手术中探查,确定肿瘤侵犯鼻腔鼻窦的部位主要为筛窦、上颌窦,其次为额窦、鼻腔外侧壁,最少为蝶窦,SNIP组1例患者为肿瘤累及双侧筛窦。两组间肿瘤的受累部位无显著性差异,结果见表 2。无论SNIP还是恶变SNIP肿瘤累及蝶窦都较少见。恶变的肿瘤在术中常不能确定根基部位,受累鼻窦及骨质以破坏表现为主;而SNIP则大部分在术中可分辨肿瘤的根基,根基处常伴有骨质增生及丰富的血供,术中需骨钻磨除骨质并电凝肿瘤滋养血管,以减少肿瘤复发。术前影像学提示眶壁受累时,IP-SCC组6例患者术中冷冻病理结果示肿瘤侵犯眶筋膜,但2例患者家属要求保留眼球,未行眼球剜除术,4例患者行眼球剜除术。其余患者术前提示眶壁受累或肿瘤侵犯眶内时,术中可与眶筋膜分离,保留眶筋膜完整。SNIP组患者眶壁受累时,术中内镜下未见眶筋膜受累表现;若眶壁为肿瘤起源部位,则磨除眶壁骨质并用低功率双极电凝处理受累眶壁下眶筋膜组织。
表 2.
两组间肿瘤累及部位的比较分析
| 肿瘤累及部位 | SNIP组(n=60) | IP-SCC组(n=29) | χ 2 | P |
| 额窦 | 12 | 9 | 1.320 | 0.251 |
| 筛窦 | 30 | 13 | 0.209 | 0.647 |
| 上颌窦 | 31 | 15 | 0 | 0.996 |
| 蝶窦 | 1 | 3 | 3.430 | 0.064 |
| 鼻腔外侧壁 | 7 | 5 | 0.521 | 0.470 |
2.4. 两组间的肿瘤影像学特征比较
鼻窦CT检查主要判断病变范围及受累部位骨质病变情况,鼻窦MRI检查可更准确判断病变性质及眶内、颅底等结构受累情况。鼻窦影像检查结果见表 3,可见鼻窦CT检查IP-SCC组患者更多见鼻窦骨质破坏,两组间有显著差异(P = 0.016),其中眶壁、颅底骨质破坏在IP-SCC组明显增加(P < 0.01),提示眶壁、颅底骨质破坏是肿瘤恶变的危险因素。未发生恶变的SNIP鼻窦CT的主要特点是肿瘤根基处鼻窦骨质增生,两组间也有显著性差异(P < 0.01)。增强MRI结果显示,IP-SCC组6例(20.7%,6/29)患者肿瘤组织局部可呈现“脑回征”表现,而大部分SNIP组患者(76.7%,46/60)均呈现典型“脑回征”表现,两组间有显著差异(P < 0.01)。IP-SCC组中眶内组织受累、颅底脑膜强化的表现显著高于SNIP组(P < 0.05)。以上结果提示,肿瘤组织缺乏典型的脑回征、眶内组织受累、颅底硬膜强化等表现可能是肿瘤恶变的危险因素。IP-SCC组患者的鼻窦MRI影像特点见图 2,MRI显示肿瘤增强后“脑回征”消失,呈粟粒样改变。
表 3.
肿瘤影像学特征的两组间比较分析
| SNIP组(n=60) | IP-SCC组(n=29) | χ 2 | P | |
| 鼻窦CT | ||||
| 鼻腔鼻窦骨质破坏吸收 | 25 | 20 | 5.829 | 0.016 |
| 眶壁骨质破坏 | 1 | 5 | 7.543 | 0.006 |
| 颅底骨质破坏 | 0 | 6 | 13.311 | < 0.01 |
| 鼻窦骨质增生硬化 | 37 | 5 | 15.483 | < 0.01 |
| 鼻窦MRI | ||||
| 脑回征 | 46 | 6(局部) | 25.220 | < 0.01 |
| 眶内受累 | 1 | 5 | 7.543 | 0.006 |
| 颅底硬膜强化 | 0 | 3 | 6.423 | 0.05 |
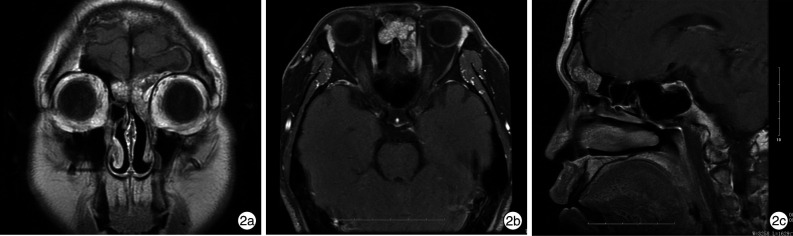
图 2.
IP-SCC组患者复发额窦肿瘤在鼻窦MRI和CT中所见
2a:MRI冠状位T1WI增强扫描,可见额窦及额隐窝区肿瘤呈粟粒样不均匀强化;2b:MRI轴状位T1WI增强扫描,可见肿瘤增强后不均匀强化;2c:MRI矢状位T1WI增强扫描,可见肿瘤呈粟粒样改变,无“脑回征”。
2.5. 内翻性乳头状瘤恶变的多因素回归分析
通过以上统计学分析发现,具有鉴别SNIP恶变的危险因素包括:①症状:涕中带血;②长期吸烟史;③内镜检查:肿瘤表面附着脓性分泌物;④影像学指标:鼻窦CT示眶壁、颅底骨质破坏,鼻窦增强MRI示无“脑回征”、眶内受累、颅底硬膜强化。将上述指标进行多因素Logistic回归分析,由表 4结果可见:涕中带血、长期吸烟史、内镜下见脓涕附着肿瘤、CT示眶壁骨质破坏、MRI示眶内组织受累、脑回征消失等6个因素可作为SNIP恶变的预测危险因素。其中,“脑回征消失”的OR值约为44,提示有该影像学表现的患者发生SNIP恶变的可能性增加到44倍,在预测SNIP恶变的多项因素中更重要。这一回归模型对SNIP恶变的预测准确率为75.0%,对良性SNIP的预测准确率为96.7%,模型总体预测准确率为89.8%,表明统计学方法可靠,结果可信,这些因素也与临床实际一致。
表 4.
内翻性乳头状瘤恶变的多因素回归分析
| 因素 | b | S.E | Wald χ2 | P | OR | 95%CI | |
| 下限 | 上限 | ||||||
| 涕中带血 | -2.913 | 1.055 | 7.628 | 0.006 | 0.054 | 0.007 | 0.429 |
| 吸烟史 | -2.040 | 0.970 | 4.428 | 0.035 | 0.130 | 0.019 | 0.869 |
| 内镜见脓涕 | -3.263 | 1.076 | 9.196 | 0.002 | 0.038 | 0.005 | 0.315 |
| CT示眶壁骨质破坏 | -2.803 | 2.106 | 4.152 | 0.042 | 0.061 | 0.001 | 3.764 |
| CT示颅底骨质破坏 | -15.459 | 28 420.737 | 0.000 | 0.999 | 0 | 0.000 | — |
| MRI示眶内组织受累 | -2.079 | 1.752 | 6.296 | 0.022 | 0.125 | 0.004 | 3.875 |
| MRI示颅底硬脑膜强化 | -3.959 | 34 338.972 | 0.000 | 0.999 | 0.019 | 0.000 | — |
| MRI脑回征消失 | 3.790 | 1.074 | 12.450 | 0.001 | 44.237 | 5.390 | 363.062 |
3. 讨论
SNIP恶变的发病机制目前未完全阐明,可能与HPV病毒感染、长期慢性炎症作用、环境因素、职业暴露等因素有关[6-7]。肿瘤癌变是一个复杂的多阶段、多步骤的过程,涉及多个癌基因或抑癌基因的改变。有学者对p53基因突变、HPV感染、Ki-67核抗原阳性率等与SNIP恶变的相关性进行了大量研究。研究结果显示抑癌基因p53突变后产生的突变型p53在恶变和SNIP不典型增生中高表达,与良性SNIP中的表达有显著差异,提示p53异常表达与SNIP的恶变和癌前病变有关,是恶性肿瘤发生中的重要相关因素[8]。HPV感染是SNIP的发病机制之一。一项系统回顾和Meta分析研究发现,高危组的HPV感染与SNIP的复发、癌变相关[9],但HPV对SNIP的恶性转化过程可能无直接诱导作用,还需与宿主细胞癌基因激活、抑癌基因失活共同发挥作用[10]。感染HPV同时伴有p53基因的突变可能使发生癌变的危险性增加[11]。Ki-67是一种与细胞增殖相关的核抗原,其表达高低可评价细胞的增殖状态,对研究肿瘤生物学行为有重要意义。研究结果表明在鼻息肉、良性SNIP、SNIP不典型增生、IP-SCC患者中Ki-67活性依次增强,与SNIP的良恶性密切相关[12]。
也有许多研究分析了SNIP与IP-SCC的区别[13-14],Miyazaki等[13]对70例SNIP患者(包括6例IP-SCC患者)进行了研究,发现疼痛、涕中带血、骨质破坏是IP-SCC的临床特点,但因为所研究的病例数较少,其临床价值有限。还有学者发现影像学检查可用于SNIP肿瘤性质的评估[15-16]。有学者认为鼻窦CT上的有骨质侵蚀表现为侵袭性肿瘤,符合IP-SCC。但SNIP也可显示骨质破坏,从鼻窦CT单独比较骨质破坏难以将两者区分。MRI在鉴别SNIP与IP-SCC时具有重要作用[17-18],MR T2WI或增强T1WI上呈规整的“脑回征”外观是诊断SNIP的可靠征象,形态不规整则提示肿瘤伴发恶变。另外,核磁DWI相中ADC值也具有鉴别SNIP良恶性的作用[5]。
本研究在以往研究的基础上结合临床实践,总结多项临床指标和影像学指标,对两组患者进行对比分析,并对有显著性差异的指标进行多因素Logistic回归分析。研究结果提示年龄、性别因素不是SNIP恶变的危险因素。SNIP组和IP-SCC组患者均以男性多见,男女比分别为1.86:1和1.9:1,低于文献报道的男:女为3~5:1[19]。比较两组间临床症状差异时,涕中带血为IP-SCC组中有显著差异的症状,多因素Logistic回归分析显示,涕中带血是SNIP恶变的预测因素,因此接诊患者时需详细询问有无这一症状。嗅觉减退在SNIP和SNIP恶变患者中均可出现,无显著性差异。有研究认为慢性炎症是SNIP的发病因素之一[2],可能与肿瘤癌变相关,但研究结果提示鼻部的慢性感染史并不是肿瘤恶变的危险因素,可能仅与肿瘤复发相关。临床中也有医师认为多次手术史可能导致肿瘤恶变,本研究结果显示多次手术史与肿瘤恶变无相关性。本研究结果还提示长期吸烟史是SNIP恶变的另一危险因素,这一结果与既往研究结果一致[20],提示吸烟是SNIP恶变的重要促发因素,临床工作中应积极倡导患者戒烟。
此外,内镜检查中见“肿瘤附着脓涕”也是SNIP恶变的危险因素。这一结果提示肿瘤微生态环境的改变可能在肿瘤恶变中发挥了一定作用,还需要进一步深入研究来证实21。内镜检查见肿瘤呈分叶状改变时,恶变的可能性较小。由上述结果可以看出,临床治疗中详细地询问患者病史和症状、内镜下仔细观察肿瘤特征对术前判断肿瘤是否恶变十分重要。
内翻性乳头状瘤好发于筛窦、上颌窦,其次为额窦和鼻腔外侧壁,发生于蝶窦较为少见,因此恶变的肿瘤累及部位也以筛窦和上颌窦多见。因本研究中仅1例患者为双侧肿瘤,其余患者均为单侧发病,因此无法对双侧肿瘤是否为肿瘤恶变危险因素做出分析。发生于筛窦和上颌窦的肿瘤最易侵犯的周围组织包括眼眶和颅底,通过影像学检查可以准确地对肿瘤侵犯周围组织的程度和范围进行判断。由表 3可以看出,鼻窦CT眶壁和颅底骨质的破坏侵犯常常出现于恶变肿瘤中。多因素Logistic回归分析结果显示,眶壁骨质破坏是SNIP恶变的预测因素,而颅底骨质破坏不是预测因素。“脑回征”是指MRI增强T1WI或T2WI上病变内部结构呈平行排列的高和等信号相间的条状影,也称为“栅栏征”、“相间条状”或“柱状”[17]。与病理结果相对照,SNIP的病理特点是上皮组织内翻入间质组织,上皮组织增强后轻度强化,T2WI呈等信号,而间质组织血供丰富增强后明显强化,间质组织多为水肿组织T2WI呈长T2信号,因此上皮组织与间质组织相间排列时可呈现明暗相间的“脑回征”表现。该特征对SNIP的诊断具有特征性意义。当肿瘤恶变后,上皮组织与间质组织的相间排列的病理特点发生改变,因此不再呈现“脑回征”改变,多因素Logistic回归分析结果也证实了脑回征的消失是肿瘤恶变的预测因素。另外,眶内组织受累提示肿瘤侵犯周围组织是肿瘤恶变的预测因素。这一结果与以往研究结论一致[5],但本研究还对病史、症状和体征等多因素进行研究分析,明确了病史、症状、体征仔细采集的重要性,再结合影像学特征可以对肿瘤是否发生恶变做出全面的预测。
综上所述,为了更精准地在术前对SNIP是否恶变做出预测,需要详细采集临床资料,包括询问病史、症状、内镜检查,并针对性地进行鼻窦CT、MRI特征的分析才能准确做出术前诊断。涕中带血、长期吸烟史、内镜下见脓涕附着肿瘤、CT示眶壁骨质破坏,MRI示眶内组织受累、脑回征消失6个因素是SNIP恶变的危险因素。全面的临床资料分析有助于提高肿瘤术前诊断的准确性,从而精准地制定手术方案,实施恰当的手术操作,提高治疗效果,改善患者预后。
References
- 1.Anari S, Carrie S. Sinonasal inverted papilloma:narrative review. J Laryngol Otol. 2010;124(7):705–15. doi: 10.1017/S0022215110000599. [DOI] [PubMed] [Google Scholar]
- 2.Wang MJ, Noel JE. Etiology of sinonasal inverted papilloma:A narrative review. World J Otorhinolaryngol Head Neck Surg. 2017;3(1):54–58. doi: 10.1016/j.wjorl.2016.11.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Zhang L, Fang G, Yu W, et al. Prediction of malignant sinonasal inverted papilloma transformation by preoperative computed tomography and magnetic resonance imaging. Rhinology. 2020;58(3):248–256. doi: 10.4193/Rhin19.240. [DOI] [PubMed] [Google Scholar]
- 4.Thompson L. World Health Organization classification of tumours:pathology and genetics of head and neck tumours. Ear Nose Throat J. 2006;85(2):74. doi: 10.1177/014556130608500201. [DOI] [PubMed] [Google Scholar]
- 5.Yan CH, Tong C, Penta M, et al. Imaging predictors for malignant transformation of inverted papilloma. Laryngoscope. 2019;129(4):777–782. doi: 10.1002/lary.27582. [DOI] [PubMed] [Google Scholar]
- 6.Re M, Gioacchini FM, Bajraktari A, et al. Malignant transformation of sinonasal inverted papilloma and related genetic alterations:a systematic review. Eur Arch Otorhinolaryngol. 2017;274(8):2991–3000. doi: 10.1007/s00405-017-4571-2. [DOI] [PubMed] [Google Scholar]
- 7.Tong C, Palmer JN. Updates in the cause of sinonasal inverted papilloma and malignant transformation to squamous cell carcinoma. Curr Opin Otolaryngol Head Neck Surg. 2021;29(1):59–64. doi: 10.1097/MOO.0000000000000692. [DOI] [PubMed] [Google Scholar]
- 8.Uchi R, Jiromaru R, Yasumatsu R, et al. Genomic Sequencing of Cancer-related Genes in Sinonasal Squamous Cell Carcinoma and Coexisting Inverted Papilloma. Anticancer Res. 2021;41(1):71–79. doi: 10.21873/anticanres.14752. [DOI] [PubMed] [Google Scholar]
- 9.Zhao RW, Guo ZQ, Zhang RX. Human papillomavirus infection and the malignant transformation of sinonasal inverted papilloma:A meta-analysis. J Clin Virol. 2016;79:36–43. doi: 10.1016/j.jcv.2016.04.001. [DOI] [PubMed] [Google Scholar]
- 10.Sahnane N, Ottini G, Turri-Zanoni M, et al. Comprehensive analysis of HPV infection, EGFR exon 20 mutations and LINE1 hypomethylation as risk factors for malignant transformation of sinonasal-inverted papilloma to squamous cell carcinoma. Int J Cancer. 2019;144(6):1313–1320. doi: 10.1002/ijc.31971. [DOI] [PubMed] [Google Scholar]
- 11.Frasson G, Cesaro S, Cazzador D, et al. High prevalence of human papillomavirus infection in sinonasal inverted papilloma:a single-institution cohort of patients. Int Forum Allergy Rhinol. 2020;10(5):629–635. doi: 10.1002/alr.22539. [DOI] [PubMed] [Google Scholar]
- 12.Hakim SA, Abd Raboh NM, Shash LS. IMP3 Immunohistochemical Expression in Inverted Papilloma and Inverted Papilloma-Associated Sinonasal Squamous Cell Carcinoma. Anal Cell Pathol(Amst) 2021;2021:6639834. doi: 10.1155/2021/6639834. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Miyazaki T, Haku Y, Yoshizawa A, et al. Clinical features of nasal and sinonasal inverted papilloma associated with malignancy. Auris Nasus Larynx. 2018;45(5):1014–1019. doi: 10.1016/j.anl.2018.02.009. [DOI] [PubMed] [Google Scholar]
- 14.黎 庆辉, 朱 江. 鼻腔-鼻窦内翻性乳头状瘤复发与恶变的临床分析. 临床耳鼻咽喉头颈外科杂志. 2014;28(11):797–800. [PubMed] [Google Scholar]
- 15.Kasbekar AV, Swords C, Attlmayr B, et al. Sinonasal papilloma:what influences the decision to request a magnetic resonance imaging scan? J Laryngol Otol. 2018;132(7):584–590. doi: 10.1017/S0022215118000804. [DOI] [PubMed] [Google Scholar]
- 16.房 高丽, 王 成硕. 鼻腔鼻窦内翻性乳头状瘤起源部位的影像学研究进展. 临床耳鼻咽喉头颈外科杂志. 2014;28(23):1902–1906. [PubMed] [Google Scholar]
- 17.王 新艳, 陈 青华, 王 英, et al. 多参数MRI鉴别鼻腔鼻窦内翻性乳头状瘤恶变的价值. 中华放射学杂志. 2017;51(7):500–504. doi: 10.3760/cma.j.issn.1005-1201.2017.07.005. [DOI] [Google Scholar]
- 18.梁 青壮, 李 德志, 徐 震纲. 鼻腔-鼻窦内翻性乳头状瘤临床及其相关研究进展. 中国耳鼻咽喉颅底外科杂志. 2015;21(1):80–84. [Google Scholar]
- 19.Hong SL, Kim BH, Lee JH, et al. Smoking and malignancy in sinonasal inverted papilloma. Laryngoscope. 2013;123(5):1087–1091. doi: 10.1002/lary.23876. [DOI] [PubMed] [Google Scholar]
- 20.杨 凤娟, 甘 卫刚, 刘 锋, et al. 鼻腔菌群多样性与慢性鼻窦炎伴鼻息肉手术预后相关性分析. 临床耳鼻咽喉头颈外科杂志. 2020;34(9):799–804. doi: 10.13201/j.issn.2096-7993.2020.09.008. [DOI] [PMC free article] [PubMed] [Google Scholar]