Abstract
Structural nasal obstruction(SNO) is a series of diseases caused by congenital or acquired structural anatomical abnormalities of nasal airway and its surrounding tissues, which leads to increased nasal ventilation resistance. The effect of medication drugs for SNO is poor and surgical intervention is often needed. However, the abnormal structure of nasal airway is very complex, including the periphery of nasal airway, internal nasal airway, the front and rear of nasal airway and complex factors. These abnormal structures may interfere with the nasal airflow mechanics by changing the nasal ventilation volume and disrupting the symmetry of the bilateral nasal cavity, and finally lead to subjective feeling of nasal obstruction. In addition, the structure of nasal airway has plasticity. After the abnormal structure appears, the corresponding compensation of nasal airway can occur to ensure normal nasal ventilation and bilateral nasal cavity symmetry. Therefore, the SNO is the result of the failure of nasal airway remodeling after the appearance of abnormal structures. The etiology of SNO is complex, involving original structural abnormalities, nasal symmetry changing and nasal airway structure remodeling. Therefore, accurate identification of the main factors leading to SNO is the vitalpremise of making personalized nasal ventilation surgery.
Keywords: nasal obstruction, nasal airway, etiology
鼻塞(nasal obstruction)是耳鼻喉科的常见主诉,是多数鼻科疾病的共有症状,可严重影响患者的睡眠及生活质量[1]。鼻塞可以由炎症(过敏性及感染性)、占位病变、鼻气道结构异常、药物性、生理性、感觉神经性及心理性等因素引起[2-3]。其中黏膜炎症引起的鼻塞多数持续时间不会太长,为急性或亚急性,药物治疗可有效缓解[4]。但对于鼻塞持续时间超过半年以上的慢性鼻塞患者,其病因更为复杂且顽固。
慢性鼻塞患者中最常见的病因为结构因素[5]。鼻气道及周围结构形态异常导致鼻通气阻力增加的一系列疾患,统称为结构性鼻塞(structural nasal obstruction)。鼻通气本质是一个流体力学与生理学的复合内容,鼻腔异常结构会改变鼻腔物理性通气容积、干扰气流、影响鼻黏膜对气体加温加湿等系列生理功能,进而使患者产生鼻塞的病理感受[6]。由于结构性鼻塞的主要病因是鼻气道的骨与软骨支架结构异常,因此保守药物治疗的效果通常较差,往往需手术干预。此外,结构性鼻塞患者具体的异常结构差异很大,手术干预的内容也需要个体化。所以如何准确确定结构性鼻塞的阻塞因素并进行有效干预是耳鼻咽喉头颈外科医生面临的重要课题。
准确的鼻通气手术实施,需要医生深刻理解结构性鼻塞的机制,全面认识引起结构性鼻塞的结构性因素。术前要对异常结构进行逐一排查评估,确定各异常结构对鼻通气影响的权重,为患者制定个性化手术干预方案,进而避免不准确的结构矫正导致鼻塞缓解不理想。因此,本文基于近年来对结构性鼻塞的认识,系统回顾结构性鼻塞的可能病因及机制,期望为临床结构性鼻塞的诊疗提供帮助。
1. 鼻气道结构异常导致鼻塞的机制
1.1. 鼻通气阻力改变的流体动力学机制
鼻气道是一个不规则的物理性管腔(图 1),气流通过这一管道时遵循物理学的气体流体力学原理[7]。而结构性鼻塞的产生即与鼻腔异常结构对鼻腔气流的影响有关[8],其具体原理如下:①根据泊肃叶定律(Poiseuille law),流体在水平圆管中作层流运动、管两端压强不变时,其体积流量(Q)与管半径的4次方(r4)成反比,即管道半径或面积的轻微变化都可对流体流量产生极大的影响[7]。而鼻气道可视为骨性及软组织围成的通道,当其外周结构异常时,常使鼻气道横截面积缩小。因此如果患者不增强鼻呼吸力度,鼻通气流量会明显下降,使患者产生鼻通气不足的感觉。②根据流体流动的连续性原理(continuity principle of fluid flow),在稳定的流体中,流体的速度与通道的横截面积成反比。当患者正常鼻呼吸时,将鼻气道看成一个管道,则其横截面积最小的部位气流速度最快[7]。再根据伯努利定律(Bernoulli principle),流体速度的增加与腔内压力的降低有关。而鼻气道腔内气压降低可使周围软组织塌陷,使气道阻塞进一步恶化[7]。所以当以软骨或软组织构成为主的部位出现结构异常时,鼻塞发生的可能性更大。此外,当患者鼻通气不足时常会代偿性增加呼吸肌的收缩,使胸腔负压加大、鼻气道两端压差增加,进而加快鼻腔内整体的气流流速,以期获得充足的鼻通气。然而因此产生的高速气流,也会导致软组织塌陷的风险上升,最终代偿失败引发鼻塞。
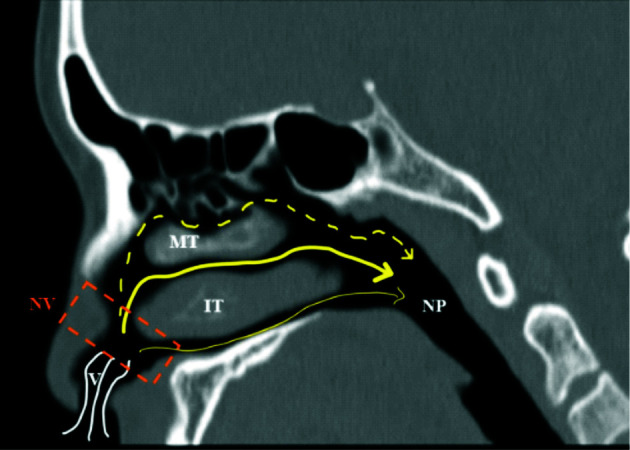
图 1.
吸气时鼻气道气流流动情况
吸入气体通过鼻孔进入,在宽敞的鼻前庭(V)气流以湍流为主(弯曲白线)。在通过狭窄的鼻阀区即鼻阈(NV)时以高速的层流为主(黄色线)。大部分气流(粗黄线)沿抛物线从下鼻甲上方通过,另外在下鼻甲下方(细黄线)和朝向前颅底的上方(细黄虚线)也有少量气流通过。鼻腔内气流最终于鼻咽(NP)部汇合。
1.2. 鼻腔气流动力学变化与鼻腔生理感知
鼻塞本身是一个主观感受,类似于痛温觉,存在感受器、传入神经,并最终在中枢形成鼻塞的认知。目前对鼻塞的感觉形成通路认识尚不透彻,但是已知瞬时受体电位通道蛋白(TRPM8),即冷受体/薄荷醇感受器参与其中。Zhao等[9]研究认为该感受器并非单纯感受鼻内气体温度,而是感受鼻黏膜的温度变化,是鼻黏膜的温度感受器。当黏膜温度降低时TRPM8将感觉通过三叉神经上传,使人产生凉爽感即鼻腔通畅感[10]。而鼻黏膜温度变化是由环境空气温度、湿度、鼻腔结构及气流之间相互作用等多方面因素决定的[10]。所以当异常结构导致鼻流量减少时,可通过影响鼻黏膜散热使患者产生鼻塞的主观感受。如空鼻症(empty nose syndrome)或术中鼻甲切除过多的患者,虽然鼻腔物理容积增大但依然有鼻塞感,其机制可能与鼻黏膜面积减少导致功能正常的TRPM8受体数量不足有关。同时也与鼻甲缺失使得鼻腔内气流湍流减少、层流为主,空气与黏膜相互作用减弱,不能进行充足的黏膜冷却有关[10]。
2. 鼻气道结构异常与结构性鼻塞
鼻气道内所有可导致鼻通气阻力增加的异常结构均属于结构性鼻塞概念范畴。而鼻气道结构复杂,包括由鼻骨、上颌骨、筛骨、犁骨及腭骨等组成的刚性框架,和鼻翼软骨及鼻中隔软骨组成的半刚性框架[7],二者共同影响鼻腔的物理通气容积。且外鼻软骨结构具有活动性,其支撑力减弱时会出现动态塌陷导致鼻塞[7]。鼻腔入口处的软组织阀门结构(内、外鼻阀),是鼻气道内最狭窄部位,同时有极强的鼻阻力调节能力[8]。此外,鼻腔内三对鼻甲以及其下方相应的鼻道是重要的鼻侧壁结构。骨性卷曲的鼻甲结构为增加黏膜面积提供了解剖基础,有助于气流与黏膜的充分接触,实现对气体加温加湿的生理功能。黏膜下结构富含可由自主神经调节收缩的血管网,使得黏膜厚度具有可变性,可通过改变鼻气道横截面积进而影响鼻通气[11]。特别是下鼻甲前端,参与构成内鼻阀,对鼻通气的影响更大。鼻道则是各鼻窦的重要引流通道,阻塞时易造成炎症引发鼻塞。鼻腔外侧鼻窦的前筛房结构过度气化,也可以挤占鼻腔通气容积。因此,导致结构性鼻塞的结构因素具有多样性,本文依据结构性因素发生的位置将其划分为鼻气道外围、鼻气道内部、鼻气道前后端以及复合性因素。
2.1. 鼻气道外围因素
鼻气道的外围结构复杂,包括构成鼻气道框架的鼻外围结构(上颌骨额突、鼻骨及鼻背的软骨结构)和鼻底部硬腭(上颌骨腭突及腭骨),鼻腔外围的上颌窦及筛房结构(鼻丘、钩突、筛泡)等。Williams等[12]研究表明在进行了鼻中隔成形和/或鼻甲整形及鼻阀(即鼻阈)修复手术的患者中,依然有部分患者存在术后慢性鼻塞,并与腭弓高、上颌横向宽度窄、梨状孔处鼻角锐利有关。可见鼻气道外围因素异常可为影响鼻通气的重要原因。
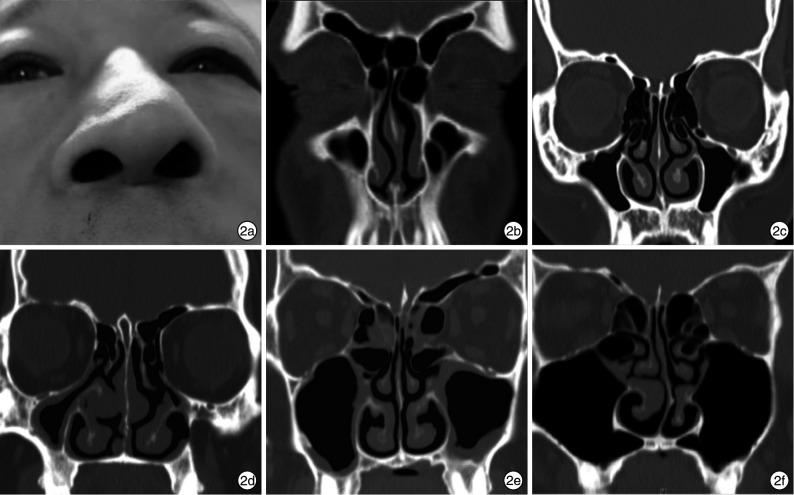
鼻气道外围结构异常与外伤性、先天性及后期发育异常等因素有关。外伤易导致鼻骨骨折而引起鼻畸形,以歪鼻、鞍鼻、驼峰鼻多见(图 2a)。而相对于单纯性鼻骨骨折,鼻骨骨折合并上颌骨额突骨折更为常见,且部分严重者多伴有鼻中隔偏曲[13]。先天因素有胚胎期上颌骨鼻突过度生长或者上颌骨过度内移引起的梨状孔狭窄[14],在轴位CT的下鼻道平面测量足月新生儿梨形孔径宽度 < 8 mm为梨状孔狭窄。但其发病率较低,仅为后鼻孔闭锁的1/3。鼻气道外围结构异常引起鼻塞的原因与挤占鼻腔有效容积有关。按其位置分类,前部多见梨状孔狭窄;前中部有鼻丘的过度气化(图 2b)、钩突气化(图 2c)、钩突肥大及内翻等异常(图 2d)、筛泡的过度气化等(图 2e);后部包括上颌窦过度气化所致上颌窦内侧壁内移(图 2f)[15];下部包括硬腭高拱,多由口腔气流长期冲击硬腭而鼻腔内气流刺激减弱造成,常见于长期鼻塞导致的以异常口呼吸为主的儿童[16]。除直接降低鼻腔通气容积外,异常结构的存在也可增加鼻腔内气流的湍流成分使鼻阻力增加,如常位于中鼻甲前端、钩突前上方的鼻丘气房及其下方的筛泡若肥大可使经过中鼻道后段的湍流成分增加[17]。
图 2.
鼻气道外围因素
2a:鼻翼塌陷导致外鼻畸形;2b:左侧鼻丘气房过度气化;2c:双侧钩突气化;2d:钩突肥大伴有角度内翻;2e:双侧筛泡肥大;2f:上颌窦过度气化突入鼻底。
2.2. 鼻气道内部因素
鼻气道内部因素主要是鼻阀即鼻阈(nasal valve)、鼻甲、鼻中隔及鼻中隔膨隆区域(septal swell body)等结构性原因。常见的异常结构有内、外鼻阀的狭窄或者塌陷、鼻中隔偏曲、鼻中隔膨隆区增大、下鼻甲肥大等[7, 18]。
2.2.1. 鼻中隔偏曲与结构性鼻塞
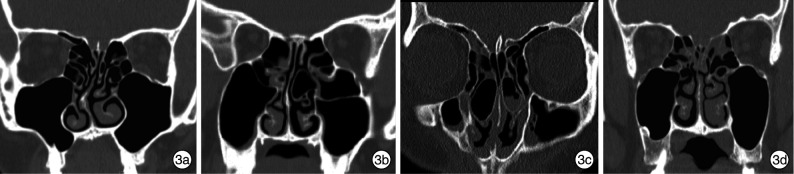
鼻中隔偏曲是造成结构性鼻塞最常见的原因,且鼻中隔偏曲的形态多样,有S形、C形、前部偏曲、后部偏曲、低位偏曲、高位偏曲等[8, 18]。但并非所有鼻中隔偏曲均会导致鼻塞,研究表明前部或高位的偏曲可使内鼻阀缩小而产生显著鼻塞,而鼻腔后部或低位的偏曲对气流阻力影响较小甚至没有[7]。此外,鼻中隔偏曲还会导致两侧鼻腔结构发生代偿性异常改变[19],此类患者若只进行鼻中隔成形术而未对代偿结构进行处理,实际上也未能恢复双侧鼻腔对称性(图 3a)。比如鼻中隔偏曲伴偏曲凹侧下鼻甲肥大的患者在单纯鼻中隔成形术后,原相对宽的鼻中隔凹侧通气容积反而会显著缩小,可形成术后结构性鼻塞。此外,位于后鼻部筛骨垂直板和犁骨交界处的鼻中隔的棘突也会增加鼻阻力,多由创伤后此处连接中断、局灶性角度偏移造成,常与鼻中隔偏曲并存[8]。值得注意的是,不同偏曲部位对应的手术方法并不相同,因此有学者提出了以鼻中隔偏曲单元为基础的鼻中隔偏曲分型方法,可指导个体化鼻中隔矫正手术的实施[20]。
图 3.
影像学检查
3a:鼻中隔前端偏曲伴凹侧下鼻甲肥大;3b:右侧上颌窦内侧壁过度气化向内,左侧中鼻甲后端气化;3c:双侧中鼻甲泡;3d:左侧中鼻甲反张。
2.2.2. 鼻甲改变与结构性鼻塞
下鼻甲异常包括肥大与气化,后者相对罕见[21]。由于下鼻甲前端参与构成鼻气道最狭窄部位即内鼻阀,故下鼻甲肥大对鼻通气的影响主要是前端造成。此外,下鼻甲存在与鼻中隔偏曲方向有关的代偿,且多发生在鼻中隔偏曲的凹面侧,包括骨质肥厚与黏膜肥厚,同时伴有角度的异常改变(图 3a)[22]。近期相关研究显示,这种代偿肥厚以骨性增厚为主,内侧黏膜增厚次之,而外侧黏膜增厚并不明显[19],故目前有学者推荐对伴下鼻甲肥大的鼻中隔偏曲患者同时行下鼻甲骨折外移术,可达到减容和缩小下鼻甲骨角度的效果[22]。而对于下鼻甲肥大程度与鼻中隔偏曲程度的相关性研究,目前结果并不统一[19, 23]。此外,值得注意的是下鼻甲肥大虽然是临床常见诊断,但目前却缺乏统一的诊断标准。而关于下鼻甲肥大的量化分度,Camacho等[24]建立了一个根据鼻内镜检查,采取四分位法对下鼻甲肥大造成的气道阻塞进行客观评价的分级量表,但仍需验证,而且下鼻甲大小还受鼻周期的影响。因此,下鼻甲肥大的诊断以及手术中处理到何种程度,目前仍依靠临床医生的经验。
中鼻甲异常以泡性中鼻甲较为常见[21](图 3b、c),按气化部位可分三类:广泛型最多见约占半数以上,其次为只位于垂直板的板状型,而只位于下部的球状型则较少见[25]。泡性中鼻甲可发生于单侧或双侧,但后者较多见[21]。在鼻中隔偏曲的患者中,单侧泡性中鼻甲发病率增高,且多出现在鼻中隔偏曲的凹面侧[26]。在双侧均存在泡性中鼻甲的患者中,凹侧的泡性中鼻甲也往往大于凸侧(图 3c)[23],反映了中鼻甲的代偿性重塑。此外,其与鼻中隔偏曲的高度也存在一定关系,伴泡性中鼻甲的患者鼻中隔偏曲的位置高于无泡性中鼻甲患者[23]。虽然多数情况下,中鼻甲泡多体积较小且无症状,但如果若气化严重也会增加鼻通气的阻力而造成鼻塞。此外,中鼻甲反张(图 3d)会导致中鼻道狭窄,也被认为是鼻塞的结构性原因之一[27]。还有,起源于筛骨的第二中鼻甲,可以将正常的中鼻甲向内推移造成鼻塞[28]。同下鼻甲一样,鼻中隔偏曲也可造成中鼻甲的骨性与黏膜性的代偿改变[29],且Demir等[30]研究表示鼻中隔成形术后并不能改变这种代偿性肥大,术后1年这种代偿性肥大依然存在。因此在结构性鼻塞的治疗中,除矫正鼻中隔偏曲外,也需对术后可能影响通气的鼻腔代偿性结构改变进行适当的处理,恢复双侧鼻腔对称性。此外,凹侧中鼻甲气化严重时会越过中线,这样的代偿性改变如果在手术中不予处理,鼻中隔也难以回到中线位置。
2.2.3. 鼻阀与结构性鼻塞
外鼻阀,即鼻翼内的鼻前庭区域,由下外侧鼻软骨、尾端鼻中隔以及鼻底围成。内鼻阀由鼻中隔中间部分、鼻外侧软骨的尾侧及下鼻甲的前端构成,是鼻腔最狭窄的部位,对呼吸道阻力影响最大,占上呼吸道总阻力的2/3左右[7-8],应作为结构性鼻塞的评估重点。鼻中隔与外侧鼻软骨间的夹角称为鼻瓣角(nasal valve angle),该角度的小幅度下降可能导致鼻塞症状,可作为临床诊断参考指标[31],但其平均指标受人种等因素影响。白种人中鼻瓣角在10°~15°[32],而Suh等[33]研究表示CT扫描测得亚洲人鼻瓣角为(21.6±4.5)°,明显高于白种人。鼻阀塌陷导致鼻气道横截面积缩小是引起鼻塞的常见原因,常由鼻外伤或医源性因素造成,且软组织的弹性也会随着年龄增高和既往手术史而逐步减低[1]。研究表明鼻阀塌陷是鼻中隔成形术后鼻塞的重要原因[34-35],由于外侧鼻软骨和下外侧鼻软骨的弹性对鼻阀起关键的支撑作用,术中若未能将上外侧软骨与鼻中隔软骨背侧重新连接会导致下方内鼻阀塌陷而引起鼻塞。此外,鼻阀塌陷可为静态,也可呈随呼吸运动变化的动态塌陷。因此医生需对患者的内鼻阀和外鼻阀在静态、正常呼吸以及深呼吸时进行可视化动态塌陷评估,可应用Cottle试验、改良的Cottle手法等辅助判断。
2.3. 鼻气道前后端因素
鼻气道前端入口为前鼻孔,其狭窄可由鼻小柱肥大、鼻翼塌陷造成。鼻气道后端由鼻后孔分隔鼻腔和鼻咽部,与骨中隔和鼻甲后缘的位置相对应。先天性鼻后孔闭锁是新生儿鼻塞的最常见病因,可分为膜性、骨性、混合性闭锁,其中混合性较为常见,膜性最少见。此外,除了鼻腔解剖结构的变异外,一些鼻气道前后端的占位性病变也可阻碍鼻通气,如前端鼻前庭囊肿,后端腺样体肥大、鼻咽癌等[1]。
2.4. 复合性因素
虽然目前无文献报道复合因素的比例,但是结构性鼻塞往往并非单一因素造成,常由两个或两个以上异常结构性因素导致,如前文所述鼻中隔偏曲造成两侧鼻腔结构的代偿改变[22, 29]。因此,有学者提出单独鼻中隔偏曲矫正不适合大部分结构性鼻塞[6]。结构性鼻阻塞手术前须对引起结构性鼻塞的结构性因素逐一排查、综合评估,选择与患者鼻塞症状程度最相关的一系列因素(影响患者鼻通气阻力最明显的因素)进行干预,这样能减少诊断评估的疏漏和手术干预的不足,进而提高手术干预的效果。
最后,需要再次强调鼻塞的医源性因素也很常见,如鼻窦鼻腔手术后的鼻腔粘连会造成相应部位气道狭窄、鼻骨整形术中大范围的畸形截骨可能导致鼻骨塌陷等[7],均可影响鼻气道正常通气,所以在鼻气道周围的手术中也需要考虑到对鼻通气阻力的影响,降低医源性鼻塞的发生率。
2.5. 鼻腔结构重塑与结构性鼻塞的形成
值得注意的是,鼻气道结构改变与结构性鼻塞之间并非等同。存在结构异常并不一定导致鼻塞,比如鼻中隔偏曲在正常人群中的出现率高达80%[1],但并非所有鼻中隔偏曲患者均有鼻塞症状。所以结构性鼻塞需要满足两个条件:一是具有影响鼻气道阻力的异常结构存在;二是主观鼻塞感与客观鼻塞证据(即鼻通气阻力增加)同时存在。
那么出现结构异常后只有部分人出现了结构性鼻塞,而大部分未出现的原因是什么?为回答这一问题,有学者提出了鼻气道结构的可塑性(plasticity)及重塑(structural remodeling)的概念[6]。可塑性就是鼻气道结构可做出改变的能力。重塑就是鼻气道结构发生改变后,鼻气道为适应该变化而进行的自身结构适应性调整的结果。基于此,学者提出结构性鼻塞是鼻气道结构代偿性重塑失败的结果[6],即鼻腔的黏膜与骨质的可塑性也是有限度的,当鼻气道结构的重塑不能代偿异常结构造成的两侧鼻腔通气不平衡或通气量不足、或发生过度代偿等变化时,会引发结构性鼻塞。因此,鼻气道内先导性的结构异常可能不直接导致鼻塞,而是经过较长时间的代偿失败后才引起鼻塞。这可能是鼻气道异常结构出现时间与鼻塞发生时间之间存在不同步的原因。而成功的代偿则会适应这一结构异常,使患者不出现症状。
那么怎样的代偿性重塑才算成功?基于鼻空气动力学和鼻塞的形成机制,成功的代偿应该具备两点: 首先鼻通气阻力没有增加、患者无鼻塞感。其次,鼻腔具有良好的对称性。因为两侧鼻气道之间的对称性或者气流的平衡性是患者鼻通气正常、无鼻塞感的重要前提[36-37],其平衡性被干扰也被认为会触发鼻气道广泛的重塑[18, 36],包括中鼻甲、下鼻甲、前筛复合体等结构,但其具体机制尚未明确。Li等[36]研究发现,当鼻中隔偏曲伴发偏曲对侧泡性中鼻甲时,有利于恢复鼻腔两侧空气动力学及加温功能的对称性,且患者偏曲侧鼻塞的主诉率明显低于无中鼻甲泡患者,可提示中鼻甲泡是为了恢复两侧鼻腔对称性的一个代偿性改变,印证了鼻腔结构代偿性重塑。但同时研究者也发现泡性中鼻甲的出现会使鼻腔变窄、增加患者的总鼻阻力,可造成部分患者发生非偏曲侧或双侧鼻塞。所以必须强调,鼻气道结构与空气动力学的对称性并非代偿成功的唯一标准,保证鼻通气阻力适中不导致鼻塞同样重要。
虽然鼻腔内可发生重塑的结构很多,但总体按发生重塑的组织类型可分为骨性和黏膜性重塑[6, 19]。而骨与黏膜的可塑性大小,以及在重塑中所占的权重应与个体所处的发育阶段有关(图 4)。如果鼻中隔偏曲发生在鼻窦气化发育阶段,那么骨与黏膜性重塑均会明显,但若是发生在鼻窦发育后期,则以黏膜重塑为主。此外,骨与黏膜重塑速度上应存在差异,所以患者病程的长短应该亦可影响两种类型在重塑中的权重。但目前这一推断尚有待结合病史与年龄进行分析来进一步确定。
图 4.
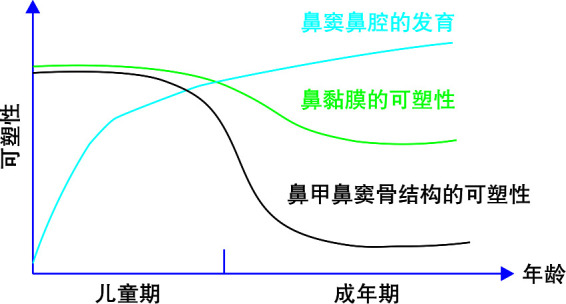
鼻腔和鼻窦可塑性随年龄的估计
结构性鼻塞是一个古老的科学问题,鼻中隔矫正手术已经进行了数千年,但是目前仍有诸多认识的不足。首先,结构性鼻塞患者中鼻腔结构存在代偿的重塑被广泛认同,但是其具体机制尚未研究透彻。目前有研究进行了儿童与成年人的对照,可以排除先天性因素导致重塑的可能[38]。那么鼻腔重塑的后天驱动因素是什么?这一驱动因素是如何影响鼻腔结构重塑?这些仍不明确。其次,在假设的驱动因素下,鼻腔结构性重塑的具体内容如何确定(鼻腔的哪些结构改变属于重塑)?机体是如何选择自身重塑结构的(什么样的机制或原理决定了重塑的具体结构)?这些问题也未明确。此外,对于结构性鼻塞的认识中,病史长短、发病年龄与结构性鼻塞的关系也要深入探讨。这可能涉及到鼻塞的重塑机制,可能与鼻腔重塑能力、重塑形式、重塑结局等有关[6],但也仅是推测性观点。最后,结构性鼻塞的干预问题更是临床的难点。结构性鼻塞病史多久干预最为合适?程度多重干预最能使患者受益?早期干预是否会避免鼻腔结构重塑,进而改善疗效?疾病初期干预是否会缓解气道阻力,进而减轻口咽腔睡眠时的负压,从而改善睡眠呼吸暂停低通气综合征的发生率或严重程度?这些问题尚需持续深入探索,而本文基于目前的各项研究成果,主要对结构性鼻塞的可能病因及机制进行了探讨,以期为后续研究提供帮助。就目前而言,不可轻视结构性鼻塞,在干预之前必须进行全面细致的定性、定量、定位评估。对多处鼻气道内异常结构在鼻塞发生中的权重要个体化的谨慎权衡,避免只停留在鼻中隔偏曲这一个结构异常中[14, 34]。
Funding Statement
首都医科大学“本科生科研创新”项目(No:XSKY2020158)
References
- 1.Schuman TA, Senior BA. Treatment Paradigm for Nasal Airway Obstruction. Otolaryngol Clin North Am. 2018;51(5):873–882. doi: 10.1016/j.otc.2018.05.003. [DOI] [PubMed] [Google Scholar]
- 2.张 罗, 韩 德民, 王 琪. 鼻炎概述. 中国耳鼻咽喉头颈外科. 2007;14(1):19–24. doi: 10.3969/j.issn.1672-7002.2007.01.007. [DOI] [Google Scholar]
- 3.张 革化, Fenton RS, Rival R, et al. 鼻阻塞的主观评价与客观鼻测量的相关性研究. 中华耳鼻咽喉头颈外科杂志. 2008;43(7):484–489. doi: 10.3321/j.issn:1673-0860.2008.07.002. [DOI] [PubMed] [Google Scholar]
- 4.Esmaili A, Acharya A. Clinical assessment, diagnosis and management of nasal obstruction. Aust Fam Physician. 2017;46(7):499–503. [PubMed] [Google Scholar]
- 5.袁 晓培, 马 有祥, 邢 志敏, et al. 鼻内镜下鼻腔成形术治疗结构性鼻炎. 临床耳鼻咽喉头颈外科杂志. 2007;21(17):782–785. [PubMed] [Google Scholar]
- 6.Liu JF, Yan ZF, Zhang ZJ, et al. Septoplasty alone is not suitable for most structural nasal obstructions. World J Otorhinolaryngol Head Neck Surgery. 2020 doi: 10.1016/j.wjorl.2020.05.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Hsu DW, Suh JD. Anatomy and Physiology of Nasal Obstruction. Otolaryngol Clin North Am. 2018;51(5):853–865. doi: 10.1016/j.otc.2018.05.001. [DOI] [PubMed] [Google Scholar]
- 8.Whyte A, Boeddinghaus R. Imaging of adult nasal obstruction. Clin Radiol. 2020;75(9):688–704. doi: 10.1016/j.crad.2019.07.027. [DOI] [PubMed] [Google Scholar]
- 9.Zhao K, Blacker K, Luo Y, et al. Perceiving nasal patency through mucosal cooling rather than air temperature or nasal resistance. PLoS One. 2011;6(10):e24618. doi: 10.1371/journal.pone.0024618. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Sozansky J, Houser SM. Pathophysiology of empty nose syndrome. Laryngoscope. 2015;125(1):70–74. doi: 10.1002/lary.24813. [DOI] [PubMed] [Google Scholar]
- 11.Baraniuk JN, Merck SJ. Neuroregulation of human nasal mucosa. Ann N Y Acad Sci. 2009;1170:604–609. doi: 10.1111/j.1749-6632.2009.04481.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Williams R, Patel V, Chen YF, et al. The Upper Airway Nasal Complex: Structural Contribution to Persistent Nasal Obstruction. Otolaryngol Head Neck Surg. 2019;161(1):171–177. doi: 10.1177/0194599819838262. [DOI] [PubMed] [Google Scholar]
- 13.张 柳青, 孙 艺渊, 王 珮华, 石 润杰, 陈 东. 2881例鼻骨骨折患者流行病学分析. 临床耳鼻咽喉头颈外科杂志. 2020;34(3):239–243. doi: 10.13201/j.issn.2096-7993.2020.03.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Rao A, Godehal SM, Patil AR, et al. Congenital nasal pyriform aperture stenosis: a rare cause of neonatal nasal airway obstruction. BJR Case Rep. 2015;1(1):20150006. doi: 10.1259/bjrcr.20150006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.刘 锦峰, 闫 占峰, 郝 鹏鹏, et al. 上颌窦后部气化程度对鼻腔形态影响的CT观察. 中国医学文摘(耳鼻咽喉科学) 2018;33(1):66–69. [Google Scholar]
- 16.陈 威, 徐 啟. 青少年口呼吸伴腺样体面容者硬腭形态的研究. 浙江实用医学. 2019;24(4):250–253. [Google Scholar]
- 17.刘 继远, 桂 雄斌, 陆 灵娟, et al. 成人大筛泡与鼻塞及鼻源性头痛和嗅觉障碍的关系. 临床耳鼻咽喉科杂志. 2005;19(20):950–951. doi: 10.3969/j.issn.1001-1781.2005.20.016. [DOI] [Google Scholar]
- 18.Janovic N, Janovic A, Milicic B, et al. Is Computed Tomography Imaging of Deviated Nasal Septum Justified for Obstruction Confirmation? Ear Nose Throat J. 2021;100(2):NP131–NP136. doi: 10.1177/0145561319871533. [DOI] [PubMed] [Google Scholar]
- 19.邱 小雯, 胡 建道. 鼻中隔偏曲伴下鼻甲肥大患者的鼻窦CT分析. 中国耳鼻咽喉头颈外科. 2017;24(7):365–367. [Google Scholar]
- 20.何 婷, 邓 刚, 黄 喜, 江 远明, 师 洪. 以划分鼻中隔偏曲单元为基础的个体化鼻中隔矫正手术. 临床耳鼻咽喉头颈外科杂志. 2020;34(8):706–709. doi: 10.13201/j.issn.2096-7993.2020.08.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Koo SK, Kim JD, Moon JS, et al. The incidence of concha bullosa, unusual anatomic variation and its relationship to nasal septal deviation: A retrospective radiologic study. Auris Nasus Larynx. 2017;44(5):561–570. doi: 10.1016/j.anl.2017.01.003. [DOI] [PubMed] [Google Scholar]
- 22.Jun BC, Kim SW, Kim SW, et al. Is turbinate surgery necessary when performing a septoplasty? Eur Arch Otorhinolaryngol. 2009;266(7):975–980. doi: 10.1007/s00405-008-0855-x. [DOI] [PubMed] [Google Scholar]
- 23.Tomblinson CM, Cheng MR, Lal D, et al. The Impact of Middle Turbinate Concha Bullosa on the Severity of Inferior Turbinate Hypertrophy in Patients with a Deviated Nasal Septum. AJNR Am J Neuroradiol. 2016;37(7):1324–1330. doi: 10.3174/ajnr.A4705. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Camacho M, Zaghi S, Certal V, et al. Inferior turbinate classification system, grades 1 to 4:development and validation study. Laryngoscope. 2015;125(2):296–302. doi: 10.1002/lary.24923. [DOI] [PubMed] [Google Scholar]
- 25.Ozcan KM, Selcuk A, Ozcan I, et al. Anatomical variations of nasal turbinates. J Craniofac Surg. 2008;19(6):1678–1682. doi: 10.1097/SCS.0b013e318188a29d. [DOI] [PubMed] [Google Scholar]
- 26.Yiǧit O, Acioǧlu E, Cakir ZA, et al. Concha bullosa and septal deviation. Eur Arch Otorhinolaryngol. 2010;267(9):1397–1401. doi: 10.1007/s00405-010-1228-9. [DOI] [PubMed] [Google Scholar]
- 27.Neskey D, Eloy JA, Casiano RR. Nasal, septal, and turbinate anatomy and embryology. Otolaryngol Clin North Am. 2009;42(2):193–205. doi: 10.1016/j.otc.2009.01.008. [DOI] [PubMed] [Google Scholar]
- 28.段 丙志, 崔 顺九. 副中鼻甲和第二中鼻甲鼻内镜手术切除1例. 中国耳鼻咽喉头颈外科. 2006;13(1):20–20. doi: 10.3969/j.issn.1672-7002.2006.01.021. [DOI] [Google Scholar]
- 29.Demir D, Asil K, Güven M, et al. Assessment of the correlation between nasal septal deviation and compensatory hypertrophy of the middle turbinate. Eur Arch Otorhinolaryngol. 2015;272(10):2847–2851. doi: 10.1007/s00405-014-3387-6. [DOI] [PubMed] [Google Scholar]
- 30.Demir D, Asil K, Güven M, et al. Does septoplasty change the dimensions of compensatory hypertrophy of the middle turbinate? J Laryngol Otol. 2016;130(6):554–559. doi: 10.1017/S0022215116001055. [DOI] [PubMed] [Google Scholar]
- 31.Rhee JS, Weaver EM, Park SS, et al. Clinical consensus statement: Diagnosis and management of nasal valve compromise. Otolaryngol Head Neck Surg. 2010;143(1):48–59. doi: 10.1016/j.otohns.2010.04.019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Osborn JL, Sacks R. Chapter 2:Nasal obstruction. Am J Rhinol Allergy. 2013;27 Suppl 1:S7-8. doi: 10.2500/ajra.2013.27.3889. [DOI] [PubMed] [Google Scholar]
- 33.Suh MW, Jin HR, Kim JH. Computed tomography versus nasal endoscopy for the measurement of the internal nasal valve angle in Asians. Acta Otolaryngol. 2008;128(6):675–679. doi: 10.1080/00016480701663391. [DOI] [PubMed] [Google Scholar]
- 34.Wang Y, Bonaparte JP. Diagnosis and management of septal deviation and nasal valve collapse-a survey of Canadian otolaryngologists. J Otolaryngol Head Neck Surg. 2019;48(1):71–71. doi: 10.1186/s40463-019-0394-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Chambers KJ, Horstkotte KA, Shanley K, et al. Evaluation of Improvement in Nasal Obstruction Following Nasal Valve Correction in Patients With a History of Failed Septoplasty. JAMA Facial Plast Surg. 2015;17(5):347–350. doi: 10.1001/jamafacial.2015.0978. [DOI] [PubMed] [Google Scholar]
- 36.Li L, Zang H, Han D, et al. Impact of a Concha Bullosa on Nasal Airflow Characteristics in the Setting of Nasal Septal Deviation: A Computational Fluid Dynamics Analysis. Am J Rhinol Allergy. 2020;34(4):456–462. doi: 10.1177/1945892420905186. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Han D, Zhang L. Nasal cavity ventilation expansion techniques. Acta Otolaryngol. 2011;131(12):1244–1248. doi: 10.3109/00016489.2011.615760. [DOI] [PubMed] [Google Scholar]
- 38.Aslan G, Uzun L, Ugur MB, et al. Unilateral inferior turbinate bone hypertrophy: is it compensatory or congenital? Am J Rhinol Allergy. 2013;27(4):255–259. doi: 10.2500/ajra.2013.27.3918. [DOI] [PubMed] [Google Scholar]