Abstract
目的
分析儿童变应性真菌性鼻窦炎(AFRS)的临床特点及鼻内镜手术联合药物治疗的效果。
方法
对3例AFRS患儿术前常规进行鼻内镜检查、鼻窦CT和MRI扫描及过敏原检测,术中取窦内分泌物及受累鼻窦黏膜行真菌学及组织病理学检查。患儿均行鼻内镜手术,术前及术后配合口服及鼻腔应用皮质类固醇激素,给予鼻腔冲洗治疗,并个体化使用抗过敏治疗及免疫治疗。术后随访3~12个月。
结果
3例患儿均有鼻息肉和头痛,其中2例有眼球突出和面部不对称;均有典型的CT及MRI表现;血清总IgE均升高;2例真菌SIgE呈阳性。3例患儿均行全组鼻窦开放,其中1例可见真菌菌丝和孢子,2例其他真菌检测阳性。术后患儿面部不对称均自行缓解,其中2例有不同程度的黏膜肿胀、息肉样变。
结论
AFRS是一种特殊类型的慢性鼻窦炎,在儿童人群中并非罕见。早期诊断、果断手术、规范治疗、长期随访,在儿童AFRS的诊治中至关重要。
Keywords: 鼻窦炎, 超敏反应, 真菌, 儿童
Abstract
Objective
To assess the presentation of allergic fungal rhinosinusitis(AFRS) in children and the role of long-term comprehensive therapy of endoscopic surgery combined with drug therapy.
Methods
The 3 children with AFRS were routinely examined by nasal endoscopy, CT scan, MRI scan and allergen detection before surgery, and mycological and histomathological examination were performed on the secretions in the sinus and the mucosa of the affected sinuses. All the 3 patients underwent endoscopic surgery, preoperative and postoperative treatment with oral and nasal corticosteroid, nasal irrigation, and individualized anti-allergy therapy and immunotherapy. The patients were followed up for 3 to 12 months.
Results
All 3 children had nasal polyps and headache, and 2 children had exophthalmos and facial asymmetry. There were typical CT and MRI findings on imaging. Serum total IgE were all elevated, and 2 cases were positive for fungal SIgE. All 3 children underwent endoscopic surgery. Fungal hyphae and spores were found in 1 child, and other fungi tests were positive in another 2 children. Postoperative facial asymmetry was relieved spontaneously, and mucosal swelling and polypoid changes were observed in 2 children.
Conclusion
AFRS is a specific type of chronic rhinosinusitis that is not uncommon in children. Early diagnosis, prompt operation, standardized treatment and long-term follow-up are very important in the diagnosis and treatment of AFRS in children.
Keywords: sinusitis, hypersensitivity, fungi, child
变应性真菌性鼻窦炎(allergic fungal rhinosinusitis,AFRS)是一种特殊类型的慢性鼻窦炎(chronic rhinosinusitis,CRS),是机体对鼻腔鼻窦内定植真菌的慢性、强烈的变态反应。与其他CRS相比,该病术后易复发,预后较差,严重影响患者的生活质量。国内外关于儿童AFRS的文献报道较少[1-3]。本文总结了我科收治的3例AFRS患儿的临床资料,对其诊断、治疗及随访过程进行分析,帮助广大耳鼻喉科医生更好地认识儿童AFRS。
1. 病例报告
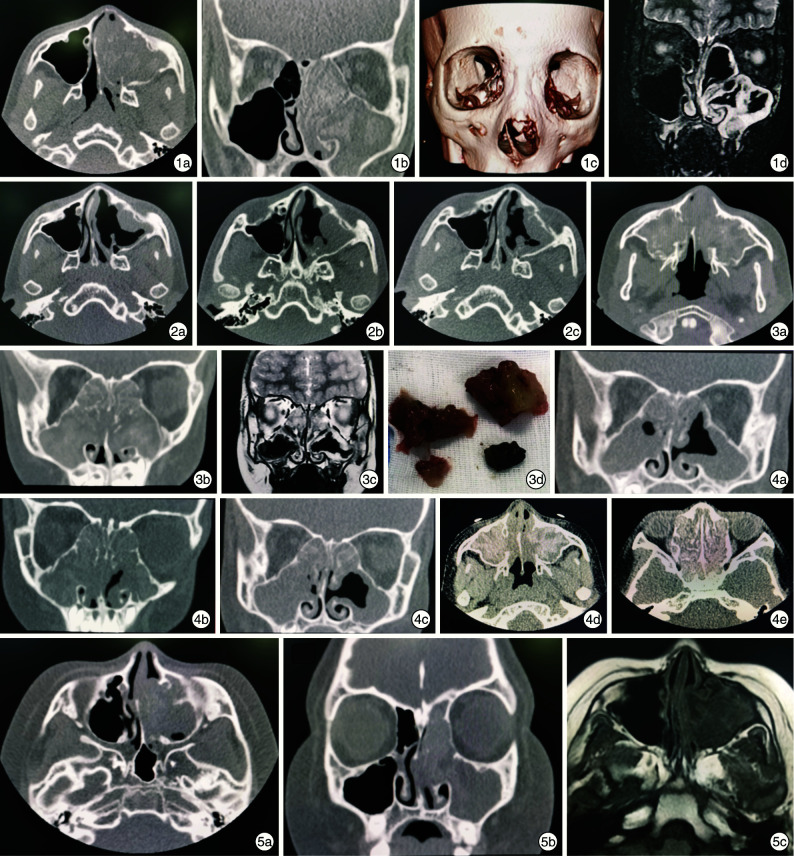
例1,男,12岁,主诉左侧鼻塞、流涕、头痛、嗅觉减退半年,加重1个月,于2020年5月20日就诊于我院。既往有支气管哮喘史和变应性鼻炎史。查体可见鼻背增宽,左侧总鼻道可见灰白色息肉样新生物,中鼻甲无法窥及。左面部稍隆起,左侧眼球向外移位,眼球各向活动良好。鼻窦CT:左侧上颌窦、筛窦、蝶窦、额窦窦腔扩大,其内未见含气征象,窦腔内软组织密度影填充,局部见片状分布高密度钙化影,上颌窦窦口扩大,左侧钩突骨质吸收;左侧上颌窦后壁骨质变薄,局部骨质连续性中断(图 1a~1c)。鼻窦MRI示左侧上颌窦、筛窦、蝶窦、额窦内见T2WI序列混杂信号影填充,CT所见的高密度钙化区呈短T2信号,T1WI序列表现为低、等信号(图 1d)。皮肤过敏原点刺:多价真菌、尘螨、葎草、艾蒿、春季花粉及夏秋花粉均呈阳性。血清特异性IgE检测:总IgE>5000 IU/mL,mx2混合真菌4级。G试验(-),GM试验(-)。于2020年5月25日全身麻醉下行鼻内镜下左侧全组鼻窦开放+窦内病变去除+鼻息肉切除术。术后窦腔内分泌物及菌团经特殊染色(PAS、革兰、六胺银)可见真菌菌丝及孢子。真菌荧光呈阳性。术后第1天左眼突出开始好转。术后1周给予制霉菌素盐水冲洗,2周后更换为生理盐水冲洗,布地奈德鼻喷雾剂喷鼻,连续3个月,口服泼尼松,连续4周递减。术后随访:术后3个月,左眼突出即完全缓解;术后8个月,变应性鼻炎发作,给予抗组胺药口服+布地奈德鼻喷雾剂喷鼻,2周后逐渐停药;现随访1年,患儿双侧鼻腔通畅,鼻道内未见新生物,复查CT显示上颌窦及前组筛窦内黏膜增厚,无息肉形成。患儿术后影像学检查见图 2,具体临床特点见表 1。
图 1.
例1患儿术前影像学检查 1a、1b:分别显示CT轴状位和冠状位,示左侧全组鼻窦内及鼻腔扩大,见软组织影填充,局部见斑片状高密度影;1c:CT重建,显示左侧鼻背增宽,鼻中隔明显受压右偏;1d:MRI STIR序列冠位,显示左侧上颌窦窦腔扩大,内见条片状STIR序列高信号影; 图 2 例1患儿术后影像学检查 2a:术后3个月,左侧上颌窦前壁局部黏膜轻度增厚,密度均匀;2b:术后8个月,左侧上颌窦前、后壁黏膜明显增厚,呈息肉样改变;2c:术后12个月,左侧上颌窦黏膜增厚较前好转,未见明显息肉复发; 图 3 例2患儿术前影像学检查及术中所见 3a、3b分别为CT轴状位和冠状位,显示双侧全组鼻窦窦腔、鼻腔扩大,见软组织密度影填充,局部见片状高密度影,双侧上颌窦窦口扩大;3c:MRI T2WI序列冠状位,显示双侧筛窦、上颌窦黏膜增厚,双侧筛窦窦腔完全被短T2信号影填充;3d:术中取出的黏蛋白和灰褐色团块; 图 4 例2患儿术后影像学检查 4a:术后3个月,双侧筛窦、上颌窦黏膜增厚,密度均匀,以右侧显著;4b:术后6个月,双侧鼻窦炎较前明显加重,窦腔黏膜明显增厚,密度均匀,未见明显钙化影;4c:术后8个月,双侧筛窦、上颌窦炎较前有所吸收好转,密度均匀;4d、4e:术后1年,双侧全组鼻窦内软组织影伴磨玻璃样改变; 图 5 例3患儿术前影像学检查 5a、5b:分别为CT轴状位和冠状位,显示左侧上颌窦窦腔及鼻腔扩大,内见软组织影填充,密度不均匀,内见线状钙化影;5c:MRI T1WI序列轴位像,显示左侧上颌窦黏膜明显增厚,呈T1WI序列低/等信号。
表 1.
临床患者特点总结
| 例1 | 例2 | 例3 | |
| 临床表现 | |||
| 鼻息肉 | + | + | + |
| 单侧病变 | + | - | + |
| 鼻中隔偏曲 | + | - | + |
| 头痛 | + | + | + |
| 眼球突出 | + | + | - |
| 面部不对称 | + | + | - |
| 擤出灰褐色物 | + | + | + |
| 既往史 | |||
| 变应性鼻炎 | + | + | + |
| 支气管哮喘 | + | + | - |
| 影像学检查 | |||
| CT显示密度不均 | + | + | + |
| MRI T2中央无信号 | + | + | + |
| 实验室检查 | |||
| 总IgE/(IU·mL-1) | >5000 | 212 | 1124 |
| 真菌过敏 | ++++ | - | ++++ |
| 其他过敏原过敏 | ++ | ++ | +++ |
| 术中发现 | |||
| 真菌团块 | + | + | + |
| 黏蛋白 | + | + | + |
| 术后病理 | |||
| 真菌菌丝孢子 | + | - | - |
| 其他真菌检测 | + | ± | + |
| 术后治疗 | |||
| 口服激素 | 1个月 | 1个月+ 低剂量间断 |
7 d |
| 鼻喷激素 | + | + | + |
| 鼻腔盥洗 | + | + | + |
| 粉尘螨脱敏 | - | + | - |
| 预后复发 | - | + | - |
例2,男,5岁,双侧鼻塞、流涕1年,偶有脓臭涕及黄色团状物,半年前出现双眼外凸,于2020年9月6日于我院住院治疗。既往史:3年前诊断为双眼斜视,8个月前诊断为支气管哮喘。专科查体见外鼻无畸形,左侧总鼻道可见灰白色息肉样新生物,中鼻甲未窥及,左侧眼球向外移位,眼球各向活动良好,右侧鼻腔内未见明显新生物。电子鼻咽镜显示左侧鼻腔内荔枝肉样组织,右侧鼻腔内未见息肉样组织。鼻窦CT:双侧全组鼻窦内及鼻腔混杂密度填充,斑片状高密度影(图 3a、3b)。鼻窦MRI:T2相全组鼻窦及鼻腔内弥漫混杂信号,窦壁膨隆,符合真菌性鼻窦炎改变(图 3c)。血清特异性IgE检测:总IgE 212 IU/mL,粉尘螨2级,真菌0级。G试验(-),GM试验(-)。于2020年9月7日全身麻醉下行鼻内镜下双侧全组鼻窦开放+窦内病变去除+鼻息肉切除术,术中取出黏蛋白和灰褐色团块(图 3d)。术后病理显示(左真菌团块)局灶间小团状球形可疑菌团。(左右黏蛋白)经特殊染色(PAS、革兰、六胺银)未见真菌菌丝及孢子。真菌荧光呈阴性。术后1周给予生理盐水冲洗,布地奈德鼻喷雾剂喷鼻,同时口服泼尼松,连续4周递减。术后随访:术后1个月,左眼突出即完全缓解;术后3个月复查CT,发现鼻腔黏膜增厚征象明显(图 4a),行内镜下观察,双侧窦口开放良好,鼻腔内未见明显息肉,予继续鼻喷激素+鼻腔冲洗,同时开始粉尘螨特异性免疫治疗,持续至今;术后5个月患儿因进行其他部位外科手术,自行停用鼻喷激素及鼻腔冲洗;术后6个月复查,患儿诉鼻塞加重,查体双侧鼻腔内可见息肉,CT显示双侧鼻窦炎较前明显加重(图 4b),予恢复生理盐水冲洗,布地奈德鼻喷雾剂喷鼻,同时口服小剂量泼尼松,连续4周递减;术后7个月复查,自觉鼻塞缓解,内镜显示双侧鼻窦开放好,窦腔内黏膜息肉样变,鼻腔内未见息肉组织;术后8个月,患儿鼻腔通畅,复查CT显示上颌窦及前组筛窦内黏膜增厚、息肉样变(图 4c),对比2个月前有明显好转;术后1年复查CT,示双侧全组鼻窦内软组织影伴磨玻璃样改变,双侧鼻腔内可见息肉样新生物,考虑复发(图 4d、4e),择期再入院手术治疗。具体临床特点见表 1。
例3,男,11岁。左侧鼻塞6年,加重伴脓涕6个月,无头痛及面部胀痛,无明显嗅觉减退,无视物模糊。病程中曾自行擤出红色痂皮样物。既往有反复喘息史。查体:体重100 kg;左侧总鼻道可见灰白色息肉样新生物,中鼻甲无法窥及;眼球无突出,各向活动良好。内镜:双侧鼻腔黏膜苍白水肿,左侧鼻腔内可见息肉样新生物自中鼻道脱出,鼻腔内可见脓涕。鼻窦CT检查提示左侧上颌窦、筛窦、额窦窦腔及左侧鼻腔较对侧扩大,见软组织影填充,其内密度欠均匀,局部见线状高密度影,鼻中隔右偏,左侧上颌窦窦口扩大,左侧上颌窦前壁局部骨质结构欠光滑(图 5a、5b)。鼻窦MRI显示:左侧上颌窦、筛窦、额窦窦腔扩大,黏膜明显增厚,见软组织影填充,T2WI序列呈高信号影;左侧鼻道内亦见T2WI序列高信号影,鼻中隔右偏(图 5c)。血清特异性IgE检测:总IgE 1124 IU/mL,烟曲霉3级、链格孢4级、mx2混合真菌4级。于2021年3月1日行鼻内镜下左侧全组鼻窦开放+窦内病变去除+鼻息肉切除术。术后病理结果符合炎性息肉。嗜酸细胞染色>50个/HPF。送检黏蛋白中可见大量黏液腺体,伴弥漫性淋巴细胞及嗜酸粒细胞浸润。真菌荧光染色呈阴性。息肉基因组学检测:曲霉菌(+)。术后1周起口服泼尼松7 d,持续鼻喷布地奈德及鼻腔盥洗。由于患儿体型肥胖,担心长期全身应用糖皮质激素可能导致代谢综合征,因此缩短疗程。术后2个月复查,内镜显示鼻腔黏膜轻度水肿、息肉样变,各窦口开放好,鼻腔内未见明显息肉。目前仍在随访中。具体临床特点见表 1。
2. 讨论
2.1. AFRS的诊断与鉴别诊断
作为非侵袭性真菌性鼻窦炎中较常见的一种类型,AFRS的发病情况尚不十分清楚,但诸多文献报道,AFRS在青少年和青年成人中较为多发[3-5],平均患病年龄为21.9岁[3]。AFRS在温暖潮湿的地区高发。在美国,因CRS进行手术的患者中,AFRS占7%~12%[6],而印度学者的研究结果显示AFRS占CRS的24%[7]。因此,AFRS虽然不是一种罕见病,但国内外的诊断率仍然很低。Bent等[8]较早指出,AFRS诊断率远低于预期的主要原因在于临床医师对AFRS认识不足。唯有提高AFRS的诊断率,才能采取系统和有针对性的治疗,从而提高AFRS的长期控制率,减少并发症的发生。目前,国内外AFRS诊断标准仍未完全达成共识[4],最经典且被广泛接受的是Bent-Kuhn标准[8]:①有特应性病史,或经变应原皮试、血清学检查证实的Ⅰ型变态反应;②有鼻息肉;③有典型的CT影像学特征;④有嗜酸性黏蛋白,同时真菌未侵袭黏膜组织;⑤通过真菌染色或培养证实有真菌存在。同时,2020年欧洲鼻窦炎和鼻息肉意见书[9]里指出,并非所有的AFRS患者中都能找到真菌过敏的证据。本研究的3例患儿均符合上述特点。3例患儿变应原检测证实为Ⅰ型变态反应,其中2例有明确变应性哮喘史,2例真菌过敏。3例鼻息肉均有典型的影像学表现,术中均发现变应性黏蛋白及灰褐色真菌团块。虽仅有1例术后病理证实有明确的真菌菌丝,但另2例也通过其他方式证实了真菌的存在。
AFRS的鉴别诊断包括:①后鼻孔息肉:本病青少年多见,多源自鼻窦,最常见的为上颌窦后鼻孔息肉,源自上颌窦内水肿黏膜,多单侧发病,临床表现为单侧进行性鼻塞,查体可见总鼻道内灰白色息肉样新生物自上颌窦口脱出;②真菌球性鼻窦炎:多见于成人,单侧鼻窦发病,以上颌窦发病率最高,其次为蝶窦、筛窦,额窦罕见,临床表现似CRS,如单侧鼻塞、流脓涕,或有恶臭等;CT显示单窦不均匀密度增高,可见高密度钙化斑或点,可有窦壁膨隆或吸收,无骨质破坏;③鼻腔鼻窦内翻性乳头状瘤:本病多发生于成人,多数为单侧发病,常表现为鼻塞及鼻内肿物,伴脓涕、涕中带血,好发于筛窦、上颌窦,其次为额窦及鼻腔外侧壁,易发生恶变,恶变时CT表现为颅底及眶壁骨质破坏,MRI示眶内组织受累、颅底硬脑膜硬化及脑回征消失[10]。
2.2. 儿童AFRS的特点
3例AFRS患儿均有头痛,其中2例眼球突出、面部不对称,远高于成人患者11%的面部畸形发生率[2]。这与文献中提到的儿童AFRS的临床特点相符[2-3, 11],即患儿有较大的可能性出现头痛、突眼、眼距增宽及面部不对称。这可能主要是因为儿童面部尚处于发育期,骨骼远较成人更柔韧,以及病灶的慢性膨胀共同作用的结果[11]。因此,当临床医生遇见有特应性体质的鼻息肉患儿,如果同时伴有头痛、突眼、眼距增宽及面部不对称的情况,应当警觉AFRS的可能。
2.3. 儿童AFRS的治疗
AFRS是因真菌侵入鼻腔鼻窦引发的一种强烈的、特殊的变态反应性疾病,尽管也属于CRS,但其治疗方式却与儿童CRS的常规治疗存在显著差异。
2.3.1. 手术治疗
由于AFRS没有自愈倾向,对常规药物治疗无效,易造成儿童面部畸形,对生活质量影响较大,故AFRS患儿的首选治疗方法是内镜鼻窦手术[4],以便彻底清除真菌变应原,减少抗原对机体的刺激,同时通畅引流,改善鼻腔鼻窦的缺氧状态,抑制真菌的生长繁殖[12]。发现AFRS时通常已累及范围较广,常需开放病变侧的全组鼻窦。这与目前儿童CRS手术的阶梯治疗并不相符,即对于药物疗效不佳的儿童CRS,第1级手术是腺样体和扁桃体切除,对于术后仍持续存在CRS的患儿,才考虑进行功能性鼻内镜手术[13],且通常进行mini-FESS,即仅切除钩突、开放前组筛窦,而不开放蝶窦和额窦[12]。果断彻底的内镜手术是AFRS序贯治疗的第一步。
2.3.2. 糖皮质激素
在彻底清除真菌变应原、开放窦口的基础上,还应重视消除炎症反应,其中,口服糖皮质激素是最有效的治疗方式[4]。Bent等[8]提出,如果未经口服糖皮质激素治疗,AFRS患者的术后复发率接近100%。为了控制某些严重患者的息肉性炎症,必要时可延长全身糖皮质激素治疗的时间[4]。但是,长期口服糖皮质激素可能引起严重不良反应,特别是对于儿童以及有其他基础疾病者,因此,鼻内糖皮质激素体现出其重要的补充作用。局部用药避免和减轻了大多数糖皮质激素药物的急性及长期毒性,其在鼻息肉治疗中的有效性也已经得到证实[14]。目前仍没有前瞻性研究评估口服糖皮质激素的治疗剂量及治疗持续时间,学者们在各自的临床中选用的剂量和疗程也差别颇大,如Rupa等[15]采用术后口服泼尼松龙50 mg/d,36周,然后再进行6周的减量;而Gan等[16]采用术后泼尼松40 mg/d,4 d;30 mg/d,4 d;20 mg/d,4 d;10 mg/d,4 d。秉承选用能控制症状的最低剂量和疗程的原则,我们采用的口服糖皮质激素剂量是从术前3 d起开始口服泼尼松,0.5 mg/(kg·d-1),术后继续按此剂量使用4 d,此后每7天减半量,减至2.5 mg/d后,持续应用至术后1个月。此后如出现息肉复发,再次口服泼尼松,0.5 mg/(kg·d-1),3 d,每3天减半量,减至2.5 mg,隔日给药1次后,持续应用至1个月。鼻内糖皮质激素的疗程至少为3个月。例2患儿因其他原因停用鼻用激素后症状复发,给予鼻用激素和口服激素后症状好转。
2.3.3. 抗过敏治疗
由于较多AFRS患者合并除真菌以外的其他过敏原,因此积极控制过敏性疾病,特别是变应性鼻炎的发作是预防AFRS复发的重要手段。例1患儿术后随访中,在出现明显的变应性鼻炎症状后,复查CT显示窦腔黏膜息肉样变,而在抗过敏治疗后,CT即显示黏膜病变明显好转,说明适时的抗过敏治疗在AFRS中的重要作用。
2.3.4. 抗真菌治疗
AFRS治疗中是否采用抗真菌治疗存在争议。目前没有局部应用抗真菌药物治疗AFRS的临床试验。虽然AFRS和变应性支气管肺曲霉菌病被认为是上下气道联合疾病的例证,但变应性支气管肺曲霉菌病常规使用抗真菌治疗却并未在AFRS的治疗中获得广泛认可。Chan等[17]研究表明,抗真菌药物在AFRS中可能有一些益处,而另一些研究则显示局部和全身抗真菌治疗CRS并未让患者受益[18]。由于抗真菌药可能产生副作用,故未给患儿口服抗真菌药,仅仅在明确查到菌丝及孢子的例1患儿治疗中进行了2周的制霉菌素盐水冲洗。尽管普遍认为AFRS是由真菌过敏引起的,但是抗真菌治疗普遍应用之前,仍然需要进一步研究去寻找其有效的证据。
2.3.5. 免疫治疗
考虑到AFRS是一种严重的难治性变态反应性疾病,Bent等认为应将免疫治疗作为AFRS阶梯治疗中,继外科手术、糖皮质激素后的第三步治疗措施[8]。目前免疫治疗作为AFRS综合治疗的一部分,不仅可使AFRS患者临床症状减轻,而且同时大大降低手术复发率,是一种具有应用前景的治疗方法[19]。但免疫治疗目前仍存在一些问题,如并非所有AFRS患者都能找到相应的变应原,有的真菌变应原没有相应的变应原疫苗,或仅在实验室中研制出来,但仍未能真正应用于临床等[19]。此外,免疫治疗的作用机制目前仍不明确,免疫治疗后AFRS是否会复发仍有待进一步研究。对例2患儿补充了粉尘螨脱敏治疗,已初步看到效果,但由于例数较少、随访时间短,均不足以进行论证。因此对AFRS患儿是否进行免疫治疗,如何进行免疫治疗,尚需进一步在研究和探索。
2.4. AFRS与嗜酸粒细胞黏蛋白鼻窦炎
由于AFRS与其他伴嗜酸粒细胞增多的CRS在临床表现、实验室检查、影像学检查上具有极大的相似性,且目前缺乏明确的免疫学指标去鉴别,因此,CRS可能存在着某些疾病病种的交叉,如AFRS和嗜酸粒细胞黏蛋白鼻窦炎(eosinophilic mucin rhinosinusitis, EMRS)就是这样的两种疾病。AFRS和EMRS在临床表现、实验室检查、影像学检查、治疗及预后等方面均十分类似,二者的区别仅在于黏蛋白里是否有真菌以及患者是否有真菌过敏。
Pant等[20]将EMRS定义为伴有嗜酸性黏蛋白的CRS,并且依据嗜酸性黏蛋白中有无真菌及有无真菌过敏,将EMRS分为四个亚型:①嗜酸性黏蛋白中有真菌且有真菌过敏,即AFRS;②嗜酸性黏蛋白中无真菌但有真菌过敏;③嗜酸性黏蛋白中有真菌但无真菌过敏;④嗜酸性黏蛋白中无真菌且无真菌过敏。通过比较发现,这四个亚型在症状、体征、有无哮喘、CT评分、血清免疫球蛋白(IgG、IgG1、IgG2、IgG3、IgG4、IgA、IgM、IgE)水平、外周血白细胞(嗜酸粒细胞、嗜碱粒细胞、单核细胞、淋巴细胞)计数方面均无显著差异。2、3、4亚型不完全符合AFRS的诊断,考虑可能是疾病的早期或检验方法、真菌培养技术的欠缺。2020年欧洲鼻窦炎和鼻息肉意见书[9]指出,对于AFRS是临床上一种独立的完整疾病,还是嗜酸粒细胞性CRS中的一部分,目前仍存有争议。EPOS专家小组讨论后认为应保留“变应性真菌性鼻窦炎”作为规范用语,同时并非所有患者都能找到真菌过敏的证据。因此,本研究中的例2和例3患儿虽然未明确找到真菌菌丝与孢子,但临床表现和影像学检测结果均与AFRS极其类似,采取其他真菌检测方式有阳性结果。
2.5. 总结
AFRS是一种特殊类型的CRS,在儿童人群中并非罕见。作为难治性鼻窦炎,AFRS可导致患儿多次手术、面部变形、视力受损、生活质量明显下降。早期诊断、果断手术、规范治疗、长期随访,在儿童AFRS的诊治中至关重要。
Footnotes
利益冲突 所有作者均声明不存在利益冲突
References
- 1.Campbell JM, Graham M, Gray HC, et al. Allergic fungal sinusitis in children. Ann Allergy Asthma Immunol. 2006;96(2):286–290. doi: 10.1016/S1081-1206(10)61237-9. [DOI] [PubMed] [Google Scholar]
- 2.McClay JE, Marple B, Kapadia L, et al. Clinical presentation of allergic fungal sinusitis in children. Laryngoscope. 2002;112(3):565–569. doi: 10.1097/00005537-200203000-00028. [DOI] [PubMed] [Google Scholar]
- 3.Thorp BD, McKinney KA, Rose AS, et al. Allergic fungal sinusitis in children. Otolaryngol Clin North Am. 2012;45(3):631–642. doi: 10.1016/j.otc.2012.03.003. [DOI] [PubMed] [Google Scholar]
- 4.徐 睿, 马 玲, 许 庚. 变应性真菌性鼻-鼻窦炎的诊断与治疗. 中华耳鼻咽喉头颈外科杂志. 2016;51(8):635–640. doi: 10.3760/cma.j.issn.1673-0860.2016.08.017. [DOI] [PubMed] [Google Scholar]
- 5.杨 晴, 陆 美萍, 程 雷. 变应性真菌性鼻窦炎研究进展. 中国耳鼻咽喉头颈外科. 2020;27(3):171–176. [Google Scholar]
- 6.Granville L, Chirala M, Cernoch P, et al. Fungal sinusitis: histologic spectrum and correlation with culture. Hum Pathol. 2004;35(4):474–481. doi: 10.1016/j.humpath.2003.10.024. [DOI] [PubMed] [Google Scholar]
- 7.Das A, Bal A, Chakrabarti A, et al. Spectrum of fungal rhinosinusitis; histopathologist's perspective. Histopathology. 2009;54(7):854–859. doi: 10.1111/j.1365-2559.2009.03309.x. [DOI] [PubMed] [Google Scholar]
- 8.Bent JP 3rd, Kuhn FA. Diagnosis of allergic fungal sinusitis. Otolaryngol Head Neck Surg. 1994;111(5):580–588. doi: 10.1177/019459989411100508. [DOI] [PubMed] [Google Scholar]
- 9.Fokkens WJ, Lund VJ, Hopkins C, et al. European Position Paper on Rhinosinusitis and Nasal Polyps 2020. Rhinology. 2020;58(Suppl S29):1–464. doi: 10.4193/Rhin20.600. [DOI] [PubMed] [Google Scholar]
- 10.王 明婕, 侯 丽珍, 周 兵, et al. 鼻腔鼻窦内翻性乳头状瘤恶变的相关危险因素分析. 临床耳鼻咽喉头颈外科杂志. 2021;35(7):627–632. doi: 10.13201/j.issn.2096-7993.2021.07.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Gupta AK, Bansal S, Gupta A, et al. Is fungal infestation of paranasal sinuses more aggressive in pediatric population? Int J Pediatr Otorhinolaryngol. 2006;70(4):603–608. doi: 10.1016/j.ijporl.2005.08.014. [DOI] [PubMed] [Google Scholar]
- 12.王 全桂, 毕 青玲, 肖 水芳, et al. 26例变应性真菌性鼻-鼻窦炎临床分析. 临床耳鼻咽喉头颈外科杂志. 2009;23(4):167–169. [PubMed] [Google Scholar]
- 13.许 庚, 李 源. 儿童慢性鼻窦炎手术治疗的思考与临床诊疗指引. 中华耳鼻咽喉科杂志. 2003;38(4):241–242. [PubMed] [Google Scholar]
- 14.Joe SA, Thambi R, Huang J. A systematic review of the use of intranasal steroids in the treatment of chronic rhinosinusitis. Otolaryngol Head Neck Surg. 2008;139(3):340–347. doi: 10.1016/j.otohns.2008.05.628. [DOI] [PubMed] [Google Scholar]
- 15.Rupa V, Jacob M, Mathews MS, et al. A prospective, randomised, placebo-controlled trial of postoperative oral steroid in allergic fungal sinusitis. Eur Arch Otorhinolaryngol. 2010;267(2):233–238. doi: 10.1007/s00405-009-1075-8. [DOI] [PubMed] [Google Scholar]
- 16.Gan EC, Thamboo A, Rudmik L, et al. Medical management of allergic fungal rhinosinusitis following endoscopic sinus surgery: an evidence-based review and recommendations. Int Forum Allergy Rhinol. 2014;4(9):702–715. doi: 10.1002/alr.21352. [DOI] [PubMed] [Google Scholar]
- 17.Chan KO, Genoway KA, Javer AR. Effectiveness of itraconazole in the management of refractory allergic fungal rhinosinusitis. J Otolaryngol Head Neck Surg. 2008;37(6):870–874. [PubMed] [Google Scholar]
- 18.Ryan MW, Clark CM. Allergic Fungal Rhinosinusitis and the Unified Airway: the Role of Antifungal Therapy in AFRS. Curr Allergy Asthma Rep. 2015;15(12):75. doi: 10.1007/s11882-015-0573-6. [DOI] [PubMed] [Google Scholar]
- 19.覃 纲, 梁 灼萍. 变应性真菌性鼻-鼻窦炎免疫治疗现状. 山东大学耳鼻喉眼学报. 2018;32(3):23–26. [Google Scholar]
- 20.Pant H, Kette FE, Smith WB, et al. Eosinophilic mucus chronic rhinosinusitis: clinical subgroups or a homogeneous pathogenic entity? Laryngoscope. 2006;116(7):1241–1247. doi: 10.1097/01.mlg.0000224547.14519.ad. [DOI] [PubMed] [Google Scholar]