Abstract
目的
观察OM85-BV治疗反复上呼吸道感染伴腺样体肥大的疗效并对其治疗机制进行初步探讨。
方法
448例反复上呼吸道感染伴腺样体肥大的患儿,根据自主选择是否接受OM85-BV治疗分为对照组和观察组,对照组326例采用常规药物治疗,观察组122例采用OM85-BV治疗+常规药物治疗。2组患儿治疗周期均为12周,在治疗的不同时段(入组时、治疗6周、治疗12周),根据OSA-18改良中文版对患儿睡眠呼吸阻塞症状进行评分,比较2组患儿症状评分结果和治疗有效率。2组经过12周药物治疗仍无效者接受腺样体切除术。比较2组中接受手术治疗的患儿术前血清IL-2、IL-4、IL-6、IL-10、TNF、IFN-γ细胞因子含量和IgE含量,血清CD3、CD4、CD8在淋巴细胞中的比例及CD4/CD8比值情况。比较2组中接受腺样体切除术患儿腺样体HBD-2、IFN-γ、IL-4、IL-6细胞因子含量、表达水平差异及分布特征。
结果
经过12周的治疗,观察组总有效率明显高于对照组,反复上呼吸道感染伴腺样体肥大儿童的睡眠呼吸阻塞症状的改善程度也明显高于对照组。观察组中血清IFN-γ明显高于对照组,血清IL-2、IL-4、IL-6、IL-10、TNF、IgE与对照组相比无明显差异。观察组中血清CD3、CD4、CD8、CD4/CD8与对照组相比无明显差异。观察组腺样体HBD-2明显高于对照组,IL-4、IFN-γ明显低于对照组,IL-6与对照组相比无明显差异。
结论
OM85-BV可明显改善反复上呼吸道感染伴腺样体肥大患儿的睡眠障碍,却不能改变患儿体内免疫淋巴细胞的水平。OM85-BV既可提高机体的Th1免疫防御反应,又可增强机体对病原的抵抗力,诱导腺样体局部HBD-2的表达增加,增强局部腺样体对微生物抵抗力,使定植于腺样体的细菌减少,减弱腺样体局部炎症反应。
Keywords: 腺样体肥大, OM85-BV, 上呼吸道感染
Abstract
Objective
To observe the efficacy of OM85-BV in the treatment of recurrent upper respiratory tract infection with adenoid hypertrophy and to explore its possible mechanism.
Method
Four hundred and forty-eight children with recurrent upper respiratory tract infection and adenoid hypertrophy were collected. Three hundred and twenty-six patients in the control group were treated with conventional drugs, and one hundred and twenty-two patients in the observation group were treated with OM85-BV+conventional drugs, and the treatment lasted 12 weeks. The sleep obstructive symptoms of adenoid hypertrophy were scored according to OSA-18 before and after the treatment respectively(0, 6, 12 weeks). The symptoms scores and effective rate of treatment between the study and the control group were compared. The patients in the control group and the observation group who were unresponsive to drug treatment received surgery after 12 weeks of drug treatment. The levels of serum IL-2, IL-4, IL-6, IL-10, TNF, IFN-γ and IgE, the ratio of serum CD3, CD4, CD8 in lymphocytes and the ratio of CD4/CD8 were compared between the study and the control group before operation. The levels of HBD-2, IFN-γ, IL-4, IL-6 cytokines in the adenoid were compared between the control group and the observation group. The expression and distribution of adenoid HBD-2, IFN-γ, IL-4, IL-6 were compared between the control group and the observation group.
Result
After 12 weeks of treatment, the total effective rate of the observation group was significantly higher than that of the control group, and the improvement of sleep respiratory obstruction symptoms of children with recurrent upper respiratory tract infection and adenoid hypertrophy was also much better than that of the control group. The serum IFN-γ of the observation group was significantly higher than that of the control group, and there was no significant difference in serum IL-2, IL-4, IL-6, IL-10, TNF, IgE between the observation group and the control group. There was no significant difference in serum CD3, CD4, CD8 and CD4/CD8 between the observation group and the control group. In the observation group, the adenoid HBD-2 was significantly higher but IL-4, IFN-γ were significantly lower than that in the control group, and IL-6 had no significant difference compared with the control group.
Conclusion
OM85-BV can significantly improve the sleep apnea symptoms but can not rise the level of immune lymphocytes in children with adenoid hypertrophy and recurrent upper respiratory tract infection.OM85-BV can improve the Th1 immune response, enhancing the ability of human body to fight against pathogens and induce the release of HBD-2, increasing the resistance to microorganisms, reducing the bacteria aggregation, weakening the local inflammatory response in adenoids.
Keywords: adenoid hypertrophy, OM85-BV, upper respiratory infections
腺样体肥大是儿童耳鼻咽喉科常见疾病,腺样体又称为咽扁桃体,是位于鼻咽部的淋巴组织,属于咽内淋巴环内环的主要组成部分。反复上呼吸道感染会刺激腺样体增生肥大,增生的腺样体会堵塞后鼻孔,导致儿童呼吸不畅,可引起夜间打鼾和张口呼吸,甚至引起低氧血症,严重影响患儿生活质量。反复上呼吸道感染的高危人群是学龄前儿童,处于此阶段的儿童免疫力尚不完善,研究表明反复上呼吸道感染与机体免疫力低下密切相关〔1〕,而且儿童腺样体肥大与机体免疫力低下也密切相关〔2〕。Boncho-Vaxom英文缩写OM85-BV,中文名为细菌溶解产物,是含8种呼吸道致病菌(即流感嗜血清杆菌、肺炎双球菌、肺炎克雷伯菌、臭鼻克雷伯菌、金葡球菌、草绿色链球菌、化脓性链球菌、卡他耐森菌)的冻干溶解物,可激发机体免疫系统特异性和非特异性免疫应答,是一种常用的免疫调节剂〔3〕。大量临床研究报道细菌溶解产物可以显著降低儿童反复上呼吸道感染的次数〔4〕,表明腺样体肥大与儿童反复上呼吸道感染相关,而OM85-BV对于治疗反复上呼吸道感染伴腺样体肥大的儿童临床疗效及治疗机制尚不明确。因此,本研究通过观察OM85-BV治疗反复上呼吸道感染伴腺样体肥大的疗效,对其治疗机制进行初步探讨。
1. 资料与方法
1.1. 临床资料
以2018-05-2019-08在浙江大学附属儿童医院就诊的反复上呼吸道感染伴腺样体肥大的患儿为研究对象,共448例。根据自主选择是否接受OM85-BV治疗分为对照组与观察组,对照组326例患者采用常规药物治疗,观察组122例采用OM85-BV+常规药物治疗。2组研究对象的一般资料见表 1。
表 1.
2组研究对象的一般资料比较
| 组别 | 例数 | 男 | 女 | 年龄/岁 | 腺样体A/N | 入组时第1次问卷评分 | 入组时IgE水平/ (pg·mL-1) |
| 对照组 | 326 | 190 | 136 | 5.42±2.04 | 0.65±0.11 | 21.43±12.365 | 95.0±10.4 |
| 观察组 | 122 | 71 | 51 | 5.81±2.15 | 0.67±0.23 | 23.44±13.182 | 94.0±13.2 |
1.1.1. 纳入标准
年龄2~12岁; 伴有反复上呼吸道感染; 首次确诊为腺样体肥大; 既往无服用OM85-BV史。反复上呼吸道感染诊断标准〔5〕:①0~2岁≥7次/年; ②3~5岁≥6次/年; ③6~12岁≥5次/年。腺样体肥大确诊标准〔6〕:①症状:反复睡时打鼾伴张口呼吸; ②体征:可有腺样体面容; ③辅助检查:腺样体X片A/N比值(腺样体的厚度/鼻咽腔的宽度)≥60%。
1.1.2. 排除标准
伴扁桃体肥大者; 伴鼻腔或口腔呼吸道狭窄引起睡眠呼吸障碍的疾病; 严重器官功能不全者; 患有精神疾病者; 伴有全身免疫性疾病者; 既往行腺样体手术者; 重症OSA需手术者。根据知情告知,患儿及其家属同意参加本次研究,并签署相关知情同意书。根据OSA-18改良中文版对患儿睡眠呼吸阻塞症状进行评分后进入研究。该研究为前瞻性研究,已通过浙江大学儿童医院医学伦理委员会审批。
1.2. 主要实验材料、仪器及药品
人IL-4、IL-6、IFN-γ、HBD-2 ELISA试剂盒,人IL-4、IL-6、IFN-γ、HBD-2抗体,TissuePrep快速组织细胞破碎仪,M5多功能酶标仪,OM85-BV(细菌溶解产物,药品规格3.5mg/粒)。
1.3. 方法
1.3.1. 治疗方案
腺样体肥大的常规治疗包括:鼻用糖皮质激素(至少4周),抗白三烯药物,鼻腔盐水冲洗等〔7〕。对照组患儿行常规药物治疗; 观察组患儿行OM85-BV治疗+常规药物治疗,每日空腹口服OM85-BV 1粒(3.5mg/粒),每月连用10 d,停20 d,连续使用12周为1个疗程。经过12周药物治疗后,根据临床评估选择接受腺样体切除术或继续药物治疗。
1.3.2. 睡眠呼吸阻塞评分
OSA生活质量评分表OSA-18中文版由睡眠障碍、身体不适症状、情绪障碍、白天功能状态及父母关切的问题5个部分共18道问题组成,用于评估患儿的临床症状,具有良好的信度和效度〔8〕,为了便于患儿理解评分表的内容,我们制定了OSA-18改良中文版,并将评分系统从7分制改为6分制。要求监护人或患儿对最近6周特定症状发生的频率进行评分:0-从不,2-偶尔,4-经常,6-一直,不同患儿的症状总评分为0~108分。2组患儿分别在治疗不同时段(入组时、治疗6周、治疗12周)填写OSA-18改良中文版。腺样体肥大治疗效果的评定标准:参考公式=(治疗前OSA-18改良中文版评分—治疗后OSA-18改良中文版评分)/治疗前OSA-18改良中文版评分×100%,得分≥66%为显效,26%~65%为有效,≤25%为无效,总有效=显效+有效〔9〕。
1.3.3. 实验方法
2组经过12周药物治疗后经临床评估,需要接受手术治疗,观察组33例,对照组98例。均留取1~2 mL血清标本测定IL-2、IL-4、IL-6、IL-10、TNF、IFN-γ细胞因子含量和IgE含量,留取1~2 mL血清标本测定CD3、CD4、CD8在淋巴细胞中的比例及CD4/CD8比值情况,留取50~60 mg腺样体剩余标本用于测定腺样体中HBD-2、IFN-γ、IL-4、IL-6细胞因子含量,留取1 g腺样体剩余标本做组织切片免疫组织化学染色分析HBD-2、IFN-γ、IL-4、IL-6在腺样体组织的表达差异及分布特征。
1.4. 观察指标
2组12周治疗期间的症状评分结果; 2组12周治疗期间治疗有效率; 2组接受手术治疗的患儿术前血清IL-2、IL-4、IL-6、IL-10、TNF、IFN-γ细胞因子含量和IgE含量,血清CD3、CD4、CD8在淋巴细胞中的比例及CD4/CD8比值情况; 2组接受手术治疗的患儿腺样体HBD-2、IFN-γ、IL-4,IL-6细胞因子含量、表达水平差异及分布特征。
1.5. 统计学方法
采用SPSS 18.0软件进行统计学分析,计量资料采用x±s表示,比较行独立样本t检验。计数资料采用率(%)表示,比较行χ2检验,以P < 0.05为差异有统计学意义。
2. 结果
2.1. 12周治疗期间的症状评分
2组患儿治疗周期均为12周,在治疗不同时段(入组时、治疗6周、治疗12周)根据OSA-18改良中文版对患儿睡眠呼吸阻塞症状进行评分。入组时第1次问卷评分观察组与对照组相比无明显差异(P>0.05)。经过6周与12周的治疗,对照组与观察组患儿症状评分均较入组时第1次问卷评分降低(P < 0.05)。经过6周的治疗周期,第2次问卷评分观察组与对照组相比无明显差异(P>0.05)。经过12周的治疗周期,第3次问卷评分观察组与对照组相比无明显差异(P>0.05)。问卷评分差值(第1次—第2次)观察组与对照组相比无明显差异(P>0.05)。问卷评分差值(第1次—第3次)观察组12.65±9.58明显高于对照组9.87±13.309,差异有统计学意义(P < 0.05)。
2.2. 12周药物治疗效果
观察组总有效率高于对照组,差异有统计学意义(χ2=25.659,P=0.000)。见表 2。
表 2.
2组治疗效果比较 例(%)
| 组别 | 例数 | 显效 | 有效 | 无效 | 总有效 |
| 对照组 | 326 | 85(26.1) | 104(31.9) | 137(42.0) | 189(58.0) |
| 观察组 | 122 | 47(38.5) | 55(45.1) | 20(16.4) | 102(83.6) |
2.3. 接受手术治疗的患儿术前血清细胞因子水平
观察组中接受手术治疗的患儿血清IFN-γ(2.25±1.52)高于对照组(1.39±0.85),2组差异有统计学意义(P < 0.05);观察组中接受手术治疗的患儿血清IL-2、IL-4、IL-6、IL-10、TNF、IgE与对照组比较,差异无统计学意义(P>0.05)。
2.4. 接受手术治疗的患儿术前血清淋巴细胞水平
观察组CD3为70.53%±6.00%,对照组为68.16%±7.15%;观察组CD4为38.40%±6.50%,对照组为36.60%±7.10%;观察组CD8为24.28%±4.13%,对照组为24.93%±6.94%;观察组CD4/CD8为1.65±0.49,对照组为1.66±0.80。观察组CD3、CD4、CD8、CD4/CD8与对照组比较,差异均无统计学意义(P>0.05)。
2.5. 接受手术治疗的患儿腺样体细胞因子水平
排除不符合要求的样本,已收集手术患者腺样体标本共99例,其中观察组27例,对照组72例。通过ELISA技术对腺样体HBD-2、IFN-γ、IL-4、IL-6细胞因子含量进行测定。观察组腺样体HBD-2明显高于对照组,差异有统计学意义(P < 0.05)。观察组腺样体IL-4、IFN-γ明显低于对照组,差异有统计学意义(P < 0.05)。观察组腺样体IL-6与对照组比较,差异无统计学意义(P>0.05)。
2.6. 腺样体的HBD-2、IL-4、IL-6、IFN-γ免疫组织化学结果
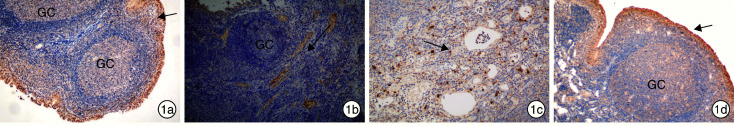
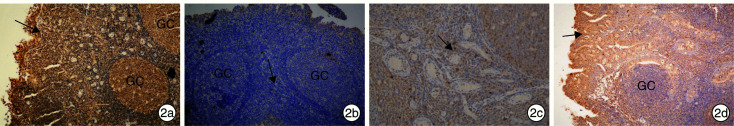
通过免疫组织化学技术对腺样体的HBD-2、IL-4、IL-6、IFN-γ表达水平差异及分布特征进行分析。观察组腺样体HBD-2表达明显高于对照组,腺样体IL-4、IFN-γ表达均明显低于对照组,腺样体IL-6表达与对照组比较差异无统计学意义。HBD-2是抗原诱导表达的抗菌肽,主要表达在淋巴上皮及接受抗原刺激的生发中心(germinal center,GC)。IL-4、IFN-γ、IL-6是分泌蛋白,主要表达在副皮质区及滤泡间区,由T淋巴细胞分泌,也可表达在淋巴上皮。HBD-2,IL-4,IL-6,IFN-γ均可经过毛细血清管网及毛细淋巴管从皮质区向髓质区输出。见图 1、2。
图 1.
对照组免疫组织化学结果
1a:HBD-2在腺样体淋巴上皮的分布; 1b:IFN-γ在滤泡间区及副皮质区的分布; 1c:IL-4在滤泡间区及副皮质区的分布; 1d:IL-6在滤泡间区及副皮质区的分布;
图 2.
观察组免疫组织化学结果
2a:HBD-2在腺样体淋巴上皮的分布; 2b:IFN-γ在滤泡间区及副皮质区的分布; 2c:IL-4在滤泡间区及副皮质区的分布; 2d:IL-6在滤泡间区及副皮质区的分布
3. 讨论
OM85-BV是目前常用的机体免疫调节剂,对变应性鼻炎、哮喘、慢性阻塞性肺疾病、反复上呼吸道感染的患者均有一定的治疗效果〔10-11〕。虽然细菌溶解产物由细菌蛋白质抗原构成,但对预防上呼吸道病毒及细菌感染均有效〔12〕。OM85-BV可通过TLR4和TLR2介导的ERK1/2NF-κB通路上调巨噬细胞IL-1β、IL-6及TNF-a的表达,从而增强机体的免疫功能〔13〕。OM85-BV是TLR激动剂,动物研究表明其主要通过激活TLR4来激活机体的抗感染免疫〔14〕。OM85-BV可通过NF-κB和MAPK依赖途径刺激树突状细胞表面的模式识别受体,使树突状细胞提早激活,对机体的早期感染具有免疫保护作用〔15〕。OM85-BV还可以促进IFN-β分泌,增强炎症活动〔16〕。
众多研究表明OM85-BV对过敏性疾病(哮喘、变应性鼻炎)均有治疗作用,可增强机体Th1免疫反应,减弱Th2免疫反应〔11, 17〕。实验研究表明,经过OM85处理的过敏小鼠,鼻部症状可缓解,鼻腔嗜酸性细胞的浸润减少,鼻腔灌洗液Th2细胞因子IL-4、IL-5、IL-13有所下降,Th1细胞因子INF-γ升高,治疗周期越长,IL-5下降越明显,IFN-γ升高越明显,血清中IgE、IgG1水平也下降〔18〕。在接触过敏原前服用OM85-BV的致敏小鼠支气管肺泡灌洗液中IL-4、IL-5、IL-13明显下降,INF-γ升高,支气管嗜酸性细胞浸润减少,可改善哮喘症状,但仍无法预防哮喘的发生〔19〕。服用OM85-BV的支气管哮喘患儿血清IL-4、IL-5、IL-13、IL-17水平下降,INF-γ升高,气道Treg水平升高,对过敏原耐受性增强,可减轻气道高反应,减轻支气管哮喘患儿的气道炎症,预防哮喘发作〔20〕。有学者认为其根本机制与肠道-肺轴的免疫循环有关,气道及肠道均属于黏膜相关性淋巴结,细菌溶解产物经过口服到达肠道,作用于肠道黏膜的潘氏淋巴结,激活肠道免疫反应,肠道被激活的淋巴细胞经过肠道-肺免疫循环进入气道,增强机体对呼吸道感染的免疫防御反应〔21〕。研究表明,孕期母体服用OM85-BV可预防新生儿哮喘等过敏性疾病的发生〔22〕。
近年来OM85-BV对上呼吸道感染的预防及治疗作用有大量的临床研究,Esposito等〔20〕报道OM85-BV可以使患儿的反复呼吸道感染发生率下降。对OM85-BV预防儿童急性上呼吸道感染的成本效益进行分析,其对学龄前儿童具有良好的效益〔23〕。腺样体肥大严重影响儿童的睡眠质量〔24〕。本研究发现,经过6周与12周的治疗,对照组与观察组患儿临床症状均得到有效缓解,经过12周的治疗,观察组总有效率明显高于对照组,反复上呼吸道感染伴腺样体肥大儿童的睡眠呼吸阻塞症状的改善程度也明显高于对照组。OM85-BV可以改善反复上呼吸道感染伴腺样体肥大患儿的睡眠障碍与上呼吸道感染的预防及治疗有关。
观察组患儿血清IFN-γ明显高于对照组(P < 0.05),血清IL-2、IL-4、IL-6、IL-10、TNF、IgE与对照组比较均无差异,血清CD3、CD4、CD8、CD4/CD8与对照组比较也均无差异,腺样体IL-4、IFN-γ表达明显低于对照组(P < 0.05),观察组腺样体IL-6表达与对照组比较无明显差异。服用OM85-BV患儿血清IFN-γ升高,可促进机体的Th1免疫防御反应。本研究并未对T细胞群进行分类计数,12周的OM85-BV治疗对患儿体内的淋巴细胞水平无明显影响,可能是因为OM85-BV治疗周期过短不足以引起淋巴细胞水平的变化。本研究的对象为反复上呼吸道感染的患儿,腺样体局部炎症反应较强,局部IL-4、IL-6与IFN-γ高表达,OM85-BV可增强机体抵抗力和机体对病原的清除能力,减少腺样体局部细菌定植,从而减弱腺样体局部炎症反应,使局部腺样体IL-4、IFN-γ表达下降。
观察组腺样体HBD-2明显高于对照组(P < 0.05)。HBD-2是一类重要的内源性抗菌肽,在病原微生物或炎症因子的刺激下,各种腺体组织及黏膜上皮细胞可诱导性表达HBD-2。HBD-2具有广谱抗微生物学活性及细胞毒性,常被称为“内源性超级抗菌肽”,它对细菌、病毒、真菌、肿瘤细胞均有一定的杀伤作用,同时它具有稳定的分子结构,可以抵御蛋白酶的水解,病原微生物不易对其产生耐药性,是先天性免疫防御及获得性免疫防御系统的重要组成部分〔25〕。廖嘉仪等〔26〕的研究表明细菌溶解产物可提高支气管哮喘合并反复呼吸道感染患儿血清HBD-1水平。Guaní-Guerra等〔27〕研究表明细菌提取物可增加变应性鼻炎患儿鼻黏膜HBD-2的表达从而增强局部黏膜上皮对病菌的抵御力。本研究发现观察组腺样体表达HBD-2明显高于对照组,OM85-BV可诱导机体HBD-2表达增加,腺样体局部HBD-2表达增加,可以增强腺样体对感染的抵抗力。OM85-BV对机体有双重免疫作用,增强机体固有免疫,抑制特异性Th2免疫。本研究表明OM85-BV对腺样体也可表现为双重免疫作用,增强局部腺样体对病原体的抵抗力,同时抑制过度炎症反应,增强儿童对上呼吸道感染的抵抗力,减轻腺样体增生肥大,有效改善腺样体的阻塞症状。
本研究虽然是对OM85-BV治疗反复上呼吸道感染伴腺样体肥大患儿的前瞻性研究,但并未采用随机、双盲法对研究对象进行分组,可能存在入组研究对象偏倚。因入组病例数量较大,最终2组的临床特征表现为组间可比,可在一定程度上缓解研究对象偏倚造成的差异。对2组患儿的淋巴细胞未能够进行分类计数,不能明确研究OM85-BV对不同免疫淋巴细胞群的影响。
OM85-BV可明显改善腺样体肥大患儿的睡眠呼吸阻塞的临床症状,不能改变患儿体内免疫淋巴细胞的水平,OM85-BV可提高机体的Th1免疫防御反应,可增强机体对病原的抵抗力,诱导腺样体局部HBD-2表达增加,增强局部腺样体对微生物抵抗力,使定植于腺样体的细菌减少,可减弱腺样体局部炎症反应。
References
- 1.Berger M, Geng B, Cameron DW, et al. Primary immune deficiency diseases as unrecognized causes of chronic respiratory disease. Respir Med. 2017;132:181–188. doi: 10.1016/j.rmed.2017.10.016. [DOI] [PubMed] [Google Scholar]
- 2.Zupin L, Celsi F, Bresciani M, et al. Human beta defensin-1 is involved in the susceptibility to adeno-tonsillar hypertrophy. Int J Pediatr Otorhinolaryngol. 2018;107:135–139. doi: 10.1016/j.ijporl.2018.01.041. [DOI] [PubMed] [Google Scholar]
- 3.Triantafillou V, Workman AD, Patel NN, et al. Broncho-Vaxom®(OM-85 BV)soluble components stimulate sinonasal innate immunity. Int Forum Allergy Rhinol. 2019;9(4):370–377. doi: 10.1002/alr.22276. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Esposito S, Bianchini S, Bosis S, et al. A randomized, placebo-controlled, double-blinded, single-centre, phase IV trial to assess the efficacy and safety of OM-85 in children suffering from recurrent respiratory tract infections. J Transl Med. 2019;17(1):284–284. doi: 10.1186/s12967-019-2040-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.张 波. 反复呼吸道感染的临床概念和处理原则. 世界最新医学信息文摘. 2017;17(62):194–194. [Google Scholar]
- 6.Acar M, Kankilic ES, Koksal AO, et al. Methodsof the diagnosis of adenoid hypertrophy for physicians: adenoid-nasopharynx ratio. J Craniofac Surg. 2014;25(5):e438–440. doi: 10.1097/SCS.0000000000000952. [DOI] [PubMed] [Google Scholar]
- 7.仇 书要, 刘 大波, 钟 建文. 2018法国耳鼻咽喉头颈外科学会指南解读: 不同治疗方案在儿童OSAHS治疗中的地位. 临床耳鼻咽喉头颈外科杂志. 2020;34(2):97–100. doi: 10.13201/j.issn.1001-1781.2020.02.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.周 永, 莫 贤海, 宾 翔, et al. OSA-18调查表法对儿童阻塞性睡眠呼吸障碍患儿生活质量评估的临床意义. 中国耳鼻咽喉颅底外科杂志. 2014;20(6):502–506. [Google Scholar]
- 9.Yan XH, Zhao Y, Wang J, et al. Associations among sleep symptoms, physical examination, and polysomnographic findings in children with obstructive sleep apnea. Eur Arch Otorhinolaryngol. 2020;277(2):623–630. doi: 10.1007/s00405-019-05719-8. [DOI] [PubMed] [Google Scholar]
- 10.Koatz AM, Coe NA, Cicerán A, et al. Clinical and Immunological Benefits of OM-85 Bacterial Lysate in Patients with Allergic Rhinitis, Asthma, and COPD and Recurrent Respiratory Infections. Lung. 2016;194(4):687–697. doi: 10.1007/s00408-016-9880-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Bodemer C, Guillet G, Cambazard F, et al. Adjuvant treatment with the bacterial lysate(OM-85) improves management of atopic dermatitis: A randomized study. PLoS One. 2017;12(3):e0161555. doi: 10.1371/journal.pone.0161555. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Rossi GA, Bessler W, Ballarini S, et al. Evidence that a primary anti-viral stimulation of the immune response by OM-85 reducessusceptibility to a secondary respiratory bacterial infection in mice. Ital J Pediatr. 2018;44(1):112–112. doi: 10.1186/s13052-018-0569-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Luan H1, Zhang Q, Wang L. OM85-BV induced the productions of IL-1β, IL-6, and TNF-α via TLR4-and TLR2-mediated ERK1/2/NF-κB pathway in RAW264.7 cells. J Interferon Cytokine Res. 2014;34(7):526–536. doi: 10.1089/jir.2013.0077. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Coviello S, Wimmenauer V, Polack FP, et al. Bacterial lysates improve the protective antibody response against respiratory viruses through Toll-like receptor 4. Hum Vaccin Immunother. 2014;10(10):2896–2902. doi: 10.4161/hv.29784. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Parola C, Salogni L, Vaira X, et al. eCollection 2013.Selective activation of human dendritic cells by OM-85 through a NF-kB and MAPK dependent pathway. PLoS One. 2013;8(12):e82867. doi: 10.1371/journal.pone.0082867. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Dang AT, Pasquali C, Ludigs K, et al. OM-85 is an immunomodulator of interferon-β production and inflammasome activity. Sci Rep. 2017;7:43844. doi: 10.1038/srep43844. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Emeryk A, Bartkowiak-Emeryk M, Raus Z, et al. Mechanical bacterial lysate administration prevents exacerbation in allergic asthmatic children-The EOLIA study. Pediatr Allergy Immunol. 2018;29(4):394–401. doi: 10.1111/pai.12894. [DOI] [PubMed] [Google Scholar]
- 18.Han L, Zheng CP, Sun YQ, et al. A bacterial extract of OM-85 Broncho-Vaxom prevents allergic rhinitis in mice. Am J Rhinol Allergy. 2014;28(2):110–116. doi: 10.2500/ajra.2013.27.4021. [DOI] [PubMed] [Google Scholar]
- 19.Liu C, Huang R, Yao R, et al. The Immunotherapeutic Role of Bacterial Lysates in a Mouse Model of Asthma. Lung. 2017;195(5):563–569. doi: 10.1007/s00408-017-0003-8. [DOI] [PubMed] [Google Scholar]
- 20.Esposito S, Soto-Martinez ME, Feleszko W, et al. Nonspecific immunomodulators for recurrent respiratory tract infections, wheezing and asthma in children: a systematic review of mechanistic and clinical evidence. Curr Opin Allergy Clin Immunol. 2018;18(3):198–209. doi: 10.1097/ACI.0000000000000433. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Lu Y, Li Y, Xu L, et al. Bacterial Lysate Increases the Percentage of Natural Killer T Cells in Peripheral Blood and Alleviates Asthma in Children. Pharmacology. 2015;95(3-4):139–144. doi: 10.1159/000377683. [DOI] [PubMed] [Google Scholar]
- 22.Scott NM, Lauzon-Joset JF, Jones AC, et al. Protection against maternal infection-associated fetal growth restriction: proof-of-concept with a microbial-derived immunomodulator. Mucosal Immunol. 2017;10(3):789–801. doi: 10.1038/mi.2016.85. [DOI] [PubMed] [Google Scholar]
- 23.Berber A, Del-Rio-Navarro BE. Cost-effectiveness analysis of OM-85 vs placebo in the prevention of acute respiratory tractinfections(ARTIs)in children that attend day-care centers. Health Econ Rev. 2019;9(1):12–12. doi: 10.1186/s13561-019-0230-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.张 丰珍, 王 桂香, 许 志飞, et al. 儿童重度OSAHS睡眠结构及相关因素分析. 临床耳鼻咽喉头颈外科杂志. 2019;33(5):441–446. doi: 10.13201/j.issn.1001-1781.2019.05.014. [DOI] [PubMed] [Google Scholar]
- 25.Donnarumma G, Paoletti I, Fusco A, et al. β-Defensins: Work in Progress. Adv Exp Med Biol. 2016;901:59–76. doi: 10.1007/5584_2015_5016. [DOI] [PubMed] [Google Scholar]
- 26.廖 嘉仪, 张 涛. 细菌溶解产物对支气管哮喘合并反复呼吸道感染患儿血清β防御素1及免疫球蛋白的影响. 中国当代儿科杂志. 2014;16(5):508–512. [PubMed] [Google Scholar]
- 27.Guaní-Guerra E, Negrete-García MC, Montes-Vizuet R, et al. Human β-defensin-2 induction in nasal mucosa after administration of bacterial lysates. Arch Med Res. 2011;42(3):189–194. doi: 10.1016/j.arcmed.2011.04.003. [DOI] [PubMed] [Google Scholar]