Abstract
目的
探讨原发性和继发性喉结核的临床模式、诊断和治疗。
方法
回顾性分析103例确诊为喉结核的患者, 从病例记录中获得人口学特征、生活方式、临床特征、诊断和治疗。
结果
103例患者中, 64例被诊断为原发性喉结核, 39例被诊断为继发性喉结核。最常见的症状是声音嘶哑和吞咽困难。声带是最常见的侵犯部位。大多数原发性喉结核病患者表现为单发、增生病变。继发性喉结核表现为溃疡、水肿、多部位病变。所有喉结核患者均给予系统的抗结核治疗。如果患者出现喉梗阻, 则考虑手术治疗。
结论
原发性、继发性喉结核的临床表现、体征存在差异。喉结核容易误诊为喉炎、喉肿瘤, 应进行病理学检查, 以明确诊断。
Keywords: 结核, 喉; 临床特征; 误诊
Abstract
Objective
The aim of this study was to analyze and compare the clinical pattern, diagnosis and treatment in primary and secondary laryngeal and pharyngeal TB.
Methods
A retrospective analysis was carried out on 103 patients diagnosed laryngeal tuberculosis in our department. Characteristics of demography, life-style, clinical features, diagnosis and treatment were obtained from medical case records. Clinical analysis of 103 patients with pathologically confirmed laryngeal TB was carried out retrospectively in the second affiliated hospital of Nanchang university in Jiangxi province.
Results
Among 103 patients, 64 cases were diagnosed as primary laryngeal TB and 39 cases were diagnosed as secondary laryngeal TB. The most common complaints were hoarseness and odynophagia. The true and the false vocal cords were most commonly involved. Most patients with primary tuberculosis of the larynx present a single, hyperplastic lesion.Secondary laryngeal TB of larynx was characterized by ulcers, edema effusive, multiple sites lesions. The anti-TB treatment was given systemically to all patients. The surgery should be considered if the patient has a laryngeal obstruction.
Conclusion
The clinical manifestations and signs of primary and secondary tuberculosis of the larynx are different. Laryngeal tuberculosis is easy to be misdiagnosed as laryngitis and laryngeal tumors. Pathological examination should be performed to confirm the diagnosis.
Keywords: tuberculosis, larynx; clinical features; misdiagnosis
随着全球结核病感染的减少,2000年以来,肺结核感染和死亡率下降;然而,包括喉结核在内的肺外结核(extrapulmonary tuberculosis,EPTB)由于免疫缺陷状态发生率的增加而呈上升趋势。喉结核是由结核分枝杆菌引起的慢性细菌性感染疾病,分为原发性和继发性。许多相关文献表明,疾病的临床表现和体征有区别[1-3]。现对我科2010年1月—2020年1月收治的103例喉结核患者临床资料进行回顾性研究,以期为该病的诊断和治疗提供参考。
1. 资料与方法
1.1. 临床资料
回顾性分析我科所有经过病理检查确诊为喉结核的103例患者。记录每个病例的流行病学和临床资料。流行病学参数包括年龄和性别,以及可能诱发或促进喉结核病发病的危险因素。临床参数包括患者的症状和体征、电子鼻咽镜检查结果。辅助检查包括胸部X线检查、血沉(ESR)、结核菌素抗体测试及结核分枝杆菌痰涂片检查等。
1.2. 原发性和继发性喉结核的诊断标准
原发性喉结核的诊断取决于以下两点:①病理诊断;②胸部CT或X线提示正常。继发性喉结核的诊断标准:①长期声音嘶哑,咽喉疼痛和吞咽困难;②结核病高发地区有(无)结核病史的患者,与结核病患者或患有结核病的家庭成员有密切的接触;③喉部病变的特征:病变主要位于喉咽部的后部,包括会厌的喉侧、劈裂的后部、杓间区、室带及声带的后部;④胸部CT或X线检查提示活动性或慢性肺结核、胸膜积液、胸腰椎结核,彩色多普勒超声显示颈部淋巴结核;⑤抗结核药物治疗1个月后,临床症状明显改善;⑥痰涂片检查发现结核分枝杆菌,纯化蛋白衍生物检测(PPD)呈强阳性,ESR显示血沉增加;⑦肺结核中毒症状如发热、盗汗、逐渐消瘦等均明显;⑧经喉及颈部淋巴结活检证实为结核病。王洪田等(2011)认为与前5项相一致的可作出临床诊断,与8个项目都一致可确诊为继发性喉结核。患者经过一段时间的常规抗结核治疗,症状仍然没有改善,需要进行活检,排外肿瘤的可能性。
1.3. 电子喉镜检查结果分类
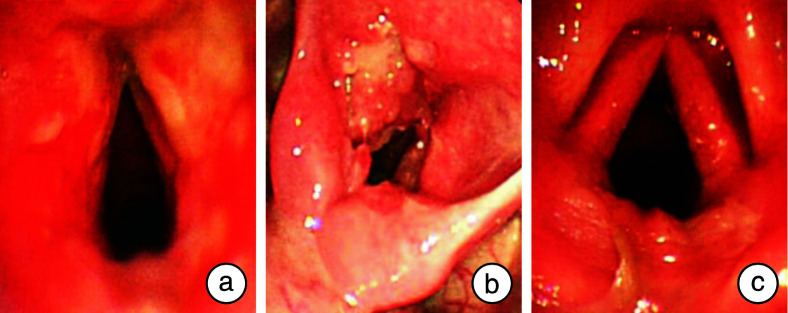
使用电子喉镜观察病变的浸润范围和形态。根据喉部病变的浸润范围,将涉及咽喉部两个以上解剖分区的病变视为多发病灶,而仅将一个解剖区域视为单个病变。根据喉镜的病理特点,将喉结核分为3种类型:①浸润性水肿型(渗出型)(见图 1a):黏膜充血肿胀并伴局部糜烂和渗出;②增生型(见图 1b):组织增生或肥大,组织增生可伴有局部溃疡。③喉炎型(见图 1c):病变局限于声带的一侧或两侧,表现为慢性喉炎。
图 1.
电子喉镜检查
a:浸润性水肿型(渗出型);b:增生型;c:喉炎型
1.4. 统计学分析
使用SPSS 17.0统计学软件分析数据。比较原发性喉结核和继发性喉结核的人口统计学变量,生活方式因素和临床特征。计数数据采用Fisher's精确检验或卡方检验进行分析,以P < 0.05为差异有统计学意义。
2. 结果
2.1. 人口因素和生活方式因素
本研究共103例喉结核患者,原发性喉结核64例,继发性喉结核39例。其中男75例,女38例,男女性别比1.71∶1;年龄7~75岁,平均35.3岁。65例患者有长期吸烟史,47例有饮酒习惯。32例来自城市地区,71例患者来自农村地区。患者的人口学及描述性数据见表 1,发病年龄以40~60岁最高。
表 1.
原发性和继发性喉结核的人口学及烟酒不良嗜好的比较 例(%)
| 项目 | 例数(%) | 原发性喉结核 | 继发性喉结核 | P |
| 性别 | 0 | |||
| 男 | 75(72.81) | 53(51.46) | 22(21.36) | |
| 女 | 28(27.18) | 11(10.68) | 17(16.50) | |
| 年龄/岁 | ||||
| 0~20 | 4(3.88) | 0(0) | 4(3.88) | |
| >20~30 | 4(3.88) | 2(1.94) | 2(1.94) | |
| >30~40 | 12(11.65) | 7(6.80) | 5(4.85) | |
| >40~50 | 31(30.10) | 20(19.42) | 11(10.68) | |
| >50~60 | 25(24.27) | 17(16.50) | 8(7.78) | |
| >60~70 | 20(19.42) | 12(11.65) | 8(7.78) | |
| >70 | 7(6.80) | 4(3.88) | 3(2.91) | |
| 出生地 | 0 | |||
| 城市 | 32(31.07) | 24(23.30) | 8(7.77) | |
| 农村 | 71(68.93) | 42(40.78) | 31(30.10) | |
| 吸烟 | 0.06 | |||
| 否 | 38(36.89) | 20(19.42) | 18(17.48) | |
| 是 | 65(63.11) | 44(42.72) | 21(20.39) | |
| 饮酒 | 0.05 | |||
| 否 | 66(64.08) | 32(31.08) | 34(33.01) | |
| 是 | 47(45.63) | 32(31.08) | 15(14.56) |
2.2. 临床表现
喉结核的主要症状为声音嘶哑、吞咽疼痛,全身症状不明显。43例出现声音嘶哑,12例出现声音嘶哑和吞咽疼痛,7例出现声音嘶哑和咽喉疼痛。继发性喉结核的全身症状非常普遍,39例患者中31例有全身症状,比例高达79.48%。主要症状包括发热、乏力、盗汗、食欲不振及逐渐消瘦。局部症状为声音嘶哑、咽喉疼痛、吞咽疼痛、咽部不适及异物感。
2.3. 喉镜特征
原发性和继发性喉结核内镜特征比较,见表 2。最受累的部位是声带,室带,杓间区,杓会厌劈,会厌,扁桃体和其他部位。
表 2.
原发性和继发性喉结核内镜特征比较
| 喉镜特征 | 原发性喉结核 | 继发性喉结核 | χ 2 | P |
| 浸润和水肿型 | 12(18.75) | 19(48.72) | 12.776 | 0.002 |
| 增生型 | 37(57.81) | 10(25.64) | ||
| 喉炎型 | 15(23.44) | 10(25.64) | ||
| 多部位 | 18(28.13) | 32(82.05) | 28.212 | 0.00 |
| 单部位 | 46(71.87) | 7(17.95) |
2.4. 治疗和结果
25例单发声带病变行声带病损切除术,2例患者因呼吸困难行气管切开术。所有患者不管是术前病理确诊还是术后病理确诊,均转入结核病专科医院抗结核治疗。2例患者在抗结核治疗后出现喉部粘连,影响发声和呼吸,进行了喉部粘连分离手术。
3. 讨论
3.1. 喉结核的患病率
结核病是一个重大的全球公共卫生问题,它还影响经济和社会发展。中国是全球结核病高负担国家之一,位列全球第3位。我省结核病发病率远高于全国水平。在中国由于结核病耐药菌,尤其是耐多药结核病的出现,预计结核病发病率仍处于稳定状态,甚至呈上升趋势。根据世界卫生组织2019年全球报告,2018年中国新增结核病患者86.6万,其中,耐利福平结核病的患者在全球居第2[4],结核病在新疆等农村地区的发病率仍然很高[5]。近年来的研究表明,EPTB的发病率呈上升趋势,在美国、英国、德国分别占21.6%,38.0%和22.0%[6-8],增长的原因尚不清楚。考虑到EPTB的诊断难度和漏诊病例,EPTB的实际比例可能比所报告的要高得多。年轻人、女性、亚裔和非洲裔以及人类免疫缺陷病毒(HIV)感染是EPTB的独立危险因素[9]。在发展中国家,由于缺乏检测资源和医生对疾病认识不全面[10],EPTB的比例仅降低10.3%。喉结核病作为常见的EPTB一直被临床医生所忽视。在过去的12年里,喉结核病的发病率有所增加,这与EPTB的发病率相似,尤其是原发性喉部和咽部结核病。造成这种情况的主要因素可能与休眠结核分枝杆菌的恢复有关。结核分枝杆菌在宿主体内常处于休眠状态,只有10%的患者在结核分枝杆菌感染后发病。当糖尿病、艾滋病等疾病损害免疫系统时,潜伏的结核分枝杆菌活性增强。本研究表明,30~60岁是喉结核发病的高峰年龄,这与Shin等[1]和Prasad等(2014)的研究结果相似。继发性喉结核通常继发于重症肺结核,老年患者一般病情较差,尤其是肺部状况。含结核分枝杆菌的痰液卡在咽喉内,细菌通过破损的黏膜或黏液腺侵入体内。另一个突出的特点是农村人口在继发性喉结核中占很大比例,而城镇人口在原发性喉结核中占50%,两者有显著差异。而吸烟、饮酒在原发性喉结核和继发性喉结核中所占的比例差异并无统计学意义,这可能与我们的统计比较粗糙有关,并未涉及吸烟具体的量、初始年龄和饮酒具体的量等。本研究中原发性喉结核占比较大,固然与本身的发病率增加有关,还可能与继发性喉结核患者全身症状较重,可能更多就诊于结核专科病医院或者呼吸科有关。
3.2. 原发性和继发性喉结核的临床表现差异
根据我们的研究结果,原发性喉结核主要表现为单发和增生性病变。声带是最常见的侵入部位,声音嘶哑是最常见的临床表现。继发性喉结核主要为多发性病灶,具有浸润水肿的形态。咽喉的后部为主要侵入部位,患者主要表现出咽喉疼痛。根据我们的观察,原发性和继发性喉结核的临床表现差异的原因如下:①喉结核的病理学与组织学特征密切相关。黏膜及黏膜下组织紧密结合区以增生为主要病理表现,充血和水肿病变常位于松散的组织中。声带是最常见的原发性喉结核侵犯区域,因此增生性病变在原发性喉结核患者中更为明显。咽喉的后部,包括会厌的舌面、披裂的后部、杓间区、室带及声带的后部都由松散的组织组成,所以大多数继发性喉结核患者是浸润性水肿型病变。②喉结核病变的侵袭范围与肺结核的严重程度有关。单纯和非特异性的炎症病变通常并不伴有肺结核。多发性溃疡和肉芽肿病灶常伴有继发性喉结核合并活动性肺结核[11]。③原发性喉结核未见明显的肺部病变,全身中毒症状较轻,故感染途径多为经血液或淋巴途径,而非直接接触。原发性喉和咽结核与患者的免疫状况和结核分枝杆菌潜伏感染密切相关。当免疫系统平衡被破坏时,巨噬细胞吞噬其他的细胞诱发肉芽肿。这可能是原发性喉部和咽部结核增生型病变形成的主要原因[12]。继发性喉咽结核常继发于肺结核,尤其是晚期肺结核(常伴有空洞形成)和慢性活动性肺结核,感染途径以直接接触为主。
3.3. 原发性和继发性喉结核的诊断和治疗
原发性喉结核临床缺乏特异性,声带增生性病变且单一性的病变较多,常被当作声带良性病变误诊,往往在术后病理诊断之后才确诊。我们认为这可能与下列因素有关:①原发性喉结核没有结核病史,不容易引起临床医生的关注;②原发性喉结核的症状不典型,肉眼很难分辨;浸润性水肿型和喉炎型病变与喉炎相似;增生型病变与喉部和下咽部肿瘤难以区分[13-15]。因此,有必要进行多部位的病理活检。
继发性喉结核的诊断较容易。局部活检结合肺结核感染可作出诊断。但是对于经过1个月的抗结核治疗的患者,如果疗效欠佳,需要再次进行活检,以排外喉结核同时合并喉肿瘤的可能性。
随着有效的化疗药物的出现,喉结核患者对外科治疗的需求有增长趋势[16]。一旦做出喉结核的诊断,应尽早给予足够的抗结核药物,并同时雾化吸入抗结核药物。糖皮质激素有助于缓解严重的过敏反应,促进结核病病灶的吸收。在急性水肿期,适当剂量的糖皮质激素治疗可迅速缓解瘢痕形成,避免永久性嘶哑,提高抗结核药物疗效。近年来的研究表明,结核病是一种与免疫调节相关,由保护性免疫反应和病理性免疫反应介导的传染病。当细胞免疫功能正常时,结核病不易发展;细胞免疫功能受损导致结核病的发生和发展。临床结果证明,免疫治疗可以缩短原发性肺结核患者的化疗周期[17]。因此,免疫治疗在今后可能适用于喉结核患者。
本组有2例多部位增生性患者,以Ⅲ度呼吸困难作为首诊,这时应该立即在有保护措施的情况下进行气管切开,以保证患者的生命安全。有个别患者在抗结核治疗后出现喉粘连和狭窄,为了进一步提高患者的生活质量,我们采用CO2激光手术对粘连带进行分离,同时放置硅胶管预防复发,一般在15 d复查时将硅胶管取出。
综上所述,原发性和继发性喉结核仍处于高发状态。原发性喉结核具有较长的临床病程,无特异性症状和内镜征象,需要依靠病理来进行鉴别。有效性的抗结核药物治疗依然是喉结核的主要治疗方式,但是当患者出现呼吸困难或者抗结核治疗后残留的粘连等,应进行手术,以确保呼吸功能和提高患者的嗓音功能。
References
- 1.Shin JE, Nam SY, Yoo SJ, et al. Changing trends in clinical manifestations of laryngeal tuberculosis. Laryngoscope. 2000;110(11):1950–1953. doi: 10.1097/00005537-200011000-00034. [DOI] [PubMed] [Google Scholar]
- 2.Wang CC, Lin CC, Wang CP, et al. Laryngeal tuberculosis: a review of 26 cases. Otolaryngol Head Neck Surg. 2007;137(4):582–588. doi: 10.1016/j.otohns.2007.04.002. [DOI] [PubMed] [Google Scholar]
- 3.Rizzo PB, Da Mosto MC, Clari M, et al. Laryngeal tuberculosis: an often forgotten diagnosis. Int J Infect Dis. 2003;7(2):129–131. doi: 10.1016/S1201-9712(03)90008-7. [DOI] [PubMed] [Google Scholar]
- 4.Harding E. WHO global progress report on tuberculosis elimination. Lancet Respir Med. 2020;8(1):19–19. doi: 10.1016/S2213-2600(19)30418-7. [DOI] [PubMed] [Google Scholar]
- 5.Zheng Y L, Zhang L P, Zhang X L, et al. Forecast Model Analysis for the Morbidity of Tuberculosis in Xinjiang, China. PLoS One. 2015;10(3):e0116832. doi: 10.1371/journal.pone.0116832. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Peto HM, Pratt RH, Harrington TA, et al. Epidemiology of extrapulmonary tuberculosis in the United States, 1993-2006. Clin Infect Dis. 2009;49(9):1350–1357. doi: 10.1086/605559. [DOI] [PubMed] [Google Scholar]
- 7.te Beek LA, van der Werf MJ, Richter C, et al. Extrapulmonary tuberculosis by nationality, The Netherlands, 1993-2001. Emerg Infect Dis. 2006;12(9):1375–1382. doi: 10.3201/eid1209.050553. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Forssbohm M, Zwahlen M, Loddenkemper R, et al. Demographic characteristics of patients with extrapulmonary tuberculosis in Germany. Eur Respir J. 2008;31(1):99–105. doi: 10.1183/09031936.00020607. [DOI] [PubMed] [Google Scholar]
- 9.Zhang X, Andersen AB, Lillebaek T, et al. Effect of sex, age, and race on the clinical presentation of tuberculosis: a 15-year population-based study. Am J Trop Med Hyg. 2011;85(2):285–290. doi: 10.4269/ajtmh.2011.10-0630. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Wang X, Yang Z, Fu Y, et al. Insight to the Epidemiology and Risk Factors of Extrapulmonary Tuberculosis in Tianjin, China during 2006-2011. PLoS One. 2014;9(12):e112213. doi: 10.1371/journal.pone.0112213. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Kulkarni NS, Gopal GS, Ghaisas SG, et al. Epidemiological considerations and clinical features of ENT tuberculosis. J Laryngol Otol. 2001;115(7):555–558. doi: 10.1258/0022215011908487. [DOI] [PubMed] [Google Scholar]
- 12.Flynn JL, Chan J, Lin PL. Macrophages and control of granulomatous inflammation in tuberculosis. Mucosal Immunol. 2011;4(3):271–278. doi: 10.1038/mi.2011.14. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.El Ayoubi F, Chariba I, El Ayoubi A, et al. Primary tuberculosis of the larynx. Eur Ann Otorhinolaryngol Head Neck Dis. 2014;131(6):361–364. doi: 10.1016/j.anorl.2013.10.005. [DOI] [PubMed] [Google Scholar]
- 14.Benwill JL, Sarria JC. Laryngeal tuberculosis in the United States of America: a forgotten disease. Scand J Infect Dis. 2014;46(4):241–249. doi: 10.3109/00365548.2013.877157. [DOI] [PubMed] [Google Scholar]
- 15.Cranford J, Kadakia S, Berzofsky C. Palatopharyngoplasty for treatment of nasopharyngeal stenosis secondary to extra-laryngeal tuberculosis. Am J Otolaryngol. 2016;37(6):559–562. doi: 10.1016/j.amjoto.2016.06.002. [DOI] [PubMed] [Google Scholar]
- 16.Lee JY. Diagnosis and treatment of extrapulmonary tuberculosis. Tuberc Respir Dis(Seoul) 2015;78(2):47–55. doi: 10.4046/trd.2015.78.2.47. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Stickney DR, Noveljic Z, Garsd A, et al. Safety and activity of the immune modulator HE2000 on the incidence of tuberculosis and other opportunistic infections in AIDS patients. Antimicrob Agents Chemother. 2007;51(7):2639–2641. doi: 10.1128/AAC.01446-06. [DOI] [PMC free article] [PubMed] [Google Scholar]