Abstract
KBG综合征是由ANKRD11基因突变引起的一种罕见的多系统常染色体显性遗传疾病。本文报道的1例患者有一系列相关的临床症状,包括听力丧失、身材矮小、上中门齿巨齿症和智力迟钝,诊断为KBG综合征。纯音测听显示双侧传导性听力损失,颞骨CT显示双侧中耳听骨链畸形,X线显示骨龄只有5岁左右,基因检测提示有ANKRD11的新生突变。本文简要分析KBG综合征的听力学表型特征,以期提高临床对该病的重视。
Keywords: 听力损失, KBG综合征, ANKRD11突变
Abstract
KBG syndrome is an uncommon autosomal dominant inheritance disease involving multiple systems caused by mutations of ANKRD11 gene. The patient, who has a series of symptoms including hearing loss, short stature, macrodontia of upper central incisors and mental retardation, was diagnosed with KBG syndrome. Pure tone audiometry showed bilateral conductive hearing loss, the temporal bone CT suggested there were deformed ossicular chain in bilateral middle ears, and X-ray showed bone age was only five years old or so, what is the most important is that genetic testing prompted a de novo mutation of ANKRD11. The aim of this article was to briefly analyze the audiological phenotypic characteristics of KBG syndrome and hope to improve the clinical attention to this disease.
Keywords: hearing loss, KBG syndrome, ANKRD11 mutations
1. 病例报告
患者,女,6岁8个月,主因“自幼双耳听力差”就诊并寻求遗传咨询。患儿出生时双耳听力筛查均未通过,家长当时自觉患儿对声音反应尚可,1月龄复筛仍未通过,完善相关检查后提示双耳为中度传导性听力损失,当时未予特殊治疗;6月龄时复查声导抗、听性脑干反应(auditory brainstem response,ABR)、多频听觉稳态诱发反应(auditory steady-state evoked responses,ASSR)及颞骨CT后初步诊断为“双耳中度传导性听力损失;先天性中耳畸形(双);发育迟缓?”,遂右耳佩戴助听器至今,8~10 h/d,病程中无耳鸣、耳痛及耳闷胀感,无耳流脓、眩晕及恶心呕吐等不适,既往无耳毒性药物使用史。现患儿家长为明确病因并寻求遗传咨询就诊,完善相关检查,考虑遗传性可能性大,遂予基因测序。患儿言语发育可,学习成绩中下水平,身材矮小。个人史及家族史:第1胎,足月顺产,产程中无窒息;出生身长49 cm,体重3240 g。母亲孕晚期有胎动减少及脐绕颈,婴幼儿期喂养困难、挑食,偶有便秘,5个月抬头,8个月独坐,16个月独走,24个月会说简单语,前囟门宽大,约于2岁6个月闭合。母亲身高159 cm;父亲身高179 cm。否认近亲结婚及家族性矮小症病史。
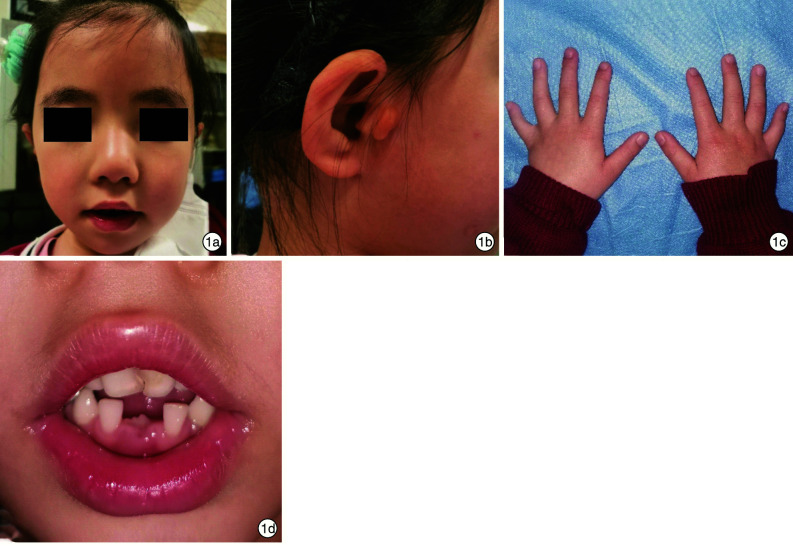
体检:身高117 cm;体重19.5 kg;韦氏儿童智力量表(WISC-R)测试总分61,其中语言总分60,操作总分70。面部表情自然,浓眉,眼距增宽,左上眼睑内侧下垂,左眼斜视,球形鼻,牙列不齐,中上切牙巨齿畸形且对位不齐,中下切牙缺如,右下磨牙置换后;双手第五指短指畸形。耳鼻咽喉专科查体可见双侧耳屏前及右侧颊部皮肤色泽正常的皮赘突起,内可触及软骨,以右耳前为著。双侧耳郭形态偏小,双侧鼓膜完整,右侧稍内陷。鼻根部塌陷,内眦增宽,鼻尖呈球状(图 1)。
图 1.
患儿面部特征
1a:浓眉、宽眼距、球形鼻;1b:示右侧耳屏前及颊部副耳;1c:示双手第五指短指畸形;1d:牙列不齐,中上切牙巨齿畸形,中下切牙缺如;
辅助检查:纯音测听提示双耳中重度传导性听力损失,双侧高频骨导听力阈值均有不同程度提高(图 2);声导抗示双耳均引出As型曲线;颞骨CT示双耳听骨链发育均有不同程度畸形(图 3);生长激素激发试验示30 min GH峰值13.975 ng/mL。骨龄相当于5岁左右。
图 2.
6岁8月龄患儿纯音测听
2a:左耳为中度传导性听力损失,PTA 44 dB,气骨导差27 dB;2b:右耳为重度传导性听力损失,PTA 64 dB,气骨导差45 dB;
图 3.
颞骨轴位CT
3a:6月龄患儿右耳镫骨前后脚弧度增大(红色箭头所示);3b:8月龄患儿左耳砧镫关节处角度增大(黄色箭头所示);3c:6岁8月龄患儿右耳镫骨前脚弧度增大,后脚显影不全(绿色箭头所示);
为明确听力损失病因并予以相关遗传咨询解答,征得患儿家长知情同意后行家系遗传性听力损失基因突变检测。对样本DNA进行核酸提取并构建基因组文库后进行质检,对文库目标区域捕获及定量,最后行高通量测序。对测序数据进行预处理后与人类参考基因组HG19进行匹配比对,比对质检后检测SNP和INDEL,对SNP和INDEL结果进行注释并关联到多个数据库(HGMD、OMIM、ClinVar),根据ACMG指南对变异位点进行致病性分析。初步结果未发现与临床表型高度相关且致病性证据较为充分的听力损失基因变异,但提示可疑存在ANKRD11基因变异;故对此家系进一步进行ANKRD11基因变异验证,结果提示(图 4):患儿ANKRD11基因(NM_013275)9号外显子存在1个杂合突变c.2262dupA(p.E755Rfs*27),即患儿cDNA序列的第2262位的A碱基重复,导致后续发生移码突变并出现套峰现象,该变异的染色体定位为chr16:89350687。最后对患儿及其父母进行Sanger测序验证。扩增ANKRD11基因9号外显子的引物序列分别为:F:TCGTCAAAAGCAGAATCTTCC,R:ACAAACAAAGACATCAGCAGGT。结果提示患儿该基因突变为新发杂合突变(不除外其父母嵌合体可能),其父母双方均未检出该突变,且HGMD、Clin Var、OMIM、Orphanet数据库中尚未收录此突变,Mutation taster软件预测该突变基因产物可致病,根据ACMG指南[1],该变异符合PVS1+PS2+PM2+PP4标准,属于致病突变,故结合患儿症状、体征及基因检测结果确诊为KBG综合征。
图 4.
患儿及父母ANKRD11基因外显子测序图提示患儿ANKRD11基因(NM_013275)9号外显子存在1处新发杂合突变c.2262dupA(p.E755Rfs*27)
4a:患儿杂合变异;4b:患儿父亲无变异;4c:患儿母亲无变异。
2. 文献回顾
以“KBG综合征”、“ANKRD11”和“16q24.3缺失”为关键词在维普、万方和中国知网数据库检索从建库至2021年4月发表的中文文献4篇,共计报道6例,其中3例为散发[2-4],其余3例来自同一个家系[5]。以((KBG syndrome)OR(ANKRD11))OR(16q24.3 microdeletion)为检索式在Pubmed数据库、Web of Science数据库中检索从建库至2021年4月收录的英文文献共155篇,共计报道KBG综合征243例,年龄分布于1~66岁,尚不排除有部分病例因症状轻微而存在临床诊断不足的可能[6]。再以((KBG syndrome)AND(hearing loss))OR(audiology)为检索式于结果中筛选到包含“听力损失”临床表型的英文文献共16篇,共计报道65例。
KBG综合征(OMIM 148050;Orpha 2332)是一种罕见的可累及全身多系统的常染色体显性遗传病,1975年由Herrmann等首次发现并以最先确诊的3个家系姓氏首字母命名。KBG综合征的发病被认为主要是由ANKRD11基因突变或包含ANKRD11基因的16q24.3微缺失导致的,ANKRD11内的单核苷酸突变和小内含子约占致病突变的83%,较大拷贝数突变(主要是缺失)约占17%[7]。ANKRD11基因位于16号染色体长臂上,包含4个结构域:一个锚蛋白重复结构域,一个转录启动结构域和两个转录阻遏结构域,该基因主要负责编码ANKRD11蛋白,该蛋白是含有锚蛋白重复结构域的辅因子家族成员,可将组蛋白去乙酰化酶招募到p160共启动因子和核受体复合物上,以抑制配体依赖的反式启动[8];在中枢神经系统中,起共调节因子作用的ANKRD11基因广泛表达于神经元和胶质细胞的细胞核中,影响神经母细胞的增殖及骨骼发育相关基因的表达,并参与神经元可塑性的调节过程且在细胞定位中发挥一定的作用[9],这可能与KBG综合征患者普遍存在发育迟缓及身材矮小的表型具有一定的相关性。KBG综合征的典型表型主要包括颅面发育畸形、骨骼系统发育异常、齿龈发育异常及神经系统发育异常,较少见的表型包括行为学异常、心血管系统异常、生殖系统发育异常及消化系统发育异常等。此外,正如本文报道,部分颅面畸形轻微或未出现诸如癫痫发作、房/室间隔缺损等其他严重临床表型的患者可以听力损失为首要表现[10]。
Skjei等[11]综合分析已报道的52例KBG综合征患者的临床表型并初步定义了KBG综合征的诊断标准,该版本主要标准包括永久性上颌中切牙巨齿畸形、特征性颅面发育畸形、骨龄显著延迟、一级亲属患KBG综合征等,并认为满足其中4个及以上即可确诊。Ockeloen等[12]综合分析72例KBG综合征患者的临床表型后,发现仅15%可满足“骨龄显著延迟”这一标准,因此剔除该标准,认为满足3个及以上即可确诊;Low等报道并分析32例KBG综合征患者临床表型后发现依赖特征性颅面畸形很难将KBG综合征与其他遗传病鉴别,如Cornelia de Lange综合征、锁骨颅骨发育不全综合征及Robinow综合征等。因此Low等[13]在前期标准的基础上拟定了新的诊断标准,即主要标准:上颌中切牙巨齿畸形;身材矮小;复发性中耳炎或听力减退;一级亲属患KBG综合征;次要标准:短指畸形或其他相关的手部异常;癫痫发作;隐睾;喂养困难;腭咽发育异常;自闭症;前囟门闭合延迟。该标准认为体型发育延迟、智力低下、言语能力发育迟缓等行为异常的患者合并两个主要诊断标准或合并一个主要诊断标准及两个次要诊断标准即可确诊为KBG综合征,该标准可使其报道的病例确诊率达97%,而且值得注意的是该版本也是首次关注到听力损失的重要性,并将其纳入诊断标准。目前针对KBG综合征的诊断标准尚未有统一共识[7],这也进一步说明KBG综合征的临床表型存在着很大的异质性,仅依靠临床表型诊断KBG综合征存在较大误诊及漏诊的风险,已明确的是KBG综合征是由ANKRD11基因突变或16q24.3微缺失导致的,因此对于疑诊者进行基因检测是十分必要的。目前对于KBG综合征的治疗尚无特效根治性治疗,基本采取对症治疗策略。
3. 讨论
目前已报道的200余例KBG综合征患者中合并听力损失者约30%,严重程度从轻度至重度不等,且听力损失的性质可为传导性、感音神经性或混合性[10]。KBG综合征患者出现听力损失的病因及病理机制尚不明确,先前研究表明KBG综合征患者在耳鼻咽喉专科可表现为软腭腭裂、硬腭发育不全、腭咽闭合不全、双歧悬雍垂、腺样体肥大、鼓膜穿孔及复发性中耳炎等[13]。传导性听力损失一方面可能与鼓膜穿孔及复发性中耳炎相关,而各种结构或功能异常导致的腭咽功能不全及腺样体肥大等可加重中耳炎的发作从而使听力进行性下降,甚至出现感音神经性听力损失;另一方面,ANKRD11基因参与维持骨稳定性,我们认为KBG综合征患者出现传导性听力损失的另一原因与听骨链发育异常相关,其可表现为听骨链局部固定或硬化,从而引起程度不等的传导性听力损失。此外,如前述,ANKRD11在大脑中广泛表达,参与了作为活动依赖性可塑性基础的细胞机制的调节并在神经细胞迁移定位中发挥作用,我们认为部分患者出现感音神经性听力损失或因ANKRD11突变致听觉神经传导通路甚至听觉皮层发育不全所致。有研究表明,当严重听骨链畸形导致正常听骨链惯性消失时会引起患者骨导听力阈值的升高,且以高频为主,此时患者的听力损失可表现为混合性[14]。此外,当病变同时累及中耳传音结构和内耳感音系统时,听力损失亦可表现为混合性。
本例患儿于1岁即诊断为双耳中重度传导性听力损失,未明确病因,予以佩戴助听器以改善听力,听力损失未影响患儿言语能力发育。此次就诊专科查体及辅助检查提示患儿听力损失类型为非分泌性中耳炎性的鼓膜完整的传导性听力损失,以右耳为著,此类传导性听力损失常见病因主要包括分泌性中耳炎、先天性胆脂瘤、听骨链畸形及耳硬化症等[15],其中儿童患者以分泌性中耳炎最常见[15-16]。本例患儿病程中无耳闷胀感及耳溢液,听力损失无进行性加重,颞骨CT可见明确听骨链畸形,考虑此即出现传导性听力损失的病因。但在临床上不难发现颞骨CT在诊断听骨链畸形方面尚具有一定局限性,对于高度怀疑听骨链异常所致的鼓膜完整的传导性听力损失且依靠颞骨CT不能明确者可行鼓室探查术明确病因。鉴于KBG综合征合并听力损失表型的发病率高达约30%,对确诊患者进行耳科相关检查是必不可少的。听力损失表现不明确者,专科查体或可发现鼓膜穿孔、耳溢液等异常,小儿行为测听或成人纯音测听可主观评估听力损失程度及性质;有明确听力损失表现者,音叉试验与纯音测听相结合可明确听力损失性质;对于传导性听力损失者可行颞骨HRCT全面评估中耳传音结构,鼓膜穿孔者可行耳内镜直观观察中耳病变情况,必要时可行咽鼓管功能检测;对于感音神经性听力损失者可进一步行OAE、ABR及CAEP等检查明确病变部位,必要时可完善内听道MRI。对于有相应综合征表现但尚未确诊者,在排除后天因素所致听力损失后,可行遗传性检测明确病因。然而不典型症状对于KBG综合征罕见病的遗传咨询仍是挑战,特别是出现综合征型或非综合征型听力损失时,基因诊断就显得尤为重要。近年来,第3代测序技术的普及提升了遗传性听力损失的诊断能力,并加速了听力损失基因诊断的临床应用,提高了综合征型与非综合征型听力损失的精准诊断水平,为遗传性听力损失家系的遗传咨询和产前诊断提供了科学指导[17]。
对于该患儿的治疗,我们建议继续佩戴助听器,规律随诊,避免使用耳毒性药物,待中耳结构发育达成人水平后行鼓室探查术及鼓室成形术以彻底改善听力。回顾性分析已报道的出现听力损失病例的相关信息[13],发现约55%以上的患者表现为传导性听力损失,13.8%以上的患者表现为感音神经性听力损失,20%以上的患者表现为混合性听力损失,部分患者未进行过听力学相关检查,因此我们建议对于新确诊的KBG综合征患者均应进行必要的听力学检查以明确听力损失的性质及程度,并针对病情进行相应的随诊和监测,必要时可予佩戴助听器或外科手术干预。目前对于单纯性先天性听骨链畸形导致的传导性听力损失在外科治疗上以镫骨足板活动度与否为中心决定术式。镫骨底板活动者应行听骨链重建术,而镫上结构正常与否决定植入部分听骨赝复物还是全听骨赝复物;镫骨底板固定者应行人工镫骨植入术,在植入时可采取底板钻孔或底板切除,甚至鼓岬或前庭开窗等术式。
目前KBG综合征的确诊率仍较低,这可能与患者临床表型不典型及临床对于该病的认识不足相关,故应提高对此病的认识,改善临床管理,对具有相应临床表现的患者及时进行基因检测及遗传咨询以明确诊断,尽早对症治疗以提高生活质量。
Footnotes
利益冲突 所有作者均声明不存在利益冲突
References
- 1.Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genetics in medicine: official journal of the American College of Medical Genetics. 2015;17(5):405–424. doi: 10.1038/gim.2015.30. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Shang YY. KBG Syndrome: A Case Report and Literature Review. Avances Clin Med. 2020;10(11):2743–2747. [Google Scholar]
- 3.曹 玉红, 张 立毅, 曹 开方, et al. KBG综合征1例报告及文献回顾. 临床儿科杂志. 2020;38(5):335–338. doi: 10.3969/j.issn.1000-3606.2020.05.005. [DOI] [Google Scholar]
- 4.李 秋月, 杨 琳, 吴 静, et al. ANKRD11基因突变所致KBG综合征1例并文献复习. 中国循证儿科杂志. 2018;13(6):452–458. doi: 10.3969/j.issn.1673-5501.2018.06.011. [DOI] [Google Scholar]
- 5.王 大燕, 赖 盼建, 李 小兵. 一个KBG综合征家系的ANKRD11基因变异分析. 中华医学遗传学杂志. 2020;37(9):1029–1031. doi: 10.3760/cma.j.cn511374-20190907-00462. [DOI] [PubMed] [Google Scholar]
- 6.Sirmaci A, Spiliopoulos M, Brancati F, et al. Mutations in ANKRD11 cause KBG syndrome, characterized by intellectual disability, skeletal malformations, and macrodontia. Am J Hum Genet. 2011;89(2):289–294. doi: 10.1016/j.ajhg.2011.06.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Morel Swols D, Foster J 2nd, Tekin M. KBG syndrome[J]. Orphanet J Rare Dis, 2017, 19;2(1): 183.
- 8.Gallagher D, Voronova A, Zander MA, et al. Ankrd11 is a chromatin regulator involved in autism that is essential for neural development. Dev Cell. 2015;32(1):31–42. doi: 10.1016/j.devcel.2014.11.031. [DOI] [PubMed] [Google Scholar]
- 9.Lo-Castro A, Brancati F, Digilio MC, et al. Neurobehavioral phenotype observed in KBG syndrome caused by ANKRD11 mutations. Am J Med Genet B Neuropsychiatr Genet. 2013;162B(1):17–23. doi: 10.1002/ajmg.b.32113. [DOI] [PubMed] [Google Scholar]
- 10.Bianchi PM, Bianchi A, Digilio MC, et al. Audiological findings in a de novo mutation of ANKRD11 gene in KBG syndrome: Report of a case and review of the literature. Int J Pediatr Otorhinolaryngol. 2017;103:109–112. doi: 10.1016/j.ijporl.2017.10.017. [DOI] [PubMed] [Google Scholar]
- 11.Skjei KL, Martin MM, Slavotinek AM. KBG syndrome: report of twins, neurological characteristics, and delineation of diagnostic criteria. Am J Med Genet A. 2007;143A(3):292–300. doi: 10.1002/ajmg.a.31597. [DOI] [PubMed] [Google Scholar]
- 12.Ockeloen CW, Willemsen MH, de Munnik S, et al. Further delineation of the KBG syndrome phenotype caused by ANKRD11 aberrations. Eur J Hum Genet. 2015;23(9):1176–1185. doi: 10.1038/ejhg.2014.253. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Low K, Ashraf T, Canham N, et al. Clinical and genetic aspects of KBG syndrome. Am J Med Genet A. 2016;170(11):2835–2846. doi: 10.1002/ajmg.a.37842. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Zhang L, Gao N, Yin Y, et al. Bone conduction hearing in congenital aural atresia. Eur Arch Otorhinolaryngol. 2016;273(7):1697–1703. doi: 10.1007/s00405-015-3727-1. [DOI] [PubMed] [Google Scholar]
- 15.张 晓, 陈 敏, 刘 薇, et al. 83例儿童鼓膜完整的传导性聋病例分析及诊疗策略. 中华耳科学杂志. 2020;18(6):1002–1006. doi: 10.3969/j.issn.1672-2922.2020.06.001. [DOI] [Google Scholar]
- 16.Qureishi A, Lee Y, Belfield K, et al. Update on otitis media-prevention and treatment. Infect Drug Resist. 2014;7:15–24. doi: 10.2147/IDR.S39637. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.袁 慧军, 卢 宇. 综合征型耳聋的分子病因学诊断. 中国听力语言康复科学杂志. 2021;19(3):161–163. [Google Scholar]