Abstract
Gestationsdiabetes (GDM) wird als Glukosetoleranzstörung definiert, die erstmals in der Schwangerschaft festgestellt wird. GDM ist mit einer erhöhten feto-maternalen Morbidität sowie Langzeitkomplikationen bei Mutter und Kind assoziiert. Frauen, die die Kriterien eines manifesten Diabetes mellitus bereits in der Frühschwangerschaft erfüllen (Nüchternplasmaglukose ≥ 126 mg/dl, Spontanglukosemessung ≥ 200 mg/dl oder HbA1c ≥ 6,5 % vor der 20. Schwangerschaftswoche) sollen als Schwangere mit manifestem Diabetes klassifiziert und ebenso behandelt werden. Ein Screening auf unerkannten Typ 2 Diabetes bei der ersten pränatalen Kontrolle wird besonders bei Frauen mit hohem Risiko (Anamnese eines GDM/Prädiabetes, Fehlbildungen, Totgeburt, wiederholte Aborte oder Geburtsgewicht über 4500 g in früheren Schwangerschaften, Adipositas, metabolisches Syndrom, Alter > 35 Jahre, bei Gefäßerkrankungen, Auftreten von Diabetessymptomen wie Glukosurie, ethnische Zugehörigkeit zu Gruppen mit hohem Risiko [arabisch, S und SO-asiatisch, lateinamerikanisch]) empfohlen. GDM wird durch einen oralen Glukosetoleranztest (oGTT, 120 min; 75 g Glukose) oder durch Nüchternplasmaglukose ≥ 92 mg/dl diagnostiziert. Bei hohem Risiko kann ein oGTT bereits im ersten Trimenon sinnvoll sein, zwischen der 24.–28. Schwangerschaftswoche muss dieser Test aber in jedem Fall bei allen Schwangeren mit bis dahin unauffälligen Glukosewerten im Rahmen der Mutter-Kind-Pass-Untersuchung durchgeführt werden. Nach WHO Empfehlungen basierend auf der „Hyperglycemia and Adverse Pregnancy Outcome (HAPO) study“ liegt ein GDM vor, wenn die Plasmaglukose nüchtern 92 mg/dl, nach 60 min 180 mg/dl oder nach 120 min 153 mg/dl überschreitet (Internationale Konsensuskriterien). Ein einziger erhöhter Wert ist für die Diagnose ausreichend und bedarf bereits einer strikten Stoffwechselkontrolle. Nach bariatrischer Operation wird aufgrund der Gefahr einer postprandialen Hypoglykämie die Durchführung eines oGTT nicht empfohlen. Alle Frauen mit GDM müssen eine Ernährungsberatung erhalten und ihre Blutzuckerwerte (4 Messzeitpunkte) regelmäßig kontrollieren. Ebenso sollte, falls nicht kontraindiziert, die körperliche Aktivität erhöht werden. Falls die Blutzuckerspiegel nicht im Therapiezielbereich liegen (nüchtern < 95 mg/dl und 1 h postprandial < 140 mg/dl, Evidenzklasse B) soll als erste Wahl eine Insulintherapie initiiert werden (Evidenzklasse A). Neben der mütterlichen Stoffwechselüberwachung sind geburtshilfliche Kontrollen und ein ultraschallgestütztes, fetales Monitoring notwendig, um die mütterliche und fetale/neonatale Morbidität und die perinatale Mortalität möglichst gering zu halten (Evidenzklasse A). Im Rahmen der neonatalen Untersuchungen müssen bei Neugeborenen von Müttern mit GDM Blutzuckerkontrollen erfolgen und bei Erfordernis geeignete Maßnahmen eingeleitet werden. Nach der Entbindung (4–12 Wochen post partum) wird neuerlich die Durchführung eines oGTT (75 g; WHO Kriterien) bei allen Frauen mit GDM empfohlen, um eine über die Schwangerschaft hinaus bestehende Glukosetoleranzstörung auszuschließen. Bei Normalbefund sollen alle 2–3 Jahre regelmäßig weitere Testungen (Nüchternblutzucker, Spontanglukose, HbA1c oder oGTT) erfolgen (Evidenzklasse B). Alle Frauen sollen über ihr deutlich erhöhtes Risiko für Typ 2 Diabetes, das höhere kardiovaskuläre Risiko, sowie über entsprechende Präventionsmaßnahmen, informiert werden. Dazu gehören Lebensstilmaßnahmen, wie Gewichtsreduktion bei Übergewicht, gesunde Ernährung und ausreichend körperliche Aktivität (Evidenzklasse A). Auch die Kinder sollen hinsichtlich einer unauffälligen Entwicklung regelmäßig nachuntersucht werden, da in rezenten Untersuchungen höheres Risiko für Übergewicht und Adipositas sowie erhöhte Glukoseparameter festgestellt wurden. Wenn möglich sollte die gesamte Familie über Lebensstilmaßnahmen zur Aufrechterhaltung/Verbesserung der Gesundheit informiert werden.
Schlüsselwörter: Gestationsdiabetes, Diabetische Fetopathie, Prädiabetes, Typ 2 Diabetes mellitus, Übergewicht/Adipositas, Kardiovaskuläres Risiko, Schwangerschaft, Schwangerschaftskomplikationen, Geburtshilfliche Versorgung, Neonatale Versorgung
Abstract
Gestational diabetes (GDM) is defined as any degree of glucose intolerance with onset during pregnancy and is associated with increased feto-maternal morbidity as well as long-term complications in mothers and the offspring. Women detected to have diabetes early in pregnancy receive the diagnosis of overt, non-gestational, diabetes (glucose: fasting ≥ 126 mg/dl, spontaneous ≥ 200 mg/dl or HbA1c ≥ 6.5% before 20 weeks of gestation). GDM is diagnosed by an oral glucose tolerance test (oGTT) or increased fasting glucose (≥ 92 mg/dl). Screening for undiagnosed type 2 diabetes at the first prenatal visit is recommended in women at increased risk (history of GDM/pre-diabetes; malformation, stillbirth, successive abortions or birth weight > 4500 g previously; obesity, metabolic syndrome, age > 35 years, vascular disease; clinical symptoms of diabetes (e.g. glucosuria) or ethnic origin with increased risk for GDM/T2DM (Arab, South- and Southeast Asian, Latin American)) using standard diagnostic criteria. Performance of the oGTT (120 min; 75 g glucose) may already be indicated in the first trimester in high-risk women but is mandatory between gestational week 24–28 in all pregnant women with previous non-pathological glucose metabolism. Following WHO recommendations, which are based on the Hyperglycemia and Adverse Pregnancy Outcome (HAPO) study, GDM is defined, if fasting venous plasma glucose is ≥ 92 mg/dl or 1 h ≥ 180 mg/dl or 2 h ≥ 153 mg/dl after glucose loading (international consensus criteria). In case of one pathological value a strict metabolic control is mandatory. After bariatric surgery we do not recommend to perform an oGTT due to risk of postprandial hypoglycemia. All women with GDM should receive nutritional counseling, be instructed in blood glucose self-monitoring and motivated to increase physical activity to moderate intensity levels—if not contraindicated (Evidence level A). If blood glucose levels cannot be maintained in the therapeutic range (fasting < 95 mg/dl and 1 h after meals < 140 mg/dl, Evidence level B) insulin therapy should be initiated as first choice (Evidence level A). Maternal and fetal monitoring is required in order to minimize maternal and fetal/neonatal morbidity and perinatal mortality. Regular obstetric examinations including ultrasound examinations are recommended (Evidence level A). Neonatal care of GDM offspring at high risk for hypoglycaemia includes blood glucose measurements after birth and if necessary appropriate intervention. Monitoring the development of the children and recommendation of healthy lifestyle are important issues to be tackled for the whole family. After delivery all women with GDM have to be reevaluated as to their glucose tolerance by a 75 g oGTT (WHO criteria) 4–12 weeks postpartum. Assessment of glucose parameters (fasting glucose, random glucose, HbA1c or optimally oGTT) are recommended every 2–3 years in case of normal glucose tolerance. All women have to be instructed about their increased risk of type 2 diabetes and cardiovascular disease at follow-up. Possible preventive meassures, in particular lifestyle changes as weight management and maintenance/increase of physical activity should be discussed (evidence level A).
Keywords: Gestational diabetes mellitus, Diabetic fetopathy, Prediabetes, Type 2 diabetes mellitus, Overweight/obesity, Cardiovascular risk Pregnancy, Pregnancy complications, Neonatal care
Grundsatz Statement
Bei Frauen mit in der Schwangerschaft erstmals aufgetretener oder diagnostizierter Glukosetoleranzstörung besteht gegenüber Schwangeren mit normaler Glukosetoleranz ein höheres Risiko für perinatale Morbidität und Mortalität und operative Entbindungen und ein höheres Risiko nach Entbindung einen Diabetes mellitus Typ 2 (T2DM) und kardiovaskuläre Komplikationen zu entwickeln [1, 2]. Frauen mit Gestationsdiabetes (GDM) und strikter metabolischer Kontrolle haben bessere Schwangerschaftsergebnisse als Frauen mit GDM, die nicht behandelt werden [3, 4]. Antenatale Lifestyle-Interventionen (strukturierte Ernährungsempfehlungen und Bewegungsprogramme) führen zu besseren Schwangerschafts-Outcomes [5]. Patientinnen, bei denen sich während der Schwangerschaft ein Typ 1 Diabetes mellitus manifestiert, sowie solche mit einem bereits präkonzeptionell oder zu Schwangerschaftsbeginn bestehenden, aber erst in der Gravidität diagnostizierten anderen Diabetestyp, sollen wie Patientinnen mit präkonzeptionell bekanntem Diabetes mellitus behandelt und überwacht werden (siehe Leitlinie: Gravidität bei vorbestehendem Diabetes). Ein präkonzeptionell bestehender Diabetes mellitus kann angenommen werden, wenn bereits vor der 20. Schwangerschaftswoche die Kriterien für einen manifesten Diabetes mellitus erfüllt sind: Nüchternblutzucker ≥ 126 mg/dl oder Spontanmessung ≥ 200 mg/dl; bzw. 2 h-Wert im oralen Glukosetoleranztest (oGTT) ≥ 200 mg/dl oder HbA1c ≥ 6,5 %. Frauen mit GDM haben postpartal ein deutlich erhöhtes Risiko für die Entwicklung eines T2DM und sollen deshalb über Präventionsmaßnahmen informiert und lebenslang überwacht werden [6].
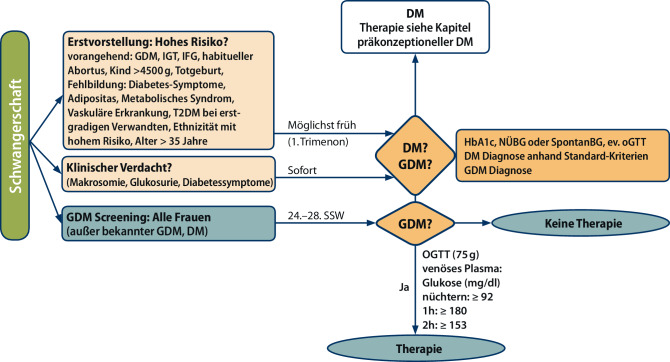
Risikoevaluierung und Diagnose (Abb. 1)
Bei Erstvorstellung beim Frauenarzt werden schwangere Frauen bezüglich ihres Risikos für GDM oder Diabetes mellitus eingestuft. Bei Vorliegen eines höheren Risikos (siehe unten) soll die Frau möglichst früh hinsichtlich einer Glukosestoffwechselstörung untersucht werden: Dies kann durch eine Nüchternglukosemessung, eine Spontanglukosemessung, eine HbA1c-Bestimmung und/oder Durchführung eines oGTT erfolgen.
Hohes Risiko für GDM bzw. Risiko für vorbestehende, unerkannte Stoffwechselstörung (Prädiabetes oder Diabetes) besteht bei:
GDM in einer früheren Schwangerschaft
Prädiabetes in der Anamnese (gestörte Glukosetoleranz und/oder Nüchternglukose > 100 mg/dl)
Kongenitale fetale Fehlbildung in einer früheren Schwangerschaft
Geburt eines Kindes > 4500 g
Intrauteriner Fruchttod (IUFT)
Habitueller Abortus (> 3 Fehlgeburten hintereinander)
Diabetes-Symptome
Adipositas (BMI ≥ 30 kg/m2)
Alter über 35 Jahre
Metabolisches Syndrom
Vaskuläre Erkrankung (Koronare Herzkrankheit (KHK), Insult (cAVK), periphere arterielle Verschlusskrankheit (pAVK))
Familienanamnese von T2DM bei erstgradigen Verwandten
Ethnizität (z. B. arabisch, S‑ und SO-asiatisch, lateinamerikanisch)
Bei Auftreten von diabetes-spezifischen Symptomen oder klinischer Auffälligkeiten (Polydipsie, Polyurie, Glukosurie; Makrosomie) ist ein Test – auch bei unauffälligem Vorbefund und unabhängig von der Schwangerschaftswoche – unmittelbar durchzuführen.
In einer multizentrischen österreichischen Studie waren ein GDM in einer früheren Schwangerschaft, das Auftreten einer Glukosurie, Übergewicht (präkonzeptioneller BMI > 27 kg/m2), ein Alter über 30 Jahre und der Verdacht auf Makrosomie im Ultraschall die besten unabhängigen Prädiktoren für einen GDM [7], wobei das Risiko bei vorangegangenem GDM fast 3‑fach, ansonsten ungefähr 2‑fach erhöht war. Eine multinationale europäische Studie zeigte, dass fast jede 4. adipöse Frau bereits vor der 20. Schwangerschaftswoche erhöhte Blutzuckerwerte im Sinne eines GDMs nach IADPSG/WHO 2013 Kriterien und Parameter des metabolischen Syndroms aufwies [8].
Um geburtshilfliche Komplikationen, wie fetale Malformationen, Makrosomie, IUFT, Schulterdystokie oder sekundäre Sectio zu vermeiden, ist eine Früherkennung vom GDM bereits in der Frühschwangerschaft wünschenswert. Obwohl Frauen, die einen GDM in der zweiten Hälfte der Schwangerschaft entwickeln, bereits in der Frühschwangerschaft deutlich erhöhte Nüchternblutzucker-, sowie HbA1c und C‑Peptid Werte zeigen, bleibt die Analyse von derartigen Surrogaten des Glukosestoffwechsels (Nüchternblutzucker, HbA1c, C‑Peptid, HOMA‑B, HOMA-IR) in der Frühschwangerschaft für die Diagnose eines GDMs nur beschränkt aussagekräftig [9]. Die Erstellung von Prädiktionsmodellen, welche gleichzeitig anamnestische Faktoren und biochemische Variablen untersuchen, könnte zur Früherkennung von GDM führen und die Risiken für unerwünschte geburtshilfliche Outcomes reduzieren [10].
Alle Schwangeren erhalten im Rahmen der 2. Mutter-Kind-Pass-Labor-Vorsorge Untersuchung zwischen der 24.–28. Schwangerschaftswoche einen 75 g oGTT [11–13]. Durch die Einführung des oGTTs im Mutter-Kind-Pass konnte in Österreich eine Reduktion der IUFT Fälle bei schwangeren Frauen mit einem erhöhten Risiko für GDM erreicht werden [14]. Bei Frauen mit bereits diagnostiziertem GDM oder Diabetes bzw. wenn der unmittelbar gemessene Nüchternglukosewert (venöse Plasmaglukose) 92 mg/dl oder höher ist, sollte auf den oGTT verzichtet werden. Ausgenommen von der Durchführung eines oGTT sind auch Frauen nach bariatrischer/metabolischer Chirurgie, da das Risiko einer postprandialen Hypoglykämie (Dumping Phänomen) nach der Ingestion der Glukoselösung besonders hoch ist [15]. Nach bariatrischer Operation werden daher regelmäßige Blutzuckerselbstkontrollen zur Diagnose eines GDM herangezogen. Ebenso ist die Verwendung eines kontinuierlichen Glukosemesssystem (CGMS, FGM) in diesem Fall denkbar [15].
Methodik: Diagnostischer 75 g oraler Glukosetoleranztest (oGTT)
Der Test soll bei allen Frauen mit bisher unauffälligen oder unbekannten Blutglukosewerten in der Schwangerschaft zwischen 24–28. Schwangerschaftswoche morgens nach mindestens achtstündiger Nahrungskarenz durchgeführt werden. Eine Änderung der bisherigen Ernährung, eine Reduktion der Kohlenhydrate oder Diäten vor dem Test sollten vermieden werden. Ebenso sollten vor dem Test keine außergewöhnlichen körperlichen Belastungen erbracht werden. Der Testbeginn sollte zwischen 6.00 h und 9.00 h erfolgen, da die Glukosetoleranz tageszeitlichen Änderungen unterliegt. Die Schwangere soll die Glukoselösung (75 g Glukose in 300 ml Wasser) innerhalb von 5 min trinken, während des Testes sitzen (liegende Position vermeiden, keine unnötige körperliche Aktivität) und nicht rauchen. Zur GDM Diagnostik sollen Blutglukosewerte ausschließlich mit einer qualitätsgesicherten Methode in venösem Plasma direkt gemessen werden oder in venösem Vollblut gemessen und mit einem Faktor von 1,11 (+ 11 %) in venöse Plasmawerte umgerechnet werden.
Um möglichst exakte oGTT Resultate zu erhalten ist es erforderlich gewisse Standards zu berücksichtigen [12]. Diese sind wie folgt (abgeleitet nach [12]):
Messungen aus venösem Plasma und nicht aus Kapillarblut
Messung in einem zertifizierten Labor nach zertifizierten Methoden, um präanalytische Fehler zu minimieren.
Am Testtag ist vor dem oGTT die eine Einnahme kontrainsulinärer Medikamente (z. B. Thyroxin, Progesteron, Glukokortikoide, Sympathikomimetika) zu vermeiden.
Nach Einleitung der fetalen Lungenreife mittels Glukokortikoiden sollte man bis zur Testdurchführung mindestens fünf Tage zuwarten.
Bei Fieber, akuten Erkrankungen oder verordneter Bettruhe ist der Test bis zur vollständigen Genesung zu verschieben.
Bei operativen Eingriffen am Magen-Darm-Trakt (z. B. bariatrische Operation) ist die Aussagekraft eines oGTT limitiert. Zudem besteht die Gefahr eines Dumping-Syndroms. In diesem Fall sollte eine Blutzuckerselbstmessung über mehrere Tage erfolgen und Blutzuckerprofile zur Bewertung herangezogen werden.
Bei Hyperemesis gravidarum oder stärkerer Schwangerschaftsübelkeit ist der Test um einige Tage zu verschieben.
Die internationale Klassifikation (Tab. 1; [13, 16]) beruht auf Evidenz-basierten (= HAPO-Studie) Blutzuckergrenzwerten [17, 18]. Ab einem pathologischen Wert ist ein GDM diagnostiziert. In einer aktuellen randomisiert kontrollierten Studie, die die HAPO GDM Diagnosekriterien (0–1–2 h: 92–180–153 mg/dl) mit höheren Diagnosekriterien (0–2 h: 99–162 mg/dl) verglich und kindliche und mütterliche Schwangerschaftsoutcomes untersuchte, konnte kein signifikanter Unterschied im Primäroutcome large for gestational age Geburt beobachtet werden [19]. In Sekundäranalysen wurde eine erhöhte Inanspruchnahme medizinischer Leistungen, aufgrund häufigerer GDM Diagnosen bei niedrigeren Grenzwerten, aber auch ein signifikant niedrigeres Risiko für Präeklampsie, Gewichtszunahme und häufigeres Stillen in der Gruppe mit niedrigeren Diagnosekriterien festgestellt.
| Zeitpunkt | Venöses Plasma (mg/dl) |
|---|---|
| Nüchtern | ≥ 92 |
| 1 h | ≥ 180 |
| 2 h | ≥ 153 |
oGTT oraler Glukosetoleranztest, WHO World Health Organization, IADPSG International Association of the Diabetes and Pregnancy Study Groups
Anhand von Auswertungen der Schwangerschaftsergebnisse an fünf österreichischen Zentren konnte auch ein einfacher Algorithmus und Risiko-Score zur Vorhersage des GDM entwickelt werden, der auf der Messung der Nüchternplasmaglukose beruht und im Einzelfall herangezogen werden kann [21].
Prävention
Die Prävention von GDM wurde in zahlreichen Studien untersucht und dabei an verschiedenen Risikogruppen getestet. Bei Frauen mit Adipositas konnte in den bisherigen großen Studien mit Lebensstilintervention keine Verbesserung im fetalen Outcome (large for gestational age, LGA) oder eine Verbesserung der mütterlichen Stoffwechselsituation oder GDM Prävalenz erreicht werden [22, 23]. In der DALI Studie konnte im Vergleich drei verschiedener Interventionsgruppen (gesunde Ernährung, körperliche Aktivität, Kombination aus beidem) eine signifikante Gewichtsabnahme in der kombinierten Interventionsgruppe im Vergleich zur Kontrolle gezeigt werden, dies hatte aber keinen Einfluss auf die mütterlichen oder kindlichen Outcomes bei Geburt [22, 23]. Bei adipösen Frauen konnte mit Ernährungsmaßnahmen das GDM Risiko, sowie eine kindliche Makrosomie verringert werden. Dies konnte bei körperlicher Aktivität nicht beobachtet werden. Vitamin D Supplementation in der Schwangerschaft führte zwar zu einer signifikanten Reduktion der Nüchternglukose im 3. Trimenon, dies hatte aber klinisch keine Relevanz und konnte die GDM Prävalenz bzw. das Risiko für LGA-Geburten bei adipösen, schwangeren Frauen im Vergleich zu Placebo trotz suffizienter Vitamin D‑Werte nicht reduzieren [24]. Trotz der signifikanten Erhöhung von Vitamin D und einer hohen Suffizienzrate waren durch eine Vitamin D Supplementation in der Schwangerschaft im Vergleich zu Placebogruppe auch die Lipidparameter in den Behandlungsgruppen nicht signifikant unterschiedlich [25]. Eine Supplementation mit Probiotika und Myoinositol konnte das GDM Risiko verringern. Bei adipösen schwangeren Frauen konnte unter Gabe von Metformin keine Reduktion des GDM Risikos und keine Verbesserung des mütterlichen Stoffwechsels oder Geburtsoutcomes erreicht werden [22]. Die bisherigen Studien zeigen, dass der Beginn einer Lebensstilmodifikation vor dem ersten Trimester oder idealerweise bereits bei Kinderwunsch sinnvoll ist. [5, 22]. Eine rezente Metaanalyse zeigt, dass die Implementierung strukturierter antenataler Interventionsprogramme (Ernährung, Bewegung oder beides kombiniert) das Auftreten eines Gestationsdiabetes vermindern und die mütterlichen Schwangerschafts-Outcomes verbessern können, die neonatalen Ergebnisse aber nur durch Diät beeinflusst werden konnten [5].
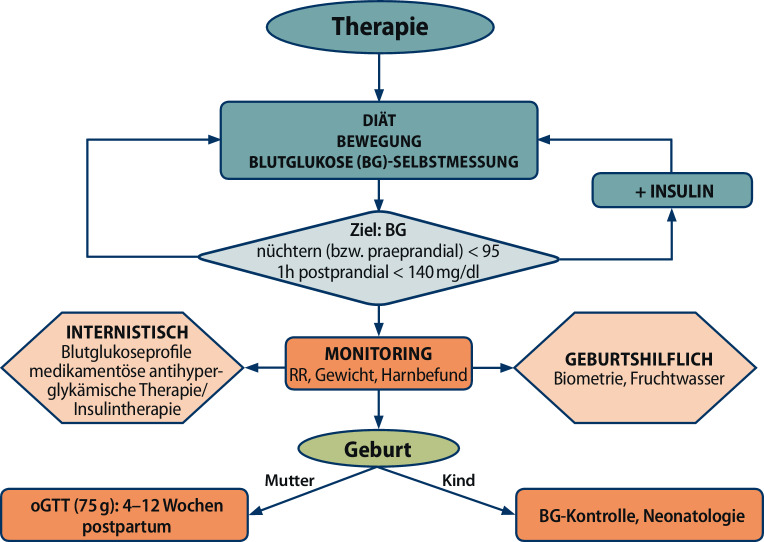
Therapie (Abb. 2)
Diabetologische/Internistische Betreuung
Erstellung eines individuellen Therapieplans bestehend aus einer Lebensstilmodifikation mit Ernährung, Bewegung und Blutglukoseselbstmessungen:
-
Ernährung: Je nach Körpergewicht und körperlicher Aktivität ausgerichteter Diätplan (bei Normalgewicht ca. 24–30 kcal/kg: 40–50 % Kohlenhydrate, 30–35 % Fett und 20 % Eiweiß). Auf schnell resorbierbare Kohlenhydrate sollte verzichtet werden. Eine ballaststoffreiche Ernährung (ca. 30 g/Tag) ist zu empfehlen. Die ausreichende Versorgung mit Mineralstoffen und Vitaminen ist zu berücksichtigen (Eisen, Folsäure, Vitamin D, Kalzium, Vitamin B, Magnesium, Jod). Hier gelten die nationalen Referenzwertempfehlungen für Nahrungszufuhr in der Schwangerschaft (D-A-CH Referenzwerte, www.oege.at) Die täglich empfohlene Proteinzufuhr in der Schwangerschaft entspricht der einer gesunden Schwangerschaft (60–80 g/Tag). Eine Aufteilung der Mahlzeiten auf 3 kleine bis mittlere Hauptmahlzeiten und 2–4 kleine Zwischenmahlzeiten inklusive Abendsnack sollte erfolgen [26]. Für eine DASH- oder Mediterrane Ernährung werden sowohl präventive als auch outcome-orientiert positive Daten bezüglich GDM berichtet [27]. Die Endocrine Society empfiehlt bei Adipositas eine Kalorienrestriktion um etwa ein Drittel, so keine deutliche Gewichtsreduktion (bis maximal 5 kg) und Katabolismus auftritt. Die minimale Aufnahme liegt zwischen 1500 und 2000 kcal/Tag [27]. Bei einer Low Carb-Ernährung mit nur 35–40 % Kalorien aus Kohlenhydraten wird eine ausgleichende Protein- und Fettzufuhr vorwiegend pflanzlichen Ursprungs empfohlen. In einer Sekundäranalyse einer GDM Präventionsstudie konnte in der Ernährungsinterventionsgruppe mit reduzierter Kohlenhydratzufuhr zwar eine niedrigere Gewichtszunahme in der Schwangerschaft aber auch ein Zusammenhang mit vermutlich Lipolyse induzierten, höheren Nüchternglukosewerten, freien Fettsäuren und Ketonkörpern beobachtet werden [28]. Auch im Nabelschnurblut konnten erhöhte freie Fettsäuren festgestellt werden, wobei Langzeitbeobachtungen leider fehlen. Eine Gewichtskontrolle sollte bei jedem Kontrollbesuch erfolgen bzw. selbstständig wöchentlich von der Patientin dokumentiert werden.
Die Gewichtszunahme in der Schwangerschaft sollte dabei den Empfehlungen des Institute of Medicine folgen (Tab. 2; [29]).
Schulung in Blutzucker-Selbstmessung. Dokumentation der Glukose-Profile: mindestens 4 Messungen täglich (nüchtern, 1 h postprandial). Bei Beginn einer Insulintherapie sollte die Patientin über die Symptome und Risiko von Hypoglykämien, sowie über das richtige Verhalten in dieser Situation geschult werden. Eine schlechte Adhärenz zu regelmäßigen selbstständigen Blutzuckermessungen steht mit einem erhöhten Präeklampsierisiko in Zusammenhang und war in einer Studie mit Zugehörigkeit zu niedriger sozialer Klasse, nichteuropäischer Herkunft und Diabetes in der Familienanamnese assoziiert [30]. Hingegen konnten bei guter Adhärenz mit guter Blutzuckereinstellung keine Unterschiede zwischen täglich 4 Messungen und Messungen jeden zweiten Tag in mütterlichen und kindlichen Outcomes festgestellt werden [31]. Eine Reduktion der Blutzuckermessungen (Messung alle 2 Tage) kann bei guter Blutzuckereinstellung und fortgeschrittener Schwangerschaft überlegt werden. Sollte eine kontinuierliche Glukosemessung erfolgen sind folgende Blutzuckerwerte anzustreben: Zielbereich 63–140 mg/dl, Zeit im Zielbereich (Time in Range) > 70 %, Zeit unter Zielbereich < 4 %, Zeit über Zielbereich < 25 % [11]
Bewegung: Bei einer unproblematischen Schwangerschaft ist regelmäßige moderate körperliche Aktivität ein weiterer Bestandteil des Therapiekonzepts. Die Aktivitätszeit sollte dabei mindestens 150 min pro Woche betragen und sollte in den Alltag integriert werden. Bei Ausübung von Sport sollten Sportarten gewählt werden, die mit einer Schwangerschaft vereinbar sind (kein Kontaktsport, Kampfsport, Sportarten mit hoher Sturz- oder Verletzungsgefahr) und dem jeweiligen Trainingszustand entsprechen. Zur GDM-Prävention mittels körperlicher Aktivität vor der Schwangerschaft oder in der Frühschwangerschaft und adäquater oben beschriebener Ernährung (DASH-, mediterrane Ernährung) liegt eine Metaanalyse aus 40 Studien vor [32].
-
Therapieziele und pharmakologische Therapie:
Bei unzureichender Einstellung durch Lebensstilmaßnahmen ist unmittelbar eine medikamentöse Therapie einzuleiten. Insulin sollte gegenüber oralen glukosesenkenden Medikamenten aufgrund der deutlich besseren Studienlage und keiner Plazentagängigkeit bevorzugt eingesetzt werden [11].
| BMI | BMI-Limits (kg/m2) (WHO) | Empfohlene Zunahme während des SS (kg) | Empfohlene Gewichtszunahme/Woche (kg/Woche) (2. + 3. Trimenon) |
|---|---|---|---|
| Untergewicht | < 18,5 | 13–18 | 0,51 |
| Normalgewicht | 18,5–24,9 | 11–16 | 0,42 |
| Übergewicht | 25,0–29,9 | 7–11 | 0,28 |
| Adipositas | ≥ 30,0 | 5–9 | 0,22 |
BMI Body Mass Index,WHO World Health Organization
Werden die Grenzwerte zu einem Messzeitpunkt zu 50 % überschritten (Tab. 3), ist eine individuell anzupassende Insulintherapie, zu beginnen. Liegen Nüchternglukosewerte über 110 mg/dl vor ist ein sofortiger Therapiebeginn mit Insulin erforderlich [12]. Der HbA1c Wert ist für die Diagnose eines GDM ungeeignet, kann aber zur Verlaufskontrolle der Metabolik herangezogen werden und soll jedenfalls im Referenzbereich für Gesunde liegen (HbA1c < 6,0 %). Die mütterlichen Blutzuckerprofile müssen auch während der Geburt im Zielbereich liegen (80–130 mg/dl), um neonatale Hypoglykämien und Anpassungsstörungen zu vermindern.
| Zeitpunkt | Kapilläres Vollblut (mg/dl) |
|---|---|
| Nüchtern (präprandial) | 65–95 |
| 1 h postprandial | < 140 |
| 2 h postprandial | < 120 |
Zur weiteren Individualisierung der Therapie dient die fetale Biometrie, die zur Entscheidung, ob eine medikamentöse Therapie begonnen, intensiviert oder gelockert werden muss, herangezogen werden soll [12]. Der fetale Abdomenumfang korreliert mit dem fetalen Insulinspiegel. Liegt eine fetale asymmetrische Wachstumssteigerung vor und liegt die abdominelle Zirkumferenz über der 75. Perzentile des Gestationsalters sind strengere Therapieziele anzustreben. Hierbei sollen Nüchternglukosewerte bei kapillärer Messung < 90 mg/dl und 1 h postprandial < 130 mg/dl erreicht werden. Bei fötaler Wachstumsretardierung sind dementsprechend auch individuell angepasste, höhere mütterliche Glukosegrenzwerte zulässig bzw. ist der Beginn einer Insulintherapie zurückhaltend zu wählen [12].
Regelmäßige Kontrollen sollen individuell den Bedürfnissen der schwangeren Frauen entsprechend im Abstand von wenigen Tagen bis 3 Wochen erfolgen. Dabei ist anhand der Blutglukoseprofile eine Therapieanpassung (Insulindosis) je nach Erfordernis durchzuführen. Der Blutdruck und die Gewichtszunahme sollten kontrolliert und ein Harnbefund erhoben werden.
Auch telemedizinische Visiten können die Betreuungsqualität erhöhen und können vor allem bei Zugangsbeschränkungen aufgrund COVID 19 und zur Reduktion der Patientenzahlen in der Ambulanz als Social Distancing Maßnahme als Alternative überlegt werden. Telemedizinische Visiten bei GDM konnten in einer Metanalyse das Risiko für GDM assoziierte Geburts- und Schwangerschaftskomplikationen im Vergleich zur Standardbetreuung reduzieren [11, 33].
Insulin
Aufgrund der sehr gut dokumentieren Datenlage für Insulin sollte bevorzugt Insulin in der Schwangerschaft verwendet werden. Primär wird NPH-Insulin als Basisinsulin verwendet. Auch andere Langzeitinsuline (Glargin, Glargin U300 oder Detemir) können ohne Bedenken in der Schwangerschaft angewendet werden, jedoch zeigt eine Metaanalyse keine signifikanten Differenzen in Bezug auf mehrere maternale oder neonatale Parameter im Vergleich zu NPH-Insulin [34]. Im Vergleich NPH zu Glargin gibt es keine Unterschiede im Geburtsgewicht, sowie vergleichbares Risiko für neonatale Komplikationen und Malformationen. Ebenso sind die mütterlichen Outcomes Präeklampsie und Schwangerschaftshypertonie vergleichbar selten. Für Insulin Detemir ist das Risiko für LGA oder neonatale Hypoglykämie ebenso vergleichbar mit NPH Insulin [34]. Randomisiert kontrollierte Studien zu Insulin Degludec zeigen wie bereits zuvor publizierte Fallbeschreibungen keinen Hinweis auf maternale oder kindliche Komplikationen in der Schwangerschaft beziehungsweise vergleichbare Resultate wie bei anderen Langzeitinsulinen [35–38].
Schnellwirksame Insuline werden zur Korrektur postprandialer Spitzen angewendet. Vielfach finden Insulin Lispro oder Aspart Anwendung und sollten gegenüber Humaninsulin auch aufgrund der einfacheren Handhabung vorgezogen werden. Zu Glulisin liegen nur Vigilanzdaten in der Gravidität vor [39], die keine besonderen Auffälligkeiten in der Schwangerschaft zeigen, jedoch sollte es derzeit aufgrund der unzureichenden Datenlage nicht verwendet werden. Die Analoga konnten aber bisher nur teilweise Überlegenheit gegenüber Normalinsulin zeigen [34]. Der Vergleich von Aspart zu Humaninsulin zeigt keine Unterschiede bei Makrosomie oder Häufigkeit von Kaiserschnittgeburten. Lispro verglichen zu Humaninsulin war mit niedrigerer Inzidenz für Ikterus und weniger maternalen Hypoglykämien verbunden, andererseits wurden in der Gruppe mit Lispro höhere Inzidenzen für LGA und höheres Geburtsgewicht berichtet. Ultraschnell-wirksames Insulin Aspart (Fiasp) und ultrarapid Lispro (URLi, Lyumjev) sind in der Schwangerschaft zugelassen. Ultraschnellwirksame Insuline werden rascher resorbiert, sind daher schneller wirksam als bisherige Analoginsuline und werden zur Optimierung postprandialer Hyperglykämien angewendet.
Orale Antidiabetika
Der Sulfonylharnstoff Glibenclamid und das Biguanid Metformin werden in manchen Therapieempfehlungen (z. B. NICE, ADA Guidelines) als mögliche Alternativen oder zusätzlich zu Insulin in der Schwangerschaft genannt. Die Empfehlung wurde aber zuletzt aufgrund ungewisser Langzeitfolgen bei Nachkommen abgeschwächt [11, 12]. Metformin und Glibenclamid sind plazentagängig. Randomisierte kontrollierte Untersuchungen über den Einsatz von Glibenclamid und Metformin [40, 41] bei GDM zeigten keine wesentlichen Unterschiede zwischen der oralen Behandlung und einer Insulintherapie. Bei Verwendung eines dieser Präparate in der Schwangerschaft sollten die Patientinnen in die Therapieentscheidung miteinbezogen und aufgeklärt werden. Die Verabreichung von anderen oralen und subkutanen glukosesenkenden Medikamenten wie Alpha-Glukosidasehemmer, Glitazone, Glinide, GLP-1-Analoga, DPP-4- und SGLT-2-Hemmer wird in der Schwangerschaft nicht empfohlen. Es fehlt neben den Studiendaten zur sicheren Anwendung auch die Zulassung in der Schwangerschaft.
Metformin
An die Gabe von Metformin sollte insbesondere bei übergewichtigen insulinresistenten Frauen als Monotherapie oder in Kombination mit Insulin gedacht werden [26]. Unter Gabe von Metformin ab der 20. Schwangerschaftswoche wurde eine niedrigere Rate schwerer neonataler Hypoglykämien, jedoch eine höhere Frühgeburtenrate beobachtet [40]. Eine rezente Metaanalyse zeigt bei Frauen mit Metformintherapie verglichen zu einer Insulintherapie eine geringere maternale Gewichtszunahme in der Schwangerschaft, weniger Hypoglykämien bei Mutter und Kind sowie ein geringeres Geburtsgewicht [42]. Die Mütter in der Metformingruppe konnten bei der Nachuntersuchung postpartal eher ihr Ausgangsgewicht erreichen als insulinbehandelte Frauen; bezüglich des postpartalen Glukosetoleranzstatus bestanden keine Unterschiede [40]. Ein Grund für einen zögerlichen Einsatz von Metformin ist das Fehlen ausreichender Langzeitdaten zur kindlichen Entwicklung. Die MIG-TOFU Studie zeigte, dass Kinder aus der Metformintherapie-Gruppe in der Schwangerschaft erhöhte subkutane Fettmasse verglichen zur Insulingruppe aufwiesen – die Gesamtkörperfettmasse blieb jedoch vergleichbar [43]. Eine weitere Studie bei Nachkommen von Müttern, die bei PCOS 1700–2000 mg Metformin in der Schwangerschaft erhielten, konnte 4 Jahre nach Entbindung ein deutlich erhöhtes Risiko für Übergewicht und Adipositas im Vergleich zur Placebogruppe feststellen [44]. Bei Frauen mit PCOS und Metformintherapie zu Beginn der Schwangerschaft zur Ovulationsstimulierung wird eine Beendigung der Metformintherapie vor Ende des ersten Trimesters empfohlen [11].
Sulfonylharnstoff
Bei Ablehnung einer notwendigen Insulintherapie stellt eine Therapie mit Glibenclamid eine mögliche, wenn auch hierzulande äußerst selten genutzte Alternative zur Behandlung eines GDM dar. Eine Insulintherapie sollte aber jedenfalls präferiert werden, wenn der GDM bereits vor der 25. Schwangerschaftswoche besteht oder Glukosewerte über 110 mg/dl vorherrschen [26]. Vorteile von Metformin gegenüber Glibenclamid konnten in einer Metaanalyse gezeigt werden – unter Glibenclamidtherapie konnten höhere maternale Gewichtszunahme, sowie vermehrte Raten von fetaler Makrosomie und neonataler Hypoglykämie festgestellt werden [45]. Auch im Vergleich zu Insulin häufte sich unter Glibenclamid das Risiko für Makrosomien, neonatalen Hypoglykämien und höherem Geburtsgewicht [45]. Neugeborene aus Glibenclamid behandelten GDM-Schwangerschaften weisen zudem höheres Risiko für Geburtskomplikationen (Hypoglykämie, Atemnotsyndrom des Neugeborenen (RDS), Intensivstationsaufenthalte, LGA) auf [46]. In einer randomisiert kontrollierten Studie konnte ein höheres Risiko an kumulativ perinatalen Komplikationen (Makrosomie, Hypoglykämie, Hyperbilirubinämie) in der Glibenclamidgruppe im Vergleich zu Insulin festgestellt werden [47]. Zwar konnten keine erhöhten Makrosomieraten im Vergleich Glibenclamid zu Insulin beobachtet werden, jedoch waren die Hypoglykämieraten bei geringen Glibenclamiddosen von durchschnittlich 5,4 mg signifikant höher als unter Insulin. Aufgrund der Datenlage ist die primäre Verwendung von Insulin zur Behandlung von GDM klar zu favorisieren [48]. Eine Anwendung von Sulfonylharnstoffen in der Schwangerschaft wird nicht empfohlen.
Geburtshilfliche Überwachung
Schwangere mit GDM sollten in einem Krankenhaus mit diabetologischer Erfahrung und angeschlossener Neonatologie entbunden werden. Empfohlen werden:
Ein- bis dreiwöchentliche klinische Kontrollen
bei Hyperglykämie in Frühschwangerschaft: Frühes Organscreening durch Ultraschall zum Ausschluss von Fehlbildungen (v. a. Herz, Niere)
Ultraschall (Biometrie, Fruchtwasser, evtl. Doppler), Wachstumskurven (v. a. Wachstumszunahme des Abdomens = asymmetrische Wachstumszunahme; Polyhydramnion) beachten
Achten auf erhöhtes Risiko zur Entwicklung einer Schwangerschaftshypertonie, Präeklampsie, Infektionen
Idealen Geburtstermin und Geburtsmodus festlegen
Schwangere Frauen, die einen GDM im Laufe der Schwangerschaft entwickeln, zeigen eine herabgesetzte Insulinsensitivität bereits vor der Schwangerschaft [49, 50]. Dies könnte zu oxidativem Stress in der ersten Phase der Schwangerschaft führen und eine Ursache für kongenitale Defekte darstellen [51]. Um große anatomische Fehlbildung zu erkennen, ist für jede schwangere Frau eine Routine Ultraschall-Untersuchung zwischen der 18. und 22. Schwangerschaftswoche empfohlen [52].
Da die mütterliche Hyperglykämie einen direkten Einfluss auf die fetale Hyperglykämie, Hyperinsulinämie und, letztendlich, auf das fetale Wachstum hat [53], sind sonographische fetale Wachstumskontrollen alle 2–4 Wochen empfohlen [54]. Regelmäßig durchgeführte Ultraschallkontrollen führen zu einem besseren neonatalen Outcome und sollen zu einem nicht ultraschall-basierten Management präferiert werden [55]. Hierbei soll das erwartete fetale Gewicht (EFW) durch die Vermessung vom Kopfumfang (KU), Abdomenumfang (AU) und Femurlänge (FL) geschätzt werden [56]. Unter den geburtshilflichen Komplikationen eines GDMs erkennt man die fetale Makrosomie, welche bereits ab der 24. Schwangerschaftswoche sonographisch diagnostiziert werden kann, wenn der Abdomenumfang (AU) eine akzelerierte Wachstumstendenz aufweist [57]. Eine übermäßige Fruchtwassermenge (Polyhydramnion) wird als Hinweis einer diabetischen Fetopathie gesehen, wobei bis dato keine Referenzwerte festgelegt wurden [58]. Die Messung des fetalen subkutanen Fettgewebes könnte als Zusatzparameter für die Evaluation der diabetischen Fetopathie herangezogen werden, dies ist aber heute aufgrund der mäßigen Reproduzierbarkeit der Messwerte noch nicht Teil der Routine Untersuchungen bei GDM Schwangerschaften [59].
Eine Überschreitung des Geburtstermins sollte bei Schwangeren mit insulinpflichtigem GDM vermieden werden.
Ob zwischen Schwangerschaftswoche 38 + 0 und 40 + 0 eine Geburtseinleitung stattfinden soll, soll individuell entschieden werden. Dabei sollen der Insulinbedarf, die Ultraschallbefunde (Kindsgewicht, Doppler, Fruchtwasser), maternale Erkrankungen wie Präeklampsie und die vorausgegangenen Schwangerschaftsverläufe in die Entscheidung miteinbezogen werden [60–62]. Eine Einleitung wegen schlechter Blutzucker-Einstellung vor Schwangerschaftswoche 38 + 0 sollte wegen frühgeburtlichkeitsbedingter Morbidität vermieden werden. Vielmehr sollte eine pränatale Optimierung der Blutzucker-Werte erfolgen.
Es ist bekannt, dass das Risiko für eine Schulterdystokie ab einem Geburtsgewicht von 4250 g signifikant ansteigt [63]. Ab einem geschätzten Geburtsgewicht von 4500 g sollte deshalb bei einer Schwangeren mit GDM eine Sectio empfohlen werden. Bei einem Schätzgewicht von 4000–4499 g sollte eine differenzierte Aufklärung der Schwangeren über individuell erhöhtes Schulterdystokie-Risiko erfolgen, insbesondere bei ausgeprägter Kopf-Abdomen Differenz.
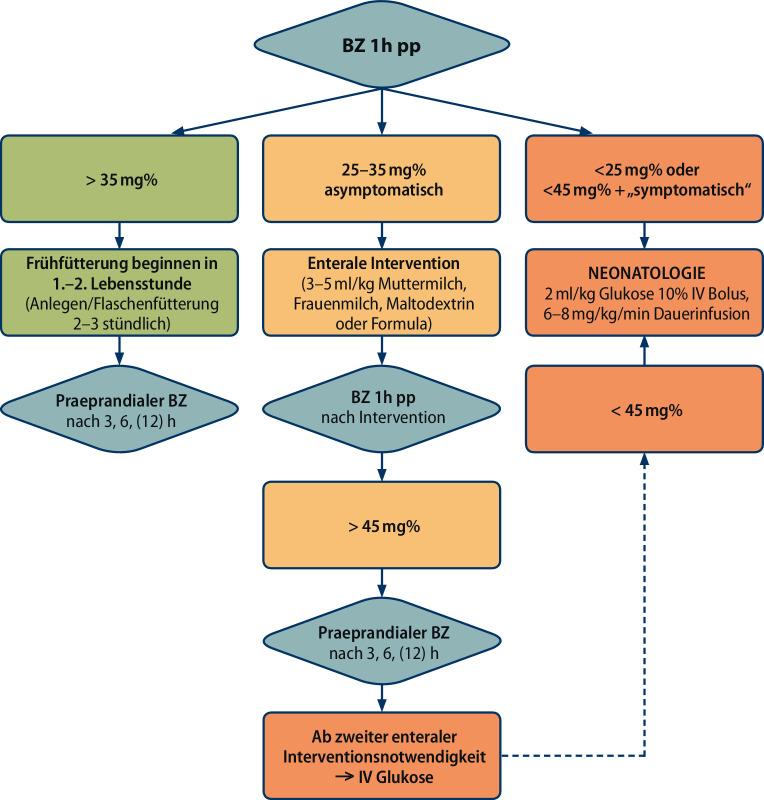
Überwachung und Management des Neugeborenen (Abb. 3)
Ein Routinemonitoring ist für eine Hochrisikopopulation an Neugeborenen sinnvoll, zu denen Kinder aus diabetischen Schwangerschaften bzw. solche, die aus einem anderen Grund einem erhöhten Risiko für die Entwicklung einer Hypoglykämie ausgesetzt sind, zählen (z. B. dystrophe Neugeborene; LGA-Babys).
Generell zu vermeiden sind prolongierte und rezidivierende Hypoglykämien, da diese mit akuten systemischen und langfristigen neurologischen Konsequenzen einhergehen können [64].
Blutglukosebestimmungen nach Geburt
Erste Messung: In Abhängigkeit vom Risikofaktor soll bei zu erwartender Hypoglykämie 30–60 min nach Geburt (bei schlecht eingestelltem Gestationsdiabetes), ansonsten innerhalb der ersten zwei Lebensstunden gemessen werden. Der Einfachheit halber kann aber für die gesamte Population der Zeitpunkt 1 h nach Geburt festgelegt werden. Eine Ausnahme ist hier nur die Indikation schlecht eingestellter Schwangerschaftsdiabetes der Mutter – hier sollte die erste Messung bereits nach 30 min erfolgen.
Weitere Messungen: Zumindest zweimal vor den nächsten beiden Mahlzeiten (ca. nach 3 und 6 h, evtl. auch nach 12 h z. B. bei mütterlichem Diabetes, grenzwertigen Messungen). Ende der Messungen: Es sollen zumindest zwei normale präprandiale Glukosewerte hintereinander dokumentiert sein, um die Messungen beenden zu können.
Messung nach Intervention: Bei enteraler oder intravenöser Intervention aufgrund einer Hypoglykämie erfolgt eine Kontrolle 1 h nach Intervention.
Die Bestimmung der Blutglukose muss unmittelbar nach der Blutabnahme erfolgen. Bei Verwendung von Schnelltests (Glukometer) weisen diese im hypoglykämischen Bereich unter 45 mg/dl Glukose in Abhängigkeit vom Hersteller Ungenauigkeiten auf. Ein mit dieser Meßmethode ermittelter hypoglykämischer Wert soll durch eine laborchemische Bestimmung kontrolliert werden. Dies sollte aber zu keiner Verzögerung der Therapie führen.
Interventionsgrenzen und therapeutische Zielwerte
Aufgrund interindividueller Schwankungen gibt es keine absoluten Grenzwerte für die Behandlung der Hypoglykämie des Neugeborenen. Vorgeschlagen werden pragmatische „Interventionsgrenzen“ bei denen eine Intervention in Erwägung gezogen werden sollte (siehe Intervention: < 25 mg % intravenös, 25–35 mg % enteral).
Die „therapeutischen Zielwerte“ beinhalten einen Sicherheitsabstand.
Ernährung des Säuglings nach Geburt
Neugeborene sollen bereits innerhalb der ersten Lebensstunde angelegt werden, dies gilt besonders für Kinder aus diabetischer Schwangerschaft. Nahrung aus der Flasche (Anfangsmilch) soll nur angeboten werden, wenn Stillen nicht möglich/erwünscht ist bzw. als Intervention bei zu niedrigem Blutzucker (siehe „Intervention“) [65].
Intervention
Enteral: Nur bei asymptomatischer Hypoglykämie 25–35 mg % → Verabreichung von 10–20 ml (3–5 ml/kg) abgepumpter Muttermilch, Frauenmilch, Maltodextrinlösung 15 % oder Formulanahrung. Alternativ ist die Verwendung von buccal zu verabreichendem 40 %igen Dextrose-Gel möglich. Intravenös: Bei deutlicher Hypoglykämie < 25 mg %, symptomatischen Kindern < 45 mg % oder persistierender Hypoglykämie (falls die Kontrolle 1 h nach Intervention < 45 mg % ist, oder falls trotz zweimaliger enteraler Intervention weiter korrekturbedürftige präprandiale Blutzuckerwerte gemessen werden) → 2 ml/kg Glukose 10 % als iv Bolus, gefolgt von 6–8 mg/kg/min Glukose als kontinuierliche Infusion. Es wird eine schrittweise Reduktion der intravenösen Glukosezufuhr unter Beginn der enteralen Ernährung und präprandialen Blutzuckerkontrolle empfohlen.
Kinder von Frauen mit GDM haben ein höheres Risiko im späteren Leben übergewichtig zu werden und ein metabolisches Syndrom bis hin zu einem Diabetes zu entwickeln [66]. Deshalb sollte bei allen – und besonders bei makrosomen – Kindern auf eine normale Gewichtsentwicklung geachtet werden (s. „Nachbetreuung der Kinder“).
Nachbetreuung der Mutter
Falls nach der Geburt normale Blutzuckerwerte erhoben werden (nüchtern < 100 mg/dl und unabhängig von Mahlzeiteneinnahme < 200 mg/dl) ist keine weitere definierte Ernährungstherapie oder Blutzuckerselbstmessung notwendig. Allerdings muss 4 bis 12 Wochen nach der Geburt eine Reklassifizierung der mütterlichen Glukosetoleranz mittels Standard-oGTT erfolgen. Bei pathologischem Befund müssen Therapieempfehlungen erfolgen (s. Leitlinien Diabetes mellitus – Definition, Klassifikation, Diagnose, Screening und Prävention, Diabetes-Therapie). Im Fall eines postpartal bestehenden Prädiabetes (gestörte Glukosetoleranz (2 h Wert 140–199 mg/dl) im oGTT oder erhöhter Nüchternglukose [100–125 mg/dl]) wird eine Lebensstiländerung mit Ernährungs- und Bewegungsberatung empfohlen. Eine Subanalyse des Diabetes Prevention Programs zeigte, dass bei vergleichbarer Ausgangslage bezüglich Glukosetoleranzstatus und Insulinresistenz Frauen mit GDM-Anamnese ein doppelt so hohes Risiko für die Progression zu einem manifesten Diabetes aufwiesen wie jene, die eine unauffällige Schwangerschaft hatten. Weiters profitierte diese Gruppe von einer Therapie mit Metformin besonders [67]. Dies wurde im 10 Jahres Follow up erneut bestätigt: Lebensstilmaßnahmen und Metformin konnten das Diabetesrisiko um 35–40 % verglichen zu Placebo verringern [68]. Eine Analyse des Wiener GDM Programms zeigte dass ein 2 h Blutzuckerwert im ersten oGTT postpartum über 140 mg/dl, ein HDL unter 50 mg/dl und ein Alter über 35 Jahre die wichtigsten unabhängigen Risikofaktoren für die Entwicklung eines manifesten Diabetes innerhalb von 10 Jahren darstellten [69]. Untersuchungen belegen nun auch für die seit einigen Jahren geltenden GDM Diagnoserichtlinie (basierend auf der HAPO Studie) ein mehr als 3‑fach höheres Risiko für eine Glukosestoffwechselstörung bei Frauen mit GDM im Vergleich zu Frauen mit normaler Glukosetoleranz nach 11 Jahren Follow up [70].
Entsprechend der Datenlage müssen alle Frauen mit GDM außerdem über ihr erhöhtes Risiko für die Entwicklung eines T2DM, eines GDM-Rezidivs (20–50 %) bei neuerlicher Schwangerschaft, ein erhöhtes kardiovaskuläres Risiko sowie über Möglichkeiten der Diabetesprävention informiert werden [70].
Bei unauffälligem Erstbefund sollen die Frauen alle zwei bis drei Jahre mittels oGTT oder zumindest mittels Messung der Nüchternglukose und des HbA1c nachuntersucht werden.
Frauen mit Diabetes in der Schwangerschaft sollen, wenn immer es möglich ist, ihr Kind stillen, da protektive Effekte in Studien gezeigt werden konnten [26]. Bei einer Stilldauer von mehr als drei Monaten weisen stillende Mütter eine um bis zu zehn Jahre verzögerte Progression von GDM zu T2DM auf als nicht stillende Frauen [71].
Frauen nach GDM sollen reine Gestagen-Präparate insbesondere in der Stillzeit vermeiden, da sich dadurch das Risiko für die Manifestation eines T2DM erhöhen könnte [72]. Außer auf eine Glukosestoffwechselstörung soll auch auf weitere kardiovaskuläre Risikoparameter wie Dyslipidämie und Hypertonie untersucht werden, da Frauen nach GDM ein höheres kardiovaskuläres Risiko aufweisen [73, 74].
Nachbetreuung der Kinder
Bei Nachkommen von GDM Schwangerschaften ist ein erhöhtes Risiko für Übergewicht/Adipositas und T2DM bekannt [70, 75]. Ein gesunder Lebensstil und regelmäßige Gewichtskontrollen sind zu empfehlen. Bei Hinweisen auf Hyperglykämie ist eine sofortige Abklärung empfohlen (siehe auch Leitlinie Diabetes mellitus – Definition, Klassifikation, Diagnose, Screening und Prävention). Ein T2DM-Screening sollte bei asymptomatischen Kindern und Jugendlichen bei Adipositas (BMI > 95. Perzentile, geschlechts- und altersadjustiert) oder ein Übergewicht (BMI > 85. Perzentile) und mütterlichem GDM in der Schwangerschaft des Kindes erfolgen [76].
Evidenzlage
Gesichert ist, dass eine mütterliche Hyperglykämie im 1. Trimenon mit einem höheren Risiko für die Entwicklung einer diabetischen Embryopathie, im 2. und 3. Trimenon für die Entwicklung einer diabetischen Fetopathie mit erhöhter Morbidität und Mortalität assoziiert ist [77]. Die „Hyperglycemia and adverse pregnancy outcome (HAPO)“ Studie zeigte weiters, dass ein kontinuierlicher Zusammenhang zwischen der Höhe der mütterlichen Blutzuckerwerte im oGTT und den kindlichen Komplikationen besteht [17, 70, 78].
Während eine Ernährungstherapie alleine in Metaanalysen nicht eindeutig zu besseren fetalen Ergebnissen führt, ist die Verbesserung der postprandialen Blutglukosewerte unter Insulintherapie mit einer geringeren Morbidität verbunden. Studien konnten belegen, dass eine Behandlung (Ernährung und Bewegung, je nach Glukosewerten Insulin) des GDM das Risiko für schwere kindliche Komplikationen im Vergleich zu unbehandelten Frauen signifikant reduzieren konnte [3, 4].
Es konnte klar gezeigt worden, dass Frauen nach GDM ein besonders hohes Risiko für die Entwicklung eines T2DM haben [1, 6, 70], und auch ein höheres Risiko für die Entwicklung kardiovaskulärer Erkrankungen vorliegt [79, 80]. Lebensstiländerungen im Sinne der Diabetesprävention führen zu einer deutlichen Verringerung der Diabetesmanifestationsrate [67, 68]. In der Schwangerschaft war vor allem in Risikogruppen der Erfolg der bisherigen GDM Präventionsstudien bescheiden oder nicht vorhanden [22, 81]. Präzisionsmedizin-Ansätze könnten in der Zukunft zu größeren Erfolgen beitragen [82]. Kinder von Frauen mit GDM haben ein höheres Risiko selbst übergewichtig zu werden und Stoffwechselstörungen zu entwickeln [70, 78].
Funding
Open access funding provided by Medical University of Vienna.
Interessenkonflikt
A. Kautzky-Willer hat von folgenden Unternehmen, die teils auch fördernde Mitglieder der ÖDG sind, Forschungsunterstützungen und/oder Honorare erhalten: Astra Zeneca, Bristol-Myers Squibb, Glaxo Smith-Kline Pharma, Eli Lilly, Merck Sharp&Dohme, Novartis, Novo Nordisk, Roche, Sanofi-Aventis. Y. Winhofer hat von folgenden Unternehmen, die auch fördernde Mitglieder der ÖDG sind, Forschungsunterstützungen/Honorare erhalten: Sanofi Aventis, Eli Lilly, Astra Zeneca, Novartis. M. Lechleitner hat von folgenden Unternehmen, die auch fördernde Mitglieder der ÖDG sind, Honorare erhalten: Astra Zeneca, Bristol-Myers Squibb, Germania Pharmazeutika, GlaxoSmithKline Pharma, Eli Lilly, Medtronic, Merck Sharp&Dome, Novartis, Novo Nordisk, Pfizer, Sanofi-Aventis, Takeda. R. Weitgasser hat von folgenden Unternehmen, die teils auch fördernde Mitglieder der ÖDG sind, Forschungsunterstützungen und/oder Honorare erhalten: Abbott Diabetes Care, Amgen, Allergan, AstraZeneca, Boehringer-Ingelheim, Daiichi Sankyo, Eli Lilly, Merck Sharp & Dohme, Novo Nordisk, Roche Diabetes Care, Sanofi.. H. Kiss, V. Falcone, A. Berger und J. Harreiter geben an, dass kein Interessenkonflikt besteht.
Footnotes
Hinweis des Verlags
Der Verlag bleibt in Hinblick auf geografische Zuordnungen und Gebietsbezeichnungen in veröffentlichten Karten und Institutsadressen neutral.
Literatur
- 1.Bellamy L, Casas JP, Hingorani AD, Williams D. Type 2 diabetes mellitus after gestational diabetes: a systematic review and meta-analysis. Lancet. 2009;373(9677):1773–1779. doi: 10.1016/S0140-6736(09)60731-5. [DOI] [PubMed] [Google Scholar]
- 2.Sweeting A, Wong J, Murphy HR, Ross GP. A clinical update on gestational diabetes mellitus. Endocr Rev. 2022;43(5):763–793. doi: 10.1210/endrev/bnac003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Crowther CA, Hiller JE, Moss JR, et al. Effect of treatment of gestational diabetes mellitus on pregnancy outcomes. N Engl J Med. 2005;352(24):2477–2486. doi: 10.1056/NEJMoa042973. [DOI] [PubMed] [Google Scholar]
- 4.Alwan N, Tuffnell DJ, West J. Treatments for gestational diabetes. Cochrane Database Syst Rev. 2009;3:CD003395. doi: 10.1002/14651858.CD003395.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Teede HJ, Bailey C, Moran LJ, et al. Association of antenatal diet and physical activity-based interventions with gestational weight gain and pregnancy outcomes: a systematic review and meta-analysis. JAMA Intern Med. 2022;182(2):106–114. doi: 10.1001/jamainternmed.2021.6373. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Vounzoulaki E, Khunti K, Abner SC, et al. Progression to type 2 diabetes in women with a known history of gestational diabetes: systematic review and meta-analysis. BMJ. 2020;369:m1361. doi: 10.1136/bmj.m1361. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Kautzky-Willer A, Bancher-Todesca D, Weitgasser R, et al. The impact of risk factors and more stringent diagnostic criteria of gestational diabetes on outcomes in central European women. J Clin Endocrinol Metab. 2008;93(5):1689–1695. doi: 10.1210/jc.2007-2301. [DOI] [PubMed] [Google Scholar]
- 8.Harreiter J, Simmons D, Desoye G, et al. IADPSG and WHO 2013 gestational diabetes mellitus criteria identify obese women with marked insulin resistance in early pregnancy. Diabetes Care. 2016;39(7):e90–2. doi: 10.2337/dc16-0200. [DOI] [PubMed] [Google Scholar]
- 9.Falcone V, Kotzaeridi G, Breil MH, et al. Early assessment of the risk for gestational diabetes mellitus: can fasting parameters of glucose metabolism contribute to risk prediction? Diabetes Metab J. 2019;43(6):785–793. doi: 10.4093/dmj.2018.0218. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Kotzaeridi G, Blatter J, Eppel D, et al. Performance of early risk assessment tools to predict the later development of gestational diabetes. Eur J Clin Invest. 2021;51(12):e13630. doi: 10.1111/eci.13630. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.American Diabetes Association Professional Practice Committee. Draznin B, Aroda VR, et al. 15. Management of diabetes in pregnancy: standards of medical care in diabetes-2022. Diabetes Care. 2022;45(1):S232–S43. doi: 10.2337/dc22-S015. [DOI] [PubMed] [Google Scholar]
- 12.Deutsche Diabetes Gesellschaft e. V. (DDG), Deutsche Gesellschaft für Gynäkologie und Geburtshilfe e. V. (DGGG). S3-Leitlinie: Gestationsdiabetes mellitus (GDM), Diagnostik, Therapie und Nachsorge. 2018. http://www.awmf.org/leitlinien/detail/ll/057-008.html, AWMF-Registernummer 057–008. Zugegriffen: 12.05.2022
- 13.World Health Organization Diagnostic criteria and classification of hyperglycaemia first detected in pregnancy: a world health organization guideline. Diabetes Res Clin Pract. 2014;103(3):341–363. doi: 10.1016/j.diabres.2013.10.012. [DOI] [PubMed] [Google Scholar]
- 14.Muin DA, Pfeifer B, Helmer H, et al. Universal gestational diabetes screening and antepartum stillbirth rates in Austria—a population-based study. Acta Obstet Gynecol Scand. 2022;101(4):396–404. doi: 10.1111/aogs.14334. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Harreiter J, Schindler K, Bancher-Todesca D, et al. Management of pregnant women after bariatric surgery. J Obes. 2018;2018:4587064. doi: 10.1155/2018/4587064. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.International Association of Diabetes and Pregnancy Study Groups Consensus Panel. Metzger BE, Gabbe SG, et al. International association of diabetes and pregnancy study groups recommendations on the diagnosis and classification of hyperglycemia in pregnancy. Diabetes Care. 2010;33(3):676–682. doi: 10.2337/dc09-1848. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.HAPO Study Cooperative Research Group. Metzger BE, Lowe LP, et al. Hyperglycemia and adverse pregnancy outcomes. N Engl J Med. 2008;358(19):1991–2002. doi: 10.1056/NEJMoa0707943. [DOI] [PubMed] [Google Scholar]
- 18.HAPO Study Cooperative Research Group. Metzger BE, Lowe LP, et al. Hyperglycemia and adverse pregnancy outcome (HAPO) study: associations with neonatal anthropometrics. Diabetes. 2009;58(2):453–459. doi: 10.2337/db08-1112. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Crowther CA, Samuel D, McCowan LME, et al. Lower versus higher glycemic criteria for diagnosis of gestational diabetes. N Engl J Med. 2022;387(7):587–598. doi: 10.1056/NEJMoa2204091. [DOI] [PubMed] [Google Scholar]
- 20.American Diabetes Association Professional Practice Committee. Draznin B, Aroda VR, et al. 2. Classification and diagnosis of diabetes: standards of medical care in diabetes-2022. Diabetes Care. 2022;45(1):S17–S38. doi: 10.2337/dc22-S002. [DOI] [PubMed] [Google Scholar]
- 21.Gobl CS, Bozkurt L, Rivic P, et al. A two-step screening algorithm including fasting plasma glucose measurement and a risk estimation model is an accurate strategy for detecting gestational diabetes mellitus. Diabetologia. 2012;55(12):3173–3181. doi: 10.1007/s00125-012-2726-7. [DOI] [PubMed] [Google Scholar]
- 22.Harreiter J, Kautzky-Willer A. Sex and gender differences in prevention of type 2 diabetes. Front Endocrinol (Lausanne) 2018;9:220. doi: 10.3389/fendo.2018.00220. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Simmons D, Devlieger R, van Assche A, et al. Effect of physical activity and/or healthy eating on GDM risk: the DALI lifestyle study. J Clin Endocrinol Metab. 2017;102(3):903–913. doi: 10.1210/jc.2016-3455. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Corcoy R, Mendoza LC, Simmons D, et al. The DALI vitamin D randomized controlled trial for gestational diabetes mellitus prevention: no major benefit shown besides vitamin D sufficiency. Clin Nutr. 2020;39(3):976–984. doi: 10.1016/j.clnu.2019.04.006. [DOI] [PubMed] [Google Scholar]
- 25.Harreiter J, Mendoza LC, Simmons D, Desoye G, Devlieger R, Galjaard S, Damm P, Mathiesen ER, Jensen DM, Andersen LLT, Dunne F, Lapolla A, Dalfra MG, Bertolotto A, Wender-Ozegowska E, Zawiejska A, Hill D, Jelsma JGM, Snoek FJ, Worda C, Bancher-Todesca D, van Poppel MNM, Corcoy R, Kautzky-Willer A, On Behalf Of The Dali Core Investigator Group Vitamin D3 Supplementation in Overweight/Obese Pregnant Women: No Effects on the Maternal or Fetal Lipid Profile and Body Fat Distribution-A Secondary Analysis of the Multicentric, Randomized, Controlled Vitamin D and Lifestyle for Gestational Diabetes Prevention Trial (DALI) Nutrients. 2022;14(18):3781. doi: 10.3390/nu14183781. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Blumer I, Hadar E, Hadden DR, et al. Diabetes and pregnancy: an endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2013;98(11):4227–4249. doi: 10.1210/jc.2013-2465. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Kapur K, Kapur A, Hod M. Nutrition management of gestational diabetes mellitus. Ann Nutr Metab. 2021 doi: 10.1159/000509900. [DOI] [PubMed] [Google Scholar]
- 28.Harreiter J, Simmons D, Desoye G, et al. Nutritional lifestyle intervention in obese pregnant women, including lower carbohydrate intake, is associated with increased maternal free fatty acids, 3-β-Hydroxybutyrate, and fasting glucose concentrations: a secondary factorial analysis of the European multicenter, randomized controlled DALI lifestyle intervention trial. Diabetes Care. 2019;42(8):1380–1389. doi: 10.2337/dc19-0418. [DOI] [PubMed] [Google Scholar]
- 29.Institute of Medicine. Weight gain during pregnancy: reexamining the guideline. 2009. https://nap.nationalacademies.org/resource/12584/Report-Brief---Weight-Gain-During-Pregnancy.pdf. Zugegriffen: 21.03.2023
- 30.Cosson E, Baz B, Gary F, et al. Poor reliability and poor adherence to self-monitoring of blood glucose are common in women with gestational diabetes mellitus and may be associated with poor pregnancy outcomes. Diabetes Care. 2017;40(9):1181–1186. doi: 10.2337/dc17-0369. [DOI] [PubMed] [Google Scholar]
- 31.Mendez-Figueroa H, Schuster M, Maggio L, et al. Gestational diabetes mellitus and frequency of blood glucose monitoring: a randomized controlled trial. Obstet Gynecol. 2017;130(1):163–170. doi: 10.1097/AOG.0000000000002101. [DOI] [PubMed] [Google Scholar]
- 32.Mijatovic-Vukas J, Capling L, Cheng S, et al. Associations of diet and physical activity with risk for gestational diabetes mellitus: a systematic review and meta-analysis. Nutrients. 2018;10(6):698. doi: 10.3390/nu10060698. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Xie W, Dai P, Qin Y, et al. Effectiveness of telemedicine for pregnant women with gestational diabetes mellitus: an updated meta-analysis of 32 randomized controlled trials with trial sequential analysis. BMC Pregnancy Childbirth. 2020;20(1):198. doi: 10.1186/s12884-020-02892-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Lv S, Wang J, Xu Y. Safety of insulin analogs during pregnancy: a meta-analysis. Arch Gynecol Obstet. 2015;292(4):749–756. doi: 10.1007/s00404-015-3692-3. [DOI] [PubMed] [Google Scholar]
- 35.Mathiesen ER, Alibegovic AC, Corcoy R, Dunne F, Feig DS, Hod M, Jia T, Kalyanam B, Kar S, Kautzky-Willer A, Marchesini C, Rea RD, Damm P, EXPECT study group Insulin degludec versus insulin detemir, both in combination with insulin aspart, in the treatment of pregnant women with type 1 diabetes (EXPECT): an open‑label, multinational, randomised, controlled, non-inferiority trial. Lancet Diabetes Endocrinol. 2023;11(2):86–95. doi: 10.1016/S2213-8587. [DOI] [PubMed] [Google Scholar]
- 36.Milluzzo A, Tumminia A, Scalisi NM, et al. Insulin degludec in the first trimester of pregnancy: report of two cases. J Diabetes Investig. 2018;9(3):629–631. doi: 10.1111/jdi.12721. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Keller MF, Vestgaard M, Damm P, Mathiesen ER, Ringholm L. Treatment with the long-acting insulin analog degludec during pregnancy in women with type 1 diabetes: an observational study of 22 cases. Diabetes Res Clin Pract. 2019;152:58–64. doi: 10.1016/j.diabres.2019.05.004. [DOI] [PubMed] [Google Scholar]
- 38.Ringholm L, Do NC, Damm P, Mathiesen ER. Pregnancy outcomes in women with type 1 diabetes using insulin degludec. Acta Diabetol. 2022;59(5):721–727. doi: 10.1007/s00592-021-01845-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Doder Z, Vanechanos D, Oster M, Landgraf W, Lin S. Insulin glulisine in pregnancy—experience from clinical trials and post-marketing surveillance. Eur Endocrinol. 2015;11(1):17–20. doi: 10.17925/EE.2015.11.01.17. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Rowan JA, Hague WM, Gao W, Battin MR, Moore MP. Metformin versus insulin for the treatment of gestational diabetes. N Engl J Med. 2008;358(19):2003–2015. doi: 10.1056/NEJMoa0707193. [DOI] [PubMed] [Google Scholar]
- 41.Ijas H, Vaarasmaki M, Morin-Papunen L, et al. Metformin should be considered in the treatment of gestational diabetes: a prospective randomised study. BJOG. 2011;118(7):880–885. doi: 10.1111/j.1471-0528.2010.02763.x. [DOI] [PubMed] [Google Scholar]
- 42.He K, Guo Q, Ge J, et al. The efficacy and safety of metformin alone or as an add-on therapy to insulin in pregnancy with GDM or T2DM: a systematic review and meta-analysis of 21 randomized controlled trials. J Clin Pharm Ther. 2022;47(2):168–177. doi: 10.1111/jcpt.13503. [DOI] [PubMed] [Google Scholar]
- 43.Rowan JA, Rush EC, Obolonkin V, et al. Metformin in gestational diabetes: the offspring follow-up (MiG TOFU): body composition at 2 years of age. Diabetes Care. 2011;34(10):2279–2284. doi: 10.2337/dc11-0660. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Hanem LGE, Stridsklev S, Juliusson PB, et al. Metformin use in PCOS pregnancies increases the risk of offspring overweight at 4 years of age: follow-up of two RCTs. J Clin Endocrinol Metab. 2018;103(4):1612–1621. doi: 10.1210/jc.2017-02419. [DOI] [PubMed] [Google Scholar]
- 45.Balsells M, Garcia-Patterson A, Sola I, et al. Glibenclamide, metformin, and insulin for the treatment of gestational diabetes: a systematic review and meta-analysis. BMJ. 2015;350:h102. doi: 10.1136/bmj.h102. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Camelo Castillo W, Boggess K, Sturmer T, et al. Association of adverse pregnancy outcomes with glyburide vs insulin in women with gestational diabetes. JAMA Pediatr. 2015;169(5):452–458. doi: 10.1001/jamapediatrics.2015.74. [DOI] [PubMed] [Google Scholar]
- 47.Senat MV, Affres H, Letourneau A, et al. Effect of glyburide vs subcutaneous insulin on perinatal complications among women with gestational diabetes: a randomized clinical trial. JAMA. 2018;319(17):1773–1780. doi: 10.1001/jama.2018.4072. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Kautzky-Willer A, Harreiter J. Needle beats pill in gestational diabetes mellitus. Nat Rev Endocrinol. 2018;14(8):448–449. doi: 10.1038/s41574-018-0050-0. [DOI] [PubMed] [Google Scholar]
- 49.Catalano PM, Huston L, Amini SB, Kalhan SC. Longitudinal changes in glucose metabolism during pregnancy in obese women with normal glucose tolerance and gestational diabetes mellitus. Am J Obstet Gynecol. 1999;180(4):903–916. doi: 10.1016/S0002-9378(99)70662-9. [DOI] [PubMed] [Google Scholar]
- 50.Catalano PM, Tyzbir ED, Wolfe RR, et al. Carbohydrate metabolism during pregnancy in control subjects and women with gestational diabetes. Am J Physiol. 1993;264(1):E60–7. doi: 10.1152/ajpendo.1993.264.1.E60. [DOI] [PubMed] [Google Scholar]
- 51.Wu Y, Liu B, Sun Y, et al. Association of maternal prepregnancy diabetes and gestational diabetes mellitus with congenital anomalies of the newborn. Diabetes Care. 2020;43(12):2983–2990. doi: 10.2337/dc20-0261. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Salomon LJ, Alfirevic Z, Da Silva Costa F, et al. ISUOG practice guidelines: ultrasound assessment of fetal biometry and growth. Ultrasound Obstet Gynecol. 2019;53(6):715–723. doi: 10.1002/uog.20272. [DOI] [PubMed] [Google Scholar]
- 53.Ornoy A, Reece EA, Pavlinkova G, Kappen C, Miller RK. Effect of maternal diabetes on the embryo, fetus, and children: congenital anomalies, genetic and epigenetic changes and developmental outcomes. Birth Defects Res C Embryo Today. 2015;105(1):53–72. doi: 10.1002/bdrc.21090. [DOI] [PubMed] [Google Scholar]
- 54.Metzger BE, Buchanan TA, Coustan DR, et al. Summary and recommendations of the fifth international workshop-conference on gestational diabetes mellitus. Diabetes Care. 2007;30(2):S251–60. doi: 10.2337/dc07-s225. [DOI] [PubMed] [Google Scholar]
- 55.Davidson SJ, de Jersey SJ, Britten FL, et al. Fetal ultrasound scans to guide management of gestational diabetes: Improved neonatal outcomes in routine clinical practice. Diabetes Res Clin Pract. 2021;173:108696. doi: 10.1016/j.diabres.2021.108696. [DOI] [PubMed] [Google Scholar]
- 56.Salomon LJ, Alfirevic Z, Berghella V, et al. ISUOG practice guidelines (updated): performance of the routine mid-trimester fetal ultrasound scan. Ultrasound Obstet Gynecol. 2022;59(6):840–856. doi: 10.1002/uog.24888. [DOI] [PubMed] [Google Scholar]
- 57.Greco P, Vimercati A, Scioscia M, et al. Timing of fetal growth acceleration in women with insulin-dependent diabetes. Fetal Diagn Ther. 2003;18(6):437–441. doi: 10.1159/000073139. [DOI] [PubMed] [Google Scholar]
- 58.Deutsche Diabetes Gesellschaft e. V. (DDG). S2e-Leitlinie: Diabetes in der Schwangerschaft. 2021. https://www.awmf.org/leitlinien/detail/ll/057-023.html. Zugegriffen: 30. Nov. 2021, AWMF-Registernummer 057-023.
- 59.Larciprete G, Valensise H, Vasapollo B, et al. Fetal subcutaneous tissue thickness (SCTT) in healthy and gestational diabetic pregnancies. Ultrasound Obstet Gynecol. 2003;22(6):591–597. doi: 10.1002/uog.926. [DOI] [PubMed] [Google Scholar]
- 60.Sutton AL, Mele L, Landon MB, et al. Delivery timing and cesarean delivery risk in women with mild gestational diabetes mellitus. Am J Obstet Gynecol. 2014;211(3):244.e1–244.e7. doi: 10.1016/j.ajog.2014.03.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Boulvain M, Irion O, Dowswell T, Thornton JG. Induction of labour at or near term for suspected fetal macrosomia. Cochrane Database Syst Rev. 2016;5:CD000938. doi: 10.1002/14651858.CD000938.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Melamed N, Ray JG, Geary M, et al. Induction of labor before 40 weeks is associated with lower rate of cesarean delivery in women with gestational diabetes mellitus. Am J Obstet Gynecol. 2016;214(3):364.e1–364.e8. doi: 10.1016/j.ajog.2015.12.021. [DOI] [PubMed] [Google Scholar]
- 63.Langer O, Berkus MD, Huff RW, Samueloff A. Shoulder dystocia: should the fetus weighing greater than or equal to 4000 grams be delivered by cesarean section? Am J Obstet Gynecol. 1991;165(4):831–837. doi: 10.1016/0002-9378(91)90424-P. [DOI] [PubMed] [Google Scholar]
- 64.Gesellschaft für Neonatologie und Pädiatrische Intensivmedizin. Deutsche Gesellschaft für Perinatale Medizin. Deutsche Diabetes Gesellschaft. Deutsche Gesellschaft für Kinderheilkunde und Jugendmedizin. Deutsche Gesellschaft für Gynäkologie und Geburtshilfe Betreuung von Neugeborenen diabetischer Mütter. Frauenarzt. 2003;44(4):439–441. [Google Scholar]
- 65.Chertok IR, Raz I, Shoham I, Haddad H, Wiznitzer A. Effects of early breastfeeding on neonatal glucose levels of term infants born to women with gestational diabetes. J Hum Nutr Diet. 2009;22(2):166–169. doi: 10.1111/j.1365-277X.2008.00921.x. [DOI] [PubMed] [Google Scholar]
- 66.Hillier TA, Pedula KL, Schmidt MM, et al. Childhood obesity and metabolic imprinting: the ongoing effects of maternal hyperglycemia. Diabetes Care. 2007;30(9):2287–2292. doi: 10.2337/dc06-2361. [DOI] [PubMed] [Google Scholar]
- 67.Ratner RE, Christophi CA, Metzger BE, et al. Prevention of diabetes in women with a history of gestational diabetes: effects of metformin and lifestyle interventions. J Clin Endocrinol Metab. 2008;93(12):4774–4779. doi: 10.1210/jc.2008-0772. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.Aroda VR, Christophi CA, Edelstein SL, et al. The effect of lifestyle intervention and metformin on preventing or delaying diabetes among women with and without gestational diabetes: the diabetes prevention program outcomes study 10-year follow-up. J Clin Endocrinol Metab. 2015;100(4):1646–1653. doi: 10.1210/jc.2014-3761. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.Göbl CS, Bozkurt L, Prikoszovich T, et al. Early possible risk factors for overt diabetes after gestational diabetes mellitus. Obstet Gynecol. 2011;118(1):71–78. doi: 10.1097/AOG.0b013e318220e18f. [DOI] [PubMed] [Google Scholar]
- 70.Lowe WL, Jr., Scholtens DM, Lowe LP, et al. Association of gestational diabetes with maternal disorders of glucose metabolism and childhood adiposity. JAMA. 2018;320(10):1005–1016. doi: 10.1001/jama.2018.11628. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71.Ziegler AG, Wallner M, Kaiser I, et al. Long-term protective effect of lactation on the development of type 2 diabetes in women with recent gestational diabetes mellitus. Diabetes. 2012;61(12):3167–3171. doi: 10.2337/db12-0393. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.Xiang AH, Kawakubo M, Kjos SL, Buchanan TA. Long-acting injectable progestin contraception and risk of type 2 diabetes in Latino women with prior gestational diabetes mellitus. Diabetes Care. 2006;29(3):613–617. doi: 10.2337/diacare.29.03.06.dc05-1940. [DOI] [PubMed] [Google Scholar]
- 73.Shah BR, Retnakaran R, Booth GL. Increased risk of cardiovascular disease in young women following gestational diabetes mellitus. Diabetes Care. 2008;31(8):1668–1669. doi: 10.2337/dc08-0706. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 74.Kramer CK, Campbell S, Retnakaran R. Gestational diabetes and the risk of cardiovascular disease in women: a systematic review and meta-analysis. Diabetologia. 2019;62(6):905–914. doi: 10.1007/s00125-019-4840-2. [DOI] [PubMed] [Google Scholar]
- 75.Damm P, Houshmand-Oeregaard A, Kelstrup L, et al. Gestational diabetes mellitus and long-term consequences for mother and offspring: a view from Denmark. Diabetologia. 2016;59(7):1396–1399. doi: 10.1007/s00125-016-3985-5. [DOI] [PubMed] [Google Scholar]
- 76.American Diabetes Association 2. Classification and diagnosis of diabetes: standards of medical care in diabetes-2018. Diabetes Care. 2018;41(1):S13–S27. doi: 10.2337/dc18-S002. [DOI] [PubMed] [Google Scholar]
- 77.Reece EA, Leguizamon G, Wiznitzer A. Gestational diabetes: the need for a common ground. Lancet. 2009;373(9677):1789–1797. doi: 10.1016/S0140-6736(09)60515-8. [DOI] [PubMed] [Google Scholar]
- 78.Scholtens DM, Kuang A, Lowe LP, et al. Hyperglycemia and adverse pregnancy outcome follow-up study (HAPO FUS): maternal glycemia and childhood glucose metabolism. Diabetes Care. 2019;42(3):381–392. doi: 10.2337/dc18-2021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.Harreiter J, Dovjak G, Kautzky-Willer A. Gestational diabetes mellitus and cardiovascular risk after pregnancy. Womens Health (Lond) 2014;10(1):91–108. doi: 10.2217/WHE.13.69. [DOI] [PubMed] [Google Scholar]
- 80.Harreiter J, Fadl H, Kautzky-Willer A, Simmons D. Do women with diabetes need more intensive action for cardiovascular reduction than men with diabetes? Curr Diab Rep. 2020;20(11):61. doi: 10.1007/s11892-020-01348-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Harreiter J, Desoye G, van Poppel MNM, et al. The effects of lifestyle and/or vitamin D supplementation interventions on pregnancy outcomes: what have we learned from the DALI studies? Curr Diab Rep. 2019;19(12):162. doi: 10.1007/s11892-019-1282-7. [DOI] [PubMed] [Google Scholar]
- 82.Sparks JR, Ghildayal N, Hivert MF, Redman LM. Lifestyle interventions in pregnancy targeting GDM prevention: looking ahead to precision medicine. Diabetologia. 2022;65(11):1814–1824. doi: 10.1007/s00125-022-05658-w. [DOI] [PMC free article] [PubMed] [Google Scholar]