Abstract
目的
通过评估老年性聋患者的认知功能, 探讨年龄、听力损失程度、言语识别能力与认知功能之间的关系。
方法
选取131名老年人参加本研究, 其中老年性聋组66例, 听力正常组(对照组)65例。①完成纯音听阈测试, 获得0.5、1、2、4 kHz平均听阈; ②使用普通话言语测听材料中的单音节词汇表测试双耳中较好耳安静环境下最大言语识别率及给声强度为60 dB HL时的言语识别率; ③使用汉化版简易智能精神状态量表(MMSE)评估受试者的认知功能; ④使用Spearman相关系数分析年龄、平均听阈、最大言语识别率与MMSE得分之间的相关性; ⑤使用GLM模型分析性别、耳聋时间、教育程度对老年性聋患者认知功能的影响。
结果
① 老年性聋组轻度认知功能障碍(MCI, < 27分)的比例(16.7%)高于对照组(10.8%), 但差异无统计学意义(P>0.05); ②MMSE得分随年龄增加而降低(P < 0.05), 且存在显著相关性(对照组: r=-0.424, P=0.000; 老年性聋组: r=-0.277, P=0.024); ③不同平均听阈水平组间的MMSE得分差异有统计学意义(P < 0.05), 且老年性聋组MMSE得分与平均听阈之间有显著相关性(r=-0.375, P < 0.01); ④老年性聋组60 dB HL处言语识别率低(< 50%)的MMSE得分显著低于言语识别率高者(≥50%), 且MMSE得分与最大言语识别率之间存在显著相关性(r=0.402, P=0.001); ⑤老年性聋组MCI者的平均年龄、平均听阈均显著高于认知功能正常(27~30分)者(P < 0.05), 而平均最大言语识别率显著低于认知功能正常者(P < 0.05); ⑥由GLM模型分析得出耳聋时间以及教育程度对MMSE得分有显著影响(β=-0.066, t=-2.98, P < 0.01; β=0.286 9, t=2.39, P < 0.05), 性别对MMSE得分无显著影响(β=0.277, t=1.46, P=0.143)。
结论
老年性聋患者的年龄、听力损失程度、言语识别能力与认知功能显著相关, MCI的发病率高于老年听力正常者, 耳聋时间是MCI的危险因素, 而受教育程度是保护因素。
Keywords: 老年性聋, 认知功能, 听力损失, 言语识别
Abstract
Objective
To evaluate the cognitive function of patients with presbycusis, and to explore the relationship among age, hearing loss, speech recognition ability and cognitive function.
Method
A total of 131 elder participated in this study. Based on hearing threshold, all participants were divided into the elderly hearing loss group(66 cases) and the control group(65 cases with normal hearing). ① The pure tone audiometry test was completed to obtain the average hearing threshold of 0.5, 1, 2, and 4 kHz; ② The single-syllable vocabulary in Mandarin Speech Test Materials was used to test the maximum speech recognition rate and the speech recognition rate at 60 dB HL in a quiet environment about the better ear; ③ Chinese version of the Mini-mental State Examination(MMSE) was used to assess the subject's cognitive function; ④ Use spearman correlation coefficient to analyze the correlation between age, average hearing threshold, maximum speech recognition rate and the MMSE score; ⑤ Use GLM to analyze the effects of gender, deafness time, and education level on the cognitive function in presbycusis patients.
Result
① The proportion of mild cognitive dysfunction(< 27 points)(16.7%) in the elderly hearing loss group was higher than the control group(10.8%), but there was no significant difference(P>0.05); ②The MMSE score decreased with age(P < 0.05), and there was a significant correlation between MMSE score and age(the control group: r=-0.424, P=0.000; the elderly hearing loss group: r=-0.277, P=0.024); ③There was a significant difference in MMSE scores between groups with different average hearing threshold levels(P < 0.05), and there was a significant correlation between the MMSE score and the average hearing threshold in the elderly hearing loss group(r=-0.375, P < 0.01); ④The MMSE score of the elderly hearing loss group with a low speech recognition rate at 60 dB HL(< 50%) was significantly lower than the group with a high speech recognition rate(≥50%), and there was a significant correlation between MMSE score and maximum speech recognition rate(r=0.402, P=0.001); ⑤The average age and hearing threshold of the MCI in the elderly hearing loss group were significantly higher than the normal cognitive function group(27-30 points)(P < 0.05), and the average maximum speech recognition rate was significantly lower than the normal cognitive function group(P < 0.05); ⑥Analyzed by the GLM, the deafness time and education level have significant effects on MMSE scores(β=-0.066, t=-2.98, P < 0.01; β=0.286 9, t=2.39, P < 0.05), but gender have no significant effect on MMSE scores(β=0.277, t=1.46, P=0.143).
Conclusion
The age, hearing loss and speech recognition ability of presbycusis patients was significantly correlated with cognitive function. The incidence rate of MCI in presbycusis patients is higher than that in elderly normal hearing subjects. Deafness time is a risk factor of mild cognitive impairment, while education is a protective factor.
Keywords: presbycusis, cognitive function, hearing loss, speech recognition
老年性聋又称年龄相关性听力损失(age-related hearing loss), 表现为听觉敏感性和噪声环境下言语理解能力减退、中枢系统处理听觉信息速度减慢以及对声源定位能力下降等〔1〕。老年听力损失可以引起听觉言语交流能力减退、生活质量下降、家庭负担增加和生命健康受损等一系列严重问题。目前研究〔2-4〕表明老年性聋与认知功能之间会相互影响, 从而影响老年人的生活质量以及社会参与度, 而国内关于老年性聋患者认知功能的报道较为有限。本研究通过测试初次验配助听器的老年性聋患者的纯音听阈、言语识别能力以及认知功能, 评估年龄、听力损失程度、听力损失时间对认知功能的影响, 探究听力损失程度、言语识别能力与老年人认知功能之间的相关性。
1. 资料与方法
1.1. 研究对象
来自2019-01-2019-10上海交通大学医学院附属第九人民医院听力中心验配助听器的老年性聋患者66例(老年性聋组), 男35例, 女31例; 年龄60~89岁, 平均(77.27±7.00)岁。入选标准: ①年龄在60岁以上; ②小学以上文化程度, 能听懂并会讲普通话; ③无助听器使用史; ④目前无耳科基础疾病或已痊愈, 如化脓性中耳炎、分泌性中耳炎、突发性聋、梅尼埃病、听神经瘤等, 无先天性聋病史、耳毒性药物史、耳部爆震史以及精神病史; ⑤鼓室导抗图为A型, 纯音听阈检查为感音神经性聋; ⑥无其他医学及心理禁忌证, 生活能自理, 接受简易智能精神状态量表(mini-mental state examination, MMSE)得分≥19分〔5〕。
老年听力正常者65例为对照组, 男28例, 女37例; 年龄61~88岁, 平均(75.34±7.40)岁。双耳各频率听阈均小于25 dB HL, 无耳科疾病史, 小学以上文化程度, MMSE得分均在19分以上。
两组受试者基本情况见表 1。
表 1.
两组受试者基本情况
| 项目 | 老年性聋组 | 对照组 |
| 性别 | ||
| 男 | 35(53.0) | 28(43.1) |
| 女 | 31(47.0) | 37(56.9) |
| 年龄/岁 | ||
| 60~69 | 12(18.2) | 15(23.1) |
| 70~79 | 26(39.4) | 28(43.1) |
| 80~89 | 28(42.4) | 22(33.8) |
| 耳聋时间/年 | 5.69±4.51 | - |
| 听力损失程度 | ||
| 轻度 | 0(0) | - |
| 中度 | 35(53.0) | - |
| 重度 | 31(47.0) | - |
| 教育程度 | ||
| 低(初中及以下) | 22(33.3) | 23(35.4) |
| 中(高中) | 26(39.4) | 28(43.1) |
| 高(大专及以上) | 18(27.3) | 14(21.5) |
1.2. 听力学检查
采用声导抗仪(Interacoustics Titan, 丹麦)进行鼓室导抗图测试, 听力计(Madsen Astera, 丹麦)进行纯音测听及言语测听, 获取较好耳的平均听阈和最大言语识别率。测试均在本底噪声 < 25 dB(A)的标准隔声室内进行, 所有测试设备均通过中科院上海声学所工程师校准。纯音听阈测试方法按国家标准GB/T 16403-1996进行。根据世界卫生组织推荐标准, 以纯音测听0.5、1、2、4 kHz的气导听阈加权值作为平均听阈。言语测听采用张华等编制的普通话言语测听材料(Mandarin Speech Test Materials)〔6〕中的单音节测听词表测试给声强度为60 dB HL时好耳的言语识别率及最大言语识别率。在测试耳0.5、1、2、4 kHz 4个频率的气导平均听阈上20 dB开始给声, 以10 dB为步距, 每一个给声强度下给出1个测试词表, 得出一个声强的正确百分比后, 再以10 dB步距递增言语声强, 进行下一难度等价性一致的词表测试。若随着言语声强的增大, 患者出现不耐受或者声强达到听力计最大声输出时测试结束, 得到的多个言语识别率中得分最高的即为最大言语识别率, 同时在测试过程中获得给声强度为60 dB HL时的言语识别率。
1.3. 认知功能评估方法
MMSE〔7〕是一项被全世界广泛用于临床上筛查老年性痴呆的认知功能评估量表。汉化版MMSE的研究表明其涵盖的认知项目广泛, 操作简单方便, 筛查痴呆敏感度较高, 适于临床广泛应用〔3〕。既往研究以26分作为痴呆筛查的界定值, 具有较高的敏感性及特异性, 本研究以受试对象得分27~30分为正常, < 27分为认知功能减退。
1.4. 统计学方法
应用SPSS 22.0统计学软件进行数据分析。使用独立样本t检验、方差分析分析不同组年龄、听力损失程度、言语识别率之间的差异; 利用Spearman相关系数分析认知功能得分与年龄、听力损失程度以及言语识别率之间的相关性; 利用GLM(generalized linear model)模型分析性别、耳聋时间、受教育程度等因素对认知功能得分的影响。P < 0.05为差异有统计学意义。
2. 结果
2.1. 平均听阈
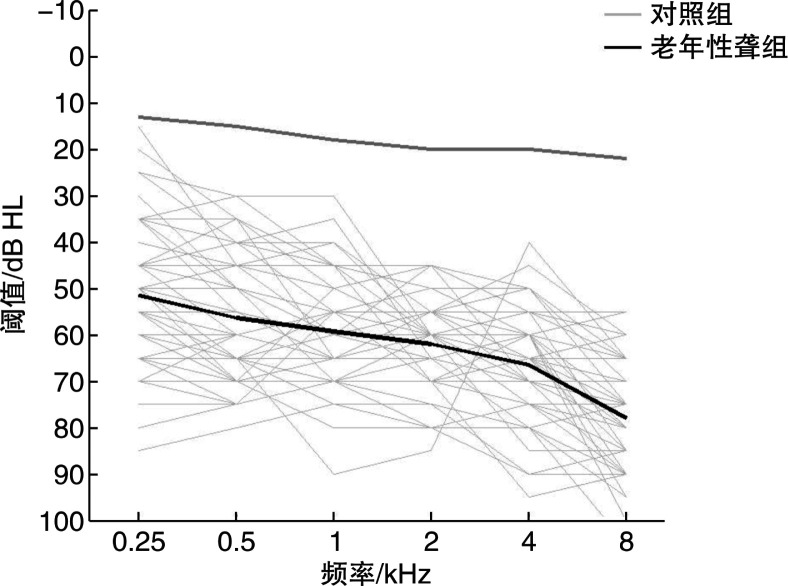
老年性聋组双耳中较好耳与对照组双耳平均听阈的比较见图 1。老年性聋组听阈范围为15~100 dB HL, 对照组为5~25 dB HL。
图 1.
老年性聋组双耳中较好耳与对照组双耳平均听阈的比较
2.2. MMSE量表得分
老年性聋组中MMSE得分≥27分者55例(83.3%), < 27分者11例(16.7%); 对照组中MMSE得分≥27分者58例(89.2%), < 27分者7例(10.8%)。老年性聋组有认知功能障碍的比例高于对照组, 但卡方检验二者差异无统计学意义(P>0.05)。
2.3. 年龄对MMSE量表得分的影响
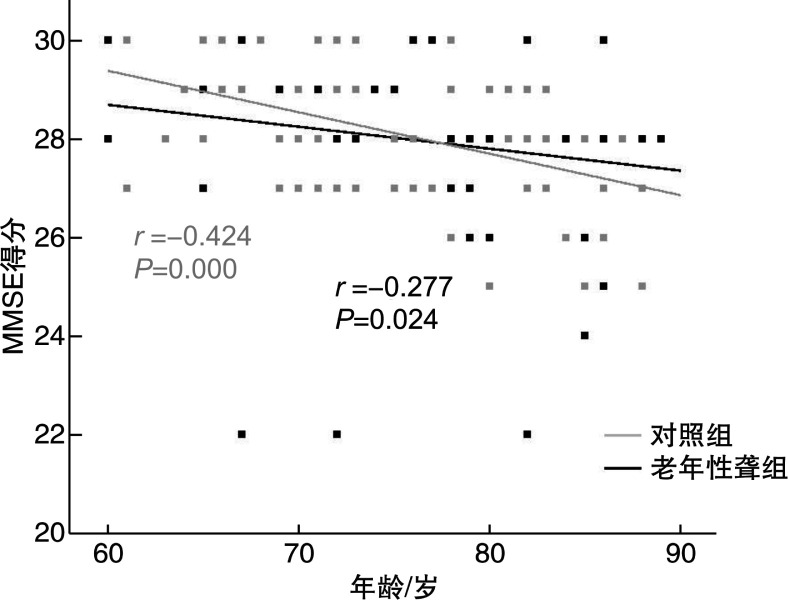
图 2表明两组受试者的MMSE得分与年龄之间均呈显著直线相关性(对照组: r=-0.424, P=0.000; 老年性聋组: r=-0.277, P=0.024)。不同年龄组的MMSE得分比较见表 2, 方差分析表明, 年龄对两组受试者的MMSE得分均有显著影响(P < 0.05), 即随年龄增加, 认知功能下降。
图 2.
两组受试者MMSE得分与年龄之间的相关性
表 2.
不同年龄组的MMSE得分比较 x±s
| 年龄/岁 | MMSE得分/分 | |
| 对照组 | 老年性聋组 | |
| 60~69 | 28.80±1.21 | 28.25±2.18 |
| 70~79 | 28.32±1.22 | 28.08±1.77 |
| 80~89 | 27.32±1.36 | 26.82±1.36 |
| P | 0.002 | 0.023 |
根据MMSE量表得分将老年性聋组分为认知功能正常组(27~30分)55例和轻度认知功能障碍(mild cognitive impairment, MCI)组(< 27分)11例, 两组的平均年龄分别为(76.65±7.04)岁和(80.36±6.15)岁, 后者的平均年龄显著高于前者(P < 0.05)。
2.4. 听力损失程度对MMSE量表得分的影响
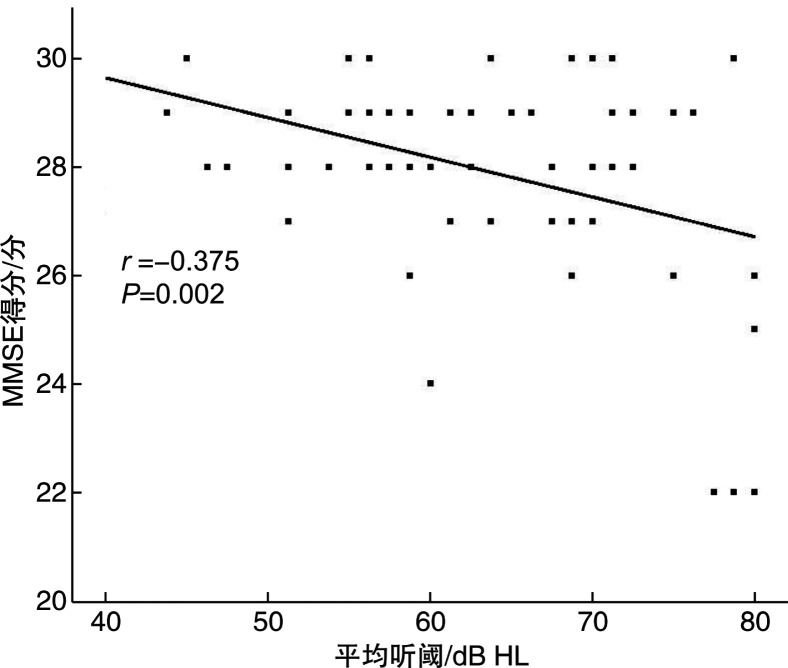
将老年性聋组按听力损失程度分为中度听力损失组(41~60 dB HL)30例和重度听力损失组(61~80 dB HL)36例, 其MMSE量表得分平均值见表 3。方差分析表明, 听力损失程度对MMSE得分有显著影响(P < 0.05), 即认知功能随听力损失程度增加而下降, 进一步两两比较表明仅对照组与重度听力损失组之间的差异有统计学意义(P < 0.05)。认知功能正常组和MCI组的平均听阈分别为(61.50±8.48) dB HL与(73.75±8.37) dB HL, 后者的听力损失程度显著高于前者(P < 0.05), 且认知功能测试得分与平均听阈之间显著相关(r=-0.375, P=0.002), 见图 3。
表 3.
不同平均听阈水平组MMSE得分比较 x±s
| 平均听阈/dB HL | 例数 | MMSE得分/分 |
| 对照组 | 65 | 28.09±1.38 |
| 老年性聋组 | ||
| 中度听力损失组 | 30 | 27.77±1.17 |
| 重度听力损失组 | 36 | 27.25±2.05 |
图 3.
老年性聋组MMSE得分与平均听阈之间的相关性
2.5. 言语识别率与MMSE量表得分之间的关系
老年性聋组的平均最大言语识别率(85.30%)显著低于对照组(99.5%)。由Spearman相关性分析得出老年性聋组的MMSE得分与最大言语识别率之间呈显著正相关性(r=0.402, P=0.001)。将老年性聋组按60 dB HL处的好耳言语识别率分为低言语识别率组(< 50%)26例和高言语识别率组(≥50%)40例, 两组的MMSE得分分别为(26.69±2.19)分和(28.00±1.06)分, 后者显著高于前者(P < 0.01)。认知功能正常组与MCI组的最大言语识别率得分分别为(87.45±15.18)%和(74.55±20.67)%, 后者显著低于前者(P < 0.01)。
2.6. 老年性聋组患者MMSE得分的影响因素
由GLM模型分析得出耳聋时间以及教育程度对MMSE得分有显著影响(β=-0.066, t=-2.98, P < 0.01; β=0.2869, t=2.39, P < 0.05), 性别对MMSE得分无显著影响(β=0.277, t=1.46, P=0.143), 说明老年性聋患者的认知功能水平与耳聋时间呈负相关, 与受教育程度呈正相关, 即耳聋时间越短, 受教育程度越高, 认知功能水平越高。
3. 讨论
老年性聋的发生、发展是多环节、多因素共同作用的结果, 其中听觉系统的退行性病变是重要发病机制〔1〕。听皮层是听觉神经系统的高级听觉中枢, 负责对复杂声音信息进行精确分辨、处理和加工。随着年龄老化, 老年人的听觉系统、神经系统共同的退行性病变可导致听觉、认知能力减退, 二者会互相影响。因此, 本研究着眼于分析首次来门诊验配助听器的老年性聋患者的年龄、听力损失程度、言语识别率与认知功能的关系。
3.1. 老年性聋患者的MCI发生率
MCI是介于正常老化和早期痴呆之间的一种认知功能缺损状态, 以记忆障碍为主要特点, 可伴有其他认知功能损害, 如语言、注意和视空间障碍等, 但患者的日常生活能力不受影响〔8〕。由于研究对象的年龄、抽样方法和使用的诊断标准不同, 以往有关MCI发生率的研究报道差异较大。国外相关研究发现65岁以上的老年人MCI发生率为3%~22%〔9〕, 而国内研究发现60岁以上老年人的发生率为12.7%〔8〕, 其中西部地区(14.7%)的发生率比东部地区(9.6%)高。本研究中老年听力正常者MCI的发生率为10.8%, 类似于国内平均发生率, 而老年性聋患者MCI的发生率为16.7%, 高于国内MCI的平均发生率, 考虑原因是本研究中的老人都是中度及以上的听力损失程度, 患者更容易伴发MCI。
3.2. 年龄对老年性聋患者认知功能的影响
随着年龄的增加, 老年人的大脑功能和结构将会经历显著性变化, 例如神经元损失增加、突触密度下降、能量产生下降、突触信号紊乱以及蛋白质破坏等, 从而影响神经中枢的功能〔10〕, 可能出现认知功能的下降。Wang等〔11〕对上海地区1302名60岁以上的老人进行了为期1年的纵向研究, 发现70岁以上老人MCI的发生率明显高于60~70岁的老人, 表明年龄是MCI患病的危险因素。此外, 相比于正常认知老年人, MCI患者的认知功能随年龄增加下降速度明显更快〔12〕。本研究发现听力正常的老年人和老年性聋患者认知功能的得分均与年龄存在显著相关性, 即年龄越大, 认知功能越低。此外, 老年性聋患者中MCI组的平均年龄高于认知功能正常组, 表明年龄是MCI患病的危险因素。
3.3. 听觉功能对老年性聋患者认知功能的影响
本研究发现听力损失程度显著影响认知功能得分, 但仅发现老年性聋患者中重度听力损失者与听力正常者的MMSE得分之间存在显著性差异, 表明听力损失会影响认知功能得分, 到中度以上时会更明显。此外, 老年性聋患者的认知功能得分与听力损失程度呈显著负相关, MCI组的平均听阈高于认知功能正常组, 提示听力损失较重者出现MCI的可能性更大。此外, 对5项RCT(共825例69~83岁老年性聋患者)的Meta分析显示, 听力损害与认知能力的下降显著相关, 助听器可有效改善听力健康以及日常生活质量〔4〕。相关流行病学证据表明周围性听力损失会加快认知下降的速率, 增加患痴呆症的风险〔13-15〕, 对听力损失干预会减缓认知下降。但目前关于老年性聋患者听力损失后导致认知功能障碍的机制尚无明确定论〔2〕, 其中“感觉剥夺”假说认为认知功能的下降是由于长期缺乏足够的感知输入, 听觉系统区域萎缩被认为是感觉剥夺机制的潜在机制; “资源分配”(resource allocation)假说认为认知过程会因感知障碍而受到限制, 当存在听力损失时, 更多资源被用来感知言语, 从而减少了用于更高级别的认知过程的资源。因此, 建议听障老年患者及早验配助听器或采取其他干预手段, 加强其社会活动参与度。
本研究还发现老年性聋患者中言语识别率较低者的认知功能得分显著低于较高者, 表明言语识别率会影响老年性聋患者的认知水平。特别是60 dB HL的好耳言语识别率低的患者认知得分显著偏低, 考虑原因是正常言语交谈强度一般为65 dB SPL左右, 所以在此给声强度下言语识别率较低的患者在日常生活中参与交流时面对的困难更大, 获得的言语信息就偏少, 对大脑的刺激明显减少。此外, 老年性聋患者的认知功能得分与最大言语识别率之间呈显著正相关, 相关性高于认知功能得分与平均听阈之间的相关性。进一步表明相比于听力程度, 言语识别能力与认知功能之间的相关性更高。老年性聋患者中MCI组的言语识别率低于认知功能正常组, 表明认知功能降低的患者言语识别率也有所降低。影响老年人言语理解困难的因素包括外周因素、听觉中枢及认知功能, 言语识别依赖听觉感知和认知相互作用, 言语理解过程中首先需要察觉相关言语信息, 在提取言语信号的关键特征后, 通过认知功能整理信息〔16〕。Anderson等〔16〕建立的听觉-认知模型, 揭示了认知能力如记忆力和注意力协同中枢言语处理在一定程度上决定了老年人在噪声下言语理解的程度。而MCI患者的突出临床症状为记忆障碍, 表现为工作记忆功能受损, 而工作记忆是认知系统中的核心结构, 主要负责获取当前信息, 与长时记忆中的信息相联系, 并暂时保存重要的信息, 从而获得对任务的整体理解。相关研究表明工作记忆的降低对老年人言语识别有重要影响, 原因在于老年人对一些知识进行“检索”或者“回忆”等认知功能的下降〔17〕。因此, 当老年性聋患者出现听力及言语识别率下降的情况时, 应密切关注其认知功能状态, 及时干预。
3.4. 其他因素对老年性聋患者认知功能的影响
对老年性聋患者MMSE得分的影响因素进行分析发现, 耳聋时间越短, 受教育程度越高, MMSE得分越高。受教育程度高的患者往往退休前更倾向于从事脑力劳动, 社交活动更广, 甚至会定期阅读, 对于新兴事物(如上网)的接受程度较高, 因此接受到的外部刺激更多, 相较于受教育程度低的患者, 认知功能下降的速度会更慢。Wang等〔11〕研究发现60岁以上的老年人群MCI的保护因素包括吸烟、喝茶以及退休前从事智力工作等, 与本研究结果一致。此外, 听力损失会造成大脑接受的传入刺激减少而影响认知功能, 耳聋时间的延长会加重认知功能下降的程度。因此, 及时关注老年人的听力损失, 及时干预其听力状态, 可能会有效减缓其认知功能下降的速度。
综上所述, 老年性聋患者MCI的发生率较高, 其与年龄、听力损失程度均呈负相关, 即年龄越大、听力损失越重, 认知功能水平越低。老年性聋患者的认知功能水平与言语识别率呈显著正相关。耳聋时间也是MCI的危险因素, 受教育程度是保护因素, 即耳聋时间越短、受教育程度越高, 认知功能下降越不明显, 提示尽早干预耳聋状态, 可有效减缓其认知功能下降, 有利于维护认知功能的完整。当然, 听觉功能与认知之间的关系非常复杂, 二者相辅相成、互相影响, 同时还受其他很多因素的影响, 目前尚无定论, 因此也成为当今国内外研究的热点重点之一, 要最终揭示它们之间的机制和关联, 还有很多地方需要我们去探究。
Funding Statement
国家自然科学基金(No: 81700903)
References
- 1.Gates GA, Mills JH. Presbycusis. Lancet. 2005;366(9491):1111–1120. doi: 10.1016/S0140-6736(05)67423-5. [DOI] [PubMed] [Google Scholar]
- 2.Nixon GK, Sarant JZ, Tomlin D. Peripheral and central hearing impairment and their relationship with cognition: a review. Int J Audiol. 2019;58(9):541–552. doi: 10.1080/14992027.2019.1591644. [DOI] [PubMed] [Google Scholar]
- 3.Taljaard DS, Olaithe M, Brennan-Jones CG, et al. The relationship between hearing impairment and cognitive function: A meta-analysis in adults. Clin Otolaryngol. 2016;41(6):718–729. doi: 10.1111/coa.12607. [DOI] [PubMed] [Google Scholar]
- 4.Ferguson MA, Kitterick PT, Chong LY, et al. Hearing aids for mild to moderate hearing loss in adults. Cochrane Database Syst Rev. 2017;9:CD012023. doi: 10.1002/14651858.CD012023.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.彭 丹涛, 许 贤豪, 刘 江红, et al. 简易智能精神状态检查量表检测老年期痴呆患者的应用探讨. 中国神经免疫学和神经病学杂志. 2005;12(4):187–190. doi: 10.3969/j.issn.1006-2963.2005.04.001. [DOI] [Google Scholar]
- 6.王 靓, 张 华, 王 硕, et al. 普通话单音节词言语测听材料的等价性分析. 中国耳鼻咽喉头颈外科. 2006;13(6):397–401. doi: 10.3969/j.issn.1672-7002.2006.06.016. [DOI] [Google Scholar]
- 7.Mitchell AJ. A meta-analysis of the accuracy of the mini-mental state examination in the detection of dementia and mild cognitive impairment. J Psychiatr Res. 2009;43(4):411–431. doi: 10.1016/j.jpsychires.2008.04.014. [DOI] [PubMed] [Google Scholar]
- 8.Nie H, Xu Y, Liu B, et al. The prevalence of mild cognitive impairment about elderly population in China: a meta-analysis. Int J Geriatr Psychiatry. 2011;26(6):558–563. doi: 10.1002/gps.2579. [DOI] [PubMed] [Google Scholar]
- 9.Sanford AM. Mild Cognitive Impairment. Clin Geriatr Med. 2017;33(3):325–337. doi: 10.1016/j.cger.2017.02.005. [DOI] [PubMed] [Google Scholar]
- 10.Kohama SG, Rosene DL, Sherman LS. Age-related changes in human and non-human primate white matter: from myelination disturbances to cognitive decline. Age(Dordr) 2012;34(5):1093–1110. doi: 10.1007/s11357-011-9357-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Wang T, Xiao S, Chen K, et al. Prevalence, incidence, risk and protective factors of amnestic mild cognitive impairment in the elderly in Shanghai. Curr Alzheimer Res. 2017;14(4):460–466. doi: 10.2174/1567205013666161122094208. [DOI] [PubMed] [Google Scholar]
- 12.Cheng Y, Xiao S. Recent research about mild cognitive impairment in China. Shanghai Arch Psychiatry. 2014;26(1):4–14. doi: 10.3969/j.issn.1002-0829.2014.01.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Livingston G, Sommerlad A, Orgeta V, et al. Dementia prevention, intervention, and care. Lancet. 2017;390(10113):2673. doi: 10.1016/S0140-6736(17)31363-6. [DOI] [PubMed] [Google Scholar]
- 14.Lin FR. Hearing loss and cognition among older adults in the United States. J Gerontol A Biol Sci Med Sci. 2011;66(10):1131–1136. doi: 10.1093/gerona/glr115. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Lin FR, Yaffe K, Xia J, et al. Hearing Loss and Cognitive Decline in Older Adults. JAMA Intern Med. 2013;173(4):293–299. doi: 10.1001/jamainternmed.2013.1868. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Anderson S, White-Schwoch T, Parbery-Clark A, et al. A dynamic auditory-cognitive system supports speech-in-noise perception in older adults. Hear Res. 2013;300:18–32. doi: 10.1016/j.heares.2013.03.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Gates GA, Anderson ML, Feeney MP, et al. Central auditory dysfunction in older persons with memory impairment or Alzheimer dementia. Arch Otolaryngol Head Neck Surg. 2008;134(7):771–777. doi: 10.1001/archotol.134.7.771. [DOI] [PMC free article] [PubMed] [Google Scholar]