Resumen
Los esfingolípidos (esfingomielina, glucolípidos y gangliósidos) se localizan en las membranas celulares, el plasma y las lipoproteínas. En pacientes con enfermedades cardiovasculares, renales y metabólicas, el perfil de los esfingolípidos y sus metabolitos (ceramida, esfingosina y esfingosina-1-fosfato) se modifica, y estos cambios pueden explicar las alteraciones en algunas respuestas celulares, como la apoptosis. Además, se ha sugerido que la esfingosina y la esfingosina-1-fosfato previenen la COVID-19. En esta revisión también se mencionan brevemente las técnicas que permiten el estudio de los esfingolípidos y sus metabolitos.
Palabras clave: Esfingolípidos, Esfingomielina, Ceramida, Esfingosina, Esfingosina 1-fosfato, Enfermedades cardiovasculares
Abstract
Sphingolipids (sphingomyelin, glycolipids, gangliosides) are located in cell membranes, plasma, and lipoproteins. In patients with cardiovascular, renal, and metabolic diseases, the profile of sphingolipids and their metabolites (ceramide, sphingosine, and sphingosine-1-phosphate) is modified, and these changes may explain the alterations in some cellular responses such as apoptosis. Furthermore, sphingosine and sphingosine-1-phosphate have been suggested to prevent COVID-19. This review also briefly mentions the techniques that allow us to study sphingolipids and their metabolites.
Keywords: Sphingolipids, Sphingomyelin, Ceramide, Sphingosine, Sphingosine 1-phosphate, Cardiovascular diseases
Introducción
Los esfingolípidos (esfingomielina, glucolípidos, gangliósidos) son el segundo grupo más abundante de lípidos de membrana. Los esfingolípidos, junto con el colesterol, forman microdominios llamados balsas lipídicas o lipidrafts, que regulan la función de las proteínas de membrana (receptores, enzimas, transportadores y canales iónicos) y participan en la transducción de señales, así como en los procesos de comunicación celular. La esfingomielina y sus metabolitos (ceramida, esfingosina y esfingosina-1-fosfato) modulan procesos celulares como la diferenciación, la proliferación, el crecimiento, la senescencia y la apoptosis1,2.
Metabolismo de los esfingolípidos
La síntesis de novo de los esfingolípidos se lleva a cabo en el retículo endoplásmico liso, iniciando con la condensación de la L-serina con palmitoil-CoA para formar 3-ceto-esfinganina, en una reacción catalizada por la serina palmitoil-transferasa. La 3-ceto-esfinganina es reducida a esfinganina, la cual es N-acilada por la ceramida sintasa para formar dihidroceramida, y posteriormente la dihidroceramida es oxidada por la dihidroceramida desaturasa para formar ceramida (Fig. 1)3-5.
Figura 1.
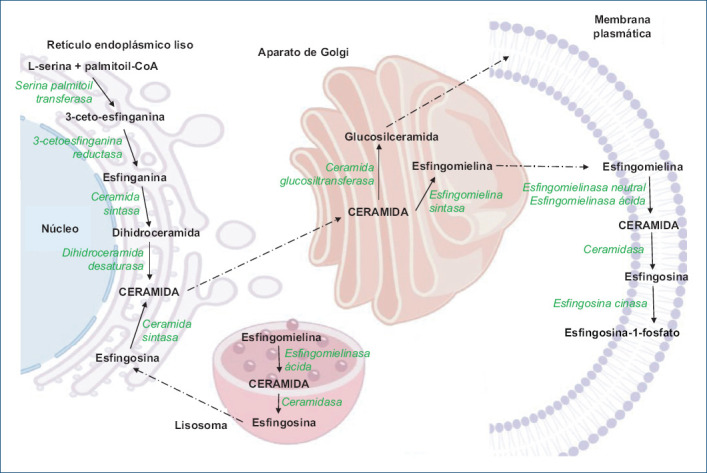
Metabolismo de los esfingolípidos en las células.
La esfingosina que proviene de los lisosomas puede ser utilizada por la ceramida sintasa para formar ceramida. La ceramida que se forma a través de estas dos vías puede ser transportada del retículo endoplásmico liso al aparato de Golgi. En la cara citosólica del aparato de Golgi, la ceramida es glucosilada por la glucosilceramida sintasa para formar glucosilceramida, así como otros glucoesfingolípidos complejos, que posteriormente son transportados en vesículas para incorporarse a las membranas plasmáticas (Fig. 1)3-5.
Por otro lado, en el lumen de los primeros compartimentos del aparato de Golgi, la esfingomielina sintasa utiliza ceramida como substrato para la biosíntesis de esfingomielina. La esfingomielina también será transportada hacia la membrana plasmática. En las membranas plasmáticas, los glucoesfingolipidos y la esfingomielina aparecen organizados en microdominios llamados balsas lipídicas o lipidrafts (Fig. 1)3-5.
Es importante señalar que en las membranas plasmáticas también se localizan las enzimas que participan en el catabolismo de los esfingolípidos. Así, las esfingomielinasas hidrolizan a la esfingomielina y liberan ceramida, la cual es hidrolizada por la ceramidasas y se libera esfingosina, y esta a su vez es fosforilada por la esfingosina cinasa para formar esfingosina-1-fosfato (Fig. 1)3-5.
El catabolismo de los esfingolípidos también se lleva a cabo en los lisosomas. Los glucoesfingolípidos son hidrolizados por las glucosidasas, en tanto que la esfingomielina es hidrolizada por la esfingomielinasa ácida. Ambas reacciones liberan ceramida, la cual es hidrolizada por las ceramidasas para formar esfingosina. La esfingosina es transportada al retículo endoplásmico liso para formar ceramida, reacción que es catalizada por la ceramida sintasa (Fig. 1)3-5.
Como se mencionó anteriormente, en el aparato de Golgi la ceramida puede ser utilizada para la síntesis de glucoesfingolípidos o de esfingomielina; también, en la cara trans del aparato de Golgi, así como en la membrana plasmática, la ceramida puede ser fosforilada por la ceramida cinasa para formar ceramida-1-fosfato (Fig. 1)3-5.
Es importante señalar que la deficiencia de enzimas lisosomales que participan en el metabolismo de los esfingolípidos ocasiona su acumulación y entonces se manifiestan las enfermedades que se mencionan en la tabla 1. Los genes que codifican para estas enzimas siguen un patrón de herencia autosómico recesivo, con excepción de la enfermedad de Fabry, que sigue una herencia ligada al sexo (cromosoma X, locus Xq22)6,7.
Tabla 1.
Enfermedades por deficiencia de enzimas lisosomales que participan en el metabolismo de los esfingolípidos
| Enfermedad | Enzima |
|---|---|
| Enfermedad de Gaucher | Glucocerebrosidasa o β-glucosidasa |
| Niemann-Pick tipos A y B | Esfingomielinasa ácida (aSMasa) |
| Enfermedad de Krabbe | Galactosil ceramidasa |
| Leucodistrofía metacromática | Arilsulfatasa A |
| Enfermedad de Fabry | α-Galactosidasa |
| Enfermedad de Tay-Sachs | Hexosaminidasa A |
| Enfermedad de Sandhoff | Hexosaminidasas A y B |
| Enfermedad de Farber | Ceramidasa ácida |
Los esfingolípidos y sus metabolitos en las enfermedades cardiovasculares, renales y metabólicas
En condiciones fisiológicas, la esfingomielina, así como sus metabolitos (ceramida, esfingosina y esfingosina-1-fosfato), se encuentran presentes en el plasma y en las lipoproteínas8. Sin embargo, se han reportado cambios en la concentración de esfingomielina y de sus metabolitos en el plasma de pacientes con enfermedades cardiovasculares, renales, y metabólicas (Tabla 2)9-27. También, la esfingomielina y sus metabolitos se han determinado en las arterias, el músculo esquelético y cardiaco, y el tejido adiposo de pacientes con obesidad o con enfermedad arterial coronaria (Tabla 3)28-33.
Tabla 2.
Esfingolípidos o sus metabolitos en el plasma de pacientes con enfermedad metabólica, renal o cardiovascular
| Esfingolípido o metabolito | Enfermedad |
|---|---|
| Esfingomielina | Hipercolesterolemia familiar |
| Enfermedad arterial coronaria | |
| Fibrilación auricular | |
| Enfermedad renal y coronaria, | |
| diabetes tipo 1 | |
| Ceramida | Fibrilación auricular |
| Diabetes tipo 2 | |
| Diabetes tipo 1 | |
| Enfermedad renal crónica | |
| Síndrome metabólico | |
| Síndrome coronario agudo | |
| Hipertensión arterial | |
| Isquemia miocárdica | |
| Esfingosina | Diabetes tipo 2 |
| Esfingosina-1-fosfato | Hipertensión arterial |
| Enfermedad arterial coronaria Obesidad | |
| Isquemia-reperfusión (intervención | |
| coronaria percutánea) | |
| Infarto al miocardio |
Tabla 3.
Esfingolípidos o sus metabolitos en los tejidos de pacientes con enfermedad cardiovascular o metabólica
| Esfingolípido o metabolito | Enfermedad |
|---|---|
| Esfingomielina en arterias | Enfermedad arterial coronaria |
| Ceramida en músculo esquelético Ceramida en corazón | Obesidad Enfermedad isquémica cardiaca |
| Ceramida, esfinganina, esfingosina y esfingosina-1-fosfato en tejido adiposo | Obesidad |
Los cambios en el contenido de esfingolípidos, así como de sus metabolitos, en el plasma y los tejidos se pueden deber a cambios en la expresión o la actividad de las enzimas que participan en su metabolismo. Con respecto a la expresión, se ha reportado que en el miocardio de pacientes con sobrepeso u obesidad moderada, con o sin antecedentes de diabetes tipo 2, aumenta la expresión a nivel de ARNm de las enzimas involucradas en la síntesis y la degradación de ceramida, incluidas la serina palmitoiltransferasa, la esfingomielinasa neutra, las ceramidasas y la esfingosina cinasa 1; sin embargo, no se han observado cambios en el contenido de ceramida34. En el tejido adiposo intraabdominal de pacientes con obesidad también se ha encontrado aumentada la expresión de las esfingomielinasas a nivel de ARNm35.
Con respecto a la actividad enzimática, se ha reportado que en el plasma de pacientes con diabetes tipo 2, insuficiencia cardiaca crónica o síndrome coronario agudo se observa un incremento la actividad de la esfingomielinasa ácida21,36,37.
Los esfingolípidos y sus metabolitos posiblemente se acumulan en los tejidos y de esta manera contribuyen en el desarrollo y el mantenimiento de las enfermedades cardiovasculares, renales y metabólicas.
Participación de los esfingolípidos en la apoptosis celular
La apoptosis es un proceso fisiológico que durante el período prenatal y tras el nacimiento contrarresta los efectos de la proliferación celular, lo cual contribuye en el mantenimiento de la masa celular, así como en la arquitectura de los órganos y los tejidos38-44. Los estudios experimentales y clínicos han demostrado que la desregulación de la apoptosis puede contribuir al desarrollo y al mantenimiento de diversas enfermedades cardiovasculares; por ejemplo, un aumento en la apoptosis conduce a atrofia y pérdida de la función de un órgano, mientras que una disminución de la apoptosis conduce a la remodelación del órgano45-56.
Por otro lado, también se ha reportado que la ceramida y la esfingosina regulan el ciclo celular, la diferenciación y la apoptosis, mientras que la esfingosina-1-fosfato promueve la proliferación y la supervivencia e inhibe la apoptosis57-60.
A continuación, se describen las principales vías de señalización celular a través de las cuales la ceramida, la esfingosina y la esfingosina-1-fosfato participan en la regulación de la apoptosis. Estas vías de señalización se han estudiado principalmente en cultivos de líneas celulares de cáncer, lo cual sugiere que algunas vías de señalización pueden estar involucradas en el desarrollo tanto del cáncer como de las enfermedades cardiovasculares.
La ceramida actúa directamente sobre diversas proteínas intracelulares, como la proteína fosfatasa activada por ceramida (CAPP), la proteína cinasa activada por ceramida (CAPK), la proteína cinasa C ς (PKC ς) y la catepsina D61-65. La CAPP cataliza la desfosforilación y con ello la inactivación de PKCα, Akt/PKB y del factor antiapoptótico Bcl-2. La ceramida inhibe Akt a través de PKC ς, y la catepsina D estimula la liberación del citocromo c y la activación de las caspasas 9 y 3 (Fig. 2)66-70.
Figura 2.
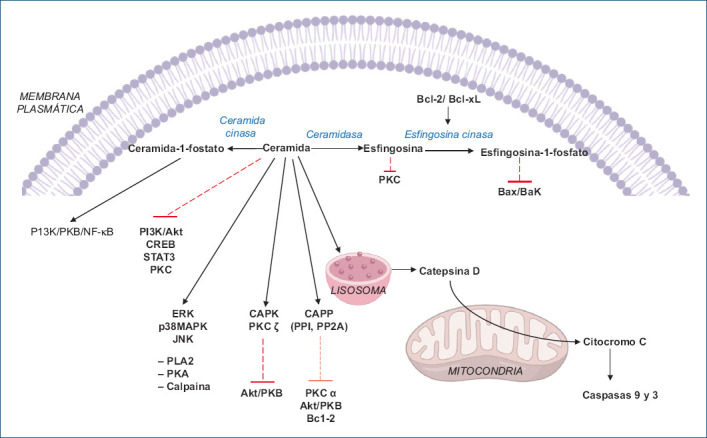
Vías de señalización a través de las cuales la ceramida, la esfingosina y la esfingosina-1-fosfato regulan el proceso de apoptosis. Akt/PKB: proteína cinasa B; Bcl-2: protooncogén B-cell lymphoma 2; CAPK: proteína cinasa activada por ceramida; CAPP: fosfatasas activadas por ceramida; CREB: proteína de unión a elementos de respuesta cAMP; ERK: cinasa de señalización extracelular; ERK: cinasa reguladora de señales extracelulares; JNK: cinasas c-Jun N-terminal; p38MAPK: MAP cinasa p38; PI3K/Akt: fosfatidilinositol-3 cinasa; PKA: proteína cinasa A; PKC α: proteína cinasa C isoforma α; PKC ς: proteína cinasa C isoforma ς; PLA2: fosfolipasa A2; PP1: proteína fosfatasa 1; PP2A: proteína fosfatasa 2A; STAT3: transductor de señal y activador de la transcripción.
La ceramida también puede activar ERK y p38MAPK; puede o no activar JNK; disminuye la activación de P13k/Akt, CREB, STAT3, p21/p53, FAK y PKC; y aumenta la activación de PLA2, PKA y calpaína, lo cual puede conducir a la apoptosis. La comunicación cruzada entre MAPK, PKC y CREB también puede regular la apoptosis inducida por ceramida (Fig. 2)71-80.
Además, Bcl-2/Bcl-xL inhibe la actividad de la ceramida sintasa y de las esfingomielinasas, y también activa a la esfingosina cinasa, y por lo tanto aumenta la esfingosina-1-fosfato, la cual disminuye la expresión y la actividad de Bax/Bak, y así disminuye la apoptosis (Fig. 2)81-83.
La esfingosina es uno de los metabolitos menos estudiados, pero se sabe que inhibe a la proteína cinasa C (PKC) y también regula el Ca++ intracelular. Por otro lado, la ceramida-1-fosfato inhibe la apoptosis, al menos en parte, estimulando la vía PI3-K/PKB/NF-κB y manteniendo la producción del factor Bcl-xL antiapoptótico84.
Considerando lo antes descrito, es necesario realizar estudios enfocados en demostrar si la ceramida, la esfingosina y la esfingosina-1-fosfato participan en la regulación de las vías de señalización de la apoptosis en las enfermedades cardiovasculares, renales y metabólicas, lo cual en un futuro hará posible la intervención y, en algunos casos, la interrupción de la apoptosis.
La esfingomielina y sus metabolitos en la COVID-19
Los pacientes con riesgo cardiovascular, renal y metabólico son especialmente vulnerables para una mayor morbimortalidad cuando sufren la COVID-19 (acrónimo de Coronavirus Disease 2019) causada por el SARS-CoV-2 (Severe Acute Respiratory Syndrome Coronavirus 2)85. Se ha demostrado que, en el epitelio nasal humano, la esfingosina evita la interacción de la proteína spike del SARS-CoV-2 y la enzima convertidora de la angiotensina 2; evidencia que sugiere que la esfingosina podría ser una alternativa terapéutica para prevenir y tratar las infecciones por SARS-CoV-286. Además de la esfingosina, también se propone que los análogos de la esfingosina-1-fosfato, como el FTY720, tendrían un gran potencial en el tratamiento de la COVID-1987,88. En cultivo de células de epitelio nasal humano se ha demostrado que los antidepresivos, como la amitriptilina, inhiben la actividad de la esfingomielinasa ácida, lo cual disminuye la infección por SARS-CoV-289. No obstante, es necesario realizar estudios de preclínica y clínicos para evaluar los efectos terapéuticos y los riesgos de la respuesta a la esfingosina y la esfingosina-1-fosfato, así como la inhibición de la esfingomielinasa ácida en pacientes con enfermedades cardiovasculares, diabetes y obesidad, ya que estas constituyen la comorbilidad más prevalente en los pacientes con COVID-19.
Métodos para el estudio de los esfingolípidos y sus metabolitos
Para el estudio de los esfingolípidos y de sus metabolitos se requieren técnicas que permitan su aislamiento, análisis y cuantificación. Para la detección y la cuantificación de los esfingolípidos se han descrito métodos como los ensayos a través de la diacilglicerol cinasa o la cromatografía en capa fina, pero son técnicas poco utilizadas. Actualmente, técnicas como la cromatografía de gases o la cromatografía líquida de alta eficacia (HPLC, High Performance Liquid Chromatography) permiten una mejor separación e identificación de estas moléculas, a través de los tiempos de retención. Por otra parte, si el cromatógrafo de gases o líquidos está acoplado a un espectrómetro de masas (MS), este último permitirá la identificación y la cuantificación de los esfingolípidos y sus metabolitos, a través de su masa y carga (m/z). Estos resultados son corroborados a través de estándares que pueden ser analizados dentro de unas bases de datos. Finalmente, si el análisis se desea hacer con mayor profundidad puede desarrollarse un análisis de fragmentación de las moléculas analizadas dentro del espectrómetro de masas, o también llamado MS2, que en conjunto con las técnicas anteriores no solo proporciona los tiempos de retención, la masa y la carga, sino también su espectro de fragmentación90-95.
La microcopía de alta resolución (STED-Microscopy, Stimulated Emission Depletion-Microscopy) es otra de las técnicas que en los últimos años nos ha acercado a tener un dato visual del tipo y de la interacción de los lípidos de la membrana celular96-99.
Otras de las técnicas utilizadas para identificar cambios en los esfingolípidos y sus metabolitos en la membrana celular son la microscopía de fluorescencia y la citometría de flujo. Estas permiten identificar y cuantificar algunos lípidos mediante el uso de anticuerpos monoclonales o de colorantes fluorescentes100-102. Recientemente reportamos que con la técnica de ELISA (Enzyme-Linked-Immunosorbent Assay) es posible determinar la concentración de ceramida, esfingosina y esfingosina-1-fosfato en plasma y tejidos103, lo cual permitirá en un futuro aplicarlo en la clínica.
Conclusiones
Se ha sugerido que la esfingomielina, así como sus metabolitos, podrían ser biomarcadores potencialmente útiles en la clínica para el diagnóstico, el pronóstico y el tratamiento de las enfermedades cardiovasculares, renales y metabólicas, aunque aún existen limitaciones para su validez. Por esta razón, es importante realizar estudios preclínicos enfocados en comprender el metabolismo de los esfingolípidos, incluyendo a las enzimas que participan en este proceso, lo cual permitirá explicar los cambios en la concentración de esfingomielina y de sus metabolitos en el plasma, así como su contenido en algunos tejidos. Además, es necesario estudiar el o los mecanismos a través de los cuales los esfingolípidos y sus metabolitos contribuyen en la fisiopatología de las enfermedades cardiovasculares, lo cual nos permitirá proponer alternativas farmacológicas en el tratamiento de las enfermedades cardiovasculares, renales y metabólicas.
Financiamiento
Se agradece al «Proyecto apoyado por el Fondo Sectorial de Investigación para la Educación», CONACyT A1-S-9870, que se otorgó a Rocío Bautista-Pérez.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Bibliografía
- 1.Hannun YA, Obeid LM. Principles of bioactive lipid signalling:lessons from sphingolipids. Nat Rev Mol Cell Biol. 2008;9:139–50. doi: 10.1038/nrm2329. [DOI] [PubMed] [Google Scholar]
- 2.Slotte JP. Biological functions of sphingomyelins. Prog Lipid Res. 2013;52:424–37. doi: 10.1016/j.plipres.2013.05.001. [DOI] [PubMed] [Google Scholar]
- 3.Hannun YA, Obeid LM. Sphingolipids and their metabolism in physiology and disease. Nat Rev Mol Cell Biol. 2018;19:175–91. doi: 10.1038/nrm.2017.107. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Futerman AH, Riezman H. The ins and outs of sphingolipid synthesis. Trends Cell Biol. 2005;15:312–8. doi: 10.1016/j.tcb.2005.04.006. [DOI] [PubMed] [Google Scholar]
- 5.Tidhar R, Futerman AH. The complexity of sphingolipid biosynthesis in the endoplasmic reticulum. Biochim Biophys Acta. 2013;1833:2511–8. doi: 10.1016/j.bbamcr.2013.04.010. [DOI] [PubMed] [Google Scholar]
- 6.Ozbayraktar FB, Ulgen KO. Molecular facets of sphingolipids:mediators of diseases. Biotechnol J. 2009;4:1028–41. doi: 10.1002/biot.200800322. [DOI] [PubMed] [Google Scholar]
- 7.Ferreira CR, Gahl WA. Lysosomal storage diseases. Transl Sci Rare Dis. 2017;2:1–71. doi: 10.3233/TRD-160005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Hammad SM, Pierce JS, Soodavar F, Smith KJ, Al Gadban MM, Rembiesa B, et al. Blood sphingolipidomics in healthy humans:impact of sample collection methodology. J Lipid Res. 2010;51:3074–87. doi: 10.1194/jlr.D008532. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Noel C, Marcel YL, Davignon J. Plasma phospholipids in the different types of primary hyperlipoproteinemia. J Lab Clin Med. 1972;79:611–2. [PubMed] [Google Scholar]
- 10.Jiang XC, Paultre F, Pearson TA, Reed RG, Francis CK, Lin M, et al. Plasma sphingomyelin level as a risk factor for coronary artery disease. Arterioscler Thromb Vasc Biol. 2000;20:2614–8. doi: 10.1161/01.atv.20.12.2614. [DOI] [PubMed] [Google Scholar]
- 11.Schlitt A, Blankenberg S, Yan D, von Gizycki H, Buerke M, Werdan K, et al. Further evaluation of plasma sphingomyelin levels as a risk factor for coronary artery disease. Nutr Metab (Lond) 2006;3:5. doi: 10.1186/1743-7075-3-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Jensen PN, Fretts AM, Hoofnagle AN, Sitlani CM, McKnight B, King IB, et al. Plasma ceramides and sphingomyelins in relation to atrial fibrillation risk:the Cardiovascular Health Study. J Am Heart Assoc. 2020;9:e012853. doi: 10.1161/JAHA.119.012853. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Pongrac Barlovic D, Harjutsalo V, Sandholm N, Forsblom C, Groop PH FinnDiane Study Group. Sphingomyelin and progression of renal and coronary heart disease in individuals with type 1 diabetes. Diabetologia. 2020;63:1847–56. doi: 10.1007/s00125-020-05201-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Gorska M, Dobrzyn A, Baranowski M. Concentrations of sphingosine and sphinganine in plasma of patients with type 2 diabetes. Med Sci Monit. 2005;11:CR35–8. [PubMed] [Google Scholar]
- 15.Haus JM, Kashyap SR, Kasumov T, Zhang R, Kelly KR, Defronzo RA, et al. Plasma ceramides are elevated in obese subjects with type 2 diabetes and correlate with the severity of insulin resistance. Diabetes. 2009;58:337–43. doi: 10.2337/db08-1228. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Lopez X, Goldfine AB, Holland WL, Gordillo R, Scherer PE. Plasma ceramides are elevated in female children and adolescents with type 2 diabetes. J Pediatr Endocrinol Metab. 2013;26:995–8. doi: 10.1515/jpem-2012-0407. [DOI] [PubMed] [Google Scholar]
- 17.Boon J, Hoy AJ, Stark R, Brown RD, Meex RC, Henstridge DC, et al. Ceramides contained in LDL are elevated in type 2 diabetes and promote inflammation and skeletal muscle insulin resistance. Diabetes. 2013;62:401–10. doi: 10.2337/db12-0686. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Klein RL, Hammad SM, Baker NL, Hunt KJ, Al Gadban MM, Cleary PA, et al. DCCT/EDIC Research Group. Decreased plasma levels of select very long chain ceramide species are associated with the development of nephropathy in type 1 diabetes. Metabolism. 2014;63:1287–95. doi: 10.1016/j.metabol.2014.07.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Mitsnefes M, Scherer PE, Friedman LA, Gordillo R, Furth S, Warady BA CKiD Study Group. Ceramides and cardiac function in children with chronic kidney disease. Pediatr Nephrol. 2014;29:415–22. doi: 10.1007/s00467-013-2642-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Warshauer JT, Lopez X, Gordillo R, Hicks J, Holland WL, Anuwe E, et al. Effect of pioglitazone on plasma ceramides in adults with metabolic syndrome. Diabetes Metab Res Rev. 2015;31:734–44. doi: 10.1002/dmrr.2662. [DOI] [PubMed] [Google Scholar]
- 21.Pan W, Yu J, Shi R, Yan L, Yang T, Li Y, et al. Elevation of ceramide and activation of secretory acid sphingomyelinase in patients with acute coronary syndromes. Coron Artery Dis. 2014;25:230–5. doi: 10.1097/MCA.0000000000000079. [DOI] [PubMed] [Google Scholar]
- 22.Spijkers LJ, van den Akker RF, Janssen BJ, Debets JJ, De Mey JG, Stroes ES, et al. Hypertension is associated with marked alterations in sphingolipid biology:a potential role for ceramide. PLoS One. 2011;6:e21817. doi: 10.1371/journal.pone.0021817. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Klevstig M, Ståhlman M, Lundqvist A, Scharin Täng M, Fogelstrand P, Adiels M, et al. Targeting acid sphingomyelinase reduces cardiac ceramide accumulation in the post-ischemic heart. J Mol Cell Cardiol. 2016;93:69–72. doi: 10.1016/j.yjmcc.2016.02.019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Deutschman DH, Carstens JS, Klepper RL, Smith WS, Page MT, Young TR, et al. Predicting obstructive coronary artery disease with serum sphingosine-1-phosphate. Am Heart J. 2003;146:62–8. doi: 10.1016/S0002-8703(03)00118-2. [DOI] [PubMed] [Google Scholar]
- 25.Kowalski GM, Carey AL, Selathurai A, Kingwell BA, Bruce CR. Plasma sphingosine-1-phosphate is elevated in obesity. PLoS One. 2013;8:e72449. doi: 10.1371/journal.pone.0072449. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Egom EE, Mamas MA, Chacko S, Stringer SE, Charlton-Menys V, El-Omar M, et al. Serum sphingolipids level as a novel potential marker for early detection of human myocardial ischaemic injury. Front Physiol. 2013;4:130. doi: 10.3389/fphys.2013.00130. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Knapp M, Baranowski M, Czarnowski D, Lisowska A, Zabielski P, Górski J, et al. Plasma sphingosine-1-phosphate concentration is reduced in patients with myocardial infarction. Med Sci Monit. 2009;15:CR490–3. [PubMed] [Google Scholar]
- 28.Kummerow FA, Cook LS, Wasowicz E, Jelen H. Changes in the phospholipid composition of the arterial cell can result in severe atherosclerotic lesions. J Nutr Biochem. 2001;12:602–7. doi: 10.1016/s0955-2863(01)00181-4. [DOI] [PubMed] [Google Scholar]
- 29.Adams JM, Pratipanawatr T, Berria R, Wang E, De Fronzo RA, Sullards MC, et al. Ceramide content is increased in skeletal muscle from obese insulin-resistant humans. Diabetes. 2004;53:25–31. doi: 10.2337/diabetes.53.1.25. [DOI] [PubMed] [Google Scholar]
- 30.Straczkowski M, Kowalska I, Nikolajuk A, Dzienis-Straczkowska S, Kinalska I, Baranowski M, et al. Relationship between insulin sensitivity and sphingomyelin signaling pathway in human skeletal muscle. Diabetes. 2004;53:1215–21. doi: 10.2337/diabetes.53.5.1215. [DOI] [PubMed] [Google Scholar]
- 31.de la Maza MP, Rodriguez JM, Hirsch S, Leiva L, Barrera G, Bunout D. Skeletal muscle ceramide species in men with abdominal obesity. J Nutr Health Aging. 2015;19:389–96. doi: 10.1007/s12603-014-0548-7. [DOI] [PubMed] [Google Scholar]
- 32.Klevstig M, Ståhlman M, Lundqvist A, Scharin Täng M, Fogelstrand P, Adiels M, et al. Targeting acid sphingomyelinase reduces cardiac ceramide accumulation in the post-ischemic heart. J Mol Cell Cardiol. 2016;93:69–72. doi: 10.1016/j.yjmcc.2016.02.019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Blachnio-Zabielska AU, Koutsari C, Tchkonia T, Jensen MD. Sphingolipid content of human adipose tissue:relationship to adiponectin and insulin resistance. Obesity (Silver Spring) 2012;20:2341–7. doi: 10.1038/oby.2012.126. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Baranowski M, Blachnio-Zabielska A, Hirnle T, Harasiuk D, Matlak K, Knapp M, et al. Myocardium of type 2 diabetic and obese patients is characterized by alterations in sphingolipid metabolic enzymes but not by accumulation of ceramide. J Lipid Res. 2010;51:74–80. doi: 10.1194/jlr.M900002-JLR200. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Kolak M, Gertow J, Westerbacka J, Summers SA, Liska J, Franco-Cereceda A, et al. Expression of ceramide-metabolizing enzymes in subcutaneous and intra-abdominal human adipose tissue. Lipids Health Dis. 2012;11:115. doi: 10.1186/1476-511X-11-115. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Gorska M, Baranczuk E, Dobrzyn A. Secretory Zn2-dependent sphingomyelinase activity in the serum of patients with type 2 diabetes is elevated. Horm Metab Res. 2003;35:506–7. doi: 10.1055/s-2003-41810. [DOI] [PubMed] [Google Scholar]
- 37.Doehner W, Bunck AC, Rauchhaus M, von Haehling S, Brunkhorst FM, Cicoira M, et al. Secretory sphingomyelinase is upregulated in chronic heart failure:a second messenger system of immune activation relates to body composition, muscular functional capacity, and peripheral blood flow. Eur Heart J. 2007;28:821–8. doi: 10.1093/eurheartj/ehl541. [DOI] [PubMed] [Google Scholar]
- 38.James TN. Normal and abnormal consequences of apoptosis in the human heart. From postnatal morphogenesis to paroxysmal arrhythmias. Circulation. 1994;90:556–73. [PubMed] [Google Scholar]
- 39.Bitar FF, Bitar H, El Sabban M, Nasser M, Yunis KA, Tawil A, et al. Modulation of ceramide content and lack of apoptosis in the chronically hypoxic neonatal rat heart. Pediatr Res. 2002;51:144–9. doi: 10.1203/00006450-200202000-00005. [DOI] [PubMed] [Google Scholar]
- 40.Matturri L, Ottaviani G, Lavezzi AM, Turconi P, Cazzullo A, Rossi L. Expression of apoptosis and proliferating cell nuclear antigen (PCNA) in the cardiac conduction system of crib death (SIDS) Adv Clin Path. 2001;5:79–86. [PubMed] [Google Scholar]
- 41.Kang PM, Yue P, Izumo S. New insights into the role of apoptosis in cardiovascular disease. Circ J. 2002;66:1–9. doi: 10.1253/circj.66.1. [DOI] [PubMed] [Google Scholar]
- 42.Bialostozky D, Rodríguez-Diez G, Zazueta Detección de apoptosis en enfermedades cardiovasculares mediante las imágenes SPECT de cardiología nuclear. Arch Cardiol Mex. 2008;78:217–28. [PubMed] [Google Scholar]
- 43.Lee Y, Gustafsson AB. Role of apoptosis in cardiovascular disease. Apoptosis. 2009;14:536–48. doi: 10.1007/s10495-008-0302-x. [DOI] [PubMed] [Google Scholar]
- 44.Dong Y, Chen H, Gao J, Liu Y, Li J, Wang J. Molecular machinery and interplay of apoptosis and autophagy in coronary heart disease. J Mol Cell Cardiol. 2019;136:27–41. doi: 10.1016/j.yjmcc.2019.09.001. [DOI] [PubMed] [Google Scholar]
- 45.Narula J, Haider N, Virmani R, DiSalvo TG, Kolodgie FD, Hajjar RJ, et al. Apoptosis in myocytes in end-stage heart failure. N Engl J Med. 1996;335:1182–9. doi: 10.1056/NEJM199610173351603. [DOI] [PubMed] [Google Scholar]
- 46.Misao J, Hayakawa Y, Ohno M, Kato S, Fujiwara T, Fujiwara H. Expression of bcl-2 protein, an inhibitor of apoptosis, and Bax, an accelerator of apoptosis, in ventricular myocytes of human hearts with myocardial infarction. Circulation. 1996;94:1506–12. doi: 10.1161/01.cir.94.7.1506. [DOI] [PubMed] [Google Scholar]
- 47.Elsässer A, Suzuki K, Schaper J. Unresolved issues regarding the role of apoptosis in the pathogenesis of ischemic injury and heart failure. J Mol Cell Cardiol. 2000;32:711–24. doi: 10.1006/jmcc.2000.1125. [DOI] [PubMed] [Google Scholar]
- 48.Chen Y. Expression of bcl-2 and Bax protein in the failing human heart-an inhibitor or accelerator of apoptosis? Fa Yi Xue Za Zhi. 2000;16:10–1. [PubMed] [Google Scholar]
- 49.Suzuki K, Kostin S, Person V, Elsässer A, Schaper J. Time course of the apoptotic cascade and effects of caspase inhibitors in adult rat ventricular cardiomyocytes. J Mol Cell Cardiol. 2001;33:983–94. doi: 10.1006/jmcc.2001.1364. [DOI] [PubMed] [Google Scholar]
- 50.Yang YJ, Chen YF, Ruan YM, Chen X, Zhang HD, Tian Y, et al. Beneficial effects of carvedilol on cardiomyocyte apoptosis and bcl-2/bax expression after acute myocardial infarction an experiment with rats. Zhonghua Yi Xue Za Zhi. 2006;86:919–22. [PubMed] [Google Scholar]
- 51.Kossmehl P, Kurth E, Faramarzi S, Habighorst B, Shakibaei M, Wehland M, et al. Mechanisms of apoptosis after ischemia and reperfusion:role of the renin-angiotensin system. Apoptosis. 2006;11:347–58. doi: 10.1007/s10495-006-4350-9. [DOI] [PubMed] [Google Scholar]
- 52.Kang S, Yang YJ, Wu YL, Chen YT, Li L, Tian Y. Myocardium and microvessel endothelium apoptosis at day 7 following reperfused acute myocardial infarction. Microvasc Res. 2010;79:70–9. doi: 10.1016/j.mvr.2009.11.003. [DOI] [PubMed] [Google Scholar]
- 53.Song XJ, Yang CY, Liu B, Wei Q, Korkor MT, Liu JY, et al. Atorvastatin inhibits myocardial cell apoptosis in a rat model with post-myocardial infarction heart failure by downregulating ER stress response. Int J Med Sci. 2011;8:564–72. doi: 10.7150/ijms.8.564. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Chen TL, Zhu GL, He XL, Wang JA, Wang Y, Qi GA. Short-term pretreatment with atorvastatin attenuates left ventricular dysfunction, reduces infarct size and apoptosis in acute myocardial infarction rats. Int J Clin Exp Med. 2014;7:4799–808. [PMC free article] [PubMed] [Google Scholar]
- 55.Ahmad F, Lal H, Zhou J, Vagnozzi RJ, Yu JE, Shang X, et al. Cardiomyocyte-specific deletion of Gsk3? mitigates post-myocardial infarction remodeling, contractile dysfunction, and heart failure. J Am Coll Cardiol. 2014;64:696–706. doi: 10.1016/j.jacc.2014.04.068. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Zhang Q, Lu L, Liang T, Liu M, Wang ZL, Zhang PY. MAPK pathway regulated the cardiomyocyte apoptosis in mice with post-infarction heart failure. Bratisl Lek Listy. 2017;118:339–46. doi: 10.4149/BLL_2017_065. [DOI] [PubMed] [Google Scholar]
- 57.Jayadev S, Liu B, Bielawska AE, Lee JY, Nazaire F, Pushkareva MY, et al. Role for ceramide in cell cycle arrest. J Biol Chem. 1995;270:2047–52. doi: 10.1074/jbc.270.5.2047. [DOI] [PubMed] [Google Scholar]
- 58.Van Brocklyn JR, Lee MJ, Menzeleev R, Olivera A, Edsall L, Cuvillier O, et al. Dual actions of sphingosine-1-phosphate:extracellular through the Gi-coupled receptor Edg-1 and intracellular to regulate proliferation and survival. J Cell Biol. 1998;142:229–40. doi: 10.1083/jcb.142.1.229. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Olivera A, Kohama T, Edsall L, Nava V, Cuvillier O, Poulton S, et al. Sphingosine kinase expression increases intracellular sphingosine-1-phosphate and promotes cell growth and survival. J Cell Biol. 1999;147:545–58. doi: 10.1083/jcb.147.3.545. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Castillo SS, Teegarden D. Sphingosine-1-phosphate inhibition of apoptosis requires mitogen-activated protein kinase phosphatase-1 in mouse fibroblast C3H10T 1/2 cells. J Nutr. 2003;133:3343–9. doi: 10.1093/jn/133.11.3343. [DOI] [PubMed] [Google Scholar]
- 61.Chalfant CE, Szulc Z, Roddy P, Bielawska A, Hannun YA. The structural requirements for ceramide activation of serine-threonine protein phosphatases. J Lipid Res. 2004;45:496–506. doi: 10.1194/jlr.M300347-JLR200. [DOI] [PubMed] [Google Scholar]
- 62.Corda S, Laplace C, Vicaut E, Duranteau J. Rapid reactive oxygen species production by mitochondria in endothelial cells exposed to tumor necrosis factor-alpha is mediated by ceramide. Am J Respir Cell Mol Biol. 2001;24:762–8. doi: 10.1165/ajrcmb.24.6.4228. [DOI] [PubMed] [Google Scholar]
- 63.Bourbon NA, Yun J, Kester M. Ceramide directly activates protein kinase C zeta to regulate a stress-activated protein kinase signaling complex. J Biol Chem. 2000;275:35617–23. doi: 10.1074/jbc.M007346200. [DOI] [PubMed] [Google Scholar]
- 64.Fox TE, Houck KL, O'Neill SM, Nagarajan M, Stover TC, Pomianowski PT, et al. Ceramide recruits and activates protein kinase C zeta (PKC zeta) within structured membrane microdomains. J Biol Chem. 2007;282:1 2450–7. doi: 10.1074/jbc.M700082200. [DOI] [PubMed] [Google Scholar]
- 65.Heinrich M, Wickel M, Winoto-Morbach S, Schneider-Brachert W, Weber T, Brunner J, et al. Ceramide as an activator lipid of cathepsin D. Adv Exp Med Biol. 2000;477:305–15. doi: 10.1007/0-306-46826-3_33. [DOI] [PubMed] [Google Scholar]
- 66.Lee JY, Hannun YA, Obeid LM. Ceramide inactivates cellular protein kinase C alpha. J Biol Chem. 1996;271:13169–74. doi: 10.1074/jbc.271.22.13169. [DOI] [PubMed] [Google Scholar]
- 67.Bourbon NA, Sandirasegarane L, Kester M. Ceramide-induced inhibition of Akt is mediated through protein kinase C zeta:implications for growth arrest. J Biol Chem. 2002;277:3286–92. doi: 10.1074/jbc.M110541200. [DOI] [PubMed] [Google Scholar]
- 68.El-Assaad W, El-Sabban M, Awaraji C, Abboushi N, Dbaibo GS. Distinct sites of action of Bcl-2 and Bcl-xL in the ceramide pathway of apoptosis. Biochem J. 1998;336:735–41. doi: 10.1042/bj3360735. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.Yuan H, Williams SD, Adachi S, Oltersdorf T, Gottlieb RA. Cytochrome c dissociation and release from mitochondria by truncated Bid and ceramide. Mitochondrion. 2003;2:237–44. doi: 10.1016/S1567-7249(02)00106-X. [DOI] [PubMed] [Google Scholar]
- 70.Miñano A, Caballero-Benítez A, Lluch M, Morán J, Rodríguez-Alvarez J. C2-ceramide mediates cerebellar granule cells apoptosis by activation of caspases-2, -9, and -3. J Neurosci Res. 2008;86:1734–47. doi: 10.1002/jnr.21633. [DOI] [PubMed] [Google Scholar]
- 71.Iwayama H, Ueda N. Role of mitochondrial Bax, caspases, and MAPKs for ceramide-induced apoptosis in renal proximal tubular cells. Mol Cell Biochem. 2013;379:37–42. doi: 10.1007/s11010-013-1624-8. [DOI] [PubMed] [Google Scholar]
- 72.Yabu T, Shiba H, Shibasaki Y, Nakanishi T, Imamura S, Touhata K, et al. Stress-induced ceramide generation and apoptosis via the phosphorylation and activation of nSMase1 by JNK signaling. Cell Death Differ. 2015;22:258–73. doi: 10.1038/cdd.2014.128. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.Itoh Y, Yano T, Sendo T, Sueyasu M, Hirano K, Kanaide H, et al. Involvement of de novo ceramide synthesis in radiocontrast-induced renal tubular cell injury. Kidney Int. 2006;69:288–97. doi: 10.1038/sj.ki.5000057. [DOI] [PubMed] [Google Scholar]
- 74.Xuan L, Han F, Gong L, Lv Y, Wan Z, Liu H, et al. Ceramide induces MMP-9 expression through JAK2/STAT3 pathway in airway epithelium. Lipids Health Dis. 2020;19:196. doi: 10.1186/s12944-020-01373-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 75.Fekry B, Jeffries KA, Esmaeilniakooshkghazi A, Szulc ZM, Knagge KJ, Kirchner DR, et al. C16-ceramide is a natural regulatory ligand of p53 in cellular stress response. Nat Commun. 2018;9:4149. doi: 10.1038/s41467-018-06650-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 76.Xu R, García-Barros M, Wen S, Li F, Lin CL, Hannun YA, et al. Tumor suppressor p53 links ceramide metabolism to DNA damage response through alkaline ceramidase 2. Cell Death Differ. 2018;25:841–56. doi: 10.1038/s41418-017-0018-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77.Park SS, Kim MO, Yun SP, Ryu JM, Park JH, Seo BN, et al. C (16)-Ceramide-induced F-actin regulation stimulates mouse embryonic stem cell migration:involvement of N-WASP/Cdc42/Arp2/3 complex and cofilin-1/?-actinin. Biochim Biophys Acta. 2013;1831:350–60. doi: 10.1016/j.bbalip.2012.09.005. [DOI] [PubMed] [Google Scholar]
- 78.Jiang X, Zhu Z, Qin H, Tripathi P, Zhong L, Elsherbini A, et al. Visualization of ceramide-associated proteins in ceramide-rich platforms using a cross-linkable ceramide analog and proximity ligation assays with anti-ceramide antibody. Front Cell Dev Biol. 2019;7:166. doi: 10.3389/fcell.2019.00166. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.Cabral LM, Wengert M, Almeida FG, Caruso-Neves C, Vieyra A, Einicker-Lamas M. Ceramide-activated protein kinases A and C zeta inhibit kidney proximal tubule cell Na(+)-ATPase. Arch Biochem Biophys. 2010;498:57–61. doi: 10.1016/j.abb.2010.04.004. [DOI] [PubMed] [Google Scholar]
- 80.Ma JQ, Liu CM, Yang W. Protective effect of rutin against carbon tetrachloride-induced oxidative stress, inflammation and apoptosis in mouse kidney associated with the ceramide, MAPKs, p53 and calpain activities. Chem Biol Interact. 2018;286:26–33. doi: 10.1016/j.cbi.2018.03.003. [DOI] [PubMed] [Google Scholar]
- 81.Zhang J, Alter N, Reed JC, Borner C, Obeid LM, Hannun YA. Bcl-2 interrupts the ceramide-mediated pathway of cell death. Proc Natl Acad Sci U S A. 1996;93:5325–8. doi: 10.1073/pnas.93.11.5325. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 82.Sawada M, Nakashima S, Banno Y, Yamakawa H, Takenaka K, Shinoda J, et al. Influence of Bax or Bcl-2 overexpression on the ceramide-dependent apoptotic pathway in glioma cells. Oncogene. 2000;19:3508–20. doi: 10.1038/sj.onc.1203699. [DOI] [PubMed] [Google Scholar]
- 83.Bektas M, Jolly PS, Müller C, Eberle J, Spiegel S, Geilen CC. Sphingosine kinase activity counteracts ceramide-mediated cell death in human melanoma cells:role of Bcl-2 expression. Oncogene. 2005;24:178–87. doi: 10.1038/sj.onc.1208019. [DOI] [PubMed] [Google Scholar]
- 84.Gómez-Muñoz A, Kong JY, Parhar K, Wang SW, Gangoiti P, González M, et al. Ceramide-1-phosphate promotes cell survival through activation of the phosphatidylinositol 3-kinase/protein kinase B pathway. FEBS Lett. 2005;579:3744–50. doi: 10.1016/j.febslet.2005.05.067. [DOI] [PubMed] [Google Scholar]
- 85.Zheng YY, Ma YT, Zhang JY, Xie X. COVID-19 and the cardiovascular system. Nat Rev Cardiol. 2020;17:259–60. doi: 10.1038/s41569-020-0360-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 86.Edwards MJ, Becker KA, Gripp B, Hoffmann M, Keitsch S, Wilker B, et al. Sphingosine prevents binding of SARS-CoV-2 spike to its cellular receptor ACE2. J Biol Chem. 2020;295:15174–82. doi: 10.1074/jbc.RA120.015249. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 87.Amraei R, Rahimi N. COVID-19, renin-angiotensin system and endothelial dysfunction. Cells. 2020;9:1652. doi: 10.3390/cells9071652. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 88.Pan Y, Gao F, Zhao S, Han J, Chen F. Role of the SphK-S1P-S1PRs pathway in invasion of the nervous system by SARS-CoV-2 infection. Clin Exp Pharmacol Physiol. 2021;48:637–50. doi: 10.1111/1440-1681.13483. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 89.Carpinteiro A, Edwards MJ, Hoffmann M, Kochs G, Gripp B, Weigang S, et al. Pharmacological inhibition of acid sphingomyelinase prevents uptake of SARS-CoV-2 by epithelial cells. Cell Rep Med. 2020;1:100142. doi: 10.1016/j.xcrm.2020.100142. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 90.Hartler J, Armando AM, Trötzmüller M, Dennis EA, Köfeler HC, Quehenberger O. Automated annotation of sphingolipids including accurate identification of hydroxylation sites using MSn data. Anal Chem. 2020;92:14054–62. doi: 10.1021/acs.analchem.0c03016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 91.Haynes CA, Allegood JC, Park H, Sullards MC. Sphingolipidomics:methods for the comprehensive analysis of sphingolipids. J Chromatogr B Analyt Technol Biomed Life Sci. 2009;877:2696–708. doi: 10.1016/j.jchromb.2008.12.057. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 92.Polito AJ, Akita T, Sweeley CC. Gas chromatography and mass spectrometry of sphingolipid bases. Characterization of sphinga-4,14-dienine from plasma sphingomyelin. Biochemistry. 1968;7:2609–14. doi: 10.1021/bi00847a024. [DOI] [PubMed] [Google Scholar]
- 93.Singh A, Del Poeta M. Sphingolipidomics:an important mechanistic tool for studying fungal pathogens. Front Microbiol. 2016;7:501. doi: 10.3389/fmicb.2016.00501. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 94.Snider JM, Luberto C, Hannun YA. Approaches for probing and evaluating mammalian sphingolipid metabolism. Anal Biochem. 2019;575:70–86. doi: 10.1016/j.ab.2019.03.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 95.Wigger D, Gulbins E, Kleuser B, Schumacher F. Monitoring the sphingolipid de novo synthesis by stable-isotope labeling and liquid chromatography-mass spectrometry. Front Cell Dev Biol. 2019;7:210. doi: 10.3389/fcell.2019.00210. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 96.Schneider F, Waithe D, Porsmose CM, Galiani S, Koller T, Ozhan G, et al. STED-FCS reveals diffusional heterogeneity of lipids and GPI-anchored proteins in the plasma membrane and actin cytoskeleton free plasma membrane vesicles. Biophysical Journal. 2018;114:99a. [Google Scholar]
- 97.Schlegel J, Sauer M. Superresolution microscopy of sphingolipids. Methods Mol Biol. 2021;2187:303–11. doi: 10.1007/978-1-0716-0814-2_17. [DOI] [PubMed] [Google Scholar]
- 98.de Souza N. Watching single lipids move. Nat Methods. 2010;7:428. doi: 10.1038/nmeth0610-428. [DOI] [PubMed] [Google Scholar]
- 99.Honigmann A, Mueller V, Ta H, Schoenle A, Sezgin E, Hell SW, et al. Scanning STED-FCS reveals spatiotemporal heterogeneity of lipid interaction in the plasma membrane of living cells. Nat Commun. 2014;5:5412. doi: 10.1038/ncomms6412. [DOI] [PubMed] [Google Scholar]
- 100.Chen Y, Qin J, Chen ZW. Fluorescence-topographic NSOM directly visualizes peak-valley polarities of GM1/GM3 rafts in cell membrane fluctuations. J Lipid Res. 2008;49:2268–75. doi: 10.1194/jlr.D800031-JLR200. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 101.Eich C, Manzo C, de Keijzer S, Bakker GJ, Reinieren-Beeren I, García-Parajo MF, et al. Changes in membrane sphingolipid composition modulate dynamics and adhesion of integrin nanoclusters. Sci Rep. 2016;6:20693. doi: 10.1038/srep20693. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 102.van den Bogaart G, Meyenberg K, Risselada HJ, Amin H, Willig KI, Hubrich BE, et al. Membrane protein sequestering by ionic protein-lipid interactions. Nature. 2011;479:552–5. doi: 10.1038/nature10545. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 103.Pérez-Villavicencio R, Flores-Estrada J, Franco M, Escalante B, Pérez-Méndez O, Mercado A, et al. Effect of empagliflozin on sphingolipid catabolism in diabetic and hypertensive rats. Int J Mol Sci. 2022;23:2883. doi: 10.3390/ijms23052883. [DOI] [PMC free article] [PubMed] [Google Scholar]


