Abstract
高血压是危害人类健康的首要疾病,方便准确的血压测量方法将有助于高血压的防控。本文提出了一种基于面部视频信号的连续血压测量方法。采用颜色失真滤波与独立成分分析法提取面部视频信号中感兴趣区域的视频脉搏波,基于时频域以及生理学原理对脉搏波进行多维特征提取;设计了一种集成特征选择方法提取具有通用性的最优特征子集;比较基于粒子群优化的Elman神经网络、支持向量机与深度信念网络所建立的单人血压测量模型;采用支持向量回归算法构建通用血压预测模型,并与真实血压值进行比较与评价。实验结果表明:基于面部视频的血压测量结果与标准血压值具有较好的一致性,由视频估计出的收缩压与标准收缩压的平均绝对误差(MAE)为4.9 mm Hg,标准差(STD)为5.9 mm Hg;舒张压的MAE为4.6 mm Hg,STD为5.0 mm Hg,符合AAMI标准。本文所提出的基于视频流的非接触式血压检测方法可以用于血压的测量。
Keywords: 连续血压测量, 独立成分分析, 特征筛选, 机器学习, 支持向量机
Abstract
Hypertension is the primary disease that endangers human health. A convenient and accurate blood pressure measurement method can help to prevent the hypertension. This paper proposed a continuous blood pressure measurement method based on facial video signal. Firstly, color distortion filtering and independent component analysis were used to extract the video pulse wave of the region of interest in the facial video signal, and the multi-dimensional feature extraction of the pulse wave was preformed based on the time-frequency domain and physiological principles; Secondly, an integrated feature selection method was designed to extract the universal optimal feature subset; After that, we compared the single person blood pressure measurement models established by Elman neural network based on particle swarm optimization, support vector machine (SVM) and deep belief network; Finally, we used SVM algorithm to build a general blood pressure prediction model, which was compared and evaluated with the real blood pressure value. The experimental results showed that the blood pressure measurement results based on facial video were in good agreement with the standard blood pressure values. Comparing the estimated blood pressure from the video with standard blood pressure value, the mean absolute error (MAE) of systolic blood pressure was 4.9 mm Hg with a standard deviation (STD) of 5.9 mm Hg, and the MAE of diastolic blood pressure was 4.6 mm Hg with a STD of 5.0 mm Hg, which met the AAMI standards. The non-contact blood pressure measurement method based on video stream proposed in this paper can be used for blood pressure measurement.
Keywords: Continuous blood pressure measurement, Independent component analysis, Feature selection, Machine learning, Support vector machine
0. 引言
高血压是危害人类健康的首要疾病之一,相关数据[1]表明,1990年至2019年间,全球高血压人数已经由约6.5亿增至12.8亿。随着生活水平的提高,快节奏、高压力的生活方式成为心血管疾病的诱因,伴随人口老龄化程度的加重[2],高血压在我国的发病率也逐年上升,因此高血压的防控显得尤为重要。
血压(blood pressure,BP)测量可分为有创测量与无创测量[3],根据测量结果可分为间断式与连续式测量方法。近年来,基于光电容积脉搏波描记法(photoplethysmography,PPG)的连续无创血压测量研究层出不穷[4-10]。其中非接触式连续血压测量方法具有测量过程舒适、方法简单、易于携带等特点,被国内外学者广为关注。2008年,Verkruysse等[11]提出了在环境光下提取面部视频信号中的远程光电容积脉搏波描记法(video-photoplethysmography,vPPG)信号,使得该血压测量方式成为可能。2016年,Jain等[12]提出仅采用面部视频提取vPPG特征,建立多项式回归模型对血压进行估计。2019年,Luo等[13]采用智能手机摄像头获取面部不同位置的vPPG信号,构建多层感知机模型对连续血压进行预测,但其准确度有待提高。
目前基于单vPPG作为信号源的非接触式血压估计方法较少,而且没有相关的公开数据源可供参考与研究,同时非接触式血压估计的准确度还有待进一步提高。针对以上问题,本文提出了一种基于视频流的非接触式连续血压检测算法:采用MIMIC数据库数据[14-15]以及实验平台采集数据,丰富数据量,构建不同血压估计模型并进行筛选,设计集成特征选择算法对vPPG特征进行筛选与优化,基于皮肤生理与光学特性与信号处理分离技术相结合的方法提取vPPG信号,以此来提高血压估计的可信度与准确度。
1. 信号产生原理
1.1. 血压的生理机制
血液在血管中流动并对血管壁产生的压力称为血压,血压的变化受到血液充盈量、心脏周期性泵血、动脉血管弹性以及外周阻力等相关因素影响。血液的充盈程度直接影响着血压的大小。
1.2. 脉搏波的生理机制
PPG的波形反映了血管内血容量的变化,当心血管发生异常时,会引起PPG波形的改变,而血压的变化也会受到血容量的影响,因此PPG信号的时频域特征与血压之间存在相关性,对PPG信号特征的相关研究,能够使我们对血压进行预测与分析。
1.3. PPG与vPPG的采集原理
PPG的采集利用光学原理与皮肤特性,当光线照射到皮肤组织时,部分光线经过皮肤内部的角质层、结缔组织以及微动静脉等人体组织后,会从皮肤反射出来[16],由传感器接收光强变化即得到PPG信号。vPPG的采集原理与PPG相似,也可叫做远程光电容积描记术(remote PPG,rPPG),在环境光的照射下,使用摄像头记录面部由心脏泵血引起的光强变化,即vPPG信号。
2. 信号处理部分
2.1. 实验数据库
本文数据来源于两部分,一部分为MIMIC数据库的连续血压与PPG数据;另一部分来自实验平台所采集的面部视频数据与连续血压数据。经过筛选后,共选取了MIMIC数据库中102例受试者的相关数据,每例受试者3组数据,每组数据长度约为10 min。
在实验平台的数据采集中,受试者采用校内自由招募的形式,在实验前均需签署实验告知书。采用日本Canon EOS 60D相机记录面部视频数据,采用美国BIOPAC MP160型16通道生理仪进行连续血压与指尖PPG信号的采集。测量过程中,受试者与相机距离约为1 m,受试者尽量保持静止状态,保证面部充满整个屏幕,在白天室内正常光线下以及夜晚日光灯照明下,记录不同时间段数据。每例受试者记录15~20组数据,每组数据2 min左右。共采集5例受试者视频数据,并经受试者知情同意,所采集数据可用于科学研究,采样率为60 fps,分辨率为1 280*720,指尖PPG信号采样率为1 000 Hz,共100组数据。
2.2. 数据预处理
对于MIMIC数据库受试者的PPG数据,我们采用以coif5为母小波对其进行分解,采用软阈值策略对信号进行去噪处理,最后重构恢复出干净的PPG信号。对于实验平台采集到的vPPG数据,通过对视频信号中感兴趣区域(region of interest,ROI)的选取,降低vPPG的提取难度,并且提高图像处理的速度。Kwon等[17]的研究显示,眼睛下方区域显示出良好的信号质量。经过选择面部不同区域如额头、鼻子、下巴等进行验证与测试,我们同样选择左侧眼睛下眼睑部位的脸颊中部区域作为我们的ROI区域,用于后续vPPG的提取,ROI区域分辨率为200*200,如图1所示,红色框选区域为ROI区域。
图 1.
Schematic diagram of video ROI selection
视频ROI选择示意图
本文结合皮肤光学特性以及信号分离方法,采用颜色失真滤波器(color distortion filter,CDF)与独立成分分析(independent component analysis,ICA)算法相结合的脉搏波检测方法,对vPPG信号进行预处理与提取。图2为vPPG信号的预处理与提取流程。
图 2.

The flowchart of vPPG extraction from video
视频提取vPPG流程图
CDF由Wang等[18]提出,该方法能够去除颜色引起的干扰以及其他生理信号如呼吸等干扰。CDF处理步骤主要包括数据预处理、定义特征颜色空间以及加权计算能量滤波。
ICA是一种盲源信号提取方法[19-20],可从多源干扰信号中提取出所需要的目标信号。如图2所示,CDF滤波器处理后的RGB三个通道信号经过ICA算法处理后获得了三个通道中存在的近似vPPG信号,即成分1、2、3。根据频谱分析对三种成分进行自动提取,如图2所示,选择频谱与PPG信号相近的成分2作为vPPG信号。
之后我们设计切比雪夫Ⅰ型滤波器对vPPG信号进行进一步处理,得到最终的vPPG信号。将vPPG信号与指尖同步采集的PPG信号进行比对,如图3所示,vPPG信号具有显著周期性的脉搏波波形,且与指尖PPG信号在大体上吻合,但一些vPPG信号存在重搏波消失等现象。采用计算瞬时心率(单位为bpm)的方法,公式如下所示:
图 3.
30-second signal waveform comparison between vPPG and fingertip PPG
vPPG与指尖PPG的30 s信号波形比较图
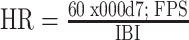 |
1 |
式中,IBI为收缩峰值之间的时间,FPS为采集帧率。
对实验平台采集的100组vPPG数据进行了验证,与PPG数据的瞬时心率的均方根误差在2~7 bmp之间,具有较好的一致性。
3. 血压预测模型
3.1. 评价标准
本文采用美国医疗仪器促进协会标准(The Association for The Advancement of Medical Instrumentation,AAMI)[21]和英国高血压学会(British Hypertension Society,BHS)标准[22]进行评价与判断。
AAMI一般要求测量受试者数量不少于85例,每例受试者需3组数据,平均绝对误差(mean absolute error,MAE)≤5 mm Hg,误差的标准差(standard deviation,STD)≤8 mm Hg。BHS标准根据三种不同阈值下待检测装置所测血压与听诊器所测血压的累计误差百分比(cumulative error,CE)进行分级,如表1所示。
表 1. BHS standard.
BHS标准
| BHS标准等级 | 累积误差百分比 | ||
| ≤5 mm Hg | ≤10 mm Hg | ≤15 mm Hg | |
| A | 60% | 85% | 95% |
| B | 50% | 75% | 90% |
| C | 40% | 65% | 85% |
3.2. 脉搏波特征提取
由于脉搏波特征点的幅值、位置等波形特征与血管外周阻力以及血管壁弹性相关,因此研究中首先采用MIMIC数据库的PPG信号,尽可能完备地提取时间特征、幅值特征、面积特征以及相关的生理参量。由于篇幅原因只在此处说明提取相关特征的类型与数目,用于血压预测的vPPG特征将于特征筛选与优化部分进行具体说明与解释。根据收缩时间ST、舒张时间DT共计算出12个时间特征,根据脉搏波波峰幅值H、波形特征K以及相关时间特征共计算出11个面积特征,根据时间特征与面积特征共计算出一阶微分特征9个,提取生理参数特征每搏心搏输出量Z、心输出量SV以及外周阻力TPR共3个,提取傅里叶变换域特征25个、小波域特征5个、Hilbert变换域特征13个,共计78个特征。
3.3. 单人血压预测模型构建与选择
本研究首先根据脉搏波信号特征以及与血压之间的关系,初步选择基于粒子群优化的Elman神经网络、深度信念网络(deep belief network,DBN)以及支持向量机(support vector machine,SVM)算法进行单人的血压模型构建,进行比较与评价后得出最优算法用于后续的特征筛选验证以及通用模型构建。
Elman神经网络是一种前馈神经网络[23],相比于普通神经网络增加了承接层与循环连接。为了增强网络的稳定性,采用粒子群优化算法(particle swarm optimization,PSO)寻找最优权值以及阈值,并采用变异操作在每次粒子更新后以一定概率重新初始化粒子,防止PSO算法出现过早收敛、搜索精度降低等问题。
SVM算法是一种强大的分类器[24-25],对于线性分类以及非线性分类均有很好的表现,目前广泛地应用于小样本数据以及生理数据处理方面[26]。经过测试后,本文采用基于RBF内核的SVR算法进行模型的构建。对于模型中的超参数,采用网格参数寻优函数SVMcgForRegress进行确定与优化。
DBN算法是由受限玻尔兹曼机(restricted Boltzmann machine,RBM)堆叠形成的分层结构[27],并采用逐层学习算法进行训练。RBM预训练中可利用大量无标签数据对单个RBM进行训练,使得输入的特征参数在降维时保留更多的信息,通过反向传播来调整相关参数,最终得到训练好的DBN网络。
研究中共采用102例MIMIC数据库受试者数据以及实验平台采集的5例受试者的指尖PPG与血压数据,采用提取到的78个PPG特征作为模型的输入。每例受试者60%的数据采用三折交叉验证的方法进行模型的构建,40%数据用于测试。由MIMIC数据库数据进行模型的测试结果,对于三种模型而言,均满足AAMI标准,由SVR方法构建的模型具有最高的精确度,收缩压(systolic blood pressure,SBP)MAE为3.3 mm Hg,STD为3.9 mm Hg;舒张压(diastolic blood pressure,DBP)MAE为1.75 mm Hg,STD为2.25 mm Hg。由实验平台采集数据构建模型的预测SBP与DBP均满足AAMI标准,且SVR模型的预测精度均高于其他两种模型。为了进一步评价SVR算法的可行性与准确度,对来自数据库与实验平台共107例受试者的数据进行误差统计,如表2所示,模型的预测结果均满足BHS的A级标准,因此我们选择SVR算法作为血压预测模型构建方法。
表 2. CE of SBP/DBP prediction by SVR single PPG-BP prediction model.
SVR单人脉搏波-血压预测模型SBP/DBP的预测累积误差百分比
| 指标 | 特征数 | 累积误差百分比 | ||
| ≤ 5 mm Hg | ≤ 10 mm Hg | ≤ 15 mm Hg | ||
| SBP | 78 | 97.802% | 99.886% | 99.976% |
| DBP | 78 | 99.721% | 99.991% | 100% |
3.4. 特征筛选与优化
由于不同个体之间的生理差异性,如年龄、性别、健康状态等[28],导致不同人群之间脉搏波特征与血压的相关程度不同,因此对于提取到的78个脉搏波特征需要进行优化,才能保证血压预测模型的准确度。其次,vPPG与PPG信号之间存在着波形等方面的差异,为了保证模型构建以及算法的复杂度,需要对特征进行进一步筛选。本文设计了一种基于集成特征选择的方法,对78个特征进行优化,最终筛选出6/7个脉搏波特征用于血压的预测。
我们选用两种过滤式特征选择方法[RRelieff和近邻成分分析(neighborhood component analysis,NCA)法]和两种嵌入式特征选择方法[平均影响值(mean impact value,MIV)法和基于支持向量机的递归特征消除(support vector machine-recursive feature elimination,SVM-RFE)法],采用基于排名的稳定性聚合技术,进行集成特征选择。集成稳定性聚合方法步骤如下:首先对B个训练样本应用特征选择方法进行排名,得到r1,r2,···,rn排序,之后通过计算每个特征Ji的得分Si,将得分Si作为该特征选择的特征权重得分进行特征排序。当该特征的排序处于我们所选择的特征参数数目s以内时,则对该特征进行选取。
图4为特征选择方法的总体流程图,采用MIMIC数据库中65例受试者的3段不同时间段数据,共195组数据进行特征选择。每组数据首先采用四种方法分别进行特征排序,对于每种方法得到的特征排序结果,采用稳定性聚合的方法得到4种特征权重排序,对于这4种特征权重排序,再次进行稳定性聚合,得到最终的排序结果。
图 4.
Flow chart of PPG feature extraction
脉搏波特征提取流程图
如图5所示,我们首先对特征数量进行了选择与验证。采用参与特征选择的65例受试者的任意一组数据,对于排序后的78个特征分别选取排序靠前的前3到前20个,以及前30、40、50、60个特征分别进行SVR模型构建,并使用参与特征选择的65例受试者剩余的130组数据,以及未参与特征选择的37例受试者的111组数据,共计241组数据分别进行验证,当选择特征数目增加至4个以后,预测误差基本上趋于稳定。
图 5.
The trend of BP prediction accuracy with the number of input features
血压预测精度随输入特征个数的变化趋势
为了获得更加精确的特征数目,对选择特征数目4、6/7、15进行进一步的验证,结果如表3所示。综合运算速度与预测精度,确定采用前6个PPG特征进行SBP预测,前7个PPG特征进行DBP预测。
表 3. The prediction error of SBP/DBP when selecting different number of features.
选择不同特征数目时SBP/DBP的预测误差
| 指标 | 特征数 | 累积误差百分比 | ||
| ≤5 mm Hg | ≤10 mm Hg | ≤15 mm Hg | ||
| SBP | 4 | 90.681% | 99.533% | 99.982% |
| 6 | 90.982% | 99.585% | 99.987% | |
| 15 | 90.897% | 99.569% | 99.986% | |
| DBP | 4 | 98.050% | 99.932% | 99.998% |
| 7 | 98.406% | 99.955% | 100% | |
| 15 | 98.112% | 99.943% | 100% | |
3.5. 通用血压预测模型构建
我们将vPPG所提取到的特征按上述方法进行排序后,提取前6/7个特征与PPG特征进行比较,结果如表4所示。选择平均绝对百分比误差(mean absolute percentage error,MAPE)均在20%以内的P5、F1、F2、T、RP5、RP6共6个特征用于通用血压预测模型的构建。
表 4. The MAPE of features extracted from 100 groups of subjects’ vPPG and PPG.
100组受试者数据视频提取的vPPG与PPG提取特征的平均绝对百分比误差
| 参数 | 含义 | MAPE |
| P5 | 二次谐波能量百分比 | 6.644% |
| F1 | 主频,基波对应频率 | 15.481% |
| F2 | 二次谐波频率 | 0.987% |
| ΔT | 峰峰时间间隔 | 6.857% |
| RP 5 | 0.25~3.5 Hz/0.25~20 Hz谱能比 | 18.878% |
| RP 6 | 0.25~10 Hz/0.25~20 Hz谱能比 | 2.743% |
| W1 | 单个脉搏波周期内幅值为2/3对应点的时间间隔 | 84.283% |
| W2 | 单个脉搏波周期内幅值为1/2对应点的时间间隔 | 68.800% |
最终我们采用SVR算法,使用筛选后的6个脉搏波特征作为输入,采用MIMIC数据库数据构建通用连续血压预测模型,并使用实验平台所采集到的5例受试者的100组数据进行模型的验证。
4. 结果与讨论
4.1. 视频血压预测结果
结果表明,采用通用血压预测模型所得SBP的MAE为4.9 mm Hg,STD为5.9 mm Hg,DBP的MAE为4.6 mm Hg,STD为5.0 mm Hg,满足AAMI标准;如表5所示,血压预测结果也满足BHS的A级标准。
表 5. Comparison of predicted CE of SBP/DBP based on video with BHS standard.
基于视频的SBP/DBP的预测累积误差百分比与BHS标准的比较
| 指标 | 特征数 | 累积误差百分比 | ||
| ≤5 mm Hg | ≤10 mm Hg | ≤15 mm Hg | ||
| SBP | 6 | 82.642% | 99.303% | 100% |
| DBP | 6 | 91.645% | 99.975% | 100% |
最后,对由视频估计出的血压与实验测得的标准血压进行了一致性分析,由图6可知,视频估计出的SBP与实验测得的标准SBP的皮尔逊相关系数达到0.94,即存在94%的视频估计值与实验标准值的误差值落在95%一致性区间内(–6.5 mm Hg,7.6 mm Hg),且在一致性区间内的差值绝对值最大为7.6 mm Hg;由视频估计出的DBP与标准DBP的皮尔逊相关系数达到0.94,即存在94%的视频估计值与实验标准值的误差值落在95%一致性区间内(–5.1 mm Hg,5.9 mm Hg),且在一致性区间内的差值绝对值最大为5.9 mm Hg,因此可以认为由视频估计的血压与实验测得的标准血压具有较好的一致性。
图 6.

Pearson consistency analysis and Bland-Altman diagram of the BP prediction model based on video data
基于视频的通用血压预测模型与标准值的皮尔逊一致性分析与Bland-Altman图
4.2. 总结与展望
本文基于MIMIC数据库与实验平台采集的数据,实现了一种基于视频流的非接触式血压测量方法。视频数据预处理部分,采用CDF与ICA相结合的方法有效地提取出vPPG信号;对基于粒子群优化的Elman神经网络、SVR与DBN三种方法进行了比较与选择,将SVR方法作为模型构建方法;共提取78个脉搏波时频域特征,并且设计具有数据多样性与算法多样性的集成特征选择方法对特征进行筛选与优化,得到6个vPPG最优特征用于通用模型构建;最终建立基于SVR的通用血压预测模型,预测结果符合AAMI与BHS标准。本研究还可继续进行优化与改进。受限于时间以及实验条件,实验平台所采集的受试者数量不足,后续研究可采集更多人群的数据用于视频血压估计。
基于视频的血压测量方法检测过程简单,设备便于携带,具有广泛的应用场景与市场需求。该方法可用于网络远程医疗、自身居家健康检测及上班族在使用电脑工作时的健康检测。进一步的,可采集不同场景下,以及高血压、低血压等不同受试者样本数据来完善模型,有望用于临床工作中的连续血压测量。
重要声明
利益冲突声明:本文全体作者均声明不存在利益冲突。
作者贡献声明:闫昊负责论文写作、血压模型构建和整体流程设计;李霞负责数据采集与处理和特征筛选;朱田杨负责视频数据处理;龚宁负责数据采集和数据预处理;陈修强负责数据采集和特征提取;周秦武负责方法流程设计与指导以及文章写作指导。
Biographies
闫昊(1997-),男,硕士研究生;通信作者:
周秦武,男,教授
Funding Statement
陕西省重点研发计划项目(2018SF-098)
References
- 1.World Health Organization. World health statistics 2019: monitoring health for the SDGs, sustainable development goals. Geneva: World Health Organization, 2019.
- 2.中华人民共和国统计局. 中国统计年鉴. 北京: 中国统计出版社, 2021.
- 3.Geddes L A. The direct and indirect measurement of blood pressure. Chicago: Year Book Medical Publishers, 1970: 08000-00014.
- 4.Booth J A short history of blood pressure measurement. Proc R Soc Med. 1977;70(11):793–799. doi: 10.1177/003591577707001112. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Penaz J. Photoelectric measurement of blood pressure, volume and flow in the finger// Dresden Conference Committee of the 10th International Conference on Medicine and Biological Engineering. Dresden: Med Biol Eng Comput, 1973: 104.
- 6.Wippermann C F, Schranz D, Huth R G Evaluation of the pulse wave arrival time as a marker for blood pressure changes in critically ill infants and children. J Clin Monit. 1995;11(5):324–328. doi: 10.1007/BF01616991. [DOI] [PubMed] [Google Scholar]
- 7.Ni Yongbin, Wang Hongyu, Hu Dayi, et al The relationship between pulse wave velocity and pulse pressure in Chinese patients with essential hypertension. Hypertens Res. 2003;26(11):871–874. doi: 10.1291/hypres.26.871. [DOI] [PubMed] [Google Scholar]
- 8.Eom H, Lee D, Han S, et al End-to-end deep learning architecture for continuous blood pressure estimation using attention mechanism. Sensors. 2020;20(8):2338. doi: 10.3390/s20082338. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Esmaelpoor J, Moradi M H, Kadkhodamohammadi A A multistage deep neural network model for blood pressure estimation using photoplethysmogram signals. Comput Biol Med. 2020;120:103719. doi: 10.1016/j.compbiomed.2020.103719. [DOI] [PubMed] [Google Scholar]
- 10.Da U J, Lim K M Combined deep CNN-LSTM network-based multitasking learning architecture for noninvasive continuous blood pressure estimation using difference in ECG-PPG features. Sci Rep. 2021;11(1):13539. doi: 10.1038/s41598-021-92997-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Verkruysse W, Svaasand L O, Nelson J S Remote plethysmographic imaging using ambient light. Opt Express. 2008;16(26):21434–21445. doi: 10.1364/OE.16.021434. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Jain M, Deb S, Subramanyam A V. Face video based touchless blood pressure and heart rate estimation// 2016 IEEE 18th International Workshop on Multimedia Signal Processing (MMSP). Montreal: IEEE, 2016: 16599992.
- 13.Luo H, Yang D, Barszczyk A, et al Smartphone-based blood pressure measurement using transdermal optical imaging Technology. Circ Cardiovasc Imag. 2019;12(8):e008857. doi: 10.1161/CIRCIMAGING.119.008857. [DOI] [PubMed] [Google Scholar]
- 14.Moody G B, Mark R G. Integration of real-time and off-line clinical data in the MIMIC database// Computers in Cardiology 1997. Lund: IEEE, 1997: 585-588.
- 15.Escobar B, Torres R. Feasibility of non-invasive blood pressure estimation based on pulse arrival time: A MIMIC database study// Computing in Cardiology 2014. Cambridge: IEEE, 2014: 1113-1116.
- 16.Prauzek M, Peterek T, Adamec O, et al. Simple data acquisition system for photopletysmography and electrocardiography// 2010 2nd International Conference on Signal Processing Systems. Dalian: IEEE, 2010: V2-377-V2-379.
- 17.Kwon S, Kim J, Lee D, et al. ROI analysis for remote photoplethysmography on facial video// 2015 37th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). Milan: IEEE, 2015: 4938-4941.
- 18.Wang W, Brinker A, Stuijk S, et al. Color-distortion filtering for remote photoplethysmography// 2017 12th IEEE International Conference on Automatic Face & Gesture Recognition (FG 2017). Washington: IEEE, 2017: 71-78.
- 19.Hyvärinen A, Oja E A fast fixed-point algorithm for independent component analysis. Neural Comput. 1997;9(7):1483–1492. doi: 10.1162/neco.1997.9.7.1483. [DOI] [PubMed] [Google Scholar]
- 20.王建雄, 张立民, 钟兆根 基于FastICA算法的盲源分离. 计算机技术与发展. 2011;21(12):93–96. doi: 10.3969/j.issn.1673-629X.2011.12.025. [DOI] [Google Scholar]
- 21.Alpert B S Validation of the welch Allyn SureBP (inflation) and StepBP (deflation) algorithms by AAMI standard testing and BHS data analysis. Blood Press Monit. 2011;16(2):96–98. doi: 10.1097/MBP.0b013e328345232f. [DOI] [PubMed] [Google Scholar]
- 22.O’Brien E, Petrie J, Littler W, et al The British Hypertension Society protocol for the evaluation of automated and semi-automated blood pressure measuring devices with special reference to ambulatory systems. J Hypertens. 1990;8(7):607–619. doi: 10.1097/00004872-199007000-00004. [DOI] [PubMed] [Google Scholar]
- 23.Elman J Finding structure in time. Cognitive Sci. 1990;14(2):179–211. doi: 10.1207/s15516709cog1402_1. [DOI] [Google Scholar]
- 24.Paiva J S, Cardoso J, Pereira T. Supervised learning methods for pathological arterial pulse wave differentiation: a SVM and neural networks approach. Int J Med Inform, 2018, 109: 30-38.
- 25.Chang C C, Lin C J LIBSVM: a library for support vector machines. ACM Trans Intell Syst Technol. 2007;2(3):1–27. [Google Scholar]
- 26.Sakr G E, Mokbel M, Darwich A, et al. Comparing deep learning and support vector machines for autonomous waste sorting// 2016 IEEE International Multidisciplinary Conference on Engineering Technology (IMCET). Beirut: IEEE, 2016: 207-212.
- 27.Lee S, Chang J H Deep belief networks ensemble for blood pressure estimation. IEEE Access. 2017;5:9962–9972. doi: 10.1109/ACCESS.2017.2701800. [DOI] [Google Scholar]
- 28.Haury A C, Gestraud P, Vert J P The influence of feature selection methods on accuracy, stability and interpretability of molecular signatures. PLoS One. 2011;6(12):e28210. doi: 10.1371/journal.pone.0028210. [DOI] [PMC free article] [PubMed] [Google Scholar]






