Abstract
Es ist seit Langem bekannt, dass chronisch entzündliche Systemerkrankungen wie die Psoriasis ein hohes Risiko für die Entwicklung von Komorbidität bieten. Im klinischen Alltag ist es deshalb von besonderer Bedeutung, Patient:innen zu identifizieren, die ein individuell erhöhtes Risikoprofil bieten. Bei Menschen mit Psoriasis konnten in epidemiologischen Studien in Abhängigkeit von Krankheitsdauer und -schwere die Komorbiditätsmuster „metabolisches Syndrom“, „kardiovaskuläre Komorbidität“ und „psychische Erkrankungen“ als besonders relevant identifiziert werden. In der alltäglichen Versorgung von Menschen mit Psoriasis in der dermatologischen Praxis haben sich der Einsatz einer interdisziplinär inhaltlich abgestimmten Checkliste für die Risikoanalyse und die Bahnung einer professionellen Anschlussversorgung bewährt. Auf der Basis einer existierenden Checkliste wurden die Inhalte von einer interdisziplinären Expertengruppe kritisch bewertet, und eine leitlinienorientierte Aktualisierung wurde vorgenommen. Der nun vorgelegte Analysebogen stellt nach Auffassung der Autoren ein praktikables, sachbezogen fokussiertes und inhaltlich aktualisiertes Werkzeug für die Risikoermittlung von Komorbidität bei Patient:innen mit mittelschwerer bis schwerer Psoriasis dar.
Schlüsselwörter: Psoriasis, Komorbidität, Metabolisches Syndrom, Kardiovaskuläres Risiko, Psychische Erkrankungen
Abstract
It has long been known that chronic inflammatory systemic diseases, such as psoriasis, pose a high risk of developing comorbidities. In everyday clinical practice, it is therefore of particular importance to identify patients who have an individually increased risk profile. In patients with psoriasis, the comorbidity patterns “metabolic syndrome”, “cardiovascular comorbidity” and “mental illness” were identified as particularly relevant in epidemiological studies depending on the duration and severity of the disease. In the everyday care of patients with psoriasis in dermatological practice, the use of an interdisciplinary checklist for risk analysis and the initiation of professional follow-up care has proven valuable. On the basis of an existing checklist, the contents were critically evaluated by an interdisciplinary group of experts and a guideline-oriented update was prepared. In the opinion of the authors, the new analysis sheet represents a practicable, factually focused and updated tool for comorbidity risk assessment in patients with moderate and severe psoriasis.
Keywords: Psoriasis, Comorbidity, Metabolic syndrome, Cardiovascular risk, Mental illness
Psoriasis wird heute als eine genetisch disponierte, autoimmunologisch und autoinflammatorisch vermittelte, chronisch entzündliche Systemerkrankung (Psoriasiskrankheit) verstanden, die phänotypisch insbesondere die Haut (Psoriasis vulgaris), Gelenke, gelenknahen Knochen und Enthesen (Psoriasisarthritis) betrifft [40, 66]. Im Zentrum der Immunpathogenese wird dabei die Aktivierung von naiven T‑Zellen durch dendritische Zellen gesehen, die zytokinvermittelt (z. B. IL-23, IL‑6, TGF-β) in pathologische und regulatorische Th17-Zellen differenzieren. Diese wiederum exprimieren Botenstoffe, insbesondere Subtypen von IL-17, TNF-α und IL-22, die über Rezeptoren auf Effektorzellen in verschiedenen Organen pathologische Reaktionsmuster induzieren. Darüber hinaus werden über „pathogen-associated molecular patterns“ (PAMPS) und „damage-associated molecular patterns“ (DAMPS) Toll-like(TLR)- und Nod-like-Rezeptoren (NLR) aktiviert, die als Teil des NLRP3-Inflammasoms vorwiegend über Pro-Caspase 1 zur Expression von Zytokinen der IL-1-Familie führen [43, 44, 66]. Dadurch wird die Immunpathogenese durch autoimmunologische und autoinflammatorische Phänomene individuell variabel bedingt. Beide pathogenetischen Kaskaden sind Teil eines systemischen Entzündungsgeschehens, welches in Abhängigkeit von individuellen genetischen und epigenetischen Faktoren sowie der Schwere und Dauer der Erkrankung zur Komorbidität beitragen [21, 38, 54, 61]. Gleichzeitig lassen sich aus diesen Zusammenhängen Strategien für präventive bzw. therapeutische Ansätze sowohl für die Grunderkrankung selbst als auch für die komorbiden Symptome ableiten.
Es werden verschiedene Symptomkomplexe von Komorbidität unterschieden, deren klinische Relevanz sehr unterschiedlich sein kann und die bereits im Kindesalter beobachtet werden können [51]. Aufgrund der Häufigkeit und der sich daraus ableitenden klinischen Bedeutung sind aus dermatologischer Perspektive insbesondere die Symptomkomplexe metabolisches Syndrom, kardiovaskuläre Komorbidität und psychische Erkrankungen von hoher Relevanz [28]. Um die Ermittlung des individuellen Risikos für Komorbidität bei Patient:innen mit einer mittelschweren bis schweren Psoriasis praktikabel zu gestalten, wurden für den klinischen Alltag Handlungsempfehlungen erarbeitet, die in Form von Checklisten und Fragebögen eine Abschätzung ermöglichen [32, 52, 70]. Die Anwendung von derartigen Checklisten im Alltag hat sich aus Sicht der Autoren besonders bewährt. Dieses Vorgehen bedarf aber einer stetigen inhaltlichen Überprüfung, um sowohl die aktuelle Evidenz zu den jeweiligen Komorbiditätsmustern interdisziplinär abzubilden, als auch die fachspezifischen Therapien für die Versorgung der Patient:innen leitlinienkonform zu bahnen [17, 62]. Zudem verdichten sich die Hinweise, dass eine konsequente Langzeittherapie zur Reduktion der Aktivität der Psoriasis das Risiko für Komorbidität relevant reduziert [10, 53].
Auf der Grundlage einer bereits etablierten Handlungsempfehlung möchten die Autoren im Rahmen eines interdisziplinären Diskurses eine kritische Analyse sowie Aktualisierung einer etablierten Checkliste vornehmen und damit der aktuell vorliegenden Evidenz Rechnung tragen.
Metabolisches Syndrom
Auch wenn die Definition eines metabolischen Syndroms Unschärfen aufweist, so wird heute darunter ein komorbides und sich gegenseitig akzelerierendes Auftreten von Typ-2-Diabetes, Übergewicht, Hypercholesterinämie und arterieller Hypertonie verstanden [4, 49, 57, 63]. In engem pathogenetischen Zusammenhang bzw. gehäufter Koexistenz werden zudem eine nichtalkoholische Fettleber (NAFLD), eine Nephropathie (Albumin-Kreatinin-Verhältnis im Urin [UACR] > 30 mg/g), eine obstruktive Schlafapnoe (OSA) bzw. ein polyzystisches Ovarialsyndrom (PCOS) beobachtet [24, 57]. Patient:innen mit einer Psoriasis haben in Abhängigkeit von Erkrankungsschwere und -dauer ein erhöhtes Risiko, ein metabolisches Syndrom als Komorbidität zu entwickeln [6, 47]. Umgekehrt stellt das metabolische Syndrom einen Risikofaktor für das Auftreten einer Psoriasis dar [29, 37]. Als Diagnosekriterien für ein metabolisches Syndrom gelten der Bauchumfang bei Männern von mehr als 94 cm und bei Frauen von mehr als 80 cm sowie das Vorliegen von mindestens 2 weiteren der folgenden Störungen: arterielle Hypertonie (systolisch ≥ 130 mm Hg, diastolisch ≥ 85 mm Hg als Mittelwert einer 24-h-Langzeitblutdruckmessung oder alternativ systolisch ≥ 140 mm Hg, diastolisch ≥ 90 mm Hg als wiederholte Einzelmessung) oder eine bereits behandelte arterielle Hypertonie, Nüchtern-Triglyzeride ≥ 150 mg/dl (≥ 1,7 mmol/l) (ohne Medikation), HDL-Cholesterin < 40 mg/dl (< 1,03 mmol/l) bei Männern und < 50 mg/dl (< 1,29 mmol/l) bei Frauen, erhöhte Nüchtern-Blutglukose ≥ 100 mg/dl (≥ 5,6 mmol/l) bzw. HbA1c ≥ 6,5 % (≥ 48 mmol/mol) oder ein bereits diagnostizierter Typ-2-Diabetes [2, 72]. Daraus ergibt sich für Personen mit einem metabolischen Syndrom ein 2‑ bis 3fach erhöhtes Risiko für ein unerwünschtes kardiovaskuläres Ereignis (MACE) [5, 27, 35]. Grundsätzlich sollte deshalb neben einer Ernährungs- und Lebensstilberatung die Gabe von Antihypertensiva, Statinen sowie von Antidiabetika erwogen und fachärztlich abgeklärt werden.
Kardiovaskuläre Komorbidität
Die Bedeutung der kardiovaskulären Komorbidität bei Menschen mit Psoriasis ist bereits epidemiologisch gut untersucht, und die Hypothesen für die pathogenetischen Zusammenhänge sind weitgehend durch Evidenz belegt [7, 8, 19, 25, 48]. Bereits bei jugendlichen Patient:innen lassen sich entsprechende Veränderungen nachweisen [34]. Im Zentrum der pathologischen Vorgänge im kardiovaskulären System steht die sich in Abhängigkeit von Erkrankungsschwere und -dauer zunehmend etablierende Atherosklerose, die durch die psoriatische Entzündung wesentlich getrieben wird [23]. Dies konnte sowohl durch einen Anstieg von Biomarkern der Entzündung (hsCRP, VEGF, P‑Selektin) [9, 60, 65] als auch durch bildgebende Verfahren zum Nachweis der vaskulären Entzündung (18F-Fluorodeoxyglukose-Positronenemissions-Computertomographie [FDG-PET-CT]) belegt werden [45]. Der molekulare Zusammenhang wird unter anderem in einer zytokinvermittelten Insulinresistenz und einer sich daraus ableitenden endothelialen Dysfunktion gesehen [6, 31]. Letztere führt durch ein verändertes Insulinsignal an Endothelzellen über eine reduzierte Aktivität der endothelialen Stickstoffmonoxidsynthase (eNOS) und verminderter Expression von Endothelin 1 (ET-1) zu einer Gefäßdilatation und bahnt die proinflammatorischen Milieubedingungen des atherosklerotischen Umbaus [23, 30, 46]. Die sich daraus ableitende chronische Entzündung der Gefäßwände mit Zunahme der Intima- und Mediadicke sowie Ausbildung von Kalzifikationen an den Koronararterien bedingen dann die definierten klinischen Ereignisse wie Herzinfarkt bzw. Schlaganfall [11, 39]. Vor diesem Hintergrund lassen sich aus klinischer Perspektive abhängige und unabhängige Faktoren formulieren, an denen sich das individuelle Risiko eines Patienten abschätzen lässt. Neben familienanamnestischen Angaben zu unerwünschten kardiovaskulären Ereignissen (MACE) und Nikotinabusus ist v. a. das Vorliegen einer arteriellen Hypertonie von Bedeutung [52, 70]. Zudem wird überlappend auch das Vorliegen eines metabolischen Syndroms mit LDL-Hypercholesterinämie, Übergewicht und Typ-2-Diabetes als bedeutsam für das kardiovaskuläre Risiko gesehen [59].
Psychische Erkrankungen
Die Psoriasis kann eine erhebliche psychosoziale Belastung darstellen. Darüber hinaus fungiert die Haut auch als neuroendokrines Organ, und die Psoriasis kann als chronisch entzündliche Systemerkrankung über Botenstoffe durch metabolische Prozesse Einfluss auf das Nervensystem nehmen, sodass eine funktionelle Verquickung der beiden Organsysteme vorliegt [71]. Neben einer naheliegenden Interaktion zwischen Haut und dem peripheren Nervensystem im Rahmen von Juckreiz oder Parästhesien [33] hat sich auch das Verständnis der Einflussnahme auf das zentrale Nervensystem (ZNS) entwickelt und kann mittlerweile auf verschiedenen Ebenen mit Evidenz belegt werden [13, 26, 41]. Aus klinischer Sicht sind insbesondere Depression, Angststörung und Suizidalität, Suchterkrankung und sozialer Rückzug von Bedeutung [1, 18, 20, 55, 56]. Die Identifizierung des erhöhten individuellen Risikos bei Patient:innen bzw. die Erkennung von Markersymptomen durch die Dermatolog:in ist v. a. von Bedeutung, weil psychopharmakotherapeutische, somatotherapeutische oder psychotherapeutische (z. B. interpersonelle Psychotherapie) Interventionen, insbesondere bei Angststörung und Depression, ein wirksames Instrument zur Behandlung der Komorbidität darstellen können [42]. Neben dem sozioökonomischen Status der Patient:in und den damit verbundenen individuellen Lebensumständen lassen sich weitere, unabhängige Risikofaktoren definieren [14, 64]. Mit Blick auf die Erfassung einer depressiven Störung bietet der „Zwei-Fragen-Test“ mit einer hohen Sensitivität (ca. 96 %) bei mittlerer Spezifität (ca. 57 %) für die schnelle Erfassung eine geeignete Möglichkeit [22, 50, 69]. Darüber hinaus gibt es zur Erfassung von Depression deutlich aussagekräftigere psychometrische Tools, die aber für die zeitsparende Erfassung im vorliegenden Kontext weniger sinnvoll erscheinen [36, 67, 68]. Zur Behandlung einer depressiven Störung hat sich zudem die Gabe von Citalopram in einer Dosierung von 10–20 mg/Tag als nützlich, praktikabel und unproblematisch erwiesen [15]. Für die Identifikation einer Alkoholsucht (Risiko für eine alkoholbezogene Störung) wird der Alcohol Use Disorders Identification Test – Consumption Items (AUDIT-C) empfohlen und ist im vorliegenden Zusammenhang geeignet [3, 12, 16]. Um eine aussagefähigere Einschätzung vornehmen bzw. andere Suchterkrankungen und -aspekte erfassen zu können, sind weiterführende Verfahren möglich [58]. Insgesamt lässt sich feststellen, dass die ausgewählten Tests (Zwei-Fragen-Test und AUDIT-C) für die rasche und zielorientierte Ermittlung von Risikopatient:innen ein praktikables, validiertes und aussagefähiges Verfahren darstellen.
Hinweise zum Einsatz der Checkliste
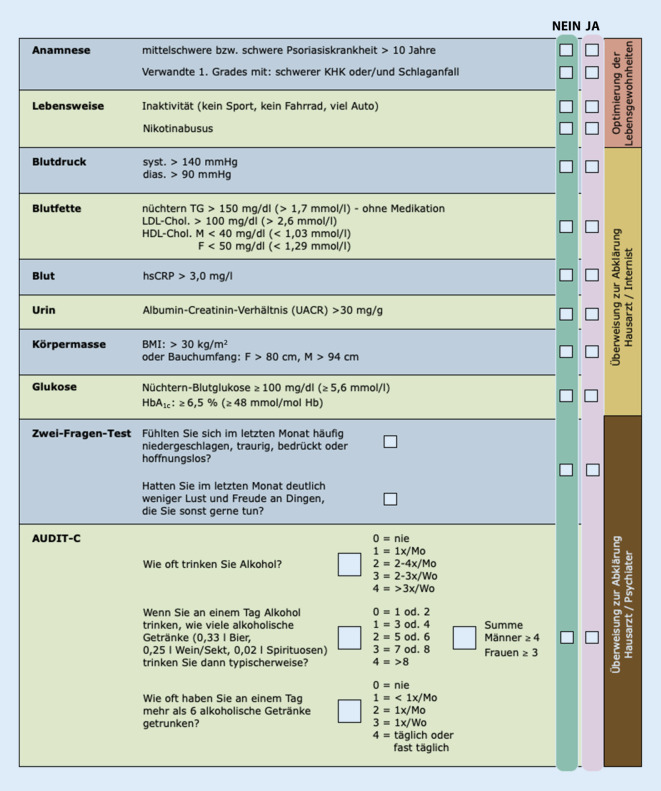
Die Checkliste ist erarbeitet worden, um eine praktikable und fokussierte Ermittlung des Risikos auf Komorbidität einer individuellen Patient:in im klinischen Alltag abschätzen zu können (Abb. 1). Die gewählten Parameter orientieren sich an den für die Diagnostik der einzelnen Komorbiditätsmuster etablierten Verfahren und den aktuellen Leitlinien bezogen auf die jeweilige Komorbidität. Sie sind aber explizit nicht für eine fundierte Diagnosestellung ausreichend, sondern sollen der Dermatolog:in die Identifizierung von Patient:innen mit besonderer Risikokonstellation ermöglichen, um eine fachärztlich spezialisierte Betreuung im Rahmen der interdisziplinären Versorgung der Psoriasiskrankheit bahnen zu können. Es wird empfohlen, die Checkliste vor Therapiebeginn und anschließend jährlich anzuwenden. Bei entsprechender Risikokonstellation ist die ausgefüllte Checkliste gut geeignet, der Hausärzt:in bzw. der weiterbehandelnden Fachärzt:in eine Begründung für die Überweisung an die Hand zu geben. Ziel ist es, eine möglichst optimierte Versorgung von Patient:innen mit mittelschwerer bis schwerer Psoriasis um den Aspekt der Identifizierung und professionellen Behandlung von Komorbidität zu erweitern. Die Lotsenfunktion der Dermatolog:in ist in diesem Zusammenhang von großer Bedeutung. Die vorliegende Checkliste soll für die interdisziplinäre Schnittstelle ein arbeitstechnisches Werkzeug mit geringem Aufwand und fundierter Aussage für die tägliche Praxis für Dermatolog:innen bereitstellen.
Funding
Open Access funding enabled and organized by Projekt DEAL.
Einhaltung ethischer Richtlinien
Interessenkonflikt
Das Manuskript widerspiegelt die Arbeitsergebnisse einer Expertengruppe, die auf Veranlassung der Fa. Almirall in einem Beratungsboard die Inhalte erarbeitet und im Umlaufverfahren das Manuskript erstellt hat. Das Projekt wurde vollumfänglich von der Fa. Almirall finanziert. Es wird ausdrücklich bestätigt, dass der Sponsor keinen Einfluss auf die erarbeiteten Inhalte genommen hat. Folgende Autoren geben an, in den letzten 5 Jahren Honorare für Beratung und/oder Vorträge und/oder Sponsoring für wissenschaftliche Projekte und/oder klinische Studien von folgenden, im thematischen Zusammenhang relevanten Firmen erhalten zu haben: J. Wohlrab – AbbVie, Almirall, Biogen, BMS, Boehringer Ingelheim, Celltrion, Galderma, GSK, Hexal, Janssen-Cilag, Leo, Lilly, MSD, Mylan, Novartis, Pfizer und Regeneron. A. Körber – MSD, Pfizer, Biogen-Idec, AbbVie, Novartis, LEO-Pharma, Janssen-Cilag, Celgene, Lilly, Almirall, Hexal, Beiersdorf, BMS, Sanofi, UCB. G. Adler – Almirall. M. Blüher – Almirall, Amgen, AstraZeneca, Bayer, Boehringer-Ingelheim, Daiichi Sankyo, Lilly, Novartis, Novo Nordisk, Pfizer, Sanofi. A. Zirlik – Almirall, Amgen, AstraZeneca, Bayer Health Care, Boehringer Ingelheim, Bristol Meyers Squibb, Daiichi Sankyo, Novartis, Pfizer, Sanofi Aventis. S. Gerdes – AbbVie, Affibody AB, Almirall, Amgen, Biogen Idec, Bioskin, Bristol-Myers Squibb, Boehringer Ingelheim, Celgene, Dermira, Eli Lilly, Foamix, Forward Pharma, Galderma, Hexal AG, Incyte Inc., Janssen-Cilag, Johnson & Johnson, Klinge Pharma, Leo Pharma, Medac, MSD, Neubourg Skin Care GmbH, Novartis, Pfizer, Sandoz Biopharmaceuticals, UCB Pharma.
Für diesen Beitrag wurden von den Autor/-innen keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Aguayo-Carreras P, Ruiz-Carrascosa JC, Molina-Leyva A. Type D personality is associated with poor quality of life, social performance, and psychological impairment in patients with moderate to severe psoriasis: a cross-sectional study of 130 patients. Indian J Dermatol Venereol Leprol. 2020;86:375–381. doi: 10.4103/ijdvl.IJDVL_114_19. [DOI] [PubMed] [Google Scholar]
- 2.Alberti KG, Eckel RH, Grundy SM, et al. Harmonizing the metabolic syndrome: a joint interim statement of the international diabetes federation task force on epidemiology and prevention; national heart, lung, and blood institute; American heart association; world heart federation; international atherosclerosis society; and international association for the study of obesity. Circulation. 2009;120:1640–1645. doi: 10.1161/CIRCULATIONAHA.109.192644. [DOI] [PubMed] [Google Scholar]
- 3.Suchtforschungsverbund Baden-Württemberg AUDIT-C-Fragebogen. https://www.bundesaerztekammer.de/fileadmin/user_upload/downloads/AlkAUDITCFragebogen.pdf. Zugegriffen: 5. Okt. 2022
- 4.Bagheri P, Khalili D, Seif M, et al. Dynamic behavior of metabolic syndrome progression: a comprehensive systematic review on recent discoveries. BMC Endocr Disord. 2021;21:54. doi: 10.1186/s12902-021-00716-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Ballantyne CM, Hoogeveen RC, Mcneill AM, et al. Metabolic syndrome risk for cardiovascular disease and diabetes in the ARIC study. Int J Obes (Lond) 2008;32(2):S21–24. doi: 10.1038/ijo.2008.31. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Boehncke S, Thaci D, Beschmann H, et al. Psoriasis patients show signs of insulin resistance. Br J Dermatol. 2007;157:1249–1251. doi: 10.1111/j.1365-2133.2007.08190.x. [DOI] [PubMed] [Google Scholar]
- 7.Boehncke WH. Systemic inflammation and cardiovascular comorbidity in psoriasis patients: causes and consequences. Front Immunol. 2018;9:579. doi: 10.3389/fimmu.2018.00579. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Boehncke WH, Boehncke S, Tobin AM, et al. The ‘psoriatic march’: a concept of how severe psoriasis may drive cardiovascular comorbidity. Exp Dermatol. 2011;20:303–307. doi: 10.1111/j.1600-0625.2011.01261.x. [DOI] [PubMed] [Google Scholar]
- 9.Boos CJ, Lip GY. Elevated high-sensitive C-reactive protein, large arterial stiffness and atherosclerosis: a relationship between inflammation and hypertension? J Hum Hypertens. 2005;19:511–513. doi: 10.1038/sj.jhh.1001858. [DOI] [PubMed] [Google Scholar]
- 10.Botelho KP, de Andrade Pontes MA, Rodrigues CEM, et al. Prevalence of metabolic syndrome among patients with psoriasis treated with TNF inhibitors and the effects of anti-TNF therapy on their lipid profile: a prospective cohort study. Metab Syndr Relat Disord. 2020;18:154–160. doi: 10.1089/met.2019.0092. [DOI] [PubMed] [Google Scholar]
- 11.Bugger H, Zirlik A. Anti-inflammatory strategies in atherosclerosis. Hamostaseologie. 2021;41:433–442. doi: 10.1055/a-1661-0020. [DOI] [PubMed] [Google Scholar]
- 12.Bush K, Kivlahan DR, Mcdonell MB, et al. The AUDIT alcohol consumption questions (AUDIT-C): an effective brief screening test for problem drinking. Ambulatory care quality improvement project (ACQUIP). Alcohol use disorders identification test. Arch Intern Med. 1998;158:1789–1795. doi: 10.1001/archinte.158.16.1789. [DOI] [PubMed] [Google Scholar]
- 13.Chen G, Chen ZM, Fan XY, et al. Gut-brain-skin axis in psoriasis: a review. Dermatol Ther (Heidelb) 2021;11:25–38. doi: 10.1007/s13555-020-00466-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Colombo D, Caputo A, Finzi A, et al. Evolution of and risk factors for psychological distress in patients with psoriasis: the PSYCHAE study. Int J Immunopathol Pharmacol. 2010;23:297–306. doi: 10.1177/039463201002300128. [DOI] [PubMed] [Google Scholar]
- 15.D’erme AM, Zanieri F, Campolmi E, et al. Therapeutic implications of adding the psychotropic drug escitalopram in the treatment of patients suffering from moderate-severe psoriasis and psychiatric comorbidity: a retrospective study. J Eur Acad Dermatol Venereol. 2014;28:246–249. doi: 10.1111/j.1468-3083.2012.04690.x. [DOI] [PubMed] [Google Scholar]
- 16.Dybek I, Bischof G, Grothues J, et al. The reliability and validity of the alcohol use disorders identification test (AUDIT) in a German general practice population sample. J Stud Alcohol. 2006;67:473–481. doi: 10.15288/jsa.2006.67.473. [DOI] [PubMed] [Google Scholar]
- 17.Elmets CA, Leonardi CL, Davis DMR, et al. Joint AAD-NPF guidelines of care for the management and treatment of psoriasis with awareness and attention to comorbidities. J Am Acad Dermatol. 2019;80:1073–1113. doi: 10.1016/j.jaad.2018.11.058. [DOI] [PubMed] [Google Scholar]
- 18.Fabrazzo M, Cipolla S, Signoriello S, et al. A systematic review on shared biological mechanisms of depression and anxiety in comorbidity with psoriasis, atopic dermatitis, and hidradenitis suppurativa. Eur Psychiatry. 2021;64:e71. doi: 10.1192/j.eurpsy.2021.2249. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Gaeta M, Castelvecchio S, Ricci C, et al. Role of psoriasis as independent predictor of cardiovascular disease: a meta-regression analysis. Int J Cardiol. 2013;168:2282–2288. doi: 10.1016/j.ijcard.2013.01.197. [DOI] [PubMed] [Google Scholar]
- 20.Galili E, Barzilai A, Shreberk-Hassidim R, et al. Neuropsychiatric comorbidity among adolescents with psoriasis. Br J Dermatol. 2018;178:910–916. doi: 10.1111/bjd.16031. [DOI] [PubMed] [Google Scholar]
- 21.Gerdes S, Mrowietz U, Boehncke WH. Comorbidity in psoriasis. Hautarzt. 2016;67:438–444. doi: 10.1007/s00105-016-3805-3. [DOI] [PubMed] [Google Scholar]
- 22.Gerdes S, Wilsmann-Theis D, Celis D, et al. Two questions may be enough—screening for depression in patients with psoriasis: a multicenter study. J Dtsch Dermatol Ges. 2020;18:1115–1125. doi: 10.1111/ddg.14203. [DOI] [PubMed] [Google Scholar]
- 23.Gistera A, Hansson GK. The immunology of atherosclerosis. Nat Rev Nephrol. 2017;13:368–380. doi: 10.1038/nrneph.2017.51. [DOI] [PubMed] [Google Scholar]
- 24.Gonzalez-Parra E, Dauden E, Carrascosa JM, et al. Kidney disease and psoriasis. A new comorbidity? Actas Dermosifiliogr. 2016;107:823–829. doi: 10.1016/j.ad.2016.05.009. [DOI] [PubMed] [Google Scholar]
- 25.Gu WJ, Weng CL, Zhao YT, et al. Psoriasis and risk of cardiovascular disease: a meta-analysis of cohort studies. Int J Cardiol. 2013;168:4992–4996. doi: 10.1016/j.ijcard.2013.07.127. [DOI] [PubMed] [Google Scholar]
- 26.Hunter HJ, Hinz R, Gerhard A, et al. Brain inflammation and psoriasis: a [(11) C]-(R)-PK11195 positron emission tomography study. Br J Dermatol. 2016;175:1082–1084. doi: 10.1111/bjd.13788. [DOI] [PubMed] [Google Scholar]
- 27.Isomaa B, Almgren P, Tuomi T, et al. Cardiovascular morbidity and mortality associated with the metabolic syndrome. Diabetes Care. 2001;24:683–689. doi: 10.2337/diacare.24.4.683. [DOI] [PubMed] [Google Scholar]
- 28.Kamiya K, Kishimoto M, Sugai J, et al. Risk factors for the development of psoriasis. Int J Mol Sci. 2019;20(18):4347. doi: 10.3390/ijms20184347. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Kim HN, Han K, Park YG, et al. Metabolic syndrome is associated with an increased risk of psoriasis: a nationwide population-based study. Metabolism. 2019;99:19–24. doi: 10.1016/j.metabol.2019.07.001. [DOI] [PubMed] [Google Scholar]
- 30.Kim JA, Koh KK, Quon MJ. The union of vascular and metabolic actions of insulin in sickness and in health. Arterioscler Thromb Vasc Biol. 2005;25:889–891. doi: 10.1161/01.ATV.0000164044.42910.6b. [DOI] [PubMed] [Google Scholar]
- 31.Kim JA, Montagnani M, Koh KK, et al. Reciprocal relationships between insulin resistance and endothelial dysfunction: molecular and pathophysiological mechanisms. Circulation. 2006;113:1888–1904. doi: 10.1161/CIRCULATIONAHA.105.563213. [DOI] [PubMed] [Google Scholar]
- 32.Kimball AB, Gladman D, Gelfand JM, et al. National psoriasis foundation clinical consensus on psoriasis comorbidities and recommendations for screening. J Am Acad Dermatol. 2008;58:1031–1042. doi: 10.1016/j.jaad.2008.01.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Komiya E, Tominaga M, Kamata Y, et al. Molecular and cellular mechanisms of itch in psoriasis. Int J Mol Sci. 2020;21(21):8406. doi: 10.3390/ijms21218406. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Kwa L, Kwa MC, Silverberg JI. Cardiovascular comorbidities of pediatric psoriasis among hospitalized children in the United States. J Am Acad Dermatol. 2017;77:1023–1029. doi: 10.1016/j.jaad.2017.08.034. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Lakka HM, Laaksonen DE, Lakka TA, et al. The metabolic syndrome and total and cardiovascular disease mortality in middle-aged men. JAMA. 2002;288:2709–2716. doi: 10.1001/jama.288.21.2709. [DOI] [PubMed] [Google Scholar]
- 36.Lee A, Park J. Diagnostic test accuracy of the beck depression inventory for detecting major depression in adolescents: a systematic review and meta-analysis. Clin Nurs Res. 2022;31(8):1481–1490. doi: 10.1177/10547738211065105. [DOI] [PubMed] [Google Scholar]
- 37.Lee HJ, Han KD, Park HE, et al. Changes in metabolic syndrome and risk of psoriasis: a nationwide population-based study. Sci Rep. 2021;11:24043. doi: 10.1038/s41598-021-03174-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Lewis DJ, Chan WH, Hinojosa T, et al. Mechanisms of microbial pathogenesis and the role of the skin microbiome in psoriasis: a review. Clin Dermatol. 2019;37:160–166. doi: 10.1016/j.clindermatol.2019.01.011. [DOI] [PubMed] [Google Scholar]
- 39.Libby P. The changing landscape of atherosclerosis. Nature. 2021;592:524–533. doi: 10.1038/s41586-021-03392-8. [DOI] [PubMed] [Google Scholar]
- 40.Lowes MA, Bowcock AM, Krueger JG. Pathogenesis and therapy of psoriasis. Nature. 2007;445:866–873. doi: 10.1038/nature05663. [DOI] [PubMed] [Google Scholar]
- 41.Martins AM, Ascenso A, Ribeiro HM, et al. The brain-skin connection and the pathogenesis of psoriasis: a review with a focus on the serotonergic system. Cells. 2020;9(4):796. doi: 10.3390/cells9040796. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Matiushenko VP, Kutasevych YF, Havryliuk OA, et al. Effectiveness of psychopharmacotherapy in psoriasis patients with associated anxiety and depression. Dermatol Ther. 2020;33:e14292. doi: 10.1111/dth.14292. [DOI] [PubMed] [Google Scholar]
- 43.Mcdermott MF, Aksentijevich I, Galon J, et al. Germline mutations in the extracellular domains of the 55 kDa TNF receptor, TNFR1, define a family of dominantly inherited autoinflammatory syndromes. Cell. 1999;97:133–144. doi: 10.1016/S0092-8674(00)80721-7. [DOI] [PubMed] [Google Scholar]
- 44.Mcgonagle D, Mcdermott MF. A proposed classification of the immunological diseases. PLoS Med. 2006;3:e297. doi: 10.1371/journal.pmed.0030297. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Mehta NN, Yu Y, Saboury B, et al. Systemic and vascular inflammation in patients with moderate to severe psoriasis as measured by [18F]-fluorodeoxyglucose positron emission tomography-computed tomography (FDG-PET/CT): a pilot study. Arch Dermatol. 2011;147:1031–1039. doi: 10.1001/archdermatol.2011.119. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Montagnani M, Quon MJ. Insulin action in vascular endothelium: potential mechanisms linking insulin resistance with hypertension. Diabetes Obes Metab. 2000;2:285–292. doi: 10.1046/j.1463-1326.2000.00092.x. [DOI] [PubMed] [Google Scholar]
- 47.Mysliwiec H, Baran A, Harasim-Symbor E, et al. Serum fatty acid profile in psoriasis and its comorbidity. Arch Dermatol Res. 2017;309:371–380. doi: 10.1007/s00403-017-1748-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Neimann AL, Shin DB, Wang X, et al. Prevalence of cardiovascular risk factors in patients with psoriasis. J Am Acad Dermatol. 2006;55:829–835. doi: 10.1016/j.jaad.2006.08.040. [DOI] [PubMed] [Google Scholar]
- 49.Nogueira-De-Almeida CA. Metabolic syndrome definition in adolescents should incorporate insulin resistance. Ann Pediatr Endocrinol Metab. 2020;25:287–288. doi: 10.6065/apem.2040166.083. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Nvl-005 A-R‑N (2017) S3-Leitlinie (Nationale Versorgungsleitlinie). https://www.leitlinien.de/themen/depression. Zugegriffen: 05. Okt. 2022
- 51.Osier E, Wang AS, Tollefson MM, et al. Pediatric psoriasis comorbidity screening guidelines. JAMA Dermatol. 2017;153:698–704. doi: 10.1001/jamadermatol.2017.0499. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Radtke MA, Mrowietz U, Feuerhahn J, et al. Early detection of comorbidity in psoriasis: recommendations of the national conference on healthcare in psoriasis. J Dtsch Dermatol Ges. 2015;13:674–690. doi: 10.1111/ddg.12643. [DOI] [PubMed] [Google Scholar]
- 53.Roubille C, Richer V, Starnino T, et al. Evidence-based recommendations for the management of comorbidities in rheumatoid arthritis, psoriasis, and psoriatic arthritis: expert opinion of the Canadian dermatology-rheumatology comorbidity initiative. J Rheumatol. 2015;42:1767–1780. doi: 10.3899/jrheum.141112. [DOI] [PubMed] [Google Scholar]
- 54.Salihbegovic EM, Kurtalic S, Omerkic E. Comorbidity in men with psoriasis. Med Arch. 2021;75:31–34. doi: 10.5455/medarh.2021.75.31-34. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Schielein MC, Tizek L, Knobloch L, et al. Psoriasis and addiction: assessing mental health based on a cross-sectional study in Germany. Eur J Dermatol. 2021;31(6):722–729. doi: 10.1684/ejd.2021.4146. [DOI] [PubMed] [Google Scholar]
- 56.Schielein MC, Tizek L, Schuster B, et al. Always Online? Internet addiction and social impairment in psoriasis across Germany. J Clin Med. 2020;9(6):1818. doi: 10.3390/jcm9061818. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Serbis A, Giapros V, Galli-Tsinopoulou A, et al. Metabolic syndrome in children and adolescents: is there a universally accepted definition? Does it matter? Metab Syndr Relat Disord. 2020;18:462–470. doi: 10.1089/met.2020.0076. [DOI] [PubMed] [Google Scholar]
- 58.Simón Grima JS, Estrada-Marcen N, Montero-Marin J. Exercise addiction measure through the exercise addiction inventory (EAI) and health in habitual exercisers. A systematic review and meta-analysis. Adicciones. 2019;31:233–249. doi: 10.20882/adicciones.990. [DOI] [PubMed] [Google Scholar]
- 59.Singh P, Silverberg JI. Screening for cardiovascular comorbidity in United States outpatients with psoriasis, hidradenitis, and atopic dermatitis. Arch Dermatol Res. 2021;313:163–171. doi: 10.1007/s00403-020-02087-w. [DOI] [PubMed] [Google Scholar]
- 60.Strober B, Teller C, Yamauchi P, et al. Effects of etanercept on C-reactive protein levels in psoriasis and psoriatic arthritis. Br J Dermatol. 2008;159:322–330. doi: 10.1111/j.1365-2133.2008.08628.x. [DOI] [PubMed] [Google Scholar]
- 61.Takeshita J, Grewal S, Langan SM, et al. Psoriasis and comorbid diseases: epidemiology. J Am Acad Dermatol. 2017;76:377–390. doi: 10.1016/j.jaad.2016.07.064. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Takeshita J, Grewal S, Langan SM, et al. Psoriasis and comorbid diseases: implications for management. J Am Acad Dermatol. 2017;76:393–403. doi: 10.1016/j.jaad.2016.07.065. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Tropeano A, Corica D, Pomi LA, et al. The metabolic syndrome in pediatrics: do we have a reliable definition? A systematic review. Eur J Endocrinol. 2021;185:265–278. doi: 10.1530/EJE-21-0238. [DOI] [PubMed] [Google Scholar]
- 64.Tzur Bitan D, Krieger I, Comaneshter D, et al. The association between the socioeconomic status and anxiety-depression comorbidity in patients with psoriasis: a nationwide population-based study. J Eur Acad Dermatol Venereol. 2019;33:1555–1561. doi: 10.1111/jdv.15651. [DOI] [PubMed] [Google Scholar]
- 65.Uysal S, Yilmaz FM, Karatoprak K, et al. The levels of serum pentraxin3, CRP, fetuin-A, and insulin in patients with psoriasis. Eur Rev Med Pharmacol Sci. 2014;18:3453–3458. [PubMed] [Google Scholar]
- 66.Verma D, Fekri SZ, Sigurdardottir G, et al. Enhanced inflammasome activity in patients with psoriasis promotes systemic inflammation. J Invest Dermatol. 2021;141:586–595.e5. doi: 10.1016/j.jid.2020.07.012. [DOI] [PubMed] [Google Scholar]
- 67.Wang YP, Gorenstein C. Assessment of depression in medical patients: a systematic review of the utility of the Beck depression inventory-II. Clinics (Sao Paulo) 2013;68:1274–1287. doi: 10.6061/clinics/2013(09)15. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.Wang YP, Gorenstein C. Psychometric properties of the Beck depression inventory-II: a comprehensive review. Braz J Psychiatry. 2013;35:416–431. doi: 10.1590/1516-4446-2012-1048. [DOI] [PubMed] [Google Scholar]
- 69.Whooley MA, Avins AL, Miranda J, et al. Case-finding instruments for depression. Two questions are as good as many. J Gen Intern Med. 1997;12:439–445. doi: 10.1046/j.1525-1497.1997.00076.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.Wohlrab J, Fiedler G, Gerdes S, et al. Recommendations for detection of individual risk for comorbidities in patients with psoriasis. Arch Dermatol Res. 2013;305:91–98. doi: 10.1007/s00403-013-1318-9. [DOI] [PubMed] [Google Scholar]
- 71.Wu JJ, Feldman SR, Koo J, et al. Epidemiology of mental health comorbidity in psoriasis. J Dermatolog Treat. 2018;29:487–495. doi: 10.1080/09546634.2017.1395800. [DOI] [PubMed] [Google Scholar]
- 72.Zimmet P, Magliano D, Matsuzawa Y, et al. The metabolic syndrome: a global public health problem and a new definition. J Atheroscler Thromb. 2005;12:295–300. doi: 10.5551/jat.12.295. [DOI] [PubMed] [Google Scholar]