Abstract
Weltweit stellen nach Schätzungen der Weltgesundheitsorganisation (WHO) Kinder und Jugendliche unter 15 Jahren etwa 11 % aller Tuberkulose(TB)-Fälle dar, etwa die Hälfte davon ist jünger als 5 Jahre. Dieser CME-Beitrag beschäftigt sich anhand der 2022 veröffentlichten Guidelines der WHO zum Management der TB im Kindes- und Jugendalter mit den aktuellen Empfehlungen und Neuerungen.
Schlüsselwörter: Kinder, Jugendliche, Erregerdiagnostik, Antituberkulöse Agenzien, Multiresistente Tuberkulose
Abstract
According to the annual global reports from the Word Health Organization (WHO), children under 15 years of age represent 11% of all cases of tuberculosis (TB) globally. Nearly 50% of these cases are children below 5 years old. This continuing medical education (CME) article provides an overview of the current recommendations and innovations based on the revised WHO guidelines on TB management in children and adolescents published in 2022.
Keywords: Children, Adolescents, Pathogen diagnostics, Antitubercular agents, Multidrug-resistant tuberculosis
Lernziele
Nach der Lektüre dieses Beitrags
sind Ihnen die aktuellen Empfehlungen der WHO Guidelines 2022 zum Management der Tuberkulose (TB) im Kindes- und Jugendalter bekannt.
kennen Sie die diagnostischen Schritte bei Verdacht auf eine TB.
kennen Sie die Therapieempfehlungen, abhängig vom betroffenen Organ, vom Patient:innenalter bzw. vom Vorliegen einer aktiven oder latenten TB und vom Resistenzprofil.
kennen Sie die aktuellen Nachsorgeempfehlungen nach TB-Therapie.
Einleitung
Nach Schätzungen der Weltgesundheitsorganisation (WHO) erkranken etwa 1,1 Mio. Kinder und Jugendliche jährlich an einer TB, etwa die Hälfte davon ist < 5 Jahre alt. Die tatsächliche Zahl der TB-erkrankten Kinder ist vermutlich wesentlich höher, schätzungsweise wird nur etwa die Hälfte der Fälle weltweit von nationalen TB-Programmen erfasst [1]. Tuberkuloseexponierte Kinder < 5 Jahren weisen im Fall einer Infektion mit Mycobacterium tuberculosis
Mycobacterium tuberculosis
(M.tb) ein hohes Risiko für eine Erkrankung auf – einschließlich schwerer Verlaufsformen wie einer miliaren Tuberkulose
miliaren Tuberkulose
oder einer tuberkulösen Meningitis (TBM). Daher sind v. a. bei jungen Kindern Präventionsmaßnahmen wie eine Chemoprophylaxe nach signifikanter Exposition oder eine Chemoprävention bei latenter tuberkulöser Infektion (LTBI) von besonderer Bedeutung, um im Fall einer Infektion die Progression zu einer aktiven TB zu verhindern. Dringend erforderlich sind eine möglichst rasche Identifikation von TB-gefährdeten Kindern sowie bei Kindern mit einem TB-Verdacht eine zeitnahe Diagnostik und ggf. adäquate Therapie.
Die aktuellen 2022 veröffentlichten Empfehlungen der WHO berücksichtigen neue Erkenntnisse der TB-Diagnostik, Prävention und Therapie der medikamentensensiblen und -resistenten TB sowie der TBM im Kindes- und Jugendalter [1, 2]. Die WHO-Empfehlungen sind allerdings nicht explizit auf Regionen mit niedrigen TB-Inzidenzen zugeschnitten. Es handelt sich um globale Empfehlungen insbesondere für Länder mit hohen TB-Inzidenzen und limitierten Ressourcen.
Epidemiologie
Nach Schätzungen der WHO erkrankten 2018 weltweit 10 Mio. Menschen an TB. Laut dem European Center for Disease Prevention and Control (ECDC) waren 2019 etwa 246.000 Menschen in der europäischen Region an TB erkrankt (Inzidenz von 26/100.000). Davon wurden insgesamt 49.752 (Inzidenz 9,6/100.000) in Ländern der Europäischen Union (EU) bzw. des Europäischen Wirtschaftsraums (EEA) gemeldet; der Anteil von Kindern im Alter < 15 Jahren betrug 4,1 % [3]. Die Rate von multiresistenten (MDR‑)TB-Fällen in der EU/EEA betrug 3,4 %. In Europa variieren die Inzidenzen und MDR-TB-Raten in den einzelnen Ländern erheblich. Details hierzu sind der ECDC-Website zu entnehmen [4].
Deutschland und Österreich sind entsprechend der Definition der ECDC Niedriginzidenzländer
Niedriginzidenzländer
für TB (< 20/100.000/Jahr). Im Jahr 2020 wurden in Deutschland 4127 TB-Fälle registriert, was einer Inzidenz von 5,0 Neuerkrankungen/100.000 Einwohner entspricht. Davon erkrankten 163 Kinder und Jugendliche < 15 Jahren (Inzidenz 1,4/100.000). Die höchste Inzidenz wurde mit 2,1 (84 Erkrankungen) bei Kleinkindern < 5 Jahren verzeichnet [5]. Kinder mit ausländischer Staatsangehörigkeit erkrankten im Vergleich zu deutschen Kindern etwa 12-mal so häufig an einer TB (Inzidenz 6,6 vs. 0,5/100.000).
In Österreich wurden im Jahr 2021 dem nationalen Referenzzentrum insgesamt 396 TB-Fälle gemeldet, entsprechend einer Inzidenz von 4,4/100.000. Die geringste Inzidenz findet sich in den Altersgruppe der 0‑ bis 4‑ und 5‑ bis 14-Jährigen mit 1,1/100.000, die höchste Inzidenz mit 6,2/100.000 weist die Altersgruppe der 15- bis 24-Jährigen auf [6].
Diagnostik
Die Diagnostik der TB in der Pädiatrie stellt betreuende Ärzt:innen vor eine Herausforderung, da aufgrund der geringen Erregerlast bei Kindern eine mikrobiologische Bestätigung oft nicht gelingt [7]. Die WHO empfiehlt einen sich an Anamnese, Symptom und Röntgenbefunde orientierenden Algorithmus als Diagnosehilfe bei Kindern < 15 Jahren ohne Verwendung immundiagnostischer Tests als Screening [2]. Diese Empfehlungen werden insbesondere in Regionen mit eingeschränkten Ressourcen angewendet. Aufgrund der diagnostischen Möglichkeiten im deutschsprachigen Raum werden zur frühzeitigen Identifizierung einer Infektion entsprechend den Empfehlungen des deutschen Zentralkomitees zur Bekämpfung der TB immundiagnostische Tests als Screening eingesetzt [8].
Anamnese
Mithilfe folgender anamnestischer Fragen an die Eltern/Betreuungspersonen sollte bei pädiatrischen Patient:innen eine Risikobeurteilung
Risikobeurteilung
Hat Ihr Kind einen relevanten Kontakt zu TB-Erkrankten gehabt?
Ist jemand aus ihrer Familie, Ihr Kind eingeschlossen, in einem Land mit hoher TB-Häufigkeit geboren oder hat sich in den letzten 2 Jahren dort aufgehalten?
Hat Ihr Kind regelmäßig Kontakt mit Erwachsenen, die ein hohes TB-Risiko haben?
Hat Ihr Kind eine HIV-Infektion?
Hat eine Migration oder Flucht stattgefunden, und wie waren die Fluchtumstände?
Klinische Zeichen
Klinische Symptome sind v. a. bei jungen Kindern meist unspezifisch. Kinder, bei denen im Rahmen einer Umgebungsuntersuchung
Umgebungsuntersuchung
radiologisch eine pulmonale TB diagnostiziert wird („active case finding“), haben im Frühstadium der Erkrankung häufig wenige Symptome oder sind symptomfrei. Auf eine (pulmonale) TB hinweisen können:
Gewichtsverlust/mangelnde Gewichtszunahme,
subfebrile Temperaturen/Fieber ohne Fokus > 1 Woche,
Abgeschlagenheit/Spielunlust,
Husten > 2 Wochen,
neu aufgetretenes nächtliches Schwitzen (von der WHO nicht als Symptom aufgeführt).
Immundiagnostische Testung
Zu den immundiagnostischen Nachweismethoden zählen der Tuberkulin Hauttest
Tuberkulin Hauttest
(THT) und der Interferon-Gamma-Release-Assay
Interferon-Gamma-Release-Assay
(IGRA). Diese Tests können eine Infektion mit M.tb nachweisen, jedoch nicht eine LTBI von einer aktiven TB unterscheiden [10, 11]. Bei beiden Tests gibt es eine Latenzzeit von 2 bis 8 Wochen, innerhalb derer nach Exposition und initial negativem Befund eine Konversion möglich ist. Bei Kindern < 5 Jahren sind beide Tests als gleichwertig anzusehen, haben jedoch nur eine Sensitivität von etwa 80 % [12, 13]. Eine rezente Infektion mit Varizellen oder Masern bzw. eine Lebendimpfung in den letzten 6 Wochen kann zu einem falsch-negativen Ergebnis der Tests führen [7, 10, 12].
Zahlreiche Biomarker sind zur Unterscheidung von Infektion und Erkrankung evaluiert worden, jedoch noch nicht abschließend validiert und daher für die klinische Routine aktuell weder national noch international empfohlen.
Bildgebende Untersuchungen
Ein Thoraxröntgen
Thoraxröntgen
(initial in 2 Ebenen, insbesondere bei Kindern unter 5 Jahren) wird bei V. a. eine pulmonale TB im Kindesalter empfohlen, hat jedoch eine verminderte Aussagekraft im Vergleich zu Erwachsenen. Vor allem bei Kleinkindern zeigen sich oft Lymphknotenvergrößerungen
Lymphknotenvergrößerungen
im Hilusbereich, die jedoch ein eher unspezifisches Zeichen sind [2, 7]. Eine Computertomographie
Computertomographie
ist im Kindesalter bei Verdacht auf eine pulmonale TB nur in Ausnahmefällen z. B. vor EBUS-gesteuerter Biopsie oder zur Abklärung von Differenzialdiagnosen (u. a. eines Lymphoms) indiziert. Während eine Hilus-Lymphknotentuberkulose bisher als extrapulmonale TB klassifiziert wurde, wird diese laut aktueller WHO-Leitlinie nun als pulmonale TB definiert.
Bakteriologische Bestätigung
Ein Erregernachweis
Erregernachweis
soll bei V. a. TB immer angestrebt werden. Aufgrund der geringen Erregerlast gelingt dieser bei Kindern deutlich seltener als bei Erwachsenen. Ein fehlender Nachweis schließt eine TB keineswegs aus.
Bei Kindern wird von der WHO im Gegensatz zu erwachsenen Patient:innen nach wie vor eine mikroskopische Untersuchung
mikroskopische Untersuchung
der gewonnenen Proben (Sputum, Magensaft) zum Nachweis säurefester Stäbchen
säurefester Stäbchen
empfohlen, dies auch im Hinblick auf eine mögliche Therapieverkürzung bei „nonsevere“ TB (s. unten). Folgende Erregerdiagnostik wird bei V. a. pulmonale TB empfohlen – in den meisten europäischen Ländern erfolgt diese aus mindestens 3 Proben an 3 aufeinanderfolgenden Tagen:
Sputum, induziertes Sputum.
Nüchternmagensäfte (Säuglinge, Kleinkinder): Hierbei wird „verschlucktes“, potenziell erregerhaltiges Sputum untersucht. Wenn keine zügige mikrobiologische Untersuchung möglich ist, sollten die Proben in Phosphatpuffer asserviert werden.
Stuhlproben: Nach „Verschlucken“ von erregerhaltigem Sputum und Passage des Magen-Darm-Trakts lassen sich tuberkulöse Mykobakterien molekulargenetisch im Stuhl nachweisen. Die Sensitivität und Spezifität ist mit Ergebnissen der Nüchternmagensäfte vergleichbar. Von der WHO wird der Nachweis von M.tb in Stuhlproben mithilfe von speziellen PCR-basierten Schnelltests bei V. a. pulmonale TB als Alternative zu Sputen oder Magensäften empfohlen (die mikroskopische oder kulturelle Untersuchung von Stuhlproben zum Nachweis von Mykobakterien wird nicht empfohlen). Die Stuhlprobe muss vor der Anwendung dieser speziellen PCR-Schnelltests nur minimal prozessiert werden [14].
Von der WHO werden als Erregernachweis spezielle Polymerase-Kettenreaktion-basierte Schnelltests
Polymerase-Kettenreaktion-basierte Schnelltests
empfohlen [14]; mit ihnen können Mykobakterien des MTb-Komplexes zeitgleich mit einer Rifampicinresistenz in < 2 h nachgewiesen werden (die Tests werden im Folgenden als „MTB/RIF-PCR-Schnelltests“ bezeichnet). Aufgrund der Verfügbarkeit und Finanzierbarkeit der oben genannten Untersuchungen in den meisten europäischen Ländern ist aus Sicht der Autoren die molekulargenetische Stuhluntersuchung mit MTB/RIF-PCR-Schnelltests zunächst als zusätzliche Erregerdiagnostik bei V. a. pulmonale TB empfehlenswert. Sollte eine Gewinnung anderer respiratorischer Proben bei V. a. pulmonale TB nicht möglich sein, sollten molekulargenetische Stuhluntersuchungen
molekulargenetische Stuhluntersuchungen
durchgeführt werden.
Bronchoskopie/Endobronchialer-Ultraschall-gesteuerte Biopsie
Eine Bronchoskopie ausschließlich zur Erregerdiagnostik wird bei Kindern nicht empfohlen. Sollte dies aus differenzialdiagnostischen oder therapeutischen Aspekten erfolgen, kann während der Narkose neben Trachealsekret/Bronchoalveolärer-Lavage-Flüssigkeit auch Magensaft asserviert werden. Die Gewinnung/Untersuchung von postbronchoskopischem Nüchternmagensaft
postbronchoskopischem Nüchternmagensaft
am Folgetag kann die Nachweisquote aufgrund des vermehrten Hustens und Verschluckens von erregerhaltigem Sputum nach dem Eingriff erhöhen. Bei hilärer Lymphadenopathie
hilärer Lymphadenopathie
ist eine EBUS-gesteuerte Lymphknotenbiopsie zur histologischen und zur mikrobiologischen Diagnostik durch pädiatrisch erfahrene Untersucher:innen bereits bei Kleinkindern möglich. Diese Untersuchung kann bei fehlendem Erregernachweis in oben genannten Proben zur histologischen differenzialdiagnostischen Abklärung einer Lymphadenopathie sowie zur Erregerdiagnostik bei unbekanntem Index und/oder hohem Risiko einer MDR-TB beitragen [2].
Merke
Eine molekulargenetische und kulturelle Erregerdiagnostik, einschließlich Resistenzbestimmung, soll bei jeder TB-Erkrankung angestrebt werden.
Therapie
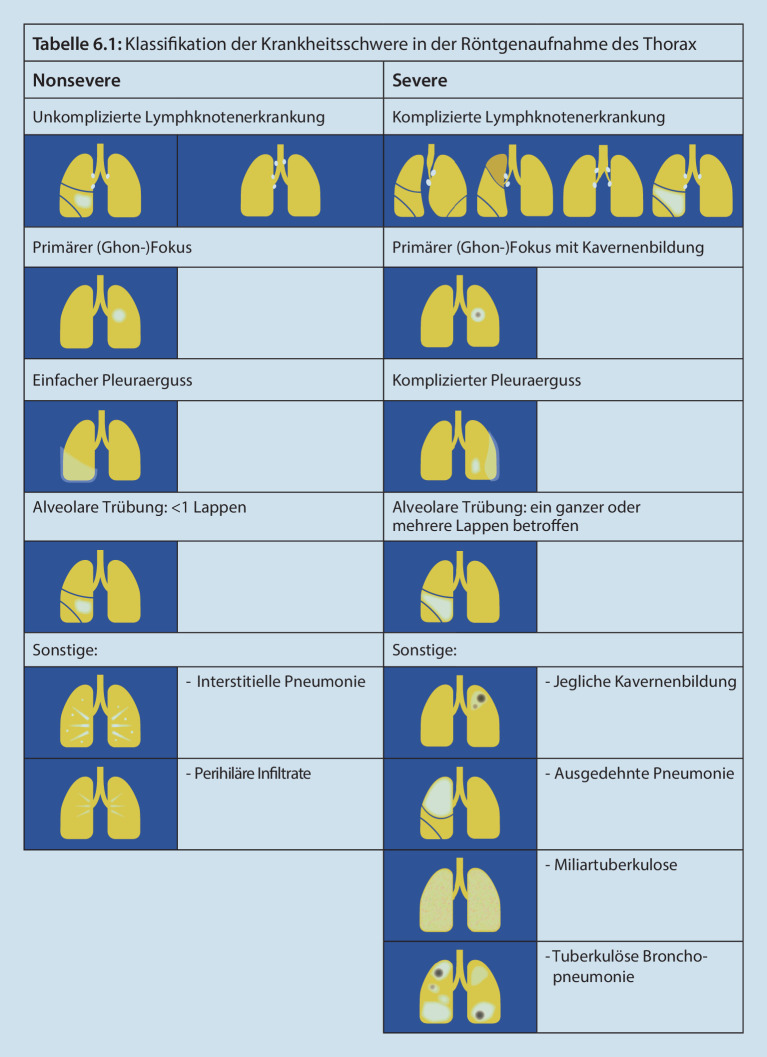
Die Standardtherapie der medikamentensensiblen pulmonalen TB wird über 6 Monate durchgeführt [7]. Nach den neuen WHO-Empfehlungen ist bei „nonsevere“ bzw. minimaler TB eine Therapieverkürzung
Therapieverkürzung
bei Kindern im Alter > 3 Monaten und < 16 Jahren, die sich in einem guten klinischem Allgemein- und Ernährungszustand befinden, von 6 auf 4 Monate möglich. Diesen Empfehlungen liegen Daten des SHINE-Trials zugrunde [15]. Als nonsevere bzw. minimale TB werden folgende Manifestationen definiert (Abb. 1):
isolierte periphere Lymphknoten-TB,
intrathorakale Lymphknoten-TB ohne Belüftungsstörung,
unkomplizierter Pleuraerguss ohne Empyem oder Pneumothorax,
nichtkavernöse pulmonale TB, pathologische Veränderung beschränkt auf einen Lungenlappen,
kein Anhalt für MDR- oder rifampicinresistente TB bei Patient:in oder Indexpatient:in,
kein mikroskopischer Nachweis säurefester Stäbchen in mikrobiologischen Präparaten,
MTB/RIF-PCR-Schnelltest negativ oder sehr niedrig (englisch „trace“).
Keine Therapieverkürzung soll erfolgen bei:
Patient:innenalter < 3 Monate,
Patient:innenalter > 16 Jahre,
mikroskopischem Nachweis säurefester Stäbchen und/oder positivem (semiquantitativ nicht „trace“ oder niedrig) MTB/RIF-PCR-Schnelltests als Hinweis auf eine hohe Erregerlast,
miliarer TB bzw. miliarem Muster im Thoraxröntgen,
Kavernen, pathologische Veränderungen in > 1 Lungenlappen,
Belüftungsstörung,
extrapulmonaler TB (außer unkompliziertem Pleuraerguss oder peripherer Lymphknoten-TB),
früherer TB-Therapie,
Unterernährung, schweren Komorbiditäten,
deutlich beeinträchtigtem Allgemeinzustand.
Ob eine Therapieverkürzung möglich ist, sollte initial und erneut vor einer Therapiedeeskalation
Therapiedeeskalation
nach 2‑monatiger Drei- bzw. Vierfachtherapie kritisch evaluiert werden. Eine HIV-Infektion unter suffizienter Therapie ist per se keine Kontraindikation des verkürzten Therapieregimes.
Merke
Das verkürzte Therapieregime über 4 Monate bei „nonsevere“ TB stellt keine allgemeingültige Therapieempfehlung dar, sondern kann bei ausgewählten Patienten erwogen werden.
Weitere neue Therapieempfehlungen
Bei Kindern > 12 Jahren und mit einem Körpergewicht > 40 kg mit sensibler pulmonaler TB könnte nach den neuen WHO-Leitlinien ein 4‑monatiges Therapieregime mit Isoniazid (INH), Rifapentin, Moxifloxacin and Pyrazinamid als Alternative zu dem 6‑monatigen Regime erfolgen. Rifapentin ist im deutschsprachigen Raum jedoch noch nicht verfügbar [2].
Besuch von Gemeinschaftsunterkünften
Kinder < 5 Jahre sind aufgrund der Paucibazillarität
Paucibazillarität
seltener und infolge der geringeren Hustenstoßstärke weniger ansteckend [17]. Der Besuch einer Gemeinschaftseinrichtung ist bei gutem Allgemeinzustand nach Therapiebeginn möglich, sofern mikroskopisch und molekulargenetisch kein Erregernachweis in respiratorischen Proben gelang und die Medikamente zuverlässig täglich verabreicht werden. Auch bei initialem Erregernachweis ist aufgrund oben genannten Faktoren nach 14-tägiger Therapie der Besuch einer Gemeinschaftseinrichtung wieder möglich. Bei hoher Erregerlast mit mikroskopischem Nachweis säurefester Stäbchen in respiratorischen Proben und/oder ausgedehnter pulmonaler TB sollte dieser erst 21 Tage nach Therapiebeginn erfolgen. Nur bei Patient:innen mit mikroskopischem Keimnachweis, ausgedehnter/kavernöser pulmonaler TB oder MDR-TB sind erneute mikrobiologische Testungen vor dem Kita- oder Schulbesuch erforderlich. Kinder mit LTBI oder extrapulmonalen Manifestationen einer TB sind nicht infektiös und können Gemeinschaftseinrichtungen nach Ausschluss einer pulmonalen TB uneingeschränkt besuchen.
Betreuer:innen sollten über die Medikation (mit rifampicinbedingter orangefarbener Verfärbung des Urins) und die Nichtinfektiosität des jeweiligen Kindes aufgeklärt werden [7].
Extrapulmonale Tuberkulose
Neben den Lungen können Bakterien des M.tb-Komplexes beinahe jedes andere Organ befallen (u. a. periphere Lymphknoten, Pleura, Knochen und Gelenke, Abdomen, Zentralnervensystem und Haut). Der Anteil extrapulmonaler TB an 2017 weltweit gemeldeten 6,4 Mio. TB-Fällen betrug 14 % [18]. Die häufigste Form der extrapulmonalen TB im Kindesalter stellt die periphere Lymphknotentuberkulose
periphere Lymphknotentuberkulose
dar [19]. Bei Kindern, sofern Patient:innen mit und ohne gleichzeitige pulmonale TB mitgerechnet werden, zeigt sich je nach Setting ein Anteil von 20–60 % [5, 20, 21].
Es gelten prinzipiell dieselben Diagnostik- und Therapieempfehlungen wie für die pulmonale TB. Spezifische Aspekte müssen jedoch je nach betroffenen Organen berücksichtigt werden. Dies kann sowohl die Wahl der antituberkulotischen Medikamente, die Dosierung und Therapiedauer, aber auch die Sensitivität der unterschiedlichen diagnostischen Möglichkeiten beeinflussen. Auch bei extrapulmonaler TB geht der Trend in Richtung kürzere Therapiedauer. So ist z. B. bei ausschließlich peripherer Lymphknoten-TB oder unkompliziertem Pleuraerguss eine Therapieverkürzung (2HRZ[E]/2HR: H Isoniazid (INH), R Rifampicin (RMP), Z Pyrazinamid, E Ethambutol) möglich. Alle anderen extrapulmonalen Manifestationen gelten als schwere TB („severe“) und sollten in der Zusammenschau mit der Grunderkrankung, den klinischen Zeichen und dem Verlauf 6 Monate [2HRZ(E)/4HR] oder länger therapiert werden [22].
Kinder mit osteoartikulärer Tuberkulose
osteoartikulärer Tuberkulose
sollten ebenfalls 12 Monate (2HRZE/10HR) therapiert werden.
Tuberkulöse Meningitis
Eine seltene, aber sehr schwere Form der TB ist die tuberkulöse Meningitis (TBM), die auch in Niedriginzidenzländern mit einer hohen Mortalität und Morbidität einhergeht [23]. Ein besonders hohes Risiko für eine TBM nach Infektion haben Kinder im Alter von 2 bis 4 Jahren [24]. Die initialen Symptome einer TBM können insbesondere im jungen Alter unspezifisch sein, was die Diagnosestellung erschwert.
Als Neuerung wird in der aktuellen WHO-Leitlinie die Anwendung des MTB/RIF-PCR-Schnelltest aus dem Liquor als primärer diagnostischer Test empfohlen anstelle der Direktmikroskopie und der Kultur. Für Niedriginzidenzländern konnte gezeigt werden, dass mit der Kombination von immunologischen und mikrobiologischen Tests (Liquorkultur
Liquorkultur
und Liquor-PCR) eine diagnostische Sensitivität von mehr als 80 % erreicht werden kann, sodass die Liquorkultur weiterhin einen hohen Stellenwert hat [25].
Für die optimale Therapie der TBM bei Kindern liegen wenige Studien vor. Neben der bislang ausgesprochenen Empfehlung einer initialen Vierfachkombination von INH, RMP, PZA und EMB über 2 Monate, gefolgt von einer 10-monatigen Therapie mit RMP und INH, wird nun als gleichwertige Alternative eine intensivierte Therapie
intensivierte Therapie
über 6 Monate empfohlen. Hierbei werden erhöhte Dosen von INH (20 mg/kgKG), RMP (20 mg/kgKG), PZA (40 mg/kgKG) und Ethionamid (20 mg/kgKG) über den gesamten Zeitraum von 6 Monaten gegeben. Die gute Effektivität dieses verkürzten, intensivierten Regimes konnte an einer südafrikanischen Studie mit 184 Kindern belegt werden [26]. Im deutschsprachigen Raum steht statt Ethionamid das Propylanalogon Protionamid
Protionamid
zur Verfügung; dieses wird in gleicher Dosierung wie Ethionamid verwendet. Die Rationale für dieses Regime ist zum einen die bessere Liquorgängigkeit
Liquorgängigkeit
von Ethionamid im Vergleich zu EMB, zum anderen konnte gezeigt werden, dass höhere Dosierungen der Antituberkulotika bei Kindern notwendig sind, um adäquate Liquorspiegel
adäquate Liquorspiegel
zu erreichen [27, 28]. Rifampicin hat eine schlechte Liquorgängigkeit, sobald sich die Inflammation der Blut-Hirn-Schranke gelegt hat. Bei Studien an Erwachsenen waren höhere RMP-Dosen bis 35 mg/kgKG mit einem Überlebensvorteil assoziiert [29, 30]. Neben der antituberkulotischen Therapie ist eine adjuvante antiinflammatorische Therapie
antiinflammatorische Therapie
mit Steroiden unverändert empfohlen. Kindern mit TBM sollten immer Kortikosteroide (Dexamethason
Dexamethason
oder Prednisolon
Prednisolon
) verabreicht und die Gaben nach 4 bis 6 Wochen ausgeschlichen werden. Im Fall einer paradoxen Reaktion auf die antituberkulotische Therapie („immune reconstitution inflammatory syndrome“, IRIS) kann zusätzlich die Gabe von Acetylsalicylsäure oder immunmodulatorischen Medikamenten
immunmodulatorischen Medikamenten
wie Thalidomid erwogen werden [31, 32]. Auch Patient:innen mit einer tuberkulösen Perikarditis
tuberkulösen Perikarditis
können von einer adjuvanten Therapie mit Kortikosteroiden am Beginn der TB-Therapie profitieren [33].
Behandlung der Multiple drug resistant tuberculosis
In den aktuellen WHO-Guidelines werden Bedaquilin
Bedaquilin
und Delamanid
Delamanid
für alle Altersgruppen empfohlen, womit ausschließlich orale Therapieregimes mit kürzerer Behandlungsdauer möglich geworden sind.
Die Therapieprinzipien sind unverändert:
Die Betreuung von Kindern/Jugendlichen mit multiresistenter TB soll stets in einem pädiatrischen TB-Zentrum erfolgen.
Wenn bei einem Kind/Jugendlichen keine Resistenzprüfung möglich ist, soll die Behandlung auf dem Resistenzmuster des wahrscheinlichsten Indexfalls basieren.
Die Regime beinhalten in der Initialphase mindestens 4 Substanzen (wenn möglich, alle 3 Substanzen aus der Gruppe A; Tab. 1), in der Erhaltungsphase mindestens 3.
Priorisiert sind bei der Auswahl die Medikamente aus Gruppe A und B sowie Delamanid.
| Substanz | Dosierung | Max. Dosis/Tag | |
|---|---|---|---|
| Gruppe A |
Levofloxacin (LFX) oder Moxifloxacin (MFX) |
15–20 mg/kgKG 10–15 mg/kgKG |
1500 mg 800 mg |
| Bedaquilin (BDQ) |
3–7 kgKG: 60 mg für 2 Wo, dann 20 mg 3‑mal/Wo 7–10 kgKG: 80 mg für 2 Wo, dann 40 mg 3‑mal/Wo 10–16 kgKG: 120 mg für 2 Wo, dann 60 mg 3‑mal/Wo 16–30 kgKG: 200 mg für 2 Wo, dann 100 mg 3‑mal/Wo > 30 kgKG: 400 mg für 2 Wo, dann 200 mg 3‑mal/Wo |
400 mg | |
| Linezolid (LZD) |
< 16 kgKG: 15 mg/kgKG > 16 kgKG: 10–12 mg/kgKG |
600 mg | |
| Gruppe B | Clofazimin (CFZ) | 2–5 mg/kgKG | 100 mg |
|
Cycloserin (CS) oder Terizidon (TRD) |
15–20 mg/kgKG 15–20 mg/kgKG |
1000 mg 1000 mg |
|
| Gruppe C | Ethambutol (EMB) | 15–25 mg/kgKG | 2000 mg |
| Delamanid (DLM) |
3–5 kgKG: einmal 25 mg 5–16 kgKG: 2‑mal 25 mg 16–30 kgKG: 50–25 mg 30–50 kgKG: 2‑mal 50 mg > 50 kgKG: 2‑mal 100 mg |
200 mg | |
| Pyrazinamid (PZA) | 30–40 mg/kgKG | 2000 mg | |
| Amikacin (AM) | 15–20 mg/kgKG | 1000 mg | |
| Ethionamid (ETO) | 15–20 mg/kgKG | 1000 mg | |
| Protionamid (PTO) | 15–20 mg/kgKG | 1000 mg | |
| Paraaminosalicylsäure (PAS) | 200–300 mg/kgKG | 12000 mg | |
| Meropenem (MPM) | 60–120 mg/kgKG | 6000 mg | |
| Imipenem-Cilastatin (IMP-CLN) | 2- bis 3‑mal 1000 mg (Imp) | 3000 mg |
Die Dauer der Behandlung soll je nach Lokalisation und Schweregrad der Erkrankung und deren Verlauf individuell festgelegt werden. Bei leichten Krankheitsformen (bei gutem Therapieansprechen) werden 6 bis 9 Monate, bei schweren 9 bis 12 Monate Mindestdauer empfohlen. Wenn Medikamente aus der Gruppe A (bei Resistenz oder Toxizität) nicht angewendet werden können, verlängert sich die Therapie.
Kindgerechte Formulierungen sind generell empfohlen, jedoch in deutschsprachigen Ländern noch nicht verfügbar.
Chemoprophylaxe/Chemoprävention
Im deutschsprachigen Raum wird differenziert zwischen Chemoprophylaxe, d. h. der Prophylaxe nach einer TB-Exposition, und der Chemoprävention (Therapie der LTBI). International und in den WHO-Empfehlungen wird nur der Begriff der präventiven Therapie
präventiven Therapie
(„preventive treatment“) verwendet. Diese stimmt weitgehend mit den deutschsprachigen Empfehlungen zur Chemoprävention überein und bietet in den neuen WHO-Empfehlungen keine neuen Aspekte zur Vorversion.
Chemoprophylaxe
Hierbei handelt es sich um eine medikamentöse prophylaktische Behandlung symptomfreier TB-exponierter Personen mit negativen immunologischen und radiologischen Befunden. Kinder < 5 Jahren sollen diese aufgrund des erhöhten Krankheitsprogressionsrisikos umgehend nach infektionsrelevantem TB-Kontakt bis zum Ausschluss einer Infektion 8 Wochen nach letztem TB-Kontakt erhalten. Ziel ist es, eine Infektion zu verhindern bzw. eine bereits bestehende, noch nicht nachweisbare Infektion zu behandeln, um eine Erkrankung zu verhindern.
Die Chemoprophylaxe erfolgt mit INH, sofern bei der/dem Indexpatient:in keine INH-Resistenz bekannt ist. Besteht bei der/dem Indexpatient:in eine INH-Resistenz, soll RMP zur Chemoprophylaxe eingesetzt werden. Bei einer MDR-TB der/des Indexpatient:in soll das Vorgehen abhängig von der Resistenzlage sowie dem Infektions- und Erkrankungsrisiko mit einem erfahrenen Zentrum abgesprochen werden. Besteht 8 Wochen nach letztem Kontakt kein Hinweis auf eine TB oder LTBI, wird die Chemoprophylaxe beendet, im Fall einer LTBI soll eine Chemoprävention durchgeführt werden.
Chemoprävention
Hierbei handelt es sich um die Therapie einer LTBI mit dem Ziel, eine Aktivierung bzw. Progression zu einer TB zu verhindern. Im deutschsprachigen Raum wird für Kinder und Jugendliche bei Vorliegen einer LTBI generell eine Chemoprävention empfohlen, d. h., auch wenn kein Index identifizierbar ist. Empfohlen wird die tägliche Gabe von INH und RMP für 3 Monate oder INH allein für 9 Monate, wobei Ersteres aufgrund der kürzeren Therapiedauer und des dadurch günstigeren Einflusses auf die Adhärenz
Adhärenz
bevorzugt wird. Die Verträglichkeit beider Regime ist gut, wobei es in den ersten Therapiewochen zu einem leichten passageren Transaminasenkonzentrationsanstieg
passageren Transaminasenkonzentrationsanstieg
kommen kann; schwere Hepatitiden sind sehr selten (< 0,1 %). Regelmäßige klinische und laborchemische (Transaminasen‑)Kontrollen sowie die Überwachung der Adhärenz werden empfohlen. Bei INH-Erregerresistenz stellt eine 4‑monatige Therapie mit RMP eine weitere Option dar. Die WHO-Leitlinien empfehlen auch INH plus Rifapentin einmal/Woche über 3 Monate, Rifapentin ist in Deutschland jedoch (noch) nicht zugelassen. Bei einer LTBI nach MDR-TB-Exposition erfolgt die Chemoprävention in Absprache mit einem erfahrenen Zentrum nach dem Erregerresistenzprofil
Erregerresistenzprofil
des Indexpatienten/der Indexpatientin [7].
Besonderheiten bei der Therapie einer multiresistenten Tuberkulose
Zweitrangmedikamente weisen eine geringere Effektivität und eine erhöhte Toxizität im Vergleich zu Erstrangmedikamenten auf. Häufigere laborchemische und klinische Kontrollen sind daher notwendig (Tab. 2). Aufgrund der längeren Therapiedauer stellt die Betreuung von Patient:innen mit MDR-TB eine besondere Herausforderung dar. Die Betreuung von MDR-TB-Patient:innen sollte nur von bzw. in enger Zusammenarbeit mit einem TB-Zentrum erfolgen.
| Medikament | Empfohlenes Monitoring | Bemerkung |
|---|---|---|
| Amikacin | Elektrolyte, Hörfunktion, Nierenfunktion | Reintonaudiometrie oder otoakustische Emissionen: vor/monatlich unter Therapie/6 Monate nach Therapieende |
| Bedaquilin | Elektrolyte, Leberfunktion, QTc-Intervall | EKG: im 1. Quartal monatlich, bei unauffälliger QTc-Zeit 3‑monatlich |
| Clofazimin | Elektrolyte, Leberfunktion, QTc-Intervall |
Mögliche reversible Hautverfärbung EKG: im 1. Quartal monatlich, bei unauffälliger QTc-Zeit 3‑monatlich |
| Delamanid | Elektrolyte, Leberfunktion, QTc-Intervall, Überwachung des Schlafverhaltens, psychologische Beratung |
Neuropsychiatrische Nebenwirkungen: Verhaltensänderungen, Albträume, Pavor nocturnus und Halluzinationen EKG im 1. Quartal monatlich, bei unauffälliger QTc-Zeit 3‑monatliche |
| Ethambutol | Veränderungen des Farbsehens und der Sehschärfe | Perimetrie, Farbsehprüfung und/oder Fundoskopie monatlich |
| Protionamid | Leberfunktion, TSH, fT4 | Schilddrüsenwerte alle 3 Monate |
| Isoniazid | Leberfunktion, periphere Neuropathie | Vitamin B6 zur Vermeidung periphererer Neuropathie |
| Levofloxacin | Elektrolyte, QTc-Intervall | Geringeres Potenzial der QTc-Verlängerung im Vergleich zu Moxifloxacin |
| Linezolid | Veränderungen des Farbsehens und der Sehschärfe, Blutbildveränderungen, periphere Neuropathie |
Monatliche Blutbildkontrolle für 6 Monate, danach ggf. alle 3 Monate ausreichend; Risiko für Neuropathie steigt mit Dauer der Therapie Farbsehprüfung und/oder Fundoskopie monatlich |
| Meropenem | – | Potenziell neurotoxisch (sehr selten) |
| Moxifloxacin | Elektrolyte, QTc-Intervall |
Höheres Risiko der QTc-Verlängerung als Levofloxacin (bei Kindern sehr geringes Risiko) EKG: im 1. Quartal monatlich, bei unauffälliger QTc-Zeit 3‑monatlich |
| Pyrazinamid | Leberfunktion | Testung alle 3 Monate |
fT4 freies Thyroxin, TSH thyreoidstimulierendes Hormon
Nachsorge, Kontrollen
Allgemein sollte vor Therapiebeginn (Chemoprophylaxe, Chemoprävention, Chemotherapie) sowie nach 2 bis 4 Wochen eine laborchemische Kontrolle
laborchemische Kontrolle
erfolgen (Blutbild, Leberwerte). Eine Hepatotoxizität
Hepatotoxizität
manifestiert sich meist innerhalb von 4 Wochen. Weitere Verlaufskontrollen sollten in Abhängigkeit von den klinischen Zeichen und den Laborbefunden erfolgen. Kontrollen in Form einer Thoraxröntgenaufnahme
Thoraxröntgenaufnahme
werden vor Beendigung der Chemoprävention, vor Deeskalation auf die Erhaltungstherapie (meist nach 2 Monaten) und vor Therapieende empfohlen. Eine erneute klinische und radiologische Kontrolle wird 12 Monate nach Therapiebeendigung empfohlen. Eine Aufklärung der Kinder und Betreuungspersonen über die Symptome einer TB sowie der Hinweis, sich bei deren Auftreten erneut ärztlich vorzustellen, sind essenziell.
Die detaillierten Empfehlungen bezüglich der Nachsorge und Kontrollen sind den aktuellen WHO-Guidelines und der AWMF-Leitlinie zu entnehmen [2, 7].
Fazit für die Praxis
Bei Kindern < 15 Jahren empfiehlt die WHO als Screening für eine Tuberkulose einen sich an Anamnese, Symptome und Röntgenbefunde orientierenden Algorithmus ohne Einsatz diagnostischer Tests. Aufgrund der diagnostischen Möglichkeiten im deutschsprachigen Raum stellen die immundiagnostischen Tests eine wichtige Säule im Screening dar.
Ein Erregernachweis soll bei V. a. eine TB immer angestrebt werden. Ein fehlender Nachweis schließt eine TB nicht aus.
Nach den neuen WHO-Empfehlungen ist bei „nonsevere“ bzw. minimaler pulmonaler TB eine Verkürzung der Therapiedauer bei Kindern im Alter > 3 Monaten und < 16 Jahren, die sich in einem guten klinischen Allgemein- und Ernährungszustand befinden, von 6 auf 4 Monate möglich. Das verkürzte Therapieregime stellt keine allgemeingültige Therapieempfehlung dar, sondern kann bei ausgewählten Patient:innen erwogen werden.
Bei extrapulmonaler Tuberkulose gelten prinzipiell dieselben Diagnostik- und Therapieempfehlungen wie für die pulmonale TB. Spezifische Aspekte müssen jedoch je nach betroffenen Organen berücksichtigt werden.
Kinder mit TB-Infektion haben im Alter von 2-4 Jahren ein besonders hohes Risiko für eine tuberkulöse Meningitis (TBM).
Zur Behandlung der „Multiple drug resistant tuberculosis“ empfehlen die WHO-Guidelines Bedaquilin und Delamanid, womit ausschließlich orale Therapieregime mit kürzerer Behandlungsdauer möglich geworden sind.
Abkürzungen
- AM
Amikacin
- BDQ
Bedaquilin
- CFZ
Clofazimin
- CLN
Cilastatin
- DLM
Delamanid
- DOT
„Directly observed therapy“
- EBUS
Endobronchialer Ultraschall
- ECDC
European Centre for Disease Prevention and Control
- EEA
European Economic Area
- EMB (auch E)
Ethambutol
- ETO
Ethionamid
- EU
Europäische Union
- fT4
freies Thyroxin
- HIV
„Human immunodeficiency virus“
- IGRA
Interferon-Gamma-Release-Assay
- IMP
Imipenem
- INH (auch H)
Isoniazid
- IRIS
„Immune reconstitution inflammatory syndrome“
- LFX
Levofloxacin
- LK
Lymphknoten
- LTBI
Latente tuberkulöse Infektion
- LZD
Linezolid
- MDR-TB
„Multiple drug resistant tuberculosis“
- MFX
Moxifloxacin
- MPM
Meropenem
- M.tb
Mycobacterium tuberculosis
- PAS
Paraaminosalicylsäure
- PCR
„Polymerase chain reaction“ (Polymerase-Kettenreaktion)
- PTO
Protionamid
- PZA (auch Z)
Pyrazinamid
- RMP (auch R)
Rifampicin
- SHINE-Trial
Shorter Treatment for Minimal Tuberculosis in Children
- TB
Tuberkulose
- TBM
Tuberkulöse Meningitis
- THT
Tuberkulin-Hauttest
- TRD
Terizidon
- TSH
Thyreoidstimulierendes Hormon
- WHO
World Health Organization
CME-Fragebogen
Auf welche der folgenden Maßnahmen kann im Rahmen der Diagnosesicherung einer Tuberkulose im Kindesalter am ehesten verzichtet werden?
Anamnese und klinische Untersuchung
Thoraxröntgen
Immundiagnostik
Erregernachweis
Bronchoskopie
Ein 6‑jähriger Patient wird nach der Diagnose einer latenten tuberkulösen Infektion (LTBI) seit 2 Wochen präventiv mit Isoniazid und Rifampicin behandelt. Die Eltern sind sehr besorgt, weil ihnen gesagt wurde, dass heute die „Leberwerte“ bestimmt werden sollen. Sie beraten die Familie. Wie häufig treten schwere Hepatitiden unter einer Kombinationstherapie Isoniazid plus Rifampicin im Kindesalter auf?
< 0,1 % der Fälle
0,5 % der Fälle
1 % der Fälle
2–3 % der Fälle
5 % der Fälle
Nach dem Kontakt zu einer an Tuberkulose erkrankten Person kann eine prophylaktische Therapie indiziert sein. Welches der folgenden ist kein zutreffendes Kriterium, um eine prophylaktische Therapie zu beginnen?
Negative immunologische Befunde
Negative radiologische Befunde
Das Resistenzprofil des Indexfalles ist bekannt
Alter < 5 Jahre
Beginn innerhalb von 8 Wochen nach letztem infektionsrelevantem Kontakt
In der Therapie der Tuberkulose werden verschiedene Therapieformen unterschieden. Welches Therapieregime entspricht einer präventiven Therapie?
Isoniazid für 3 Monate
Rifampicin für 3 Monate
Isoniazid + Rifampicin für 3 Monate
Isoniazid + Rifampicin für 6 Monate
Isoniazid für 12 Monate
Welche Aspekte sind bei der Erstellung eines Therapiekonzeptes zur Behandlung einer multiresistenten Tuberkulose (MDR-TB) unbedingt zu beachten, um sowohl ein gutes Ansprechen als auch ein nebenwirkungsarmes Regime zu haben?
Die Kombination soll ein Aminoglykosid beinhalten.
Im Säuglingsalter sollen Fluorchinolone nicht verwendet werden.
Die Auswahl der Medikamente basiert auf der Wahrscheinlichkeit für Resistenzen aus dem Ursprungsland des Patienten/der Patientin.
Das Regime soll in der Initialphase maximal 4 Substanzen und in der Erhaltungsphase maximal 2 Substanzen enthalten.
Ein rein orales Therapieregime soll angestrebt werden.
Welche Medikamente sollten bei der Behandlung einer multiresistenten Tuberkulose auf jeden Fall zum Einsatz kommen, sofern keine Resistenzen dagegen vorliegen?
Levofloxacin, Linezolid, Amikacin
Levofloxacin, Bedaquilin, Amikacin
Moxifloxacin, Bedaquilin, Linezolid
Moxifloxacin, Clofazimin, Meropenem
Bedaquilin, Linezolid, Amikacin
Welches Symptom ist bei Vorliegen einer pulmonalen Tuberkulose im Säuglings- und Kleinkindalter am ehesten anzutreffen?
Erbrechen
Hämoptysen
Tachykardie
Bauchschmerzen
Mangelnde Gewichtszunahme
Welche Erregerdiagnostik wird von der WHO 2022 bei V. a. eine pulmonale Tuberkulose im Kindesalter alternativ zu der Untersuchung von Nüchternmagensäften empfohlen?
Molekulargenetische Untersuchung eines Rachenabstrichs
Kulturelle Untersuchung eines nasalen Abstrichs
Molekulargenetische Untersuchung von Stuhlproben
Mikroskopische Untersuchung von Stuhlproben
Anlage einer Blutkultur
Welches ist ein Ausschlusskriterium für eine 4‑monatige statt 6‑monatiger antimykobakterieller Therapie einer pulmonalen Tuberkulose im Kindesalter?
Alter 4 Monate
Kein mikroskopischer oder molekulargenetischer Erregernachweis
Belüftungsstörung
Infektion mit dem „human immunodeficiency virus“ (HIV) unter suffizienter Therapie
Unkomplizierter Pleuraerguss
Ein 4‑jähriges Mädchen ist bei Ihnen mit einer unkomplizierten pulmonalen Tuberkulose in Behandlung. Im Magensaft konnten mikroskopisch säurefeste Stäbchen nachgewiesen werden. Die Resistenztestungen der Indexperson und auch der Patientin zeigen pansensible Erreger (Mycobacterium tuberculosis). Daher wurde vor einer Woche eine Therapie mit Isoniazid, Rifampicin und Pyrazinamid begonnen, diese wird gut vertragen. Die Eltern erkundigen sich nun bei Ihnen, ab wann ihre Tochter wieder den Kindergarten besuchen kann. Welche Auskunft geben Sie Ihnen?
Die Patientin darf erst nach Abschluss der gesamten Therapie den Kindergarten wieder besuchen.
Die Patientin darf erst nach erfolgter Therapiereduktion (nach 2 Monaten Therapie) den Kindergarten wieder besuchen.
Die Patientin darf bereits eine Woche nach dem Start der Therapie den Kindergarten wieder besuchen.
Die Patientin darf nach 21-tägiger Therapie den Kindergarten wieder besuchen.
Die Patientin darf erst nach erneuter mikrobiologischer Testung frühestens nach 4 Wochen den Kindergarten wieder besuchen.
Einhaltung ethischer Richtlinien
Interessenkonflikt
Gemäß den Richtlinien des Springer Medizin Verlags werden Autoren und Wissenschaftliche Leitung im Rahmen der Manuskripterstellung und Manuskriptfreigabe aufgefordert, eine vollständige Erklärung zu ihren finanziellen und nichtfinanziellen Interessen abzugeben.
Autoren
K. Kainz: A. Finanzielle Interessen: K. Kainz gibt an, dass kein finanzieller Interessenkonflikt besteht. – B. Nichtfinanzielle Interessen: Fachärztin für Kinder- und Jugendheilkunde, angestellt in Klinik Ottakring, 1160 Wien | Mitgliedschaften: ÖGKJ, GPP, ERS. F. Brinkmann: A. Finanzielle Interessen: BMBF Forschungsförderung für NAPKON Projekte (Immunebridge, NUMKRAINE). – ja, ohne Angaben. – B. Nichtfinanzielle Interessen: Leiterin der Sektion für Pädiatrische Pneumologie und Allergologie; Universitätsklinikum Schleswig-Holstein, Campus Lübeck | Leitung AG Infektiologie und Tuberkulose der Gesellschaft für Pädiatrische Pneumologie (GPP); Expertenrat Influenza RKI; AG Leitung Mykobakteriosen DGI. M. Bogyi: A. Finanzielle Interessen: M. Bogyi gibt an, dass kein finanzieller Interessenkonflikt besteht. – B. Nichtfinanzielle Interessen: angestellter Kinderpneumologe, Oberarzt, Klinik Ottakring, Wien | Mitgliedschaften: GPP; ÖGKJ; ESPID; ERS; ptbnet. C. Feiterna-Sperling: A. Finanzielle Interessen: C. Feiterna-Sperling gibt an, dass kein finanzieller Interessenkonflikt besteht. – B. Nichtfinanzielle Interessen: Ärztin für Kinder- und Jugendmedizin, angestellte wissenschaftliche Mitarbeiterin, Charité – Universitätsmedizin Berlin, Augustenburger Platz 1, 13353 Berlin | Mitgliedschaften: Deutsche Gesellschaft für Kinder- und Jugendmedizin, Deutsche AIDS-Gesellschaft, Deutsche Gesellschaft für Pädiatrische Infektiologie. F. Götzinger: A. Finanzielle Interessen: 10.000 € unabhängiger Forschungs-Grant für eine epidemiologische Studie zum Thema Hepatitis E. – ESPID 2021 und 2020; ÖGIT 2022, ERS 2019 (alle als Referent für den Kongress; kein Industrievortrag). – Mitglied des österr. obersten Sanitätsrates (COVID-19-Therapieboard, Arbeitsgruppe Long-COVID) (alles unbezahlt); Leiter des Referates für transkulturelle Pädiatrie (ÖGKJ). – B. Nichtfinanzielle Interessen: angestellter Pädiater mit Schwerpunkt Kinderinfektiologie, Klinik Ottakring, Wiener Gesundheitsverbund, Wien, Österreich. C. Mädel: A. Finanzielle Interessen: Für nichts, was mit diesem Artikel in Verbindung steht. – B. Nichtfinanzielle Interessen: Facharzt mit Spezialisierung pädiatrische Pneumologie sowie Allergologie, Klinik Ottakring, Abteilung für Kinder und Jugendheilkunde, Montleartstraße 37, A‑1160 Wien. | Mitgliedschaften: ÖGKJ, GPP. S. Thee: A. Finanzielle Interessen: S. Thee gibt an, dass kein finanzieller Interessenkonflikt besteht. – B. Nichtfinanzielle Interessen: angestellte Fachärztin für Kinder- und Jugendmedizin, Klinik für Pädiatrie mit Schwerpunkt Pneumologie und Immunologie | Charité – Universitätsmedizin Berlin. R. Krüger: A. Finanzielle Interessen: R. Krüger gibt an, dass kein finanzieller Interessenkonflikt besteht. – B. Nichtfinanzielle Interessen: wissenschaftliche Mitarbeiterin, Charité – Universitätsmedizin Berlin, Fachärztin für Kinder- und Jugendmedizin, infektiologische/immunologische Ambulanz und Tagesklinik | Mitgliedschaften: DGPI, ESPID, PAAD, API, ESID.
Wissenschaftliche Leitung
Die vollständige Erklärung zum Interessenkonflikt der Wissenschaftlichen Leitung finden Sie am Kurs der zertifizierten Fortbildung auf www.springermedizin.de/cme.
Der Verlag
erklärt, dass für die Publikation dieser CME-Fortbildung keine Sponsorengelder an den Verlag fließen.
Für diesen Beitrag wurden von den Autor/-innen keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1. WHO public call for data on the management of TB in children and adolescents. https://www.who.int/news-room/articles-detail/who-public-call-for-data-on-the-management-of-tb-in-children-and-adolescents. Zugegriffen: 29. Okt. 2022
- 2. WHO consolidated guidelines on tuberculosis: module 5: management of tuberculosis in children and adolescents. https://www.who.int/publications-detail-redirect/9789240046764. Zugegriffen: 29. Okt. 2022 [PubMed]
- 3.European Centre for Disease Prevention and Control (2021) Tuberculosis surveillance and monitoring in Europe 2021–2019 data. https://www.ecdc.europa.eu/en/publications-data/tuberculosis-surveillance-and-monitoring-europe-2021-2019-data. Zugegriffen: 29. Okt. 2022
- 4.Infographic: Multidrug-resistant (MDR) tuberculosis in the EU/EEA, 2021 [Internet]. https://www.ecdc.europa.eu/en/publications-data/infographic-multidrug-resistant-mdr-tuberculosis-eueea-2021. Zugegriffen: 10. Mai 2023
- 5.Koch-Institut R. Bericht zur Epidemiologie der Tuberkulose in Deutschland für 2020. 2020. p. 108. [Google Scholar]
- 6.Nationale Referenzzentrale für Tuberkulose . Jahresbericht 2021. Wien: Nationale Referenzzentrale für Tuberkulose; 2022. [Google Scholar]
- 7.Feiterna-Sperling C, Brinkmann F, Adamczick C, Ahrens F, Barker M, Berger C, et al. S2k-Leitlinie zur Diagnostik, Prävention und Therapie der Tuberkulose im Kindes- und Jugendalter: Eine Leitlinie unter Federführung der Deutschen Gesellschaft für Pädiatrische Infektiologie (DGPI) e. V. Pneumologie. 2017;71(10):629–680. doi: 10.1055/s-0043-116545. [DOI] [PubMed] [Google Scholar]
- 8.Brinkmann F, Feiterna-Sperling C, Günther A, Breuer C, Hartmann P, Hufnagel M, et al. Untersuchung auf Tuberkulose bei geflüchteten Kindern und Jugendlichen aus der Ukraine. Pneumologie. 2022;76(07):479–484. doi: 10.1055/a-1832-2546. [DOI] [PubMed] [Google Scholar]
- 9.Ozuah PO, Ozuah TP, Stein REK, Burton W, Mulvihill M. Evaluation of a risk assessment questionnaire used to target tuberculin skin testing in children. JAMA. 2001;285(4):451–453. doi: 10.1001/jama.285.4.451. [DOI] [PubMed] [Google Scholar]
- 10.Kohns M, Seyfarth J, Schramm D, Mayatepek E, Jacobsen M. Tuberkulose: Pathogenese und Wertigkeit immundiagnostischer Tests. Monatsschr Kinderheilkd. 2013;161(8):697–702. doi: 10.1007/s00112-013-2882-y. [DOI] [Google Scholar]
- 11.Diel R, Nienhaus A. Aktuelle Fragestellungen zum Tuberkulose-Screening mit Interferon-Gamma-Release Assays (IGRAs) Pneumologie. 2015;69(05):271–275. doi: 10.1055/s-0034-1391919. [DOI] [PubMed] [Google Scholar]
- 12.Diel R, Loytved G, Nienhaus A, Castell S, Detjen A, Geerdes-Fenge H, et al. Neue Empfehlungen für die Umgebungsuntersuchungen bei Tuberkulose. Pneumologie. 2011;65(06):359–378. doi: 10.1055/s-0030-1256439. [DOI] [PubMed] [Google Scholar]
- 13.Kay AW, Islam SM, Wendorf K, Westenhouse J, Barry PM. Interferon-γ release assay performance for tuberculosis in childhood. Pediatrics. 2018;141(6):e20173918. doi: 10.1542/peds.2017-3918. [DOI] [PubMed] [Google Scholar]
- 14.World Health Organization . Practical manual of processing stool samples for diagnosis of childhood TB. Geneva: World Health Organization; 2022. [Google Scholar]
- 15.Turkova A, Wills GH, Wobudeya E, Chabala C, Palmer M, Kinikar A, et al. Shorter Treatment for Nonsevere Tuberculosis in African and Indian Children. N Engl J Med. 2022;386(10):911–922. doi: 10.1056/NEJMoa2104535. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Palmer M, Seddon JA, Goussard P, Schaaf HS. Diagnostik CXR Atlas for tuberculosis in children. A guide to chest X-ray interpretation. International Union Against Tuberculosis and Lung Disease (The Union) 2022. [Google Scholar]
- 17.Kunkel A, Abel zur Wiesch P, Nathavitharana RR, Marx FM, Jenkins HE, Cohen T. Smear positivity in paediatric and adult tuberculosis: systematic review and meta-analysis. BMC Infect Dis. 2016;16(1):282. doi: 10.1186/s12879-016-1617-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18. Global tuberculosis report 2021. https://www.who.int/publications-detail-redirect/9789240037021. Zugegriffen: 29. Okt. 2022
- 19.Perez-Velez CM, Marais BJ. Tuberculosis in children. N Engl J Med. 2012;367(4):348–361. doi: 10.1056/NEJMra1008049. [DOI] [PubMed] [Google Scholar]
- 20.Santiago-García B, Blázquez-Gamero D, Baquero-Artigao F, Ruíz-Contreras J, Bellón JM, Muñoz-Fernández MA, et al. Pediatric extrapulmonary tuberculosis: clinical spectrum, risk factors and diagnostic challenges in a low prevalence region. Pediatr Infect Dis J. 2016;35(11):1175–1181. doi: 10.1097/INF.0000000000001270. [DOI] [PubMed] [Google Scholar]
- 21.UK Health Security Agency (2021) Tuberculosis in England: 2020. UK Health Security Agency, London, S 198
- 22.Wiseman CA, Gie RP, Starke JR, Schaaf HS, Donald PR, Cotton MF, et al. A proposed comprehensive classification of tuberculosis disease severity in children. Pediatr Infect Dis J. 2012;31(4):347–352. doi: 10.1097/INF.0b013e318243e27b. [DOI] [PubMed] [Google Scholar]
- 23.Thee S, Basu Roy R, Blázquez-Gamero D, Falcón-Neyra L, Neth O, Noguera-Julian A, et al. Treatment and outcome in children with tuberculous meningitis: a multicenter pediatric tuberculosis network European trials group study. Clin Infect Dis. 2022;75(3):372–381. doi: 10.1093/cid/ciab982. [DOI] [PubMed] [Google Scholar]
- 24.van Well GTJ, Paes BF, Terwee CB, Springer P, Roord JJ, Donald PR, et al. Twenty years of pediatric tuberculous meningitis: a retrospective cohort study in the western cape of South Africa. Pediatrics. 2009;123(1):e1–e8. doi: 10.1542/peds.2008-1353. [DOI] [PubMed] [Google Scholar]
- 25.Basu Roy R, Thee S, Blázquez-Gamero D, Falcón-Neyra L, Neth O, Noguera-Julian A, et al. Performance of immune-based and microbiological tests in children with tuberculosis meningitis in Europe: a multicentre Paediatric Tuberculosis Network European Trials Group (ptbnet) study. Eur Respir J. 2020;56(1):1902004. doi: 10.1183/13993003.02004-2019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.van Toorn R, Schaaf HS, Laubscher JA, van Elsland SL, Donald PR, Schoeman JF. Short intensified treatment in children with drug-susceptible tuberculous meningitis. Pediatr Infect Dis J. 2014;33(3):248. doi: 10.1097/INF.0000000000000065. [DOI] [PubMed] [Google Scholar]
- 27.Donald PR. Cerebrospinal fluid concentrations of antituberculosis agents in adults and children. Tuberculosis. 2010;90(5):279–292. doi: 10.1016/j.tube.2010.07.002. [DOI] [PubMed] [Google Scholar]
- 28.Savic RM, Ruslami R, Hibma JE, Hesseling A, Ramachandran G, Ganiem AR, et al. Pediatric tuberculous meningitis: model-based approach to determining optimal doses of the anti-tuberculosis drugs rifampin and levofloxacin for children. Clin Pharmacol Ther. 2015;98(6):622–629. doi: 10.1002/cpt.202. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Yunivita V, Dian S, Ganiem AR, Hayati E, Hanggono Achmad T, Purnama Dewi A, et al. Pharmacokinetics and safety/tolerability of higher oral and intravenous doses of rifampicin in adult tuberculous meningitis patients. Int J Antimicrob Agents. 2016;48(4):415–421. doi: 10.1016/j.ijantimicag.2016.06.016. [DOI] [PubMed] [Google Scholar]
- 30.Ruslami R, Ganiem AR et al. (2012) Intensified regimen containing rifampicin and moxifloxacin for tuberculous meningitis: an open-label, randomised controlled phase 2 trial—The Lancet Infectious Diseases [Internet]. https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(12)70264-5/fulltext. Zugegriffen: 22. Januar 2023 [DOI] [PubMed]
- 31.Bonnet F (2022) Intensified tuberculosis treatment to reduce the mortality of HIV-infected and uninfected patients with tuberculosis meningitis (INTENSE-TBM): Study protocol for a Phase III Randomized Controlled Trial [Internet]. In Review. https://www.researchsquare.com/article/rs-1941581/v1. Zugegriffen: 29. Okt. 2022 [DOI] [PMC free article] [PubMed]
- 32.van Toorn R, Solomons RS, Seddon JA, Schoeman JF. Thalidomide use for complicated central nervous system tuberculosis in children: insights from an observational cohort. Clin Infect Dis. 2021;72(5):e136–e145. doi: 10.1093/cid/ciaa1826. [DOI] [PubMed] [Google Scholar]
- 33.Schutz C, Davis AG, Sossen B, Lai RPJ, Ntsekhe M, Harley YX, et al. Corticosteroids as an adjunct to tuberculosis therapy. Expert Rev Respir Med. 2018;12(10):881–891. doi: 10.1080/17476348.2018.1515628. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.DRTB-Field-Guide-2021_v5.1.pdf. http://sentinel-project.org/wp-content/uploads/2022/04/DRTB-Field-Guide-2021_v5.1.pdf. Zugegriffen: 29. Okt. 2022