Abstract
Hintergrund
Die Lunge ist ein häufiger Ort der Metastasierung bei einer Vielzahl unterschiedlicher Tumorerkrankungen.
Fragestellung
Darstellung der Inzidenz, Diagnostik, Therapie und Prognose von Lungenmetastasen.
Material und Methode
Sichtung der relevanten Literatur über öffentlich zugängliche Datenbanken (u. a. PubMed, Embase) und Bewertung im multidisziplinären Expertenkreis
Ergebnisse
Die Lungenmetastasierung bedarf einer differenzierten und spezialisierten radiologischen und histopathologischen Bewertung. Es stehen zahlreiche wirksame lokal-ablative und systemische Behandlungsverfahren zur Verfügung.
Schlussfolgerung
Der Beitrag gibt eine multidisziplinäre ausgerichtete Übersicht über Diagnose- und Therapieoptionen bei Lungenmetastasen
Schlüsselwörter: Pulmonale Metastasektomie, Histopathologie, Radiologische Bildgebung, Prognose, Interdisziplinäre Zusammenarbeit
Abstract
Background
The lung is a common site of metastasis in numerous cancers.
Objective
To present the incidence, diagnosis, treatment, and prognosis of pulmonary metastases.
Materials and methods
Review of relevant literature via publicly available databases (including PubMed and Embase) and evaluation in a multidisciplinary expert panel.
Results
Pulmonary metastasis requires differential and specialized radiologic and histopathologic evaluation. Numerous effective local ablative and systemic treatment modalities are available.
Conclusion
This article provides a multidisciplinary focused review of diagnostic and treatment options for pulmonary metastases.
Keywords: Pulmonary metastasectomy, Histopathology, Radiologic imaging, Prognosis, Interdisciplinary communication
Lungenmetastasen entstehen als hämatogene oder lymphogene Absiedelungen verschiedenster Primärneoplasien. Sie treten solitär oder multipel bei ca. 30 % aller an Krebs erkrankten Patienten auf [1]. Als Primärtumoren kommen Tumoren des Gastrointestinaltraktes (Adenokarzinome des Kolons, des Magens und des pankreatikobiliären Systems), der Niere (v. a. klarzelliges Nierenzellkarzinom), Plattenepithelkarzinome des Kopf-Hals-Bereichs und des Ösophagus, Adenokarzinome der Brustdrüse, der Schilddrüse sowie Hodentumoren (v. a. Chorionkarzinom; [2, 3]). Bei den nichtepithelialen Tumoren sind insbesondere das maligne Melanom und die Sarkome zu nennen [2, 3]. Zumeist werden Lungenmetastasen in der primären Ausbreitungsdiagnostik oder in der bildgebenden Nachsorge detektiert.
Bildgestützte Diagnostik und Therapie
Die Ausbreitungsdiagnostik bei Tumorerkrankungen schließt die Lungenbildgebung in aller Regel mit ein. Im Rahmen der Planung einer systemischen Therapie oder in der Nachsorge sind der möglichst spezifische Einzelnachweis und die zuverlässige Größenbestimmung mit exakter Messung der Wachstumsdynamik im Verlauf essenziell. Abhängig von den technischen Möglichkeiten und der onkologischen Rationale einer lokoregionären Therapie durch Resektion, Lokalablation oder Bestrahlung kann auch die anatomische Topographie sowie die Funktionseinschätzung der Lunge von Bedeutung sein. Entsprechend muss die bildgebende Diagnostik geeignet sein, Lungenmetastasen geometrisch exakt und mit hohem Kontrast zum umgebenden Gewebe und der intrapulmonalen Luft in detaillierter räumlicher Auflösung zu liefern oder aber tiefergehende Informationen über das Läsionsgewebe zu erheben, die Aufschluss über Entität und ggf. Ansprechen liefern. Hinderlich ist dabei u. a. die Atembeweglichkeit der Zielstrukturen.
Der Goldstandard ist die Multidetektor-Computertomographie (CT). Sie erlaubt bei sehr schneller Bildakquisition von wenigen Sekunden in Millimeterauflösung sowie scharfem Kontrast in der Lunge eine sehr sensitive und dreidimensional exakte Darstellung von Lungenmetastasen bei robusten Bildqualitätsverhältnissen sogar bei pulmonal eingeschränkten Patienten. Bei rein pulmonaler Fragestellung ist die CT auch im Niedrigstrahlendosisbereich ohne Kontrastmittel möglich. Unterstützend werden Bildnachbearbeitungen angewendet, wie multiplanare Rekonstruktionen, Maximum-Intensitäts-Projektionen, CAD(„computer aided diagnosis“)-Systeme und Texturanalysen mit zunehmender Unterstützung durch künstliche Intelligenz [4].
Ein Vorteil der CT ist, dass gleichzeitig ein Status der Lunge und einer der angrenzenden Organe erhoben werden kann, welcher für die Therapiesteuerung eine Rolle spielen kann.
So kann eine funktionseinschränkende Lungengerüsterkrankung oder auch eine therapieinduzierte Pneumonitis beurteilt werden. Auch Pneumonien (Abb. 1), Lungenarterienembolien, Pleurabefall, Lymphangiose, Beteiligung des Mediastinums bzw. der Thoraxwand und Pleuraergüsse sind mit der CT erfassbar.
In der CT lässt sich neben dem Lungenstatus auch der Status angrenzender Organe erheben
Die Rundherdbewertung trennt durch morphologische Kriterien und Wachstumsdynamik im Verlauf sichere und wahrscheinliche Metastasenbefunde von benignen Läsionen, wie z. B. Hamartome (Fettanteil), Chondrome (Popcorn-artige Verkalkungen), Rundatelektasen (Kometenschweifzeichen) oder fokale Infiltrate (nicht solide), relativ zuverlässig (Abb. 1). Hinweise auf ein primäres statt sekundäres pulmonales Malignom (Spiculae) sollten im Rahmen der Therapieplanung ernst genommen und ggf. geklärt werden (Abb. 1; [5]). Im Zweifelsfall kann anhand der CT auch eine weiterführende Diagnostik geplant werden, entweder mittels einer CT-gestützten Punktion bzw. einer Drahtmarkierung für eine minimal-invasive chirurgische Bergung oder durch Einsatz zusätzlicher Bildgebung (z. B. FDG-PET/CT (Fluor-Desoxyglukose-Positronenemissionstomographie-Computertomographie) anreichernden Lungenmetastase des linken Unterlappens.) bzw. durch sinnvolle Verlaufs-CT-Intervalle. Je nach onkologischem Szenario kann über die gleiche Technik wie bei der CT-gestützten Biopsie auch eine Therapie erfolgen – nämlich durch die CT-gestützte Ablation z. B. mit der Radiofrequenz‑/Mikrowellenablation, der CT-gestützten Brachytherapie oder auch durch Markereinbringung für eine getriggerte perkutane Bestrahlung [6].
Die Magnetresonanztomographie (MRT) hat durch beschleunigte 3‑D-Sequenzen immense Fortschritte bei der Lungenbildgebung gemacht, ist allerdings nicht ganz so sensitiv, und auch die Größenbestimmung insbesondere bei kleinen Läsionen ist weniger verlässlich im Vergleich zur CT. Hinzu kommen höhere Kosten und geringere Verfügbarkeit, was die Lungen-MRT bei der Ausbreitungsdiagnostik, selbst als Erweiterung einer ohnehin geplanten Oberbauch-MRT auf wenige sinnvolle Szenarien (wie z. B. pädiatrische Patient:innen) beschränkt (Abb. 1; [7]).
Die Positronenemissionstomographie (PET) steht vor allem mit dem Tracer F18-Fuorodesoxyglukose (FDG) für die Charakterisierung von Läsionen ab einer Größe von ca. 10 mm zur Verfügung, benötigt aber für eine ausreichende Sensitivität im Rahmen des Stagings die CT-Komponente wegen der Neigung zu falsch-negativen Befunden bei kleinen Läsionen.
Aufgrund der fehlenden Spezifität für maligne Prozesse ist bei der FDG-PET auch mit falsch-positiven Befunden bei inflammatorischen Prozessen zu rechnen. Hinzu kommen spezifische Tracer für einige Tumorentitäten, wie Prostatakarzinom (prostataspezifisches Membranantigen, PSMA) und neuroendokrinen Tumoren (Somatostatinanaloga).
Goldstandard für Ausbreitungsdiagnostik, Therapiekontrolle und Lokaltherapieplanung bei Lungenmetastasen ist also nach wie vor die Thorax-CT, welche durch die Optionen FDG-PET, CT-gestützte Biopsie und Verlaufskontrolle ergänzt wird. Für die minimal-invasive Therapie mittels direkter Ablation oder Markierung für Resektion oder Strahlentherapie ist die CT-geführte Punktion hervorragend geeignet.
Histologische Einordnung
Die diagnostische Sicherung erfolgt in den meisten Fällen mittels CT-gestützter Biopsie. Bei einzelnen Raumforderungen erfolgt eine Segmentresektion oder ein atypisches Resektat zur Diagnosesicherung. Die zugrundeliegende Histomorphologie muss nicht zwingend maligne sein. So können sich hinter den radiologisch auffälligen Befunden z. B. intrapulmonale Lymphknoten oder Pneumokoniosen (z. B. Silikosen) verbergen. Auch Granulome (z. B. Sarkoidose) oder raucherassoziierte Erkrankungen (z. B. desquamative interstitielle Pneumonie, DIP) können klinisch metastasensuspekt imponieren [2, 3].
Die Diagnose maligner Befunde bereitet zumeist wenig Schwierigkeiten. Insbesondere Sarkome lassen sich je nach Subtyp, z. B. durch ihre klassischen Gefäßmuster und den mesenchymalen Aufbau, etwa glattmuskuläre Fasern beim Leiomyosarkom, gut dem Primärtumor zuordnen.
Sarkome lassen sich je nach Subtyp gut dem Primärtumor zuordnen
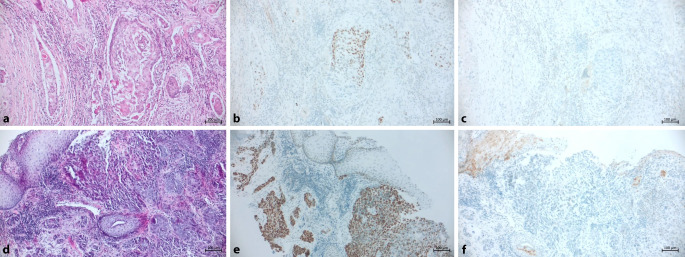
Das maligne Melanom kann, wenn es keine Pigmentierung aufweist, diagnostisch Probleme bereiten. Immunhistologisch sind hier MelanA, HMB45, S100, SOX19, MITF hilfreich [2, 3]. Weniger problematisch sind Metastasen des Mammakarzinoms, insbesondere bei Rezeptorpositivität (Immunhistologie für Östrogen‑, Progesteronrezeptor und HER2), sowie klarzellige Nierenzellkarzinome. Letztere weisen eine charakteristische hellzellige Morphologie auf, eine Immunhistologie (z. B. PAX8, CD10) ist selten (z. B. bei anderen Subtypen) notwendig [2, 3]. Eine „Blickdiagnose“ stellen Metastasen des kolorektalen Adenokarzinoms dar; diese bilden sogenannte „Schmutznekrosen“ aus (Abb. 2). Auch die Morphologie von Metastasen des Magens und des pankreatikobiliären System kann suggestiv sein (gangartiges Wuchsmuster, intra- und extrazelluläre Schleimbildung). Gegebenenfalls empfiehlt sich ein Abgleich mit der Histologie des Primärtumors. Insbesondere bei isoliert vorliegenden pulmonalen Herdbefunden und längerem Intervall zwischen Primärdiagnose und nun fraglicher Metastasierung kann sonst die differenzialdiagnostische Überlegung eines primär enterischen, kolloidalen oder muzinösen Adenokarzinoms der Lunge in Betracht kommen. Sollten klinisches Bild und immunhistologische Untersuchungen (u. a. CK7, CK20, CDX2, SATB2) eine abschließende Diskriminierung nicht ermöglichen, sind vergleichende molekularpathologische Untersuchungen hilfreich (Abb. 3) [8, 9].

Vergleichbares gilt bei Plattenepithelkarzinomen des Kopf-Hals-Bereiches: Primärtumor und Metastase sollten konventionell-morphologisch (v. a. Bautyp, z. B. basaloid, hellzellig, Grad der Verhornung) und immunhistologisch verglichen werden. Immunhistologisch sind hierbei die Zellzyklusproteine p16 und p53 sinnvoll (Abb. 2). Auch die PD-L1(„programmed cell death protein 1 ligand 1“)-Expression kann hilfreich sein. So kann (identische vs. diskordante Expressionsmuster) vor dem klinischen und radiologischen Hintergrund meist eine gute Unterscheidung erzielt werden. Sollte (in seltenen Fällen) diese nicht sicher möglich sein, kann z. B. eine Methylierungsanalyse erfolgen [8].
Die Unterscheidung zwischen Metastase und Primärtumor der Lunge beim schleimbildenden Adenokarzinom und Plattenepithelkarzinom kann Probleme bereiten, ist jedoch wichtig, da sich das chirurgische Vorgehen ändert und auch weitere therapeutische Implikationen bestehen können: So würde ein Patient mit einer R0-resezierten Metastase im Regelfall keine weitere Therapie erhalten, wohingegen bei einem primären Lungenkarzinom ab UICC-Stadium IIA eine adjuvante Therapie folgen würde [10]. Es sei in diesem Kontext darauf verwiesen, dass Lungenmetastasen im Allgemeinen und solche eines Plattenepithelkarzinoms im Besonderen, zentral in der Lunge (also am Hauptbronchus) lokalisiert sein können und zusätzlich eigene hiläre Lymphknotenmetastasen ausbilden können. Klinisch imponiert dies wie ein Primärtumor der Lunge und untermauert die Notwendigkeit des oben genannten Vorgehens.
Chirurgische Therapie
Unter allen Lungenmetastasen ist das kolorektale Karzinom der am häufigsten zugrunde liegende Primärtumor. Studien bestätigen das kolorektale Karzinom als einen günstigen histologischen Typ für die Metastasektomie mit 5‑Jahre-Überlebensraten von bis zu 68 % [11]. Ein präoperativ erhöhtes karzinoembryonales Antigen (CEA) im Serum, ein Patient:innenalter >70 Jahre und extrathorakale metastatische Läsionen gelten als ungünstige prognostische Faktoren [12].
Mit 5‑Jahre-Überlebensraten nach Resektion bis 75 % ist das Nierenzellkarzinom der zweithäufigste primäre Tumor unter den pulmonalen Metastasen [13].
Für Patient:innen von metastasierenden Sarkomen werden 5‑Jahre-Gesamtüberlebensraten nach der Resektion zwischen 15 und 51 % berichtet [14].
Es gibt keinen einheitlichne Zahlenwert für bzw. gegen eine pulmonale Metastasektomie bei multiplen Lungenmetastasen
Nach einer pulmonalen Metastasektomie von Karzinomen der Kopf- und Halsregion liegt die 5‑Jahre-Gesamtüberlebensrate zwischen 21 und 59 % [15]. Adenoidzystische Karzinome haben dabei eine bessere Prognose im Vergleich zu Plattenepithelkarzinomen [16]. Ein hohes Patient:innenalter und Lokalrezidive vor Auftreten von Lungenmetastasen sind Faktoren, die mit einer schlechteren Prognose und einem schlechteren Gesamtüberleben einhergehen [17, 18].
Die Anzahl der metastatischen Läsionen gilt allgemein als eine wichtige prognostische Variable. Eine größere Anzahl von Läsionen (≥3) wird mit einer schlechteren Prognose verbunden [19]. Ein Grenzwert für die Ablehnung der pulmonalen Metastasektomie bei multiplen Lungenmetastasen existiert allerdings nicht.
Kriterien der pulmonalen Metastasenchirurgie
Das Grundprinzip in der operativen Behandlung von Lungenmetastasen ist die Wahrung von Selektionskriterien onkologisch und funktionell geeigneter Patient:innen [20]. Diese allgemeinen Kriterien sind
Kontrolle des Primärtumors,
Fehlen oder Therapie extrathorakaler Metastasen und
vollständige technische Resektabilität der Metastasen bei funktioneller Operabilität [22].
Obwohl fachdisziplinübergreifende Übereinstimmung bezüglich dieser Kriterien besteht, gibt es keine multidisziplinären Leitlinien anerkannter wissenschaftlicher Fachgesellschaften, die den chirurgischen Ansatz, die Art der Resektion und die Notwendigkeit einer perioperative Lymphknotenuntersuchung eindeutig festlegen [23].
Operative Techniken
Hauptziel einer pulmonalen Metastasektomie ist die vollständige Resektion der Metastasen unter weitgehender Erhaltung des gesunden Lungenparenchyms. Dies wird bei peripheren Läsionen meist durch Keilresektion, Exzision durch Elektrokauterisation oder Laserenukleation erreicht. Anatomische Resektion werden erforderlich, um radikale Resektionen zentraler Läsionen zu erreichen. Ähnlich den europäischen Daten der European Society of Thoracic Surgeons (ESTS) liegt laut International Registry of Lung Metastases die Häufigkeit von Keilresektionen bei 67 %, von Segmentektomien bei 9 %, von Lobektomien bei 21 % und von Pneumonektomien bei 3 % [23]. Eine Pneumonektomie sollte nur bei hochselektierten Patient:innen erwogen werden [23]. Die laserunterstützte Chirurgie hat den Vorteil, dass sie parenchymsparend die Resektion einer größeren Anzahl von Metastasen im Vergleich zur Keilresektion erlaubt [23].
Die Thorakotomie gilt als der chirurgische Standardansatz für die Durchführung von pulmonalen Metastasektomien. Der Hauptvorteil der Thorakotomie ist die Möglichkeit der bimanuellen Abtastung der Lunge, um alle vorhandenen Befunde zu detektieren. Den Vorteilen der videoassistierten Thorakoskopie VATS (kürzere postoperative Erholungszeit, geringeres Schmerzniveau, positive Auswirkungen auf die kurzfristige Lebensqualität) steht nachteilig ein eingeschränktes Ausmaß der Palpation der Lunge gegenüber (Abb. 4 und 5). Gleichzeitig scheint aber zumindest bei Metastasen kolorektalen Ursprungs das krankheitsfreie Überleben nach VATS-Metastektomie nicht negativ beeinflusst zu werden [24].

Gemäß dem ESTS-Expertenkonsens gilt die Empfehlung zur intraoperativen Lymphknotenentnahme. Ein nachgewiesener mediastinaler Lymphknotenbefall nach pulmonaler Metastasektomie ist ein schlechter prognostischer Faktor [21, 25].
Bei begründeter Aussicht auf ein langfristiges Überleben unterscheiden sich bei Rezidiv-Lungenmetastasen die chirurgischen Indikationskriterien für wiederholte pulmonale Metastasektomie nicht von denen der Erstoperation. Ein längerer Zeitabstand zwischen der ersten pulmonalen Metastasektomie und dem Auftreten von wiederkehrenden Metastasen gilt als prognostisch günstig [19].
Strahlentherapie pulmonaler Metastasen
Indikation und Ergebnisse
Die Strahlentherapie stellt eine nichtinvasive Therapieform dar, die sowohl zur Palliation als auch zur lokalen Kontrolle pulmonaler Metastasen zum Einsatz kommen kann. Während noch vor 20 Jahren eine Strahlenbehandlung bei pulmonaler Metastasierung routinemäßig nur in niedriger Dosierung und konservativer Fraktionierung zur Symptomkontrolle, beispielsweise bei Blutungen, angewandt wurde, hat sich ihr Indikationsspektrum mit zunehmend verbesserter Prognose vieler Krebserkrankungen und den sich entwickelnden Möglichkeiten der hochpräzisen stereotaktischen Bestrahlungen deutlich erweitert.
Bei funktioneller Inoperabilität lässt sich alternativ die lokal sanierende stereotaktische Radiatio einsetzen
Insbesondere bei oligometastasierten Tumorleiden kommt eine hochdosierte ablative, also lokal sanierende stereotaktische Bestrahlung auch mehrerer pulmonaler Metastasen heute bei vielen Patienten im Laufe ihrer Erkrankung zum Einsatz und kann selbst bei funktioneller Inoperabilität sicher und mit sehr guten lokalen Ergebnissen durchgeführt werden [25].
Im Vergleich zur alleinigen systemischen Therapie haben lokal-ablative Behandlungen von pulmonalen Metastasen in einer randomisierten Phase-II-Studie beim nichtkleinzelligen Lungenkarzinom deutliche Verbesserungen im progressionsfreien (14,2 vs. 4,4 Monate) und Gesamtüberleben (18,9 vs. 17,0 Monate) betroffener Patient:innen gezeigt [26]. Insbesondere bei oligometastasierten Tumorleiden mit 5 oder weniger Metastasen hat die ablative, hochdosierte Strahlentherapie aller Tumorlokalisationen überzeugende Ergebnisse geliefert; so resultierte in der randomisierten Phase-II-SABR-COMET-Studie bei einer Vielzahl zugrunde liegender Primärtumorerkrankungen nach 8 Jahren Nachbeobachtungszeit die Hinzunahme einer stereotaktischen Bestrahlung gegenüber der alleinigen palliativen systemischen Therapie in einer Verdopplung des Gesamtüberlebens von 13,6 auf 27,2 Monate [27].
Für die stereotaktische Hochdosis-Bestrahlung sind neben der direkten DNA-Schädigung und Wachstumshemmung bestrahlter Tumoren auch im Vergleich zur konventionellen Bestrahlung gesteigerte immunogene Effekte beschrieben. Zahlreiche präklinische und erste klinische Daten zeigen nach stereotaktischer Bestrahlung eine Mobilisierung von T‑Zellen im Tumormikromilieu, eine (Re‑)Sensibilisierung gegenüber Immuncheckpoint-Inhibitoren und eine Aktivierung einer systemischen Immunantwort [28]. Auch wenn zur Kombinationsbehandlung bisher nur wenig Evidenz aus klinischen Studien vorliegt, könnte in Zukunft die stereotaktische Hochdosis-Bestrahlung in Verbindung mit einer Immuntherapie eine weitere Verbesserung der Prognose pulmonal metastasierter Patienten bei einigen Tumorerkrankungen mit sich bringen.
Technik der stereotaktischen Strahlentherapie
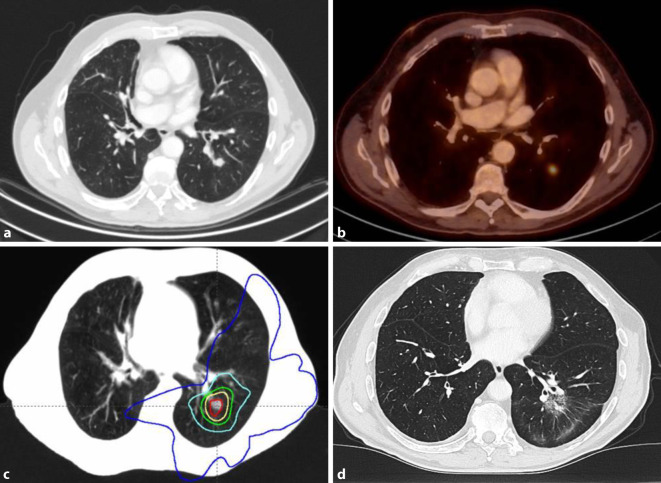
In der modernen Strahlentherapie werden pulmonale Metastasen fast ausschließlich mittels stereotaktischer, hochdosierter Bestrahlung behandelt (Abb. 6). Hierunter versteht man Bestrahlungskonzepte, die mit hoher Präzision hohe Strahlendosen in einer oder nur wenigen Fraktionen (also mit hohen Einzeldosen) applizieren. Durch hohe Einzeldosen und optimale Präzision können Tumoren auf diese Weise biologisch wirksame Dosen von mehr als 100 Gy (Gray) erhalten, was die Dosierungsmöglichkeiten der konventionellen Bestrahlung deutlich übersteigt. Nur sehr große (>5 cm) und in direkter Lagebeziehung zu Hauptbronchien und hilären Blutgefäßen lokalisierte Metastasen limitieren die Möglichkeiten der stereotaktischen Bestrahlung und sollten nur mit geringen (Einzel‑)Dosen therapiert werden, um das Risiko höhergradiger Strahlenschäden zu minimieren.
Die stereotaktische Bestrahlung setzt nicht nur eine präzise Lagerung des Patienten, sondern auch eine räumlich wie zeitlich aufgelöste CT-Schnittbildgebung zur Bestrahlungsplanung voraus. So kann ein über alle Atemphasen integriertes Tumorvolumen festgelegt werden, das – um zusätzliche geringe Sicherheitssäume zur Kompensation technischer Abweichungen bei den einzelnen Bestrahlungsfraktionen erweitert – als Zielvolumen reproduzierbar und während des gesamten Atemzyklus bestrahlt werden kann. Sog. Gating-Verfahren und Bestrahlungen in Atemanhaltetechnik („deep inspiration breath-hold“) minimieren die Atemverschieblichkeit und können so das zu bestrahlende Volumen bei bestimmten Patienten zusätzlich reduzieren.
Steile Dosisabfälle zum umliegenden gesunden Lungenparenchym ermöglichen bei der stereotaktischen pulmonalen Bestrahlung eine verträgliche und nebenwirkungsarme Therapie, die selbst bei älteren und komorbiden Patienten sicher eingesetzt werden kann. Hierfür ist neben der präzisen Patientenlagerung und konformalen Bestrahlungsplanung auch eine präzise Qualitätssicherung und Lagerungskontrolle (einschließlich Bewegungsmanagement) vor und während jeder Bestrahlungssitzung notwendig.
Hinsichtlich der optimalen Dosierung und Fraktionierung besteht bisher kein abschließender Konsensus; auf die konventionelle Strahlentherapie normierte biologisch wirksame Gesamtdosen von mehr als 100 Gy sind allerdings mit höheren Raten an lokaler Kontrolle assoziiert und werden daher regelhaft gefordert [29].
Multimodale und systemische Therapie
Die spezifischen Empfehlungen zur multimodalen Therapie von Lungenmetastasen richten sich an den jeweiligen organbezogenen Leitlinien der wissenschaftlichen Fachgesellschaften.
Generell gilt, dass Patient:innen mit neu aufgetretenen Lungenmetastasen in einem qualifizierten multidisziplinären Tumorboard eines zertifizierten onkologischen Zentrums besprochen werden sollen.
Die lokalen und systemischen Behandlungsmöglichkeiten von Lungenmetastasen sind mannigfach. Neben der Schaffung optimierter Heilungschancen spielt häufig auch eine bestmögliche Palliation von Schmerzen, Atemnot, Husten und weiteren respiratorischen Einschränkungen eine wichtige Rolle für den Funktionserhalt und die Lebensqualität der Patienten.
Hinsichtlich der Wirksamkeit und Nebenwirkungsrate von Systemtherapien bietet die Lungenmetastasierung Chancen, aber auch Herausforderungen, die bekannt sein sollten.
Während bei klassischen zytotoxischen Chemotherapien keine wesentlichen Unterschiede im Ansprechen von Lungenmetastasen im Vergleich zu anderen Lokalisationen berichtet wurden, könnte sich die Sachlage bei Immuntherapien anders darstellen. Eine jüngst publizierte Studie einer Forschergruppe aus Barcelona beschreibt ein immunogen aktiviertes Molekularprofil von Lungenmetastasen unterschiedlicher Tumorentitäten im Vergleich zu nichtpulmonalen Metastasen. Dies könnte zu einem besseren Ansprechen von Lungenmetastasen auf immunstimulierender Therapie mit Immuncheckpointinhibitoren (ICI) führen [30]. Dieser Befund ist interessant, bedarf aber der Validierung im klinischen Kontext.
Zahlreiche Krebsmedikamente weisen ein pneumotoxisches Nebenwirkungspotenzial auf. Dazu gibt die frei zugängliche Internetplattform Pneumotox Auskunft (https://www.pneumotox.com/drug/index/). Ein potenziell pneumotoxisches Zytostatikum ist Bleomycin, welches vor allem zur Behandlung von Keimzelltumoren eingesetzt wird. Bestehende respiratorische Einschränkungen stellen eine Kontraindikation gegen Bleomycin dar, um einer kritischen Reduktion des Gasaustauschs im Falle einer medikamentös induzierten Lungenfibrose vorzubeugen. Die Lungen ist ein häufiger Metastasierungsweg von Hoden- und extragonadalen Keimzelltumoren. Dies kann je nach Einzelfall das für den Gasaustausch zur Verfügung stehende Lungenvolumen signifikant einschränken. Eine genaue Anamnese und lungenfunktionelle Untersuchung ist obligat vor Einsatz von Bleomycin. Bei vorbestehender relevanter Einschränkung sollen alternative und weitgehend gleich wirksame Alterativen (z. B. Ifosfamid) zum Einsatz kommen [31].
Alle bislang verfügbaren PD(„programmed cell death protein 1“)- oder PD-Ligand-1- ioder CTLA-4(„cytotoxix T‑lymphocyte-associated protein 4“)-inhibierenden Antikörper (ICI) können pulmonale Nebenwirkungen, insbesondere eine immunogen ausgelöste Pneumonitis verursachen [32]. ICI werden heute breit eingesetzt, auch bei Tumorerkrankungen mit häufiger Lungenbeteiligung, wie dem malignen Melanom, Nierenzellkarzinom, Lungenkarzinom, Kopf-Hals-Tumoren, Ösophagus- und Magenkarzinom. Insofern ist beim Auftreten oder bei einer Verschlechterung respiratorischer Symptome unter ICI unbedingt an eine mögliche Arzneimittelnebenwirkung zu denken und unverzüglich eine Unterbrechung der ICI-Therapie mindestens bis zur weiteren differenzialdiagnostischen Abklärung zu veranlassen. Bestätigt sich der Verdacht, bestehen dezidierte Empfehlungen, wie weiter zu verfahren ist [33].
Interstitielle Lungenerkrankungen (ILD) und Pneumonitis sind auch eine häufige Nebenwirkung der Antikörper-Wirkstoff-Konjugate („antibody-drug conjugates“, ADC). Insbesondere Trastuzumab-Deruxtecan (T-DXd), das zur Behandlung HER2(humaner epidermaler Wachstumsfaktorrezeptor-2)-positiver Mamma- und Magenkarzinome eingesetzt wird, führt in ca. 10 % der Behandlungen zu ILD. In seltenen Fällen (1–2 %) verläuft diese schwer, in Einzelfällen wurden Todesfälle berichtet [34]. Als einer der wesentlichen Risikofaktoren für das Auftreten von ILD unter T‑DXd wurde eine vorbestehende pulmonale Komorbidität eruiert [35], zu der auch eine Lungenmetastasierung zählen kann.
Fazit für die Praxis
Die Lunge ist ein häufiger Metastasierungsort bei zahlreichen malignen Grunderkrankungen.
Die differenzialdiagnostische Abgrenzung zu benignen, entzündlichen und primären malignen Erkrankungen erfordert eine differenzierte bildgebende Diagnostik und oftmals die histologische Sicherung.
Patienten mit neu auftretender pulmonaler Metastasierung sollen in einem qualifizierten multidisziplinären Tumorboard besprochen werden.
Neben den chirurgischen gibt es wirksame lokal-ablative Therapieverfahren für Lungenmetastasen. Die beste Datenlage besteht für die stereotaktische Radiotherapie.
Lungenmetastasen werden oftmals systemisch-medikamentös behandelt. Dabei sind je nach verwendeter Arzneimittelklasse unerwünschte pneumotoxische Effekte zu beachten.
Einhaltung ethischer Richtlinien
Interessenkonflikt
F. Lordick berichtet Vortragshonorare von Art Tempi, AstraZeneca, Servier, Bristol-Myers Squibb, Daaichi Sankyo, Eli Lilly, Falk Foundation, Incyte, Medscape, Merck KGaA, Merck Sharp & Dohme, Novartis, Roche, Servier und StreamedUp; Beraterhonorare von Amgen, Astellas Pharma, Biontech, Bristol-Myers Squibb, Merck Sharp and Dohme; institutionelle Forschungsunterstützung durch AstraZeneca, Bristol-Myers Squibb, Gilead und Iomedico. S. Krämer, H. Bläker, T. Denecke, N. Nicolay und M. von Laffert geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autor/-innen keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.Köhler D, Schönhofer B, Voshaar T. Pneumologie. Stuttgart: Thieme; 2010. p. 241. [Google Scholar]
- 2.Suster S, Moran C. Biopsy interpretation of the Lung. Wolters Kluwer; 2013. Metastatic tumors to the lung; pp. 369–401. [Google Scholar]
- 3.Suster S, Moran C. Diagnostic pathology, thoracic. Amirsys; 2012. Neoplasms, metastatic; pp. I-3-2–I-3-33. [Google Scholar]
- 4.Vliegenthart R, Fouras A, Jacobs C, Papanikolaou N. Innovations in thoracic imaging: CT, radiomics, AI and x-ray velocimetry. Respirology. 2022;27(10):818–833. doi: 10.1111/resp.14344. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Brandman S, Ko JP. Pulmonary nodule detection, characterization, and management with multidetector computed tomography. J Thorac Imaging. 2011;26(2):90–105. doi: 10.1097/RTI.0b013e31821639a9. [DOI] [PubMed] [Google Scholar]
- 6.Vogl TJ, Eckert R, Naguib NN, Beeres M, Gruber-Rouh T, Nour-Eldin NA. Thermal ablation of colorectal lung metastases: retrospective comparison among laser-induced thermotherapy, radiofrequency ablation, and microwave ablation. AJR Am J Roentgenol. 2016;207(6):1340–1349. doi: 10.2214/AJR.15.14401. [DOI] [PubMed] [Google Scholar]
- 7.Hirsch FW, Sorge I, Vogel-Claussen J, Roth C, Gräfe D, Päts A, Voskrebenzev A, Anders RM. The current status and further prospects for lung magnetic resonance imaging in pediatric radiology. Pediatr Radiol. 2020;50(5):734–749. doi: 10.1007/s00247-019-04594-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Jurmeister P, Schöler A, Arnold A, Klauschen F, Lenze D, Hummel M, Schweizer L, Bläker H, Pfitzner BM, Mamlouk S, Sers C, Denkert C, Stichel D, Frost N, Horst D, von Laffert M, Capper D. DNA methylation profiling reliably distinguishes pulmonary enteric adenocarcinoma from metastatic colorectal cancer. Mod Pathol. 2019;32(6):855–865. doi: 10.1038/s41379-019-0207-y. [DOI] [PubMed] [Google Scholar]
- 9.Jurmeister P, Vollbrecht C, Behnke A, Frost N, Arnold A, Treue D, Rückert JC, Neudecker J, Schweizer L, Klauschen F, Horst D, Hummel M, Dietel M, von Laffert M. Next generation sequencing of lung adenocarcinoma subtypes with intestinal differentiation reveals distinct molecular signatures associated with histomorphology and therapeutic options. Lung Cancer. 2019;138:43–51. doi: 10.1016/j.lungcan.2019.10.005. [DOI] [PubMed] [Google Scholar]
- 10.Postmus PE, Kerr KM, Oudkerk M, Senan S, Waller DA, Vansteenkiste J, Escriu C, Peters S, ESMO Guidelines Committee Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28(suppl_4):iv1–iv21. doi: 10.1093/annonc/mdx222. [DOI] [PubMed] [Google Scholar]
- 11.Murakawa T. Past, present, and future perspectives of pulmonary metastasectomy for patients with advanced colorectal cancer. Surg Today. 2021;51(2):204–211. doi: 10.1007/s00595-020-02119-y. [DOI] [PubMed] [Google Scholar]
- 12.Okumura T, Boku N, Hishida T, Ohde Y, Sakao Y, Yoshiya K, Higashiyama M, Hyodo I, Mori K, Kondo H. Surgical outcome and prognostic stratification for pulmonary metastasis from colorectal cancer. Ann Thorac Surg. 2017;104(3):979–987. doi: 10.1016/j.athoracsur.2017.03.021. [DOI] [PubMed] [Google Scholar]
- 13.Meacci E, Nachira D, Congedo MT, Porziella V, Chiappetta M, Ferretti G, Iaffaldano A, Ciavarella LP, Margaritora S. Lung metastasectomy following kidney tumors: outcomes and prognostic factors from a single-center experience. J Thorac Dis. 2017;9(Suppl 12):S1267–S1272. doi: 10.21037/jtd.2017.05.04. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Marulli G, Mammana M, Comacchio G, Rea F. Survival and prognostic factors following pulmonary metastasectomy for sarcoma. J Thorac Dis. 2017;9(Suppl 12):S1305–S1315. doi: 10.21037/jtd.2017.03.177. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Shiono S. The role of pulmonary metastasectomy for pulmonary metastasis from head and neck cancer. J Thorac Dis. 2021;13(4):2643–2648. doi: 10.21037/jtd.2020.04.14. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Girelli L, Locati L, Galeone C, Scanagatta P, Duranti L, Licitra L, Pastorino U. Lung metastasectomy in adenoid cystic cancer: Is it worth it? Oral Oncol. 2017;65:114–118. doi: 10.1016/j.oraloncology.2016.10.018. [DOI] [PubMed] [Google Scholar]
- 17.Kanzaki R, Fukui E, Kanou T, Ose N, Funaki S, Minami M, Shintani Y, Okumura M. Preoperative evaluation and indications for pulmonary metastasectomy. J Thorac Dis. 2021;13(4):2590–2602. doi: 10.21037/jtd-19-3791. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Schlachtenberger G, Doerr F, Menghesha H, Lauinger P, Wolber P, Sabashnikov A, Popov AF, Macherey-Meyer S, Bennink G, Klussmann JP, Wahlers T, Hekmat K, Heldwein MB. Patients with pulmonary metastases from head and neck cancer benefit from pulmonary metastasectomy, a systematic review. Medicina. 2022;58(8):1000. doi: 10.3390/medicina58081000. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Pastorino U, Buyse M, Friedel G, Ginsberg RJ, Girard P, Goldstraw P, Johnston M, McCormack P, Pass H, Putnam JB., Jr International registry of lung metastases. Long-term results of lung metastasectomy: prognostic analyses based on 5206 cases. J Thorac Cardiovasc Surg. 1997;113(1):37–49. doi: 10.1016/S0022-5223(97)70397-0. [DOI] [PubMed] [Google Scholar]
- 20.Bong CY, Smithers BM, Chua TC. Pulmonary metastasectomy in the era of targeted therapy and immunotherapy. J Thorac Dis. 2021;13(4):2618–2627. doi: 10.21037/jtd.2020.03.120. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Handy JR, Bremner RM, Crocenzi TS, Detterbeck FC, Fernando HC, Fidias PM, Firestone S, Johnstone CA, Lanuti M, Litle VR, Kesler KA, Mitchell JD, Pass HI, Ross HJ, Varghese TK. Expert consensus document on pulmonary metastasectomy. Ann Thorac Surg. 2019;107(2):631–649. doi: 10.1016/j.athoracsur.2018.10.028. [DOI] [PubMed] [Google Scholar]
- 22.Gonzalez M, Brunelli A, Szanto Z, Passani S, Falcoz PE. Report from the European society of thoracic surgeons database 2019: current surgical practice and perioperative outcomes of pulmonary metastasectomy. Eur J Cardiothorac Surg. 2021;59(5):996–1003. doi: 10.1093/ejcts/ezaa405. [DOI] [PubMed] [Google Scholar]
- 23.Panagiotopoulos N, Patrini D, Lawrence D, Scarci M, Mitsos S. Pulmonary metastasectomy and laser-assisted resection. J Thorac Dis. 2018;10(Suppl 17):S1930–S1933. doi: 10.21037/jtd.2018.05.08. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Rusidanmu A, Chin W, Xu J, Wang L, He Z, Lv X, Hu J. Does a thoracoscopic approach provide better outcomes for pulmonary metastases? J Thorac Dis. 2021;13(4):2692–2697. doi: 10.21037/jtd-19-3958. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Adebahr S, Hechtner M, Schräder N, Schimek-Jasch T, Kaier K, Duncker-Rohr V, Gkika E, Momm F, Gaertner J, Becker G, Grosu AL, Nestle U. Early impact of pulmonary fractionated stereotactic body radiotherapy on quality of life:benefit for patients with low initial scores (STRIPE trial) J Thorac Oncol. 2019;14(3):408–419. doi: 10.1016/j.jtho.2018.10.170. [DOI] [PubMed] [Google Scholar]
- 26.Gomez DR, Tang C, Zhang J, Blumenschein GR, Jr, Hernandez M, Lee JJ, Ye R, Palma DA, Louie AV, Camidge DR, Doebele RC, Skoulidis F, Gaspar LE, Welsh JW, Gibbons DL, Karam JA, Kavanagh BD, Tsao AS, Sepesi B, Swisher SG, Heymach JV. Local consolidative therapy vs. maintenance therapy or observation for patients with oligometastatic non-small-cell lung cancer: long-term results of a multi-institutional, phase II, randomized study. J Clin Oncol. 2019;37(18):1558–1565. doi: 10.1200/JCO.19.00201. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Harrow S, Palma DA, Olson R, Gaede S, Louie AV, Haasbeek C, Mulroy L, Lock M, Rodrigues GB, Yaremko BP, Schellenberg D, Ahmad B, Senthi S, Swaminath A, Kopek N, Liu M, Schlijper R, Bauman GS, Laba J, Qu XM, Warner A, Senan S. Stereotactic radiation for the comprehensive treatment of oligometastases (SABR-COMET): extended long-term outcomes. Int J Radiat Oncol Biol Phys. 2022;114(4):611–616. doi: 10.1016/j.ijrobp.2022.05.004. [DOI] [PubMed] [Google Scholar]
- 28.Akanda ZZ, Neeson PJ, John T, Barnett S, Hanna GG, Miller A, Jennens R, Siva S. A narrative review of combined stereotactic ablative radiotherapy and immunotherapy in metastatic non-small cell lung cancer. Transl Lung Cancer Res. 2021;10(6):2766–2778. doi: 10.21037/tlcr-20-1117. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Rieber J, Streblow J, Uhlmann L, Flentje M, Duma M, Ernst I, Blanck O, Wittig A, Boda-Heggemann J, Krempien R, Lohaus F, Klass ND, Eble MJ, Imhoff D, Kahl H, Petersen C, Gerum S, Henkenberens C, Adebahr S, Hass P, Schrade E, Wendt TG, Hildebrandt G, Andratschke N, Sterzing F, Guckenberger M. Stereotactic body radiotherapy (SBRT) for medically inoperable lung metastases-A pooled analysis of the German working group “stereotactic radiotherapy”. Lung Cancer. 2016;97:51–58. doi: 10.1016/j.lungcan.2016.04.012. [DOI] [PubMed] [Google Scholar]
- 30.García-Mulero S, Alonso MH, Pardo J, Santos C, Sanjuan X, Salazar R, Moreno V, Piulats JM, Sanz-Pamplona R. Lung metastases share common immune features regardless of primary tumor origin. J Immunother Cancer. 2020;8(1):e000491. doi: 10.1136/jitc-2019-000491. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Oldenburg J, Berney DM, Bokemeyer C, Climent MA, Daugaard G, Gietema JA, De Giorgi U, Haugnes HS, Huddart RA, Leão R, Sohaib A, Gillessen S, Powles T, ESMO Guidelines Committee Testicular seminoma and non-seminoma: ESMO-EURACAN Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022;33(4):362–375. doi: 10.1016/j.annonc.2022.01.002. [DOI] [PubMed] [Google Scholar]
- 32.Rapoport BL, Shannon VR, Cooksley T, Johnson DB, Anderson L, Blidner AG, Tintinger GR, Anderson R. Pulmonary toxicities associated with the use of immune checkpoint inhibitors: an update from the immuno-oncology subgroup of the neutropenia, infection & myelosuppression study group of the multinational association for supportive care in cancer. Front Pharmacol. 2021;12:743582. doi: 10.3389/fphar.2021.743582. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Haanen J, Obeid M, Spain L, Carbonnel F, Wang Y, Robert C, Lyon AR, Wick W, Kostine M, Peters S, Jordan K, Larkin J, Guidelines Committee ESMO. Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022 doi: 10.1016/j.annonc.2022.10.001. [DOI] [PubMed] [Google Scholar]
- 34.Swain SM, Nishino M, Lancaster LH, Li BT, Nicholson AG, Bartholmai BJ, Naidoo J, Schumacher-Wulf E, Shitara K, Tsurutani J, Conte P, Kato T, Andre F, Powell CA. Multidisciplinary clinical guidance on trastuzumab deruxtecan (T-DXd)-related interstitial lung disease/pneumonitis-Focus on proactive monitoring, diagnosis, and management. Cancer Treat Rev. 2022;106(102378):2022–2012. doi: 10.1016/j.ctrv.2022.102378. [DOI] [PubMed] [Google Scholar]
- 35.Powell CA, Modi S, Iwata H, Takahashi S, Smit EF, Siena S, Chang DY, Macpherson E, Qin A, Singh J, Taitt C, Shire N, Camidge DR. Pooled analysis of drug-related interstitial lung disease and/or pneumonitis in nine trastuzumab deruxtecan monotherapy studies. ESMO Open. 2022;7(4):100554. doi: 10.1016/j.esmoop.2022.100554. [DOI] [PMC free article] [PubMed] [Google Scholar]