Abstract
Hintergrund
Die photonenzählende Computertomographie („photon-counting detector computed tomography“, PCD-CT) ist eine Technologie, die viele Einschränkungen der herkömmlichen Detektoren überwindet. Eine direkte Umwandlung der auf den Detektor eintreffenden Photonen in elektrische Signale, verbunden mit einer sensitiveren und präziseren Photonerfassung ermöglicht eine spektrale Auswertung sowie eine potenziell verringerte Strahlenexposition des Patienten. Durch die Kombination von angewandten Energieschwellenwerten und den Verzicht auf Detektorsepten kann elektronisches Rauschen reduziert, die Ortsauflösung erhöht und die Dosiseffizienz gesteigert werden.
Bewertung
Aktuelle Forschungsarbeiten bestätigen deutlich reduziertes Bildrauschen, reduzierte Strahlendosis, erhöhte Ortsauflösung, verbessertes Jodsignal sowie eine Reduktion von Artefakten. Die spektrale Auswertung potenziert diese Effekte und ermöglicht auch retrospektiv die Errechnung virtuell-monoenergetischer Bilder, virtuell-nativer Bilder oder Jodkarten. Perspektivisch ergibt sich durch die photonenzählende Technologie die Möglichkeit zur Anwendung diverser Kontrastmittel, mit der Aussicht auf einzeitige Mehrphasenbildgebung oder zur Visualisierung bestimmter Stoffwechselprozesse. Bis zum klinischen Einsatz sind hierzu weitere Grundlagenforschung sowie ergänzende Zulassungsprozesse notwendig.
Schlussfolgerung
Das bisher einzige am Markt verfügbare PCD-CT-Gerät erhielt 2021 die Zulassung. Es bleibt abzuwarten, welche weitere Anwendungen durch Verbesserungen von Hardware und Software möglich werden. Insbesondere für hochauflösende Bildgebung bei detaillierten Fragestellungen und Untersuchungen mit hoher Strahlenbelastung zeigt die Technologie bereits heute eine eindrucksvolle Überlegenheit gegenüber dem vorherigen Technologiestandard.
Schlüsselwörter: Photonenzählende Detektoren, Bildqualität, Strahlendosis, Ortsauflösung, Spektrale Bildgebung
Abstract
Background
Photon-counting detector computed tomography (PCD-CT) is a CT technology that overcomes many limitations of conventional detectors. Direct conversion of photons hitting the detector into electrical signals combined with more sensitive and accurate photon detection simultaneously allows spectral evaluation and also potential reduction in radiation exposure to the patient. The combination of energy thresholds and elimination of detector septa allows for a reduction of electronic noise, an increase of spatial resolution, and an improvement of dose efficiency.
Achievements
Recent research has confirmed significantly reduced image noise, reduced radiation dose, increased spatial resolution, improved iodine signal, and a reduction in artifacts. Spectral imaging potentiates these effects and also allows retrospective calculation of virtual monoenergetic images, virtual noncontrast images or iodine maps. Thus, the photon-counting technique offers the possibility of using various contrast agents, with the prospect of single-scan multiphase imaging or visualization of specific metabolic processes. Therefore, further research and complementary approval processes are necessary for clinical application. Likewise, further research is needed to develop and validate optimal settings and reconstructions for a wide variety of situations, as well as to test new application possibilities.
Conclusions
The only photon-counting detector CT device available on the market to date received clinical approval in 2021. It remains to be seen which other applications will become possible through improvements in hardware and software. This technology has already demonstrated an impressive superiority compared with the current standard of CT imaging, especially regarding high-resolution imaging of detailed structures and examinations with high radiation exposure.
Keywords: Photon-counting detectors, Imaging quality, Radiation dosage, Spatial resolution, Spectral imaging
Fragestellung
Der Artikel soll die technischen Hintergründe der photonenzählenden Computertomographie („photon-counting detector computed tomography“, PCD-CT) zusammenfassen, Vorteile wie Nachteile erläutern und einen Überblick über die aktuellen klinischen Forschungsergebnisse bieten.
Hintergrund
Seit der Einführung des ersten kommerziellen Computertomographen im Jahr 1972 gab es diverse Errungenschaften in der CT-Technologie. Durch Verbesserungen in Hardware und Software mit Entwicklung der Spiral-CT und dann der Mehrzeilen-CT, der Dual-Source-CT-Technologie sowie der Multi-Energie-Bildgebung und zahlreichen Dosisreduktionsmaßnahmen, wie dem Einsatz rohdatenbasierter mehrdimensionaler adaptiver Filter, der Röhrenstrommodulation (s. auch Beitrag Kachelrieß im selben Heft), patientenspezifischer Vorfilter sowie iterativer oder auf Deep Learning basierender Rekonstruktion, konnte kontinuierlich eine Verbesserung der Bildqualität, Verringerung der Strahlenexposition und Verkürzung der Untersuchungszeit erreicht werden. Der klinische Einsatz dieser Techniken wurde erst durch exponentielle Verbesserungen in Rechnerleistungen ermöglicht. In den letzten beiden Jahrzehnten wurden erste Prototypen der photonenzählenden Detektoren (PCD) entwickelt, von welchen man sich insbesondere durch höhere räumliche Auflösung, Beseitigung des elektronischen Rauschens und der inhärenten Möglichkeit der spektralen Auswertung diagnostische Verbesserungen erhoffte. Nach anfänglichen technischen Schwierigkeiten, vor allem im Hinblick auf die hohen Flussraten der Röntgenphotonen in der CT, konnten diese durch bedeutende Fortschritte bei der Synthese von Detektormaterialien und der Entwicklung von Detektorelektronik überwunden werden [1]. 2021 wurde der erste Computertomograph mit PCD der Firma Siemens Healthcare GmbH (Erlangen, Deutschland) für den klinischen Einsatz in den USA und Europa zugelassen [2]. In den nächsten Jahren sollen PCD-Systeme weiterer Gerätehersteller folgen [3, 4].
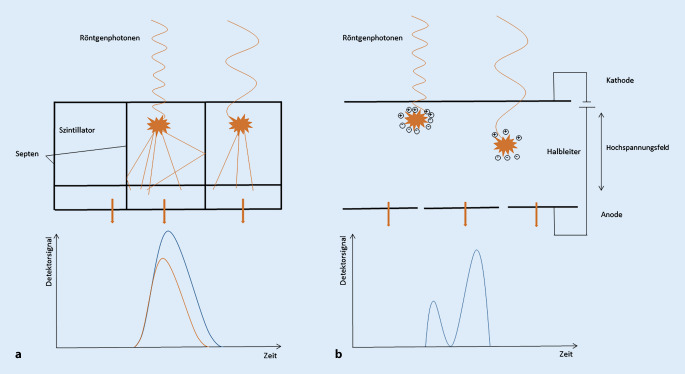
Funktionsweise der PCD-CT und Unterschiede zur EID-CT
PCD wandeln Photonen mittels eines Halbleiters, beispielsweise unter Verwendung von Cadmiumtellurid oder Silizium, unmittelbar in vollständig digitale elektrische Signale um. Hingegen wandeln konventionelle energieintegrierende Detektoren (EID) indirekt Photonen mittels Festkörperszintillatoren zunächst in sichtbares Licht um und in einem weiteren Schritt über Photodioden in digitale elektrische Signale (Abb. 1; [5]). EID verfügen über mehrere, mittels Septen getrennte Detektorzellen, jeweils bestehend aus einem Szintillator (z. B. aus Gadoliniumoxysulfid), mit anhängender Photodiode. Die absorbierte Röntgenstrahlung erzeugt im Szintillator sichtbares Licht, das von der Photodiode erfasst und in einen elektrischen Strom umgewandelt wird. Das Detektorsignal ergibt sich durch Integration aller Stromimpulse, die während einer Messzeit registriert werden. Technisch bedingt gehen Informationen über Energielevel und Anzahl der absorbierten Photonen verloren. Zudem tragen technisch bedingt kontrastdefinierende Röntgenphotonen mit niedrigerer Energie beim EID weniger zum Detektorsignal bei als Röntgenphotonen mit höherer Energie [6]. In der Konsequenz verringert sich das Kontrast-Rausch-Verhältnis („contrast to noise ratio“, CNR). Ein weiteres Problem stellt das elektronische Grundrauschen dar, welches insbesondere bei niedriger Dosis das elektrische Signal der Photodioden überproportional verfälscht. Die räumliche Auflösung wird durch Septen (reflektive Schichten) begrenzt, die um jede einzelne Detektorzelle benötigt werden, um optische Interferenzen zu unterbinden. Kleinere Detektorzellen im EID ermöglichen eine erhöhte räumliche Auflösung, jedoch werden auch zunehmend trennende Septen benötigt. In den Trennschichten der Septen absorbierte Photonen tragen zur Dosis, jedoch nicht zum Signal und der Bildqualität bei. Die Dosiseffizienz des Detektors sinkt in der Konsequenz [5], wodurch letztlich die räumliche Auflösung von EID begrenzt ist.
Die Grundlage der PCD-Technik wird durch den Einsatz von Halbleitern ermöglicht, welche jedes einzelne der Millionen pro Sekunde und Quadratmillimeter auftreffenden Photonen erfassen und in ein elektronisches Signal umwandeln, sofern eine definierte Schwellenenergie überschritten wird [7]. Hierfür wird zwischen der Kathode und den gerasterten Anoden des Detektors eine Hochspannung angelegt. Das unter dem Schwellenwert liegende elektronische Rauschen wird bei dieser Technik ausgeblendet. Die auftreffende Röntgenstrahlung erzeugt Elektronen-Loch-Paare, die in dem elektrischen Feld getrennt werden [5]. Anschließend driften Elektronen zu den Anoden und induzieren kurze Stromimpulse. Eine Pulsformungsschaltung wandelt sie in Spannungspulse, welche proportional zur Energie der absorbierten Röntgenphotonen sind. Da die PCD-Technologie keine Detektorsepten benötigt, können kleinere Detektorzellen verwendet werden. Es findet folglich auch keine Absorption von Photonen an solchen Septen statt, wodurch die Dosiseffizienz nochmals gesteigert wird. Ein weiterer Vorteil ist die gleichmäßige Gewichtung von Röntgenphotonen mit unterschiedlichen Energien im Messsignal – niederenergetische Photonen werden folglich im Gegensatz zur EID-CT nicht geringer gewichtet. Durch das gleichzeitige Ansetzen mehrerer unterschiedlicher Schwellenwerte können verschiedene energetische Bereiche separiert betrachtet werden, was neue Potenziale in der Spektralbildgebung bietet (Abb. 2).
Technische Herausforderungen
Die PCD-CT bietet zwar Lösungen für viele Limitationen der EID-CT, bringt jedoch auch neue Herausforderungen mit sich. So werden beispielsweise Stromimpulse, die in der Nähe der Pixelgrenzen absorbiert werden, zwischen benachbarten Detektorzellen aufgeteilt. Dies führt dazu, dass mitunter ein hochenergetisches Röntgenphoton fälschlicherweise als mehrere Röntgenphotonen mit niedrigerer Energie gewertet werden kann [8]. Ein weiteres technisches Problem ist der sogenannte K‑Escape. Einfallende Röntgenstrahlen können K‑Elektronen aus dem Detektormaterial herausschlagen. Die leeren K‑Schalen werden sofort wieder aufgefüllt, und es wird charakteristische Röntgenstrahlung freigesetzt, die in der Detektorzelle selbst oder in benachbarten Detektorzellen wieder absorbiert und möglicherweise fälschlich als niedrigere Energie gezählt wird [9]. Problematisch ist außerdem der Pulse Pile-up. Bei zu großen Detektorzellen treffen zu viele Röntgenphotonen zu dicht aufeinander, um getrennt registriert zu werden. Mehrere sich überlappende Pulse werden dann als ein einziger Puls mit einer hohen Energie gezählt [10]. Kleinere Pixel führen jedoch zu mehr K‑Escape. Eine Herausforderung ist es folglich, die optimale Größe der Detektorzellen zu finden, um diese sich bedingenden Fehlerquellen zu minimieren.
Bildrauschen
Die Nutzung von Schwellenwerten resultiert in einer deutlichen Reduktion des Bildrauschens. Ein Schwellenwert wird knapp oberhalb der Amplitude des Hintergrundrauschens, z. B. bei 20 keV, definiert – und somit wird das Eigenrauschen des Detektors nicht erfasst. Das Rauschen in einem rekonstruierten Bild einer PCD-CT ist folglich geringer als in einer EID-CT bei gleicher Dosis, wo diese Suppression aufgrund der lediglich indirekten Photonenerfassung nicht möglich ist [11, 12]. Studien an Phantomen wiesen eine Rauschreduktion um bis zu 89 % im Vergleich zu EID-CT bei gleichbleibender Strahlendosis nach [13]. In-vivo-Studien an Menschen zeigten an der PCD-CT bei äquivalentem Rauschen eine Reduktion der Strahlendosis um bis zu 47 % verglichen mit einem EID-CT [14]. Insbesondere bei adipösen Patienten bzw. in Scanregionen mit ausgeprägtem Weichteilmantel werden häufig Artefakte beobachtet, die auf Photonenmangel und hiermit verbunden proportional erhöhtes elektronisches Rauschen zurückzuführen sind. Durch den Einsatz von Schwellenwerten, welche das elektronische Rauschen eliminieren, können entsprechende Artefakte deutlich reduziert werden [2].
Ortsauflösung
Ein Anspruch an die moderne CT-Bildgebung ist es, in kurzer Zeit möglichst große Scanbereiche abzudecken und gleichzeitig kleine Strukturen hochaufgelöst darzustellen. Ultrahohe Auflösung erfordert bei konventionellen CT-Systemen meist den Einsatz von Hochauflösungskämmen oder -rastern. Das sind Filterelemente, die nach dem Patienten und vor dem Detektor nur für die Hochauflösungsscanmodi eingefahren werden. Sie erhöhen dadurch die nötige Strahlendosis. Zudem erfordern Hochauflösungsscans bei herkömmlichen CT-Systemen kleine Kollimationen sowie geringem Pitch. Folglich ist eine hochauflösende Ganzkörper-CT mit herkömmlichen EID nur mit längerer Scanzeit und erhöhter Strahlendosis möglich wäre. Das derzeit einzige kommerziell erhältliche PCD-System (NAEOTOM Alpha, Siemens Healthcare GmbH) weist im ultrahochauflösenden Modus eine Auflösung in der Ebene von 0,11 mm auf, während bei einem EID-System der neuesten Generation desselben Herstellers eine Auflösung in der Ebene von bestenfalls 0,24 mm möglich ist (SOMATOM Force, Siemens Healthcare GmbH; [15]).
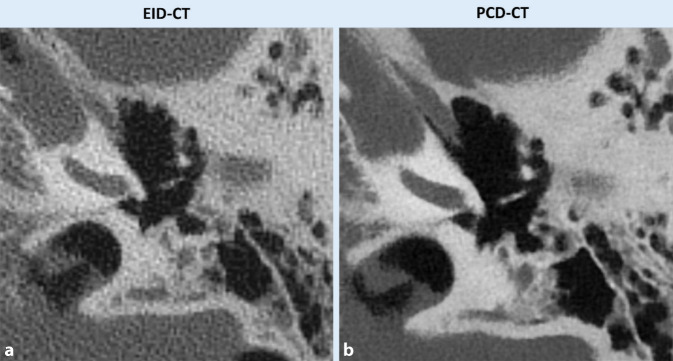
Die verbesserte räumliche Auflösung der PCD-CT kann folglich bei vielen diagnostischen Aufgaben insbesondere der pneumologischen, kardiovaskulären und muskuloskeletalen Bildgebung klinische Vorteile bieten. Inoue et al. beschrieben, dass mittels PCD-CT akquirierte Bildgebung bei Patienten mit bekannten oder vermuteten interstitiellen Lungenerkrankungen die Sicherheit der Radiologen bei der Beurteilung von diagnosedefinierenden Bildgebungsbefunden wie Milchglastrübungen und retikulären Veränderungen erhöht [16]. Untersuchungen am PCD-CT weisen eine verbesserte Abgrenzbarkeit von Bronchien/Bronchiolen, Bronchialwänden und Lungenrundherden im Vergleich zu EID-CT auf (Abb. 3; [17, 18]). Pulmonale Veränderungen bei persistierenden Beschwerden nach COVID-19-Infektion konnten mittels PCD detaillierter visualisiert und teils dadurch erst bildmorphologisch nachvollzogen werden [19].
Die inhärent höhere räumliche Auflösung von PCD im Vergleich zu EID ist auch für die CT-Bildgebung des Bewegungsapparats von Vorteil. So werden typischerweise zum Staging des multiplen Myeloms Niedrigdosis-CT-Scans durchgeführt, um lytische Knochenläsionen und Folgeerscheinungen des Myeloms wie pathologische Frakturen zu detektieren (Abb. 4). Bei vergleichbarer Dosis können mittels PCD-CT Untersuchungen im ultrahochauflösenden Modus (0,151 × 0,176 mm Detektorpixelgröße am Isozentrum) durchgeführt werden [20]. Studien zur Ganzkörper-PCD-CT belegen, dass mit niedriger Dosis kleine osteolytische Läsionen auf den PCD-CT-Bildern im Vergleich zu EID-CT-Bildern besser zu erkennen sind (79 % vs. 64 % detektierte Läsionen) und ossäre Strukturen auch quantitativ signifikant besser dargestellt werden können [21, 22].
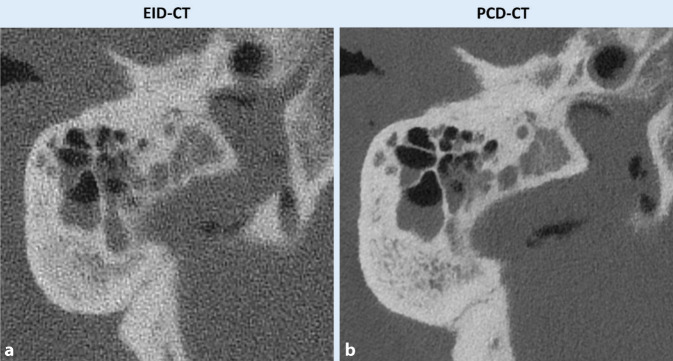
Auch die Bildgebung des Felsenbeins erfordert zur Darstellung der kleinen knöchernen Strukturen eine hohe Ortsauflösung (Abb. 5 und 6). Benson et al. konnten zeigen, dass die verbesserte räumliche Auflösung der PCD verglichen mit EID in der Felsenbeindiagnostik eine bessere Visualisierung von kritischen anatomischen Strukturen wie z. B. dem Incudostapedialgelenk ermöglicht [23]. Auch eine verbesserte Darstellung von Cochleaimplantaten mittels PCD-CT konnte nachgewiesen werden [24].
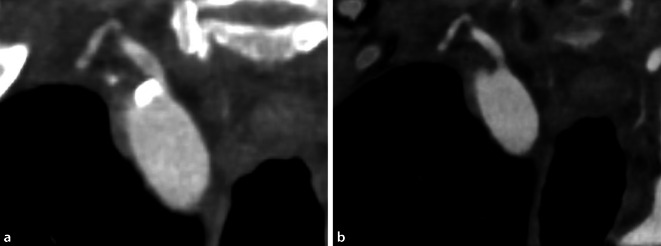
Die kleinere Pixelgröße des Detektors und die höhere geometrische Dosiseffizienz der PCD-CT ermöglichen ebenso eine höhere Auflösung bei gleichzeitiger Reduktion der Strahlendosis in der ultrahochauflösenden Bildgebung (0,151 × 0,176 mm Detektorpixelgröße am Isozentrum) kleiner Gelenke im Vergleich zur EID-CT, was bei Traumata und degenerativen Erkrankungen von Vorteil sein kann (Abb. 7; [25, 26]). Die PCD-Technologie ermöglicht ferner durch die geringe Pixelgröße und Schichtdicke auch eine ultrahochauflösende Bildgebung großer Gelenke wie der Schulter und der Hüfte, was mit den meisten herkömmlichen CT-Systemen nicht möglich ist [14].
Auch bei der Erkennung, Abgrenzung und Charakterisierung von Nierensteinen ermöglicht die hochauflösende PCD-CT im Vergleich zur herkömmlichen CT eine bessere Darstellung kleinerer Nierensteine bei gleichzeitig deutlich reduzierter Strahlendosis [27, 28].
Strahlendosis
Die applizierte Strahlendosis kann, abhängig von der Anwendung, durch Verwendung von PCD im Vergleich zu EID bei vergleichbarer Bildqualität erheblich reduziert werden. Analog zu ausgewählten EID-CT-Scans kann z. B. bei der nativen Lungenbildgebung durch Verwendung spezieller Filter das niederenergetische Photonenspektrum entfernt und somit eine zusätzliche Dosisreduktion erreicht werden [29]. In Studien konnte dargestellt werden, dass bei Low-dose-Thorax CT-Untersuchungen eine überlegene Bildqualität bei signifikant niedrigerer Dosis (bis zu 36 %) als mit EID zu erzielen ist [30, 31]. In Bezug auf die Beurteilung von interstitiellen Lungenerkrankungen konnte bei gleicher Bildqualität eine Dosisreduktion um bis zu 66 % nachgewiesen werden [32]. Bei Patienten, welche aufgrund eines multiplen Myeloms regelmäßig Ganzkörper-CT erhielten, war die Strahlendosis mittels PCD-CT um bis zu 83 % niedriger als bei einer EID-CT [21]. Auch bei einer Low-dose-CT des Abdomens zur Diagnostik der Urolithiasis wurde eine Reduktion der effektiven Dosis von 30 % erzielt [28].
Die Kombination aus erhöhter Ortsauflösung und erhöhter Dosissensitivität der PCD-CT bietet auch Vorteile in der pädiatrischen CT-Diagnostik. Die höhere räumliche Auflösung und das bessere Kontrast-Rausch-Verhältnis, verglichen mit EID, verbessern die Sichtbarkeit anatomischer Strukturen bei Kindern mit hoher Dosiseffizienz [33]. Durch diese höhere Dosiseffizienz wird eine diagnostische Umstellung von Röntgenaufnahmen hin zu Niedrig-Dosis CT ermöglicht [34].
Kontrastmitteldosis/Kontrastmittelsignal
Die Kombination aus erhöhter Photonsensitivität und spektraler Signalauslesung führt zu einem erhöhten Jodkontrast und ermöglicht bei gleichbleibender Bildqualität eine Kontrastmittelreduktion (Abb. 8; [5]). In einer Phantomstudie wurde eine erhaltene diagnostische Bildqualität trotz einer Reduktion der Kontrastmitteldosis um 50 % beschrieben [35]. Eine klinische Studie bei CT-Angiographien der Aorta wies eine gleichwertige Bildqualität von PCD-akquirierten virtuell-monoenergetischen Bildern („virtual monoenergetic images“, VMI) bei 50 keV mit 25 % Kontrastmittelreduktion verglichen mit konventionellen EID-CT-Aufnahmen nach [36]. Hiermit verbunden sind potenziell entscheidende Vorteile für Patienten mit eingeschränkter Nierenfunktion.
Dieser erhöhte Jodkontrast erweitert die Vorteile der Niedrig-kV-Bildgebung, die durch die Rekonstruktion von VMI weiter ausgebaut werden können [37]. Softwarebasiert kann nach Akquirierung der Untersuchungsrohdaten das für die diagnostische Frage am besten geeignete keV-Energieniveau auswählt und zusätzlich zu virtuell-nativen Bildern und Jodkarten rekonstruiert werden.
Die mit der PCD-CT erreichbare Kontrastoptimierung in kontrastmittelunterstützen Untersuchungen hat viele potenzielle Anwendungsmöglichkeiten. In der onkologischen Bildgebung könnte der erhöhte Jodkontrast die Abgrenzbarkeit von Malignomen verbessern, auch dann, wenn sich ihre Kontrastmittelaffinität nur geringfügig vom anatomischen Hintergrund unterscheidet.
Artefaktreduktion
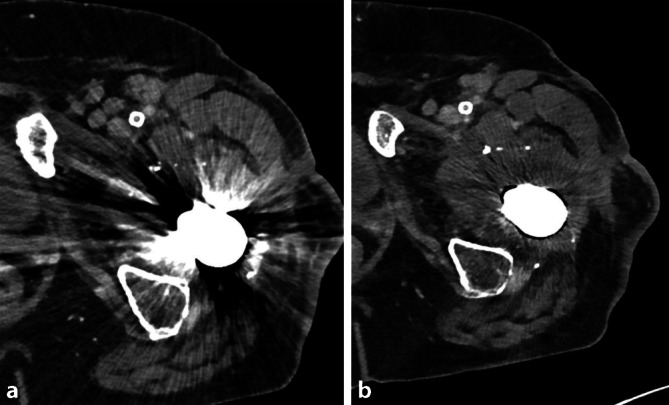
Ein weiterer klinischer Vorteil der PCD-CT ist die Möglichkeit, gängige Bildartefakte zu reduzieren. Ein häufig zu diagnostischer Einschränkung führendes Artefakt ist das Blooming-Artefakt. Es beschreibt in der Computertomographie das Phänomen, dass kleine Strukturen mit hoher Dichte größer erscheinen. Die am häufigsten hierfür genannte Ursache ist die partielle Volumenmittelung und beruht auf der begrenzten räumlichen Auflösung von EID. Teilvolumenartefakte erschweren die Kantendifferenzierung von Objekten mit hohem Kontrast. Das sogenannte Kalzium-Blooming ist ein häufiges Artefakt und stellt eine große Herausforderung bei kardiovaskulären Untersuchungen dar, insbesondere bei kleinen Gefäßen (z. B. Koronararterien, krurale Arterien). Hierbei erscheinen kalkhaltige Plaques (ebenso wie metallische Stents) größer als ihre tatsächliche Größe, was zu einer Überschätzung des prozentualen Stenosegrads bzw. zu einer Unterschätzung des residuellen Lumens führen kann.
Die erhöhte räumliche Auflösung der PCD-CT ermöglicht eine verbesserte Abgrenzbarkeit und eine genauere Volumeneinschätzung vaskulärer kalkreicher Plaques. Unter Nutzung von Spektralinformationen kann das Kalzium entfernt und die Genauigkeit der Stenosebewertung kalzifizierter Plaques erhöht werden (Abb. 9; [38, 39]).
Darüber hinaus kann die Reduktion von Metallartefakten durch die Verwendung von iterativen Metallartefaktreduktionsalgorithmen oder durch die Rekonstruktion angepasster VMI erreicht werden (Abb. 10).
Spektrale Informationen
PCD erfassen und speichern multienergetische Informationen automatisch bei jedem Scanvorgang. Hierdurch ergibt sich auch retrospektiv die Möglichkeit, zusätzliche Informationen aus den akquirierten Daten zu gewinnen. So können beispielsweise VMI, Jodkarten, virtuelle Kalziumsubtraktionen oder virtuell-native Bilder rekonstruiert werden. VMI können beispielsweise verwendet werden, um Artefakte zu reduzieren oder das Jodsignal zu verstärken und somit die Bildqualität sowie letztlich die diagnostische Sicherheit in Ergänzung zu den polyenergetischen Rekonstruktionen erhöhen [24, 40]. Perspektivisch könnte die neue Technik das klinische Potenzial von Quantifizierungsaufgaben, wie z. B. quantitative Beurteilung von Leberverfettung oder Erfassung der Knochendichte, erweitern. Neben der verbesserten Diskriminierung entzündlicher und maligner Prozesse kann die Jodbildgebung auch zur Darstellung der pulmonalen Perfusion genutzt werden (Abb. 11; [40, 41]).
Neben der Subtraktion von Jod für die Erstellung von virtuellen nativen Bildern, ist auch die Subtraktion anderer Materialien möglich. Hier ist beispielsweise die Kalziumsubtraktion zu nennen, mittels der die Visualisierung von trauma- oder tumorassoziierten Knochenmarködemen möglich ist [25]. Rekonstruktionen, die für die PCD-CT-basierte muskuloskeletale Diagnostik relevant sind, umfassen die Bildgebung der Gicht, wo sich das Potenzial aus der Erkennung und Differenzierung von Gichtkristallen und anderen kristalloiden Ablagerungen ergibt [42]. Durch die Möglichkeit, stets auch retrospektiv virtuell-native Bilder zu rekonstruieren, ergeben sich vielfältige Optionen, perspektivisch auf native Aufnahmen zu verzichten und dadurch Untersuchungszeit und Strahlenexposition zu reduzieren. Der Einsatz virtuell-nativer Rekonstruktionen bietet sich insbesondere in der vaskulären Bildgebung (exemplarisch Endoleak-Suche nach endovaskulärem Aortenrepair [EVAR] oder virtuell-native Kalkscore-Berechnung), zur Differenzierung von fokalen Läsionen (z. B. dichteangehobene Nierenzysten) sowie in der pulmonalen Bildgebung (z. B. virtuell-native Emphysemquantifizierung) an (Abb. 12; [43, 44]).
Durch das gleichzeitige Ansetzen mehrerer unterschiedlicher Schwellenwerte können verschiedene energetische Bereiche separiert betrachtet werden, was die Anwendung neuartiger Kontrastmittel sowie die simultane Gabe mehrerer Kontrastmittel ermöglicht. Denkbar sind hier beispielweise Gadolinium, Tungsten, Gold, Bismuth, Ytterbium und Tantalum, deren K‑Kanten im Bereich von 40–100 keV liegen ([45]; s. auch Beitrag von Sawall in diesem Heft [46]).
Fazit für die Praxis
Obwohl die photonenzählende Computertomographie („photon-counting detector computed tomography“, PCD-CT) erst seit verhältnismäßig kurzer Zeit in klinischer Anwendung ist, zeichnen sich durch die bislang veröffentlichten Studien bereits deutliche Vorteile der Technologie im Vergleich zu konventionellen CT-Detektoren ab.
Diese bestehen insbesondere in dem Potenzial der Dosisreduktion, der verbesserten räumlichen Auflösung, der Reduktion des elektronischen Rauschens, dem verstärkten Jodsignal, reduzierten Artefakten, einer verbesserten Dosiseffizienz sowie der ständigen Akquisition spektraler Datensätze.
Die Kombination dieser Vorteile ergibt ein immenses Potenzial zur Verbesserung der CT-Diagnostik bei bereits etablierten klinischen Fragestellungen.
Ermöglicht wird eine Verschiebung der Limitationen der CT in Bezug auf Bildauflösung und Bildartefakte oder auch der aus Strahlenschutzgründen zunehmend verantwortbare Einsatz der Niedrig-Dosis CT bei Fragestellungen, welche aktuell in anderen Modalitäten beantwortet werden.
Die neue Technologie erschließt aber auch völlig neue Anwendungsgebiete und ermöglicht den Einsatz neuer Kontrastmittel.
Es bedarf jedoch noch prospektiver, randomisierter Studien, die nicht nur die technische Überlegenheit, sondern auch Vorteile in Bezug auf Prädiktion, Gewebedifferenzierung und Outcome zeigen.
Einhaltung ethischer Richtlinien
Interessenkonflikt
Y.C. Layer wird durch eine Forschungsförderung von Siemens Healthcare unterstützt. D. Kravchenko, T. Dell und D. Kütting geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autor/-innen keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Hsieh SS, Rajbhandary PL, Pelc NJ. Spectral resolution and high-flux capability tradeoffs in CdTe detectors for clinical CT. Med Phys. 2018;45(4):1433–1443. doi: 10.1002/mp.12799. [DOI] [PubMed] [Google Scholar]
- 2.Rajendran K, Petersilka M, Henning A, et al. First clinical photon-counting detector CT system: technical evaluation. Radiology. 2022;303(1):130–138. doi: 10.1148/radiol.212579. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Cosset B, Sigovan M, Boccalini S, et al. Bicolor K-edge spectral photon-counting CT imaging for the diagnosis of thoracic endoleaks: a dynamic phantom study. Diagn Interv Imaging. 2023;104(5):235–242. doi: 10.1016/j.diii.2022.12.003. [DOI] [PubMed] [Google Scholar]
- 4.Lee C-L, Hong KJ, Kim N, et al. Feasibility study of portable multi-energy computed tomography with photon-counting detector for preclinical and clinical applications. Sci Rep. 2021;11(1):22731. doi: 10.1038/s41598-021-02210-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Flohr T, Petersilka M, Henning A, Ulzheimer S, Ferda J, Schmidt B. Photon-counting CT review. Phys Med. 2020;79:126–136. doi: 10.1016/j.ejmp.2020.10.030. [DOI] [PubMed] [Google Scholar]
- 6.Wehrse E, Klein L, Rotkopf LT, et al. Photonenzählende Detektoren in der Computertomographie – von der Quantenphysik zur klinischen Anwendung. Radiologe. 2021;61(1):1–10. doi: 10.1007/s00117-021-00812-8. [DOI] [PubMed] [Google Scholar]
- 7.Rotkopf LT, Wehrse E, Froelich MF. Spektrale Computertomographie im Zeitalter der photonenzählenden Röntgendetektoren. Radiologie. 2022;62(6):504–510. doi: 10.1007/s00117-022-01010-w. [DOI] [PubMed] [Google Scholar]
- 8.Xu C, Danielsson M, Bornefalk H. Evaluation of energy loss and charge sharing in cadmium telluride detectors for photon-counting computed tomography. IEEE Trans Nucl Sci. 2011;58(3):614–625. doi: 10.1109/TNS.2011.2122267. [DOI] [Google Scholar]
- 9.Taguchi K, Iwanczyk JS. Vision 20/20: single photon counting x-ray detectors in medical imaging. Med Phys. 2013;40(10):100901. doi: 10.1118/1.4820371. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Wielopolski L, Gardner RP. Prediction of the pulse-height spectral distortion caused by the peak pile-up effect. Nucl Instruments Methods. 1976;133(2):303–309. doi: 10.1016/0029-554X(76)90623-6. [DOI] [Google Scholar]
- 11.Si-Mohamed SA, Miailhes J, Rodesch P-A, et al. Spectral photon-counting CT technology in chest imaging. J Clin Med. 2021;10(24):5757. doi: 10.3390/jcm10245757. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Yu Z, Leng S, Kappler S, et al. Noise performance of low-dose CT: comparison between an energy integrating detector and a photon counting detector using a whole-body research photon counting CT scanner. J Med Imaging. 2016;3(4):43503. doi: 10.1117/1.JMI.3.4.043503. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Liu LP, Shapira N, Chen AA, et al. First-generation clinical dual-source photon-counting CT: ultra-low-dose quantitative spectral imaging. Eur Radiol. 2022;32(12):8579–8587. doi: 10.1007/s00330-022-08933-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Baffour FI, Rajendran K, Glazebrook KN, et al. Ultra-high-resolution imaging of the shoulder and pelvis using photon-counting-detector CT: a feasibility study in patients. Eur Radiol. 2022;32(10):7079–7086. doi: 10.1007/s00330-022-08925-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Willemink MJ, Persson M, Pourmorteza A, Pelc NJ, Fleischmann D. Photon-counting CT: technical principles and clinical prospects. Radiology. 2018;289(2):293–312. doi: 10.1148/radiol.2018172656. [DOI] [PubMed] [Google Scholar]
- 16.Inoue A, Johnson TF, White D, et al. Estimating the clinical impact of photon-counting-detector CT in diagnosing usual interstitial pneumonia. Invest Radiol. 2022;57(11):734–741. doi: 10.1097/RLI.0000000000000888. [DOI] [PubMed] [Google Scholar]
- 17.Dunning CAS, Marsh JF, Winfree T, et al. Accuracy of nodule volume and airway wall thickness measurement using low-dose chest CT on a photon-counting detector CT scanner. Invest Radiol. 2023;58(4):283–292. doi: 10.1097/RLI.0000000000000933. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Inoue A, Johnson TF, Walkoff LA, et al. Lung cancer screening using clinical photon-counting detector computed tomography and energy-integrating-detector computed tomography: a prospective patient study. J Comput Assist Tomogr. 2023;47(2):229–235. doi: 10.1097/RCT.0000000000001419. [DOI] [PubMed] [Google Scholar]
- 19.Prayer F, Kienast P, Strassl A, et al. Detection of post-COVID-19 lung abnormalities: photon-counting CT versus same-day energy-integrating detector CT. Radiology. 2022 doi: 10.1148/radiol.222087. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Baffour FI, Huber NR, Ferrero A, et al. Photon-counting detector CT with deep learning noise reduction to detect multiple myeloma. Radiology. 2023;306(1):229–236. doi: 10.1148/radiol.220311. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Schwartz FR, Vinson EN, Spritzer CE, et al. Prospective multireader evaluation of photon-counting CT for multiple myeloma screening. Radiol Imaging Cancer. 2022;4(6):e220073. doi: 10.1148/rycan.220073. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Winkelmann MT, Hagen F, Le-Yannou L, et al. Myeloma bone disease imaging on a 1st-generation clinical photon-counting detector CT vs. 2nd-generation dual-source dual-energy CT. Eur Radiol. 2023;33(4):2415–2425. doi: 10.1007/s00330-022-09225-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Benson JC, Rajendran K, Lane JI, et al. A new frontier in temporal bone imaging: photon-counting detector CT demonstrates superior visualization of critical anatomic structures at reduced radiation dose. Ajnr Am J Neuroradiol. 2022;43(4):579–584. doi: 10.3174/ajnr.A7452. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Waldeck S, Overhoff D, Alizadeh L, et al. Photon-counting detector CT virtual monoengergetic images for cochlear implant visualization—a head to head comparison to energy-integrating detector CT. Tomography. 2022;8(4):1642–1648. doi: 10.3390/tomography8040136. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Baffour FI, Glazebrook KN, Ferrero A, et al. Photon-counting detector CT for musculoskeletal imaging: a clinical perspective. AJR Am J Roentgenol. 2023;220(4):551–560. doi: 10.2214/AJR.22.28418. [DOI] [PubMed] [Google Scholar]
- 26.Booij R, Kämmerling NF, Oei EHG, Persson A, Tesselaar E. Assessment of visibility of bone structures in the wrist using normal and half of the radiation dose with photon-counting detector CT. Eur J Radiol. 2022;159:110662. doi: 10.1016/j.ejrad.2022.110662. [DOI] [PubMed] [Google Scholar]
- 27.Marcus RP, Fletcher JG, Ferrero A, et al. Detection and characterization of renal stones by using photon-counting-based CT. Radiology. 2018;289(2):436–442. doi: 10.1148/radiol.2018180126. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Niehoff JH, Carmichael AF, Woeltjen MM, et al. Clinical low dose photon counting CT for the detection of urolithiasis: evaluation of image quality and radiation dose. Tomography. 2022;8(4):1666–1675. doi: 10.3390/tomography8040138. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Esquivel A, Ferrero A, Mileto A, et al. Photon-counting detector CT: key points radiologists should know. Korean J Radiol. 2022;23(9):854–865. doi: 10.3348/kjr.2022.0377. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Sartoretti T, Racine D, Mergen V, et al. Quantum iterative reconstruction for low-dose ultra-high-resolution photon-counting detector CT of the lung. Diagnostics (Basel) 2022;12(2):522. doi: 10.3390/diagnostics12020522. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Woeltjen MM, Niehoff JH, Michael AE, et al. Low-dose high-resolution photon-counting CT of the lung: radiation dose and image quality in the clinical routine. Diagnostics (Basel) 2022;12(6):1441. doi: 10.3390/diagnostics12061441. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Jungblut L, Euler A, von Spiczak J, et al. Potential of photon-counting detector CT for radiation dose reduction for the assessment of interstitial lung disease in patients with systemic sclerosis. Invest Radiol. 2022;57(12):773–779. doi: 10.1097/RLI.0000000000000895. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Cao J, Bache S, Schwartz FR, Frush D. Pediatric applications of photon-counting detector CT. AJR Am J Roentgenol. 2022 doi: 10.2214/AJR.22.28391. [DOI] [PubMed] [Google Scholar]
- 34.Horst KK, Hull NC, Thacker PG, et al. Pilot study to determine whether reduced-dose photon-counting detector chest computed tomography can reliably display Brody II score imaging findings for children with cystic fibrosis at radiation doses that approximate radiographs. Pediatr Radiol. 2023 doi: 10.1007/s00247-022-05574-6. [DOI] [PubMed] [Google Scholar]
- 35.Emrich T, O’Doherty J, Schoepf UJ, et al. Reduced iodinated contrast media administration in coronary CT angiography on a clinical photon-counting detector CT system: a phantom study using a dynamic circulation model. Invest Radiol. 2023;58(2):148–155. doi: 10.1097/RLI.0000000000000911. [DOI] [PubMed] [Google Scholar]
- 36.Higashigaito K, Mergen V, Eberhard M, et al. CT Angiography of the aorta using photon-counting detector CT with reduced contrast media volume. Radiol Cardiothorac Imaging. 2023;5(1):e220140. doi: 10.1148/ryct.220140. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Booij R, van der Werf NR, Dijkshoorn ML, van der Lugt A, van Straten M. Assessment of iodine contrast-to-noise ratio in virtual monoenergetic images reconstructed from dual-source energy-integrating CT and photon-counting CT data. Diagnostics (Basel) 2022;12(6):1467. doi: 10.3390/diagnostics12061467. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Boccalini S, Si-Mohamed SA, Lacombe H, et al. First in-human results of computed tomography angiography for coronary stent assessment with a spectral photon counting computed tomography. Invest Radiol. 2022;57(4):212–221. doi: 10.1097/RLI.0000000000000835. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Koons E, VanMeter P, Rajendran K, Yu L, McCollough C, Leng S. Improved quantification of coronary artery luminal stenosis in the presence of heavy calcifications using photon-counting detector CT. Proc SPIE Int Soc Opt Eng. 2022;12031:120311A. doi: 10.1117/12.2613019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Jungblut L, Abel F, Nakhostin D, et al. Impact of photon-counting-detector-CT derived virtual-monoenergetic-images and iodine-maps on the diagnosis of pleural empyema. Diagn Interv Imaging. 2023;104(2):84–90. doi: 10.1016/j.diii.2022.09.006. [DOI] [PubMed] [Google Scholar]
- 41.Kariyasu T, Machida H, Yamashiro T, et al. Correlation between CT value on lung subtraction CT and radioactive count on perfusion lung single photon emission CT in chronic thromboembolic pulmonary hypertension. Diagnostics (Basel) 2022;12(11):2895. doi: 10.3390/diagnostics12112895. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Stamp LK, Anderson NG, Becce F, et al. Clinical utility of multi-energy spectral photon-counting computed tomography in crystal arthritis. Arthritis Rheumatol. 2019;71(7):1158–1162. doi: 10.1002/art.40848. [DOI] [PubMed] [Google Scholar]
- 43.Mergen V, Racine D, Jungblut L, et al. Virtual noncontrast abdominal imaging with photon-counting detector CT. Radiology. 2022;305(1):107–115. doi: 10.1148/radiol.213260. [DOI] [PubMed] [Google Scholar]
- 44.Sosna J. Photon-counting detector CT: initial analysis of virtual noncontrast imaging. Radiology. 2022;305(1):116–117. doi: 10.1148/radiol.221173. [DOI] [PubMed] [Google Scholar]
- 45.Kim J, Bar-Ness D, Si-Mohamed S, et al. Assessment of candidate elements for development of spectral photon-counting CT specific contrast agents. Sci Rep. 2018;8(1):12119. doi: 10.1038/s41598-018-30570-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Sawall S (2023) Neue Kontrastmittel für die photonenzählende Computertomographie New contrast agents for photon-counting computed tomography. Die Radiologie. 10.1007/s00117-023-01135-6 [DOI] [PubMed]