Résumé
La variole du singe est une maladie zoonotique causée par le virus Monkeypox (MPXV) du genre orthopoxvirus. Les premiers cas humains sont apparus en Afrique dans les années 1970 et sont longtemps restés cantonnés au continent africain jusqu’en 2003, où plusieurs dizaines de cas sont survenus aux États-Unis suite à une contamination par des chiens de prairie. Des événements de transmission sans précédent ont conduit à plus de 80 000 cas signalés dans le monde entre mai 2022 et février 2023, touchant essentiellement les hommes ayant des rapports sexuels avec d’autres hommes. L’évolution de l’épidémiologie de la Mpox a suscité des inquiétudes quant à sa capacité à devenir endémique au-delà de ses zones géographiques traditionnelles. Le diagnostic de confirmation repose sur la détection directe par biologie moléculaire. L’administration d’une vaccination antivariolique en pré- ou post-exposition a été déployée à large échelle au début de l’été 2022 pour limiter la diffusion de la maladie. En cas de forme graves, l’utilisation d’antiviraux peut être envisagée, seul le técovirimat étant recommandé dans cette indication. L’épidémie actuelle a le mérite de rappeler qu’une maladie jusqu’alors confinée aux régions de circulation initiale du virus peut se propager rapidement sur d’autres continents et la nécessité de la mise en œuvre permanente d’outils de surveillance globale et de contrôle des maladies transmissibles.
Mots clés: Mpox, tecovirimat, vaccination, variole, Virus Monkeypox
Abstract
Monkeypox is a zoonotic disease caused by the Monkeypox virus (MPXV) of the Orthopoxvirus genus. The first human cases occurred in Africa in the 1970s and remained confined to the African continent for a long time until 2003, when several dozen cases occurred in the United States, following contamination by prairie dogs. Unprecedented transmission events have led to more than 80,000 reported cases worldwide between May 2022 and February 2023, primarily affecting men who have sex with men. The changing epidemiology of Mpox has raised concerns about its ability to become endemic beyond its traditional geographic areas. Confirmatory diagnosis is based on direct detection by molecular biology. Pre- or post-exposure smallpox vaccination was widely deployed in early summer 2022 to limit the spread of the disease. In case of severe forms, the use of antivirals can be considered, only tecovirimat being recommended in this indication. The current epidemic has had the merit of showing that a disease that was previously confined to regions of initial virus circulation can spread very rapidly in Western countries and of the need to reinforce the implementation of tools for the surveillance and control of communicable diseases.
Keywords: Monkeypoxvirus, Mpox, tecovirimat, vaccination, variole
Introduction
Le virus de la variole du singe (Monkey-pox) est responsable d’une maladie éruptive décrite chez le singe, similaire à la variole chez l’humain. Outre les infections décrites chez les singes, ce virus peut infecter l’humain et d’autres animaux. Initialement limitée essentiellement à la zone africaine, cette infection s’est propagée rapidement dans le monde entier à partir du printemps 2022 [1]. Au cours de cette émergence, nous avons pu assister à une parfaite adaptation à l’humain de ce virus animal avec une importante transmission par voie sexuelle et l’apparition d’une symptomatologie très polymorphe. Devant ces nouvelles caractéristiques de l’infection, l’Organisation mondiale de la santé (OMS) a annoncé, le 28 novembre 2022, son intention de renommer la maladie après que des inquiétudes ont été exprimées quant au fait que son nom d’origine soit trompeur, stigmatisant et discriminatoire. La variole du singe ou Monkeypox a ainsi reçu le nouveau nom de “Mpox”. Le 29 novembre 2022, environ 81 225 cas de Mpox ont été confirmés et/ou suspectés dans 111 pays [2]. En parallèle de la lutte contre la pandémie de coronavirus (Covid-1 9), cette nouvelle émergence de Mpox a mobilisé une fois de plus toute la communauté scientifique mondiale pour lutter contre une potentielle nouvelle menace de santé publique. Néanmoins, contrairement à la Covid-19, les scientifiques avaient déjà de solides connaissances sur la Mpox et la proximité temporelle avec la pandémie de Covid-19 a permis de mettre en place rapidement des mesures de prévention de cette nouvelle émergence virale qui semble aujourd’hui en passe d’être contrôlée.
Caractéristiques virales
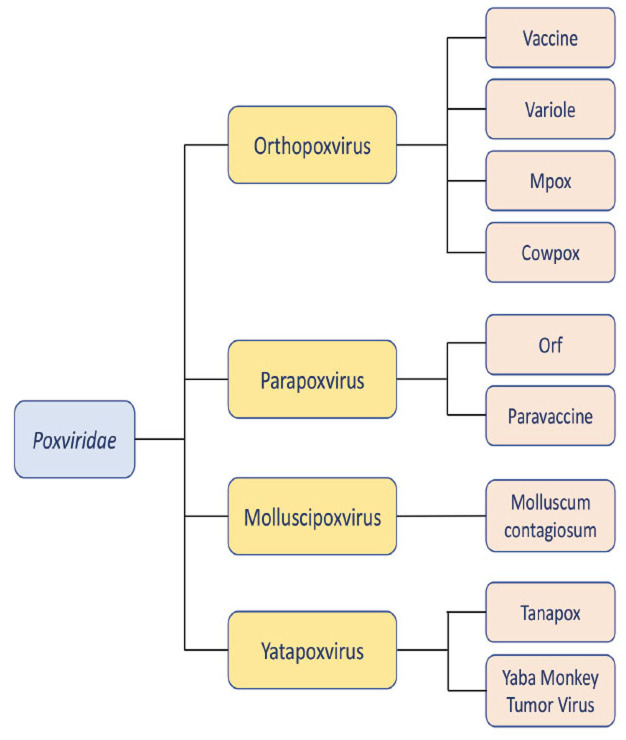
Le virus Monkeypox (MPXV) appartient à la famille des Poxviridae, du genre orthopoxvirus dans lequel sont également classés les virus de la variole, du cowpox et de la vaccine (figure 1 ) [3]. Ce sont des virus enveloppés de grande taille (200 à 250 nm) dont le génome est composé d’ADN double brin linéaire avec une épingle à cheveux fermée de manière covalente aux deux extrémités 5’ et 3’, précédées de séquences répétées terminales inversées (ITR) (figure 2 ). Son génome de 196 858 paires de bases code plus de 200 protéines. Le MPXV est très proche du virus de la variole avec 90 % d’homologie du génome. Il s’agit du plus grand virus connu infectant l’humain ; il possède une large gamme d’hôtes et un tropisme tissulaire étendu. À ce jour, aucun récepteur spécifique de la cellule hôte n’a été identifié pour les virus du genre orthopoxvirus. L’entrée virale est principalement médiée par interactions avec les ligands de la surface cellulaire et la fusion membranaire. La réplication cytoplasmique génère deux formes de virions infectieux, le virus mature intracellulaire (VMI) et le virus enveloppé extracellulaire (VEE). La couche externe de l’enveloppe du VEE joue un rôle dans l’évasion immunitaire et la transmission au sein de l’hôte, tandis que le VMI est responsable de la transmission entre les hôtes.
Figure 1.
Principaux virus de la famille des Poxviridaeregroupés par genre.
© S. Hantz
Figure 2.
Représentation schématique d’une particule virale de Monkeypoxvirus (MPXV) et de son génome.
© S. Hantz
Il existe deux souches distinctes de MPXV : la souche du bassin du Congo ou clade I et la souche ouest- africaine ou clade II. Ces deux clades présentent des caractéristiques différentes détaillées dans le tableau 1 . Les virus en circulation lors de l’épidémie de 2022 forment un clade IIb divergent, dérivé d’un clade IIa associé à des cas importés de MPXV observés en 2018 et 2019 au Royaume-Uni, en Israël et à Singapour, et tous liés à une épidémie au Nigeria en 2017–2018 [4].
Tableau 1.
Caractéristiques des infections dues aux clades I et II du MPXV.
| Caractéristiques | Clade I | Clade II |
|---|---|---|
| Endémicité | Cameroun, République centrafricaine, République démocratique du Congo, Gabon, Soudan | Bénin, Cameroun, Côte d’Ivoire, Liberia, Nigeria, Sierra Leone |
| Sévérité | Habituellement modérée à sévère | Habituellement faible à modérée |
| Taux de transmission au sein du foyer | 7,5–12,3 % | 0–3,3 % |
| Mortalité | 10,6 % | 1–6 % |
Malgré son nom, les primates non humains ne sont pas des réservoirs du virus de la variole du singe. Bien que le réservoir soit inconnu, les principaux candidats sont les petits rongeurs (par exemple les écureuils) dans les forêts tropicales d’Afrique, principalement en Afrique occidentale et centrale.
Historique
Entre 1958 et 1968, un grand nombre de primates ont été importés d’Asie, et quelques-uns d’Afrique, en Europe et aux États-Unis pour être utilisés dans le développement et les tests du vaccin contre la poliomyélite. Pendant leur transit, ils étaient souvent accompagnés d’autres animaux sauvages, pouvant créer de nombreuses opportunités de transmission du virus. Au Statens Serum Institut de Copenhague, au Danemark, Preben von Magnus a remarqué pour la première fois la variole du singe en 1958, lorsqu’il a observé deux épidémies non mortelles affectant des singes cynomolgus de laboratoire après 51 et 62 jours de transport aérien depuis Singapour [5]. En Asie, le virus n’a cependant jamais été trouvé, et on pense que son apparition chez des singes asiatiques est due au fait qu’ils ont contracté la maladie en captivité ou lors de transits.
Dans les années 1960, des singes de laboratoire ont été atteints de variole dans des laboratoires européens et américains, notamment au Walter Reed Army Institute of Research en 1962, où plusieurs d’entre eux présentaient des anticorps et aucun symptôme après une exposition au MPXV [6]. Jusqu’en 1965, date à laquelle la variole du singe a été découverte au zoo de Rotterdam, on pensait qu’elle ne se manifestait que chez les primates. Cependant, la maladie a d’abord été détectée chez les fourmiliers géants d’Amérique centrale et du Sud, avant d’affecter plusieurs orangs-outans, chimpanzés, gorilles, singes- écureuils, macaques, ouistitis et gibbons, avec une mortalité de 50 % des animaux. Les orangs-outans ont été les plus sévèrement touchés par la maladie [7].
Pendant les efforts d’éradication de la variole en 1970, les premiers cas documentés de Mpox chez l’humain ont été décrits chez six enfants non vaccinés en République démocratique du Congo (RDC), au Liberia et en Sierra Leone [1]. Après ces premiers cas, des épidémies sporadiques ont été signalées dans certains pays d’Afrique occidentale et centrale, principalement chez des enfants vivant dans des zones rurales de forêt tropicale. Entre 1981 et 1986, plus de 300 cas de Mpox ont été rapportés en RDC avec des taux de mortalité de 1 à 2 %, la majorité d’entre eux étant consécutifs à des contacts avec des animaux [8]. Cependant, la plupart de ces contaminations n’ont pas été confirmées en laboratoire, en raison du manque d’infrastructures locales de diagnostic, de la difficulté d’atteindre les patients et des défis associés aux troubles civils et au système de santé existant. De nombreux cas sont encore survenus dans les années 1990–2000 [9]. La Mpox ne touche pas seulement les pays d’Afrique. Une épidémie de Mpox a eu lieu aux États-Unis en 2003, première épidémie de Mpox en dehors du continent africain. L’origine de cette épidémie a été imputée à des chiens de prairie de compagnie infectés. Ils avaient été hébergés avec des rongeurs importés du Ghana [10]. Au cours de cette épidémie, 71 cas de Mpox ont été signalés aux États-Unis [11]. Entre 2003 et 2022, près de 70 cas liés aux voyages ont été signalés en dehors des pays endémiques, en Europe, en Amérique du Nord et en Asie. Deux cas de Mpox ont été diagnostiqués au Royaume-Uni en 2018, chez deux passagers qui avaient voyagé depuis le Nigeria [12]. Au Royaume-Uni, la première transmission interhumaine en dehors de l’Afrique a été confirmée cette année-là [13].
L’augmentation de l’incidence en Afrique depuis 2000est probablement due à l’arrêt de la vaccination contre la variole en 1980
Diffusion du MPXV
Depuis 2016, de nombreux cas confirmés ont été signalés en Sierra Leone, au Liberia, en République centrafricaine, en République du Congo et au Nigeria [14]. L’augmentation spectaculaire de l’incidence en Afrique depuis 2000 est probablement due à l’arrêt de la vaccination contre la variole en 1980, les sujets ayant reçu ce vaccin, même plus de 25 ans auparavant, étant à risque réduit de Mpox. Les cas de Mpox en Afrique augmentent également parce que la population empiète de plus en plus sur les habitats naturels des animaux sauvages porteurs du virus.
Jusqu’à récemment, la recherche sur le MPXV a été négligée au niveau mondial. La communauté scientifique s’inquiète depuis longtemps du fait que le MPXV pourrait, avec le temps, se développer et s’installer dans la niche écologique autrefois occupée par la variole, un virus phylogénétiquement proche et aujourd’hui éliminé grâce à la vaccination. Les effets combinés de la déforestation, de la croissance démographique, de l’empiètement sur les habitats des réservoirs animaux, de l’augmentation des déplacements humains et de l’interconnexion mondiale accrue ont rendu cette éventualité envisageable [15].
Épidémiologie 2022–2023
L’épidémie actuelle a débuté en mai 2022 au Royaume-Uni [16]. Le premier cas confirmé de la maladie identifiée le 6 mai 2022 est survenu chez un voyageur en provenance du Nigeria (où la maladie est endémique). Parallèlement, des cas de Mpox, sans mortalité associée, ont été signalés au Portugal, en Espagne, au Canada, en Belgique, en Suède, en Italie, en Australie, en France, en Allemagne, aux États-Unis et au Royaume-Uni, au cours du mois de mai 2022 [17]. La plupart sont survenus chez des hommes jeunes, dont beaucoup se sont identifiés comme ayant des rapports sexuels avec des hommes (HSH), avec des lésions génitales suggérant que la transmission s’était très probablement produite par contact physique étroit. Le contexte de la maladie et sa transmission sont déconcertants en raison de la fréquence inhabituellement élevée de la transmission interhumaine observée. Deux grands rassemblements de population impliquant de nombreux membres de la communauté HSH, l’un au printemps 2022 et l’autre au début de l’été ont été des catalyseurs pour sa diffusion. Le 23 juillet 2022, le directeur général de l’OMS a déclaré que cette épidémie était une urgence de santé publique de portée internationale [18].
Après une augmentation très rapide du nombre de cas en juin et juillet 2022, le pic de l’épidémie a été atteint mi-août avec 7 577 cas confirmés sur la semaine 32, suivi d’une décroissance du nombre de cas à partir de septembre suite à une campagne massive de vaccination des populations cibles pour atteindre moins de 200 cas par semaine sur la première quinzaine de février 2023 [19] (figure 3 ). Au 25 février 2023, 86 127 cas confirmés, dont 97 décès, ont été déclarés au niveau mondial sur 110 pays. Les dix pays les plus touchés au niveau mondial sont:
-
◗
États-Unis d’Amérique (n = 29 987),
-
◗
Brésil (n = 10 825),
-
◗
Espagne (n = 7 543),
-
◗
France (n = 4 128),
-
◗
Colombie (n = 4 081),
-
◗
Mexique (n = 3 877),
-
◗
Pérou (n = 3 752),
-
◗
Royaume-Uni (n = 3 735),
-
◗
Allemagne (n = 3 692)
-
◗
Canada (n = 1 460).
Figure 3.
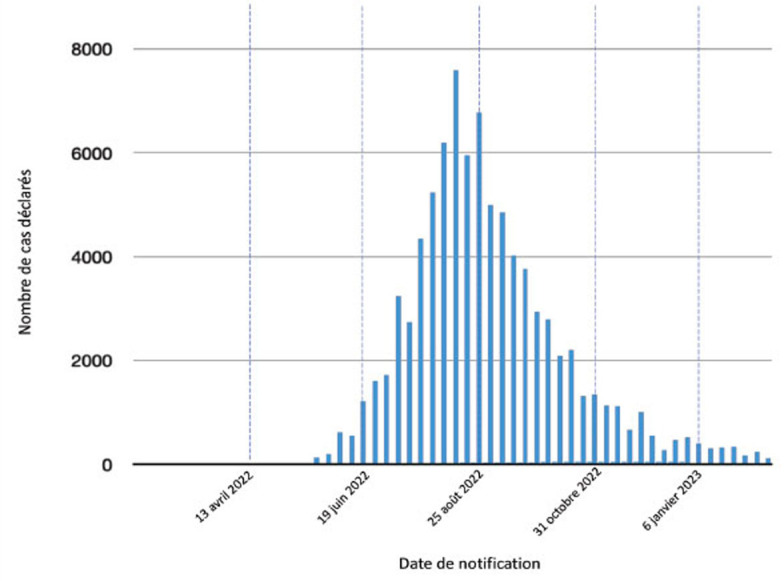
Évolution du nombre de cas de Mpox au niveau mondial sur la période 2022–2023 par date de notification.
Données de l’OMS.
Près de 98 % des cas déclarés proviennent de l’Europe et des Amériques (figure 4 ). Parmi les cas pour lesquels on dispose de données épidémiologiques et comportementales plus précises, 96,4 % (73 757 cas sur 76 482) sont des hommes, l’âge médian étant de 34 ans (IQR : 29 – 41). Les hommes âgés de 18 à 44 ans continuent d’être majoritairement affectés par cette épidémie puisqu’ils représentent 79,2 % des cas. Parmi tous ceux pour lesquels des données sont disponibles, 3,6 % (2 725 sur 76 482) sont des femmes. Parmi les cas féminins où l’orientation sexuelle est signalée, la majorité est hétérosexuelle (934 sur 978 soit 96 %). Le contexte d’exposition le plus souvent rapporté est le foyer (47 cas sur 115 ; 41 %), et la forme de transmission la plus courante est le rapport sexuel (241 cas sur 593 ; 41 %). Chez les hommes contaminés dont l’orientation sexuelle était connue, 85,5 % (27 146 cas sur 31 751) ont été identifiés comme des HSH. Parmi eux, 1 851 cas sur 27 146 (6,8 %) étaient identifiés comme bisexuels. Chez les personnes dont le statut sérologique était connu, 48 % (17 228 cas sur 35 864) étaient séropositives pour le VIH. Il convient de noter que les informations sur le statut VIH ne sont pas disponibles pour la majorité des cas, et peuvent être biaisées. 1 236 cas ont été signalés comme étant des professionnels de la santé. Cependant, la plupart ont été infectés hors contexte professionnel et des investigations sont en cours pour déterminer si certains cas pourraient être consécutifs à une exposition professionnelle. Parmi toutes les situations dans lesquelles les cas étaient susceptibles d’avoir été exposés, le plus fréquent était celui des fêtes avec contacts sexuels, représentant 3 720 cas sur 5 476 (67,9 %) de tous les événements d’exposition signalés [19].
Figure 4.

Distribution des cas de Mpox déclarés à l’OMS sur la période 2022–2023 en fonction des Régions géographiques OMS.
© S. Hantz
La France a fait partie des pays les plus touchés par cette nouvelle épidémie. Au 24 janvier 2023, 4 982 cas d’infection à MPXV ont été recensés en France, dont 4 128 cas (83 %) confirmés biologiquement. Le pic de déclaration a été relevé durant l’été 2022, puis la courbe épidémique a suivi une décroissance similaire à celle observée au niveau mondial. La distribution des cas est très inhomogène sur le territoire avec une très grande majorité rapportée en Île-de-France (3 119, soit 63 %), suivie de l’Auvergne-Rhône-Alpes (355 cas), de la Provence-Alpes-Côte d’Azur (334 cas), et de l’Occitanie (330 cas). Aucun décès n’a été signalé à cette date.
Modes de transmission
La transmission zoonotique peut avoir lieu par contact direct avec le sang, les fluides corporels ou par contact avec les lésions de la peau ou des muqueuses des animaux infectés. L’infection par le MPXV a été mise en évidence chez de nombreuses espèces animales présentes en Afrique, notamment les écureuils, les rats de Gambie et les loirs, ainsi que chez diverses espèces de singes [20]. On ne sait toujours pas quel animal est le réservoir naturel du MPXV, mais les rongeurs constituent le réservoir le plus probable. Il est possible de contracter la maladie en mangeant de la viande infectée qui n’a pas été correctement cuite. Les personnes vivant dans ou proche de zones forestières sont plus susceptibles d’être exposées en raison de leur proximité avec ces animaux sauvages infectés [21].
La transmission du virus de personne à personne fait suite à un contact étroit avec des sécrétions respiratoires, des lésions sur la peau d’une personne infectée ou des objets récemment contaminés. Selon une étude sur la transmission menée en Afrique, le taux d’attaque secondaire après un contact avec une source humaine connue est de 3 %, et des taux d’attaque jusqu’à 50 % ont été rapportés chez des personnes vivant avec une personne infectée par le MPXV [22]. Des études ont évoqué également une possible transmission materno-fœtale à l’origine de Mpox congénital [23]. Depuis l’épidémie de 2022, les données de transmission disponibles pour 22 038 cas sur 82 321 (26,8 %) établissent clairement que le MPXV peut être transmis spécifiquement par voie sexuelle [24] (figure 5 ).
Figure 5.
Distribution des modes de transmission du MPXV au cours de l’épidémie 2022–2023 déclarés à l’OMS.
© S. Hantz
Physiopathologie
La période d’incubation se situe généralement autour de huit à neuf jours, mais peut aller de quatre à dix-sept jours [25]. La virémie lors de l’infection par le MPXV est généralement courte (un à deux jours), concomitante de la fin de la phase prodromique qui dure un à cinq jours. La fièvre dure un à trois jours, puis l’éruption cutanée ou rash apparaît.
La phase éruptive était classiquement décrite comme débutant par un exanthème (visage et bras) qui gagne en une seule poussée centrifuge le tronc et les membres inférieurs. Les lésions évoluaient ensuite du stade de macules jusqu’à celui de croûtes simultanément. L’individu reste contagieux jusqu’au moment où les croûtes tombent.
Caractéristiques cliniques
Jusqu’alors, l’infection à MPXV était décrite en deux phases:
-
◗
la phase prodromique se caractérise par un syndrome grippal associant des signes généraux (fièvre, frissons, sueurs abondantes, asthénie), des céphalées, des arthralgies et une lymphadénopathie uniou bilatérale (contrairement au virus de la variole). Les personnes exposées peuvent également développer une amygdalite aiguë, une toux (productive ou non) et un énanthème touchant les muqueuses buccale, conjonctivale et/ou génitale [26];
-
◗
la phase d’état correspond à l’apparition de lésions cutanées ressemblant à celles de la variole. Les lésions prédominent sur le visage mais peuvent se développer sur les paumes, la plante des pieds et la partie dorsale des mains et des pieds. En général, les lésions commencent par des macules (lésions à base plate), puis évoluent vers des papules (lésions légèrement surélevées et dures), des vésicules (lésions remplies de liquide clair), des pustules (lésions remplies de liquide jaunâtre), des ulcérations puis des croûtes, qui finissent par dessécher et tomber.
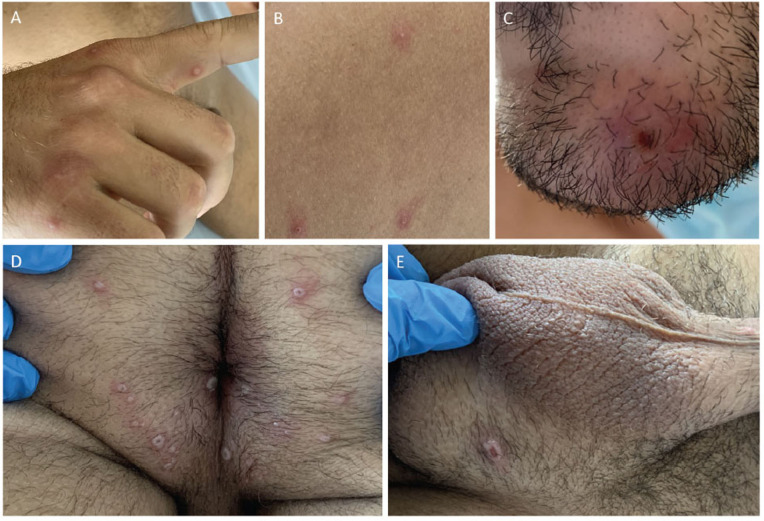
Lors de l’épidémie de Mpox en 2022, l’éruption débute le plus souvent au niveau ano-génital (figure 6 ) et/ou buccal, et peut être associée à des adénopathies satellites. Les signes généraux ne sont pas constants. L’éruption est plus ou moins floride, certains patients ne manifestant que quelques lésions isolées (figure 7 ) [27,28].
Figure 6.
Lésions cutanéo-muqueuses de Mpox.
Lésions cutanéo-muqueuses de Mpox distribuées au niveau des doigts (A), du dos (B), du visage (C), péri-anal (D) et scrotal (E).
© P. Pinet
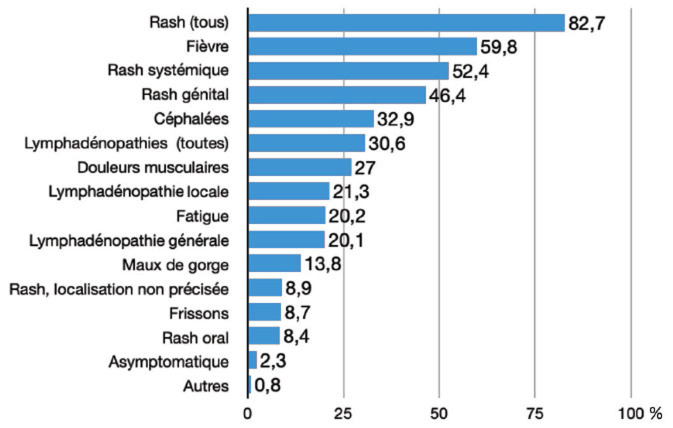
Figure 7.
Fréquence des symptômes déclarés à l’OMS au cours de l’épidémie 2022–2023.
© S. Hantz
Des complications graves peuvent survenir telles qu’une pneumonie, une déshydratation post-diarrhéique, une cellulite, une conjonctivite, une blépharite, une kératite avec risque de cécité secondaire à une ulcération de la cornée, une septicémie et une encéphalite. Ces séquelles peuvent toucher jusqu’à 43 % des individus non vaccinés [29].
Dans la population générale, le taux de létalité de la Mpox se situe historiquement entre 1 et 11 % [1], tandis que les taux de létalité des jeunes enfants et de personnes immunodéprimées ont tendance à être plus élevés. Durant l’épidémie actuelle, on estime que le taux de létalité se situe en dessous de 1 % [30].
Diagnostic
Parmi les diagnostics cliniques différentiels qui doivent être pris en compte figurent la varicelle, la rougeole, les infections cutanées bactériennes, la gale, la syphilis et les allergies associées aux médicaments. Ainsi, il est essentiel de réaliser un diagnostic biologique pour confirmer un cas suspect et éliminer ces diagnostics différentiels.
Les prélèvements recommandés pour le diagnostic virologique initial de la Mpox selon le contexte clinique et/ ou le type de lésions observées sont les suivants:
-
◗
prélèvements cutanéo-muqueux : écouvillonnages et/ou biopsies de lésions cutanées (toits des lésions, exsudats, voire croûtes) et/ou lésions muqueuses (hors sphère ORL) génitales et anales ;
-
◗
prélèvements de la sphère ORL : écouvillonnages oropharyngés (nasopharyngés possibles) ;
-
◗
prélèvements respiratoires semi-profonds et profonds si signes respiratoires : aspirations trachéo- bronchiques, liquides broncho-alvéolaires, prélèvements distaux protégés, crachats induits ;
-
◗
liquides cérébrospinaux (LCS) si suspicion d’atteinte neurologique.
Tous les prélèvements de type écouvillonnage doivent être déchargés en milieu de transport. Les échantillons doivent être conditionnés conformément aux exigences nationales et internationales et être expédiés en conséquence dans un laboratoire disposant des autorisations nécessaires.
L’approche de choix pour la confirmation diagnostique est la détection du virus par biologie moléculaire. Selon la Société française de microbiologie, le diagnostic spécifique de l’infection par le MPXV est réalisé actuellement par PCR de genre (genre orthopoxvirus) puis par une PCR de confirmation MPXV ou directement par PCR spécifique MPXV [31,32]. La culture cellulaire ne doit pas être utilisée en première intention diagnostique [33]. Tout prélèvement positif doit être envoyé au Centre national de référence, localisé à l’Institut de recherche biomédicale des armées (Irba) [34].
La plupart des tests de diagnostic moléculaire disponibles pour le MPXV sont basés sur la PCR quantitative en temps réel (qPCR), et quelques tests basés sur l’amplification isothermique en boucle (LAMP) sont en cours de développement. Les amorces et sondes publiées ont été conçues autour des régions conservées de la région centrale codante (gène de l’ADN polymérase, gène de la protéine d’enveloppe) et de la région ITS. Un grand nombre de kits de réactifs commerciaux sont désormais disponibles pour la détection des orthopoxvirus ou des MPXV avec une sensibilité et une spécificité analytiques similaires, bien que les informations sur les performances cliniques et l’évaluation des types d’échantillon soient limitées. Les techniques traditionnelles d’isolement viral restent valables, mais nécessitent des compétences techniques et un laboratoire NSB3, le MPXV se cultivant sur cellules Vero mais également sur cellules humaines (HEK293, HeLa, A549, MRC-5) [35]. Bien que la culture virale ne soit pas utilisée dans le cadre du diagnostic du MPXV, elle constitue un élément essentiel de la réponse des laboratoires aux épidémies, en particulier pour l’obtention de souches virales nécessaire à l’élaboration et au choix des contrôles positifs pour la PCR et éventuellement le développement de tests sérologiques. En outre, la culture virale est utilisée dans les études d’évaluation de l’infectivité, notamment pour comprendre la période d’infectivité virale à partir des fluides corporels et l’importance de la transmission par ces différentes sources de contamination.
Enfin, permettant d’effectuer des tests phénotypiques de sensibilité aux antiviraux, elle entre en jeu dans l’évaluation de l’immunité de la population par des tests de neutralisation, et reste incontournable pour l’évaluation du tropisme cellulaire ou d’hôte afin d’identifier les organes cibles et/ou les réservoirs animaux potentiels.
Concernant les tests sérologiques, leur utilisation ne permet pas un diagnostic de certitude compte tenu de l’importance des réactions croisées entre les différents orthopoxvirus [36]. Il existe des tests Elisa, d’hémagglutination, d’immunofluorescence indirecte ou de séroneutralisation, mais peu de tests commerciaux sont disponibles. La présence d’IgM est en faveur d’une infection aiguë qui doit être confirmée par l’analyse d’un deuxième sérum après un intervalle de dix à quinze jours pour détecter des IgG. Des études de cinétique sérologique utilisant des Elisa suggèrent que les IgM peuvent persister pendant des semaines à quelques mois, tandis que les IgG persistent pendant des années [37].
Traitements
Plusieurs molécules antivirales sont envisagées pour lutter contre les infections à MPXV. À ce jour, aucune n’a d’autorisation de mise sur le marché en France dans cette indication. Mais, dans son avis du 25 mai 2022, le Haut Conseil de la santé publique (HCSP) précise les médicaments pouvant être utilisés en cas d’infection et propose une stratégie thérapeutique autour d’un cas suspect probable ou confirmé [38].
Les différentes options médicamenteuses contre l’infection à MPXV sont, pour les antiviraux (tableau 2 ), le técovirimat (AMM européenne), le brincidofovir (AMM américaine), et le cidofovir (proposé en France dans le cadre d’une autorisation d’accès compassionnel) et pour les immunoglobulines (Ig), les Ig humaines anti-vaccine.
Tableau 2.
Caractéristiques des traitements proposés dans l’infection à MPXV.
| Caractéristiques | Técovirimat | Cidofovir | Brincidofovir |
|---|---|---|---|
| MPXV EC 50 | 0,014 – 0,039 μM | 27–78 μM | 0,07–1,2 μM |
| Mécanisme d’action | Inhibition de la production de virus extracellulaire | Inhibiteur de l’ADN polymérase | Inhibiteur de l’ADN polymérase |
| Activité contre d’autres virus à ADN | Non | Oui | Oui |
| Approbation FDA | Adultes et enfants de plus de 3 kg pour le traitement de la variole | Traitement de la rétinite à CMV au cours du sida | Adultes, enfants et nouveau-nés pour le traitement de la variole |
| Posologie | 6 mg/kg/12 heures (IV) sur 6 heures de 3 kg à 35 kg 200 mg/12 heures de 13 kg à 25 kg 400 mg/12 heures de 25 kg à 40 kg 600 mg/12 heures si plus de 40 kg | 5 mg/kg par semaine | Moins de 10 kg : 6mg/kg par semaine 10 à 48 kg : 4 mg/kg par semaine Plus de 48 kg : 200mg par semaine |
| Durée du traitement | Quatorze jours | Deux semaines | Deux semaines |
| Utilisation pendant la grossesse | Pas d’embryo-foetotoxicité observée dans les études sur animaux | Embryotoxicité chez le rat et le lapin ; non recommandé pendant la grossesse | Embryotoxicité chez le rat et le lapin ; non recommandé pendant la grossesse |
| IV/PO | IV et PO | IV | PO |
| Effets indésirables majeurs | Céphalées, nausées et vomissements, douleurs abdominales | Toxicité rénale | Diarrhée, nausées |
Técovirimat (ST-246)
Le técovirimat est un antiviral approuvé par la Food and Drug Administration (FDA) aux États-Unis en 2018 pour traiter l’infection de la variole chez les adultes, ainsi que chez les enfants dans le cadre de potentiels actes de bioterrorisme [39]. Il est efficace contre les orthopoxvirus in vitro et in vivo. Son mode d’action est l’inhibition de l’activité de la protéine VP37 des orthopoxvirus, qui est codée par un gène hautement conservé chez tous les membres du genre orthopoxvirus. Il inhibe l’interaction de la protéine VP37 avec la Rab9 GTPase et la TIP47 cellulaires, ce qui empêche la formation de virions enveloppés compétents pour la sortie de la cellule, étape nécessaire pour la dissémination du virus de cellule à cellule et à distance.
Dans les essais en culture cellulaire, les concentrations efficaces de técovirimat entraînant une réduction de 50 % de l’effet cytopathique du virus (EC50) étaient de respectivement 0,016 à 0,067 μM, 0,014 à 0,039 μM, 0,015 μM et 0,009 μM pour les virus de la variole, le MPXV, le virus de la variole du lapin (rabbitpox) et le virus de la vaccine (cowpox) [40]. Disponible sous forme de gélule de 200 mg, la posologie est de :
-
◗
200 mg/12 heures pour les patients de 13 kg à moins de 25 kg,
-
◗
400 mg/12 heures pour les patients de 25 kg à moins de 40 kg,
-
◗
600 mg/12 heures pour les patients de 40 kg et plus.
Le traitement doit être instauré le plus tôt possible après le diagnostic, pendant une durée de quatorze jours. Le técovirimat permet de diminuer la durée d’une infection et l’excrétion de particules virales. Dans des études pré-cliniques, le técovirimat a été administré par voie orale à des animaux, à des doses très supérieures à celles qui sont généralement recommandées pour les humains, et aucun effet indésirable spécifique sur le fœtus n’a été observé au cours de l’étude. Enfin, des études de tolérance sur environ 360 volontaires ont été menées dans le cadre du processus de validation de la molécule, et les résultats ont montré que son profil d’effets indésirables était comparable à celui d’un placebo [41]. Le técovirimat présente une barrière à la résistance relativement faible, et certaines substitutions d’acides aminés dans la protéine VP37 cible peuvent conférer des diminutions importantes de l’activité antivirale du médicament. Néanmoins, le risque d’émergence de résistance est vraisemblablement très faible compte tenu de l’exposition limitée au traitement.
Cidofovir
Approuvé par FDA en 2012 dans le traitement de l’infection à CMV, le cidofovir (Vistide®) est un antiviral injectable dont le spectre d’action est assez large sur l’ensemble des virus à ADN. Le cidofovir est un analogue nucléotidique qui doit d’abord être phosphorylé par des enzymes cellulaires pour donner la forme active, le CDV triphosphate (CDV-ppp). Une fois phosphorylé, le CDV-ppp a une demi-vie intracellulaire prolongée. Pendant la réplication de l’ADN, le CDV-ppp est incorporé dans le brin en croissance et bloque la synthèse de l’ADN. Il agit donc comme inhibiteur de la réplication virale, classiquement utilisé pour traiter la rétinite à cytomégalovirus (CMV) chez les patients au stade sida. Il peut également être une alternative en cas de résistance au foscarnet, ou lors de résistance du virus herpès simplex (HSV) à l’aciclovir ou du CMV au ganciclovir. L’AMM a été retirée sur demande du laboratoire, principalement pour des raisons industrielles. Néanmoins, le cidofovir est actuellement disponible en France dans le cadre d’autorisations d’accès compassionnel pour la prise en charge d’infections à adénovirus, BK virus, CMV, HSV ou HHV6, ainsi que dans le traitement de la papillomatose laryngée et/ou respiratoire basse, réfractaire au traitement chirurgical. La posologie habituelle est de 5 mg/kg par semaine pendant deux semaines mais aucune donnée n’est disponible pour les poxvirus. On ignore si le cidofovir est efficace pour traiter l’infection à MPXV chez l’humain, même si plusieurs cas décrivant son efficacité vis-à-vis d’autres orthopoxvirus tels que le virus du molluscum contagiosum ou le virus de la vaccine ont été rapportés. L’efficacité antivirale du cidofovir sur des infections à orthopoxvirus a toutefois été démontrée dans des études pré-cliniques, in vitro et chez l’animal. Il semble être plus efficace lorsqu’il est administré tôt après l’exposition au MPXV, mais présente aussi un bénéfice lorsqu’il est administré relativement tard dans l’évolution de la maladie [42]. Le principal effet indésirable est sa néphrotoxicité dose-dépendante, due à l’accumulation de la molécule au niveau des tubules rénaux proximaux. Il est également potentiellement carcinogène, tératogène et reprotoxique. Pour limiter la toxicité rénale, les injections de cidofovir doivent être associées au probénécide et à une hyperhydratation intraveineuse.
Brincidofovir (CMX001)
Le brincidofovir est une prodrogue du cidofovir administrée par voie orale. Il dispose d’une bonne biodisponibilité et a un large spectre d’action sur les virus à ADN. Néanmoins, lors de son utilisation en prophylaxie de l’infection à cytomégalovirus, des troubles digestifs sévères (diarrhées) et des réactions du greffon contre l’hôte ont été signalés en plus grand nombre dans le groupe traité versus le groupe placebo, conduisant à l’arrêt de son utilisation dans cette indication. La FDA a approuvé l’utilisation du brincidofovir pour le traitement de la variole, à partir de juin 2021. Lors d’études précliniques, le brincidofovir s’est avéré efficace contre les infections à orthopoxvirus. Seuls quelques cas rapportés ont documenté son efficacité dans le traitement de l’infection par le MPXV [42].
Immunoglobulines humaines anti-vaccine
Aux États-Unis, un traitement par injection d’immunoglobulines issues de plasmas de patients vaccinés par le vaccin antivariolique a été développé durant les années 1950, demeurant le seul traitement approuvé par la FDA pendant de longues années. Ce traitement appelé vaccinia immune globulin (VIG) était administré par voie intramusculaire à la dose de 100 mg/kg pour traiter les complications post-vaccinales. À la suite de la diminution des stocks, une nouvelle production a été initiée en 2005. Administrée par voie IV (IV-VIG), elle permet l’administration d’une dose de 200 à 500 mg/kg. Des études réalisées dans les années 1950 semblent montrer une efficacité sur le virus de la variole mais aucune donnée n’est disponible sur l’infection à MPXV.
Néanmoins, elles sont recommandées par les autorités de santé dans cette indication même si leur efficacité reste relative, le contrôle immunitaire de l’infection impliquant plus largement les différentes composantes du système immunitaire.
Indications
Tenant compte des atouts et inconvénients de chaque médicament, le HCSP propose une stratégie thérapeutique selon laquelle il n’est pas recommandé de traiter systématiquement tous les cas confirmés de Mpox avec un antiviral ou des immunoglobulines. Le choix de recourir à un traitement spécifique par antiviral ou immunoglobulines doit être discuté et décidé de façon collégiale et, si le choix porte sur un traitement antiviral, le técovirimat doit être utilisé en première intention. Les immunoglobulines humaines anti-vaccines sont à réserver pour des populations particulières, lorsque les antiviraux ne sont pas envisageables (grossesse, enfants de moins de 13 kg) [43].
L’épidémie de Mpox a mis au défi les infrastructures économiques, médicales et de santé publique du monde entier
Prévention
La prévention de la Mpox repose sur la sensibilisation des individus aux facteurs de risque et aux mesures qu’ils peuvent prendre pour réduire les contaminations. Néanmoins, les caractéristiques de l’épidémie de 2022 ont démontré que ces mesures étaient insuffisantes et il a fallu envisager la mise en place d’une stratégie vaccinale large et rapide des individus à risque élevé d’exposition [44]. Il n’existe pas de vaccin spécifique contre la Mpox mais des données observationnelles antérieures suggèrent que le vaccin contre la variole procure une protection croisée et est efficace à au moins 85 % dans la prévention de la Mpox, car le MPXV est antigéniquement proche de celui de la variole [1]. Mais, compte tenu de l’arrêt de la vaccination contre la variole au début des années 1980, les individus de moins de 40 ans ne sont pas immunisés. Et, en l’absence de rappels, les plus de 40 ans n’ont probablement plus qu’une immunité partielle contre la variole, celle-ci permettant probablement, même résiduelle, de réduire la gravité des formes de Mpox chez ces derniers.
Les vaccins utilisés pour l’éradication de la variole (Dryvax®, Wyeth) sont dits de première génération. Ce sont des vaccins utilisant un virus vivant de la vaccine, produit sur animaux. Cependant, les vaccins antivarioliques de première génération ne répondent plus aux normes de qualité de fabrication actuelle. Ces vaccins vivants atténués pouvaient être responsables de complications post-vaccinales graves (1 cas pour 10 000 vaccinations), parfois létales. Des vaccins de deuxième génération (ACAM2000®, Emergent BioSolutions) ont été produits en culture cellulaire à partir des mêmes souches de virus. Si ces procédés permettaient d’améliorer la qualité de la production tout en conservant la même efficacité vaccinale, les complications post-vaccinales sont restées identiques. Des vaccins de troisième génération (Jynneos ou Imvanex) ont ensuite été développés à partir de souches de virus vivant modifié de vaccine Ankara, de virulence réduite avec des capacités plus faibles de multiplication in vivo. Cependant, leur immunogénicité est moins importante que celles des vaccins de première et deuxième génération. Le vaccin contre la variole Jynneos a été autorisé par la FDA en 2019 pour la prévention de la Mpox et de la variole sur la base des données d’immunogénicité et d’efficacité issues d’études animales. À compter de juillet 2022, la Haute Autorité de santé (HAS) a recommandé en priorité la vaccination pour les populations suivantes : des adultes qui ont eu un contact à risque avec un malade atteint de Mpox, des HSH rapportant des partenaires multiples, des personnes trans rapportant des partenaires sexuels multiples, des personnes en situation de prostitution, des professionnels des lieux de consommation sexuelle, quel que soit le statut de ces lieux. Ces vaccins peuvent être administrés en prophylaxie post-exposition dans les quatre jours suivant l’exposition. Des données présentées à la Conference on retroviruses and opportunistic infections (Croi) 2023 ont montré une efficacité vaccinale de 66 % pour le vaccin antivariolique de première génération (Dryvax®, Wyeth) et de 72 % pour celui de deuxième génération (ACAM2000®, Emergent BioSolutions) après une médiane de treize ans entre la vaccination et l’infection à MPXV chez des militaires américains vaccinés contre la variole dans le cadre de leur activité professionnelle. L’efficacité vaccinale contre les formes graves, définies par une hospitalisation, était de 59 % (Boghuma Titanji de l’Emory University à Atlanta).
Conclusion
Que ce soit dans les pays endémiques et non endémiques, cette épidémie de Mpox a mis au défi les infrastructures économiques, médicales et de santé publique du monde entier. Le tableau clinique observé diffère de celui des précédentes épidémies africaines, avec des signes systémiques moins fréquents et des lésions cutanées moins nombreuses qu’en 2003 aux États-Unis. Une des caractéristiques de cette épidémie est la prédominance de la localisation génitale et anale des lésions, ces éléments plaidant en faveur d’une transmission du MPXV lors de rapports sexuels. De nombreuses preuves, épidémiologiques ou moléculaires, sont en faveur d’une adaptation du MPXV à l’humain, alors que les données récentes tendent à démontrer un contrôle plutôt efficace de cette épidémie avec très peu de nouveaux cas récents déclarés. Il est probable que la population la plus à risque ait été aujourd’hui vaccinée et/ou immunisée de façon naturelle, ce qui a fait chuter le nombre de “supercontaminateurs”. Néanmoins, on ignore encore l’évolution future de cette zoonose ; son expansion au-delà des communautés à risque vers la population générale reste possible. En outre, il est probable que des virus ou autres agents pathogènes zoonotiques continueront à l’avenir de provoquer des épidémies humaines. Par conséquent, outre l’endiguement de cette épidémie et sa surveillance rapprochée, les efforts doivent se concentrer sur la mise en place de mesures globales, sanitaires et écologiques, pour prévenir les épidémies émergentes d’origine zoonotique.
Déclaration de liens d’intérêts : les auteurs déclarent ne pas avoir de liens d’intérêts.
Points à retenir
-
◗
Le virus de la variole du singe (MPXV) est responsable d’épidémies chez l’humain depuis les années 1970 essentiellement en Afrique et aux États-Unis en 2003.
-
◗
L’épidémie de Mpox survenue en 2022–2023 est responsable de plus de 86 000 cas confirmés et d’une centaine de décès déclarés sur 110 pays.
-
◗
Une transmission majoritairement sexuelle, des lésions à prédominance génitale et une prévalence élevée chez les HSH sont caractéristiques de l’épidémie de 2022.
-
◗
Le diagnostic repose sur la détection directe du MPXV par PCR sur lésions.
Références
- 1.Breman J.G., Null Kalisa-Ruti, Steniowski M.V., et al. Human monkeypox, 1970-79. Bull World Health Organ. 1980;58(2):165–182. [PMC free article] [PubMed] [Google Scholar]
- 2.Adler H., Gould S., Hine P., et al. Clinical features and management of human monkeypox: a retrospective observational study in the UK. The Lancet Infect Dis. 2022;22(8):1153–1162. doi: 10.1016/S1473-3099(22)00228-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Ferraris O., Ferrier-Rembert A., Peyrefitte C. Traité de Virologie Médicale. SFM; Paris: 2019. Poxvirus; pp. 339–349. [Google Scholar]
- 4.Isidro J., Borges V., Pinto M., et al. Phylogenomic characterization and signs of microevolution in the 2022 multi-country outbreak of monkeypox virus. Nat Med. 2022;28(8):1569–1572. doi: 10.1038/s41591-022-01907-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.von Magnus P., Andersen E.K., Petersen K.B., Birch-Andersen A. A pox-like disease in cynomolgus monkeys. Acta Pathologica Microbiologica Scandinavica. 1959;46(2):156–176. [Google Scholar]
- 6.Mcconnell S.J., Herman Y.F., Mattson D.E., Erickson L. Monkey Pox Disease in Irradiated Cynomologous Monkeys. Nature. 1962;195(4846):1128–1129. [Google Scholar]
- 7.Gispen R., Verlinde J.D., Zwart P. Histopathological and virological studies on monkeypox. Arch Gesamte Virusforsch. 1967;21(2):205–216. doi: 10.1007/BF01241445. [DOI] [PubMed] [Google Scholar]
- 8.US Centers for Disease Control and Prevention Human monkeypox- Kasai Oriental, Democratic Republic of Congo, February 1996-October 1997. Morbidity and Mortality Weekly Report. 1997;46:1168–1171. [PubMed] [Google Scholar]
- 9.Heymann D.L., Szczeniowski M., Esteves K. Re-emergence of monkeypox in Africa: a review of the past six years. Br Med Bull. 1998;54(3):693–702. doi: 10.1093/oxfordjournals.bmb.a011720. [DOI] [PubMed] [Google Scholar]
- 10.Hutson C.L., Lee K.N., Abel J., et al. Monkeypox zoonotic associations: insights from laboratory evaluation of animals associated with the multi-state US outbreak. Am J Trop Med Hyg. 2007;76(4):757–768. [PubMed] [Google Scholar]
- 11.US Centers for Disease Control and Prevention Multistate outbreak of monkeypox – Illinois, Indiana and Wisonsin, 2003. Morbidity and Mortality Weekly Report. 2003;52:537–540. [PubMed] [Google Scholar]
- 12.Vaughan A., Aarons E., Astbury J., et al. Two cases of monkeypox imported to the United Kingdom, September 2018. Euro Surveill. 2018;23(38):1800509. doi: 10.2807/1560-7917.ES.2018.23.38.1800509. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Vaughan A., Aarons E., Astbury J., et al. Human-to-Human Transmission of Monkeypox Virus, United Kingdom, 2018. Emerg Infect Dis. 2020;26(4):782–785. doi: 10.3201/eid2604.191164. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Yinka-Ogunleye A., Aruna O., Ogoina D., et al. Reemergence of Human Monkeypox in Nigeria, 2017. Emerg Infect Dis. 2018;24(6):1149–1151. doi: 10.3201/eid2406.180017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Devaux C.A., Mediannikov O., Medkour H., Raoult D. Infectious Disease Risk Across the Growing Human-Non Human Primate Interface: A Review of the Evidence. Front Public Health. 2019;7:305. doi: 10.3389/fpubh.2019.00305. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Vivancos R., Anderson C., Blomquist P., et al. Community transmission of monkeypox in the United Kingdom, April to May 2022. Euro Surveill. 2022;27(22):2200422. doi: 10.2807/1560-7917.ES.2022.27.22.2200422. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.WHO. Multi-country monkeypox outbreak: situation update. 2022. www.who.int/emergencies/disease-outbreak-news/item/2022-DON393.
- 18.WHO Direct-General declares the ongoing monkeypox outbreak a Public Health Emergency of International Concern. 2022. www.who.int/europe/news/item/23-07-2022-who-director-general-declaresthe-ongoingmonkeypox-outbreak-a-public-health-event-of-international-concern.
- 19.World Health Organization. 2022-23 Mpox (Monkeypox) Outbreak: Global Trends [Internet]. 2023. Disponible sur: https://worldhealthorg.shinyapps.io/mpx_global/#6_Literature_Summary_Epidemic_Parameters.
- 20.Khodakevich L., Szczeniowski M., Null Manbu-Ma-Disu, et al. The role of squirrels in sustaining monkeypox virus transmission. Trop Geogr Med. 1987;39(2):115–122. [PubMed] [Google Scholar]
- 21.Radonic A., Metzger S., Dabrowski P.W., et al. Fatal monkeypox in wild-living sooty mangabey, Côte d’Ivoire, 2012. Emerg Infect Dis. 2014;20(6):1009–1011. doi: 10.3201/eid2006.131329. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Nolen L.D., Osadebe L., Katomba J., et al. Extended Human-to- Human Transmission during a Monkeypox Outbreak in the Democratic Republic of the Congo. Emerg Infect Dis. 2016;22(6):1014–1021. doi: 10.3201/eid2206.150579. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Mbala P.K., Huggins J.W., Riu-Rovira T., et al. Maternal and Fetal Outcomes Among Pregnant Women With Human Monkeypox Infection in the Democratic Republic of Congo. J Infect Dis. 2017;216(7):824–828. doi: 10.1093/infdis/jix260. [DOI] [PubMed] [Google Scholar]
- 24.Sah R., Abdelaal A., Reda A., et al. Monkeypox and Its Possible Sexual Transmission: Where Are We Now with Its Evidence? Pathogens. 2022;11(8):924. doi: 10.3390/pathogens11080924. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Miura F., van Ewijk C.E., Backer J.A., et al. Estimated incubation period for monkeypox cases confirmed in the Netherlands, May 2022. Euro Surveill. 2022;27(24):2200448. doi: 10.2807/1560-7917.ES.2022.27.24.2200448. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Elsayed S., Bondy L., Hanage W.P. Monkeypox Virus Infections in Humans. Clin Microbiol Rev. 2022;35(4):e0009222. doi: 10.1128/cmr.00092-22. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Jezek Z., Szczeniowski M., Paluku K.M., Mutombo M. Human monkeypox: clinical features of 282 patients. J Infect Dis. 1987;156(2):293–298. doi: 10.1093/infdis/156.2.293. [DOI] [PubMed] [Google Scholar]
- 28.Société Française de Dermatologie. Monkeypox virus: manifestations dermatologiques www.sfdermato.org/upload/news/groupemonkeypeauxfinal-1.pdf.
- 29.Mailhe M., Beaumont A.L., Thy M., et al. Clinical characteristics of ambulatory and hospitalized patients with monkeypox virus infection: an observational cohort study. Clin Microbiol Infect. 2023;29(2):233–239. doi: 10.1016/j.cmi.2022.08.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Bunge E.M., Hoet B., Chen L., et al. The changing epidemiology of human monkeypox-A potential threat? A systematic review. PLoS Negl Trop Dis. 2022;16(2):e0010141. doi: 10.1371/journal.pntd.0010141. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Olson V.A., Laue T., Laker M.T., et al. Real-time PCR system for detection of orthopoxviruses and simultaneous identification of smallpox virus. J Clin Microbiol. 2004;42(5):1940–1946. doi: 10.1128/JCM.42.5.1940-1946.2004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Li Y., Olson V.A., Laue T., et al. Detection of monkeypox virus with real-time PCR assays. J Clin Virol. 2006;36(3):194–203. doi: 10.1016/j.jcv.2006.03.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Société Française de Microbiologie. Fiche : Gestion des prélèvements biologiques d’un patient suspect ou confirmé d’infection par le Monkeypox virus (MPXV). 2022 www.sfm-microbiologie.org/actualites/monkeypox/monkeypox-fiches/.
- 34.Centre national de référence laboratoire expert (CNR-LE) Orthopoxvirus. www.defense.gouv.fr/sante/centre-national-referenceorthopoxvirus.
- 35.Cho C.T., Wenner H.A. In vitro growth characteristics of monkeypox virus. Proc Soc Exp Biol Med. 1972;139(3):916–920. doi: 10.3181/00379727-139-36266. [DOI] [PubMed] [Google Scholar]
- 36.Esposito J.J., Obijeski J.F., Nakano J.H. Serological relatedness of monkeypox, variola, and vaccinia viruses. J Med Virol. 1977;1(1):35–47. doi: 10.1002/jmv.1890010107. [DOI] [PubMed] [Google Scholar]
- 37.Karem K.L., Reynolds M., Braden Z., et al. Characterization of acute-phase humoral immunity to monkeypox: use of immunoglobulin M enzyme-linked immunosorbent assay for detection of monkeypox infection during the 2003 North American outbreak. Clin Diagn Lab Immunol. 2005;12(7):867–872. doi: 10.1128/CDLI.12.7.867-872.2005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.HSCP. Conduite à tenir autour d’un cas suspect, probable ou confirmé d’infection à Monkeypox virus [Internet]. 2022. www.hcsp.fr/Explore.cgi/avisrapportsdomaine?clefr=1212.
- 39.Food and Drugs Administration. FDA Approves the First Drug with an Indication for Treatment of Smallpox 2018 www.fda.gov/newsevents/press-announcements/fda-approves-first-drug-indicationtreatment-smallpox.
- 40.Frenois-Veyrat G., Gallardo F., Gorgé O., et al. Tecovirimat is effective against human monkeypox virus in vitro at nanomolar concentrations. Nat Microbiol. 2022;7(12):1951–1955. doi: 10.1038/s41564-022-01269-8. [DOI] [PubMed] [Google Scholar]
- 41.Grosenbach D.W., Honeychurch K., Rose E.A., et al. Oral Tecovirimat for the Treatment of Smallpox. N Engl J Med. 2018;379(1):44–53. doi: 10.1056/NEJMoa1705688. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Siegrist E.A., Sassine J. Antivirals With Activity Against Mpox: A Clinically Oriented Review. Clin Infect Dis. 2023;76(1):155–164. doi: 10.1093/cid/ciac622. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.HSCP. Avis du HCSP relatif à la conduite à tenir autour d’un cas suspect, probable ou confirmé d’infection à Monkeypox virus]. 2022. www.hcsp.fr/Explore.cgi/Telecharger?NomFichier=hcspa20220524_contenautduncasdinfmonvir.pdf.
- 44.HAS. Réponses Rapides : infection par le virus Monkeypox – Prise en charge en médecine de 1er recours. 2022. www.has-sante.fr/jcms/p_3361191/fr/reponses-rapides-infection-par-le-virus-monkeypox-prise-en-charge-en-medecine-de-1er-recours.