Abstract
目的:
设计合成长链取代的2-(4′-羟基苯基)-4,4,5,5-四甲基咪唑烷-1-氧基-3-氧化物(HPN)衍生物,以增强HPN的抗缺氧活性。
方法:
以乙腈为溶剂、碳酸钾为缚酸剂, 60 ℃反应条件下将HPN分别与6-溴己醇、6-溴己酸乙酯和6-溴己烷进行烷基化反应得到3个长链亲脂性HPN衍生物1、3和5;衍生物1在氢氧化钠甲醇/水体系下经过水解反应得到衍生物2;以二氯甲烷为溶剂, N, N′-二异丙基碳二亚胺为脱水剂,HPN与己酸进行酯化反应,得到衍生物4。采用红外光谱、电子顺磁共振和高分辨质谱表征衍生物1~5的结构,高效液相色谱法检测衍生物的纯度,计算油水分配系数(log P值)评估衍生物的脂溶性,并通过缺氧小鼠常压密闭缺氧实验和急性减压耐受实验考察HPN及衍生物1~5的抗缺氧活性。
结果:
5个衍生物的结构经红外光谱、电子顺磁共振和高分辨质谱分析确认,产率均在92%以上,纯度均在96%以上。衍生物1~5的log P值分别为2.78、2.00、2.04、2.88和3.10,均高于HPN(0.97);在给药剂量为 0.3 mmol/kg时均能显著延长常压密闭缺氧小鼠的生存时间,并将急性减压缺氧小鼠的死亡率分别下降至60%、70%、60%、70%、40%。
结论:
衍生物1~5的合成方法简便,产率较高,且在剂量较小的情况下,仍然表现出类似或优于HPN的抗缺氧活性,其中衍生物5的活性最佳。
Abstract
Objective
: To design and synthesize long-chain substituted 2-[(4′-hydroxyethoxy) phenyl]-4,4,5,5-tetramethyl-2-imidazoline-1-oxyl 3-oxide (HPN) derivatives with enhanced anti-hypoxic activity.
Methods
: HPN derivatives 1, 3, 5 containing lipophilic long chains were synthesized via the alkylation of HPN with 6-bromohexan-1-ol, ethyl 6-bromohexanoate or 6-bromohexane, respectively using acetonitrile as the solvent and K 2CO 3 as the acid-binding agent at 60 ℃. Derivative 2 was synthesized via hydrolysis reactions of derivative 1 in the NaOH/CH 3OH/H 2O system. Using dichloromethane as the solvent and N, N′-diisopropylcarbodiimide as the dehydrating agent, HPN underwent esterification with hexanoic acid to obtain derivative 4. The structures of derivatives 1-5 were characterized by infrared spectroscopy, electron paramagnetic resonance and high resolution mass spectrometry. The purities of derivatives were detected by high performance liquid chromatography, and the lipid solubilities of derivatives were evaluated by calculating the oil-water partition coefficients (log P). Anti-hypoxia activities of HPN and its long-chain lipophilic derivatives 1-5 were evaluated using normobaric hypoxia test and acute decompression hypoxia test.
Results
: The structures of the derivatives were confirmed by infrared spectroscopy, electron paramagnetic resonance and high resolution mass spectroscopy. The yields of target derivatives were all above 92%, and the purities were all above 96%. The log P values of derivatives 1-5 were 2.78, 2.00, 2.04, 2.88 and 3.10, which were higher than that of HPN (0.97). Derivatives 1-5 significantly prolonged the survival time of mice at the dose of 0.3 mmol/kg in normobaric hypoxic test and reduced the mortality rate of acute decompression hypoxic mice to 60%, 70%, 60%, 70% and 40%, respectively.
Conclusions
: The synthesis of derivatives 1-5 is convenient, and the yield is high. The synthesized derivatives especially derivative 5 show anti-hypoxic activity similar to or better than HPN at lower doses.
Keywords: Nitronyl nitroxide; 2-[(4′-Hydroxyethoxy) phenyl]-4,4,5,5-tetramethyl-2-imidazoline-1-oxyl 3-oxide; Lipophilic; Long chain; Synthesis; Anti-hypoxia; Mouse
2-(4′-羟基苯基)-4,4,5,5-四甲基咪唑烷-1-氧基-3-氧化物{2-[(4′-hydroxyethoxy) phenyl]-4,4,5,5-tetramethyl-2-imidazoline-1-oxyl 3-oxide, HPN};无特定病原体(specific pathogen free, SPF); , ′-二异丙基碳二亚胺( , ′-diisopropylcarbodiimide, DIC) ;高效液相色谱法(high performance liquid chromatography, HPLC);
脑是机体耗氧量最大的器官,对缺氧极为敏感 [1] 。缺氧可引起脑组织损伤和认知功能障碍,但其损伤机制尚未完全明确,氧化应激和活性氧的增加在其中可能发挥着重要作用 [2] 。在高原低氧环境下,机体进入急性缺氧状态,会导致脑血管扩张、脑血流增加、颅内压增高、无氧呼吸增加、ATP生成减少,产生低氧脑损伤 [3] 。同时,缺氧会诱导活性氧的大量产生,进而攻击脂质体、蛋白质和核酸等生物大分子,诱发脂质过氧化,从而对细胞和组织造成损伤 [ 2, 4] 。
抗氧化剂能够通过清除活性氧缓解缺氧诱导的损伤 [5] 。氮氧自由基HPN是一类分子结构中含硝酮功能团和一氧化氮自由基的稳定化合物,在分子磁性材料研究中受到广泛关注 [6] 。近年研究发现,氮氧自由基是一类优秀的自由基清除剂,与维生素E等传统抗氧化剂不同,氮氧自由基具有拟超氧化物歧化酶的作用,能够以催化的方式清除自由基,以较小的剂量清除大量自由基 [7] 。研究表明,氮氧自由基具有抗肿瘤、抗缺血再灌注损伤、防辐射、防次声和神经保护等广泛的药理作用 [8] 。本团队前期研究发现,HPN能够通过清除活性氧对高原缺氧小鼠产生明显的保护作用 [9] ,并设计合成了HPN分子与不同长链烷烃连接的氮氧自由基衍生物,其中C6-HPN显示出更好的缺氧活性 [10] 。
为了进一步提高HPN对缺氧脑损伤的保护作用,本研究拟通过提高脂溶性的方式,设计合成一系列长链取代的HPN衍生物,并通过常压密闭缺氧实验和急性减压耐受实验对衍生物的抗缺氧活性进行考察。
材料与方法
实验动物
140只SPF级雄性BALB/c小鼠,4~6周龄,体重(20±2)g,购自中国农业科学院兰州兽医研究所[生产许可证号SCXK(甘)2015-0001]。所有小鼠在中国人民解放军联勤保障部队第九四〇医院动物实验科适应性饲养 3 d后进行实验[使用许可证号SYXK(军)014-0029]。研究方案通过中国人民解放军联勤保障部队第九四〇医院伦理委员会审查(P18KYLL015),实验废弃物及动物尸体处理按照《医疗废物管理条例》 [11] ,实验严格遵守《关于善待实验动物的指导性意见》 [12] 。
主要仪器和试剂
模拟高原低压低氧动物实验舱为贵州风雷航空军械有限公司产品;X-4B型显微熔点仪(温度未校正)为上海精科实业有限公司产品;HWCL-3集热式恒温磁力搅拌器和R-1001VN旋转蒸发仪为郑州长城科工贸有限公司产品;ALPHA-T傅里叶变换红外光谱仪、APEX Ⅱ型傅里叶变换离子回旋共振质谱仪、micro TOF-Q Ⅱ型高分辨飞行时间质谱仪、A300-9.5/12电子顺磁共振波谱仪为德国Brucker公司产品;Ultimate 3000超高压液相色谱仪为美国Thermo Scientific公司产品;Symmetry® C 18(5.0 μm, 4.6 mm ×150 mm)色谱柱为美国Waters 公司产品。
HPN按照文献 [8]中的方法合成。己酸(98%)、6-溴己酸乙酯(98%)、6-溴正己醇(98%)和6-溴己烷(98%)为安耐吉化学试剂有限公司产品;DIC(98%)为上海阿拉丁生化科技有限公司产品;GF254高效薄层硅胶板为烟台市化学工业研究院产品;200~300目柱层层析硅胶为青岛海洋化工厂分厂产品;其他均为市售分析纯试剂。
化学反应合成HPN衍生物
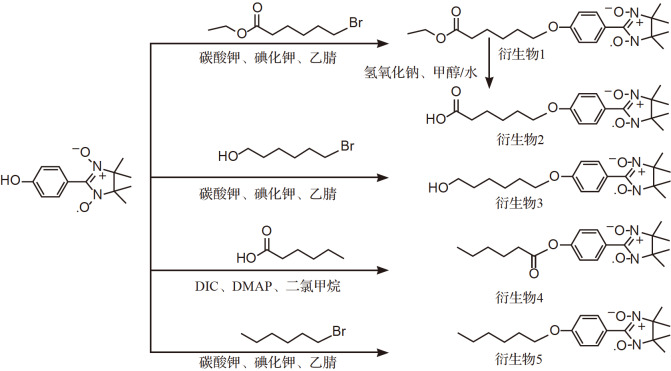
为了考察连接方式(醚键或酯键)和链端上的取代基对HPN活性的影响,将HPN分别与溴己酸乙酯、溴己醇、溴己烷和己酸反应,得到5个长链脂溶性HPN衍生物( 图1)。
图1 .
HPN衍生物1~5的合成路线
DIC: N, N′-二异丙基碳二亚胺;DMAP:4-二甲氨基吡啶.
合成衍生物1
将 2 mmol HPN和 4 mmol 6-溴己酸乙酯溶于 50 mL无水乙腈中,加入 2 mmol碳酸钾和催化量的碘化钾, 60 ℃下搅拌反应 3 h后,薄层色谱监测反应至完全,加水 50 mL, 减压除去乙腈,用 20 mL二氯甲烷萃取3次,合并有机相,无水硫酸钠干燥过夜。过滤,减压除去溶剂后快速柱层析分离,浓缩干燥后得衍生物1,即2-{4′-[(6-乙氧基羰基)-己氧基]苯基}-4,4,5,5-四甲基咪唑烷-1-氧基-3-氧化物。
合成衍生物2
将 1.0 mmol衍生物1溶于 10 mL甲醇中,冰水浴冷却至 0 ℃, 滴加10%氢氧化钠水溶液 2 mL。室温下继续反应 2 h, 薄层色谱监测反应完全后,加水 10 mL, 减压除去甲醇,用稀盐酸调节酸碱度值为酸性,有蓝色固体析出,过滤,用水洗涤至中性,滤饼真空干燥后得衍生物2,即2-[4′-(5-羧基戊氧基)苯基]-4,4,5,5-四甲基咪唑烷-1-氧基-3-氧化物。
合成衍生物3
将 1 mmol HPN和 2 mmol 6-溴正己醇溶于 25 mL无水乙腈中,加入 1 mmol碳酸钾和催化量的碘化钾, 60 ℃下搅拌反应 3 h后,薄层色谱监测反应完全后,加水 25 mL, 减压除去乙腈,用 10 mL二氯甲烷萃取3次,合并有机相,无水硫酸钠干燥过夜。过滤,减压除去溶剂后快速柱层析分离,浓缩干燥后得衍生物3,即2-[4′-(6-羟己氧基)苯基]-4,4,5,5-四甲基咪唑烷-1-氧基-3-氧化物。
合成衍生物4
将 1 mmol HPN, 1.2 mmol己酸和 0.01 mmol 4-二甲氨基吡啶溶于 10 mL无水二氯甲烷中,0 ℃冰水浴下滴加 2.0 mmol DIC无水二氯甲烷溶液 10 mL, 室温下继续搅拌反应过夜。薄层色谱监测反应完毕,加入 5 mL水,水相用 10 mL二氯甲烷萃取3次,合并有机相,硫酸钠干燥过夜。过滤,减压除去溶剂后快速柱层析分离,浓缩干燥后得衍生物4,即2-(4′-己酰氧基苯基)-4,4,5,5-四甲基咪唑烷-1-氧基-3-氧化物。
合成衍生物5
将 1 mmol HPN和 2 mmol 6-溴己烷溶于 25 mL无水乙腈中,加入 1 mmol碳酸钾和催化量的碘化钾,60 ℃下搅拌反应 3 h后,薄层色谱监测反应完全后,加水 25 mL, 减压除去乙腈,用二氯甲烷(每次10 mL)萃取3次,合并有机相,无水硫酸钠干燥过夜。过滤,减压除去溶剂后快速柱层析分离,浓缩干燥后得衍生物5,即2-(4′-己氧基苯基)-4,4,5,5-四甲基咪唑烷-1-氧基-3-氧化物。
傅里叶红外光谱、电子顺磁共振和高分辨质谱检测表征衍生物的结构
使用KBr压片法进行傅里叶红外光谱检测。以无水甲醇为溶剂,室温下测定衍生物1~5的电子顺磁共振谱。以甲醇为溶剂,室温下测定衍生物1~5的高分辨质谱。
HPLC检测衍生物的纯度
选用Symmetry® C 18(5.0 μm,4.6 mm× 150 mm)色谱柱进行HPLC检测。流动相为乙腈∶水(三氟乙酸)=70∶30(0.01%)(v/v),等度洗脱,柱温 25 ℃, 流速为 1 mL/min, 进样量为 10 μL, 检测波长为 280 nm。
计算油水分配系数(log P值)
采用ALOGPS 2.1软件计算得到衍生物1~5的log P值 [13] 。
常压密闭缺氧实验检测模型鼠缺氧后生存时间
参照文献 [14]进行常压密闭缺氧实验。将70只SPF级雄性BABL/c小鼠随机均分为模型对照组、HPN组、衍生物1组、衍生物2组、衍生物3组、衍生物4组、衍生物5组,每组10只,其中HPN组给予HPN 0.8 mmol/kg, 衍生物1~5组分别给予衍生物1~5 0.3 mmol/kg, 模型对照组给予等体积的等渗氯化钠溶液,给药方式均为腹腔注射。给药 30 min后,将小鼠置于 250 mL广口瓶内(含 5 g碱石灰),将瓶口密封后开始计时,以小鼠最后一次大喘气为死亡标志,记录小鼠的生存时间,计算生存时间延长率=(HPN各衍生物组生存时间-模型对照组生存时间)/模型对照组生存时间。
急性减压耐受实验检测模型鼠缺氧后存活率
参照文献 [14]进行急性减压耐受实验。分组方法及给药方法同1.7。给药 30 min后,将小鼠放入低压低氧实验舱,并以 10 m/s的速度减压,分别保持 5000 m和 8000 m的模拟海拔高度 5 min, 并继续减压至10 000 m的模拟海拔高度。记录模型鼠在10 000 m高度 1 h内的死亡数,并计算每组小鼠的死亡率。
统计学方法
采用SPSS 19.0软件进行统计分析。正态分布的计量数据用均数±标准差( ± )表示,组间比较采用单因素方差分析, P<0.05为差异有统计学意义。
结果
衍生物1~5的结构表征
衍生物1~5结构表征结果见 表1。衍生物1、2和4的红外光谱中,其分子结构中的C=O分别在1720、1730和 1768 cm –1 出峰 。3432 cm –1 为衍生物3中O–H的特征吸收峰。五个衍生物中均可以观察到N–O键的特征吸收峰 (1360 cm –1), C–N和C=N键的特征吸收峰 (1250和 1600 cm –1), C–O–C的特征吸收峰 (1185和 1020 cm –1) 和苯环1,4-取代特征峰 (830 cm –1)。 衍生物1~5的电子顺磁共振谱几乎相同,高分辨质谱的测定值与目标衍生物的理论计算值基本一致,在误差允许范围之内。
|
衍生物 |
质量(mg) |
性 状 |
产率(%) |
熔点(℃) |
红外光谱波数(cm –1) |
电子顺磁共振 |
高分辨质谱(m/s) |
|
衍生物1 |
720 |
深蓝色固体 |
93 |
57.7~59.0 |
2986、2935、1720、1606、1490、1363、1311、1300、1254、1192、1012、828 |
五重峰, g=2.0082, a=7.74 G |
理论值:C 21H 31N 2O 5{[M+H] +}392.2311;测量值:392.3171 |
|
衍生物2 |
345 |
深蓝色固体 |
95 |
166.8~168.8 |
2945、2869、1730、1604、1494、1379、1300、1260、1187、1035、838 |
五重峰, g=2.0082, a=7.74 G |
理论值:C 19H 27N 2O 5{[M+H] +}364.1998;测量值:364.2844 |
|
衍生物3 |
330 |
深蓝色固体 |
95 |
135.1~136.8 |
3432、2941、2865、1605、1481、1360、1299、1258、1186、1030、833 |
五重峰, g=2.0082, a=7.74 G |
理论值:C 19H 29N 2O 4{[M+H] +}350.2206;测量值:350.3041 |
|
衍生物4 |
320 |
深蓝色固体 |
92 |
72.7~73.6 |
2933、2852、1768、1601、1485、1390、1363、1300、1175、1100、1073、843 |
五重峰, g=2.0082, a=7.74 G |
理论值:C 19H 27N 2O 4{[M+Na] +} 370.1854;测量值:370.1863 |
|
衍生物5 |
317 |
深蓝色固体 |
95 |
68.4~69.0 |
2937、2868、1604、1531、1485、1391、1360、1253、1184、1022、837 |
五重峰, g=2.0082, a=7.74 G |
理论值:C 19H 29N 2O 3{[M+Na] +} 356.2076;测量值:356.2059 |
HPN:2-(4′-羟基苯基)-4,4,5,5-四甲基咪唑烷-1-氧基-3-氧化物 ;g:波谱分裂因子;a:超精细分裂常数. 1G=10 –4 T.
衍生物1~5的纯度
HPLC检测结果见 图2,可见衍生物1~5的纯度均大于96%,可用于后续实验。
图2 .
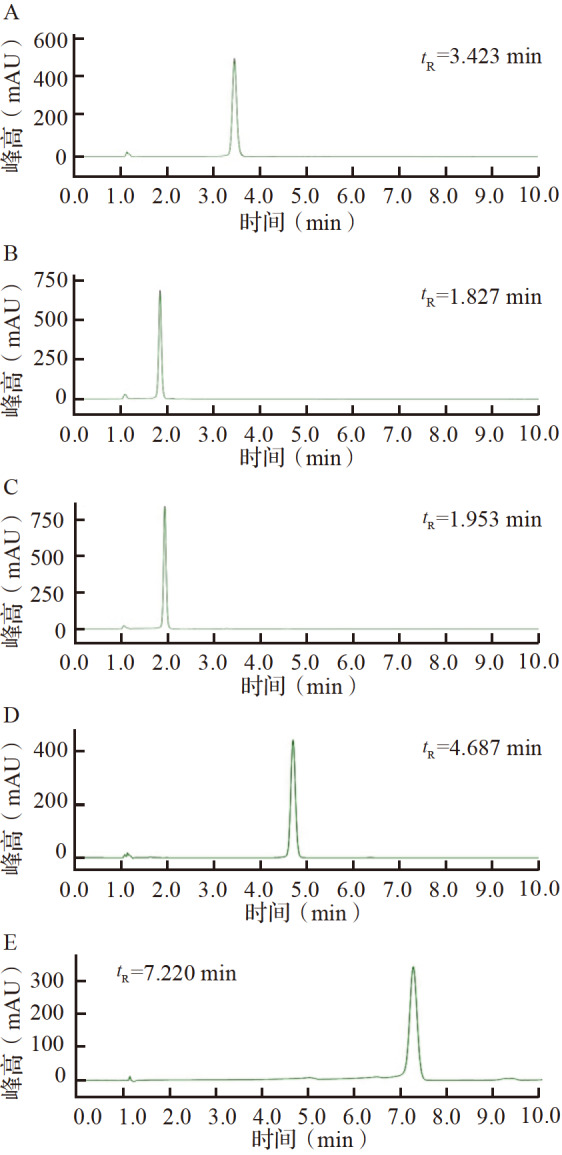
HPN衍生物1~5的高效液相色谱图谱
A:衍生物1;B:衍生物2;C:衍生物3;D:衍生物4;E:衍生物5. HPN:2-(4′-羟基苯基)-4,4,5,5-四甲基咪唑烷-1-氧基-3-氧化物; t R:保留时间.
衍生物1~5的脂溶性
HPN和衍生物1~5的log P值分别为0.97、2.78、2.00、2.04、2.88、3.10,衍生物1~5的脂溶性均较HPN增强,其中衍生物5的脂溶性最强。
衍生物1~5对常压密闭缺氧小鼠生存时间的影响
与模型对照组比较,HPN和衍生物1~5均能够显著延长常压密闭缺氧小鼠的生存时间( 表2),提示衍生物1~5在较小给药剂量 (0.3 mmol/kg)下仍然表现出类似或优于HPN的活性。
表2 HPN衍生物1~5对常压密闭缺氧小鼠生存时间的影响
Table2 Effects of HPN derivatives 1-5 on the survive time of mice under normobaric hypoxia condition
( ± )
|
组 别 |
n |
生存时间(min) |
延长率(%) |
|
模型对照组 |
10 |
36.5±3.1 |
— |
|
HPN组 |
10 |
46.1±4.8 ** |
26.5 |
|
衍生物1组 |
10 |
50.4±5.4 ** |
38.3 |
|
衍生物2组 |
10 |
47.6±4.7 ** |
30.6 |
|
衍生物3组 |
10 |
49.6±4.7 ** |
36.1 |
|
衍生物4组 |
10 |
45.7±5.1 ** |
25.3 |
|
衍生物5组 |
10 |
58.4±6.1 **# |
60.3 |
—:无相关数据. 与模型对照组比较, ** P<0.01;与HPN组比较, # P<0.05. HPN:2-(4′-羟基苯基)-4,4,5,5-四甲基咪唑烷-1-氧基-3-氧化物.
衍生物1~5对急性减压耐受小鼠死亡率的影响
急性减压时模型对照组死亡率为100%,经HPN及衍生物1~5干预后,小鼠的死亡率分别为60%、60%、70%、60%、70%、40%,与模型对照组比较差异均有统计学意义(均 P<0.05),其中衍生物5作用后的小鼠对急性减压的耐受性最佳。
讨论
氮氧自由基作为一种新型的自由基清除剂,具有广泛的生理活性。课题组前期研究表明,HPN对高原缺氧诱发的脑组织损伤具有保护作用,这种作用与清除过量自由基、缓解机体氧化应激、改善机体能量代谢、激活抗氧化通路和抑制细胞凋亡有关 [15] 。为了进一步提高其对脑组织的靶向性,增强其抗缺氧活性,本研究将脂溶性的长链引入HPN分子中。Thaler等 [16] 报道,带有亲脂性酰基链的tempol可以在生物膜中积聚,并表现出更好的神经保护作用。另外Guerrero等 [17] 证明,将羟基酪醇用C4~C10的中等长度碳链烷基化后比羟基酪醇具有更好的神经保护作用。本团队前期研究表明,在HPN结构中引入的不同碳原子的烷基链,能够增强其抗缺氧活性,当碳链为6时活性最佳 [10] 。
烷基化反应是制备衍生物1、3和5的关键步骤。HPN的酚羟基具有一定活性,能够与溴代物发生烷基化反应。通过对反应溶剂、缚酸剂和反应温度的考察,确定以乙腈为溶剂、碳酸钾为缚酸剂,60℃反应可以得到目标衍生物且产率高。制备目标衍生物2时,将HPN直接与6-溴己酸进行反应,但该反应无法进行。因此,本研究选择通过对衍生物1进行水解获得衍生物2。在氢氧化钠/甲醇/水体系中,水解反应彻底,反应结束后除去甲醇,然后酸化,产物即可析出,经过滤洗涤后得纯度较高的衍生物2。衍生物4通过HPN与己酸反应得到。在选择缩合剂时1-(3-二甲胺基丙基)-3-乙基碳二亚胺活性较高,后处理简单,但较为昂贵;二环己基碳二亚胺成本低廉,但其转化产物二环己基脲由于溶解度差很难从目标化合物中去除;而DIC成本低廉,同时后处理简单,基于以上考虑,本研究选择DIC为脱水剂,4-二甲氨基吡啶为催化剂,无水二氯甲烷为溶剂进行酯化反应,并成功获得衍生物4。
缺氧会诱导氧化应激的发生并产生大量活性氧,造成线粒体功能障碍,活性氧会破坏细胞结构,进一步导致细胞凋亡 [15] 。为考察HPN及其衍生物的抗缺氧活性,本研究采用常压密闭缺氧实验和急性减压耐受实验对衍生物1~5进行评价。结果显示,在给药剂量较小的情况下,衍生物1~5表现出不亚于HPN的抗缺氧活性。这种差异可能与其脂溶性有关,亲脂性更强的HPN衍生物能更容易通过血脑屏障,并在细胞膜上积累,从而抑制细胞内活性氧的形成和多不饱和脂肪酸的过氧化。其中log P值较大的衍生物5抗缺氧活性最佳,这与其分子结构中引入的烷基链有关。而在烷基链中引入氧等极性原子导致脂溶性有所降低,抗缺氧活性也随之降低,但衍生物1~4之间差异无统计学意义,这可能与其分子结构类似有关。
综上所述,本研究以氮氧自由基HPN为先导化合物,设计合成了5个长链脂溶性HPN衍生物,以期通过增加脂溶性,提高对脑组织的靶向作用和抗缺氧活性。结果表明,5个衍生物均能显著延长常压密闭缺氧小鼠的生存时间,显著降低急性减压耐受实验中小鼠的死亡率,表现出了明显优于HPN的抗缺氧活性,其中衍生物5的活性最佳,有望用于缺氧导致的脑损伤防护研究。下一步将通过体内和体外实验进一步明确作用机制,为将其开发成抗缺氧新药提供实验依据。
COMPETING INTERESTS
所有作者均声明不存在利益冲突
Funding Statement
国家自然科学基金(81202458); 全军医药卫生科研基金(CLZ12JA04); 中国博士后科学基金(2012M521926)
References
- 1.LAMANNA J C, CHAVEZ J C, PICHIULE P. Structural and functional adaptation to hypoxia in the rat brain[J] J Exp Biol. . 2004;207(18):3163–3169. doi: 10.1242/jeb.00976. [DOI] [PubMed] [Google Scholar]
- 2.MCGARRY T, BINIECKA M, VEALE D J, et al. Hypoxia, oxidative stress and inflammation[J] Free Radical Biol Med. . 2018;125:15–24. doi: 10.1016/j.freeradbiomed.2018.03.042. [DOI] [PubMed] [Google Scholar]
- 3.陈敬威, 杨 艺, 魏艳娜, 等. 缺氧诱导因子-1α在高原低氧脑损伤中的研究进展[J]. 解剖学杂志, 2022, 45(1): 61-65 ; CHEN Jingwei, YANG Yi, WEI Yanna, et al. Research progress of HIF-1α at hypoxic brain injury in high altitude[J]. Chinese Journal of Anatomy, 2022, 45(1): 61-65. (in Chinese)
- 4.ANGELOVA P R, ABRAMOV A Y. Functional role of mitochondrial reactive oxygen species in physiology[J] Free Radical Biol Med. . 2016;100:81–85. doi: 10.1016/j.freeradbiomed.2016.06.005. [DOI] [PubMed] [Google Scholar]
- 5.KIM R J, AN S H, GWARK J Y, et al. Antioxidant effects on hypoxia-induced oxidative stress and apoptosis in rat rotator cuff fibroblasts[J] Eur Cell Mater. . 2021;41:680–693. doi: 10.22203/eCM.v041a44. [DOI] [PubMed] [Google Scholar]
- 6.LUNEAU D. Coordination chemistry of nitronyl nitroxide radicals has memory[J]. Eur J Inorg Chem, 2020, 2020(7): 597-604
- 7.LEWANDOWSKI M, GWOZDZINSKI K. Nitroxides as antioxidants and anticancer drugs[J] Int J Mol Sci. . 2017;18(11):2490. doi: 10.3390/ijms18112490. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.邵 瑾, 杨 颖, 马慧萍, 等. 咪唑类氮氧自由基化合物的生物活性研究进展[J]. 国际药学研究杂志, 2019, 46(3): 182-187 ; SHAO Jin, YANG Ying, MA Huiping, et al. Biological activities of imidazole nitroxide radical compounds research advances[J]. Journal of International Pharmaceutical Research, 2019, 46(3): 182-187. (in Chinese)
- 9.FAN P C, MA H P, JING L, et al. The antioxidative effect of a novel free radical scavenger 4′-hydroxyl-2-substituted phenylnitronyl nitroxide in acute high-altitude hypoxia mice[J] Biol Pharmaceutical Bull. . 2013;36(6):917–924. doi: 10.1248/bpb.b12-00854. [DOI] [PubMed] [Google Scholar]
- 10.杨 颖. 氮氧自由基长链衍生物的设计合成及其对高原缺氧脑组织损伤的保护作用[D]. 兰州: 兰州大学, 2019 ; YANG Ying. Design and synthesis of nitroxide derivatives with long-chain and their protective effects on brain injury induced by high altitude hypoxia[D]. Lanzhou: Lanzhou University, 2019. (in Chinese)
- 11.中华人民共和国国务院. 医疗废物管理条例[J]. 中华人民共和国国务院公报, 2003, (21): 5-10 ; The State Council of the People’s Republic of China. Regulations on the administration of medical wastes[J]. Gazette of the State Council of the People’s Republic of China, 2003, (21): 5-10. (in Chinese)
- 12.中华人民共和国科学技术部. 关于发布《关于善待实验动物的指导性意见》的通知[EB/OL]. (2006-09-30)[2022-01-30]. https://www.most.gov.cn/xxgk/xinxifenlei/fdzdgknr/fgzc/gfxwj/gfxwj2010before/201712/t20171222_137025.html ; Ministry of Science and Technology of the People’s Republic of China. Notice on the publication of the“ Guidance on the Good Treatment of Laboratory Animals”[EB/OL]. (2006-09-30)[2022-01-30]. https://www.most.gov.cn/xxgk/xinxifenlei/fdzdgknr/fgzc/gfxwj/gfxwj2010before/201712/t20171222_137025.html. (in Chinese)
- 13.TETKO I V, BRUNEAU P. Application of ALOGPS to predict 1‐octanol/water distribution coefficients, log P, and log D, of AstraZeneca in‐house database[J] . J Pharmaceutical Sci. . 2004;93(12):3103–3110. doi: 10.1002/jps.20217. [DOI] [PubMed] [Google Scholar]
- 14.MA H P, FAN P C, JING L L, et al. Anti-hypoxic activity at simulated high altitude was isolated in petroleum ether extract of Saussurea involucrata[J] . J Ethnopharmacol. . 2011;137(3):1510–1515. doi: 10.1016/j.jep.2011.08.037. [DOI] [PubMed] [Google Scholar]
- 15.景临林, 马慧萍, 樊鹏程, 等. 氮氧自由基对高原缺氧小鼠脑组织中缺氧和凋亡蛋白的影响[J]. 中国医院药学杂志, 2015, 35(2): 1986-1990 ; JING Linlin, MA Huiping, FAN Pengcheng, et al. Effects of nitronyl nitroxide on hypoxia and apoptosis associated proteins in brain of mice under hypobaric hypoxia conditions[J]. Chinese Journal of Hospital Pharmacy, 2015, 35(2): 1986-1990. (in Chinese)
- 16.THALER S, FIEDOROWICZ M, GRIEB P, et al. Neuroprotective effects of tempol acyl esters against retinal ganglion cell death in a rat partial optic nerve crush model[J/OL] Acta Ophthalmologica. . 2011;89(7):e555–e560. doi: 10.1111/j.1755-3768.2011.02180.x. [DOI] [PubMed] [Google Scholar]
- 17.GUERRERO A, DE LA CRUZ J P, MUÑOZ-MARÍN J, et al. Neuroprotective effect of alkyl hydroxytyrosyl ethers in rat brain slices subjected to a hypoxia-reoxygenation model[J] Food Chem. . 2012;134(4):2176–2183. doi: 10.1016/j.foodchem.2012.04.022. [DOI] [PubMed] [Google Scholar]