Abstract
目的:
研究健康足月妊娠孕妇孕中晚期血高密度脂蛋白胆固醇(HDL-C)水平变化与小于胎龄儿(SGA)发生风险的关系。
方法:
应用回顾性巢式病例对照研究,纳入2017年在浙江大学医学院附属妇产科医院产检分娩的健康足月妊娠孕妇为回顾性队列,将确认分娩SGA的孕妇纳入SGA组,按新生儿性别和受孕年龄个案匹配原则以1∶4比例将确认分娩适于胎龄儿的孕妇纳入对照组,采集两组孕妇的临床资料、孕中期(孕24~27周)和孕晚期(孕37周后)HDL-C水平,计算孕晚期平均每4周HDL-C的变化(ΔHDL-C)。采用配对 t检验比较两组孕妇间HDL-C和ΔHDL-C的差异,再采用条件logistic回归模型分析ΔHDL-C与SGA发病风险的关系。
结果:
共纳入SGA组249名及对照组996名。两组足月后HDL-C水平均较孕24~27周时降低(即ΔHDL-C均小于0, P<0.05),SGA组ΔHDL-C显著高于对照组( P<0.05)。调整混杂因素后,与低水平ΔHDL-C孕妇比较,中水平、高水平ΔHDL-C孕妇分娩SGA的风险均升高( OR=1.74,95% CI:1.22~2.50; OR=2.48,95% CI:1.65~3.70,均 P<0.05)。
结论
:健康足月妊娠孕妇孕晚期HDL-C下降缓慢或不降反升与SGA的发生有关,在SGA筛查中可能具有一定的临床应用价值。
Abstract
Objective
: To explore the relationship between changes in blood high-density lipoprotein cholesterol (HDL-C) levels in advanced pregnancy and the risk of small for gestational age (SGA) in healthy full-term pregnant women.
Methods
: In this retrospective nested case-control study, pregnant women who got antenatal visits and experienced a healthy full-term delivery in Affiliated Women’s Hospital, Zhejiang University School of Medicine in 2017 were enrolled. From the cohort, 249 women delivered SGA infants with completed clinical data were set as SGA group, 996 women who delivered normal neonates were randomly selected as matched controls (1∶4). The data of baseline characteristics, the HDL-C levels in 24 th-27 th week and after 37 th week were collected, the average HDL-C changes every four weeks in the third trimester (ΔHDL-C) were calculated. Paired t test was used to compare the differences of HDL-C and ΔHDL-C between cases and controls, and a conditional logistic regression model was applied to analyze the association between ΔHDL-C and the risk of SGA.
Results
: HDL-C levels after the 37 th week in both groups were lower than those in mid-pregnancy (ΔHDL-C<0 and P<0.05 for both groups), while the ΔHDL-C levels in SGA group were significantly higher ( P<0.05). Compared with women with low ΔHDL-C, the risk of SGA was higher for women with middle and high ΔHDL-C ( OR=1.74, 95% CI:1.22–2.50; OR=2.48, 95% CI:1.65–3.70, both P<0.05).
Conclusion
: In healthy full-term pregnant women, the risk of SGA is associated with the HDL-C changing trend, HDL-C level decreasing slowly or even raising in the third trimester indicate that SGA may be likely to occur.
Keywords: Small for gestational age, Advanced pregnancy, Full-term pregnancy, High-density lipoprotein-cholesterol, Nested case-control study, Retrospective study
小于胎龄儿(small for gestational age,SGA);高密度脂蛋白胆固醇(high-density lipoprotein-cholesterol,HDL-C);低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C);体质指数(body mass index,BMI);比值比(odds ratio,OR);置信区间(confidence interval,CI);
SGA为出生体重低于相同分娩孕龄人群的第10百分位数的新生儿 [1] 。2012年,全球中低等收入国家大约有2330万表现为SGA的足月儿出生 [2] 。目前,SGA在中国的发病率约为6.39%。SGA的围产儿死亡风险是正常出生体重儿的6~9倍,围产期各种并发症的发生率高于正常人群,远期以代谢性疾病和心血管疾病为主的各种疾病发病率也显著增加,尽早进行宫内干预(如平衡的能量/蛋白质补充、药物治疗)可能可以改善SGA的预后 [ 3- 8] 。因此,SGA筛查尤为重要。SGA病因复杂,包括母体营养不良、妊娠期高血压疾病等妊娠并发症、胎儿因素以及各种可引起胎盘灌注不良的胎盘或脐带因素。目前以超声为代表的检测方式在预测SGA方面仍存在一些不足,单一的超声预测价值有限,有学者呼吁采用生长测量和生物标志物结合的预测模型 [ 9- 12] 。因此,需要寻找一种方便临床监测、同时高效廉价的检测指标以提升临床对SGA的筛查能力。
实验研究结果表明,母体胆固醇可透过胎盘参与胎儿的胆固醇代谢,而胆固醇不仅是细胞膜的重要组成部分,还是机体代谢的重要中间物质,提示母体孕期的胆固醇水平与胎儿的生长发育密切相关 [ 13- 14] 。同时,胆固醇也是临床常规检查且检验成本低廉的生化指标。通过监测母体胆固醇的改变来评估胎儿生长发育在理论上是可行的。血循环中的胆固醇主要以HDL-C和LDL-C的形式存在,其中以孕期HDL-C的水平变化与SGA间的关系最受关注 [ 4, 12, 15] 。目前研究结果显示,孕妇孕中期HDL-C水平与分娩SGA新生儿无显著相关性,而孕晚期HDL-C水平与SGA发生风险正相 关 [ 4, 15- 16] 。 但上述研究中孕晚期HDL-C测定的时间分别为30~32周、33~37周和36周,时间差异较大,且未关注HDL-C变化情况,其结论有待进一步验证。本研究通过回顾性巢式病例对照研究探索健康足月妊娠孕妇妊娠中期至晚期血HDL-C水平(常规产检结果)的变化与SGA发病的关系,探讨常规产检中血HDL-C水平预测SGA的可行性。
对象与方法
对象
收集2017年1月1日至12月31日在浙江大学医学院附属妇产科医院规范产前检查并分娩的孕妇的资料。纳入标准:①单胎活产者;②足月产者;③孕期至少测定过2次HDL-C水平者,测定时间分别在24~27周和37周后;④唐氏综合征筛查低风险且三维超声无异常发现者。排除标准:①合并甲状腺功能异常、糖尿病等代谢性疾病者;②合并乙型肝炎、梅毒等感染性疾病者;③合并妊娠高血压、胎盘早剥、妊娠肝内胆汁淤积症等妊娠期并发症者;④合并血液系统疾病者;⑤合并心脑血管疾病、肾脏疾病或其他自身免疫性疾病等者;⑥近期有手术或外伤史者;⑦孕期应用可能影响凝血、纤溶系统的药物(如阿司匹林、肝素)者;⑧有饮酒史、吸烟史或吸毒史者。
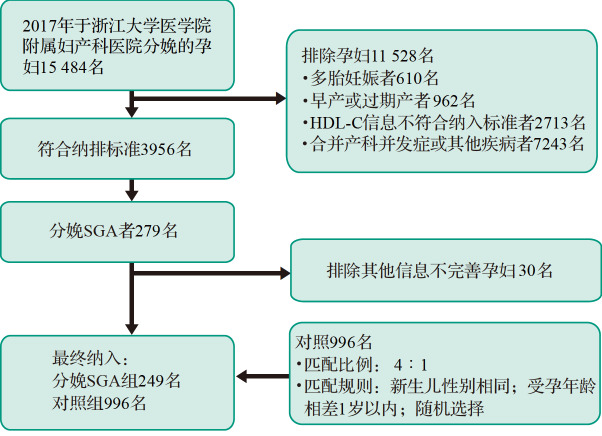
采用回顾性巢式病例对照研究方法,选择符合纳排标准的分娩SGA的孕妇作为SGA组,采用个案匹配的方式,即每一名分娩SGA的孕妇随机匹配4名新 生儿性别相同、受孕年龄相似(±1岁)的分娩适于胎龄儿的孕妇作为对照组。筛选及匹配过程见 图1, 最终共纳入249名分娩SGA的孕妇以及996名分娩适于胎龄儿的孕妇。本研究通过浙江大学医学院附属妇产科医院医学伦理委员会审查[(2019)伦审科第(054)号],因系回顾性研究,相关数据不涉及孕妇身份信息,不损害孕妇经济利益和生理健康,经伦理委员会同意后免签知情同意书。
图1 .
研究对象筛选过程及匹配条件
HDL-C:高密度脂蛋白胆固醇;SGA:小于胎龄儿.
诊断标准
SGA的具体标准参照2020年的多地区调研结果 [17] 。孕期增重参照美国医学研究院标准:孕前体重过轻(BMI <18.5 kg/m 2) 者孕期增重适宜为12.5~18.0 kg;孕前体重正常(BMI≥18.5~ 25.0 kg/m 2) 者孕期增重适宜为11.5~16.0 kg;孕前体重超重(BMI≥25.0~30.0 kg/m 2)者孕期增重适宜为7.0~11.5 kg;孕前肥胖(BMI ≥30.0 kg/m 2) 者孕期增重适宜为 5.0~9.0 kg [18] 。孕期增重低于或超过适宜量则分别为孕期增重不足及孕期增重过多。
信息采集
从医院病例数据库调取SGA组和对照组的相关信息,包括上述两次在产检时测定的HDL-C值、身高、孕前BMI、受孕季节、分娩孕龄、孕期增重情况、分娩史、流产史、居住地区、职业和学历等。
孕期HDL-C的测定及换算
孕妇于清晨空腹抽取外周静脉血约 5 mL, 1006.2 × g离心 3 min后取血清;采用全自动生化分析仪(美国雅培公司)测定血清HDL-C水平。孕中期(24~27周)测定的HDL-C用HDL-C2表示,孕晚期(37周以后)测定的HDL-C水平用HDL-C3表示。考虑到本研究人群测定HDL-C的孕周范围比较大(间隔最长达5周),单纯采用一个监测点的HDL-C数值可能会影响研究结果的准确性;同时足月后即使发现HDL-C水平异常和一定的SGA风险,因干预时机太晚而临床意义有限,遂本研究 将HDL-C3换算成孕晚期HDL-C水平的变化(ΔHDL-C):ΔHDL-C=(HDL-C3–HDL-C2)/(T3–T2)×28。式中T3指孕晚期测定HDL-C时的孕 龄(d),T2指孕中期测定HDL-C时的孕龄(d);因国内外均推荐孕24周后至少每2~4周 (14~28 d)产检一次 [ 19- 20] ,故采用ΔHDL-C代表孕晚期平均每4周的HDL-C变化可较为符合临床实际情况,也可更好地监测该指标的变化。
统计学方法
采用Stata 16.0软件对数据进行统计分析,采用Graphpad Prism 7.0做图。用Kolmogorov-Smirnov检验检测计量资料的分布情况,正态分布的计量资料以均数±标准差( )表示,组间比较采用配对 t检验。同时采用条件logistic回归分析方法,先利用单因素回归分析单一变量与SGA发病的相关性,再将单因素分析中 P<0.1的变量纳入多因素回归模型,排除自变量相关性并剔除对模型伪 R 2无明显影响的变量后,构建最终的多因素条件logistic回归模型。 P<0.05为差异有统计学意义。
结果
SGA组与对照组的一般情况比较
单因素条件logistic回归分析结果表明:两组身高、孕前BMI、孕期增重、分娩史、分娩孕周、居住地与SGA发生有关(均 P<0.05);而流产史、学历、职业及受孕季节与SGA发生无显著相关性(均 P>0.05)。见 表1。结果提示,SGA的发生可能与孕妇身高较矮、孕前体重过轻、孕期增重不足相关,且多发生于经济欠发达地区、初产妇及39~ 41周分娩者。
|
组别 |
n |
新生儿性别 |
孕妇年龄(岁) |
孕妇流产次数 |
||||||||
|
男性 |
女性 |
<25 |
25~<30 |
30~<35 |
≥35 |
0 |
≥1 |
|||||
|
SGA组 |
249 |
137(55.0) |
112(45.0) |
12(4.8) |
136(54.6) |
82(32.9) |
19(7.6) |
180(72.3) |
69(27.7) |
|||
|
对照组 |
996 |
548(55.0) |
448(45.0) |
43(4.3) |
514(51.6) |
330(33.1) |
109(10.9) |
658(66.1) |
338(33.9) |
|||
|
P值 |
— |
— |
0.051 |
|||||||||
|
组别 |
n |
孕妇身高(cm) |
孕妇孕前BMI(kg/m 2) * |
孕妇分娩史 |
||||||||
|
<155 |
155~165 |
>165 |
<18.5 |
18.5~<24 |
≥24 |
初产妇 |
经产妇 |
|||||
|
SGA组 |
249 |
23(9.2) |
209(82.7) |
20(8.0) |
74(29.7) |
167(67.1) |
8(3.2) |
215(86.3) |
34(13.7) |
|||
|
对照组 |
996 |
66(6.6) |
821(82.4) |
109(10.9) |
232(23.3) |
679(68.2) |
85(8.5) |
783(78.6) |
213(21.4) |
|||
|
P值 |
<0.01 |
<0.01 |
<0.01 |
|||||||||
|
组别 |
n |
孕妇孕期增重情况 # |
末次分娩孕周 |
孕妇学历 |
||||||||
|
增重过多 |
增重适宜 |
增重不足 |
37~<39 |
39~41 |
本科以下 |
本科 |
本科以上 |
|||||
|
SGA组 |
249 |
34(13.7) |
135(54.2) |
80(32.1) |
50(20.1) |
199(79.9) |
27(10.8) |
193(77.5) |
29(11.6) |
|||
|
对照组 |
996 |
168(28.8) |
541(54.3) |
287(16.9) |
271(27.2) |
725(72.8) |
132(13.3) |
760(76.3) |
104(10.4) |
|||
|
P值 |
<0.01 |
<0.05 |
0.535 |
|||||||||
|
组别 |
n |
孕妇居住地 |
受孕季节 |
孕妇职业 |
||||||||
|
城市 |
农村 |
冬 |
夏 |
春秋 |
职员 |
无业 |
其他 |
|||||
|
SGA组 |
249 |
193(77.5) |
56(22.5) |
90(36.1) |
58(23.3) |
101(40.6) |
191(76.7) |
14(5.6) |
44(17.7) |
|||
|
对照组 |
996 |
896(90.0) |
100(10.0) |
334(33.5) |
220(22.1) |
442(44.4) |
807(81.0) |
54(5.4) |
135(13.6) |
|||
|
P值 |
<0.01 |
0.554 |
0.242 |
SGA组与对照组血HDL-C2及ΔHDL-C比较
SGA组HDL-C2水平显著低于对照组,分别为(2.35±0.44)和(2.43±0.51)mmol/L( P<0.05),而ΔHDL-C水平显著高于对照组,分别为( –0.04±0.12)和(–0.07±0.12)mmol/L( P<0.05)。SGA组和对照组的ΔHDL-C水平均小于0( P<0.05),即孕晚期HDL-C水平较孕中期均下降。结果提示,孕 晚期HDL-C水平均下降,孕24~27周母体血低HDL-C水平以及孕晚期HDL-C下降速度较缓可能与SGA发病风险相关。
发生SGA的多因素条件logistic回归分析 结果
在构建多元回归模型时,调整混杂因素后 未见HDL-C2与SGA发病存在显著关联且加入HDL-C2这一自变量后模型伪 R 2无显著变化,遂未将HDL-C2纳入到最终的回归模型中。计算对照组孕妇ΔHDL-C水平的五分位数,根据这4个五分位数将整个研究群体的ΔHDL-C水平分为五组,以最低水平作为参照。调整混杂因素后将各组相对于参照的SGA发病 OR值及其95% CI作剂量-反应图,发现第二区间的 OR值与参照值差异较小,第三和第四区间差异较小( 图2),遂最终根据对照组孕妇ΔHDL-C水平的第2五分位数及第4五分位数将整个研究群体的ΔHDL-C水平分为低水平、中水平、高水平三组,并利用多因素条件logistic回归分析比较各组的SGA发病风险。
图2 .

基于对照组五分位数的ΔHDL-C与发生小于胎龄儿的剂量-反应关系
黑色圆点表示五分位数的各区间相对于参考区间的比值比. ΔHDL-C:孕晚期平均每4周HDL-C水平的变化. HDL-C:高密度脂蛋白胆固醇.
未调整混杂因素时,以低水平ΔHDL-C作为参照,中水平ΔHDL-C孕妇分娩SGA的风险升高( OR=1.68,95% CI:1.20~2.36),而高水平ΔHDL-C孕妇的风险则更高( OR=2.37,95% CI:1.63~3.45),具有显著的上升趋势( P<0.05)。经调整身高、孕前BMI、孕期增重、分娩史、流产史、分娩孕周、居住地等混杂因素后,之前的结果依然成立:相对于低水平ΔHDL-C孕妇,中水平和高水平ΔHDL-C孕妇分娩SGA胎儿的风险均增加( OR=1.74,95% CI:1.22~2.50; OR=2.48,95% CI:1.65~3.70),依然存在显著的上升趋势( P<0.05)。
上述结果提示,孕晚期HDL-C下降缓慢或不降反升与SGA的发生有关。
讨论
胆固醇是细胞膜的重要成分之一,也是机体代谢的重要成分(如参与孕酮合成),参与胎儿的生长发育;而胎儿体内的胆固醇主要来源于两部分,一部分为自身合成,一部分来源于母体循环 [13] 。母体循环中的胆固醇主要以HDL-C和LDL-C两种形式存在,母体HDL-C和LDL-C循环至胎盘时,依靠相关受体通过胎盘的滋养细胞层和内皮细胞层进入胎儿循环,参与胎儿生长发育 [22] 。而母体在孕期因为需要为自身及胎儿提供营养,孕期的血清总胆固醇水平随孕龄增加逐渐增高,但自接近孕晚期开始,尽管LDL-C和总胆固醇水平继续升高,HDL-C水平却逐渐下降 [ 23- 24] 。鉴于此,通过观察母体孕期胆固醇(尤其是HDL-C)的水平变化在一定程度上评估胎儿的生长发育是有依据的。而流行病学研究结果也证实孕妇HDL-C水平与SGA有关 [ 4, 12, 15- 16] 。
目前,关于孕妇血HDL-C水平与SGA发病风险之间的研究相对较少。Kramer等 [12] 研究表明,孕24~26周时母体血HDL-C水平升高与SGA的发病风险相关,但该研究选择的对照组新生儿体重处于第25~75百分位数,缩窄了适于胎龄儿的范围,且监测时间点单一(24~26周),部分结果无统计学意义(如当HDL-C处于第一至第三、四区间时,SGA发病风险并未显著增加),其关于母体血HDL-C与SGA关系的结论存在一定的局限性。随后国内Jin等 [15] 、Chen等 [4] 和Wang等 [16] 等学者在排除混杂因素后,均未发现孕妇孕中期(分别为20~21周、24~26周、24周)血HDL-C水平与SGA的相关性。而本研究亦表明孕妇孕中期(24~27周)HDL-C水平与分娩SGA新生儿无显著相关性。笔者推测Kramer等 [12] 发现的高水平HDL-C与SGA间的相关性可能源自其不同的对照组选择策略,该研究未选择第10~15和75~90百分位数出生体重的新生儿,尽管这使得对照组胎儿的体重更接近正常,但放大了SGA与适于胎龄儿间的真实差异;另外,这也可能与研究对象人种有关。
关于孕晚期HDL-C与SGA关系的研究,Jin 等 [15] 、Chen等 [4] 和Wang等 [16] 均报道了孕晚期HDL-C水平与SGA风险间的正相关性。本研究按照回顾性巢式病例对照研究设计,尽管仍然无法回避一定的回忆偏倚,但研究对象的同质性相对更好,通过匹配受孕年龄和新生儿性别减少了混杂因素对结果的干扰,并将研究人群局限于足月妊娠的健康孕妇,进一步减少了围产期的潜在干扰因素(如异常的机体状态)对结果的影响。本研究采取了不同于以往的策略探索孕晚期HDL-C水平与SGA风险间的关系:观测HDL-C水平的时间点选择了37周之后,而且结合孕24~27周的HDL水平,计算出孕晚期每4周HDL-C的平均变化, 即ΔHDL-C。该指标相对来说更能反映孕晚期 HDL-C的总体情况,也部分缓解了临床上观测到孕晚期HDL-C异常后而不能及时干预的局限性。如监测30~32周的HDL-C水平变化同样有助于预测SGA,且这更符合临床产检的频率和监测的可行性。与之前研究基本一致的是,随着孕晚期ΔHDL-C水平升高,分娩SGA的风险亦随之增大,而且从剂量-反应图可以看出SGA风险的升高趋势可能并非呈线性。此外,对照组第4五分位数的值接近0(即大多数孕妇的ΔHDL-C水平小于0),表明正常情况下大多数孕妇孕晚期HDL-C水平较孕中期是下降的,这与之前的文献报道 [ 4, 16, 23] 结果一致。结合本文资料,提示孕晚期HDL-C下降速度过缓或不降反升与SGA风险升高相关。
然而,孕晚期母体HDL-C水平或HDL-C的变化速度可影响分娩SGA风险的相关机制仍不明确。目前,研究者对胆固醇及脂蛋白在胎儿生长发育中的作用机制仍知之甚少。已有文献表明, HDL-C与SGA之间的相关性可能与胎盘功能的变化相关:孕晚期高水平的HDL-C与SGA或低出生体重风险增大显著相关 [ 4, 15- 16, 24] ,母体胆固醇可经胎盘转运至胎儿循环 [ 13, 22] ,而SGA的脐带血中HDL-C偏低 [25] ,SGA妊娠中母体循环高HDL-C、胎儿循环低HDL-C提示其胎盘营养转运功能可能出现异常,这与SGA或胎儿生长受限的发生机制是一致的;同时,胎盘上的HDL-C受体(SR-BI)的表达下降与胎儿的生长受限相关 [26] 。以上研究结果均提示,母体HDL-C的改变与SGA的相关性很可能与胎盘功能的改变有关,但更深入的机制仍有待进一步探索和验证。另外,胆固醇参与了诸多代谢及合成反应,母体胆固醇水平的异常可能会改变胎儿循环中胆固醇水平,导致胎儿的生理机能发生异常,最终引起生长发育速度改变和出生体重异常。此外,过高的HDL或被氧化的HDL可能会影响胎盘细胞的功能,从而对胚胎的生长发育造成负面影响 [27] ,这或许也是母体HDL-C水平改变与SGA发病因果链中的一环。
总之,本研究未观察到孕24~27周孕妇 HDL-C水平与SGA的独立相关性,但发现孕晚期血HDL-C水平下降速度过缓或不降反升与SGA风险增大相关,提示孕晚期母体HDL-C的变化在预测SGA方面有一定作用,可能可以成为SGA筛查的生物标志物。本研究也存在一定的局限性。首先,ΔHDL-C是两个时间点间的平均值,期间HDL-C变化速率的波动未考虑在内,今后须通过更密集地监测HDL-C的动态变化以进一步研究母体HDL-C变化速率与SGA发病风险间的关系。其次,SGA多是胎儿生长受限的结果,并不能完全等同于胎儿生长受限。目前关于胎儿生长受限的诊断比较困 难 [28] , SGA中可能存在已经达到生长潜能的健康小样儿,而对照组中也可能有一部分新生儿存在一定程度的生长受限,因此HDL-C与SGA之间的相关性并不一定能够完全反映HDL-C与胎儿生长受限的相关性。最后,本研究为回顾性研究,出现回忆导致的偏倚不可避免,相关研究结论还需要前瞻性的研究进一步证实。
COMPETING INTERESTS
所有作者均声明不存在利益冲突
Funding Statement
浙江省自然科学基金(LQ20H040005)
References
- 1.World Health Organization. International classification of diseases 11th revision[DB/OL]. (2021-05)[2021-09-19]. https://icd.who.int/browse11/l-m/en#/http%3a%2f%2fid.who.int%2ficd%2fentity%2f1786398813
- 2.VANSLAMBROUCK K, DE KOK B, TOE L C, et al. Effect of balanced energy-protein supplementation during pregnancy and lactation on birth outcomes and infant growth in rural Burkina Faso: study protocol for a randomised controlled trial[J/OL] BMJ Open. . 2021;11(3):e038393. doi: 10.1136/bmjopen-2020-038393. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.SERIZAWA K, OGAWA K, ARATA N, et al. Association between low maternal low-density lipoprotein cholesterol levels in the second trimester and delivery of small for gestational age infants at term: a case-control study of the national center for child health and development birth cohort[J] J Matern-Fetal Neonatal Med. . 2017;30(12):1383–1387. doi: 10.1080/14767058.2016.1214701. [DOI] [PubMed] [Google Scholar]
- 4.CHEN Q, CHEN H, XI F, et al. Association between maternal blood lipids levels during pregnancy and risk of small-for-gestational-age infants[J] Sci Rep. . 2020;10(1):19865. doi: 10.1038/s41598-020-76845-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.IMDAD A, BHUTTA Z A. Effect of balanced protein energy supplementation during pregnancy on birth outcomes[J] BMC Public Health. . 2011;11(Suppl 3):S17. doi: 10.1186/1471-2458-11-S3-S17. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.ROBERGE S, NICOLAIDES K, DEMERS S, et al. The role of aspirin dose on the prevention of preeclampsia and fetal growth restriction: systematic review and meta- analysis[J] Am J Obstet GynEcol. . 2017;216(2):110–120.e6. doi: 10.1016/j.ajog.2016.09.076. [DOI] [PubMed] [Google Scholar]
- 7.BETTIOL A, AVAGLIANO L, LOMBARDI N, et al. Pharmacological interventions for the prevention of fetal growth restriction: a systematic review and network meta‐ analysis[J] Clin Pharmacol Ther. . 2021;110(1):189–199. doi: 10.1002/cpt.2164. [DOI] [PubMed] [Google Scholar]
- 8.MERICQ V, MARTINEZ-AGUAYO A, UAUY R, et al. Long-term metabolic risk among children born premature or small for gestational age[J] Nat Rev Endocrinol. . 2017;13(1):50–62. doi: 10.1038/nrendo.2016.127. [DOI] [PubMed] [Google Scholar]
- 9.CIOBANU A, ROUVALI A, SYNGELAKI A, et al. Prediction of small for gestational age neonates: screening by maternal factors, fetal biometry, and biomarkers at 35–37 weeks’ gestation[J] Am J Obstet Gynecol. . 2019;220(5):486.e1–486.e11. doi: 10.1016/j.ajog.2019.01.227. [DOI] [PubMed] [Google Scholar]
- 10.POLJAK B, AGARWAL U, JACKSON R, et al. Diagnostic accuracy of individual antenatal tools for prediction of small-for-gestational age at birth[J] Ultrasound Obstet Gynecol. . 2017;49(4):493–499. doi: 10.1002/uog.17211. [DOI] [PubMed] [Google Scholar]
- 11.MCCARTHY F, DOYLE A, KHASHAN A, et al. Assessment of glycogen phosphorylase isoenzyme BB as a biomarker for pre-eclampsia and small for gestational age[J] Lancet. . 2015;385(Suppl 1):S67. doi: 10.1016/S0140-6736(15)60382-8. [DOI] [PubMed] [Google Scholar]
- 12.KRAMER M S, KAHN S R, DAHHOU M, et al. Maternal lipids and small for gestational age birth at term[J] J Pediatr. . 2013;163(4):983–988. doi: 10.1016/j.jpeds.2013.05.014. [DOI] [PubMed] [Google Scholar]
- 13.KALLOL S, ALBRECHT C. Materno-fetal cholesterol transport during pregnancy[J] Biochem Soc Trans. . 2020;48(3):775–786. doi: 10.1042/BST20190129. [DOI] [PubMed] [Google Scholar]
- 14.MCCONIHAY J A, HONKOMP A M, GRANHOLM N A, et al. Maternal high density lipoproteins affect fetal mass and extra-embryonic fetal tissue sterol metabolism in the mouse[J] J Lipid Res. . 2000;41(3):424–432. doi: 10.1016/S0022-2275(20)34481-3. [DOI] [PubMed] [Google Scholar]
- 15.JIN W, LIN S, HOU R, et al. Associations between maternal lipid profile and pregnancy complications and perinatal outcomes: a population-based study from China[J] BMC Pregnancy Childbirth. . 2016;16:60. doi: 10.1186/s12884-020-2834-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.WANG H, DANG Q, ZHU H, et al. Associations between maternal serum HDL-C concentrations during pregnancy and neonatal birth weight: a population-based cohort study[J] Lipids Health Dis. . 2020;19(1):93. doi: 10.1186/s12944-020-01264-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.首都儿科研究所, 九市儿童体格发育调查协作组. 中国不同出生胎龄新生儿出生体重、身长和头围的生长参照标准及曲线[J]. 中华儿科杂志, 2020, 58(9): 738-746 ; Capital Institute of Pediatrics, Collaborative Group on Child Physical Development Research in Nine Cities. Growth standard curves of birth weight, length and head circumference of Chinese newborns of different gestation[J]. Chinese Journal of Pediatrics, 2020, 58(9): 738-746. (in Chinese) . [DOI] [PubMed]
- 18.Institute of Medicine. Weight gain during pregnancy: reexamining the guidelines[M]. Washington (DC): National Academies Press, 2009: 254-256 . [PubMed]
- 19.中华医学会妇产科学分会产科学组. 孕前和孕期保健指南(2018)[J]. 中华妇产科杂志, 2018, 53(1): 7-13 ; Obstetrics and Gynecology Committee of the Chinese Medical Association. Preconception and prenatal care Guidelines (2018 edition) [J]. Chinese Journal of Obstetrics and Gynecology, 2018, 53(1): 7-13. (in Chinese)
- 20.Cunningham F G, Leveno K, Bloom S, et al. Williams Obstetrics[M]. 21st ed. New York: McGraw-Hill Education, 2018:164-165.
- 21.中华人民共和国国家卫生和计划生育委员会. WS/T 428-2013 成人体重判定[S/OL]. (2013-04-18)[2022-03-20]. http://www.nhc.gov.cn/ewebeditor/uploadfile/2013/08/20130808135715967.pdf ; National Health and Family Planning Commission of the People’s Republic of China. WS/T 428-2013 criteria of weight for adults.[S/OL]. (2013-04-18)[2022-03-20]. http://www.nhc.gov.cn/ewebeditor/uploadfile/2013/08/20130808135715967.pdf. (in Chinese)
- 22.CANTIN C, FUENZALIDA B, LEIVA A. Maternal hypercholesterolemia during pregnancy: potential modulation of cholesterol transport through the human placenta and lipoprotein profile in maternal and neonatal circulation[J] Placenta. . 2020;94:26–33. doi: 10.1016/j.placenta.2020.03.007. [DOI] [PubMed] [Google Scholar]
- 23.MISRA V K, TRUDEAU S, PERNI U. Maternal serum lipids during pregnancy and infant birth weight: the influence of prepregnancy BMI[J] Obesity. . 2011;19(7):1476–1481. doi: 10.1038/oby.2011.43. [DOI] [PubMed] [Google Scholar]
- 24.FARIAS D R, POSTON L, FRANCO-SENA A B, et al. Maternal lipids and leptin concentrations are associated with large-for-gestational-age births: a prospective cohort study[J] Sci Rep. . 2017;7(1):804. doi: 10.1038/s41598-017-00941-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.KWITEROVICH P O, COCKRILL S L, VIRGIL D G, et al. A large high-density lipoprotein enriched in apolipoprotein C- I[J] JAMA. . 2005;293(15):1891. doi: 10.1001/jama.293.15.1891. [DOI] [PubMed] [Google Scholar]
- 26.WADSACK C, TABANO S, MAIER A, et al. Intrauterine growth restriction is associated with alterations in placental lipoprotein receptors and maternal lipoprotein composition[J/OL] Am J Physiol-Endocrinol Metab. . 2007;292(2):E476–E484. doi: 10.1152/ajpendo.00547.2005. [DOI] [PubMed] [Google Scholar]
- 27.WANG H L, LIANG N, HUANG D X, et al. The effects of high-density lipoprotein and oxidized high-density lipoprotein on forskolin-induced syncytialization of BeWo cells[J] Placenta. . 2021;103:199–205. doi: 10.1016/j.placenta.2020.10.024. [DOI] [PubMed] [Google Scholar]
- 28.中华医学会围产医学分会胎儿医学学组, 中华医学会妇产科学分会产科学组. 胎儿生长受限专家共识(2019版)[J]. 中华围产医学杂志, 2019, 22(6): 361-380 ; Fetal Medicine Group, Perinatal Medicine Committee, Chinese Medical Association; Obstetrics and Gynecology Section, Chinese Medical Association. Expert consensus on fetal growth restriction (2019 edition) [J]. Chinese Journal of Perinatal Medicine, 2019, 22(6): 361-380. (in Chinese)