Abstract
目的
探索未定带区(ZI)γ-氨基丁酸(GABA)能神经元对七氟醚和丙泊酚麻醉-觉醒的调控作用。
方法
将48只雄性C57BL/6J小鼠分为8组(6只/组)。研究七氟醚麻醉时,化学遗传学实验分为hM3Dq组(注射携带hM3Dq的腺相关病毒)和mCherry组(注射仅携带mCherry的对照病毒);光遗传学实验分为ChR2组(注射携带ChR2的腺相关病毒)和GFP组(注射仅携带GFP的对照病毒),注射剂量均为100 nL。研究丙泊酚麻醉时,化学遗传学实验分为hM3Dq组和mCherry组;光遗传学实验分为ChR2组和GFP组。上述各组处理方法同七氟醚。通过化学遗传学和光遗传学技术激活ZI区GABA能神经元,观察其对七氟醚和丙泊酚的麻醉诱导及觉醒的调节作用,通过脑电监测观察其在七氟醚麻醉维持中的作用。
结果
在七氟醚麻醉中,与mCherry组比,hM3Dq组麻醉诱导时间显著缩短(P<0.05),与GFP组比,ChR2组麻醉诱导时间显著缩短(P<0.01),而两实验中麻醉觉醒时间差异均无统计学意义。在丙泊酚麻醉中,hM3Dq组比mCherry组麻醉诱导时间显著缩短(P<0.05),ChR2组比GFP组麻醉诱导时间显著缩短(P<0.01),而两实验中麻醉觉醒时间差异均无统计学意义。光遗传激活ZI区GABA能神经元没有改变七氟醚麻醉维持时的脑电频谱。
结论
ZI区GABA能神经元能够促进七氟醚和丙泊酚的麻醉诱导,而对麻醉维持及觉醒无调节作用。
Keywords: 七氟醚, 丙泊酚, 丘脑未定带, γ-氨基丁酸, GABA能神经元
Abstract
Objective
To explore the regulatory effects of GABAergic neurons in the zona incerta (ZI) on sevoflurane and propofol anesthesia.
Methods
Forty-eight male C57BL/6J mice divided into 8 groups (n=6) were used in this study. In the study of sevoflurane anesthesia, chemogenetic experiment was performed in 2 groups of mice with injection of either adeno-associated virus carrying hM3Dq (hM3Dq group) or a virus carrying only mCherry (mCherry group). The optogenetic experiment was performed in another two groups of mice injected with an adeno-associated virus carrying ChR2 (ChR2 group) or GFP only (GFP group). The same experiments were also performed in mice for studying propofol anesthesia. Chemogenetics or optogenetics were used to induce the activation of GABAergic neurons in the ZI, and their regulatory effects on anesthesia induction and arousal with sevoflurane and propofol were observed; EEG monitoring was used to observe the changes in sevoflurane anesthesia maintenance after activation of the GABAergic neurons.
Results
In sevoflurane anesthesia, the induction time of anesthesia was significantly shorter in hM3Dq group than in mCherry group (P < 0.05), and also shorter in ChR2 group than in GFP group (P < 0.01), but no significant difference was found in the awakening time between the two groups in either chemogenetic or optogenetic tests. Similar results were observed in chemogenetic and optogenetic experiments with propofol (P < 0.05 or 0.01). Photogenetic activation of the GABAergic neurons in the ZI did not cause significant changes in EEG spectrum during sevoflurane anesthesia maintenance.
Conclusion
Activation of the GABAergic neurons in the ZI promotes anesthesia induction of sevoflurane and propofol but does not affect anesthesia maintenance or awakening.
Keywords: sevoflurane, propofol, zone incerta, gamma-aminobutyric acid, GABAergic neurons
全身麻醉应用于外科手术已有近180年的历史,关于全麻药物相关分子机制的研究已有诸多进展,然而我们对麻醉药物如何导致意识丧失的神经生物机制还知之甚少[1]。关于全麻机制的研究对麻醉领域及神经科学意识研究都至关重要,神经环路研究发现,中枢神经系统内多种神经递质系统以及多个核团之间形成的错综复杂的神经网络,参与调节麻醉-觉醒意识状态的转换[2]。因此,神经环路研究成为解析全身麻醉机制的关键。
有研究报道,蓝斑核、中脑腹侧被盖区、腹外侧视前区、中缝背核等参与麻醉-觉醒的调控[3-6]。丘脑未定带(ZI)是位于丘脑网状核旁的丘脑下核团,富集γ-氨基丁酸(GABA)能神经元,与诸多大脑区域形成相互连接,并参与调控意识、睡眠、注意力等功能[7-9],但其是否参与麻醉-觉醒的调控尚不清楚。
丙泊酚和七氟醚作为临床中常用的静脉麻醉药和吸入麻醉药,其作用机制不完全相同,有研究证实七氟醚、丙泊酚能够诱导连续的α震荡和慢波震荡,可能提示其具有共同的分子和神经环路机制诱导无意识状态[10, 11],两种麻醉药物是否通过相同的神经环路机制发挥麻醉效应有待研究,揭示不同麻醉药物通过脑区核团发挥的共同效应将对理解麻醉诱导意识消失的机制有重要意义。
本研究通过利用特异性转基因病毒转染,结合化学遗传学及光遗传学的方法选择性的激活ZI区GABA能神经元,验证其在七氟醚及丙泊酚麻醉-觉醒中的作用,同时记录脑电(EEG)信号,从而证实ZI区GABA能神经元可能是介导这两种药物促进全麻意识消失的关键核团。
1. 材料和方法
1.1. 实验动物
雄性C57BL/6J小鼠(8~10)周龄,20~23 g,购于解放军总医院实验动物中心。饲养在解放军总医院第一医学中心麻醉科实验动物室,室温22±2 ℃,12/12 h明暗循环,自由进食水。行为学测试在北京时间09∶00~18∶00之间进行。所有实验程序和操作都符合《实验动物和动物实验管理条例》。注射病毒后的4~6周内进行翻正反射和EEG监测。实验方案得到了动物实验伦理委员会的批准(SQ 2021139),并根据本研究所的动物实验指南进行。
1.2. 实验动物分组
将48只雄性小鼠用随机数字表法随机分为8组。七氟醚、丙泊酚两种不同麻醉药物研究各分4组,利用立体定位技术进行小鼠ZI脑区不同病毒注射造模。研究七氟醚麻醉时,化学遗传学实验分为2组,实验组(hM3Dq组,n=6)注射携带hM3Dq基因片段的腺相关病毒,对照组(mCherry组,n=6)注射仅携带mCherry基因片段的对照病毒。光遗传学实验分为两组,实验组(ChR2组,n=6)注射携带ChR2基因片段的腺相关病毒,对照组(GFP组,n=6)注射仅携带GFP基因片段的对照病毒。研究丙泊酚麻醉时分组方式同上,化学遗传学实验分为2组,实验组(hM3Dq组,n=6)注射携带hM3Dq基因片段的腺相关病毒,对照组(mCherry组,n=6)注射仅携带mCherry基因片段的对照病毒。光遗传学实验分为两组,实验组(ChR2组,n=6)注射携带ChR2基因片段的腺相关病毒,对照组(GFP组,n=6)注射仅携带GFP基因片段的对照病毒。
1.3. 立体定位手术
应用2%戊巴比妥钠(40 mg/kg~50 mg/kg)腹腔注射麻醉和1%罗哌卡因头部局部麻醉后,将小鼠头部固定于立体定位仪(RWD,深圳)中,使用恒温毯将体温维持在35~36 ℃。使用微注射泵(Harvard Apparatus)及10 μL微注射器将病毒以30 nL/min的速度注射至目的核团。总注射量为100 nL。注射完成后,静置10 min后取出注射针。然后将3个脑电电极植入颅骨,随后将直径200 µm的陶瓷插芯光纤放置到注射光遗传学病毒的目标脑区上方100 µm。完成所有步骤后,将稀释的牙科水泥缓慢涂抹在颅骨表面,以固定脑电电极和光纤。微注射坐标为:ZI,AP-1.75,ML+1.0,DV-4.4;三个脑电电极坐标分别为AP+1.0 mm,ML-2.0 mm;Ap-4.0,ML-2.5 mm;AP -4.0 mm,ML+2.5 mm。
1.4. 麻醉诱导与觉醒时间计算
翻正反射圆桶通过桶上方中间的圆孔与麻醉气体监测仪连接(氧气流量:2 L/min,氧气浓度:40%)。首先让小鼠在翻正反射桶中自由活动15min,然后给予2.0%七氟醚吸入麻醉或2%丙泊酚(100 mg/kg)腹腔注射麻醉。评估翻正反射,麻醉开始后每15 s将桶旋转180度。如果小鼠处于异常姿势(四肢向上),不能主动恢复到正常姿势,则认为翻正反射消失(LORR),该时间定义为麻醉诱导时间。LORR后七氟醚麻醉继续吸入七氟醚维持麻醉,30 min后关闭挥发罐维持氧浓度,并监测翻正反射。如果小鼠自动恢复正常姿势(四肢触地),则认为恢复了翻正反射。从麻醉终止到恢复翻正反射(RORR)的时间定义为麻醉苏醒时间。丙泊酚麻醉则诱导后持续吸入40%氧气观察至其觉醒,从LORR到RORR时间定义为麻醉苏醒时间。
1.5. 脑电监测记录
翻正反射实验结束后5 d,将小鼠置入桶内连接脑电电极至监测仪,应用信号放大系统(AD)和LabChart软件(Analog Devices)监测脑电活动。以250 Hz的采样率采集EEG信号,小鼠自由活动15 min后开始1.5%七氟醚吸入麻醉,稳定20 min后给予光刺激,持续2 min(图 1),麻醉总时长为30 min。使用MatLab(R2014a, MathWorks)进行分析。消除任何带有伪影的数据,过滤掉50 Hz的交流干扰,提取0.3 Hz~50 Hz的数据进行分析。计算0.3 Hz~50 Hz范围内的功率谱密度,分别分析两组小鼠光刺激时与光刺激前后δ(0.3 Hz~4 Hz)、θ(4 Hz~10 Hz)、α(10 Hz~15 Hz)、β(15 Hz~25 Hz)和γ(25 Hz~50 Hz)这5个频段在总功率谱中各占的百分比。
图 1.

脑电监测方法示意图
Schematic diagram of the timeline of EEG monitoring in mice with optogenetic activation of the GABAergic neurons of ZI receiving 1.5% sevoflurane anesthesia
1.6. 化学遗传学技术
研究七氟醚麻醉时,实验组(hM3Dq组,n=6)将腺相关病毒(rAAV2/9-EF1a-GAD67-hM3Dq-mCherry-WPRE-pA)注射到ZI区(图 2A),以表达hM3Dq受体,从而能够选择性的激活ZI区GAGA能神经元。对照组(mCherry组,n=6)注射空白病毒(rAAV2/9-EF1a-GAD67-mCherry-WPRE-pA)。经过4周的转染与表达,腹腔注射1 mg/mL CNO(1 mg/kg)45 min后将小鼠置于圆桶中适应环境(图 2B),15 min后应用2%七氟醚麻醉小鼠,记录LORR与RORR时间。
图 2.
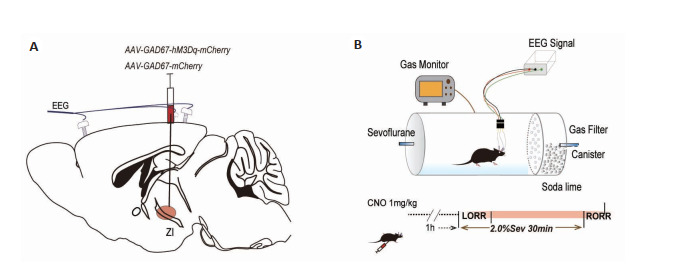
研究七氟醚麻醉时,化学遗传学方法示意图
Schematic diagram of chemogenetic methods for studying sevoflurane anesthesia. A: Virus injection in the ZI. B: Righting reflex detection in the anesthesia barrel (upper) and detection of anesthesia induction and emergence time through chemogenetic activation of the ZI in 2.0% sevoflurane anesthesia (lower).
研究丙泊酚麻醉时,实验组(hM3Dq组,n=6)将腺相关病毒(rAAV2/9-EF1a-GAD67-hM3Dq-mCherry-WPRE-pA)注射到ZI区(图 3A),可以选择性激活ZI区GABA能神经元。对照组(mCherry组,n=6)注射空白病毒(rAAV2/9-EF1a-GAD67-mCherry-WPRE-pA)。腹腔注射1 mg/mL CNO(1 mg/kg),45 min后将小鼠置于桶中适应环境(图 3B),15 min后应用2%丙泊酚(100 mg/kg)腹腔注射麻醉小鼠,记录LORR与RORR时间。
图 3.

研究丙泊酚麻醉时,化学遗传学方法示意图
Schematic diagram of chemogenetic methods for studying propofol anesthesia. A: Virus injection in the ZI. B: Righting reflex detection in the anesthesia barrel (upper) and detection of anesthesia induction and emergence time through chemogenetic activation of the ZI in 2.0% propofol ip anesthesia (lower).
1.7. 光遗传学技术
研究七氟醚麻醉时,实验组(CHR2组,n=6)将腺相关病毒(rAAV2/9-EF1a-GAD67-ChR2-GFP-WPRE-pA)注入ZI区,陶瓷插芯插入病毒注射区上方100 µm(图 4A)。对照组(GFP组,n=6)注射空白病毒(rAAV2/9-EF1a-GAD67-GFP-WPRE-pA)。小鼠在光遗传病毒转染和表达4周后进行检测。在光刺激之前,小鼠在桶内自由活动适应桶内环境,15 min后开始2%七氟醚麻醉,同时应用473-nm蓝色激光刺激(5 mW、20 Hz、持续时间20 ms、1s-on/1s-off周期)并记录麻醉诱导时间。5 d后,我们对小鼠进行麻醉苏醒时间测定,在吸入2%七氟醚麻醉30min后关闭挥发罐,同时进行光刺激以记录麻醉苏醒时间(图 4B)。
图 4.

研究七氟醚麻醉时,光遗传学方法示意图
Schematic diagram of optogenetic experiment for studying sevoflurane anesthesia. A: Virus injection in the ZI. B: Righting reflex detection in the anesthesia barrel (upper) and detection of anesthesia induction and emergence time through optogenetic activation the GABAergic neurons of ZI in 2.0% sevoflurane anesthesia (lower).
研究丙泊酚麻醉时,实验组(ChR2组,n=6)将腺相关病毒注入ZI区,陶瓷插芯插入病毒注射区上方100 µm(图 5A)。对照组(CON组,n=6)注射空白病毒(rAAV2/9-EF1a-GAD67-GFP-WPRE-pA)。经过4周的转染与表达,将小鼠置于桶中适应环境,15 min后开始2%丙泊酚(100 mg/kg)腹腔注射麻醉小鼠,同时应用473-nm蓝色激光刺激(5 mW、20 Hz、持续时间20 ms、1s-on/1s-off周期)。并记录麻醉诱导时间,LORR后则持续行光刺激(5 mW、20 Hz、持续时间20 ms、5s-on/25s-off周期)并记录麻醉苏醒时间(图 5B)。
图 5.

研究丙泊酚麻醉时,光遗传学方法示意图
Schematic diagram of optogenetic experiment for studying propofol anesthesia. A: Virus injection in the ZI. B: Righting reflex detection in the anesthesia barrel (upper) and detection of anesthesia induction and emergence time through optogenetic activation of the ZI in 2.0% propofol ip anesthesia (lower).
1.8. 免疫荧光染色
应用1×PBS将脑切片连续清洗3次(5 min/次)以去除OCT,应用BSA室温孵育30 min,然后应用稀释后的一抗GABA antibody(1:500,GeneTex, GTX125988, Rabbit)、Anti-c-fos antibody(1:1000,Abcam, ab208942, mouse)4 ℃孵育过夜,应用1×PBS清洗一抗(连续3次,5 min/次)。添加二抗(1∶200;Alexa Fluor488标记山羊抗小鼠lgG、Alexa Fluor 488标记山羊抗兔IgG、Cy3标记驴抗小鼠IgG、Cy3标记驴抗兔IgG(武汉塞维尔生物科技有限公司1),在室温下避光孵育2 h。之后再次应用1×PBS清洗。应用DAPI覆盖载玻片,15 min后,在荧光显微镜上拍摄图片(DP73, Olympus, Japan)。进行显微镜分析的实验人员对分组情况实施盲法。
1.9. 统计分析
统计分析绘图软件GraphPad采用Prism 7.0对行为学结果和免疫荧光计数进行分析。各组间比较采用单因素方差分析Bonferroni's方差分析和多重比较检验。两组间比较应用t检验。数据用均数±标准差表示,P<0.05为差异具有统计学意义。
2. 结果
2.1. 化学遗传学激活ZI区GABA能神经元能够促进七氟醚的麻醉诱导时间
腹腔注射CNO后2 h断头取脑,进行免疫荧光染色,结果显示,与mCherry组比hM3Dq组ZI区c-fos表达显著增加(P<0.0001,图 6A右)。免疫荧光染色显示病毒在ZI区成功转染(图 6B)。与mCherry组比hM3Dq组麻醉诱导时间显著缩短(P<0.05,图 6C左),麻醉觉醒时间差异无统计学意义(P>0.05,图 6C右)。
图 6.

通过化学遗传学方法激活ZI区GABA能神经元促进七氟醚麻醉诱导
Chemogenetic activation of ZI GABAergic neurons accelerates sevoflurane anesthesia induction. A: Left, Co-labelled immunofluorescence of virus autofluorescence (mCherry, red) and c-fos (green); right, the propotion of GABAergic neurons co-expressing c-fos/mCherry in the hM3Dq group is significantly higher. ****P < 0.0001 vs CON group. B: Expression of chemogenetic virus (mCherry, red) in the GABAergic neurons (green). C: Left, anesthesia induction time is shorter in the hM3Dq group. *P < 0.05 vs mCherry group; right, anesthesia emergence time is not significantly different between the two groups.
2.2. 光遗传学激活ZI区GABA能神经元能够促进七氟醚的麻醉诱导效应,但对麻醉维持没有显著影响
所有行为学实验结束后断头取脑,进行免疫荧光染色。结果显示,与GFP组比ChR2组ZI区c-fos表达显著增加(P<0.001,图 7A右),表明ChR2组GABA能神经元能够被显著激活。免疫荧光染色显示病毒在ZI区转染成功(图 7B)。与GFP组比ChR2组七氟醚麻醉诱导时间显著缩短(P<0.01,图 7C左),麻醉觉醒时间无统计学差异(P>0.05,图 7C右)。无论是ChR2组还是GFP组各个频段在光刺激前后均没有显著变化(图 8),说明调控ZI区GABA能神经元活性对七氟醚麻醉期间的脑电变化没有显著影响。
图 7.

通过光遗传学方法激活ZI区GABA能神经元促进七氟醚麻醉诱导
Optogenetic activation of ZI GABAergic neurons accelerates sevoflurane anesthesia induction. A: Left, co-labelled immunofluorescence of virus autofluorescence (GFP, green) and c-fos (red) right, the propotion of GABAergic neurons co-expressing c-fos/GFP in the CHR2 group is significantly higher. ***P < 0.001 vs CON group. B: Expression of optogenetic virus (GFP, green) in the GABAergic neurons (red). C: Left, anesthesia induction time is shorter in CHR2 group. **P < 0.01 vs GFP group; right, anesthesia emergence time show no significant difference between the two groups.
图 8.
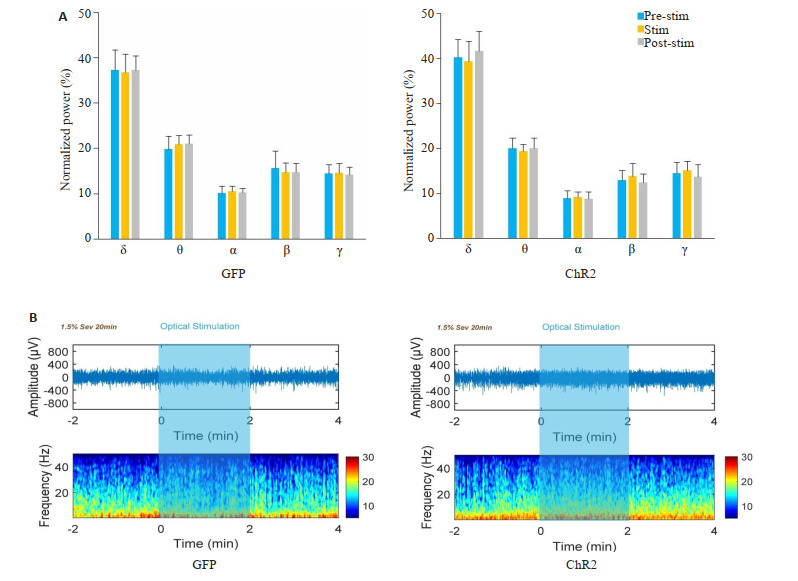
光遗传激活ZI区GABA能神经元对七氟醚麻醉维持没有显著影响
Optogenetic activation of the ZI GABAergic neurons has no significant effect on sevoflurane anesthesia maintenance. A: The percentages of power in all bands show no significant changes in either GFP group or CHR2 group. B: Representative EEG spectra for GPF group and CHR2 group.
2.3. 化学遗传学激活ZI区GABA能神经元能够促进丙泊酚的麻醉诱导效应
与mCherry组比,hM3Dq组麻醉诱导时间显著缩短(P<0.05,图 9左),麻醉觉醒时间无统计学差异(P>0.05,图 9右)。
图 9.

通过化学遗传学方法激活ZI区GABA能神经元促进丙泊酚麻醉诱导
Chemogenetic activation of ZI GABAergic neurons accelerates propofol anesthesia induction. Left, anesthesia induction time is shorter inhM3Dq group. *P < 0.05 vs mCherry group; right, anesthesia emergence time shows no significant difference between the two groups.
2.4. 光遗传学激活ZI区GABA能神经元能够缩短丙泊酚的诱导时间
ChR2组小鼠经过光遗传激活后,丙泊酚麻醉诱导时间显著缩短(P<0.01,图 10A),麻醉觉醒时间差异无统计学意义(P>0.05,图 10B)。
图 10.

通过光遗传学方法激活ZI区GABA能神经元促进丙泊酚麻醉诱导
Optical activation of ZI GABAergic neurons accelerates propofol anesthesia induction. Left: Anesthesia induction time is shorter in CHR2 group. **P < 0.01 vs GFP group; Right: Anesthesia emergence time shows no significant difference between the two groups.
3. 讨论
GABA受体是全身麻醉药物的重要靶点[1],探究大脑GABA能神经元参与麻醉觉醒的作用,对意识形成与恢复机制研究具有重大的意义。在本研究中,我们验证了激活ZI区GABA能神经元不仅能够促进七氟醚麻醉的诱导,而且能够促进丙泊酚麻醉的诱导过程,然而调控ZI区GABA能神经元活性并不影响七氟醚和丙泊酚麻醉后的觉醒过程。在七氟醚麻醉维持期,光刺激ZI区GABA能神经元前后,脑电频谱比例无明显变化。这些证据表明ZI区GABA能神经元对七氟醚/丙泊酚的麻醉诱导起到了重要的调控作用。
ZI位于丘脑下区域,是主要包含GABA能神经元的抑制性核团,研究表明ZI参与调控内脏活动、意识以及姿势和运动[12-14]。既往有研究认为ZI参与睡眠觉醒过程,在解剖结构上,ZI对基底前脑、大脑皮层等调控睡眠觉醒区域有投射[15]。另一种观点认为ZI能接受大量的包括听觉在内的感觉信息,通过将感觉信息整合后投向更高阶的核团,如丘脑背侧核以及板内核[16]。最近有研究报道ZI区Lhx6阳性的GABA能神经元能促进觉醒向睡眠的转换[8],与ZI有丰富神经纤维联系的丘脑也被证实在麻醉-觉醒之间的转化起重要的调控作用[17-19]。我们的研究证实ZI区GABA能神经元在麻醉诱导过程中起重要的促进作用。
GABA是脑内重要的抑制性神经递质,然而不同核团抑制性GABA能神经元在吸入麻醉中可以发挥截然不同的作用,激活吻内侧核GABA神经元能够促进七氟醚麻醉[20],在异氟醚麻醉中,下丘脑外侧GABA能神经元通过投射到丘脑网状核对麻醉后觉醒起重要作用[21]。同样,侧间隔GABA能神经元参与清醒控制,促进异氟醚麻醉后的觉醒[22]。研究表明,在丙泊酚麻醉中,下丘脑腹外侧视前区GABA能神经元通过投射到如结节乳头状核、腹外侧中脑导水管周围灰质,对麻醉及觉醒起重要的调节作用[23]。这些研究表明,不同核团的抑制性GABA神经元在麻醉中发挥不同的作用。我们的研究继续丰富了大脑核团抑制性GABA能神经元在麻醉诱导中的作用。
麻醉的诱导与觉醒可能是由不同的神经核团与通路介导的,而不是单纯的镜像作用[24],麻醉的诱导、维持、觉醒三个主要过程中,不同核团参与的过程也不尽相同[25-27]。研究神经核团参与麻醉不同阶段的差异为研究大脑意识状态调节提供重要的依据。本研究中,ZI区GABA能神经元只参与两种不同麻醉药物的诱导而不参与觉醒的恢复,对临床中麻醉药作用机制及晕厥猝倒等机制的研究具有重要意义。
有研究证实γ-氨基丁酸A型受体(GABAAR)是大多数现代静脉麻醉药物的主要受体,如丙泊酚和依托咪酯,七氟醚和地氟醚亦可通过作用于GABAAR发挥麻醉作用[28]。七氟醚和丙泊酚具有共同的分子和系统水平机制诱导麻醉后的无意识状态[10, 11]。本研究发现,增强ZI区的GABA能神经元活性可促进丙泊酚和七氟醚的麻醉诱导作用,进一步验证了两种药物发挥作用具有共同的受体机制。七氟醚与丙泊酚是否通过其他共同的神经通路进行麻醉与觉醒调节需要进一步证实。
ZI位于丘脑下区域,与大脑的不同区域具有往返神经联系,ZI背侧区GABA能神经元可投射至皮层和丘脑,ZI腹侧区GABA能神经元能够投射至基底前脑和脑干[29]。本研究重点关注ZI区GABA能神经元胞体在全麻机制中的调控作用,在未来研究中会进一步探索ZI区GABA能神经元内部微环路,以及其上下游核团在睡眠及全麻机制中的作用,有利于探究GABA作为抑制性神经递质在意识消失中的作用。
Biographies
曹福羊,在读博士研究生,主治医师,E-mail: caofuyang840723@163.com
郭永馨,在读博士研究生,主治医师,Email: gyxinbin@163.com
Funding Statement
国家自然科学基金(82001453,81800058);国家重点研发计划(2018YFC2001901)
Supported by National Natural Science Foundation of China (82001453, 81800058)
Contributor Information
曹 福羊 (Fuyang CAO), Email: caofuyang840723@163.com.
郭 永馨 (Yongxin GUO), Email: gyxinbin@163.com.
仝 黎 (Li TONG), Email: tongli301@aliyun.com.
米 卫东 (Weidong MI), Email: wwdd1962@163.com.
References
- 1.Hugh C, Hemmings, Jr, et al. Towards a comprehensive understanding of anesthetic mechanisms of action: a decade of discovery. Trends Pharmacol Sci. 2019;40(7):464–81. doi: 10.1016/j.tips.2019.05.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Yang QZ, Zhou F, Li A, et al. Neural substrates for the regulation of sleep and general anesthesia. Curr Neuropharmacol. 2022;20(1):72–84. doi: 10.2174/1570159X19666211214144639. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Vazey EM, Aston-Jones G. Designer receptor manipulations reveal a role of the locus coeruleus noradrenergic system in isoflurane general anesthesia. Proc Natl Acad Sci USA. 2014;111(10):3859–64. doi: 10.1073/pnas.1310025111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Taylor NE, Van Dort CJ, Kenny JD, et al. Optogenetic activation of dopamine neurons in the ventral tegmental area induces reanimation from general anesthesia. Proc Natl Acad Sci USA. 2016;113(45):12826–31. doi: 10.1073/pnas.1614340113. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Moore JT, Chen JQ, Han B, et al. Direct activation of sleep-promoting VLPO neurons by volatile anesthetics contributes to anesthetic hypnosis. Curr Biol. 2012;22(21):2008–16. doi: 10.1016/j.cub.2012.08.042. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Li A, Li R, Ouyang PR, et al. Dorsal raphe serotonergic neurons promote arousal from isoflurane anesthesia. CNS Neurosci Ther. 2021;27(8):941–50. doi: 10.1111/cns.13656. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Liu J, Lee HJ, Weitz AJ, et al. Frequency-selective control of cortical and subcortical networks by central thalamus. eLife. 2015;4:e09215. doi: 10.7554/eLife.09215. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Liu K, Kim J, Kim DW, et al. Lhx6-positive GABA-releasing neurons of the zona incerta promote sleep. Nature. 2017;548(7669):582–7. doi: 10.1038/nature23663. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Escudero G, Nuñez A. Medial prefrontal cortical modulation of whisker thalamic responses in anesthetized rats. Neuroscience. 2019;406:626–36. doi: 10.1016/j.neuroscience.2019.01.059. [DOI] [PubMed] [Google Scholar]
- 10.Salmi E, Kaisti KK, Metsähonkala L, et al. Sevoflurane and propofol increase 11C-flumazenil binding to gamma-aminobutyric acidA receptors in humans. Anesth Analg. 2004;99(5):1420–6. doi: 10.1213/01.ANE.0000135409.81842.31. [DOI] [PubMed] [Google Scholar]
- 11.Moody OA, Zhang ER, Vincent KF, et al. The neural circuits underlying general anesthesia and sleep. Anesth Analg. 2021;132(5):1254–64. doi: 10.1213/ANE.0000000000005361. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Power BD, Mitrofanis J. Zona incerta: substrate for contralateral interconnectivity in the thalamus of rats. J Comp Neurol. 2001;436(1):52–63. doi: 10.1002/cne.1053. [DOI] [PubMed] [Google Scholar]
- 13.Sharma S, Kim LH, Mayr KA, et al. Parallel descending dopaminergic connectivity of A13 cells to the brainstem locomotor centers. Sci Rep. 2018;8(1):7972. doi: 10.1038/s41598-018-25908-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Zhang XB, van den Pol AN. Rapid binge-like eating and body weight gain driven by zona incerta GABA neuron activation. Science. 2017;356(6340):853–9. doi: 10.1126/science.aam7100. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Mitrofanis J. Some certainty for the "zone of uncertainty"? Exploring the function of the zona incerta. Neuroscience. 2005;130(1):1–15. doi: 10.1016/j.neuroscience.2004.08.017. [DOI] [PubMed] [Google Scholar]
- 16.Mitrofanis J. Evidence for an auditory subsector within the zona incerta of rats. Anat Embryol. 2002;205(5):453–62. doi: 10.1007/s00429-002-0268-3. [DOI] [PubMed] [Google Scholar]
- 17.Liu YJ, Chen B, Cai YR, et al. Activation of anterior thalamic reticular nucleus GABAergic neurons promotes arousal from propofol anesthesia in mice. Acta Biochim Biophys Sin (Shanghai) 2021;53(7):883–92. doi: 10.1093/abbs/gmab056. [DOI] [PubMed] [Google Scholar]
- 18.Li JY, Gao SJ, Li RR, et al. A neural circuit from the paraventricular thalamus to the bed nucleus of the stria Terminalis for the regulation of states of consciousness during sevoflurane anesthesia in mice. Anesthesiology. 2022;136(5):709–31. doi: 10.1097/ALN.0000000000004195. [DOI] [PubMed] [Google Scholar]
- 19.Tasserie J, Uhrig L, Sitt JD, et al. Deep brain stimulation of the thalamus restores signatures of consciousness in a nonhuman primate model. Sci Adv. 2022;8(11):eabl5547. doi: 10.1126/sciadv.abl5547. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Vlasov K, Pei JZ, Nehs CJ, et al. Activation of GABAergic neurons in the rostromedial tegmental nucleus and other brainstem regions promotes sedation and facilitates sevoflurane anesthesia in mice. Anesth Analg. 2021;132(4):e50–e55. doi: 10.1213/ANE.0000000000005387. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Herrera CG, Cadavieco MC, Jego S, et al. Hypothalamic feedforward inhibition of thalamocortical network controls arousal and consciousness. Nat Neurosci. 2016;19(2):290–8. doi: 10.1038/nn.4209. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Wang D, Guo QC, Zhou Y, et al. GABAergic neurons in the dorsal-intermediate lateral septum regulate sleep-wakefulness and anesthesia in mice. Anesthesiology. 2021;135(3):463–81. doi: 10.1097/ALN.0000000000003868. [DOI] [PubMed] [Google Scholar]
- 23.Yue XF, Wang AZ, Hou YP, et al. Effects of propofol on sleep architecture and sleep-wake systems in rats. Behav Brain Res. 2021;411:113380. doi: 10.1016/j.bbr.2021.113380. [DOI] [PubMed] [Google Scholar]
- 24.Kelz MB, Sun Y, Chen JQ, et al. An essential role for orexins in emergence from general anesthesia. Proc Natl Acad Sci USA. 2008;105(4):1309–14. doi: 10.1073/pnas.0707146105. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Yin L, Li L, Deng J, et al. Optogenetic/chemogenetic activation of GABAergic neurons in the ventral tegmental area facilitates general anesthesia via projections to the lateral hypothalamus in mice. Front Neural Circuits. 2019;13:73. doi: 10.3389/fncir.2019.00073. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Zhao SY, Li R, Li HM, et al. Lateral hypothalamic area glutamatergic neurons and their projections to the lateral habenula modulate the anesthetic potency of isoflurane in mice. Neurosci Bull. 2021;37(7):934–46. doi: 10.1007/s12264-021-00674-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Wang TX, Xiong B, Xu W, et al. Activation of parabrachial nucleus glutamatergic neurons accelerates reanimation from sevoflurane anesthesia in mice. Anesthesiology. 2019;130(1):106–18. doi: 10.1097/ALN.0000000000002475. [DOI] [PubMed] [Google Scholar]
- 28.Brohan J, Goudra BG. The role of GABA receptor agonists in anesthesia and sedation. CNS Drugs. 2017;31(10):845–56. doi: 10.1007/s40263-017-0463-7. [DOI] [PubMed] [Google Scholar]
- 29.Ossowska K. Zona incerta as a therapeutic target in Parkinson's disease. J Neurol. 2020;267(3):591–606. doi: 10.1007/s00415-019-09486-8. [DOI] [PMC free article] [PubMed] [Google Scholar]


