Abstract
目的
通过脑电微状态这一新颖的脑功能研究方法探寻与听神经瘤患者耳鸣相关的生物标志物。
方法
收集41例有效的听神经瘤患者脑电信息及相关临床信息,进行焦虑量表、抑郁量表、耳鸣障碍量表以及视觉模拟量表评估。脑电采集时长为10~15 min,通过MATLAB、EEGLAB等软件包对脑电数据处理后进行微状态分析,对各项参数指标进行统计分析。
结果
纳入患者包括听神经瘤无耳鸣患者12例、耳鸣患者29例,两组临床指标差异无统计学意义(P > 0.05)。听神经瘤非耳鸣组平均全局解释方差为78.8%,耳鸣组为80.1%。听神经瘤耳鸣患者相较非耳鸣患者微状态C的发生频率增加(P=0.033),覆盖范围增加(P=0.028),THI量表与微状态A的持续时间表现为负相关(R=-0.435,P=0.018),与微状态B的发生频率(R=0.456,P=0.013)和微状态C的发生频率(R=0.412,P=0.026)表现为正相关,语法分析发现微状态C向微状态B的转化概率增加(P=0.031)。
结论
听神经瘤耳鸣患者与非耳鸣患者在脑电微状态的时间序列以及语法特征之间存在明显差异,反映了听神经瘤耳鸣患者的神经资源分配在显著网络、听觉网络以及视觉网络之间存在潜在异常,而脑电微状态可以被认为是研究听神经瘤伴耳鸣患者大脑功能网络的有用方法。
Keywords: 耳鸣, 听神经瘤, 脑电, 微状态
Abstract
Objective
To explore the biomarkers of tinnitus in vestibular schwannoma patients using electroencephalographic (EEG) microstate technology.
Methods
The EEG and clinical data of 41 patients with vestibular schwannoma were collected. All the patients were evaluated by SAS, SDS, THI and VAS scales. The EEG acquisition time was 10-15 min, and the EEG data were preprocessed and analyzed using MATLAB and EEGLAB software package.
Results
Of the 41 patients with vestibular schwannoma, 29 patients had tinnitus and 12 did not have tinnitus, and their clinical parameters were comparable. The average global explanation variances of the non-tinnitus and tinnitus groups were 78.8% and 80.1%, respectively. The results of EEG microstate analysis showed that compared with those without tinnitus, the patients with tinnitus had an increased frequency (P=0.033) and contribution (P=0.028) of microstate C. Correlation analysis showed that THI scale scores of the patients were negatively correlated with the duration of microstate A (R=-0.435, P=0.018) and positively with the frequencies of microstate B (R=0.456, P=0.013) and microstate C (R=0.412, P=0.026). Syntax analysis showed that the probability of transition from microstate C to microstate B increased significantly in vestibular schwannoma patients with tinnitus (P=0.031).
Conclusion
EEG microstate features differ significantly between vestibular schwannoma patients with and without tinnitus. This abnormality in patients with tinnitus may reflect the potential abnormality in the allocation of neural resources and the transition of brain functional activity.
Keywords: tinnitus, vestibular schwannoma, electroencephalogram, microstates
听神经瘤,即前庭神经鞘膜瘤,是桥小脑角区最常见的肿瘤[1],听神经瘤协会(ANA)的数据指出听神经瘤患者的耳鸣患病率为70%左右,远远高于普通人群[2]。耳鸣作为听神经瘤患者的一种主要伴随症状,会导致患者出现焦虑,抑郁,甚至失眠等情况,严重降低人们的生活质量[3-5]。既往研究表明听神经瘤患者耳鸣的发生与患者的性别、年龄、肿瘤大小以及听力情况等因素无显著相关性[6]。目前为止,听神经瘤患者耳鸣的发生机制及生物标志物尚不明确。
脑电图(EEG)技术作为一种新兴的脑功能检测手段,可以反映各种神经认知功能的本质,并解释神经元相互作用的潜在机制[7, 8]。经典的脑电研究主要集中在不同的频段,即α频段(8~12 Hz),β频段(12~30 Hz)、θ频段(4~7 Hz),δ频段(1~3 Hz)以及γ频段(30~70 Hz),但是单一频段的脑电研究特异性较差[9]。耳鸣已经被证实是一种全脑网络属性的变化[10],脑的局部反应并不能完全代表耳鸣特征,需要一种能从全脑衡量耳鸣的指标体系。脑电微状态就是基于脑电的全局拓扑结构探讨脑电的时间序列变化,满足这种条件。脑电微状态则反映了大脑意识感知中相对稳定的时空活动[11]。
脑电微状态研究已经广泛应用于神经科学、认知心理学、心理生理学的研究以及各种大脑疾病的诊断,比如老年痴呆症、儿童多动症、癫痫以及睡眠障碍等等[12]。基于耳鸣的脑电微状态研究也有部分文献报道[13-16],但听神经瘤患者较高的耳鸣患病率预示着其与正常人群耳鸣的发生机制不全相同。目前尚无听神经瘤患者耳鸣有关的脑电特征研究。因此,本研究拟通过脑电微状态的方法,初步探寻听神经瘤患者耳鸣发生的可能机制,并为后续基于脑功能状态指标的多样化神经调控治疗打下基础。
1. 资料和方法
1.1. 数据获取
通过解放军总医院门诊及住院系统收集患者相关信息,包括年龄、性别、肿瘤侧别、肿瘤大小、肿瘤侧听力、常用手、教育程度、耳鸣时间、耳鸣响度、SAS量表值、SDS量表值、THI量表值、VAS视觉模拟量表以及脑电信息。纳入标准:2019年6月~2021年6月于我院耳鼻喉科行听神经瘤手术的患者。排除标准:通过SAS和SDS量表评定诊断为严重焦虑或者抑郁的患者;神经纤维瘤病Ⅱ型患者;非右利手患者;伴有严重的颅内其余器质性病变;伴有眩晕的听神经瘤患者;近1月有精神性药物使用或者头部外伤史。共计纳入78例剔除患者34例。进行脑电数据浏览,对于大段漂移超过记录时间20%的被试或是含有5个以上的不良电极的被试予以剔除,剔除脑电信息3例。剩余无耳鸣听神经瘤患者12例,耳鸣听神经瘤患者29例。本研究方案经本医院机构评审委员会批准(审批号S2021-179-02)。
1.2. 脑电信息采集与处理
1.2.1. 脑电信息采集
在脑电采集前1 d告知患者相关注意事项并记录患者信息。如果患者患有耳鸣,进行耳鸣相关量表评估,包括THI量表、SAS量表、SDS量表并进行耳鸣匹配。
采用64导脑电记录仪(Neuroscan)采集脑电信息。脑电记录系统为Curry8系统,数据采样率为1000 Hz。整个脑电采集过程在电屏蔽和隔音室进行,试验室温度维持在28 ℃左右,整个脑电采集过程避免室外人员走动,以保证被试精神状态良好。脑电采集之前,去除皮肤角质,使用Qucik-Gel导电凝胶填补电极和头皮之间的空间,全部头皮电阻控制在10 kΩ以下。数据采集过程中,告知被试闭眼、放松、维持静止与清醒的状态。整个静息态脑电数据采样时间约为10~15 min。
1.2.2. 脑电信息预处理
基于MATLAB(R2013b),使用EEGLAB(v13.0.0)软件包对EEG数据进行预处理[17]。EEG数据预处理参考既往文献,包括以下步骤:(1)导入脑电数据,并按照国际惯例多所有电极进行重新定位;(2)去除脑电记录中的一些无用电极,并进行脑电数据浏览;(3)滤波范围0.1~70 Hz,并使用48~52 Hz的凹陷滤波器进行处理;(4)进行全脑平均重参考;(5)浏览数据,对漂移比较大的数据部分及伪迹进行人工剔除并记录不良电极;(6)使用球面样条插值法对记录不良的通道进行插值;(7)进行独立成分分析(ICA),解析各种独立成分,通过勾选相应独立成分予以排除;(8)将记录到的脑电数据分段,以2000 ms为一个单元;(9)对于全脑电极,删除所有通道记录中幅值超过±80 µV的分段。
1.2.3. 脑电微状态计算及指标
脑电微状态运算方法参考之前有关研究中的标准流程[14]。首先对预处理后的脑电分段信息进行2~20 Hz的带通滤波。然后计算全局场功率(GFP),GFP反映了不同时间点跨多个电极的电位变化,即不同时间点大脑电场的总体强度。计算公式如下
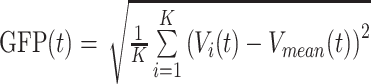 |
其中K为电极的数目,Vi为t时间点第i个电极的瞬时间电位,Vmean(t)为t时间点所有电极瞬时电位的平均值。GFP通常用于反映大脑活动的快速变化,在整个脑电记录时间进程中会有很多波峰与波谷,波峰处拓扑图信噪比更好,且与附近时间点的拓扑图更为相近,而波谷处拓扑图与附近时间点的拓扑图差异较大,认为是不同微状态的切换过程,我们提取GFP曲线局部最大值处的脑电地形图作为代表拓扑图。基于AAHC算法进行聚类分析,将所有代表性的脑电拓扑图划分为4种类型, 即微状态A、B、C、D。在对所有被试的拓扑图归类后,计算微状态参数。
本文中进行统计分析的参数包括微状态的持续时间,即微状态保持稳定的时间长度;发生频率,即某种类型微状态每秒出现的平均次数;覆盖范围,微状态占主导地位的时间记录百分比;微状态非随机转换概率。
1.3. 统计分析
通过SPSS19.0软件对所有数据进行统计分析。服从正态分布的计量资料采用均数±标准差表示,不符合正态分布的计数资料采用中位数(四分位间距)表示。临床资料中的计数资料组间比较采用独立样本t检验,计量资料组间比较采用卡方检验。微状态指标计算通过MATLAB中的Microstate0.3工具包进行,并根据脚本调试运行。微状态指标的组间比较采用独立样本t检验,微状态指标与临床量表及耳鸣响度的相关性分析采用Pearson相关性分析。P < 0.05为差异有统计学意义。
2. 结果
2.1. 患者临床特征
听神经瘤非耳鸣患者12例,听神经瘤耳鸣患者29例,两组在年龄(P=0.662)、性别(P=0.325)、肿瘤侧别(P=0.380)、肿瘤大小(P=0.267)、肿瘤侧纯音听阈(P= 0.803)、健侧纯音听阈(P=0.450)、教育程度(P=0.606)上的差异均无统计学意义(P > 0.05,表 1)。听神经瘤伴耳鸣患者的平均耳鸣时间为29月,响度为40.8±20.4 dB HL,THI评分为41.0±25.5分,SAS评分为37.7±8.3分,SDS评分为40.6±10.1分,VAS评分为3.7±1.7分。
表 1.
听神经瘤患者基本临床特征
Clinical characteristics of vestibular schwannoma patients with and without tinninus
| Clinical characteristics | Non-tinnitus group | Tinnitus group | P |
| PTAs: Pure tone averages; Educational background: including primary education, secondary Education and Bachelor degree or above; THI: Tinnitus handicap inventory; SAS: Self-rating depression scale; SDS: Self-rating anxiety scale; VAS: Visual analog scale. | |||
| Age (year) | 44.3±12.0 | 45.9±10.1 | 0.662 |
| Gender (Male/Female, n) | 8/4 | 14/15 | 0.325 |
| Tumor laterality (Left/Right, n) | 8/4 | 15/14 | 0.380 |
| Tumor size (mm) | 21.1±5.1 | 18.5±7.3 | 0.267 |
| PTAs on affected side (dB HL) | 59.4±22.0 | 57.2±26.3 | 0.803 |
| PTAs on contralateral side (dB HL) | 29.0±6.8 | 27.3±5.9 | 0.450 |
| Educational background | 1/6/5 | 2/10/17 | 0.606 |
| Tinnitus duration (months) | NA | 29 (57.5) | NA |
| Tinnitus loudness (dB HL) | NA | 40.8±20.4 | NA |
| THI scores | NA | 41.0±25.5 | NA |
| SAS scores | NA | 37.7±8.3 | NA |
| SDS scores | NA | 40.6±10.1 | NA |
| VAS scores | NA | 3.7±1.7 | NA |
2.2. 微状态分析
对神经瘤非耳鸣患者和耳鸣患者进行层次聚类后构建两组微状态类别,各包括4种类型(图 1)。对每个患者的拓扑图进行识别并与组间微状态匹配,听神经瘤非耳鸣组的平均全局解释方差为78.8%,听神经瘤耳鸣组的平均全局解释方差为80.1%,结果稳定。
图 1.

听神经瘤非耳鸣组与耳鸣组聚类微状态拓扑图
Topological maps of clustering microstates of tinnitus group and non-tinnitus group.
微状态结果显示,听神经瘤非耳鸣组微状态C的发生频率为3.864次/s,而耳鸣组微状态C的发生频率为4.421次/s,差异具有统计学意义(P=0.033);听神经瘤非耳鸣组微状态C的覆盖范围为0.241,听神经瘤耳鸣组微状态C的覆盖范围为0.281,差异具有统计学意义(P= 0.028);其余各项指标未见明显差异(表 2)。
表 2.
听神经瘤非耳鸣组和耳鸣组指标比较
EEG microstate parameters in non-tinnitus group and tinnitus group
| Microstates parameter | Non-tinnitus group | Tinnitus group | P | |||
| Mean | SD | Mean | SD | |||
| Duration (s) | ||||||
| Microstate A | 0.073 | 0.017 | 0.066 | 0.014 | 0.171 | |
| Microstate B | 0.065 | 0.012 | 0.063 | 0.011 | 0.464 | |
| Microstate C | 0.064 | 0.008 | 0.066 | 0.014 | 0.619 | |
| Microstate D | 0.064 | 0.009 | 0.061 | 0.012 | 0.378 | |
| Frequency (times/s) | ||||||
| Microstate A | 4.024 | 0.617 | 3.983 | 0.818 | 0.878 | |
| Microstate B | 3.676 | 0.550 | 3.929 | 0.883 | 0.364 | |
| Microstate C | 3.864 | 0.685 | 4.421 | 0.754 | 0.033 | |
| Microstate D | 3.754 | 0.567 | 3.869 | 0.843 | 0.668 | |
| Coverage | ||||||
| Microstate A | 0.288 | 0.077 | 0.254 | 0.048 | 0.101 | |
| Microstate B | 0.237 | 0.061 | 0.237 | 0.041 | 0.966 | |
| Microstate C | 0.241 | 0.037 | 0.281 | 0.056 | 0.028 | |
| Microstate D | 0.235 | 0.036 | 0.228 | 0.053 | 0.709 | |
将听神经瘤患者的耳鸣响度、耳鸣时长、THI量表以及VAS视觉模拟量表与微状态持续时间、发生频率、覆盖范围以及转换率进行相关分析,结果显示,THI量表数值与微状态A的持续时间呈负相关(R=-0.435,P=0.018),与微状态B的发生频率呈正相关(R=0.456,P=0.013),与微状态C的发生频率呈正相关(R=0.412,P=0.026),与其余各项指标均不相关(表 3),并未发现VAS量表与微状态各指标间存在显著相关性。
表 3.
THI量表与微状态持续时间、发生频率及覆盖范围相关分析
Correlation analysis of THI scores with microstates duration, frequency, and coverage
| Microstates category | Duration | Frequency | Coverage | |
| *P < 0.05. | ||||
| Microstate A | R | -0.435 | 0.121 | -0.318 |
| P | 0.018* | 0.533 | 0.093 | |
| Microstate B | R | -0.353 | 0.456 | 0.287 |
| P | 0.060 | 0.013 | 0.132 | |
| Microstate C | R | -0.343 | 0.412 | 0.026 |
| P | 0.068 | 0.026 | 0.894 | |
| Microstate D | R | -0.315 | 0.315 | 0.044 |
| P | 0.096 | 0.096 | 0.823 | |
语法分析显示,听神经瘤非耳鸣组从微状态C到微状态B的转换概率为0.074,耳鸣组从微状态C到微状态B的转换概率为0.090,差异具有统计学意义(P=0.031),其余各项转换概率间未发现统计学差异(图 2)。
图 2.

听神经瘤非耳鸣组和耳鸣组语法分析
Syntax analysis of non-tinnitus group and tinnitus group.
3. 讨论
脑电是通过头皮电极来记录大脑电信号活动的一种方法,关于耳鸣的脑电研究也在逐年增加[19, 20]。耳鸣作为一种持续存在的感觉,在安静环境中尤为突出。因此,在安静环境中对患者进行静息状态脑电的测量评估,是研究耳鸣相关大脑异常电生理活动的一种有效方式[21]。
脑电微状态作为一种新颖的脑电研究方式,反映大脑相对稳定的时空活动,即在一定时间内(60~120 ms)保持稳定,然后再迅速切换成另外一种相对稳定的状态[22]。研究表明,脑电微状态是个体化且高效可靠的一项脑电指标,可以作为意识过程的基本构建[23]。目前应用比较广的脑电微状态的最佳聚类数为4个,这4种聚类图谱能够解释65%~84%的全局解释方差[24, 25],在不同研究中具有高度的相似性[26],本研究中两组人群中的平均全局解释方差分别为78.8%和80.1%,与既往研究一致,结果真实可靠。微状态和静息状态功能磁共振成像之间的相关性已经得到证实[27-29],微状态的时间进程代表大脑不同神经元组件的快速切换,且其丰富的语法知识也能为脑电信息的分析提供了多种量化方法,具有重要的神经生理学意义[30]。
本研究选择各国指南中比较认可的THI量表作为耳鸣相对客观的评价指标[31]。临床指标在非耳鸣组与耳鸣组之间并无统计学差异,可以有效规避临床指标对脑电的影响。另外为了避免听神经瘤患者另一高发症状眩晕对本研究的影响,研究对于伴有眩晕的患者均予以排除。
既往原发性耳鸣病人脑电微状态的研究中发现微状态的改变主要集中于微状态A和微状态D [14, 15]。但是对于突聋伴有耳鸣的病人,表现略有不同,主要表现为微状态A、微状态B和微状态C的改变,即微状态A的覆盖范围降低,微状态B的发生频率增加以及微状态C向微状态B的转换概率增加。本研究结果与突聋伴有耳鸣病人的微状态结果相似,考虑与听神经瘤患者同时伴有不同程度的听力损失有关。但是我们同时发现听神经瘤伴耳鸣患者微状态C的发生频率与覆盖范围显著增加,且微状态C的发生频率与THI量表呈显著正相关。微状态C主要与前扣带回后部、双侧下额叶及右侧前脑岛的正血氧水平依赖信号激活相关,表征显著网络[32, 33],可以检测并定位各种内源性与外源性刺激引发的神经网络改变,同时能很好的整合来自听觉通路的刺激[34]。既往基于核磁的研究发现耳鸣患者表现为显著网络的异常[35],另有研究指出异常的显著网络与耳鸣患者的抗干扰能力和执行功能受损有关[36-38]。但是在原发性耳鸣以及突聋伴耳鸣患者中均未发现微状态C在耳鸣人群与健康对照组中存在显著差异[13],一方面考虑样本量的问题,另一方面考虑到本次研究中选取的被试为听神经瘤患者,相关研究表明听神经瘤患者在记忆力、执行功能以及信息处理速度等方面与常人存在较大差异[39],而这些差异表征与显著网络密切相关;此外听神经瘤患者表现为不同程度的听力损失,既往研究发现听力损失伴耳鸣患者显著网络明显异常,在感觉整合、引导注意力、决策等相关任务时变得更加困难[40]。因此,对于听神经瘤伴耳鸣患者相较于非耳鸣患者表现为微状态C的异常改变也就不难理解。
本研究相关性分析还发现THI量表除了与微状态C呈正相关,与微状态A的持续时间呈显著负相关,同时与微状态B的发生频率呈正相关。有研究通过同步脑电与功能核磁证明了微状态A与双侧颞上回和颞中回的激活程度有关,且与患者的听觉及语音处理有关[41, 42]。研究表明耳鸣患者颞区以及听觉皮层发生了病理性重组,微状态A的异常提示听神经瘤伴耳鸣患者相较于非耳鸣患者在听觉网络中发生了更显著的改变,既往突聋伴耳鸣病人的研究中虽然并未发现这种负相关性,但却发现了耳鸣病人微状态A的持续时间显著降低,与本研究表现为类似的趋势[13]。对于微状态B目前研究较少,微状态B对应双侧枕下回、双侧的楔状叶、左侧的舌回以及中部的双侧枕区的激活,与双侧纹状体外视觉信息的处理有关,功能核磁的研究证明视觉网络与听觉网络存在负相关性[43],耳鸣病人中视觉皮层的激活明显减少[35],同时既往微状态研究中微状态B与微状态A也表现为相反的趋势,提示听神经瘤耳鸣患者除听觉网络以外,非听觉网络(视觉网络)可能发生了改变。语法分析同时发现了微状态C向微状态B的转换概率增加,既往耳鸣相关研究中也得出过类似的发现[13],表明听神经瘤耳鸣患者的代偿可塑性随着显著网络到视觉网络的转换增加而提高。
综上所述,听神经瘤耳鸣患者与非耳鸣患者在脑电微状态的时间序列以及语法特征之间存在明显的差异,反映了听神经瘤耳鸣患者的神经资源分配在显著网络、听觉网络以及视觉网络之间存在潜在异常,通过脑电微状态可以为研究大规模脑网络状态提供一种有价值的方法,进而有助于研究其背后的神经生理机制。但本研究对于听神经瘤患者耳鸣相关的微状态特征也只是初步探索,由于听神经瘤发病率很低[44],目前收集到的听神经瘤患者脑电信息样本量较小,对于术后脑电数据采集样本量则相对更少,且术后耳鸣分类情况繁杂[45],下一步仍需要扩大样本量以便深入研究。
Biographies
张驰,博士,主治医师,E-mail: zczzc123@126.com
王晓光,副主任医师,E-mail: 814242545@qq.com
Funding Statement
国家重点研发计划(2019YFC0840707);国家重点研发计划(2019YFC0121302);北京市科技新星计划(Z201100006820133);海南省自然科学基金(820QN381)
Contributor Information
张 驰 (Chi ZHANG), Email: zczzc123@126.com.
王 晓光 (Xiaoguang WANG), Email: 814242545@qq.com.
杨 仕明 (Shiming YANG), Email: shm_yang@163.com.
王 方园 (Fangyuan WANG), Email: fyw0530@126.com.
References
- 1.Rahimpour S, Friedman AH, Fukushima T, et al. Microsurgical resection of vestibular schwannomas: complication avoidance. J Neurooncol. 2016;130(2):367–75. doi: 10.1007/s11060-016-2260-4. [DOI] [PubMed] [Google Scholar]
- 2.Leong SC, Lesser TH. A United Kingdom survey of concerns, needs, and priorities reported by patients diagnosed with acoustic neuroma. and. 2015;36(3):486–90. doi: 10.1097/MAO.0000000000000556. [DOI] [PubMed] [Google Scholar]
- 3.Kofahl C. Associations of collective self-help activity, health literacy and quality of life in patients with tinnitus. Patient Educ Couns. 2018;101(12):2170–8. doi: 10.1016/j.pec.2018.07.001. [DOI] [PubMed] [Google Scholar]
- 4.Ukaegbe OC, Orji FT, Ezeanolue BC, et al. Tinnitus and its effect on the quality of life of sufferers: a Nigerian cohort study. Otolaryngol Head Neck Surg. 2017;157(4):690–5. doi: 10.1177/0194599817715257. [DOI] [PubMed] [Google Scholar]
- 5.Zeman F, Koller M, Langguth B, et al. Which tinnitus-related aspects are relevant for quality of life and depression: results from a large international multicentre sample. Health Qual Life Outcomes. 2014;12:7–13. doi: 10.1186/1477-7525-12-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Kohno M, Shinogami M, Yoneyama H, et al. Prognosis of tinnitus after acoustic neuroma surgery: surgical management of postoperative tinnitus. World Neurosurg. 2014;81(2):357–67. doi: 10.1016/j.wneu.2012.09.008. [DOI] [PubMed] [Google Scholar]
- 7.Roth JK, Johnson MK, Tokoglu F, et al. Modulating intrinsic connectivity: adjacent subregions within supplementary motor cortex, dorsolateral prefrontal cortex, and parietal cortex connect to separate functional networks during task and also connect during rest. PLoS One. 2014;9(3):e90672. doi: 10.1371/journal.pone.0090672. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Vasicek EM, Berkow EL, Bruno VM, et al. Disruption of the transcriptional regulator Cas5 results in enhanced killing of Candida albicans by Fluconazole. Antimicrob Agents Chemother. 2014;58(11):6807–18. doi: 10.1128/AAC.00064-14. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Newson JJ, Thiagarajan TC. EEG frequency bands in psychiatric disorders: a review of resting state studies. Front Hum Neurosci. 2018;12:521–8. doi: 10.3389/fnins.2018.00521. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Dirk, Ridder D. An integrative model of auditory phantom perception: Tinnitus as a unified percept of interacting separable subnetworks. Neurosci Biobehav Rev. 2014;44:16–32. doi: 10.1016/j.neubiorev.2013.03.021. [DOI] [PubMed] [Google Scholar]
- 11.Michel CM, Koenig T. EEG microstates as a tool for studying the temporal dynamics of whole-brain neuronal networks: a review. Neuroimage. 2018;180(Pt B):577–93. doi: 10.1016/j.neuroimage.2017.11.062. [DOI] [PubMed] [Google Scholar]
- 12.Mishra A, Englitz B, Cohen MX. EEG microstates as a continuous phenomenon. Neuroimage. 2020;208:116454–9. doi: 10.1016/j.neuroimage.2019.116454. [DOI] [PubMed] [Google Scholar]
- 13.Cai YX, Chen SJ, Chen YH, et al. Altered resting-state EEG microstate in idiopathic sudden sensorineural hearing loss patients with tinnitus. Front Neurosci. 2019;13:443–51. doi: 10.3389/fnins.2019.00443. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Cai Y, Huang D, Chen Y, et al. Deviant dynamics of resting state electroencephalogram microstate in patients with subjective tinnitus. Front Behav Neurosci. 2018;12:122–9. doi: 10.3389/fnbeh.2018.00122. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Cao W, Wang FY, Zhang C, et al. Microstate in resting state: an EEG indicator of tinnitus? Acta Otolaryngol. 2020;140(7):564–9. doi: 10.1080/00016489.2020.1743878. [DOI] [PubMed] [Google Scholar]
- 16.许 学添, 蔡 跃新. 基于微状态的静息态脑电信号分析. 计算机与数字工程. 2021;49(7):1396-9, 1429. [Google Scholar]
- 17.Jia HB, Yu DC. Aberrant intrinsic brain activity in patients with autism spectrum disorder: insights from EEG microstates. Brain Topogr. 2019;32(2):295–303. doi: 10.1007/s10548-018-0685-0. [DOI] [PubMed] [Google Scholar]
- 18.Koenig T, Prichep L, Lehmann D, et al. Millisecond by millisecond, year by year: normative EEG microstates and developmental stages. Neuroimage. 2002;16(1):41–8. doi: 10.1006/nimg.2002.1070. [DOI] [PubMed] [Google Scholar]
- 19.Sadeghijam M, Talebian S, Mohsen S, et al. Shannon entropy measures for EEG signals in tinnitus. Neurosci Lett. 2021;762:136153–8. doi: 10.1016/j.neulet.2021.136153. [DOI] [PubMed] [Google Scholar]
- 20.Zhang JJ, Huang SJ, Nan WY, et al. Switching Tinnitus-On: maps and source localization of spontaneous EEG. Clin Neurophysiol. 2021;132(2):345–57. doi: 10.1016/j.clinph.2020.10.023. [DOI] [PubMed] [Google Scholar]
- 21.Schlee W, Schecklmann M, Lehner A, et al. Reduced variability of auditory alpha activity in chronic tinnitus. Neural Plast. 2014;2014:436146–52. doi: 10.1155/2014/436146. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Lehmann D. Multimodal analysis of resting state cortical activity: what does fMRI add to our knowledge of microstates in resting state EEG activity? Commentary to the papers by Britz et al. in the current issue of NeuroImage. Neuroimage. 2010;52(4):1173–4. doi: 10.1016/j.neuroimage.2010.05.033. [DOI] [PubMed] [Google Scholar]
- 23.Liu JY, Xu J, Zou GY, et al. Reliability and individual specificity of EEG microstate characteristics. Brain Topogr. 2020;33(4):438–49. doi: 10.1007/s10548-020-00777-2. [DOI] [PubMed] [Google Scholar]
- 24.Brodbeck V, Kuhn A, von Wegner F, et al. EEG microstates of wakefulness and NREM sleep. Neuroimage. 2012;62(3):2129–39. doi: 10.1016/j.neuroimage.2012.05.060. [DOI] [PubMed] [Google Scholar]
- 25.Tomescu MI, Rihs TA, Becker R, et al. Deviant dynamics of EEG resting state pattern in 22q11.2 deletion syndrome adolescents: a vulnerability marker of schizophrenia? Schizophr Res. 2014;157(1/2/3):175–81. doi: 10.1016/j.schres.2014.05.036. [DOI] [PubMed] [Google Scholar]
- 26.Gao F, Jia HB, Wu XC, et al. Altered resting- state EEG microstate parameters and enhanced spatial complexity in male adolescent patients with mild spastic diplegia. Brain Topogr. 2017;30(2):233–44. doi: 10.1007/s10548-016-0520-4. [DOI] [PubMed] [Google Scholar]
- 27.Britz J, van De Ville D, Michel CM. BOLD correlates of EEG topography reveal rapid resting-state network dynamics. Neuroimage. 2010;52(4):1162–70. doi: 10.1016/j.neuroimage.2010.02.052. [DOI] [PubMed] [Google Scholar]
- 28.Musso F, Brinkmeyer J, Mobascher A, et al. Spontaneous brain activity and EEG microstates. A novel EEG/fMRI analysis approach to explore resting-state networks. Neuroimage. 2010;52(4):1149–61. doi: 10.1016/j.neuroimage.2010.01.093. [DOI] [PubMed] [Google Scholar]
- 29.van de Ville D, Britz J, Michel CM. EEG microstate sequences in healthy humans at rest reveal scale-free dynamics. Proc Natl Acad Sci U S A. 2010;107(42):18179–84. doi: 10.1073/pnas.1007841107. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Khanna A, Pascual-Leone A, Michel CM, et al. Microstates in resting-state EEG: current status and future directions. Neurosci Biobehav Rev. 2015;49:105–13. doi: 10.1016/j.neubiorev.2014.12.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Cima RF, Mazurek B, Haider H, et al. A multidisciplinary European guideline for tinnitus: diagnostics, assessment, and treatment. HNO. 2019;67(1):10–42. doi: 10.1007/s00106-019-0633-7. [DOI] [PubMed] [Google Scholar]
- 32.Seeley WW, Menon V, Schatzberg AF, et al. Dissociable intrinsic connectivity networks for salience processing and executive control. J Neurosci. 2007;27(9):2349–56. doi: 10.1523/JNEUROSCI.5587-06.2007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Taylor KS, Seminowicz DA, Davis KD. Two systems of resting state connectivity between the insula and cingulate cortex. Hum Brain Mapp. 2009;30(9):2731–45. doi: 10.1002/hbm.20705. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Heywood R, Gao Q, Nyunt MSZ, et al. Hearing loss and risk of mild cognitive impairment and dementia: findings from the Singapore longitudinal ageing study. Dement Geriatr Cogn Disord. 2017;43(5/6):259–68. doi: 10.1159/000464281. [DOI] [PubMed] [Google Scholar]
- 35.Amaral AA, Langers DR. Tinnitus-related abnormalities in visual and salience networks during a one-back task with distractors. Hear Res. 2015;326:15–29. doi: 10.1016/j.heares.2015.03.006. [DOI] [PubMed] [Google Scholar]
- 36.Araneda R, de Volder AG, Deggouj N, et al. Altered top-down cognitive control and auditory processing in tinnitus: evidences from auditory and visual spatial stroop. Restor Neurol Neurosci. 2015;33(1):67–80. doi: 10.3233/RNN-140433. [DOI] [PubMed] [Google Scholar]
- 37.Hallam RS, McKenna L, Shurlock L. Tinnitus impairs cognitive efficiency. Int JAudiol. 2004;43(4):218–26. doi: 10.1080/14992020400050030. [DOI] [PubMed] [Google Scholar]
- 38.Stevens C, Walker G, Boyer M, et al. Severe tinnitus and its effect on selective and divided attention. Int JAudiol. 2007;46(5):208–16. doi: 10.1080/14992020601102329. [DOI] [PubMed] [Google Scholar]
- 39.范 志远, 范 振, 李 思辰, et al. 听神经瘤对患者认知功能影响的研究. 中国临床神经科学. 2020;28(1):52–8. [Google Scholar]
- 40.Xu XM, Jiao Y, Tang TY, et al. Altered spatial and temporal brain connectivity in the salience network of sensorineural hearing loss and tinnitus. Front Neurosci. 2019;13:246–53. doi: 10.3389/fnins.2019.00246. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Chen YC, Wang F, Wang J, et al. Resting-state brain abnormalities in chronic subjective tinnitus: a meta-analysis. Front Hum Neurosci. 2017;11:22–7. doi: 10.3389/fnhum.2017.00022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Chen YC, Feng Y, Xu JJ, et al. Disrupted brain functional network architecture in chronic tinnitus patients. Front Aging Neurosci. 2016;8:174–80. doi: 10.3389/fnagi.2016.00174. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Burton H, Wineland A, Bhattacharya M, et al. Altered networks in bothersome tinnitus: a functional connectivity study. BMC Neurosci. 2012;13:3–11. doi: 10.1186/1471-2202-13-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Kleijwegt M, Ho V, Visser O, et al. Real incidence of vestibular schwannoma? estimations from a national registry. and. 2016;37(9):1411–7. doi: 10.1097/MAO.0000000000001169. [DOI] [PubMed] [Google Scholar]
- 45.Zhang C, Wang FY, Cao W, et al. Identification of factors associated with tinnitus outcomes following the microsurgical treatment of vestibular schwannoma patients. Acta Otolaryngol. 2021;141(4):334–9. doi: 10.1080/00016489.2020.1869304. [DOI] [PubMed] [Google Scholar]


