Abstract
目的
基于网络药理学方法预测桂枝甘草汤治疗心力衰竭潜在作用靶点与通路。
方法
通过TCMSP数据库、TCMID数据库、TCM@Taiwan数据库获得桂枝甘草汤化学成分,采用SwissTargetPrediction数据库预测药物潜在靶点信息,通过用DisGeNET数据库、drugbank数据库、TTD数据库获得心力衰竭靶点,采用Venny2.1.0对药物与疾病的靶点进行交集选取,采用Uniprot数据库转换信息,采用Cytoscape构建“有效成分-靶点-疾病”网络,进行蛋白-蛋白相互作用网络(PPI),并通过网络拓扑分析得到桂枝甘草汤治疗心力衰竭的核心靶点,并将核心靶点通过Metascape数据库进行GO分析及KEGG分析。通过Western blot验证网络药理学的预测结果,根据网络药理学结果中degree值及与心力衰竭过程相关程度筛选出3个因子(PKCα、ERK1/2和BCL2),在戊巴比妥钠溶于无血清高糖培养基处理的H9C2细胞中模拟心衰缺血缺氧环境,提取心肌细胞总蛋白,测定PKCα、ERK1 /2和BCL2的蛋白含量。
结果
通过网络药理学的方法,得到桂枝甘草汤治疗心力衰竭的潜在靶点有190个,它们主要参与循环系统过程、氮化合物的细胞反应、阳离子稳态、MAPK级联的调节等生物过程;参与调控癌症相关通路,钙信号通路、cGMP-PKG信号通路、cAMP信号通路等38条通路。体外细胞模型的Western blot验证实验结果显示,心力衰竭组PKCα和ERK1/2蛋白相对表达量均高于正常组(P < 0.05),心力衰竭+桂枝甘草汤组其相对含量降低(P < 0.05);心力衰竭组BCL2蛋白相对表达量均低于正常组(P < 0.05),心力衰竭+桂枝甘草汤组其相对含量与心力衰竭组相比明显升高(P < 0.05)。
结论
桂枝甘草汤可能通过作用于PRKCA、PRKCB、MAPK1、MAPK3、MAPK8等多个靶点,下调PKCα和ERK1/2因子的蛋白表达,上调BCL2因子的蛋白表达,调控癌症相关通路、钙信号通路等多个信号通路来治疗心力衰竭。
Keywords: 网络药理学, 桂枝甘草汤, 心力衰竭, 分子机制
Abstract
Objective
To predict the targets and pathways in the therapeutic mechanism of Guizhi Gancao Decoction (GZGCD) against heart failure (HF) based on network pharmacology.
Methods
The chemical components of GZGCD were analyzed using the databases including TCMSP, TCMID and TCM@Taiwan, and the potential targets of GZGCD were predicted using the SwissTargetPrediction database. The targets of HF were obtained using the databases including DisGeNET, Drugbank and TTD. The intersection targets of GZGCD and HF were identified using VENNY. Uniport database was used to convert the information, and the components-targets-disease network was constructed using Cytoscape software. The Bisogene plug-in, Merge plug-in, and CytoNCA plug-in in Cytoscape software were used for protein-protein interaction (PPI) analysis to acquire the core targets. Metascape database was used for GO and KEGG analysis. The results of network pharmacology analysis were verified with Western blot analysis. Three factors (PKCα, ERK1/2 and BCL2) were screened according to the degree value of network pharmacology results and the degree of correlation with heart failure process. The pentobarbtal sodium was dissolvein H9C2 cells treated with serum-free high glucose medium to simulate the ischemic anoxic environment of heart failure. The total proteins of myocardial cells were extracted. The protein contents of PKCα, ERK1/2 and BCL2 were determined.
Results
We identified a total of 190 intersection targets between GZGCD and HF using Venny database, involving mainly the circulatory system process, cellular response to nitrogen compounds, cation homeostasis, and regulation of the MAPK cascade. These potential targets were also involved in 38 pathways, including the regulatory pathways in cancer, calcium signal pathway, cGMP-PKG signal pathway, and cAMP signal pathway. Western blot analysis showed that in an in vitro H9C2 cell model of HF, treatment with GZGCD downregulated PKCα and ERK1/2 expressions and upregulated BCL2 expression.
Conclusion
The therapeutic mechanism of GZGCD for HF involves multiple targets including PRKCA, PRKCB, MAPK1, MAPK3, and MAPK8 and multiple pathways including the regulatory pathway in cancer and the calcium signaling pathway.
Keywords: network pharmacology, Guizhi Gancao Decoction, heart failure, molecular mechanism
心力衰竭(HF)是众多心脏病的最终归宿,虽然随着医疗水平的提高,心脏疾病患者生存期延长,但心衰仍然是导致死亡和生活质量低下的主要原因[1, 2]。临床上的常规治疗以西药为主,常用利尿剂、强心剂、扩血管药物等,而非药物治疗,如植入型心脏转复除颤器等由于价格比较昂贵等原因,目前在临床上没有得到充分的使用[3]。
中医药在治疗心衰方面有着很好的疗效。桂枝甘草汤由桂枝与炙甘草两种中药组成,具有温通心阳、益气生血的功效[4]。药理研究表明,桂枝含桂皮醇、桂皮醛等一系列挥发性油类及有机酸等化学成分,具有抗氧化、扩血管、利尿等作用[5]。炙甘草含甘草皂苷类、甘草黄酮类、甘草多糖类等化学成分,有较强的抗炎杀菌、抗氧化、抗心肌缺血、抗动脉粥样硬化、增强免疫等作用[6-8]。此方在临床一直被应用于心血管疾病的治疗,并颇有成效[9],但目前关于桂枝甘草汤治疗心衰的机制尚未有报道。
中药具有多成分、多靶点的特点,其药理机制十分复杂,网络药理学能够在系统的分子水平上更好地理解细胞以及器官的行为对功能表型的影响,特别适合于复杂生物系统间相互作用关系的挖掘研究[10]。因此本研究将网络药理学方法运用于桂枝甘草汤的研究中,一方面构建桂枝甘草汤“药物靶点-疾病靶点”网络,预测桂枝甘草汤治疗心衰的作用靶点及药理作用机制,为临床应用桂枝甘草汤治疗心衰提供科学依据;另一方面为进一步应用网络药理学方法研究中药复方提供依据,推动中药复方多靶点、整体性等方面的研究。
1. 材料和方法
本研究网络药理学分析流程(图 1)。
图 1.
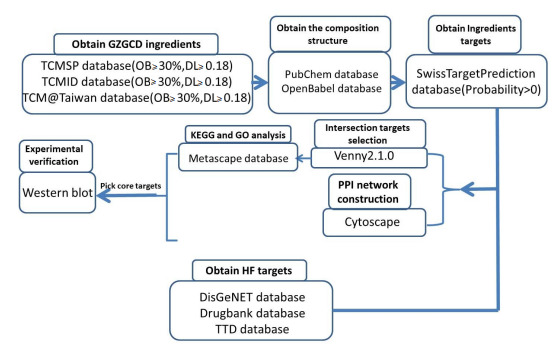
网络药理学分析流程图
Flow chart of network pharmacology analysis.
1.1. 桂枝甘草汤有效成分及成分靶点的获取
采用Traditional Chinese Medicine Systems Pharmacology(http://lsp.nwu.edu.cn/tcmsp.php)、Traditional Chinese Medicines Integrated Database(http://119.3.41.228:8000/tcmid/)、Traditional Chinese Medicines Database@Taiwan(http://tcm.cmu.edu.tw/)检索桂枝、甘草这两味中药的有效成分,将口服利用度(OB)≥30%和类药性(DL)≥0.18作为筛选有效成分的条件,并应用PubChem数据库及OpenBabel数据库获取有效成分的Smiles号,通过Smiles号在SwissTargetPrediction数据库(http://www.swisstargetprediction.ch/),进行靶点预测,以probability > 0为筛选条件,获得有效成分的靶点信息。并通过Cytoscape软件,以复方中药(桂枝、甘草),及其各自对应的有效成分、成分靶点作为节点,构建“复方中药-有效成分-成分靶点”网络,以便更好地体现两种中药所对应的靶点信息。
1.2. 疾病靶点的获取
采用DisGeNET数据库(https://www.disgenet.org/)、drugbank数据库(https://go.drugbank.com/)、Therapeutic Target Database数据库(http://db.idrblab.net/ttd/),分别检索“心力衰竭”,获取靶点,后进行去重与整合,得到心衰靶点。
1.3. 成分靶点-疾病靶点交集获取
将所获得的疾病靶点及成分靶点输入Uniprot数据库(https://www.uniprot.org)获得标准化基因名。利用Venny2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)对上述获得的成分靶点与疾病靶点取交集,得到交集靶点,并绘制韦恩图来进一步展现其交集关系。
1.4. “复方中药-有效成分-交集靶点-疾病”网络的构建
以桂枝甘草两味药物名称、有效成分、交集靶点、疾病为节点,构建“复方中药-有效成分-交集靶点-疾病”网络。
1.5. 蛋白互作网络(PPI)的构建及核心靶点的筛选
应用Cytoscape中的Bisogene插件构建药物、疾病的PPI网络,而后通过Merge插件获取二者PPI网络交集,通过CytoNAC插件对其进行拓扑分析来获取桂枝甘草汤治疗心衰的核心靶点。
1.6. GO分析及KEGG分析
运用Metascape数据库对交集靶点进行GO分析及KEGG分析。
1.7. 体外实验验证
1.7.1. 药物、试剂
桂枝与炙甘草(北京同仁堂大连药店连锁有限责任公司);胎牛血清(FBS)、DMEM培养基、胰蛋白酶(Gibco);CCK-8试剂盒(Abcam);二甲基亚砜(DMSO,碧云天);BCA蛋白定量试剂盒(Thermo Scientific);ERK1 /2抗体(C-9,SANTA CRUZ);PKCα抗体(H-7,SANTA CRUZ);BCL2抗体(Rabbit mAb, Cell signaling)。
1.7.2. 细胞培养和实验分组
将H9C2细胞放入细胞培养箱,复温1 h,而后将培养基换成正常培养基(低碳酸氢钠DMEM,iCell-128-0001+10% FBS)培养。当细胞密度达到90%时用胰酶消化传代,传代后在10%胎牛血清培养基,37 ℃、5%CO2培养箱中正常培养24 h后,再用无血清DMEM处理12 h同步化各实验组细胞。本次实验分为3组:正常组(N)、心力衰竭组(HF)和心力衰竭+桂枝甘草汤组(HF+G)。H9C2细胞心衰模型建立参照文献的方法操作[11]。本次实验具体方法如下:N组和HF组为无血清培养基,HF+G组加入无血清培养基配制的桂枝甘草汤,在培养箱中培养至最佳给药时间后进行HF细胞模型造模。将戊巴比妥钠溶于无血清高糖培养基,配置成0.1%备用。将预处理完毕的细胞用PBS冲洗2次,清除残留的桂枝甘草汤,N组加入无血清培养基,HF组和HF+G组加入等体积无血清0.1%戊巴比妥钠培养基,放于培养箱培养0.5 h后,观察梭形心肌细胞,如心肌细胞变细并有部分细胞变成圆形,少部分细胞已漂浮,则心衰细胞模型建立成功。
1.7.3. CCK-8法检测细胞活力
对生长状态良好的H9C2细胞进行消化、计数(2.65×106,3 mL)并将其均匀种于96孔板上,接种100 μL/孔。放入培养箱过夜。
将桂枝甘草汤溶于DMSO中,将10 mg/mL作为母液,然后10倍量级稀释,浓度梯度设定如下:10 mg/mL、1 mg/mL、200 μg/mL、100 μg/mL、50 μg/mL、10 μg/mL。
按上述浓度梯度给予细胞桂枝甘草汤,分别干预1、2、4、8、12 h后加入CCK8,每个浓度梯度复孔6次,用酶标仪检测450 nm波长处的吸光度A以代表细胞活力,从而获得桂枝甘草汤最佳给药时间和用药浓度。
1.7.4. 心肌细胞总蛋白含量检测
按照实验分组,药物处理后移除6孔板中的培养液,PBS缓冲液冲洗2次,胰蛋白酶消化后收集细胞于1.5 mL EP管中,再使用RIPA裂解细胞后提取蛋白,收集蛋白上清液后稀释10倍,使用BCA试剂盒进行蛋白定量,根据标准品曲线计算出每个样品的蛋白浓度。总蛋白含量=蛋白浓度×稀释倍数×总蛋白体积。最后根据结果将蛋白浓度定至同一浓度(根据最低浓度样品)。
1.7.5. Western blot检测PKCα、ERK1/2、BCL2的蛋白表达
根据网络药理学结果中degree值及与心衰过程相关程度筛选3个因子(PKCα、ERK1 /2和BCL2)进行Western blot验证。将各组细胞蛋白按照1.7.4进行定量、变性并计算上样量。按照标准蛋白印迹法检测步骤进行蛋白样品制备,SDS-PAGE电泳,转膜,免疫反应,化学发光、显影、图像分析。管家基因使用GAPDH。每个样品重复3次。
1.8. 统计学分析
用SPSS19.0软件进行数据分析,统计数据用均数±标准差表示,多组间数据比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2. 结果
2.1. 桂枝甘草汤有效成分及成分靶点的获取
桂枝甘草汤中含桂枝与甘草,两种中药通过TCMSP、TCMID、TCM@Taiwan检索,获得其化学成分,经筛选去重后桂枝共有7种有效成分,甘草共有85种有效成分,且有一种有效成分为两种中药共有。通过PubChem数据库及OpenBabel数据库获取的Smiles号,并在SwissTargetPrediction数据库进行靶点预测,筛选去重后共获得827个成分靶点(图 2)。
图 2.

“复方中药-有效成分-成分靶点”网络,节点大小及透明度与度值成正比
"Compound Chinese medicine-active ingredient-component target" network, in which the node size and transparency is proportional to the degree value. The green nodes represent traditional Chinese medicine name, pink nodes represent liquorice active components; orange nodes representcassia twig active components; blue nodes represent common active components of liquorice and cassia twig.
2.2. 疾病靶点的获取
从DisGeNET数据库、drugbank数据库及TTD数据库获取心衰靶点,筛选去重后共获得的761个心衰相关靶点。
2.3. 成分靶点-疾病靶点交集获取
将之前827个成分靶点与761个疾病相关靶点导入Venny2.1.0中,得到交集靶点共190个(图 3)。
图 3.
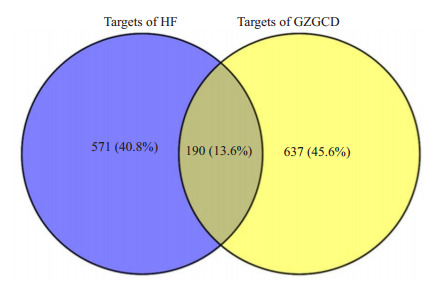
桂枝甘草汤治疗心衰的交集靶点
Intersection target of GZGCD in the treatment of heart failure.
2.4. “复方中药-有效成分-交集靶点-疾病”网络的构建
将上述得到的85种甘草有效成分、6种桂枝有效成分、1种甘草与桂枝共有的有效成分、疾病名称及190个交集靶点导入Cytoscape3.2.1软件,构建“复方中药-有效成分-交集靶点-疾病”网络(图 4)。
图 4.

“复方中药-有效成分-交集靶点-疾病”网络
"Compound Chinese medicine-active ingredient-intersection target-disease" network. The color of the nodes represents Traditional Chinese medicine name (green), active components (pink: liquorice; orange: cassia twig; blue: common active ingredients), disease name (yellow), intersectional targets (purple). Edge: Relationship between traditional Chinese medicine and its composition, composition and the target sites, disease and targets. Degree: Degree of association between the nodes.
2.5. 蛋白互作网络(PPI)的构建及核心靶点的筛选
将827个药物相关靶点与761个疾病相关靶点分别导入Cytoscape软件的Bisogene插件中,构建药物靶点PPI网络及疾病靶点PPI网络(图 5)。应用Cytoscape软件的Merge插件找出药物靶点PPI网络与疾病靶点PPI网络的交集部分,得到的交集网络节点数为8766,边数为199867(图 6)。
图 5.

靶点PPI网络,左侧为心衰PPI网络、右侧为桂枝甘草汤PPI网络
Heart failure PPI network (left) and GZGCD PPI network (right).
图 6.

心衰PPI网络与桂枝甘草汤PPI网络的交集网络
Intersection of the heart failure PPI network with the GZGCD PPI network.
对桂枝甘草汤药物靶点和心衰疾病靶点的交集网络做核心靶点筛选,筛选条件包括Degree值、Betweenness值、Closeness值、LAC值及Neighborhood Connectivity值(图 7)。
图 7.
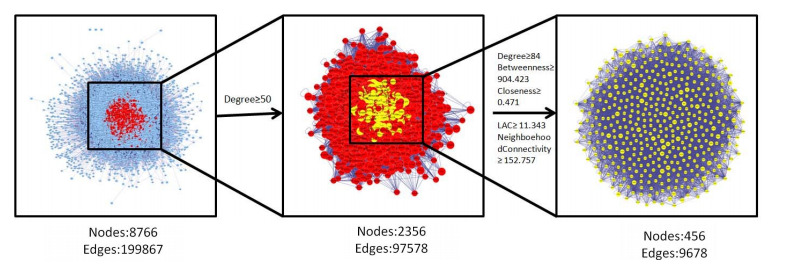
核心靶点筛选流程图
Flow chart of core target selection.
2.6. GO分析及KEGG分析
将190个成分与疾病的交集靶点导入Metascapes数据库中,获得GO分析及KEGG通路分析。
GO分析中筛选出生物过程(BP)、分子功能(MF)和细胞成分(CC)的前20位进行制图(图 8)。BP主要涉及循环系统过程、氮化合物的细胞反应、阳离子稳态、MAPK级联的调节等过程;MF主要涉及磷酸转移酶活性、激酶结合、辅酶绑定、转录因子结合等方面;CC主要涉及膜筏、细胞质核周区、受体复合物、树突等方面。
图 8.

潜在靶点GO富集分析
GO enrichment analysis of the potential targets.
KEGG通路可视化分析共得到38条通路(表 1),主要富集在癌症相关通路、钙信号通路、cGMP-PKG信号通路、cAMP信号通路、胰岛素抵抗等,其中富集程度最高的20条通路(图 9)。
表 1.
潜在靶点KEGG富集分析通路
Potential target KEGG pathway enrichment analysis
| NO. | Pathway | Number of enriched genes | NO. | Pathway | Number of enriched genes |
| 1 | Pathways in cancer | 45 | 20 | Morphine addiction | 9 |
| 2 | Calcium signaling pathway | 31 | 21 | Salivary secretion | 9 |
| 3 | cAMP signaling pathway | 25 | 22 | Bile secretion | 9 |
| 4 | cGMP-PKG signaling pathway | 24 | 23 | Transcriptional misregulation in cancer | 8 |
| 5 | Insulin resistance | 19 | 24 | Tight junction | 8 |
| 6 | Alzheimer disease | 16 | 25 | Steroid hormone biosynthesis | 8 |
| 7 | Toxoplasmosis | 16 | 26 | PPAR signaling pathway | 7 |
| 8 | Serotonergic synapse | 15 | 27 | p53 signaling pathway | 6 |
| 9 | Vascular smooth muscle contraction | 14 | 28 | Arginine and proline metabolism | 6 |
| 10 | Inflammatory mediator regulation of trp channels | 13 | 29 | Amyotrophic lateral sclerosis (ALS) | 6 |
| 11 | Hypertrophic cardiomyopathy | 12 | 30 | Phagosome | 5 |
| 12 | Endocytosis | 11 | 31 | Ovarian steroidogenesis | 5 |
| 13 | Necroptosis | 11 | 32 | Hedgehog signaling pathway | 5 |
| 14 | Renin secretion | 11 | 33 | Protein digestion and absorption | 4 |
| 15 | Alcoholism | 10 | 34 | Complement and coagulation cascades | 4 |
| 16 | Thermogenesis | 9 | 35 | Endocrine and other factor-regulated calcium reabsorption | 4 |
| 17 | Dopaminergic synapse | 9 | 36 | Cytosolic DNA-sensing pathway | 3 |
| 18 | Drug metabolism | 9 | 37 | Glutathione metabolism | 3 |
| 19 | NF-kappa B signaling pathway | 9 | 38 | Phenylalanine metabolism | 3 |
图 9.

潜在靶点KEGG富集分析TOP20
KEGG enrichment analysis of the top 20 potential targets. Left: Bar graph. Right: Bubble map color bias red represents the higher enrichment.
对通路-靶点之间的关系进行可视化分析,其中dgree值较高的依次是PRKCA、PRKCB、MAPK1、MAPK3、MAPK8、BCL2、NFKB1、TNF等(图 10)。
图 10.

“通路-靶点”网络
"Pathway-target" network. Node size is proportional to the degree value, red represents the pathways, and purple represents the targets.
2.7. 体外实验验证
2.7.1. 确定桂枝甘草汤最佳处理时间与浓度
实验结果显示在1 mg/mL组中,12 h组吸光度A450 nm高于1、2、4、8 h组(P < 0.05,图 11)。因此选择1 mg/mL桂枝甘草汤干预12 h进行后续实验。
图 11.

桂枝甘草汤最佳处理时间与浓度的测定
Determination of optimum treatment time and concentration of GZGCD. In 1 mg/mL, *P < 0.05 vs 12 h.
2.7.2. 桂枝甘草汤对戊巴比妥钠诱导的大鼠心衰心肌细胞的影响
按照上述条件进行分组干预培养后,镜下观察,N组细胞形态较好,密度均匀,为梭形心肌细胞;HF组与N组相比,心肌细胞变细并有部分细胞变成圆形,部分细胞已漂浮,密度分布不均,生长状态较差;HF+G组密度分布、细胞形态和生长状态较HF组有明显恢复。CCK8检测结果显示,与N组相比,HF组的细胞活性降低;与HF组相比,HF+G组的细胞活性升高(P < 0.05,图 12)。
图 12.

桂枝甘草汤对戊巴比妥钠诱导的大鼠心衰心肌细胞的影响
Effect of GZGCD on H9C2 cells with heart failure induced by pentobarbital sodium (Original magnification: ×10). *P < 0.05 vs N; #P < 0.05 vs HF. N: Normal group; HF: Heart failure group; HF + G: Heart failure+Guizhi Gancao Decoction.
2.7.3. 桂枝甘草汤对戊巴比妥钠诱导的大鼠心衰心肌细胞中PKCα、ERK1/2、BCL2的蛋白表达量的影响
基于网络药理学分析的结果,选择degree值较高的因子(PKCα和ERK1/2)和与心衰过程密切相关的凋亡相关因子(BCL2)进行Western blot验证,结果显示,HF组PKCα和ERK1/2蛋白相对表达量均高于N组(P < 0.05),HF+G组其相对含量与N组和HF组相比均降低(P < 0.05);HF组BCL2蛋白相对表达量均低于N组(P < 0.05),HF+G组其相对含量与HF组相比明显升高(P < 0.05,图 13)。
图 13.

桂枝甘草汤对戊巴比妥钠诱导的大鼠心衰心肌细胞中PKCα、ERK1/2、BCL2的蛋白表达量的影响
Effects of GZGCD on protein expression of PKC α, ERK1/2 and BCL2 in H9C2 cells with heart failure induced by pentobarbital sodium. *P < 0.05 vs N; †P < 0.05 vs N; #P < 0.05 vs HF.
3. 讨论
桂枝甘草汤中桂枝可温通阳气,炙甘草可益气固本,二者共用有益气温阳的功效[5],主治心阳不足的心悸。中医认为心衰的病性是虚实夹杂,虚为心之气血阴阳亏损,实则由痰、瘀、气滞、水饮引起,治法常有温阳、益气、养阴、活血、化痰、利水等[6]。桂枝甘草汤在现代临床往往应用于治疗以心阳不足为根本病机的心衰、心律失常、冠心病、心血管神经官能症等,但关于桂枝甘草汤的作用机制以及药效物质基础仍然不清楚。本研究运用多个数据库构建桂枝甘草汤药物成分靶点网络,心衰靶点网络,药物成分-疾病靶点交集网络等,并通过GO及KEGG富集分析,来预测桂枝甘草汤治疗心衰的可能靶点。结果证实桂枝甘草汤通过多靶点、多个通路共同作用来改善心衰。我们把桂枝甘草汤的190个“药物成分-疾病”交集靶点进行GO与KEGG分析。在GO分析中,本研究发现这些靶点主要参与循环系统过程、氮化合物的细胞反应、阳离子稳态、MAPK级联的调节、细胞迁移的正向调节、对伤害的反应等。在KEGG分析中,共得到38条富集通路,其中富集程度最高的通路为癌症相关信号通路。循证医学研究已经证实,癌症与心衰具有共同的危险因素(如遗传,生活方式,年龄,感染,毒素和污染),并且也可能相互促进发展进程[12],癌症造成的免疫减退、组织炎症、氧化应激也增高了心血管疾病发生的风险[13]。这与本研究结果相一致,说明心脏疾病与癌症之间存在着双向调节以及共同信号通路的密切联系[14]。
癌症相关通路极其复杂,其中较为重要并已经有相关研究证实与心衰有关的通路有cAMP信号通路、mTOR信号通路、PI3K-Akt信号通路、Jak-STAT信号通路、MAPK信号通路、钙信号通路等。cAMP信号通路是在激活心脏的成纤维细胞中发生纤维化反应的主要调节剂,心脏成纤维细胞的过度激活可能会导致间质纤维化,从而导致心肌舒张功能障碍,发生心衰[15]。mTOR信号通路在氧化应激、线粒体功能及与衰老相关的自噬过程中起到调节作用[16],下调mTOR会造成心肌细胞损害甚至心衰的发生[17]。PI3K-Akt信号通路是参与调控心肌纤维化的重要通路之一,并参与调节细胞凋亡、生长及心肌收缩[18],抑制PI3K-Akt通路会导致心肌纤维化[19]。Jak-STAT信号通路对慢性炎症的调节有着突出的临床意义[20],而炎症与心肌肥大的发生发展关系密切[21]。MAPK信号通路调节多种细胞活动包括增殖,分化,凋亡,存活,炎症和先天免疫[22],可通过调节多个转录因子增加促心肌肥大基因的表达[23]。钙信号通路是心脏收缩功能的基础[24],当其异常时会造成心肌收缩力减弱及心肌的异常生长,加重心衰[25]。此外,本研究还发现,除癌症相关信号通路外,cGMP-PKG信号通路、胰岛素抵抗通路也具有较高的富集程度。既往研究已经发现cGMP-PKG信号通路可调节钙离子浓度影响血管平滑肌的松弛,同时对于心肌肥厚与心室重构也有积极影响[26]。心脏中的葡萄糖和脂肪酸代谢均受到胰岛素信号的调控,因此胰岛素抵抗通路在心衰的发病中也起着至关重要的作用[27]。这是本研究第一次通过网络药理学方法探索桂枝甘草汤对心衰的作用机制,结合上述文献,后续研究正在从PI3K-Akt信号通路和MAPK信号通路中寻找桂枝甘草汤的作用靶点。虽然本研究结果中还有一些富集通路与心衰的关联性仍有待确认,但这些大数据的结果可为我们后续研究桂枝甘草汤的药效物质基础和潜在靶点提供方向。
本研究还进一步进行了通路-靶点分析,degree值较高的靶点前五位依次为PRKCA、PRKCB、MAPK1、MAPK3、MAPK8。PRKCA与PRKCB均属于蛋白激酶C(PKC)家族,PKC广泛存在于心肌细胞中,参与多种细胞信号传导途径,与心血管疾病的演变与发展有着紧密的关系[28]。其中PRKCA介导钙循环通路并会引起肌丝蛋白功能损伤,这是心肌收缩功能减退与心率失常发生发展的关键机制[29];活化的PRKCA可参与心肌细胞纤维化与心衰的发展过程[30]。而PRKCB与免疫反应密切相关,在B细胞中表达很高,与增殖分化有着密切的关系,可以通过调节免疫因素影响心血管疾病的易感性[31];PRKCB还可以促进mTORC1依赖的线粒体重塑与血红素的合成[32]。因此,后续体外验证实验中我们选择了PRKCA(PKCα)作为其中一个因子。结果证实戊巴比妥钠诱导的大鼠心衰心肌细胞中PKCα蛋白表达水平显著增加,而桂枝甘草汤预处理使PKCα蛋白表达水平显著降低。
MAPK1、MAPK3和MAPK8均属于丝裂原活化蛋白激酶(MAPK)家族,MAPK可调控细胞的各种生理病理过程,如细胞凋亡及增殖等[33]。目前已有研究证实,MAPK信号通路与心衰、心肌梗死和心肌肥厚等多种心血管疾病的发生密切相关[20]。MAPK家族中有4个经典MAPK亚族:ERK1/2,JNK,p38 MAPK和ERK5 [34]。本研究结果中degree值较高的靶点MAPK1别名ERK2,MAPK3别名ERK1,ERK1/2是参与细胞增殖、分化、存活与凋亡的关键一环[35, 36],通过影响细胞凋亡、线粒体信号传导、蛋白激酶等途径影响心肌细胞的死亡与损伤[37],因此后续体外验证实验中我们也选择了ERK1/2(MAPK3/1)作为其中一个因子。结果证实戊巴比妥钠诱导的大鼠心衰心肌细胞中ERK1/2蛋白表达水平显著增加,而桂枝甘草汤预处理使ERK1/2蛋白表达水平显著降低。
此外,在本研究中BCL2、NFKB1、TNF也具有较高的degree值。其中BCL2家族的蛋白是多种细胞活动过程中的重要一环,其最主要的功能是调节线粒体完整性和细胞凋亡[38]。BCL2还与线粒体的细胞色素c相关联,可以降低线粒体的细胞色素c分泌,从而对细胞凋亡起到保护作用[39]。考虑到心衰进程与心肌细胞凋亡以及线粒体功能密切相关,因此后续体外验证实验中我们又选择BCL2作为其中一个因子。结果证实戊巴比妥钠诱导的大鼠心衰心肌细胞中BCL2蛋白表达水平显著降低,而桂枝甘草汤预处理使BCL2蛋白表达水平显著增加。
综上所述,本研究采用网络药理学方法,对桂枝甘草汤治疗心衰的作用机制和靶点进行了预测,发现桂枝甘草汤可能通过多靶点、多通路发挥作用治疗心衰。我们的研究虽然是首次借助网络药理学手段在分子水平上证实了桂枝甘草汤对心衰的作用,并系统阐述了其可能的作用机制和靶点。但研究仍然存在一些局限性:其一,生物活性成分的获取是基于现有的数据库和文献,有可能不全面;其二,我们仅选择了3个因子进行体外实验验证,剩下的大部分结果仍有待验证。但本研究再次体现了网络药理学应用于中药复方研究的先进性及科学性,同时进一步为研究桂枝甘草汤的药理机制提供新的思路并为临床应用桂枝甘草汤治疗心衰提供了科学依据。
Biography
赵宇曦,E-mail: 2522201203@qq.com
Funding Statement
国家自然科学基金青年基金(81704041);2021年大连医科大学大学生创新创业训练计划项目(创新类)
Supported by Natural Science Foundation for the Youth (NSFY) of China (81704041)
Contributor Information
赵 宇曦 (Yuxi ZHAO), Email: 2522201203@qq.com.
陈 静 (Jing CHEN), Email: 23081210@qq.com.
References
- 1.Pagliaro BR, Cannata F, Stefanini GG, et al. Myocardial ischemia and coronary disease in heart failure. Heart Fail Rev. 2020;25(1):53–65. doi: 10.1007/s10741-019-09831-z. [DOI] [PubMed] [Google Scholar]
- 2.Tomasoni D, Adamo M, Lombardi C, et al. Highlights in heart failure and transplantation: 2021. ESC Heart Fail. 2019;6(6):1105–27. doi: 10.1002/ehf2.12555. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.王 宙, 周 琳, 刘 洋, et al. 慢性心力衰竭的流行病学研究现状及其防治研究进展. 中国循证心血管医学杂志. 2019;11(8):1022–4. [Google Scholar]
- 4.俞 春林, 杜 正彩, 郝 二伟, et al. 四类不同功效桂枝药对化学成分与药理作用的研究进展. 中国实验方剂学杂志. 2020;26(1):226–34. [Google Scholar]
- 5.朱 华, 秦 丽, 杜 沛霖, et al. 桂枝药理活性及其临床应用研究进展. 中国民族民间医药. 2017;26(22):61–5. [Google Scholar]
- 6.李 冀, 李 想, 曹 明明, et al. 甘草药理作用及药对配伍比例研究进展. 上海中医药杂志. 2019;53(7):83–7. [Google Scholar]
- 7.吴 昱杰, 刘 建勋. 益气活血中药改善慢性心衰心气虚证作用机制研究进展. 中药药理与临床. 2021;37(1):234–9. [Google Scholar]
- 8.李 颖. 仲景方在心阳不振型缓慢性心律失常的临床运用. 实用中医内科杂志. 2020;34(5):31–4. [Google Scholar]
- 9.周 云洁, 高 原, 宋 歌. 桂枝甘草汤联合曲美他嗪对慢性心力衰竭患者的临床疗效. 中成药. 2020;42(5):1187–91. [Google Scholar]
- 10.段 贤春, 黄 石, 彭 代银, et al. 网络药理学在中药复方研究中的应用. 中国药理学通报. 2020;36(3):303–8. [Google Scholar]
- 11.王 强, 杨 静, 修 成奎, et al. 益气温阳活血利水方对戊巴比妥钠诱导的H9C2心肌细胞线粒体自噬的影响. 中国中医药信息杂志. 2020;27(12):43–7. [Google Scholar]
- 12.Pfeffer TJ, Pietzsch S, Hilfiker-Kleiner D. Common genetic predisposition for heart failure and cancer. Herz. 2020;45(7):632–6. doi: 10.1007/s00059-020-04953-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Anker MS, Sanz AP, Zamorano JL, et al. Advanced cancer is also a heart failure syndrome: a hypothesis. J Cachexia Sarcopenia Muscle. 2021;12(3):533–7. doi: 10.1002/jcsm.12694. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Brancaccio M, Pirozzi F, Hirsch E, et al. Mechanisms underlying the cross-talk between heart and cancer. J Physiol. 2020;598(14):3015–27. doi: 10.1113/JP276746. [DOI] [PubMed] [Google Scholar]
- 15.Delaunay M, Osman H, Kaiser S, et al. The role of cyclic AMP signaling in cardiac fibrosis. Cells. 2019;9(1):69–77. doi: 10.3390/cells9010069. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Ana, Sanches-Silva Therapeutic potential of polyphenols in cardiovascular diseases: regulation of mTOR signaling pathway. Pharmacol Res. 2020;152:104626–38. doi: 10.1016/j.phrs.2019.104626. [DOI] [PubMed] [Google Scholar]
- 17.MTORC1 regulates cardiac function and myocyte survival through 4E-BP1 inhibition in mice[J]. J Clin Invest, 2010, 120(10): 103-9.
- 18.Qin WM, Cao LH, Massey IY. Role of PI3K/Akt signaling pathway in cardiac fibrosis. Mol Cell Biochem. 2021;476(11):4045–59. doi: 10.1007/s11010-021-04219-w. [DOI] [PubMed] [Google Scholar]
- 19.Ruth R, Magaye Attenuating PI3K/Akt-mTOR pathway reduces dihydrosphingosine 1 phosphate mediated collagen synthesis and hypertrophy in primary cardiac cells. Int J Biochem Cell Biol. 2021;134:105952–8. doi: 10.1016/j.biocel.2021.105952. [DOI] [PubMed] [Google Scholar]
- 20.Gillian A, Durham Targeting SOCS proteins to control JAK-STAT signalling in disease. Trends Pharmacol Sci. 2019;40(5):298–308. doi: 10.1016/j.tips.2019.03.001. [DOI] [PubMed] [Google Scholar]
- 21.Terrell AM, Crisostomo PR, Wairiuko GM, et al. Jak/STAT/SOCS signaling circuits and associated cytokine-mediated inflammation and hypertrophy in the heart. Shock. 2006;26(3):226–34. doi: 10.1097/01.shk.0000226341.32786.b9. [DOI] [PubMed] [Google Scholar]
- 22.Kim EK, Choi EJ. Compromised MAPK signaling in human diseases: an update. Arch Toxicol. 2015;89(6):867–82. doi: 10.1007/s00204-015-1472-2. [DOI] [PubMed] [Google Scholar]
- 23.Craige SM, Chen K, Blanton RM, et al. JNK and cardiometabolic dysfunction. Biosci Rep. 2019;39(7):BSR20190267–72. doi: 10.1042/BSR20190267. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Sofia, Beghi Gene polymorphisms in calcium-calmodulin pathway: focus on cardiovascular disease. Mutat Res Mutat Res. 2020;786:108325. doi: 10.1016/j.mrrev.2020.108325. [DOI] [PubMed] [Google Scholar]
- 25.Gilbert G, Demydenko K, Dries E, et al. Calcium signaling in cardiomyocyte function. Cold Spring Harb Perspect Biol. 2020;12(3):a035428–34. doi: 10.1101/cshperspect.a035428. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.许 洪彬, 綦 向军, 方 彩珊, et al. 基于网络药理学探讨真武汤治疗慢性心力衰竭的作用机制. 中国现代应用药学. 2020;37(15):1801–11. [Google Scholar]
- 27.Saotome M, Ikoma T, Hasan P, et al. Cardiac insulin resistance in heart failure: the role of mitochondrial dynamics. Int J Mol Sci. 2019;20(14):3552–9. doi: 10.3390/ijms20143552. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.陈 文政, 柏 树令. 蛋白激酶C(PKC)与心衰. 解剖科学进展. 2001;7(2):140–4. [Google Scholar]
- 29.Aslam N. Increase in PKCα activity during heart failure despite the stimulation of PKCα braking mechanism. Int J Mol Sci. 2020;21(7):2561–6. doi: 10.3390/ijms21072561. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.唐 碧, 崔 路遥, 周 静, et al. 蛋白激酶C和半乳糖凝集素-3对心肌纤维化、心力衰竭的影响及作用机制. 华中科技大学学报: 医学版. 2019;48(1):21–5. [Google Scholar]
- 31.Saijo K, Mecklenbräuker I, Santana A, et al. Protein kinase C beta controls nuclear factor kappaB activation in B cells through selective regulation of the IkappaB kinase alpha. J Exp Med. 2002;195(12):1647–52. doi: 10.1084/jem.20020408. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Carlson, Tsui Protein kinase C-β dictates B cell fate by regulating mitochondrial remodeling, metabolic reprogramming, and heme biosynthesis. Immunity. 2018;48(6):1144–59. doi: 10.1016/j.immuni.2018.04.031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Braicu C, Buse M, Busuioc C, et al. A comprehensive review on MAPK: a promising therapeutic target in cancer. Cancers (Basel) 2019;11(10):1618–27. doi: 10.3390/cancers11101618. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Yue JC, López JM. Understanding MAPK signaling pathways in apoptosis. Int J Mol Sci. 2020;21(7):2346–53. doi: 10.3390/ijms21072346. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Guo YJ, Pan WW, Liu SB, et al. ERK/MAPK signalling pathway and tumorigenesis. Exp Ther Med. 2020;19(3):1997–2007. doi: 10.3892/etm.2020.8454. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Zhao Q, Liu F, Zhao Q, et al. Constitutive activation of ERK1/2 signaling protects against myocardial ischemia via inhibition of mitochondrial fragmentation in the aging heart. Ann Transl Med. 2021;9(6):479–89. doi: 10.21037/atm-21-503. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Xu Z, Sun J, Tong Q, et al. The role of ERK1/2 in the development of diabetic cardiomyopathy. Int J Mol Sci. 2016;17(12):2001–13. doi: 10.3390/ijms17122001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Flores-Romero H, García-Sáez AJ. The incomplete puzzle of the BCL2 proteins. Cells. 2019;8(10):1176–89. doi: 10.3390/cells8101176. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Wang Y, Sun H, Zhang JW, et al. Streptozotocin- induced diabetic cardiomyopathy in rats: ameliorative effect of PIPERINE via Bcl2, Bax/Bcl2, and caspase-3 pathways. Biosci Biotechnol Biochem. 2020;84(12):2533–44. doi: 10.1080/09168451.2020.1815170. [DOI] [PubMed] [Google Scholar]


