Abstract
Introducción.
La determinación de bandas oligoclonales (BOC) en el líquido cefalorraquídeo es esencial para el diagnóstico de esclerosis múltiple (EM). El índice kappa es un biomarcador con una sensibilidad y una especificidad comparables a las de las BOC. El objetivo de este trabajo fue estudiar su utilidad y calcular el punto de corte óptimo.
Material y métodos.
Estudio observacional de muestras recibidas en el servicio de inmunología de referencia para Aragón entre enero de 2019 y junio de 2020. Se determinó el valor del índice kappa y el índice IgG. Se trazaron y compararon curvas ROC frente a la detección de BOC y el diagnóstico de EM. Se calcularon valores de sensibilidad y especificidad y el punto de corte óptimo.
Resultados.
Se analizaron 181 pacientes (59,7%, mujeres; edad media, 47,62 ± 17,8 años). El grupo de EM demostró valores estadísticamente superiores de índice kappa (66,62 frente a 0,02; p < 0,001). En el análisis de curvas ROC, el índice kappa demostró un área bajo la curva superior al índice IgG en la detección de BOC+ (0,93 frente a 0,83; p < 0,002) y el diagnóstico de EM (0,91 frente a 0,83; p < 0,021). El punto de corte óptimo del índice kappa para la detección de BOC fue 5,02 (sensibilidad y especificidad, 0,92) y 7,58 para el diagnóstico de EM (sensibilidad, 0,85; especificidad, 0,94).
Conclusiones.
El índice kappa es un biomarcador útil en el diagnóstico de la EM. Su determinación es un proceso automático y rápido, con valores de sensibilidad y especificidad superiores al índice IgG. Todavía se debe llegar a un consenso sobre el punto de corte óptimo para su positividad, si bien, en nuestro medio, un punto de corte de 5,02 parece razonable.
Palabras clave: Bandas oligoclonales, Biomarcador, Enfermedades desmielinizantes, Esclerosis múltiple, Índice kappa, Líquido cefalorraquídeo
Abstract
Introduction.
Detection of oligoclonal bands (OCB) in CSF is essential in the diagnosis of multiple sclerosis (MS). Kappa-index is a promising biomarker, with sensitivity and sensibility values comparable to those of OCB. Our objective was to investigate kappa-index utility in the diagnosis work-up for MS and to determine the optimal cut-off point for our population.
Material and methods.
Observational study of consecutive samples received in the Immunology lab department in a third level hospital between January 2019 to June 2020. Kappa-index and IgG index were measured. ROC analysis for screening of OCB and for diagnosis of MS was conducted. Sensibility, specificity and the optimal cut-off points were determined.
Results.
181 samples were included (59.7% females; age, 47.62 ± 17.8 years). Patients in the EM group presented significantly higher kappa-index level than patients without an EM diagnosis (66.62 versus 0.02; p < 0.001). ROC analysis reported a better area under the curve for the kappa-index than the IgG index for the detection of BOC (0.93 versus 0.83; p < 0.002) and the diagnosis of EM (0.91 versus 0.83; p < 0.021). An optimal cut-off point of 5.02 was determined for the detection of BOC (sensibility and specificity, 0.92) and of 7.58 for the diagnosis of EM (sensibility, 0.85; specificity, 0.94).
Conclusions.
Kappa-index is an useful biomarker in the diagnosis of MS. Its specificity and sensibility are superior to the IgG index. The optimal cut-off point has yet to be determined, but for our population a cut-off of 5.02 seems reasonable.
Key words: Biomarker, Cerebrospinal fluid, Demyelinating diseases, Kappa-index, Multiple sclerosis, Oligoclonal bands
Introducción
La esclerosis múltiple (EM) es una enfermedad crónica inflamatoria desmielinizante del sistema nervioso central que afecta a más de 2,5 millones de personas en el mundo [1,2]. Su diagnóstico es eminentemente clínico y se basa principalmente en la identificación de signos y síntomas neurológicos, y su correlación con lesiones compatibles en la sustancia blanca del sistema nervioso central.
El análisis de líquido cefalorraquídeo (LCR) se realiza de forma rutinaria en el diagnóstico de la EM para descartar otros diagnósticos alternativos y demostrar la síntesis intratecal oligoclonal de inmunoglobulinas, indicando la existencia de una respuesta inmune aberrante en el sistema nervioso central [3,4]. La detección de inmunoglobulina G (IgG) intratecal se puede realizar mediante las bandas oligoclonales (BOC) y el índice IgG. Las BOC IgG están presentes en más del 90% de los pacientes con EM [5,6]. Su detección tanto en el líquido como en el suero se considera actualmente la técnica de elección para el diagnóstico bioquímico de la enfermedad y constituye un predictor de riesgo independiente para la conversión a EM en pacientes con síndrome clínico aislado [2,5-7]. Su papel se ha visto reforzado en la última actualización de los criterios de McDonald en 2017, que permiten, en pacientes con síndrome clínico aislado que cumplen criterios clínicos o radiológicos de diseminación en espacio y BOC positivas, establecer un diagnóstico de EM [2,7].
Sin embargo, la detección de BOC tiene limitaciones. Se trata de una técnica costosa, larga y laboriosa que requiere de personal entrenado y con una lectura dependiente del técnico y del método, sin que haya consenso en la definición de puntos de cortes para la positividad [1,3,8,9]. Por otro lado, para cuantificar la síntesis de IgG intratecal se pueden usar varias fórmulas, y el índice IgG o índice Tibbling-Link es una de las más utilizadas. No obstante, su menor sensibilidad no permite sustituir a las BOC [4].
En la búsqueda de nuevos biomarcadores durante estos últimos años, ha cobrado especial importancia la cuantificación de las cadenas ligeras libres kappa en el LCR y el suero. Constituye un marcador de actividad de células plasmáticas en el LCR, y se ha propuesto como un método alternativo y de apoyo al cálculo del índice IgG y a la detección de BOC. En diversas series, el índice kappa (cadenas kappa en el LCR/cadenas kappa en el suero/albúmina en el LCR/albúmina en suero) ha demostrado valores de sensibilidad y especificidad comparables a las BOC y ser un predictor de conversión a EM en pacientes con síndrome clínico aislado [1,3,4,8,10,11]. Su principal ventaja es que se trata de un proceso automático, rápido y con un resultado cuantificable.
El objetivo de este trabajo es validar la utilidad del índice kappa en el conjunto de muestras recibidas en el servicio de inmunología de referencia en la Comunidad de Aragón, así como dilucidar el punto de corte óptimo en nuestra muestra para la discriminación de BOC y su desempeño diagnóstico como marcador adicional en el diagnóstico de EM.
Material y métodos
Es un estudio observacional retrospectivo de muestras consecutivas recibidas en el Servicio de Inmunología del Hospital Clínico Universitario Lozano Blesa de Zaragoza entre enero de 2019 y junio de 2020. Se analizaron muestras de siete hospitales de la red pública de salud de la Comunidad de Aragón. Se dividió a los pacientes en cuatro grupos diagnósticos: EM, síndrome clínico aislado y síndrome radiológico aislado, otras enfermedades neurológicas inflamatorias y otras enfermedades neurológicas no inflamatorias. Para el diagnóstico de EM y síndrome clínico aislado, se siguieron los criterios de McDonald de 2017 [7]. El síndrome radiológico aislado se diagnosticó según los criterios de Okuda [12,13].
Dos neurólogos independientes clasificaron a los pacientes de forma separada. En el grupo de otras enfermedades neurológicas inflamatorias se incluyó a pacientes con diagnóstico de neuropatías inflamatorias probadas, enfermedades desmielinizantes autoinmunes no EM y enfermedades autoinmunes sistémicas con afectación del sistema nervioso central. En el grupo de otras enfermedades neurológicas no inflamatorias se incluyó a los pacientes con diagnóstico de esclerosis lateral amiotrófica, neuropatías no inflamatorias, migraña e hidrocefalia crónica del adulto, entre otros.
Los niveles de cadenas ligeras libres kappa tanto en el suero como en el LCR se determinaron utilizando el kit Freelite Mx© Kappa latex (The Binding Site Group, Reino Unido) en un análisis turbidimétrico con el sistema Optilite de la misma casa comercial. En los pacientes con niveles de cadenas ligeras libres por debajo de 0,03 mg/dL (límite de detección de la técnica), se asignó un valor empírico de 0,0001 mg/dL. Las concentraciones de albúmina e IgG en el suero y el LCR se realizaron por nefelometría cinética en el equipo IMMAGE 800 de Beckman Coulter. La detección de BOC IgG se llevó a cabo por isoelectroenfoque en gel de agarosa seguido de inmunofijación en la que se usa un anticuerpo anti-IgG acoplado a peroxidasa, en un instrumento semiautomatizado Hydrasys Focusing (Sebia Hispania, España). Dos facultativos especialistas de laboratorio clínico evaluaron los resultados independientemente, dividiendo el patrón de BOC en cinco tipos: a) no se visualizan bandas en el LCR ni en el suero; b) se visualizan bandas IgG en el LCR pero no en el suero; c) se visualizan bandas IgG tanto en el suero como en el LCR, pero con un mayor número de bandas en el LCR; d) patrón oligoclonal idéntico en el LCR y el suero; y e) patrón monoclonal de IgG en el LCR y el suero. La positividad de BOC se considera siempre y cuando se visualicen al menos dos bandas en la muestra de LCR que no se observen en el suero del paciente.
El análisis estadístico se realizó mediante el software R-Studio 2021.09.1 (versión de R: 4.1.2.) con los paquetes ‘tableone’ y ‘pROC’. Las gráficas y tablas se crearon mediante el paquete ofimático Microsoft Office 365 (Microsoft) y los paquetes de R ‘ggplot2’ y ‘ggpubr’. El ajuste de las variables cuantitativas a la distribución normal se estudió mediante la prueba de Shapiro-Wilk y el análisis de gráficos Q-Q. La prueba de χ2 y el test de Fisher se emplearon para la comparación de variables categóricas. En las variables cuantitativas de distribución no normal se empleó el test de la U de Mann-Whitney (dos muestras) y el estadístico de Kruskal-Wallis (más de dos muestras). En las variables cuantitativas de distribución normal se empleó el test de la t de Student (dos muestras) y el método ANOVA (más de dos muestras). El análisis y el trazado de curvas ROC se llevaron a cabo con el paquete de R ‘pROC’. El área bajo la curva se comparó mediante el test de DeLong. El punto de corte óptimo se estimó mediante el índice de Youden, y se calculó la sensibilidad, la especificidad, el valor predictivo positivo y el valor predictivo negativo en dicho punto con un intervalo de confianza al 95% (IC 95%).
Este estudio ha sido aprobado por el Comité de Ética de Investigación de la Comunidad de Aragón con el número de referencia CI-PI20/342.
Resultados
Se analizaron muestras de 181 pacientes (59,7%, mujeres; edad media, 47,62 ± 17,8 años) en el período de enero de 2019 a junio de 2020. Se clasificó a los pacientes en cuatro grupos: 51 (29,14%) con EM, 41 (23,43%) con otras enfermedades neurológicas inflamatorias, 79 (45,14%) con otras enfermedades neurológicas no inflamatorias y cuatro (2,29%) con síndrome clínico aislado/síndrome radiológico aislado (Tabla I).
Tabla I.
División de pacientes en cuatro grupos: esclerosis múltiple (EM), síndrome clínico aislado/síndrome radiológico aislado (CIS/RIS), otras enfermedades neurológicas inflamatorias (ENI) y otras enfermedades neurológicas no inflamatorias (ENNI).
| EM n = 51 | ENI n = 41 | ENNI n = 79 | CIS/RIS n = 4 | Total n = 181 | |
|---|---|---|---|---|---|
| Sexo (femenino) | |||||
|
| |||||
| N (%) | 33 (64,7) | 28 (68,3) | 39 (49,4) | 4 (100) | 108 (59,7) |
|
| |||||
| Edad (años) | |||||
|
| |||||
| Mediana [RIC] | 34 (14-65) | 45 (5-83) | 56 (23-85) | 34,5 (22-45) | 45 (5-86) |
|
| |||||
| BOC+ | |||||
|
| |||||
| N (%) | 49 (96,1) | 12 (29,3) | 11 (13,9) | 3 (75) | 78 (43,1) |
|
| |||||
| Índice IgG | |||||
|
| |||||
| Mediana [RIC] | 0,82 (0,42-3,97) | 0,55 (0,3-3,06) | 0,54 (0,21-3,86) | 0,665 (0,52-0,85) | 0,57 (0,21-3,97) |
|
| |||||
| Índice kappa | |||||
|
| |||||
| Mediana [RIC] | 74,14 (0,02-686,7) | 0,03 (0-197,05) | 0,02 (0-187,79) | 14,22 (0,03-65,33) | 2,4 (0-686,7) |
BOC: bandas oligloconales; RIC: rango intercuartílico.
La comparación del grupo de pacientes con diagnóstico de EM/síndrome clínico aislado frente al grupo control de otras enfermedades neurológicas (otras enfermedades neurológicas inflamatorias/otras enfermedades neurológicas no inflamatorias) proporcionó valores medianos estadísticamente superiores de índice IgG e índice kappa (0,81 frente a 0,55 y 66,62 frente a 0,02, respectivamente; p < 0,001) (Fig. 1). Respecto a las BOC, la proporción de patrón 2 fue significativamente mayor en el grupo de EM que en el grupo control (94,5 frente a 19,17%). En la figura 2 se ofrece la distribución de pacientes con BOC de patrón 2 en los distintos grupos diagnósticos.
Figura 1.
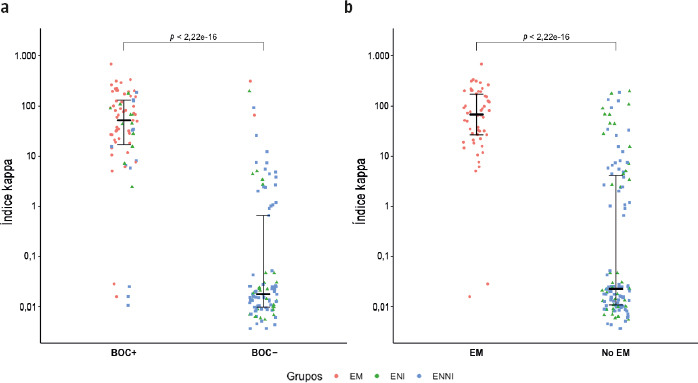
Comparación del índice kappa entre pacientes con bandas oligoclonales positivas y entre el grupo de pacientes con esclerosis múltiple frente al grupo control.
Figura 2.
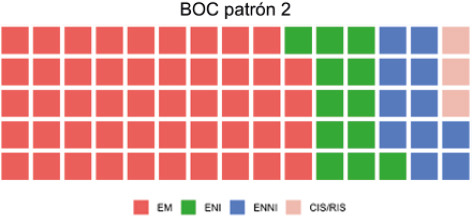
Distribución de los pacientes con bandas oligoclonales de patrón 2 en los distintos grupos.
Para el estudio de la sensibilidad y la especificidad del índice kappa respecto al índice IgG, se trazaron curvas ROC frente a la detección de BOC, así como frente al diagnóstico de EM (Fig. 3). El índice kappa demostró un área bajo la curva significativamente superior a la del índice IgG tanto para la detección de BOC+ (0,93 frente a 0,83), como en el diagnóstico de EM (0,91 frente a 0,83). Estas diferencias fueron estadísticamente significativas (p = 0,002 y p = 0,021, respectivamente).
Figura 3.
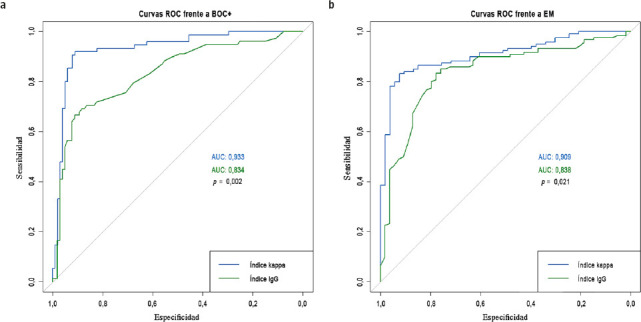
Análisis estadístico de curvas ROC para los índices IgG y kappa en relación con la positividad de las bandas oligoclonales (a) y el rendimiento diagnóstico para la esclerosis múltiple (b).
El punto de corte óptimo del índice kappa para la detección de BOC+ calculado mediante el estadístico J se estimó en 5,02. Se obtuvo una sensibilidad del 0,92 (IC 95%: 0,85-0,97) y una especificidad del 0,92 (IC 95%: 0,86-0,97) (Tabla II). Dichos valores fueron superiores a los obtenidos por el índice IgG, donde el punto de corte de 0,66 otorgaba una sensibilidad de 0,69 (IC 95%: 0,58-0,82) y una especificidad del 0,9 (IC 95%: 0,8-0,96). Para el diagnóstico de EM (Tabla III) se obtuvo un punto de corte del índice kappa de 7,58, con valores de sensibilidad de 0,85 (IC 95%: 0,77-0,93) y de especificidad de 0,94 (IC 95%: 0,89-0,98). Estos resultados fueron nuevamente mayores que los obtenidos por el índice IgG, donde, con un punto de corte óptimo de 0,65, se estimó una sensibilidad de 0,83 (IC 95%: 0,77-0,9) y una especificidad de 0,78 (IC 95%: 0,67-0,89).
Tabla II.
Valores de sensibilidad, especificidad, valor predictivo negativo (VPN) y valor predictivo positivo (VPP) en los distintos puntos de corte del índice kappa en nuestra muestra.
| Detección de BOC | ||||
|---|---|---|---|---|
|
| ||||
| Índice kappa > 3,045 | Índice kappa > 5,02 | Índice kappa > 6,6 | Índice kappa > 7,58 | |
| Sensibilidad | 0,92 | 0,92 | 0,88 | 0,85 |
|
| ||||
| IC 95% | 0,85-0,97 | 0,85-0,97 | 0,8-0,95 | 0,77-0,93 |
|
| ||||
| Especificidad | 0,85 | 0,92 | 0,92 | 0,94 |
|
| ||||
| IC 95% | 0,78-0,91 | 0,86-0,97 | 0,86-0,97 | 0,89-0,98 |
|
| ||||
| VPN | 0,93 | 0,94 | 0,91 | 0,9 |
|
| ||||
| IC 95% | 0,88-0,98 | 0,89-0,98 | 0,86-0,96 | 0,84-0,95 |
|
| ||||
| VPP | 0,82 | 0,89 | 0,89 | 0,92 |
|
| ||||
| IC 95% | 0,76-0,89 | 0,83-0,96 | 0,82-0,96 | 0,85-0,97 |
BOC: bandas oligoclonales; IC 95%: intervalo de confianza al 95%.
Tabla III.
Valores de sensibilidad, especificidad, valor predictivo negativo (VPN) y valor predictivo positivo (VPP) en los distintos puntos de corte del índice kappa en nuestra muestra.
| Diagnóstico de esclerosis múltiple | ||||
|---|---|---|---|---|
|
| ||||
| Índice kappa > 3,045 | Índice kappa > 5,02 | Índice kappa > 6,6 | Índice kappa > 7,58 | |
| Sensibilidad | 0,73 | 0,78 | 0,8 | 0,83 |
|
| ||||
| IC 95% | 0,65-0,81 | 0,71-0,86 | 0,72-0,87 | 0,74-0,9 |
|
| ||||
| Especificidad | 0,96 | 0,96 | 0,92 | 0,94 |
|
| ||||
| IC 95% | 0,91-0,99 | 0,91-0,99 | 0,85-0,98 | 0,87-0,99 |
|
| ||||
| VPN | 0,61 | 0,66 | 0,67 | 0,71 |
|
| ||||
| IC 95% | 0,55-0,69 | 0,59-0,75 | 0,59-0,76 | 0,62-0,81 |
|
| ||||
| VPP | 0,98 | 0,98 | 0,96 | 0,96 |
|
| ||||
| IC 95% | 0,95-0,99 | 0,95-0,99 | 0,92-0,99 | 0,93-0,99 |
IC 95%: intervalo de confianza al 95%.
Discusión
El estudio del líquido cefalorraquídeo constituye un paso muy relevante en el diagnóstico de la EM. Las BOC están consideradas la técnica de referencia para la detección de síntesis intratecal de IgG en pacientes con EM [6], y la revisión de los criterios de McDonald en 2017 las dota de una mayor importancia [7]. Sin embargo, la determinación de BOC es una técnica compleja, dependiente del operador y de difícil estandarización, lo cual influye en su disponibilidad e interpretación. Por este motivo la búsqueda de biomarcadores complementarios, como el índice kappa, se hace fundamental. La utilización de dichos índices posee varias ventajas tanto clínicas como de laboratorio. Su determinación es un proceso automatizado y cuantificable, con menor coste material y temporal, y con una menor variabilidad interoperador en su interpretación. Del mismo modo, mientras que las BOC dan un resultado cualitativo, un índice kappa permite obtener un valor cuantitativo.
Nuestro estudio confirma la utilidad del índice kappa en el proceso diagnóstico de la EM. El índice kappa mostró una alta sensibilidad y especificidad en la detección de BOC y el diagnóstico de EM, resultados que han corroborado múltiples estudios [1,8,9,14,15]. Estos resultados fueron superiores a los obtenidos por el índice IgG, el cual obtuvo valores significativamente menores de área bajo la curva, sensibilidad y especificidad [1,15,16]. La determinación del índice kappa no es un sustituto a la determinación de las BOC, sino una herramienta complementaria en el diagnóstico y un apoyo en la interpretación de éstas. Por una parte, poseer un valor cuantitativo sistematizable resulta de ayuda en las situaciones donde existe incertidumbre sobre el diagnóstico. Pero, además, su alto valor predictivo negativo supone un apoyo a la interpretación de la lectura de las BOC en los casos en los que el patrón pueda generar dudas. Además, en otros estudios se ha visto cómo el índice kappa constituye un marcador precoz de actividad en la enfermedad y un factor de riesgo independiente de conversión de síndrome clínico aislado en la EM [1,3,4,8,10,11]. Un estudio reciente [8,10] aportó evidencia de clase II de cómo en el seguimiento a un año, los pacientes con un evento desmielinizante del sistema nervioso central y un índice kappa superior a 100 tenían el doble de posibilidades de presentar un nuevo evento respecto a los que tenían un índice inferior. Este riesgo se multiplicaba por 4 en el seguimiento a dos años.
Actualmente, el punto de corte óptimo todavía está en discusión. En 2015, Menéndez-Valladares et al [4] marcaron un punto de corte de 10,62 (sensibilidad de 0,93 y especificidad de 0,96). Unos años después, en 2017, Valencia-Vera et al [17] propusieron un punto de corte de 2,91(sensibilidad de 0,84 y especificidad de 0,86) y adicionalmente desarrollaron un algoritmo diagnóstico enfocado al laboratorio. En 2018, el grupo formado por Leurs et al [3], en el estudio multicéntrico más grande hasta la fecha, determinó un punto de corte óptimo de 6,6 (sensibilidad de 0,88 y especificidad de 0,83). Tras esto, en 2019, Reiber et al [16] propusieron un nuevo abordaje en la interpretación de la cadena ligera kappa teniendo en cuenta una función no lineal para determinar la capacidad diagnóstica de este marcador, que generalmente es más sensible, pero menos específico, que la utilización de la positividad de las BOC. En 2020, Vecchio et al [9] llevaron a cabo un estudio para la evaluación de diferentes fórmulas que incluyeran la determinación de las cadenas ligeras kappa y llegaron al resultado de que la mejor ratio sería la utilización del índice kappa, obteniendo un punto de corte de 5 (sensibilidad de 0,93 y especificidad de 0,85). Por último, en 2021, el grupo de investigación de Sanz Díaz et al [14] finalizó su estudio con un punto de corte de 3,045 (sensibilidad de 0,97 y especificidad de 0,86). Más reciente, el grupo de Arrambide et al [18] estudió las concentraciones de índice kappa en una cohorte de pacientes con síndrome clínico aislado y comparó su precisión diagnóstica respecto a las BOC. Los puntos de corte 5,9 y 6,6 del índice kappa demostraron una precisión superior a los de las BOC para el diagnóstico de EM y el riesgo de conversión de síndrome clínico aislado a EM. En el mismo trabajo, los autores proponen una modificación de los criterios de McDonald, equiparando el índice a las BOC, lo que permite en los pacientes que cumplan criterios de diseminación en el espacio e índice kappa positivo llegar a un diagnóstico de EM.
Nuestros resultados, con un punto de corte de 5,02 (sensibilidad de 0,92 y especificidad de 0,92), no se alejan, por lo tanto, de los trabajos previos, e incluso poseen una especificidad ligeramente superior. En esta línea, los últimos estudios parecen apuntar a que, una vez que se alcanza un punto de corte igual o superior a 5, las diferencias en sensibilidad y especificidad se minimizan [18,19]. Del mismo modo, al tratarse de una cuantificación continua, el punto de corte puede elegirse en función de la sensibilidad y la especificidad que se busquen. En las tablas II y III observamos una comparativa de los distintos valores de sensibilidad y especificidad en nuestra muestra para los distintos puntos de corte estimados, así como para los obtenidos en otros trabajos [3,14].
La principal limitación de nuestro estudio es la heterogeneidad del grupo control, con una menor proporción de sujetos estrictamente sanos o controles no inflamatorios respecto a otros trabajos. Esta situación podría influir de forma negativa en la especificidad de los biomarcadores estudiados y en los valores de corte estimados. No obstante, también resulta una fortaleza. Al haber realizado el análisis sobre una muestra derivada de la práctica clínica diaria, los resultados son más representativos de la realidad asistencial del laboratorio y de los servicios de neurología de nuestra comunidad.
En conclusión, el índice kappa es un biomarcador sensible y útil en el diagnóstico de la EM. Se trata de un proceso automático, rápido y con un resultado cuantificable, cuyas sensibilidad y especificidad son superiores a las del índice IgG. Constituye un factor de riesgo independiente de conversión de síndrome clínico aislado en la EM, y su punto de corte puede utilizarse para optimizar el protocolo de laboratorio. Todavía se debe llegar a un consenso sobre el punto de corte óptimo para su positividad, si bien cada vez más trabajos y laboratorios clínicos han acotado los límites en distintas poblaciones. En nuestro medio, un punto de corte de 5,02 parece muy razonable.
Agradecimientos:
A Jesús Martín Martínez por sus consejos y ayuda en la redacción y revisión del manuscrito final.
Funding Statement
Financiación: Los reactivos Freelite fueron aportados por The Binding Site, libres de costes.
Bibliografía
- 1.Crespi I, Vecchio D, Serino R, Saliva E, Virgilio E, Sulas MG, et al. Kappa index is a reliable marker of intrathecal synthesis, and an alternative to igG index in multiple sclerosis diagnostic work-up. J Clin Med 2019;8:446. [DOI] [PMC free article] [PubMed]; Crespi I, Vecchio D, Serino R, Saliva E, Virgilio E, Sulas MG, et al. Kappa index is a reliable marker of intrathecal synthesis, and an alternative to igG index in multiple sclerosis diagnostic work-up. J Clin Med. 2019;8:446. doi: 10.3390/jcm8040446. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Lo Sasso B, Agnello L, Bivona G, Bellia C, Ciaccio M. Cerebrospinal fluid analysis in multiple sclerosis diagnosis:an update. Medicina (Mex) 2019;55:245. [DOI] [PMC free article] [PubMed]; Lo Sasso B, Agnello L, Bivona G, Bellia C, Ciaccio M. Cerebrospinal fluid analysis in multiple sclerosis diagnosis:an update. Medicina (Mex) 2019;55:245. doi: 10.3390/medicina55060245. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Leurs C, Twaalfhoven H, Lissenberg-Witte B, van Pesch V, Dujmovic I, Drulovic J, et al. Kappa free light chains is a valid tool in the diagnostics of MS:a large multicenter study. Mult Scler J 2020;26:912-23. [DOI] [PMC free article] [PubMed]; Leurs C, Twaalfhoven H, Lissenberg-Witte B, van Pesch V, Dujmovic I, Drulovic J, et al. Kappa free light chains is a valid tool in the diagnostics of MS:a large multicenter study. Mult Scler J. 2020;26:912–23. doi: 10.1177/1352458519845844. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Menéndez-Valladares P, García-Sánchez M, Cuadri-Benítez P, Lucas M, Adorna-Martínez M, Carranco-Galán V, et al. Free kappa light chains in cerebrospinal fluid as a biomarker to assess risk conversion to multiple sclerosis. Mult Scler J Exp Transl Clin 2015;1:205521731562093. [DOI] [PMC free article] [PubMed]; Menéndez-Valladares P, García-Sánchez M, Cuadri-Benítez P, Lucas M, Adorna-Martínez M, Carranco-Galán V, et al. Free kappa light chains in cerebrospinal fluid as a biomarker to assess risk conversion to multiple sclerosis. Mult Scler J Exp Transl Clin. 2015;1:205521731562093. doi: 10.1177/2055217315620935. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Menéndez-Valladares P, García-Sánchez MI, Adorna-Martínez M, García-de Veas Silva JL, Bermudo-Guitarte C, Izquierdo-Ayuso G. Validation and meta-analysis of kappa index biomarker in multiple sclerosis diagnosis. Autoimmun Rev 2019;18:43-9. [DOI] [PubMed]; Menéndez-Valladares P, García-Sánchez MI, Adorna-Martínez M, García-de Veas Silva JL, Bermudo-Guitarte C, Izquierdo-Ayuso G. Validation and meta-analysis of kappa index biomarker in multiple sclerosis diagnosis. Autoimmun Rev. 2019;18:43–9. doi: 10.1016/j.autrev.2018.07.010. [DOI] [PubMed] [Google Scholar]
- 6.Arrambide G, Tintore M, Espejo C, Auger C, Castillo M, Río J, et al. The value of oligoclonal bands in the multiple sclerosis diagnostic criteria. Brain 2018;141:1075-84. [DOI] [PubMed]; Arrambide G, Tintore M, Espejo C, Auger C, Castillo M, Río J, et al. The value of oligoclonal bands in the multiple sclerosis diagnostic criteria. Brain. 2018;141:1075–84. doi: 10.1093/brain/awy006. [DOI] [PubMed] [Google Scholar]
- 7.Thompson AJ, Banwell BL, Barkhof F, Carroll WM, Coetzee T, Comi G, et al. Diagnosis of multiple sclerosis:2017 revisions of the McDonald criteria. Lancet Neurol 2018;17:162-73. [DOI] [PubMed]; Thompson AJ, Banwell BL, Barkhof F, Carroll WM, Coetzee T, Comi G, et al. Diagnosis of multiple sclerosis:2017 revisions of the McDonald criteria. Lancet Neurol. 2018;17:162–73. doi: 10.1016/S1474-4422(17)30470-2. [DOI] [PubMed] [Google Scholar]
- 8.Hegen H, Berek K, Deisenhammer F. Cerebrospinal fluid kappa free light chains as biomarker in multiple sclerosis –from diagnosis to prediction of disease activity. Wien Med Wochenschr 2022 [Online ahead of print]. [DOI] [PMC free article] [PubMed]; Hegen H, Berek K, Deisenhammer F. Cerebrospinal fluid kappa free light chains as biomarker in multiple sclerosis –from diagnosis to prediction of disease activity. Wien Med Wochenschr. 2022 doi: 10.1007/s10354-022-00912-7. [Online ahead of print] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Vecchio D, Bellomo G, Serino R, Virgilio E, Lamonaca M, Dianzani U, et al. Intrathecal kappa free light chains as markers for multiple sclerosis. Sci Rep 2020;10:20329. [DOI] [PMC free article] [PubMed]; Vecchio D, Bellomo G, Serino R, Virgilio E, Lamonaca M, Dianzani U, et al. Intrathecal kappa free light chains as markers for multiple sclerosis. Sci Rep. 2020;10:20329. doi: 10.1038/s41598-020-77029-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Berek K, Bsteh G, Auer M, Di Pauli F, Grams A, Milosavljevic D, et al. Kappa-free light chains in CSF predict early multiple sclerosis disease activity. Neurol Neuroimmunol Neuroinflammation 2021;8:e1005. [DOI] [PMC free article] [PubMed]; Berek K, Bsteh G, Auer M, Di Pauli F, Grams A, Milosavljevic D, et al. Kappa-free light chains in CSF predict early multiple sclerosis disease activity. Neurol Neuroimmunol Neuroinflammation. 2021;8:e1005. doi: 10.1212/NXI.0000000000001005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Rathbone E, Durant L, Kinsella J, Parker AR, Hassan-Smith G, Douglas MR, et al. Cerebrospinal fluid immunoglobulin light chain ratios predict disease progression in multiple sclerosis. J Neurol Neurosurg Psychiatry 2018;89:1044-9. [DOI] [PMC free article] [PubMed]; Rathbone E, Durant L, Kinsella J, Parker AR, Hassan-Smith G, Douglas MR, et al. Cerebrospinal fluid immunoglobulin light chain ratios predict disease progression in multiple sclerosis. J Neurol Neurosurg Psychiatry. 2018;89:1044–9. doi: 10.1136/jnnp-2018-317947. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Okuda DT, Mowry EM, Beheshtian A, Waubant E, Baranzini SE, Goodin DS, et al. Incidental MRI anomalies suggestive of multiple sclerosis:the radiologically isolated syndrome. Neurology 2009;72:800-5. [DOI] [PubMed]; Okuda DT, Mowry EM, Beheshtian A, Waubant E, Baranzini SE, Goodin DS, et al. Incidental MRI anomalies suggestive of multiple sclerosis:the radiologically isolated syndrome. Neurology. 2009;72:800–5. doi: 10.1212/01.wnl.0000335764.14513.1a. [DOI] [PubMed] [Google Scholar]
- 13.Lebrun-Frenay C, Kantarci O, Siva A, Sormani MP, Pelletier D, Okuda DT, et al. Radiologically isolated syndrome:10-year risk estimate of a clinical event. Ann Neurol 2020;88:407-17. [DOI] [PubMed]; Lebrun-Frenay C, Kantarci O, Siva A, Sormani MP, Pelletier D, Okuda DT, et al. Radiologically isolated syndrome:10-year risk estimate of a clinical event. Ann Neurol. 2020;88:407–17. doi: 10.1002/ana.25799. [DOI] [PubMed] [Google Scholar]
- 14.Sanz-Diaz CT, de las Heras-Flórez S, Carretero-Pérez M, Hernández-Pérez MÁ, Martín-García V. Evaluation of kappa index as a tool in the diagnosis of multiple sclerosis:implementation in routine screening procedure. Front Neurol 2021;12:676527. [DOI] [PMC free article] [PubMed]; Sanz-Diaz CT, de las Heras-Flórez S, Carretero-Pérez M, Hernández-Pérez MÁ, Martín-García V. Evaluation of kappa index as a tool in the diagnosis of multiple sclerosis:implementation in routine screening procedure. Front Neurol. 2021;12:676527. doi: 10.3389/fneur.2021.676527. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Hegen H, Walde J, Milosavljevic D, Aboulenein-Djamshidian F, Senel M, Tumani H, et al. Free light chains in the cerebrospinal fluid. Comparison of different methods to determine intrathecal synthesis. Clin Chem Lab Med 2019;57:1574-86. [DOI] [PubMed]; Hegen H, Walde J, Milosavljevic D, Aboulenein-Djamshidian F, Senel M, Tumani H, et al. Free light chains in the cerebrospinal fluid. Comparison of different methods to determine intrathecal synthesis. Clin Chem Lab Med. 2019;57:1574–86. doi: 10.1515/cclm-2018-1300. [DOI] [PubMed] [Google Scholar]
- 16.Reiber H, Zeman D, KušnierováP, Mundwiler E, Bernasconi L. Diagnostic relevance of free light chains in cerebrospinal fluid –The hyperbolic reference range for reliable data interpretation in quotient diagrams. Clin Chim Acta 2019;497:153-62. [DOI] [PubMed]; Reiber H, Zeman D, Kušnierová P, Mundwiler E, Bernasconi L. Diagnostic relevance of free light chains in cerebrospinal fluid –The hyperbolic reference range for reliable data interpretation in quotient diagrams. Clin Chim Acta. 2019;497:153–62. doi: 10.1016/j.cca.2019.07.027. [DOI] [PubMed] [Google Scholar]
- 17.Valencia-Vera E, Martinez-Escribano Garcia-Ripoll A, Enguix A, Abalos-Garcia C, Segovia-Cuevas MJ. Application of κfree light chains in cerebrospinal fluid as a biomarker in multiple sclerosis diagnosis:development of a diagnosis algorithm. Clin Chem Lab Med 2018;56:609-13. [DOI] [PubMed]; Valencia-Vera E, Martinez-Escribano Garcia-Ripoll A, Enguix A, Abalos-Garcia C, Segovia-Cuevas MJ. Application of κfree light chains in cerebrospinal fluid as a biomarker in multiple sclerosis diagnosis:development of a diagnosis algorithm. Clin Chem Lab Med. 2018;56:609–13. doi: 10.1515/cclm-2017-0285. [DOI] [PubMed] [Google Scholar]
- 18.Arrambide G, Espejo C, Carbonell-Mirabent P, Dieli-Crimi R, Rodríguez-Barranco M, Castillo M, et al. The kappa free light chain index and oligoclonal bands have a similar role in the McDonald criteria. Brain 2022;[Online ahead of print]. [DOI] [PubMed]; Arrambide G, Espejo C, Carbonell-Mirabent P, Dieli-Crimi R, Rodríguez-Barranco M, Castillo M, et al. The kappa free light chain index and oligoclonal bands have a similar role in the McDonald criteria. Brain. 2022 doi: 10.1093/brain/awac220. [Online ahead of print] [DOI] [PubMed] [Google Scholar]
- 19.Gaetani L, Di Carlo M, Brachelente G, Valletta F, Eusebi P, Mancini A, et al. Cerebrospinal fluid free light chains compared to oligoclonal bands as biomarkers in multiple sclerosis. J Neuroimmunol 2020;339:577108. [DOI] [PubMed]; Gaetani L, Di Carlo M, Brachelente G, Valletta F, Eusebi P, Mancini A, et al. Cerebrospinal fluid free light chains compared to oligoclonal bands as biomarkers in multiple sclerosis. J Neuroimmunol. 2020;339:577108. doi: 10.1016/j.jneuroim.2019.577108. [DOI] [PubMed] [Google Scholar]


