RESUMEN
La amiloidosis cardíaca (AC) es una forma de cardiomiopatía caracterizada por el depósito extracelular de fibrillas de proteínas en el miocardio, lo que produce insuficiencia cardíaca, arritmias y alteraciones en el sistema de conducción eléctrica. La mayoría de las cardiomiopatías tienen una estrecha relación con las alteraciones del ritmo cardiaco, en especial la AC que está asociada a diferentes formas de arritmias, incluso en fases previas al diagnóstico. Arritmias como la fibrilación auricular se observan hasta en el 70% de los pacientes con AC asociadas a un especial riesgo de complicaciones cardioembólicas independiente de la estratificación de riesgo. Las arritmias ventriculares son frecuentes; sin embargo, la colocación del cardiodesfibrilador implantable no ha demostrado mejorar la sobrevida. La enfermedad del sistema de conducción eléctrica también es común, y con frecuencia es necesario implantar un marcapaso definitivo, incluso en pacientes asintomáticos. En esta revisión delimitamos las recomendaciones de las guías más recientes, resumimos datos históricos y contemporáneos, y describimos estrategias basadas en evidencia para el manejo de arritmias y sus secuelas en la AC.
Palabras clave: Amiloidosis, Arritmias Cardíacas, Electrofisiología
ABSTRACT
Cardiac amyloidosis (CA) is a form of cardiomyopathy characterized by the extracellular deposit of protein fibers in the myocardium, leading to the development of heart failure, arrhythmias, and electrical conduction system alterations. It is known that most cardiomyopathies have a close relationship with heart rhythm abnormalities, however, CA is specially related to different kinds of arrhythmias even in pre-diagnosis stages. Arrhythmias like atrial fibrillation are present in up to 70% of patients with CA associated with a high risk of cardioembolic complications independent of the risk stratification. Ventricular arrhythmias are frequent, but the use of implantable cardioverter defibrillator has not been demonstrated to improve survival. The Atrial-Ventricular node disease is also common, and is frequently associated with the implantation of a pacemaker, even in asymptomatic patients. In this review, we clarify the recommendations of the most current guidelines, summarize historical and contemporaneous data and describe evidence-based strategies for the management of arrhythmias and their complications in CA.
Keywords: Amyloidosis; Arrythmias, Cardiac; Electrophysiology
INTRODUCCIÓN
En el libro IV de la Metamorfosis de Ovidio se describe cómo Perseo «petrifica» a sus enemigos utilizando la cabeza de Medusa. Incluso Atlas, el Titán condenado por Zeus a sostener la bóveda celeste por la eternidad, fue convertido en una montaña al no rendir honores al semidios 1. (Figura 1). ¿Es la amiloidosis cardiaca (AC) una cardiomiopatía que «petrifica» el corazón, una continuación de la impulsividad del héroe griego, o una clase magistral de fisiología que muestra como un órgano degenera en el tiempo, producto de una alteración en su propia naturaleza?
Figura 1. Perseo contra Fineo. Luca Giodano (1634-1705). Galería Nacional de Londres.

La AC se caracteriza por el depósito extracelular de fibrillas de proteínas a través de diferentes órganos 2. Cuando afecta al miocardio con frecuencia puede provocar cardiomiopatía restrictiva. Aproximadamente 95% de las AC son por transtirretina (ATTR) o por cadenas ligeras de inmunoglobulinas (AL) 3. El grupo ATTR se caracteriza por mal plegado de transtirretina, una proteína producida en el hígado. Se han descrito dos formas clínicas de ATTR: natural wild-type (ATTRwt) y la hereditaria (ATTRh). La prevalencia de la ATTRwt se estima entre 5,5 y 16% en las personas mayores de 80 años, mientras que la ATTRh es más rara, y la prevalencia estimada depende de las mutaciones genéticas específicas. La amiloidosis AL es un desorden proliferativo clonal de células plasmáticas caracterizado por producción de fibrillas de proteínas anormales en la médula ósea. La prevalencia estimada de la amiloidosis AL en Estados Unidos va desde 15,5 a 40,5 casos por millón 4. Las tendencias muestran un incremento en el número de diagnósticos de ATTR en los últimos 10 años, lo que sugiere que las estimaciones sobre la carga de la enfermedad subestiman la verdadera prevalencia de miocardiopatía amiloide 5.
Además de insuficiencia cardíaca (IC), estudios han demostrado alta incidencias de arritmias, incluyendo fibrilación auricular (FA), arritmias supraventriculares, arritmias ventriculares y enfermedad del sistema de conducción eléctrico en pacientes con cardiomiopatía AL y ATTR 6-9. Estas arritmias con frecuencia son muy sintomáticas, mal toleradas y pueden necesitar tratamiento inmediato e individualizado.
EL ELECTROCARDIOGRAMA (ECG) EN LA AMILOIDOSIS CARDÍACA
Una de las características más importantes por considerar en la evaluación del ECG del paciente con AC es que la presencia de un ECG normal es muy rara. De hecho, el ECG normal se observa como máximo en el 10% de casos.
Diferentes patrones electrocardiográficos han sido descritos en los tipos de amiloidosis, entre los más frecuentes se encuentra el bajo voltaje del QRS, patrones tipo pseudoinfarto en derivadas precordiales anteriores y/o de extremidades y anormalidades de la conducción como bloqueos de rama o bloqueos de la conducción aurículoventricular (AV) de diferente grado. Probablemente el hallazgo más frecuente es la presencia de ondas Q patológicas (pseudoinfarto) en ausencia de enfermedad coronaria, Dubrey et al. la describen hasta en el 52% de los pacientes con el tipo AL 10.
Como en otras formas de cardiomiopatías, la amiloidosis se asocia con alteraciones en la amplitud de voltaje del QRS, los complejos de bajo voltaje (QRSb) (definidos como: amplitud del QRS < 5 mm en derivades de extremidades y/o < 10 mm en derivadas precordiales) 11, son observados con más frecuencia en las derivadas de extremidades (35% en AL, 37% ATTRh y 18% en la ATTRwt) en comparación con las derivadas precordiales (15% en AL, 10% ATTRh y 6%ATTRwt) 12) (Figura 2). Kristen et al. encontraron que la presencia de QRSb está asociada con la disminución de la sobrevida en las diferentes formas de amiloidosis 13.
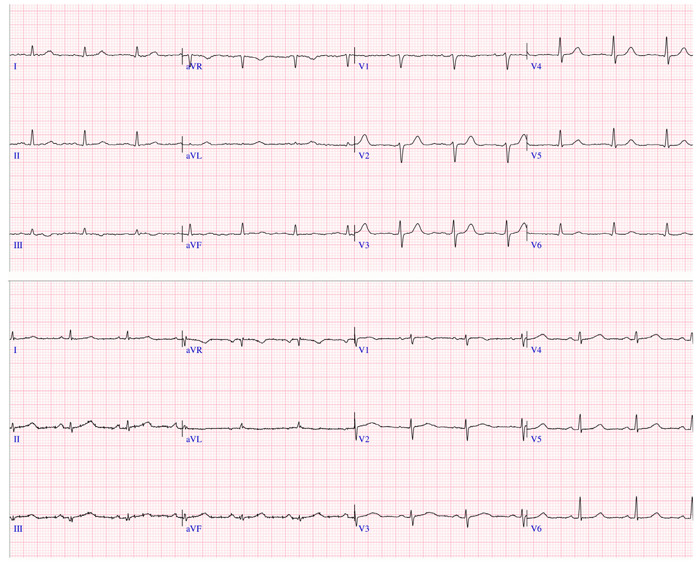
Figura 2. Electrocardiograma en amiloidosis cardiaca. A: varón de 70 años con ATTR en ECG presenta ritmo sinusal con onda P difícil de identificar, complejos QRS de baja amplitud en 10 de 12 derivadas. B: paciente mujer de 64 años con ATTR con variación patogénica p.Val50Met en ECG presenta ritmo sinusal y complejos QRS de baja amplitud en todas las derivadas, ondas q en derivadas DIII y aVF. Fondo docente Dr. Jorge Salinas-Arce.
Un concepto importante es la observación de los cambios en el tiempo, el ensanchamiento del QRS o la aparición de bloqueos de rama obligan al evaluador a un seguimiento cercano por el riesgo de bloqueo AV (Figura 3).
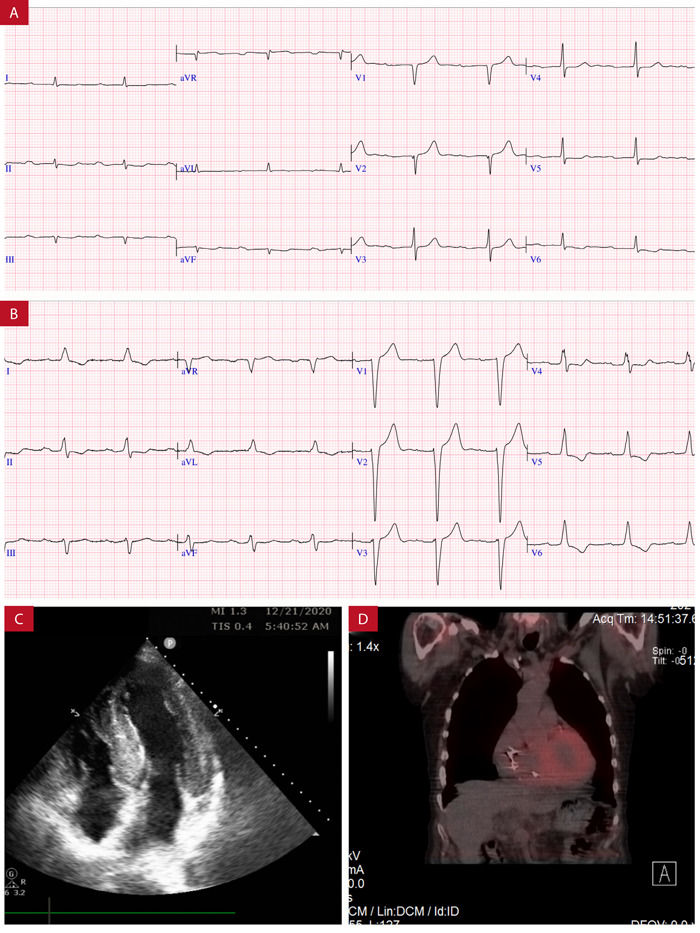
Figura 3. Electrocardiograma evolutivo en un periodo de 3 años en paciente varón de 80 años con ATTRh que evolucionó con BAV completo y fibrilación auricular. A: ECG en el 2017 presenta ritmo sinusal con onda P: 140 ms PR: 380 ms y QRS: 100 ms. B: ECG en el 2020 presenta ritmo sinusal con onda P: 160 ms PR: 300 ms QRS: 140 ms (bloqueo completo de rama izquierda). C: ecocardiografía con septum interventricular 18 mm con fisiología restrictiva. D: imagen SPECT con captación de pirofosfato a nivel del músculo cardiaco (sombra roja). Fondo docente Dr. Jorge Salinas-Arce.
ARRITMIAS AURICULARES
a. Patogénesis
El origen de las arritmias en esta población es multifactorial. Se ha demostrado que el depósito de fibrilla amiloide e infiltración del miocardio generan incremento del grosor parietal auricular y ventricular, alteraciones en la relajación y llenado restrictivo. Las presiones de llenado elevadas llevan a dilatación auricular, predisponiendo a FA y otras arritmias auriculares. Además, se cree que el depósito de amiloide en las aurículas promueve remodelado estructural y fibrosis miocárdica, sustrato para el desarrollo de FA 14,15.
b. Prevalencia
Las arritmias auriculares son más prevalentes en la AC que en la población general. La prevalencia global de FA reportada por Sanchis et al. en una población de 238 pacientes con AC fue del 44%, notoriamente superior a la prevalencia estimada de FA del 1% en la comunidad 6. En aquellos con ATTRwt, el 71% tuvieron FA, frente al 20% encontrado en el grupo con el tipo ATTRh. Longhi et al. documentaron la presencia de FA en 15% de 262 pacientes con AC. La FA se detectó en 40% de los pacientes con ATTRwt comparado con 9% de los pacientes AL y 11% del grupo ATTRh 16. Para explicar la mayor proporción de FA en el grupo ATTRwt, los autores señalan que estos tienen, a diferencia de los subtipos AL o ATTRh, mayor edad avanzada, son del sexo masculino, y mayor evolución a falla cardiaca, lo que incrementa su riesgo.
Recientemente se ha demostrado la utilidad del monitoreo electrocardiográfico ambulatorio en la identificación de FA/flutter auricular en una cohorte de 84 pacientes con ATTR. Si bien la frecuencia de FA fue similar a lo descrito anteriormente (73%); se evidenció que la tercera parte fueron FA de novo predominantemente asintomáticos, siendo identificados únicamente por el monitoreo ambulatorio. Esta estrategia condujo a mayores tasas de anticoagulación 17) (Figura 4).
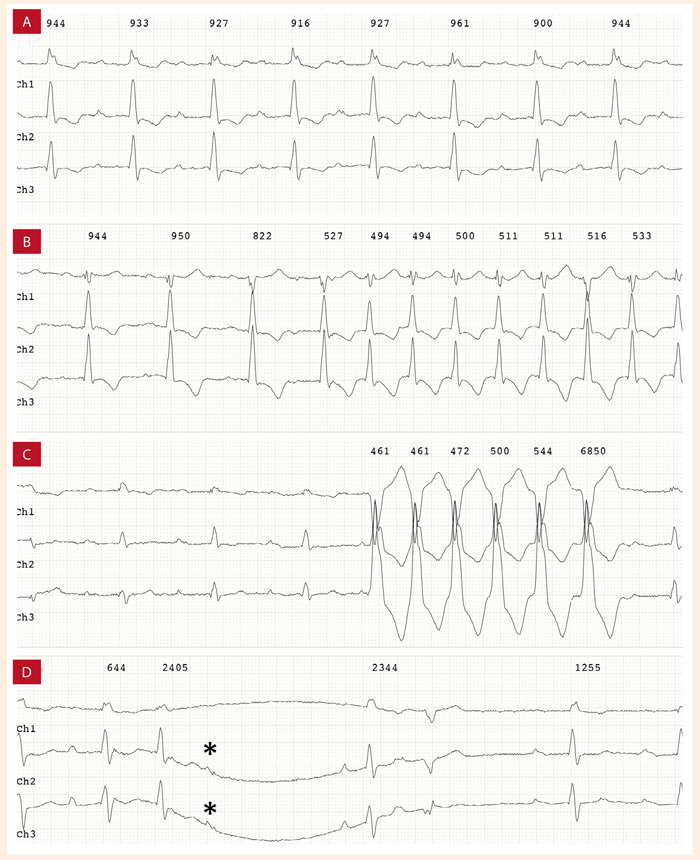
Figura 4. Arritmias auriculares en paciente varón de 68 años con ATTRh. Monitorización electrocardiográfica ambulatoria A: ritmo sinusal con BAV I y PR 360 ms. B: taquicardia auricular no sostenida. C: taquicardia ventricular no sostenida. D: bloqueo auricular ventricular y pausa, onda P bloqueada (flecha negra) Fondo docente Dr. Jorge Salinas-Arce.
En una cohorte de 133 pacientes con AC de un centro terciario, la frecuencia de FA se correlacionó linealmente con el estadio de la enfermedad en el tipo ATTR, encontrándose en el 47% de los casos en estadio I y en 94% durante los estadios más avanzados, estos hallazgos van acorde con la naturaliza evolutiva del remodelado anatómico y eléctrico atrial. No obstante, en el tipo AL, la FA se observó en el 40% de los casos en estadio II y en el 18% de aquellos en el estadio IIIb. Por lo que la investigación de FA en todas las fases de la enfermedad debiera formar parte del seguimiento rutinario, aunque la frecuencia y el tipo de monitoreo aún no está sustentada por estudios prospectivos 18.
En una población latina con amiloidosis sistémica se describió el compromiso cardiaco en el 83%, apenas el 5% tuvieron palpitaciones como síntoma principal, sin embargo, hasta el 20% no se encontraron en ritmo sinusal. Se documentó FA en el 7% de los casos de ATTRh y en el 38,5% de los tipos ATTRwt, siendo cifras superiores a la media poblacional, pero inferiores a lo documentados en la literatura internacional. Así, los autores sugieren que, en un contexto clínico apropiado, la AC debería considerarse en el diagnóstico diferencial en pacientes con arritmias sin causas aparente 19.
Se han encontrado predictores de FA que incluyen el subtipo ATTRwt, la tasa de filtración glomerular disminuida y el aumento del índice de masa corporal. Dale et al. plantean algunos signos de sospecha de AC en pacientes con FA que incluyen: edad ≥ 65 años, bajo voltaje del QRS, grosor parietal del ventrículo izquierdo ≥ 12 mm, FA/flutter recurrente a pesar de tratamiento farmacológico, alteraciones en la conducción concomitante, síndrome del túnel del carpo en edad avanzada y neuropatía inexplicable 18) (Figura 5).
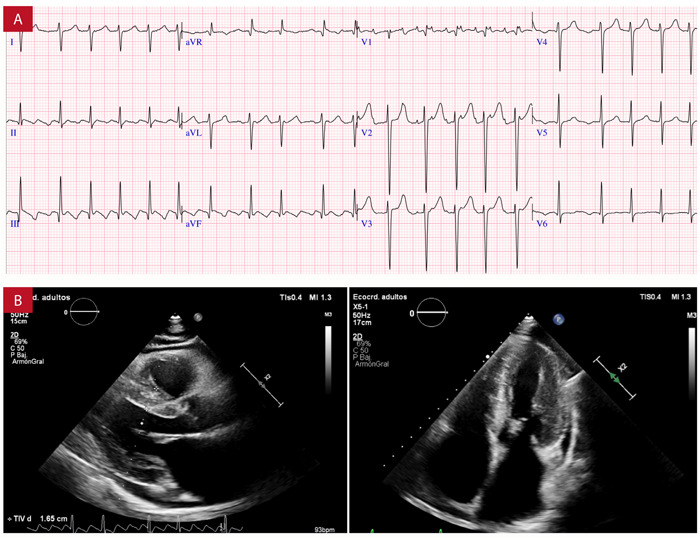
Figura 5. Varón de 69 años con diagnóstico de AC ingresa por emergencia con disnea y taquicardia. A: flutter auricular (FF: 220 ms) con bloqueo AV variable. B: ecocardiografía con aurícula izquierda dilatada en grado severo (Vol. AI index: 49 mL/m2), septum 17 mm, FEVI 52% y derrame pericárdico 5 - 7 mm. Luego de 3 meses de evolución presenta fibrilación auricular persistente. Fondo docente Dr. Jorge Salinas-Arce.
c. Riesgo de enfermedad cerebrovascular (EC) y anticoagulación
La AC se ha asociado con mayor riesgo de trombos intracardiacos, EC y embolismo sistémico en comparación con la población general. La infiltración amiloide que involucra ambas aurículas se ha sugerido como mecanismo fisiopatológico que origina disminución de la contractilidad auricular, estasis sanguínea, disfunción endotelial, e hipercoagulabilidad que predisponen a la formación de trombos. Una serie de 324 pacientes con AC, basado en hallazgos de resonancia magnética, encontró trombos intracavitarios en el 1,1% de pacientes con ATTRh y hasta un 4,5% en la variante ATTRwt, en el 90% de los casos ubicados en la orejuela de aurícula izquierda, estos resultados evidencian la subestimación de trombos que se espera en la práctica clínica ordinaria en pacientes en ritmo sinusal basado en estudios ecocardiográficos convencionales 20) (Figura 6).
Figura 6. Paciente varón con diagnóstico de amiloidosis cardiaca AL que evoluciona en forma rápida a deterioro clínico con insuficiencia cardiaca refractaria. A: ECG con flutter auricular con ciclo FF 200 ms y complejos QRS de bajo voltaje en derivadas inferiores. B: ETE con trombo que ocupa la totalidad de la orejuela izquierda (flecha blanca). C: eje largo de ecocardiografía muestra septum interventricular 16 mm con incremento de la refringencia y pared libre del VD en 9 mm D: ECG posreversión espontánea con ritmo sinusal con ondas Q en derivadas inferiores y progresión anormal de R en precordiales en. Cortesía Dra. Ana Cecilia Gonzales y Unidad de Ecocardiografía (Clínica Delgado).
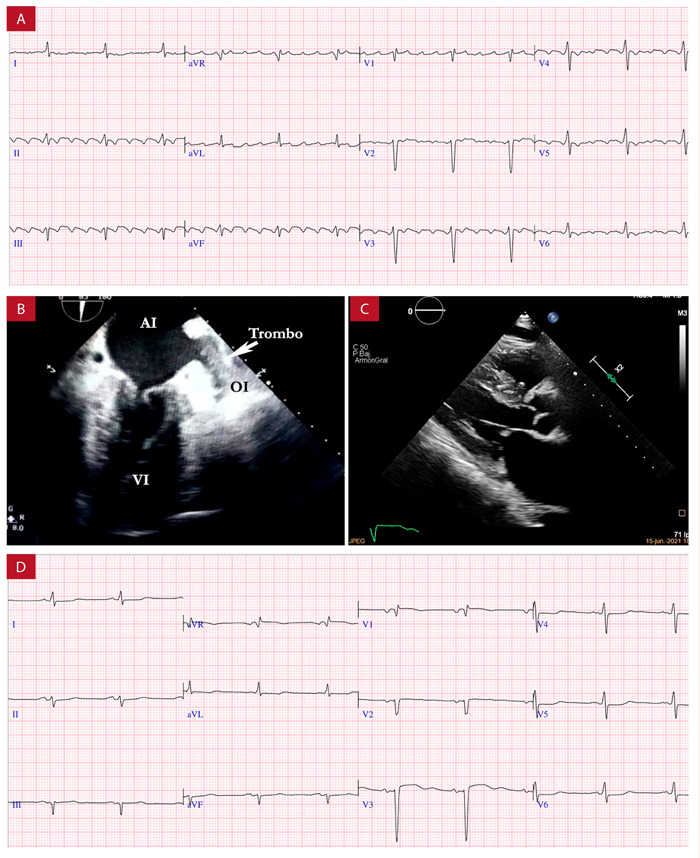
Estudios contemporáneos han demostrado que la presencia de FA en la AC parece aumentar el riesgo de trombosis intracardiaca y de EC independientemente del ritmo del paciente. En una cohorte de pacientes con ATTR y FA, Donellan et al. no encontraron asociación entre el puntaje CHA2DS2-VASc y la presencia de trombos en orejuela izquierda. Los autores concluyen que las recomendaciones en las guías actuales para anticoagulación basadas en CHA2DS2-VASc pueden no ser aplicables en pacientes ATTR. La tasa de trombos intracardiacos (TIC) en pacientes con amiloidosis AL parece ser similar, lo que ha llevado a expertos a sugerir que todos los pacientes con FA y amiloidosis deben recibir anticoagulación independientemente del puntaje CHA2DS2-VASc 21) (Figura 7-A).
Figura 7. A: arritmias auriculares y su implicancia en la amiloidosis cardiaca. B: arritmias ventriculares en la amiloidosis cardiaca. En: Cardiomiopatías y arritmias: pasado, presente y futuro. Editor: Jorge Salinas-Arce. 2022.
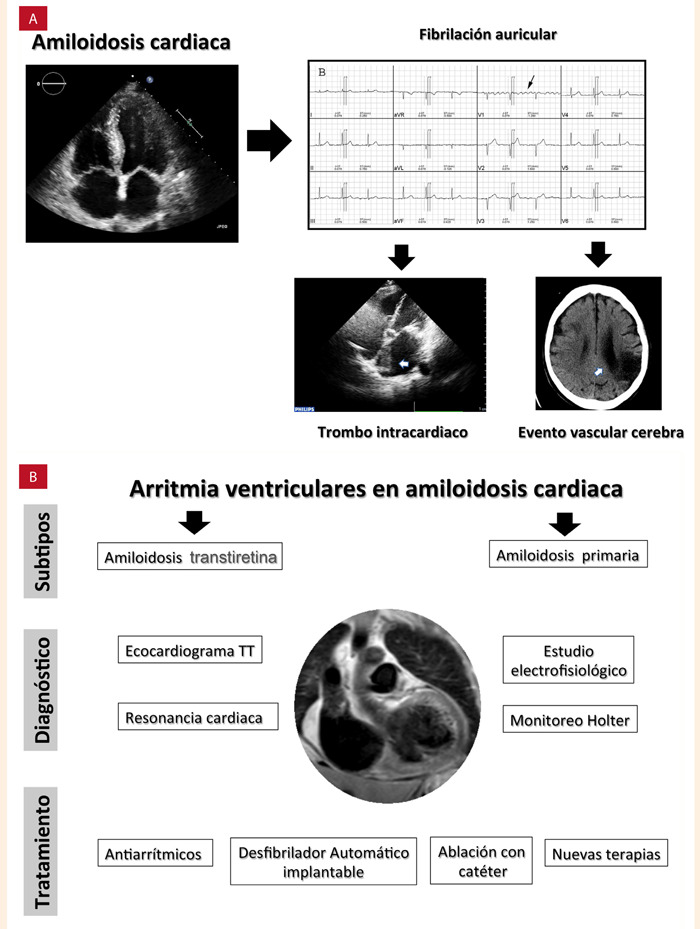
Las autopsias y los estudios ecocardiográficos han reportado TIC hasta en 33% de los pacientes con AC 22. Los trombos fueron encontrados principalmente en ambas aurículas y sus orejuelas, y cerca del 40% fueron múltiples. De los subtipos, AL parece ser la asociada con mayor riesgo. Los pacientes con subtipos ATTR también parecen tener mayores tasas de TIC en comparación con la población general, aunque en menor proporción que el grupo AL. La mayor prevalencia de TIC, incluso en ritmo sinusal estaría en relación con disfunción atrial, expresado por el hallazgo de strain auricular anormal en el grupo ATTR 23.
Los trombos en aurícula izquierda visualizados por ecocardiografía transesofágica (ETE) se han documentado hasta en 30% de los pacientes con AC previo a la cardioversión eléctrica de la FA. El-Am et al. encontraron que el 46% de los pacientes con TIC tuvieron niveles terapéuticos de anticoagulación por más de 3 semanas o arritmias de inicio menor a 48 h previo a la cardioversión planeada 24. Considerando los hallazgos descritos, al igual que diferentes autores, recomendamos se realice ETE previo a toda cardioversión farmacológica y/o eléctrica en pacientes con AC y FA/flutter.
No existen estudios prospectivos para comparar la eficiencia de derivados de la heparina, antagonistas de la vitamina K (AVK), y anticoagulantes orales directos (ACOD) en pacientes con AC. Sin embargo, publicaciones recientes muestran una mayor tendencia al empleo de anticoagulación basada en ACOD (casi hasta el 80% de los pacientes). Dale et al. en una serie de 61 pacientes con FA y ATTR en un periodo de 2,3 años no encontraron eventos cerebrovasculares 17.
Finalmente, en una cohorte retrospectiva de 273 pacientes con AC y periodo de seguimiento corto de 18 meses en promedio, se demostró similar eficacia en prevención y sobrevida entre los usuarios de ACOD y AVK (accidente cerebrovascular: 4% vs. 2%; P = 0,223), pero el doble de sangrado en aquellos con AVK (20% vs 10%) 25. En ausencia de datos o recomendaciones en guías clínicas, la elección del agente a utilizarse debe seguir las recomendaciones generales para FA.
d. Control de la frecuencia
Entender la hemodinamia de la AC es esencial en el manejo de arritmias auriculares. Los pacientes con AC tienen una fisiología restrictiva con un volumen latido bajo y fijo que requiere de altas presiones de llenado para preservar el volumen latido y mayor frecuencia cardíaca para mantener un gasto cardíaco adecuado, es por esta razón que resulta clave evitar un control exagerado de la frecuencia cardiaca (FC). En general, los betabloqueadores (BB), calcioantagonistas (CA) y digoxina se consideran mal tolerados y deben ser utilizados con precaución. Rubinow et al. demostraron que la digoxina tiene gran afinidad por las fibrillas de amiloide in vitro, este enlace favorece un incremento en concentraciones del fármaco en tejidos y en suero, con exposición prolongada a receptores de digoxina y alto riesgo de toxicidad 26. Gertz et al. mostraron que la nifedipina también se une a las fibrillas de amiloide in vitro, y esto se ha propuesto como un posible mecanismo para el efecto inotrópico negativo clínicamente manifiesto 27. Si existe intención de utilizar una estrategia farmacológica para control de la frecuencia cardiaca, los expertos recomiendan iniciar dosis bajas, con monitoreo hemodinámico frecuente, y en caso de prescripción de digoxina se sugiere monitoreo frecuente de concentraciones séricas del fármaco, así como determinación sérica de electrolitos, y función renal. Finalmente, como en cualquier caso de FA refractaria a manejo médico, se puede considerar la ablación del nodo atrio ventricular y el implante de un marcapaso definitivo.
e. Control del ritmo
Debido a los riesgos asociados a los BB, CA y digoxina en la AC, muchos expertos sugieren el uso de antiarrítmicos para el manejo de arritmias auriculares. La amiodarona parece ser bien tolerada en esta población y puede ser el antiarrítmico de elección. Debido a la fisiología restrictiva lo ideal es conservar el ritmo sinusal; sin embargo, esta recomendación tiene poca evidencia. En un análisis retrospectivo no se encontró beneficio en mortalidad con el uso de fármacos antiarrítmicos, incluyendo amiodarona, sotalol, dofetilide, o propafenona comparado al control de la frecuencia (HR: 1,70; p=0,08) (28.
f. Cardioversión con corriente directa
Debido al riesgo de desencadenar hipotensión o descompensación por el efecto inotrópico o cronotrópico negativo de los medicamentos, la cardioversión eléctrica debe ser considerada una buena opción solo para el manejo de taquiarritmias auriculares sintomáticas o que cursen con inestabilidad hemodinámica. El uso de cardioversión eléctrica en pacientes con FA y AC ha sido descrito con tasas de éxito y recurrencia variables. Se describe una incidencia relativamente alta de recurrencias, posterior a la cardioversión eléctrica, a los 3 meses y a un año, 55 y 70%, respectivamente 6, aunque la recurrencia de FA a un año no se asoció con diferencias en la mortalidad. Es importante considerar a esta población con AC como de mayor riesgo en la cardioversión para desarrollar arritmias ventriculares, bradiarritmias, hipoxemia, y enfermedad cerebrovascular (14% vs. 2%, p=0,007) 6.
g. Ablación con catéter
Existe poca evidencia sobre la seguridad y eficiencia de la ablación con catéter de arritmias auriculares en AC. Barbhaiya et al. describieron los resultados de realizar estudio electrofisiológico y ablación con catéter en 18 pacientes con AC. Posterior al periodo de cegamiento de 3 meses, las tasas de recurrencia tras 1 año fueron de 83% en pacientes con amiloidosis en comparación con 14% de controles pareados a edad y sexo (HR 5,4; IC 95%: 1,9-35,5; p=0,007) 7. Donnellan et al. reportaron resultados de 72 pacientes con AC ATTR y FA, de los cuales 24 fueron sometidos a ablación con catéter. Durante un seguimiento medio de 39 +/- 26 meses posterior a ablación, las tasas de recurrencia de FA fueron de 58%. Comparados con los controles, los pacientes del grupo de ablación presentaron menor mortalidad (29% vs. 75%; p=0,01) y hospitalización por IC o arritmias (1,7 +/- 2,4 vs. 4 +/- 3,5; p= 0,005) 29. Aunque son estudios pequeños, estos resultados demuestran tasas de recurrencia de FA posterior a ablación significativamente altas. Se requieren más estudios para determinar si la ablación es una estrategia de control del ritmo efectiva.
ARRITMIAS VENTRICULARES (ArV)
a. Epidemiología
Las diferentes formas de arritmia ventricular pueden representar eventos terminales en pacientes con AC, especialmente aquellos con subtipo AL. La prevalencia de taquicardia ventricular no sostenida (TVNS) en AL va del 5 al 27%, y 100% durante el trasplante de células hematopoyéticas 30. La prevalencia de TVNS en la población con ATTR es menor, estudios pequeños sugieren una prevalencia aproximada hasta del 17% 30. Además, a medida que la amiloidosis AL tiende a originar IC terminal comparada con el grupo TTR, hay mayor riesgo para el desarrollo de ArV. El significado clínico de las ArV es variable, algunos estudios sugieren un factor pronóstico, otros no encuentran tal correlación, en tanto que otros estudios sugieren una relación inversa entre la presencia de extrasístoles ventriculares (EV) y sobrevida 31) (Figura 7-B).
b. Fisiopatología
Existe una variedad de mecanismos en la patogénesis de las ArV en la AC. Primero, el depósito de amiloide en las fibrillas conduce a respuesta inflamatoria y estrés oxidativo que, a su vez, conduce una separación de miocitos lo que provoca remodelado y fibrosis del ventrículo izquierdo (VI), desarrollando progresivamente potencial arritmogénico 30. Segundo, el depósito de amiloide en las fibrillas del sistema de conducción puede potenciar las arritmias 32. Tercero, isquemia miocárdica micro y macrovascular resultado del depósito de amiloide, que puede ser demostrada como disfunción miocárdica regional en la evaluación por resonancia magnética nuclear cardiaca (RMNc) 33.
c. Diagnóstico y pronóstico
El rol de la monitorización cardiaca en pacientes con AC encuentra limitaciones en la detección de las arritmias. Si bien la presencia de TVNS está relacionada con disminución de la sobrevida, el monitoreo cardíaco detecta la arritmia en no más del 25% de los pacientes. Sayed et al. en una serie prospectiva de 20 pacientes con síncope en el contexto de AC severa, solo documentaron un episodio de taquicardia ventricular (TV), con 13 muertes en general 34.
Existen predictores de ArV: la evidencia de diámetros intraventriculares del VI elevados (p=0,02), fracción de eyección del ventrículo izquierdo reducida (FEVI<30% p=0,047), QRS ancho (>125 ms, p=0,049), historial previo de IC (p=0,03), y tratamiento con diuréticos (p=0,02). Estos hallazgos clínicos y ecocardiográficos específicos se observan frecuentemente en pacientes con AC y, por lo tanto, estas poblaciones de alto riesgo deben ser monitorizadas con frecuencia 35.
La utilidad de la RMN en la evaluación de la AC tiene cada vez mayor importancia, en especial para demostrar realce tardío de gadolinio (RTG) que, típicamente, ocurre en un patrón global subendocárdico y se asocia con mayor mortalidad (HR 5,4; IC 95%: 2,1-13,7; p<0,0001), pudiendo ser representativo de IC y arritmias potencialmente letales. El hallazgo de fibrosis asociada a RTG ha demostrado incrementar el riesgo de muerte súbita cardíaca (MSC) y ArV recurrentes. Por lo tanto, la RMNc es útil como herramienta diagnóstica y pronóstica en pacientes con AC (36.
La infiltración amiloide es más severa en ATTR que en AL, aumenta más la masa del VI, y genera más IC. A pesar de estas diferencias fenotípicas, la amiloidosis AL confiere peor pronóstico con mayores tasas de muerte súbita cardíaca (aproximadamente 33% de los pacientes) en los primeros 3 meses del diagnóstico.
d. Tratamiento
El tratamiento de la TV se puede dividir en fármacos antiarrítmicos, terapias basadas en procedimientos, y modalidades quirúrgicas.
Los BB, aunque con frecuencia utilizados en el control de la TV, pueden ser perjudiciales por reducir el gasto cardíaco en pacientes con AC 30. La amiodarona, que es un tratamiento efectivo contra la TV, puede tener complicaciones en el tratamiento de los pacientes con AC, particularmente prolongando el intervalo QTc y aumentando el riesgo de Torsades de Pointes, empeorando la función sistólica a través de actividad intrínseca betaantagonista y bloqueo cardíaco completo en comparación a pacientes sin AC, como fue demostrado en un estudio (43,8% vs. 30,0%, p<0,0001) 37.
El advenimiento de nuevos esquemas de tratamiento como el tafamidis, un estabilizador de TTR, previene la disociación de tetrámeros y amiloidogénesis y, por lo tanto, ha demostrado reducir la mortalidad global por todas las causas y hospitalizaciones cardiovasculares 38. De forma similar, el diflunisal es un fármaco no esteroideo que también estabiliza el tetrámero de TTR y ha demostrado estabilizar la masa del VI y la FEVI, indicando una interrupción en la progresión del infiltrado cardiaco 39. Al prevenir de forma efectiva la amiloidogénesis, estas dos terapias han reducido la incidencia de muerte súbita cardíaca con el potencial de disminuir arritmias ventriculares en la población ATTR.
Además, es importante el monitoreo estrecho del riesgo de Torsades de Pointes debido a que hay descripciones de pacientes que presentan TV polimórfica resultado de una prolongación del QTc inducido por amiloidosis. El mecanismo propuesto es por depósito de fibrillas de amiloide en el sistema de conducción intrínseco 38. El tratamiento en estos pacientes va dirigido a evitar medicamentos que prolonguen el QT, corrección de alteraciones electrolíticas, y monitoreo cardíaco adecuado.
Aunque el papel de la ablación con catéter para el tratamiento de las ArV se encuentra en evolución y la literatura actual muestra beneficio potencial en términos de tasas de recurrencia y sobrevida global, los datos existentes sobre su utilidad son aún escasos.
e. Terapia con dispositivos
El Centro Amiloide de Stanford propone los criterios de selección de los pacientes con AC para implante de un CDI. Especial consideración tienen aquellos con alto riesgo de MSC, pero con buena calidad de vida y síntomas de ICC mínimos evaluados por la clasificación de la New York Heart Association (NYHA) 39. Sin embargo, se desconoce cuál subtipo de AC obtiene mayor beneficio de la terapia con CDI.
La MSC secundaria a enfermedad del sistema de conducción es una causa frecuente de muerte en pacientes con AC, especialmente en subtipos AL con biomarcadores elevados incluyendo troponinas cardíacas y NT-pro BNP. El incremento de la carga de ArV se asocia con mayor mortalidad, por lo tanto, la detección de TVNS y los reportes de síncope deben ser motivo de preocupación clínica inmediata 39.
En la actualidad no existe consenso sobre el beneficio absoluto de la terapia CDI en AC. Quienes están a favor de la terapia CDI sugieren que los pacientes con AC con TVNS previamente identificada, tienen mayor probabilidad de recibir terapia del dispositivo, recomendando su uso como prevención secundaria 39. En un estudio de 45 pacientes, en los cuales la mayoría (73%) eran ATTR, las terapias CDI fueron más apropiadas en aquellos pacientes con cardiomiopatía menos avanzada. Sin embargo, la sobrevida global no fue modificada por la carga de ArV 40.
Cada vez hay mayor conciencia sobre la disociación electromecánica como el principal determinante de la mortalidad en estos pacientes. En un estudio con 19 pacientes con amiloidosis AL, solo dos pacientes recibieron terapias apropiadas del CDI para ArV, mientras que seis fallecieron por MSC por disociación electromecánica, a pesar de presencia de un CDI. La disociación electromecánica, seguramente, es una manifestación del deterioro progresivo de la IC no candidata a terapia CDI 41.
Cuando se documentan TVNS y síncope, la terapia CDI para la prevención de MSC en AC es seguramente un abordaje razonable. Específicamente, esto es más apropiado en amiloidosis AL donde el implante de CDI se asocia con mayor tasa de terapias apropiadas contra ArV (32% en el primer año en una serie). Sin embargo, no se ha demostrado beneficio significativo sobre la mortalidad en este grupo 31.
Para la prevención primaria en AC, la decisión de implante de un CDI requiere de un criterio estricto para la selección del candidato. La terapia es potencialmente adecuada en las etapas tempranas en amiloidosis AL donde la sobrevida predicha es favorable con menor compromiso en la función sistólica del VI y elevación mínima de biomarcadores de daño miocárdico. Específicamente en AL, el implante de CDI para prevención primaria puede ser razonable en pacientes que esperan trasplante cardíaco o dispositivo de soporte ventricular como terapia final o puente a trasplante. Esto únicamente si la sobrevida estimada es significativa (mayor a 1 año), con concentraciones de NT-pro-BNP menores a 8500 ng/L, y clase funcional NYHA menor a IV 41.
BRADICARDIAS
Diferentes bradiarritmias han sido descritas en la AC, en la totalidad de ellas el mecanismo que las origina no se restringe a la infiltración del miocardio; el reemplazo de tejido especializado por fibrosis y/o la presencia de defectos isquémicos microvasculares en ausencia de enfermedad coronaria epicárdica cumplen un rol en la mayoría de las bradicardias 42.(Figura 8)
Figura 8. Compromiso del nodo sinusal y sistema de conducción en la amiloidosis. A: Amiloidosis en el nodo sinusal (asteriscos). Miocitos normales rodeadas de amieloide (flecha). Tinción hematoxilina-eosina. x10. B: Nodo sinusal x 40, depósitos de material amieloide extracelular que aisla a los miocitos del nodo sinusal. C: Nodo AV x 20, depósitos de material amieloide extracelular que aisla a los miocitos nodales. Flechas azules señalan tejido adiposo. D: Nodo AV x 40, depósitos de material amieloide extracelular que aisla a los miocitos nodales AV. Con autorización Dr. Manuel Salguero Villadiego (Instituto de Toxicología Forense de Sevilla-España) y Dr. Damián Sánchez-Quintana (Departamento de Anatomía y Biología Celular, Facultad de Medicina, Universidad de Extremadura-España).
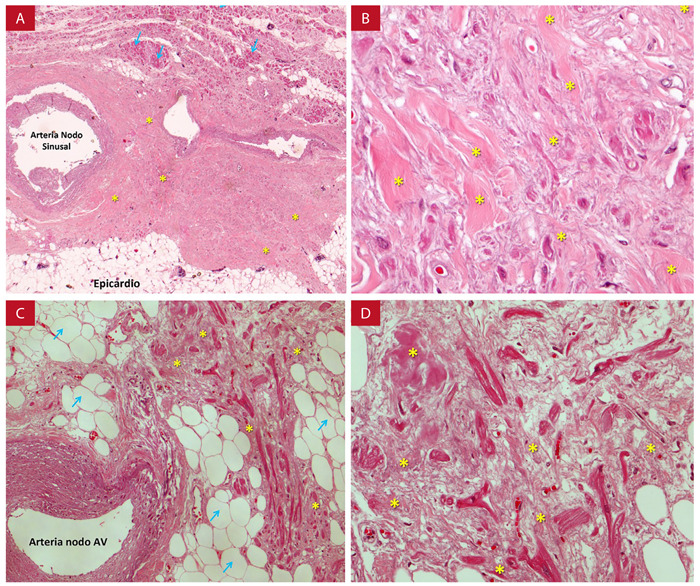
La presencia de bradicardia, pausas o arresto sinusal son descritas hasta en el 7% de los pacientes con AC, esta particular baja incidencia llama la atención, considerando que el depósito de proteínas tiene especial predilección por la aurícula.
La enfermedad del nodo AV y del sistema de conducción es descrita con más frecuencia (Figura 9). En una interesante revisión, Donnellan et al. nos presentan cómo el 9,15% de los pacientes con AC, antes de su diagnóstico, tienen un dispositivo de estimulación cardiaca por enfermedad del nodo AV. En este grupo de pacientes, durante un seguimiento de 2 años, hasta el 11% desarrollan enfermedad del nodo AV con necesidad de estimulación 43.
Figura 9. Bloqueo AV en paciente con ATTRh. A: ritmo sinusal con bloqueo AV de segundo grado tipo Wenckebach. B: bloqueo AV 2:1 con onda P de difícil identificación. C: flutter auricular con estimulación ventricular desde el ápex del VD. La fecha negra marca las ondas P bloqueadas. Fondo docente Dr. Jorge Salinas-Arce.
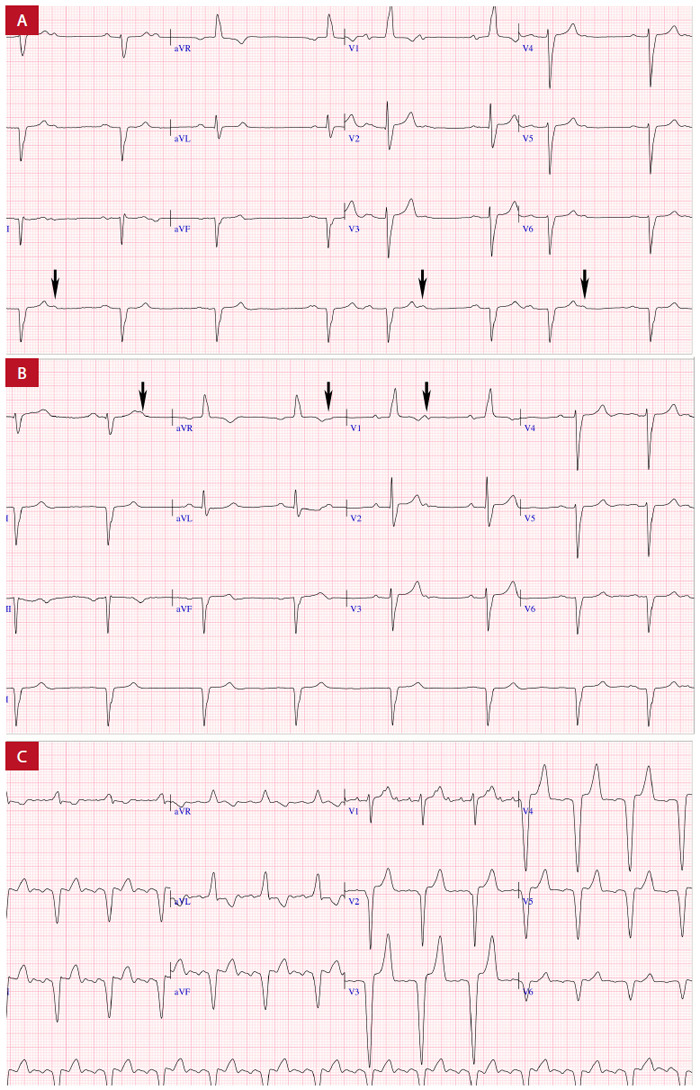
Dentro de las diferentes formas de compromiso del sistema de conducción el bloqueo AV de primer grado es el encontrado con más frecuencia, en ATTR (33-49%) en comparación a los pacientes con AL (18%). Las diferentes formas de bloqueo de rama o retraso de la conducción intraventricular se observan hasta en el 20% de los pacientes 44.
Se han descrito diferentes predictores de bloqueo AV, así tenemos la prolongación del PR o el bloqueo de rama derecho/izquierdo; sin embargo, el único factor asociado en forma significativa es la presencia de un QRS > 120 ms (HR 4,71; IC 95%: 1,97 - 11,26; p<0,001). Si bien la presencia de bloqueo AV tiene mayor mortalidad comparada a la enfermedad del nodo sinusal, en un análisis multivariado la presencia aislada de bloqueo AV no se asocia con mayor mortalidad (HR 1,8; IC 95%: 0,83 - 3,88; p=0,14) 43,44.
La asociación de AC con otras patologías como la IC con fracción de eyección preservada (IC-FEp) de lejos tiene una mayor indicación de marcapasos en comparación a pacientes sin AC. (43,8% vs. 11,5%; p=0,004) 45. Las indicaciones para el implante de un dispositivo de estimulación cardiaca no difieren de las especificadas para otras formas de bradicardia, de hecho, las guías internacionales no establecen una diferencia especial para los pacientes con AC. Sin embargo, se recomienda el implante de un dispositivo en pacientes con AC en presencia o ausencia de síntomas asociados a BAV II Mobitz 2, BAV de alto grado y BAV III 46.
Un punto de controversia es la posibilidad de considerar el implante de un marcapaso en forma profiláctica. Una serie de 262 pacientes con AC y marcapaso profiláctico fue evaluada por 45 meses encontrando que el 25% de los pacientes se hace marcapaso dependiente debido a la presencia de bloqueo AV II (29%) y bloqueo AV III (71%). Los criterios para establecer el implante del dispositivo fueron la presencia de un tiempo HV > 70 ms, HV > 55 ms con bloqueo fascicular, BAV I con PR > 200 ms o Wenckebach anterógrado < 100 ms 47.
Si bien la decisión del implante debe ser individualizada, los pacientes con trasplante hepático, o aquellos que reciben tratamiento de la AC con fármacos como el patisiran, deben recibir especial atención.
Una vez considerada la indicación, debido a las características propias de una cardiomiopatía infiltrativa, la necesidad de un mayor grado de estimulación no puede ser olvidada en los pacientes con AC. Investigadores del Universidad de Duke encontraron un promedio de estimulación, a los 6 meses posimplante, de 35,5%, el cual se incrementó hasta un 96% a los 5 años. Esta misma serie no encontró modificación significativa en los parámetros de estimulación (umbral, impedancia, etc.) durante el tiempo de seguimiento 48.
Considerando la fisiología restrictiva de esta patología no es raro observar en los pacientes con AC bajo la estimulación cardiaca en el ventrículo derecho, un deterioro de la FEVI, de la clase funcional o empeoramiento de la IC, es por esto que se hace necesario considerar la estimulación fisiológica, en especial de tipo biventricular, no contando en este momento con información sobre el beneficio de la estimulación en el His 49.
SÍNCOPE, HIPOTENSIÓN ORTOSTÁTICA Y DISAUTONOMÍA
La pérdida transitoria de la conciencia se describe en el 14% de los pacientes con AC, sin embargo, pocas veces es el síntoma inicial. La etiología en la mayoría de los casos es multifactorial, han sido descritas la presencia de arritmias, bloqueo AV, hipotensión ortostática (HO) severa y neuropatía autonómica. Un patrón de síncope recurrente en adultos mayores de 60 años sin una etiología precisa debe orientar el diagnóstico diferencial de AC. Si bien puede presentarse en las diferentes formas de AC, el subtipo AL está asociado con mayor presencia de síncope con un peor pronóstico, en especial cuando el síncope está relacionado con el estrés (físico o emocional) 50.
Las manifestaciones de disfunción autonómica en la AC son frecuentes (entre 50-80%) en especial en las formas de ATTRh, presentándose desde las fases más tempranas de la enfermedad, incluso antes de la afectación motora. La HO representa la expresión cardiovascular más frecuente de la disfunción autonómica, la asociación con una disminución de la variabilidad de la FC y de la sensibilidad barorrefleja está relacionada con ArV y el riesgo de MSC, en especial cuando la repuesta simpática está disminuida 51) (Figura 10).
Figura 10. Tilt test espectral en paciente con ATTRh y episodios repetidos de síncope en especial con los cambios de posición. A: espectro vegetativo con tono simpático de baja amplitud y caracterizado por desaparecer en fase de estrés ortostático. B: tendencia espectral con variaciones nulas en canales correspondientes al tono simpático. Se observa además caída de la presión arterial con criterios de hipotensión ortostática. (flecha negra). Fondo docente Dr. Jorge Salinas-Arce.
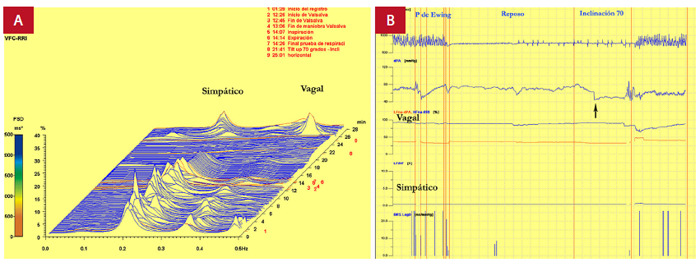
La importancia de una evaluación integral del paciente con AC y síncope puede permitirnos un reconocimiento precoz de fallos en el sistema autonómico y diseñar estrategias para que el deterioro de la calidad de vida no sea importante, y los riesgos relacionados con las caídas no se asocien con complicaciones.
CONCLUSIONES
El manejo de las arritmias en la AC es complejo y existe poca evidencia para encontrar indicaciones tipo I. Las arritmias auriculares son frecuentes en AC, y el grupo ATTRw parece tener el mayor riesgo de FA. Existe una alta prevalencia de trombos intracardiacos aun sin FA, aunque la presencia de esta aumenta su riesgo. La amiloidosis AL parece tener el mayor riesgo de trombosis intracardiaca y riesgo subsecuente de enfermedad cerebrovascular y embolismo sistémico.
Las estrategias de control de ritmo y frecuencia en arritmias auriculares conllevan retos específicos en amiloidosis cardíaca, y el consenso general es que el control del ritmo aparenta ser superior. El control de la frecuencia cardiaca agresivo debe ser cauteloso para evitar descompensación. La MSC y las ArV son comunes en la AC, sin embargo, el implante de CDI para prevención primaria o secundaria puede no mejorar la mortalidad. La enfermedad del sistema de conducción es frecuente y parece ser más prevalente en el grupo ATTRwt. Con frecuencia se requiere implante de marcapasos definitivo, aunque la estimulación profiláctica parece no mejorar resultados clínicos. A medida que mejora el pronóstico en esta población de pacientes, se requieren más estudios para determinar las mejores estrategias para manejar las arritmias en AC.
Considerando que la evolución de los pacientes nos lleva a un “endurecimiento” del corazón con cambios importantes en el sistema eléctrico, individualizar el caso y manejarlo desde un punto de vista fisiológico evitará que Perseo continue haciendo un daño irreparable en nuestros pacientes.
Footnotes
Financiamiento: Autofinanciado
Citar como: Salinas-Arce J, Alca-Clares R, Gonzales-Luna AC, Cabrera-Saldaña M, Mendoza-Novoa P, Solórzano-Altamirano P, Guevara-Valdivia M. Las arritmias en la amiloidosis cardiaca. Arch Peru Cardiol Cir Cardiovasc. 2022;3(2). doi: 10.47487/apcyccv.v3i2.217
REFERENCIAS BIBLIOGRÁFICAS
- 1.Ovidio P. Metamorfosis.Edición Álvarez y Rosa Consuelo. Vigésimo segunda edición. Madrid, España: Ediciones Cátedra; 2021. [Google Scholar]
- 2.Gertz MA, Dispenzieri A, Sher T. Pathophysiology and treatment of cardiac amyloidosis. Nat Rev Cardiol. 2015;12(2):91–102. doi: 10.1038/nrcardio.2014.165. [DOI] [PubMed] [Google Scholar]
- 3.Giancaterino S, Urey MA, Darden D, Hsu J. Management of Arrhythmias in Cardiac Amyloidosis. JACC Clin Electrophysiol. 2020;6(4):351–361. doi: 10.1016/j.jacep.2020.01.004. [DOI] [PubMed] [Google Scholar]
- 4.Quock TP, Yan T, Chang E, Guthrie S, Broder M. Epidemiology of AL amyloidosis a real-world study using US claims data. Blood Adv. 2018;2(10):1046–1053. doi: 10.1182/bloodadvances.2018016402. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Lane T, Fontana M, Martinez-Naharro A, Quarta C, Whelan C, Petrie A, et al. Natural history, quality of life, and outcome in cardiac transthyretin amyloidosis. Circulation. 2019;140(1):16–26. doi: 10.1161/CIRCULATIONAHA.118.038169. [DOI] [PubMed] [Google Scholar]
- 6.Sanchis K, Cariou E, Colombat M, Ribes D, Huart A, Cintas P, et al. Atrial fibrillation and subtype of atrial fibrillation in cardiac amyloidosis clinical and echocardiographic features, impact on mortality. Amyloid. 2019;26(3):128–138. doi: 10.1080/13506129.2019.1620724. [DOI] [PubMed] [Google Scholar]
- 7.Barbhaiya CR, Kumar S, Baldinger SH, Michaud G, Stevenson W, Falk R, et al. Electrophysiologic assessment of conduction abnormalities and atrial arrhythmias associated with amyloid cardiomyopathy. Heart Rhythm. 2016;13(2):383–390. doi: 10.1016/j.hrthm.2015.09.016. [DOI] [PubMed] [Google Scholar]
- 8.Goldsmith YB, Liu J, Chou J, Hoffman J, Comenzo R, Steingart R. Frequencies and types of arrhythmias in patients with systemic light-chain amyloidosis with cardiac involvement undergoing stem cell transplantation on telemetry monitoring. Am J Cardiol. 2009;104(7):990–994. doi: 10.1016/j.amjcard.2009.05.040. [DOI] [PubMed] [Google Scholar]
- 9.Boldrini M, Salinaro F, Mussinelli R, Raimondi A, Alogna A, Musca F, et al. Prevalence and prognostic value of conduction disturbances at the time of diagnosis of cardiac AL amyloidosis. Ann Noninvasive Electrocardiol. 2013;18(4):327–335. doi: 10.1111/anec.12032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Dubrey SW, Cha K, Anderson J, Chamarthi B, Reisinger J, Skinner M, Falk RH. The clinical features of immunoglobulin light-chain (AL) amyloidosis with heart involvement. QJM. 1998;91(2):141–157. doi: 10.1093/qjmed/91.2.141. [DOI] [PubMed] [Google Scholar]
- 11.Rautaharju PM, Surawicz B, Gettes LS, Bailey JJ, Childers R, Deal BJ, et al. AHA/ACCF/HRS recommendations for the standardization and interpretation of the electrocardiogram part IV: the ST segment, T and U waves, and the QT interval: a scientific statement from the American Heart Association Electrocardiography and Arrhythmias Committee, Council on Clinical Cardiology; the American College of Cardiology Foundation; and the Heart Rhythm Society. Endorsed by the International Society for Computerized Electrocardiology. J Am Coll Cardiol. 2009;53(11):982–991. doi: 10.1016/j.jacc.2008.12.014. [DOI] [PubMed] [Google Scholar]
- 12.Cyrille NB, Goldsmith J, Alvarez J, Maurer MS. Prevalence and prognostic significance of low QRS voltage among the three main types of cardiac amyloidosis. Am J Cardiol. 2014;114(7):1089–1093. doi: 10.1016/j.amjcard.2014.07.026. [DOI] [PubMed] [Google Scholar]
- 13.Kristen AV, Perz JB, Schonland SO, Hegenbart U, Schnabel PA, Kristen JH, et al. Non-invasive predictors of survival in cardiac amyloidosis. Eur J Heart Fail. 2007;9(6-7):617–624. doi: 10.1016/j.ejheart.2007.01.012. [DOI] [PubMed] [Google Scholar]
- 14.Henein MY, Suhr OB, Arvidsson S, Pilebro B, Westermarck P, Hornstein R, et al. Reduced left atrial myocardial deformation irrespective of cavity size a potential cause for atrial arrhythmia in hereditary transthyretin amyloidosis. Amyloid. 2018;25(1):46–53. doi: 10.1080/13506129.2018.1430027. [DOI] [PubMed] [Google Scholar]
- 15.Leone O, Boriani G, Chiappini B, Pacini D, Cenacchi G, Suarez M, et al. Amyloid deposition as a cause of atrial remodelling in persistent valvular atrial fibrillation. Eur Heart J. 2004;25(14):1237–1241. doi: 10.1016/j.ehj.2004.04.007. [DOI] [PubMed] [Google Scholar]
- 16.Longhi S, Quarta CC, Milandri A, Lorenzini M, Gaglierdi C, Manuzzi L, et al. Atrial fibrillation in amyloidotic cardiomyopathy prevalence, incidence, risk factors and prognostic role. Amyloid. 2015;22(3):147–155. doi: 10.3109/13506129.2015.1028616. [DOI] [PubMed] [Google Scholar]
- 17.Dale Z, Chandrashekar P, Al Rashdan L, Gill S, Elman M, Fischer K, et al. Routine ambulatory heart rhythm monitoring for detection of atrial arrhythmias in transthyretin cardiac amyloidosis. Int J Cardiol. 2022;358:65–71. doi: 10.1016/j.ijcard.2022.04.045. [DOI] [PubMed] [Google Scholar]
- 18.Papathanasiou M, Jakstaite AM, Oubari S, Siebermair J, Wakili R, Hoffmann J, et al. Clinical features and predictors of atrial fibrillation in patients with light-chain or transthyretin cardiac amyloidosis. ESC Heart Fail. 2022;9(3):1740–1748. doi: 10.1002/ehf2.13851. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Fernandes F, Alencar AC, Neto, Bueno BVK, Cafezeiro CRF, Rissato JH, Szor RS, et al. Clinical, Laboratory, and Imaging Profile in Patients with Systemic Amyloidosis in a Brazilian Cardiology Referral Center. Arq Bras Cardiol. 2022;118(2):422–432. doi: 10.36660/abc.20201003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Martinez Naharro A, Gonzalez Lopez E, Corovic A, Mirelis J, Baksi A, Moon J, et al. High Prevalence of Intracardiac Thrombi in Cardiac Amyloidosis. J Am Coll Cardiol. 2019;73(13):1733–1734. doi: 10.1016/j.jacc.2019.01.035. [DOI] [PubMed] [Google Scholar]
- 21.Donnellan E, Elshazly MB, Vakamudi S, Wazni O, Cohen J, Kanj M, et al. No association between CHADS-VASc score and left atrial appendage thrombus in patients with transthyretin amyloidosis. JACC Clin Electrophysiol. 2019;5(12):1473–1474. doi: 10.1016/j.jacep.2019.10.013. [DOI] [PubMed] [Google Scholar]
- 22.Roberts WC, Waller BF. Cardiac amyloidosis causing cardiac dysfunction analysis of 54 necropsy patients. Am J Cardiol. 1983;52(1):137–146. doi: 10.1016/0002-9149(83)90084-x. [DOI] [PubMed] [Google Scholar]
- 23.Palmer C, Truong VT, Slivnick JA, Wolking S, Coleman P, Mazur W, et al. Atrial function and geometry differences in transthyretin versus immunoglobulin light chain amyloidosis a cardiac magnetic resonance study. Sci Rep. 2022;12(1):140–140. doi: 10.1038/s41598-021-03359-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.El-Am EA, Dispenzieri A, Melduni RM, Ammash N, White R, Hodge D, et al. Direct current cardioversion of atrial arrhythmias in adults with cardiac amyloidosis. J Am Coll Cardiol. 2019;73(5):589–597. doi: 10.1016/j.jacc.2018.10.079. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Cariou E, Sanchis K, Rguez K, Blanchard V, Cazalbou S, Fournier P, et al. New Oral Anticoagulants vs Vitamin K Antagonists Among Patients with Cardiac Amyloidosis: Prognostic Impact. Front Cardiovasc Med. 2021;8:742428–742428. doi: 10.3389/fcvm.2021.742428. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Rubinow A, Skinner M, Cohen AS. Digoxin sensitivity in amyloid cardiomyopathy. Circulation. 1981;63(6):1285–1288. doi: 10.1161/01.cir.63.6.1285. [DOI] [PubMed] [Google Scholar]
- 27.Gertz MA, Skinner M, Connors LH, Falk H, Cohen A, Kyle R. Selective binding of nifedipine to amyloid fibrils. 1Am J Cardiol. 1985;55(13):1646–1646. doi: 10.1016/0002-9149(85)90996-8. [DOI] [PubMed] [Google Scholar]
- 28.Mints YY, Doros G, Berk JL, Connors L, Ruberg F. Features of atrial fibrillation in wild-type transthyretin cardiac amyloidosis a systematic review and clinical experience. ESC Heart Fail. 2018;5(5):772–779. doi: 10.1002/ehf2.12308. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Donnellan E, Wazni O, Kanj M, Eishazly M, Hussein A, Baranowski B, et al. Atrial fibrillation ablation in patients with transthyretin cardiac amyloidosis. Europace. 2020;22(2):259–264. doi: 10.1093/europace/euz314. [DOI] [PubMed] [Google Scholar]
- 30.Rochlani YM, Nishi SN, Hakeem A, Bhatti S. Burden of arrhythmias in patients hospitalized with cardiac amyloidosis. Circulation. 2015;132:A20097–A20097. doi: 10.1161/circ.132.suppl_3.20097. [DOI] [Google Scholar]
- 31.Kristen AV, Dengler TJ, Hegenbart U, Schonland S, Golschmidt H, Sack F, et al. Prophylactic implantation of cardioverter-defibrillator in patients with severe cardiac amyloidosis and high risk for sudden cardiac death. Heart Rhythm. 2008;5(2):235–240. doi: 10.1016/j.hrthm.2007.10.016. [DOI] [PubMed] [Google Scholar]
- 32.Ridolfi RL, Bulkley BH, Hutchins GM. The conduction system in cardiac amyloidosis clinical and pathologic features of 23 patients. Am J Med. 1977;62(5):677–686. doi: 10.1016/0002-9343(77)90870-1. [DOI] [PubMed] [Google Scholar]
- 33.Li R, Yang Zg, Wen Ly, Liu X, XU H, Zhang Q, et al. Regional myocardial microvascular dysfunction in cardiac amyloid light-chain amyloidosis assessment with 3T cardiovascular magnetic resonance. J Cardiovasc Magn Reson. 2016;18:16–16. doi: 10.1186/s12968-016-0240-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Sayed RH, Rogers D, Khan F, Wechalekar A, Lachmann H, Fontana M, et al. A study of implanted cardiac rhythm recorders in advanced cardiac AL amyloidosis. Eur Heart J. 2015;36(18):1098–1105. doi: 10.1093/eurheartj/ehu506. [DOI] [PubMed] [Google Scholar]
- 35.Pagourelias ED, Mirea O, Duchenne J, Van Cleemput J, Delforge M, Bogaert J, et al. Echo parameters for differential diagnosis in cardiac amyloidosis a head-to-head comparison of deformation and nondeformation parameters. Circ Cardiovasc Imaging. 2017;10(3):e005588. doi: 10.1161/CIRCIMAGING.116.005588. [DOI] [PubMed] [Google Scholar]
- 36.Dawson DK, Hawlisch K, Prescott G, Roussin I, Di Pietro E, Deac M, et al. Prognostic role of CMR in patients presenting with ventricular arrhythmias. JACC Cardiovasc Imaging. 2013;6(3):335–344. doi: 10.1016/j.jcmg.2012.09.012. [DOI] [PubMed] [Google Scholar]
- 37.Alkindi S, Almasoud A, Younes A, Elamm C, Benatti R, Oliveira G, et al. Increased risk of heart block in patients with cardiac amyloidosis on amiodarone. J Card Fail. 2015;21(8):S125–S125. doi: 10.1016/j.cardfail.2015.06.359. [DOI] [Google Scholar]
- 38.Maurer MS, Schwartz JH, Gundapaneni B, Elliot P, Merlini G, Waddington M, et al. Tafamidis treatment for patients with transthyretin amyloid cardiomyopathy. N Engl J Med. 2018;379:1007–1116. doi: 10.1056/NEJMoa1805689. [DOI] [PubMed] [Google Scholar]
- 39.Varr BC, Zarafshar S, Coakley T, Liedtke M, Lafayette R, Arai S, et al. Implantable cardioverter-defibrillator placement in patients with cardiac amyloidosis. Heart Rhythm. 2014;11(1):158–162. doi: 10.1016/j.hrthm.2013.10.026. [DOI] [PubMed] [Google Scholar]
- 40.Hamon D, Algalarrondo V, Gandjbakhch E, Extramiana F, Marijon E, Elbaz N, et al. Outcome and incidence of appropriate implantable cardioverter-defibrillator therapy in patients with cardiac amyloidosis. Int J Cardiol. 2016;222:562–568. doi: 10.1016/j.ijcard.2016.07.254. [DOI] [PubMed] [Google Scholar]
- 41.John RM, Stern DL. Use of implantable electronic devices in patients with cardiac amyloidosis. Can J Cardiol. 2020;36(3):408–415. doi: 10.1016/j.cjca.2019.12.002. [DOI] [PubMed] [Google Scholar]
- 42.Alreshq R, Tugal D, Siddiqi O, Ruberg F. Conduction abnormalities and role of cardiac pacing in cardiac amyloidosis A systematic review. Pacing Clin Electrophysiol. 2021;44(12):2092–2099. doi: 10.1111/pace.14375. [DOI] [PubMed] [Google Scholar]
- 43.Donnellan E, Wazni OM, Saliba WI, Hanna M, Kanj M, Patel D, et al. Prevalence, incidence, and impact on mortality of conduction system disease in transthyretin cardiac amyloidosis. Am J Cardiol. 2020;128:140–146. doi: 10.1016/j.amjcard.2020.05.021. [DOI] [PubMed] [Google Scholar]
- 44.Rapezzi C, Merlini G, Quarta CC, Riva L, Longhi S, Leone O, et al. Systemic cardiac amyloidoses Disease profiles and clinical courses of the 3 main types. Circulation. 2009;120(13):1203–1212. doi: 10.1161/CIRCULATIONAHA.108.843334. [DOI] [PubMed] [Google Scholar]
- 45.González-López E, Gallego-Delgado M, Guzzo-Merello G, Haro-Del Moral F, Cobo-Marcos M, Robles C, et al. Wild-type transthyretin amyloidosis as a cause of heart failure with preserved ejection fraction. Eur Heart J. 2015;36(38):2585–2594. doi: 10.1093/eurheartj/ehv338. [DOI] [PubMed] [Google Scholar]
- 46.Towbin JA, McKenna WJ, Abrams DJ, Ackerman MJ, Calkins H, Darrieux FCC, et al. 2019 HRS expert consensus statement on evaluation, risk stratification, and management of arrhythmogenic cardiomyopathy. Heart Rhythm. 2019;16(11):e301–e372. doi: 10.1016/j.hrthm.2019.05.007. [DOI] [PubMed] [Google Scholar]
- 47.Algalarrondo V, Dinanian S, Juin C, Chemla D, Bennani SL, Sebag C, et al. Prophylactic pacemaker implantation in familial amyloid polyneuropathy. Heart Rhythm. 2012;9(7):1069–1075. doi: 10.1016/j.hrthm.2012.02.033. [DOI] [PubMed] [Google Scholar]
- 48.Rehorn MR, Loungani RS, Black-Maier E, Coniglio A, Karra R, Pokorney S, et al. Cardiac implantable electronic devices a window into the evolution of conduction disease in cardiac amyloidosis. JACC Clin Electrophysiol. 2020;6(9):1144–1154. doi: 10.1016/j.jacep.2020.04.020. [DOI] [PubMed] [Google Scholar]
- 49.Hartnett J, Jaber W, Maurer M, Sperry B, Hanna M, Collier P, et al. Electrophysiological Manifestations of Cardiac Amyloidosis. JACC CardioOncol. 2021;3(4):506–515. doi: 10.1016/j.jaccao.2021.07.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Chamarthi B, Dubrey SW, Cha K, Skinner M, Falk RH. Features and prognosis of exertional syncope in light-chain associated AL cardiac amyloidosis. Am J Cardiol. 80(9):1242–1245. doi: 10.1016/s0002-9149(97)00653-x. [DOI] [PubMed] [Google Scholar]
- 51.Delahaye N, Le Guludec D, Dinanian S, Delforge J, Slama MS, Sarda L, et al. Myocardial muscarinic receptor upregulation and normal response to isoproterenol in denervated hearts by familial amyloid polyneuropathy. Circulation. 2001;104(24):2911–2916. doi: 10.1161/hc4901.100380. [DOI] [PubMed] [Google Scholar]


